Чистые вещества — урок. Химия, 8–9 класс.
В античные времена древнегреческими учёными было сформулировано предположение, которое позже полностью подтвердилось — о том, что вещества состоят из мельчайших невидимых глазу частиц.
Например, вода состоит из одинаковых частиц, называемых молекулами воды. Сахар состоит из одинаковых частиц, называемых молекулами сахара. Вода и сахар — это чистые вещества.
Чистыми веществами называются вещества, которые состоят из частиц одинакового вида.
Если же сахар смешать с водой, происходит диффузия — молекулы сахара проникают между молекулами воды. Образуется раствор, в состав которого входят как молекулы воды, так и молекулы сахара.Раствор — это смесь веществ.
Смесями называют вещества, в состав которых входят частицы разного вида.
Все вещества являются либо чистыми, либо смесями.
Рис. \(1\). Чистые вещества и смеси
Чистые вещества состоят из частиц одного вида, а смеси — из частиц разного вида.
Кроме веществ, состоящих из молекул, существуют вещества, имеющие немолекулярное строение.
Например, металлы и инертные газы состоят не из молекул, а из более мелких частиц — атомов.
Таким образом, медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Медь и цинк — чистые вещества. Если к меди добавить цинк и сильно нагреть, получится сплав, который называют латунью.
Латунь — это смесь, в состав которой входят как атомы меди, так и атомы цинка.
Существуют вещества немолекулярного строения, состоящие из частиц другого вида, называемых ионами. В состав ионных соединений входят не электрически нейтральные атомы или молекулы, а частицы, несущие на себе положительный или отрицательный заряд.
Примером таких веществ может служить хлорид натрия, то есть обычная поваренная соль, кристаллы которой состоят из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора. Поваренная соль является чистым веществом. Если же её растворить в воде, образуется раствор, который является смесью двух веществ — воды и поваренной соли.
Сравнение чистых веществ и смесей
| Чистые вещества | |
| Состав | Чистое вещество состоит из частиц одного вида. Например, вода состоит только из молекул воды.
Чистое вещество имеет постоянный состав. Например, любая молекула воды состоит из двух атомов химического элемента водорода и одного атома химического элемента кислорода. | Смесь состоит из частиц разного вида.
Смесь не имеет постоянного состава: содержание отдельных составных частей одной и той же смеси может быть разным. Условно говоря, в стакане воды можно растворить и одну чайную ложку сахара, и две. |
| Свойства | Чистое вещество имеет постоянные свойства. | В смеси каждое вещество в основном сохраняет свои свойства. Например, железо так же, как обычно, притягивается магнитом, поваренная соль остаётся солёной.
Физические свойства смеси отчасти меняются с изменением её количественного состава. |
Обрати внимание!
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей.
Какое же вещество в таком случае на практике считается чистым?Практически чистым (чистым) называют вещество, в котором содержание примесей столь ничтожно, что эти примеси существенным образом не влияют на его свойства.
Например, образец практически чистой воды бесцветный, без вкуса и запаха, имеет температуру кристаллизации \(0\) °С, температуру кипения \(+100\) °С, плотность при температуре \(+4\) °С равную \(1000\) кг/м³ и не проводит электрический ток.
Рис. \(2\). Чистые вещества: кислород, сахар
В некоторых отраслях науки и техники используют особо чистые вещества.
Рис. \(3\). Золото
Рис. \(4\). Кремний
В банках золото хранится в слитках, массовая доля благородного металла в которых составляет \(99,9\) %; в технике для изготовления электронных приборов и микросхем используется кремний, чистота которого составляет \(99,999\) %.
В природе, в технике и в повседневной жизни большей частью приходится иметь дело со смесями. Так, смесью является воздух, природная вода, почва, биологические жидкости, пища и многое другое.
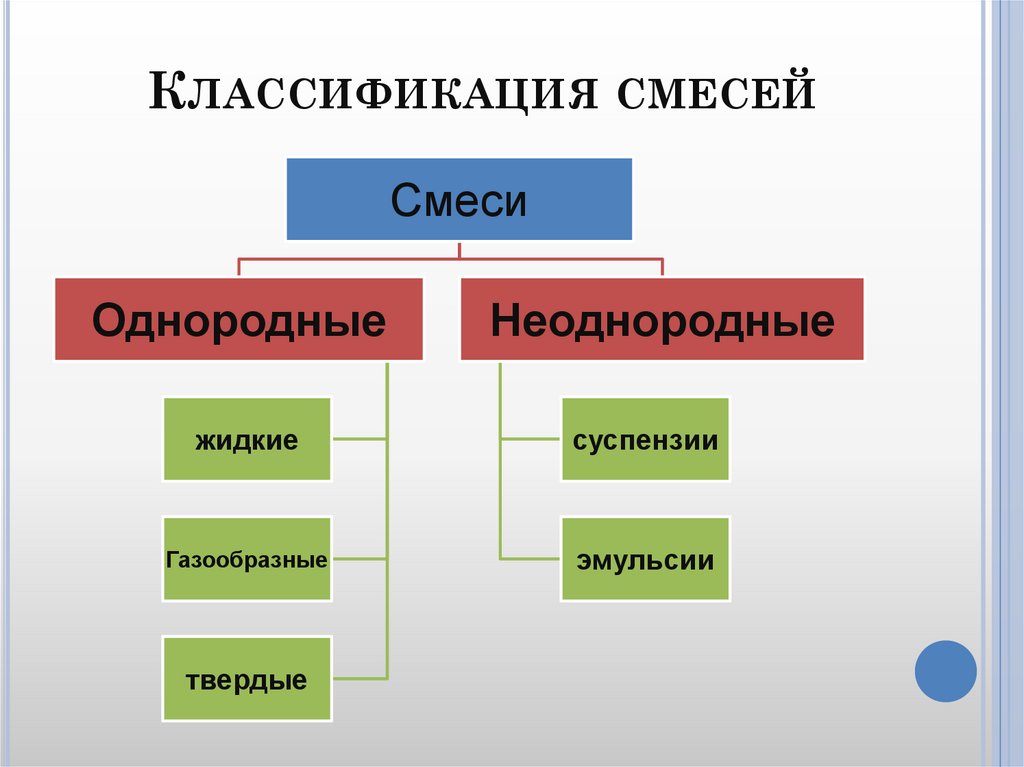
Смеси бывают двух видов: однородные (гомогенные) и неоднородные (гетерогенные).
Рис. \(5\). Классификация смесей
Источники:
Рис. 1. Чистые вещества и смеси © ЯКласс
Рис. 2. Чистые вещества Кислород © ЯКласс
Сахар https://cdn.pixabay.com/photo/2019/03/27/14/51/sugar-4085174_960_720.jpg
Рис. 3. Золото https://cdn.pixabay.com/photo/2016/10/16/10/11/bullion-1744773_960_720.jpg
Рис. 4. Кремний https://upload.wikimedia.org/wikipedia/commons/e/e9/SiliconCroda.jpg Общественное достояние
Рис. 5. Классификация смесей © ЯКласс
Чистое вещество и смеси. Химия
В 8-м классе школьники изучают в курсе химии чистые вещества и смеси. Наша статья поможет им разобраться в этой теме. Мы расскажем, какие вещества называют чистыми, а какие – смесями. А вы когда-нибудь задумывались над вопросом: «Существует ли абсолютно чистое вещество?» Возможно, ответ вас удивит.
Для чего эту тему изучают в школе?
Прежде чем рассматривать определение «чистого вещества», необходимо разобраться с вопросом: «С каким веществом мы на самом деле имеем дело – с чистым или смесью?»
Во все времена чистота вещества волновала не только научных сотрудников, ученых, но и простых людей. Что мы обычно вкладываем в это понятие? Каждый из нас хочет пить воду без примесей тяжелых металлов. Мы хотим дышать свежим воздухом, который не загрязнен выхлопными газами автомобилей. Но можно ли назвать незагрязненные воду и воздух чистыми веществами? С точки зрения науки – нет.
Что мы обычно вкладываем в это понятие? Каждый из нас хочет пить воду без примесей тяжелых металлов. Мы хотим дышать свежим воздухом, который не загрязнен выхлопными газами автомобилей. Но можно ли назвать незагрязненные воду и воздух чистыми веществами? С точки зрения науки – нет.
Что такое смесь?
Итак, смесь – это вещество, которое содержит молекулы нескольких видов. Теперь подумайте о составе воды, кторая течет из крана – да-да, в ней много примесей. В свою очередь вещества, которые составляют смесь, называются компонентами. Рассмотрим пример. Воздух, которым мы дышим, – это смесь разных газов. Компоненты, входящие в его состав – кислород, азот, углекислый газ и так далее. В случае, если масса одного компонента в десятки раз меньше массы другого, то такое вещество называют примесью. Часто в природе встречается воздух, который загрязнен примесями сероводорода. Этот газ имеет запах тухлых яиц и является ядовитым для человека. Когда отдыхающие на берегу реки разводят костер, то он загрязняет воздух углекислым газом, который тоже опасен в большом количестве.
У особо догадливых ребят, возможно, уже возник вопрос: «Что чаще встречается – чистые вещества или смеси?» Отвечаем на ваш вопрос: «В основном все, что нас окружает – это смеси».
Таким удивительным образом устроена природа.
Несколько слов о видах чистых веществ
В начале статьи мы обещали рассказать о том, существуют ли вещества абсолютно без примесей. Как вы думаете, бывают ли такие? О водопроводной воде мы уже говорили. Номожет ли содержать в себе примеси родниковая вода? Ответ на этот вопрос прост: абсолютно чистые вещества в природе не встречаются. Однако в научных кругах принято говорить об относительной чистоте вещества. Звучит это так: «Вещество чистое, но с оговоркой». Так, например, оно может быть чистым технически. Чернила черные и фиолетовые содержат примеси. Если их нельзя обнаружить при помощи химической реакции, то такое вещество называют химически чистым. Такой бывает дистиллированная вода.
О чистоте
Итак, пришло время поговорить о чистом веществе. Это такое вещество, которое в своем составе имеет частицы только одного вида. Оказывается, оно имеет особенные свойства. У него есть еще одно название: индивидуальное вещество. Давайте попробуем охарактеризовать свойства чистой воды:
Это такое вещество, которое в своем составе имеет частицы только одного вида. Оказывается, оно имеет особенные свойства. У него есть еще одно название: индивидуальное вещество. Давайте попробуем охарактеризовать свойства чистой воды:
- индивидуальное вещество: дистиллированная вода;
- температура кипения – 100°C;
- температура плавления – 0°C;
- такая вода не имеет вкуса, запаха и цвета.
Как разделять вещества?
Этот вопрос тоже уместен. Очень часто в быту и на производстве (в большей мере) человек разделяет вещества. Так, например, в молоке образуются сливки, которые можно собрать с поверхности, если применить метод отстаивания. Во время переработки нефти человек производит бензин, ракетное топливо, керосин, машинное масло и так далее. На всех этапах переработки человек применяет самые разные способы разделения смесей, которые зависят от агрегатного состояния вещества. Рассмотрим каждый из них.
Фильтрация
Данный метод применяют в том случае, когда есть жидкое вещество, в котором содержатся нерастворимые твердые частицы. Например, вода и речной песок. Такую смесь человек пропускает через фильтр. Таким образом, песок задерживается в фильтре, а чистая вода спокойно через него проходит. Мы редко придаем этому значение, но каждый день на кухне многие горожане пропускают воду из-под крана через очистительные фильтры. Так что в определенной степени вы можете считать себя учеными!
Например, вода и речной песок. Такую смесь человек пропускает через фильтр. Таким образом, песок задерживается в фильтре, а чистая вода спокойно через него проходит. Мы редко придаем этому значение, но каждый день на кухне многие горожане пропускают воду из-под крана через очистительные фильтры. Так что в определенной степени вы можете считать себя учеными!
Отстаивание
Об этом методе мы сказали несколько слов чуть выше. Однако рассмотрим его подробнее. К такому методу химики прибегают в случае, когда необходимо разделить суспензии или эмульсии. Например, если в чистую воду проникло растительное масло, то полученную смесь необходимо встряхнуть, затем дать ей настояться некоторое время. После этого человек будет наблюдать явление, когда масло в виде пленки покроет воду.
В лабораториях химики применяют еще один метод, который называется делительная воронка. При использовании этого способа очищения плотная жидкость проникает в емкость, а то, что легче – остается.
Метод отстаивания имеет серьезный недостаток – это низкая скорость протекания процесса. В этом случае необходимо длительное время для формирования осадка. На промышленных предприятиях такой способ все равно используют. Инженеры проектируют специальные конструкции, которые имеют название «отстойники».
Магнит
Каждый из нас хотя бы раз в жизни играл с магнитом. Его удивительное свойство притягивать металлы казалось магическим. Находчивые люди догадались применить магнит для того, чтобы разделять смеси. Например, разделение деревянных и железных опилок возможно при помощи магнита. Но стоит учесть, что не все металлы он может притягивать, ему подвластны только те смеси, в которых содержатся ферромагнетики. К ним можно отнести никель, тербий, кобальт, эрбий и так далее.
Дистилляция
Этот термин имеет латинские корни, в переводе означает «стекание каплями». Такой метод представляет собой разделение смесей, основанное на разницах температуры кипения веществ. Именно этот способ поможет разделить воду и спирт. Последнее вещество испаряется при +78°C. Когда его пары касаются холодных стенок и поверхностей, пары конденсируются, превращаясь в жидкое вещество.
Именно этот способ поможет разделить воду и спирт. Последнее вещество испаряется при +78°C. Когда его пары касаются холодных стенок и поверхностей, пары конденсируются, превращаясь в жидкое вещество.
В тяжелой промышленности данным методом добывают продукты нефти, чистые металлы, а также разнообразные душистые вещества.
Можно ли разделить газы
Мы с вами говорили про чистые вещества и смеси в жидком и твердом состоянии. А как быть, если необходимо провести разделение газовых смесей? Светлые головы химической промышленности сегодня практикуют несколько физических способов разделения газообразных смесей:
- конденсация;
- сорбирование;
- мембранное разделение;
- дефлегмация.
Итак, в нашей статье мы с вами рассмотрели понятие чистых веществ и смесей. Мы выяснили, что чаще встречается в природе. Теперь вы знаете различные способы разделения смесей – и некоторые из них можете продемонсттрировать самостоятельно, например магнит. Надеемся, что наша статья была для вас полезной. Изучайте науку сегодня, чтобы завтра она помогла вам решить любую проблему – как у себя дома, так и на производстве!
Надеемся, что наша статья была для вас полезной. Изучайте науку сегодня, чтобы завтра она помогла вам решить любую проблему – как у себя дома, так и на производстве!
Абсолютно чистые вещества — Справочник химика 21
Понятие о чистоте вещества имеет принципиальное значение в современной неорганической химии. Абсолютно чистые вещества в природе не существуют, поскольку загрязнение примесями (образование ограниченных растворов) происходит самопроизвольно вследствие резкого возрастания энтропии . Поэтому нет абсолютно нерастворимых веществ и, следовательно, любое вещество загрязнено примесями. Даже в тех случаях, когда вещество очищено до очень высокой степени, абсолютное число атомов примеси в единице массы или объема все еще остается огромным. Так, в германии полупроводниковой чистоты 99,9999999% Ое содержание атомов примесей не превышает Ю ат. доли, %, т. е. один атом примеси приходится на миллиард атомов основного вещества. Тем не менее 1 см этого особо чистого германия содержит около 10 атомов примеси. Примеси коренным образом влияют на свойства вещества. Например, хорошо известная хрупкость и исключительная твердость металлического хрома, как выяснилось, является следствием наличия небольшого количества примесей, в основном кислорода. Хром, полученный в условиях глубокого вакуума, оказался мягким и пластичным.
Примеси коренным образом влияют на свойства вещества. Например, хорошо известная хрупкость и исключительная твердость металлического хрома, как выяснилось, является следствием наличия небольшого количества примесей, в основном кислорода. Хром, полученный в условиях глубокого вакуума, оказался мягким и пластичным. Подобное же явление (появление второй фазы) наблюдается в точке плавления нри повышении температуры твердого тела во времени. Пересечение ординаты, соответствующей постоянной температуре, с кривой изменения температуры во времени дает точку плавления. На практике точка пересечения находится обычно путем экстраполяции. При известных значениях температуры плавления или температуры замерзания абсолютно чистого вещества этим методом можно рассчитать количество примесей, содержащихся в образце. Однако необходимо помнить о возможности существования кристаллических модификаций, которые изменяют ход кривой охлаждения.
 У очищенных парафинов кристаллические модификации, которые могут влиять на измерение плотности и коэффициентов расширения [234—235], встречаются вблизи точки плавления. [c.194]
У очищенных парафинов кристаллические модификации, которые могут влиять на измерение плотности и коэффициентов расширения [234—235], встречаются вблизи точки плавления. [c.194] I видимому, Л. Больцман. Тем не менее, большинство моделей этих систем детерминистские по своей сути. Другой недостаток, препятствующий моделированию сложных систем — стремление к описанию их на уровне взаимодействия элементарных частей системы. В сложных системах процессы являются стохастическими. Детерминированность таких систем кажущаяся. Квантовая теория изменила представления об атомах и молекулах. Одно из крупнейших достижений физики и химии XX века — теория гибридизации Л. Полинга, обычно понимается довольно узко как образование сложных электронных оболочек, хотя истинный смысл этой теории в том, что реальный атом в молекуле и изолированный атом таблицы Менделеева — разные вещества. То же относится к молекулам молекула в почве, лаборатории и организме — разные объекты. Состояние вещества зависит от среды.
Определение содержания основного вещества и примесей. В природе не существуют и принципиально не могут быть получены искусственным путем абсолютно чистые вещества. Развитие науки и производства требует применения все более и более чистых веществ и материалов. Задачей химии является разработка методов их получения и анализа. [c.74]
Абсолютно чистых веществ практически не бывает, поэтому значение заметно отличается от нуля и химическое сродство системы в исходном состоянии оказывается значительно меньше [c.
 135]
135]Из изложенного выше следует, что практически не существует абсолютно чистых веществ. Вместе с тем содержание примесей в отдельных образцах может быть весьма различным. Для вырабатываемых химической промышленностью продуктов применяются специальные наименования, обозначающие ту или иную степень их чистоты. Так, содержащий значительное количество примесей продукт носит название технического . По мере его очистки последовательно получаются следующие торговые сорта чистый , чистый для анализа , химически [c.59]
Для проведения химических реакций во многих случаях используют не абсолютно чистые вещества, а так называемые технические продукты или природные материалы (сырье). Кроме основного компонента в них присутствует большее или меньшее количество примесей. Обычно предполагается, а иногда и специально указывается в условиях задач, что примеси ведут себя инертно по отношению к тем реагентам, с которыми взаимодействует основной компонент (или, во всяком случае, при их взаимодействии с данным реагентом не получаются продукты, образуемые основным компонентом).
Вещества высокой чистоты имеют непреходящее самостоятельное значение в сугубо научном плане. Повышение степени чистоты часто приводило к открытию новых свойств вещества и новых явлений, т. е. к повышению уровня знаний о веществе как форме существования материи. Имеющиеся в нашем распоряжении материалы высокой чистоты пока представляют собой лишь слабое приближение к абсолютно чистому веществу , поскольку суммарное число примесных атомов или молекул в них всего на пять-шесть порядков меньше числа частиц основного вещества. [c.5]
Абсолютно чистое вещество получить невозможно. Применяемые в лабораторной практике вещества имеют различную степень чистоты, которая изменяется в некоторых пределах, устанавливаемых стандартами. [c.98]
При обсуждении вопроса о возможности получения абсолютно чистых веществ необходимо учесть следующее. При проведении очистки вещества, например методом зонной плавки, в основном достигается лишь вполне определенная предельная степень чистоты. Технические и временные затраты возрастают, как и в любых других методах, с ростом требований к степени чистоты и для получения абсолютно чистых веществ должны быть бесконечно большими. Кроме того, материал сосудов, в которых получают и хранят чистые вещества, всегда неизбежно является источником их загрязнений. Получение и
Технические и временные затраты возрастают, как и в любых других методах, с ростом требований к степени чистоты и для получения абсолютно чистых веществ должны быть бесконечно большими. Кроме того, материал сосудов, в которых получают и хранят чистые вещества, всегда неизбежно является источником их загрязнений. Получение и
Твердые растворы. Одним из видов дефектов, связанных с при. месями, являются твердые растворы. В природе нет кристаллов, состоящих из абсолютно чистого вещества. Каждое вещество содержит то или иное количество примесей, т. е. атомов постороннего вещества. Самые чистые химические вещества включают более 10 % примесей или избытка одного из своих компонентов. А это значит, что в кристаллах размером 1 см примесных атомов не менее 10 . [c.169]
В соответствии с существующей в настоящее время теоретической концепцией получение абсолютно чистых веществ т. е. совершенно не содержащих примесей) принципиально возможно, но только в очень небольшой области концентраций для достаточно большой пробы чистого вещества и за более или менее ограниченный промежуток времени. Для контроля чистоты необходимы особо чувствительные методы анализа. Применение методов ультрамикроанализа позволяет осуществить мечту аналитиков — обнаружение отдельных атомов в матрице вещества. Одним из таких методов является лазерная спектроскопия. Вещество испаряют и атомы селективно возбуждают действием лазерного излучения в узкой области частот. Возбужденный атом затем ионизируется вторичными фотонами. Число испускаемых при этом свободных электронов фиксируют пропорциональным счетчиком. С помощью эффективно действующей лазерной установки можно ионизировать все атомы определяемого вещества. Метод, основанный на использовании этого явления, называют резонансной ионизационной опектро-скопией (РИС). Например, можно определять отдельные атомы цезия. В другом варианте метода — оптически насыщенной нерезонансной эмиссионной спектроскопии (ОНРЭС) — измеряют интенсивность флуоресцентного излучения возбужденных атомов. Чтобы отличить излучение определяемых элементов от излучения других компонентов пробы, длины волн флуоресценции сдвигают воздействием других атомов или молекул.
Для контроля чистоты необходимы особо чувствительные методы анализа. Применение методов ультрамикроанализа позволяет осуществить мечту аналитиков — обнаружение отдельных атомов в матрице вещества. Одним из таких методов является лазерная спектроскопия. Вещество испаряют и атомы селективно возбуждают действием лазерного излучения в узкой области частот. Возбужденный атом затем ионизируется вторичными фотонами. Число испускаемых при этом свободных электронов фиксируют пропорциональным счетчиком. С помощью эффективно действующей лазерной установки можно ионизировать все атомы определяемого вещества. Метод, основанный на использовании этого явления, называют резонансной ионизационной опектро-скопией (РИС). Например, можно определять отдельные атомы цезия. В другом варианте метода — оптически насыщенной нерезонансной эмиссионной спектроскопии (ОНРЭС) — измеряют интенсивность флуоресцентного излучения возбужденных атомов. Чтобы отличить излучение определяемых элементов от излучения других компонентов пробы, длины волн флуоресценции сдвигают воздействием других атомов или молекул.
Когда употребляют понятие чистое вещество , имеют в виду, конечно, не абсолютно чистое вещество, а вещество определенной степени очистки. Последняя же зависит от способа использования данного вещества или от технических возможностей. В нашей стране существует следующая градация веществ по чистоте технической чистоты , чистый , чистый для анализа (ЧДА) , химически чистый (ХЧ) , спектрально чистый , особой чистоты . В специальных случаях употребляются и иные марки, например полупроводниковой чистоты , фармакопейный и др. Для каждого вещества количества примесей для каждой категории чистоты устанавливаются отдельно. Наиболее чистые вещества, производимые промышленностью, содержат 10 —10- % примесей. [c.38]
Абсолютно чистых веществ нет. Применяемые в лабораторной практике вещества имеют различную степень чистоты.
 Максимально допустимое количество примесей в веществе устанавливается общесоюзным стандартом (ГОСТ). [c.43]
Максимально допустимое количество примесей в веществе устанавливается общесоюзным стандартом (ГОСТ). [c.43]Абсолютно чистых веществ нет. Применяемые в лабораторной практике вещества имеют различную степень чистоты. [c.49]
В своей практической деятельности (а значит это находит свое отражение и в задачах) мы обычно имеем дело не с абсолютно чистыми веществами, а с так называемыми техническими продуктами. Масса технического продукта (целое) состоит из массы чистого вещества (одна часть) и массы примесей (другая часть). [c.54]
Химия — наука о веществе, его составе и свойствах. Различают химические и физические свойства. Под химическими свойствами разумеют способность вещества вступать во взаимодействие с другими веществами. Каждое вещество обладает характерными для него физическими свойствами цветом, вкусом, запахом, плотностью, температурами плавления и кипения, вязкостью и др. Большинство физических свойств могут быть выражены определенными числовыми данными, или константами.
В заключение рассмотрим вопрос о возможности получения абсолютно чистых веществ . [c.16]
Афинная хроматография основана на специфичности биомолекул Принципиально этим методом возможно получение абсолютно чистых веществ В нативном состоянии ферменты за счет своего активного центра и регуляторного участка (одного или более) взаимодействуют с небольшим числом лигандов, которые представляют собой субстраты, либо эффекторы Благодаря высокому сродству активного участка фермента к лиганду, их обратимому связыванию и отсутствию какой-либо другой реакции между лигандом и матрицей возможно эффективное проведение афинной хроматографии [c.51]
Хорошо известно, что абсолютно чистых веществ в природе не бывает. Поэтому к вопросу о чистоте растворителя следует подходить разумно. Одни и те же примеси в разных условиях могут либо вообще не влиять на результат, либо сделать анализ невозможным. Так, незначительная примесь олефинов в алкановом растворителе совершенно не мешает при работе с рефрактометром, но практически не позволяет проводить детектирование УФ-детектором при длине волны менее 260 нм. Напротив, [c.131]
Поэтому к вопросу о чистоте растворителя следует подходить разумно. Одни и те же примеси в разных условиях могут либо вообще не влиять на результат, либо сделать анализ невозможным. Так, незначительная примесь олефинов в алкановом растворителе совершенно не мешает при работе с рефрактометром, но практически не позволяет проводить детектирование УФ-детектором при длине волны менее 260 нм. Напротив, [c.131]
Абсолютно черное тело 4/1030 Абсолютно чистые вещества 3/835 [c.535]
Возможности обнаружения примесей также лежат в основе наших представлений о чистоте вещества. Начнем с того, что абсолютно чистых веществ не может быть в принципе. Этот вывод, в частности, следует из термодинамики (из уравнения 10.2 в разд. 10.5). Если концентрация какого либо реагента (примеси, от которой мы хотим избавиться) стремится к нулю, то ДС любой реакции, приводящей к ее удалению, стремится к бесконечности, и полная очистка вещества становится термодинамически невозможной. [c.442]
[c.442]
В природе не существует абсолютно чистых веществ. Поэтому, рассчитывая необходимые для реакции реагенты, не следует забы-ва.ть, что для химического процесса берутся и в результате процесса получаются не абсолютные вещества, а реальные химические материалы, т, е. вещества, содержащие примеси. В таких материалах различают главный компонент ( основу ) и малые компоненты ( примеси ). При этом примеси могут быть как вредными для свойств материала, так и полезными, специально вводимыми. [c.17]
Говоря о чистоте химических веществ, нужно отдавать себе отчет в том, что абсолютно чистое вещество можно представить только теоретически. Абсолютно чистых веществ нет и быть не может. В зависимости от метода очистки вещество содержит определенное количество примесей. Обычными методами очистки можно достичь содержания основного вещества 99,9.. . 99,95%. Специальными методами глубокой очистки можно уменьшить содержание примесей для органических веществ до 10 . . . 10″ %. [c.15]
. . 10″ %. [c.15]
Для получения абсолютно чистого вещества требуется бесконечно большой расход энергии и бесконечно большая высота колонны. [c.42]
Химические методы анализа не всегда удовлетворяют современным требованиям, особенно при проверке чистоты веществ. Все вещества представляют собой как бы растворы примесей в основном компоненте. Поэтому получить абсолютно чистое вещество практически невозможно, так как в нем тотчас происходит «растворение» компонентов окружающей среды, т.е. примесей. Иначе говоря, небольшое количество абсолютно чистого вещества может существовать лишь очень ограниченное время. Поэтому в технике вещество считают чистым, если повторная очистка не изменяет его физических свойств. [c.323]
Методика была проверена на пяти органических соединениях, для которых были сняты кривые замерзания и плавления и вычислены температуры замерзания абсолютно чистого вещества и степень чистоты исходных образцов. [c.228]
[c.228]
Получить абсолютно чистое вещество практически невозможно. Самая чистая дестиллированная вода всегда содержит (хотя и в ничтожно малых количествах) растворенные примеси самые чистые соли не свободны от ничтожных загрязнений. Поэтому в практической жизни химически чистым считают вещество, содержащее очень незначительное количество примесей, как говорят, следы их, так что эти примеси не имеют никакого практического значения и не влияют заметно на числовое выражение констант данного химически чистого вещества. В дальнейшем изложении при описании свойств веществ мы всегда будем иметь в виду химически чистые вещества. [c.24]
Абсолютно чистое вещество можно представить себе только теоретически. В практике чистым называют вещество, содержащее примеси ниже онределеиного предела. Этот предел, как правило, составляет доли процента н менее. Интерес к чистым веществам обусловлен потребностями современной науки и техники в материалах с особыми механическими, электрическими, полупроводниковыми, оптическими и другими физико-химическими свойствами. Особенно возросли требования к чистоте технических материалов с развитием атомной энергетики, полупроводниковой электро- н радиотехники, лазерной техники. Например, минимальная примесь может вызвать остановку ядерного реактора. В полупроводниковых материалах ничтожные следы посторонних примесей меняют величину и тип проводимости, а в отдельных случаях вообще лишают материал его полупроводниковых свойств. Получить особо чистое вещество — чрезвычайно сложная и важная технологическая задача, решенная пока для немногих веществ. Проверить чистоту вещества можно по его химическому составу и по физическим свойствам. [c.78]
Особенно возросли требования к чистоте технических материалов с развитием атомной энергетики, полупроводниковой электро- н радиотехники, лазерной техники. Например, минимальная примесь может вызвать остановку ядерного реактора. В полупроводниковых материалах ничтожные следы посторонних примесей меняют величину и тип проводимости, а в отдельных случаях вообще лишают материал его полупроводниковых свойств. Получить особо чистое вещество — чрезвычайно сложная и важная технологическая задача, решенная пока для немногих веществ. Проверить чистоту вещества можно по его химическому составу и по физическим свойствам. [c.78]
Так как абсолютно чистых веществ не существует (И 6), кристаллы неизбежно содержат примесные частицы, а [тогда тйк ке и более значительные включения инородных веществ или пустот. В общем, реальные кристаллы примерно так же относятся к теоретически рассматриваемым идеальным, как реальные газы к газу ндеа.мьиому. [c.384]
Абсолютно чистых веществ (степень чистоты 100%) нет. Любое вещество содержит большее или меньшее количество примесей. Чем меньше примесёй, тем выше качество химических веществ. Современная техника предъявляет высокие требования к степени чистоты различных химических продуктов. [c.42]
Любое вещество содержит большее или меньшее количество примесей. Чем меньше примесёй, тем выше качество химических веществ. Современная техника предъявляет высокие требования к степени чистоты различных химических продуктов. [c.42]
Таким образом, помимо неимоверных трудностей получения абсолютно «ЧИСТЫХ веществ, работать с ними практически невозможно, а при хранении самом процессе очися ки) в нпх неизбежно постепенно накапливаются прнмеси. [c.17]
В природе не существует абсолютно Mvi Tbix веществ. Например, так называемый особо чистый алюминий. все еще содержит 0,001 % примесей других веществ. Таким образом, абсолютно чистое вещество — это абстракция. Правда, когда речь идет о каком-либо веществе, то химия пользуется этой абстракцией, т, е. считает, что вещестпо истинно чистое, хотя практически берется вещество с некоторым содержанием примесей. Конечно, кимик должен стремиться использовать в своей практике по по. шожности истые вещества, содержащие минимальное количество примесей. Следует учитывать, [c.17]
Следует учитывать, [c.17]
Особенно важное значение этот эффект имеет в том случае, когда электропроводность абсолютно чистого вещества мала, как, например, в твердом германии. Предположим, что концентрация примеси столь мала, что ее атомы занимают места некоторых из атомов основного вещества. Если при этом число валентных электронов у атомов примеси на один меньше, чем у атомов основного вещества (например, атомы галлия имеют три валентных электрона, атомы германия — четыре), то мы имеем полупроводник р-типа с электропроводностью, в основном обусловленной наличием положительных дырок в зоне, котО рая в отсутствие примесей была бы целиком заполненной ва лентной зоной. Аналогично этому если атом примеси имеет один дополнительный валентный электрон (например, мышьяк имеет 5 валентных электронов), то мы имеем полупроводник м-типа, в котором проводимость обусловлена избытком электронов, занимающих пустую (в отсутствие примеси) зону проводимости. [c.352]
Оствальд пытался доказать, что гомогенные неустойчивые системы не могут существовать иначе, как в состоянии превращения . Для ЭТ0Г.0 он использовал законы энергетики , являющиеся, по его мнению, самым надежным основанием общих заключений . Эти законы,— говорил он,— не определяют численную величину скорости, которая должна при этом осуществляться они требуют только, чтобы эта скорость не была строго равна нулю, а имела конечную величину [9]. Но, во-первых, Оствальд не учитывает, что здесь может быть надежная защита для сохранения неустойчивости системы (например, высокая энергия активации) в течение неограниченно долгого времени. Во-вторых, выражаясь его же словами, мера времени или скорость химических реакций не устанавливается законами энергии [3, стр. 220]. И, наконец, в-третьих, с положением о естественной скорости трудно согласовать положение о Д1а-лой вероятности протекания реакций между абсолютно чистыми веществами, выдвинутое тоже самим Оствальдом. Самое главное в критике оствальдовского допущения естественных скоростей заключается в практической невозможности их учета в тех случаях, когда реакция не происходит без катализаторов.
Для ЭТ0Г.0 он использовал законы энергетики , являющиеся, по его мнению, самым надежным основанием общих заключений . Эти законы,— говорил он,— не определяют численную величину скорости, которая должна при этом осуществляться они требуют только, чтобы эта скорость не была строго равна нулю, а имела конечную величину [9]. Но, во-первых, Оствальд не учитывает, что здесь может быть надежная защита для сохранения неустойчивости системы (например, высокая энергия активации) в течение неограниченно долгого времени. Во-вторых, выражаясь его же словами, мера времени или скорость химических реакций не устанавливается законами энергии [3, стр. 220]. И, наконец, в-третьих, с положением о естественной скорости трудно согласовать положение о Д1а-лой вероятности протекания реакций между абсолютно чистыми веществами, выдвинутое тоже самим Оствальдом. Самое главное в критике оствальдовского допущения естественных скоростей заключается в практической невозможности их учета в тех случаях, когда реакция не происходит без катализаторов. Поэтому, не отрицая возможности медленного протекания некоторых реакций, ускоряемых катализаторами, в целом это допущение не выдерживает критики. [c.83]
Поэтому, не отрицая возможности медленного протекания некоторых реакций, ускоряемых катализаторами, в целом это допущение не выдерживает критики. [c.83]
Что такое чистое вещество — Справочник химика 21
Что такое чистое вещество [c.5]Продукты, поступающие на технический анализ, никогда не бывают химически чистыми. Даже такие чистые вещества, как реактивы, всегда содержат небольшое количество примесей. Так [c.9]
Весьма естественным является приложение принципа соответственных состояний к смесям. Для этого в первую очередь нужно определить критические овойства смесей, чтобы затем могли быть использованы основанные на приведенных параметрах состояния корреляции для чистых компонентов. В общем случае применение истинных критических свойств смесей не приводит к удовлетворительным результатам. Более результативным является использование понятия о псевдокритических свойствах. Эта концепция основывается на предположении, что существует чистое вещество, которое обладает теми же свойствами, что и смесь, при тех же температуре и давлении. Критические свойства такого чистого вещества будут псевдокритическими свойствами смеси. [c.341]
Критические свойства такого чистого вещества будут псевдокритическими свойствами смеси. [c.341]
В таблицах приводятся свойства часто используемых чистых веществ в стандартном состоянии. Стандартными условиями для твердых и жидких веществ считается температура 25 °С и давление 1 атм. Для газов в качестве стандартного принимается такой идеальный газ, фугитивность которого равна 1 атм при температуре 25°С (гипотетическое состояние). [c.135]
Для проведения идентификации в хроматографии исследователь должен иметь чистые вещества, наличие которых предполагается в анализируемой смеси. Такие чистые вещества называются СТАНДАРТАМИ. [c.63]
Это и есть стандартное изменение свободной энергии в реакции, относящейся к чистым веществам (ц,= р.»г, если = 1) при нормальном состоянии К (ж ) —константа равновесия, выраженная в молярных долях. Для идеального газа мы можем связать К (с ) и К (Р1) с К (х ), используя К (х1) и соотношения, вытекающие из законов для идеального газа /> = х Р (Р— общее давление) j= /У = Р1/НТ = х Р/НТ = где V — общий объем К (/),)= К (х ) РД» и К (с ) = К (x ) УД», где Ап — изменение числа молей в реакции. Таким образом, [c.242]
Таким образом, [c.242]
Один из вариантов этого метода состоит в следующем. На полосу фильтровальной бумаги по одной горизонтали наносят каплю раствора смеси разделяемых веществ и капли растворов, содержащих по одному из веществ, присутствие которых предполагают в смеси (такие чистые вещества, применяемые для распознавания состава смеси, называют свидетелями ). Полосу бумаги с нанесенными каплями высушивают и помещают в камеру, погружая верхний конец бумаги в лодочку со смесью нескольких жидкостей, плохо растворимых одна в другой, например фенола с водок. Герметически закрывающаяся камера (рис. 1) наполнена смесью паров этих жидкостей, для чего на дно камеры ставится сосудик с этими жидкостями. Жидкость из верхней лодочки будет медленно стекать по бумаге вниз, смывая как пятно со смесью веществ, так и пятно с чистыми веществами. Различные вещества имеют различные растворимости в каждом из стекающих растворителей, различен будет и коэффициент распределения каждого вещества в этих растворителях. Поэтому по истечении опре. [c.12]
Поэтому по истечении опре. [c.12]
Что такое чистое вещество Абсолютно чистое вещество можно представить себе только теоретически. Поэтому и определения его возможны только теоретические. Термодинамика считает вещество чистым, если оно ведет себя в многофазной системе как один независимый компонент и при всех операциях имеет один химический потенциал. Кинетика считает вещество чистым, если оно состоит из молекул одного типа. В действительности абсолютно чистых веществ нет и быть не может. Могут быть только вещества, более или менее приближающиеся к абсолютно чистым. Практика считает вещество достаточно чистым, если оно не содержит примесей такого рода и в таких количествах, которые мешают использованию этого вещества для данной определенной цели [1]. [c.7]
Здесь полезно дать определение нескольким химическим понятиям. Все вещества состоят из мельчайших частичек — атомов, которые существуют не по отдельности, а соединены между собой, сгруппированы, в частицы, уже обладающие свойствами данного вещества.
 Такие группы атомов, ведущие себя как единое целое, называются молекулами. Любое чистое вещество (индивидуальное) [c.11]
Такие группы атомов, ведущие себя как единое целое, называются молекулами. Любое чистое вещество (индивидуальное) [c.11]Почерпнув на примере хлорида натрия нужные сведения, мы можем теперь ответить на вопрос что же такое чистое вещество. [c.19]
Этот метод состоит в следующем. На полосу фильтровальной бумаги по одной горизонтали наносят каплю раствора смеси разделяемых веществ и капли растворов, содержащих по одному из веществ, присутствие которых предполагают в смеси (такие чистые вещества, применяемые для распознавания состава смеси, называют свидетелями ). Полосу бумаги с нанесенными каплями помещают в камеру, погружая верхний край бумаги в лодочку со смесью двух жидкостей, плохо растворимых одна в другой. [c.17]
Чистый пар конденсируется на чистой шероховатой или гладкой поверхности всегда в форме пленки. Капельная конденсация происходит только в тех случаях, когда на поверхности конденсации имеется вещество, которое делает последнюю несмачиваемой и которое одновременно с тем прочно пристает к поверхности, или когда пар увлекает с собой такого рода вещество (часто в виде незначительной примеси). Отсюда явствует, что теоретические основы явления капельной конденсации очень сложны. Условиями, способствующими появлению капельной конденсации, являются незначительная скорость конденсации, небольшая вязкость конденсата, большое поверхностное натяжение, несмачиваемость поверхности и отсутствие шероховатостей на поверхности. Условиями, способствующими пленочной конденсации, являются смачиваемость конденсатом поверхности конденсации, небольшое поверхностное натяжение жидкости и большая тепловая нагрузка. Создается впечатление, что шероховатость поверхности имеет меньшее значение. [c.82]
Отсюда явствует, что теоретические основы явления капельной конденсации очень сложны. Условиями, способствующими появлению капельной конденсации, являются незначительная скорость конденсации, небольшая вязкость конденсата, большое поверхностное натяжение, несмачиваемость поверхности и отсутствие шероховатостей на поверхности. Условиями, способствующими пленочной конденсации, являются смачиваемость конденсатом поверхности конденсации, небольшое поверхностное натяжение жидкости и большая тепловая нагрузка. Создается впечатление, что шероховатость поверхности имеет меньшее значение. [c.82]
Когда Il> 100, то Aj>100 и в большинстве случаев можно пренебречь обратной реакцией. Б таком случае эта система представляет собой простую реакцию первого порядка. Обычными методами можно получить и, измерив К, вычислить затем Aj. Когда А»опыт необходимо начинать с системы, содержащей не чистое вещество А, а чистое вещество В. Если 100>ur>0,01, то нужно рассматривать обе реакции. Для этого случая решение дается уравнением (III.2.9) [c.91]
Для этого случая решение дается уравнением (III.2.9) [c.91]
При данной химической природе скорость реакции увеличивается с ростом удельной поверхности, которую можно развить, используя частицы малого диаметра или частицы с большой пористостью. Размер пор влияет на скорость диффузии и обусловливает доступность внутренней поверхности. Лишь изредка в качестве промышленных катализаторов применяют чистые вещества. Обычно главный компонент смешивается с другими веществами различной каталитической активности для улучшения эффективности или удобства применения катализатора. Такое смешение может в результате привести к увеличению активной поверхности [c.303]
Для получения очень чистого вещества, почти не содержащего посторонних примесей, перекристаллизацию часто повторяют много раз. Конечно, с каждой перекристаллизацией количество вещества уменьшается, так как часть его всегда остается в маточном растворе. [c.150]
Для химически чистых веществ теплота испарения представляет собой энергию, необходимую для испарения единицы массы вещества при постоянных давлении и температуре. Так как нефтяные фракции являются смесями углеводородов, то они выкипают в некотором интервале температур и в этом случае тепло затрачивается не только на испарение, но и на повышение температуры смеси. Точное определение теплоты испарения при таких условиях весьма затруднительно. Для химически чистых индивидуальных углеводородов теплота испарения известна и приводится в справочной литературе. [c.66]
Так как нефтяные фракции являются смесями углеводородов, то они выкипают в некотором интервале температур и в этом случае тепло затрачивается не только на испарение, но и на повышение температуры смеси. Точное определение теплоты испарения при таких условиях весьма затруднительно. Для химически чистых индивидуальных углеводородов теплота испарения известна и приводится в справочной литературе. [c.66]
В процессе обратного осмоса, как было показано выше, ионы через мембрану проходят практически в эквивалентных соотношениях. А это означает, что разделить таким методом, например, многокомпонентную смесь электролитов затруднительно (см. стр. 193). Вместе с тем задача подобного типа очень часто встречается на практике (например, при выделении определенных ионов из солоноватых и морских вод, извлечении ценных веществ из сточных вод, получении особо чистых веществ). [c.197]
Превращения, которые не вызывают изменения состояния, могут равным образом протекать при постоянной температуре и сопровождаться обменом энергии. Так, чистое вещество при постояннойг температуре может изменять кристаллическую структуру это изменение называют аллотропным . Например, твердая сера при 393,6 К переходит из орторомбической формы ( октаэдрическая сера) в моноклинную ( призматическая сера). Эти две формы отличаются кристаллической структурой и физическими свойствами [c.174]
Так, чистое вещество при постояннойг температуре может изменять кристаллическую структуру это изменение называют аллотропным . Например, твердая сера при 393,6 К переходит из орторомбической формы ( октаэдрическая сера) в моноклинную ( призматическая сера). Эти две формы отличаются кристаллической структурой и физическими свойствами [c.174]
Что такое чистое вещество , индивидуальное вещество , гомогенное вещество По классическому определению (если отвлечься от неизбежного присутствия большего или меньшего количества примесей), это вешество, все молекулы которого одинаковы по структуре. Подобное определение, казалось бы, не должно вызывать ни сомнений, ни двусмысленных толкований. И так оно и есть, пока речь идет о ниакомолекулярных веществах или даже [c.38]
Таблицы содержат следующие данные для чистых веществ мольную теплоемкость (Ср), значения эмпирических коэффициентов уравнений (VI-14), энтальпию (ДЯща) и энергию Гиббса (ЛСзэв), которые рассчитываются как изменения значений этих функций при образовании 1 моль данного соединения в стандартных условиях из простых и устойчивых в этих условиях веществ, и, наконец, абсолютную энтропию в стандартных условиях 5° . Примеры таких данных для некоторых веществ приведены в табл. VI- [12]. [c.135]
Примеры таких данных для некоторых веществ приведены в табл. VI- [12]. [c.135]
Сахаристые вещества, эллаговая и галловая кислоты были найдены также и при более раггних исследованиях в эллаговых дубильных веществах. Бсстегорн сомневается однако н присутствии галловой кислоты в дубильных веществах из дуба. При своих исследованиях ему не удались получить обладающего восстановляющей способностью сахарида из очищенного дубильного вещества дуба. В общем очеиь трудно получить дубильное вещество в чистом виде и повидимому труднее всего получить такое чистое вещество из эллагового дубильного вещества. [c.215]
Один из вариантов этого метода состоит в следующем. ia полосу фильтровальной бумаги по одной горизонтали наносят каплю раствора смеси разделяе.мых веществ п капли растворов, содержащих по одному из веществ, присутствие которых предполагают в смесн (такие чистые вещества, прилюияемые для распознавания состава смесн, называют саидетеля.ми ). Полосу бу.маги с нанесенными кап- [c.13]
Полосу бу.маги с нанесенными кап- [c.13]
Как известно [17], псевдокритическая концепция предполагает, что существует чистое вещество, которое обладает теми же свойствами, что и смесь при тех же температурах и давлении, а критические свойства такого чистого вещества будут псевдо-критическими свойствами смеси (правило Кэя). Оно основанО на корреляциях Р—V—Т и развито для вычисления псевдокри-тических констант смесей углеводородов из истинных критических констант индивидуальных компонентов и их мольных долей и позднее распространено на смеси углеводородов с неорганическими газами. Согласно Кэю, для смесей [c.134]
В таких чистых веществах, как перекристаллизованные 3—5 раз сывороточный альбумин лошади [25] или яичный альбумин [26], могут наблюдаться электрофоретически обнаруживаемые изменения при хранении в стерильных условиях на холоду. Эти изменения ускоряются при повьппенной температуре. [c.369]
СОСТОИТ в том, чтобы получить наибольший выход промежуточного вещества А , то в случае, когда энергия активации второй реакции больше, чем первой, оптимальным является падающий температурный профиль по длине реактора. Здесь снова при исходной смеси, состоящей из чистого вещества А , оптимальная температура на входе бесконечна, так что необходимо ограничить температуру верхним пределом Т. Нижний температурный предел в этой задаче также существен. Действительно, увеличение температуры способствует протеканию реакции с большей энергией активации А А ) за счет другой реакции (Л1 -> 2). и потому мы могли бы добиться практически полного превращения А ь А 2, проводя процесс в бесконечно длинном реакторе при бесконечно малой температуре, что, разумеется, бессмысленно. Нри > О существует оптимальная длина реактора, с превышением которой выход вещества А, уменьшается. Некоторые оптимальные профили показаны на рис. IX.6, из которого следует, что по мере увеличения длпны реактора максимальная температура Т поддерживается на все более коротком отрезке и падение температуры от Т до Т . становится все круче. Для большей ясности деталей кривые на рис. IX.6 проведены с общей абсциссой 2 = при этом точки А, В,.
Здесь снова при исходной смеси, состоящей из чистого вещества А , оптимальная температура на входе бесконечна, так что необходимо ограничить температуру верхним пределом Т. Нижний температурный предел в этой задаче также существен. Действительно, увеличение температуры способствует протеканию реакции с большей энергией активации А А ) за счет другой реакции (Л1 -> 2). и потому мы могли бы добиться практически полного превращения А ь А 2, проводя процесс в бесконечно длинном реакторе при бесконечно малой температуре, что, разумеется, бессмысленно. Нри > О существует оптимальная длина реактора, с превышением которой выход вещества А, уменьшается. Некоторые оптимальные профили показаны на рис. IX.6, из которого следует, что по мере увеличения длпны реактора максимальная температура Т поддерживается на все более коротком отрезке и падение температуры от Т до Т . становится все круче. Для большей ясности деталей кривые на рис. IX.6 проведены с общей абсциссой 2 = при этом точки А, В,. . Е обозначают вход в слой соответствующей длины. Точка Е отмечает вход в слой наибольшей длины, который выгодно использовать при данной минимальной температуре [c.269]
. Е обозначают вход в слой соответствующей длины. Точка Е отмечает вход в слой наибольшей длины, который выгодно использовать при данной минимальной температуре [c.269]
Каждую смесь расплавляют и затем медленно охлаждают, отмечая через оп-зеделенные промежутки времени температуру остывающего сплава. Таким образом получают кривую охлаждения. На рис. 79 приведены кривые охлаждения чистого вещества (/) и сплава (2). Переход чистого вещества из жидкого в твердое состояние сопровождается )ыделением теплоты кристаллизации, поэтому, пока вся жидкость не шкристаллизуется, температура остается постоянной. Далее охлаждение твердого вещества идет равномерно. [c.136]
Очевидно, [1 является химическим потенциалом чистого -того компонента при единичной фугитивности. Так же как и в случае чистого вещества, для йолного определения абсолютного значения фугитивности компонента раствора необходимо ввести дополнительное уточнение в виде условия [c. 25]
25]
В большинстве случаев при техно-химических расчетах приходится иметь дело не с чистыми веществами, а со смесями их. Теплоемкостг, же и теплосодерлформулы теплоемкости и теплосодержания имеются только для чистых веществ. Поэтому в случае подсчета величины Ql для продуктов, состоящих из нескольких компонентов (например, смесь водяного пара, водорода, окиси углерода и т. п.), формулы (49) и (49а) примут следую-щ,ий вид [c.83]
Всякое индивидуальное химически чистое вещество характеризуется совокунностью физических свойств, называемых его константами. Такими константами являются плотность, темнература кипения, температура плавления и др. [c.149]
Можно иллюстрировать метод расчета на примере простой четырех-кокпонентной смеси, углеводородов А, В, С и D. Для кагкдого из четырех чистых веществ при четырех выбранных длинах волн измеряются коэффициенты поглощения. Для каждой длины волны можно написать уравнение такого вида [c. 318]
318]
НИЯ, весьма сложен. В связи с этим существует разрьш между нашими представлениями о свойствах тяжелых углеводородных модельных веществ и тем, что мы знаем о свойствах тяжелых углеводородов нефти в общем наши знания об углеводородах молекулярного веса от 300—1000 довольно ограничены. Каждый, кто применяет для анализа высокомолекулярных продуктов методы, основанные на свойствах синтетических углеводородов, должен быть знаком с этим фактом. Для восполнения пробела необходима большая работа, так как недостаток данных по индивидуальным компонентам становится серьезной помехой при изучении высококипящих нефтяных фракций. Если метод структурно-группового анализа применяется для изучения структурных элементов, которые не могут быть точро определены в нефтяных фракциях, например степень разветвления, то единственно возможным путем является изучение синтетических углеводородов. В этих случаях требуется большое число данных не только о самих чистых веществах, но также и об их смесях. Несмотря на то, что число данных все время увеличивается, как правило, не имеется достаточного экспериментального материала по высокомолекулярным соединениям. [c.369]
Несмотря на то, что число данных все время увеличивается, как правило, не имеется достаточного экспериментального материала по высокомолекулярным соединениям. [c.369]
Чистое вещество всегда однородно, смеси же могут быть однородными или неоднородными. Однородными наз ывают смеси, в когорых ни непосредственно, ни при помощи микроскопа нельзя обнаружить частиц этих веш.еств вследствие ничтожно малой их величины. Таки.мн смесями являются смеси газов, многие жидкости, некоторые сплавы. [c.14]
Перекись водорода. Все шире используется в качестве обесцвечивающего агента вместо гипохлоритов (несмотря на более высокую стоимость), так как не дает осадка. В химической промышленности с ее помощью получают перекиси (бензоила, надуксусной кислоты), хиноны, окисляют альдегиды в кислоты, олефины в гликоли (в присутствии окислов ванадия, хрома, молибдена). Применяют ее в виде раствора, содержащего 31,3 г чистого вещества в 100 мл (1 мл раствора выделяет около 100 мл кислорода по реакции Н2О2- Н2О + [c. 139]
139]
Такие неравенства, показывающие, в каком направлении сместится равновесие двух фаз чистого вещества, можно получить с помощью уравнения Клапейрона—Клаузиуса. В самом деле, легко видеть, что направление, в котором сместится равновесие, например при увеличении давления, определяется знаком разности V2—Vl. Если ит>0, то с повышением давления температура плавления (т. е. температура сосуществования двух фаз) повысится. В том случае, когда давление увеличивается при постоянной температуре, должно произойти уменьшение объема, т. е. произойдет затвердевание жидкости. Если — гувеличение давления обусловит понижение температуры плавления, или (при 7 = onst) плавление твердого тела. [c.156]
Часто для придания катализа глру большей избирательности, повышения его. термической стойкости и механической прочности, а также для повышения активности катализаторы применяют не в виде чистых веществ, а в виде сложных, многоком-по еитпых сИсте,м> Наиболее интересны три типа таких катализаторов смеш. анные, на носителях я промотированные Этн названия несколько условны и скорее отвечают физическому состоянию готового катализатора, чем способу его получения. [c.299]
анные, на носителях я промотированные Этн названия несколько условны и скорее отвечают физическому состоянию готового катализатора, чем способу его получения. [c.299]
Проводники второго рода называются электролитами. Это могут быть, как указано выще, чистые вещества или растворы. Часто электролитами называют вещества, растворы которых проводят электрический ток. Эти растворы называются растворами электролитов. Мы будем пользоваться термином электролит в первом смысле, т. е. будем называть так вещество (в чистом виде или раствор), прохождение электрического тока через котсфое связано с движением ионов, причем на электродах протекают электрохимические реакции, ведущие (обычно, но не обязательно) к разложению растворенного вещества (электролиз). [c.385]
Полученный по этому способу кремний содержит 2—5% примесей. Необходимый для изготовления полупроводниковых приборов кремний высокой чистоты получают более сложным путем. Природный кремнезем переводят в такое соединение кремния, которое поддается глубокой очистке. Затем кремний выделяют из полученного чистого вещества термическим разложением илн действием восстановителя. Один из таких методов состоит в превращении кремнезема в хлорид кремния Si I4, очистке этого продукта и носстаповлении нз него кремния высокочистым цинком. Весьма чистый кремний можно получить также термическим разложением иодида кремния SII4 или силана SiH . Получающийся кремний содержит весьма мало примесей и пригоден для изготовления некоторых полупроводниковых приборов. Для получения еще более чистого продукта его подвергают дополнительной очистке, например, зонной плавке (см. 193). [c.508]
Затем кремний выделяют из полученного чистого вещества термическим разложением илн действием восстановителя. Один из таких методов состоит в превращении кремнезема в хлорид кремния Si I4, очистке этого продукта и носстаповлении нз него кремния высокочистым цинком. Весьма чистый кремний можно получить также термическим разложением иодида кремния SII4 или силана SiH . Получающийся кремний содержит весьма мало примесей и пригоден для изготовления некоторых полупроводниковых приборов. Для получения еще более чистого продукта его подвергают дополнительной очистке, например, зонной плавке (см. 193). [c.508]
Если два вещества смешать друг с другом в определенных пропорциях и смесь нагреть до высокой температуррзг, то в подавляющем большинстве случаев образуется совершенно однородная жидкость, представляющая собой раствор одного компонента в другом. Некоторые системы дадут два жидких слоя взаимно насыщенных растворов, и только немногие будут совершенно нерастворимы друг в друге ми прн каких условиях. Это относится к таким веществам, которые не разлагаются до температуры плавления. Если такой раствор пли снлав охладить, то при некоторой температуре он начинает кристаллизоваться, так как растворимость веществ с понижением температуры, как правило, уменьшается. Природа и количество выпадающего вещества обусловливается природой и количественными соотношениями компонентов в растворе. Как и при всякой кристаллизации, здесь будет выделяться теплота кристаллизации, которая влияет на скорость охлаждения сплава. В некоторых случаях охлаждение может полностью прекратиться и температура смеси в течение некоторого времени будет оставаться постоянной. Таким образом, охлаждая определенный раствор, достигают неравномерного падения температуры в зависимости от нронсходящих в сплаве процессов. Если наносить на оси ординат температуру, а на оси абсцисс — время, то будут получаться кривые, иллюстрирующие процесс охлаждения. Вид этих кривых будет в высокой степени характерен как для чистых веществ, так и для их смесей различных концентраций.
Это относится к таким веществам, которые не разлагаются до температуры плавления. Если такой раствор пли снлав охладить, то при некоторой температуре он начинает кристаллизоваться, так как растворимость веществ с понижением температуры, как правило, уменьшается. Природа и количество выпадающего вещества обусловливается природой и количественными соотношениями компонентов в растворе. Как и при всякой кристаллизации, здесь будет выделяться теплота кристаллизации, которая влияет на скорость охлаждения сплава. В некоторых случаях охлаждение может полностью прекратиться и температура смеси в течение некоторого времени будет оставаться постоянной. Таким образом, охлаждая определенный раствор, достигают неравномерного падения температуры в зависимости от нронсходящих в сплаве процессов. Если наносить на оси ординат температуру, а на оси абсцисс — время, то будут получаться кривые, иллюстрирующие процесс охлаждения. Вид этих кривых будет в высокой степени характерен как для чистых веществ, так и для их смесей различных концентраций. В процессе кристаллизации в зависимости от состава смеси могут выпадать твердые чистые компоненты, или твердые растворы. Кривые, выражающие зависимость температуры кристаллизации и плавления от состава данной системы, называются диаграммами плавкости. Эти диаграммы подразделяются на три типа в зависимости от того, какая фаза выделяется из раствора. К первому типу относятся системы, при кристаллизации которых из жидких растворов выделяются чистые твердые компоненты, так называемые неизоморфные смеси. Второй тип представляют системы, при кристаллизации которых из жидких растворов выделяются твердые растворы с неограниченной областью взаимной растворимости, так называемые изоморфные смеси. Третий тип системы, при кристаллизации которых из жидких растворов выделяются твердые растворы, характеризуются определенными областями взаимной растворимости. [c.227]
В процессе кристаллизации в зависимости от состава смеси могут выпадать твердые чистые компоненты, или твердые растворы. Кривые, выражающие зависимость температуры кристаллизации и плавления от состава данной системы, называются диаграммами плавкости. Эти диаграммы подразделяются на три типа в зависимости от того, какая фаза выделяется из раствора. К первому типу относятся системы, при кристаллизации которых из жидких растворов выделяются чистые твердые компоненты, так называемые неизоморфные смеси. Второй тип представляют системы, при кристаллизации которых из жидких растворов выделяются твердые растворы с неограниченной областью взаимной растворимости, так называемые изоморфные смеси. Третий тип системы, при кристаллизации которых из жидких растворов выделяются твердые растворы, характеризуются определенными областями взаимной растворимости. [c.227]
Действие азотной кислоты на углеводороды, много изучавшееся, все-таки не впояне выяснено и вот по каким причинам опыты нре-ясде всего ставились часто над смесями, но не над чистыми веществами, затем оказывала свое влияние одновременность многих реакций, влияние различных факторов, как температура, концентрация кислоты и т. д. [c.78]
д. [c.78]
Больцман дал очень ясную интерпретацию понятия энтропии, связав ее с упорядоченностью и неупорядоченностью на молекулярном уровне. В приложении 3 наряду со стандартными теплотами образования веществ приводятся также их стандартные энтропии, 5298. Не следует думать, однако, что эти величины получены из больцмановского выражения 5 = /с 1п И . Они определяются в результате калориметрических измерений теплоемкостей твердых, жидких или газообразных веществ, а также теплот плавления и испарения при комнатной температуре и их экстраполяции к абсолютному нулю. (Способы вычисления значений 5 из таких чисто термохимических данных излагаются в более серьезных курсах химии.) Эти табулированные значения Хгдв называют абсолютными энтропиями, основанными на третьем законе термодинамики. Дело в том, что рассуждения, на которых основано их вычисление по данным тепловых измерений, были бы неполными без предположения, называемого третьим законом термодинамики и гласящего энтропия идеального крщ тйлла при абсолютном нуле температур равна нулю. Содержание третьего закона представляется очевидным, если исходить из больцмановской статистической интерпретации энтропии. [c.61]
Содержание третьего закона представляется очевидным, если исходить из больцмановской статистической интерпретации энтропии. [c.61]
Эта формулировка правила фаз относится к однокомпонентной системе, т.е. к чистому веществу. Прави.то фаз приобретает еще бо.пьшее значение, если его распространить на систему из нескольких веществ, например на многокомпонентные растворы. Для таких систем правило фаз в его наиболее общей форме описывается соотношением [c.134]
Как выглядит состав чистых веществ. Чистые вещества и смеси
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко — это целый комплекс которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное — это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное — это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества — это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом — m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом — m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.
Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества — рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества — рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ — смесям. Смесь — это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Включают в себя различные вещества | |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в Они применяются в фармакологии, промышленном производстве.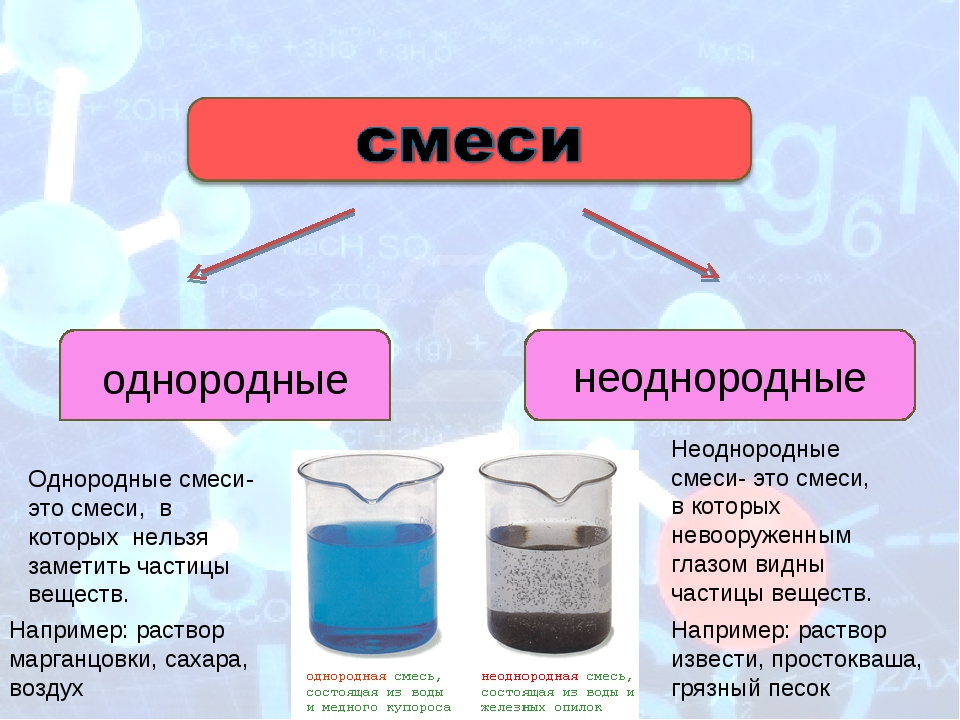
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача — отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.
Хроматография
Последний метод отделения — хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Чистое вещество содержит частицы только одного вида. Примерами могут служить серебро (содержит только атомы серебра), серная кислота и оксид углерода (IV) (содержат только молекулы соответствующих веществ). Все чистые вещества имеют постоянные физические свойства, например, температуру плавления (Т пл) и температуру кипения (Т кип).
Вещество не является чистым, если содержит какое-либо количество одного или нескольких других веществ – примесей .
Загрязнения
понижают температуру замерзания и
повышают температуру кипения чистой
жидкости. Например, если в воду добавить
соль, температура замерзания раствора
понизится.
Например, если в воду добавить
соль, температура замерзания раствора
понизится.
Смеси состоят из двух или более веществ. Почва, морская вода, воздух – все это примеры различных смесей. Многие смеси могут быть разделены на составные части – компоненты – на основании различия их физических свойств.
Различают гомогенные (однородные) и гетерогенные (неоднородные) смеси. Особенностью гомогенной смеси является то, что между компонентами такой смеси не наблюдается поверхности раздела. В этом случае говорят, что данная смесь является однофазной (фаза часть системы отделенная от других частей видимой поверхностью раздела). В пределах одной фазы физические свойства компонентов сохраняются постоянными. К гомогенным системам относятся истинные растворы (размер частиц растворенного вещества соотносится с размерами частиц растворителя и составляет ≤10 -9 м).
Особенностью гетерогенной
смеси является то, что мы можем наблюдать
поверхность раздела между ее компонентами. При переходе из одной фазы компонента
в другую его свойства резко изменяются.
Гетерогенные смеси иначе называются дисперсные
системы. Дисперсные системы состоят
из дисперсионной среды (растворитель,
непрерывная фаза) и дисперсной фазы
(растворенного вещества или прерывистой
фазы)
При переходе из одной фазы компонента
в другую его свойства резко изменяются.
Гетерогенные смеси иначе называются дисперсные
системы. Дисперсные системы состоят
из дисперсионной среды (растворитель,
непрерывная фаза) и дисперсной фазы
(растворенного вещества или прерывистой
фазы)
К гетерогенным смесям относятся дисперсные системы (размер частиц растворенного вещества значительно превышает размер частиц растворителя и составляет ≥10 -9 м). Смеси, в которых размер частиц вещества составляет 10 -7 -10 -9 м, относятся к коллоидным системам.
К дисперсным системам относятся:
Суспензии, смесь, состоящая из твердой и жидкой фазы (обозначение Т/Ж; Т- дисперсная фаза, Ж – дисперсионная среда)
Эмульсии, смесь из 2-х и более несмешивающихся жидкостей (обозначение – Ж/Ж. Дисперсная фаза и дисперсионная среда жидкости различающиеся по плотности и температурам кипения).
Более подробно данные системы будут рассмотрены в теме растворы и дисперсные системы.
1.
 5. Методы разделения смесей
5. Методы разделения смесейТрадиционными методами, которые используются в лабораторной практике с целью разделения смесей на отдельные компоненты, являются:
фильтрование,
декантация (в химической лабораторной практике и химической технологии механическое отделение твёрдой фазы дисперсной системы (суспензии) от жидкой путём сливания раствора с осадка),
разделение с помощью делительной воронки,
центрифугирование,
выпаривание,
кристаллизация,
перегонка (в том числе фракционная перегонка),
хроматография,
возгонка и другие.
Фильтрование. Для отделения жидкостей от взвешенных
в ней мелких твердых частиц применяют
фильтрование (рис.37) ,
т.е. процеживание жидкости через
мелкопористые материалы – фильтры ,
которые пропускают жидкость и задерживают
на своей поверхности твердые частицы.
Жидкость, прошедшая через фильтр и
освобожденная от находившихся в ней
твердых примесей, называется фильтратом .
В лабораторной практике часто применяют гладкие и складчатые бумажные фильтры (рис.38) , сделанные из непроклеенной фильтровальной бумаги.
Для фильтрования горячих растворов (например, с целью перекристаллизации солей), применяют специальную воронку для горячего фильтрования (рис.39) с электрическим или водяным обогревом).
Часто применяют фильтрование под вакуумом . Фильтрование под вакуумом используют для ускорения фильтрования и более полного освобождения твердой фазы от жидкой. Для этой цели собирают прибор для фильтрования под вакуумом (рис.40) . Он состоит из колбы Бунзена, фарфоровой воронки Бюхнера, предохранительной склянки и вакуум-насоса (обычно водоструйного).
В
случае фильтрования суспензии
малорастворимой соли кристаллы последней
могут быть промыты дистиллированной
водой на воронке Бюхнера для удаления
с их поверхности исходного раствора.
Для этой цели используют промывалку (рис.41) .
Декантация . Жидкости могут быть отделены от нерастворимых твердых частиц декантацией (рис.42) . Этот метод можно применять, если твердое вещество имеет большую плотность, чем жидкость. Например, если речной песок добавить в стакан с водой, то при отстаивании он осядет на дно стакана, потому что плотность песка больше, чем воды. Тогда вода может быть отделена от песка просто сливанием. Такой метод отстаивания и последующего сливания фильтрата и называется декантацией.
Центрифугирование. Для ускорения процесса отделения очень мелких частиц, образующих в жидкости устойчивые суспензии или эмульсии, используют метод центрифугирования. Этим методом можно разделить смеси жидких и твердых веществ, различающихся по плотности. Разделение проводится в ручных или электрических центрифугах (рис.43) .
Разделение
двух несмешивающихся жидкостей, имеющих
различную плотность и не образующих
устойчивых эмульсий,
можно осуществить с помощью делительной
воронки (рис. 44) .
Так можно разделить, например, смесь
бензола и воды. Слой бензола (плотность
= 0,879 г/см 3)
располагается
над слоем воды, которая имеет большую
плотность (
= 1,0 г/см 3).
Открыв кран делительной воронки, можно
аккуратно слить нижний слой и отделить
одну жидкость от другой.
44) .
Так можно разделить, например, смесь
бензола и воды. Слой бензола (плотность
= 0,879 г/см 3)
располагается
над слоем воды, которая имеет большую
плотность (
= 1,0 г/см 3).
Открыв кран делительной воронки, можно
аккуратно слить нижний слой и отделить
одну жидкость от другой.
Выпаривание (рис.45) – этот метод предусматривает удаление растворителя, например, воды из раствора в процессе нагревания его в выпарительной фарфоровой чашке. При этом выпариваемая жидкость удаляется, а растворенное вещество остается в выпарительной чашке.
Кристаллизация – это процесс выделения кристаллов твердого вещества при охлаждении раствора, например, после его упаривания. Следует иметь в виду, что при медленном охлаждении раствора образуются крупные кристаллы. При быстром охлаждении (например, при охлаждении проточной водой) образуются мелкие кристаллы.
Перегонка — метод очистки вещества основанный на
испарении жидкости при нагревании с
последующей конденсацией образовавшихся
паров. Очистка воды от растворенных в
ней солей (или других веществ, например,
красящих) перегонкой называется дистилляцией ,
а сама очищенная вода – дистиллированной.
Очистка воды от растворенных в
ней солей (или других веществ, например,
красящих) перегонкой называется дистилляцией ,
а сама очищенная вода – дистиллированной.
Фракционная перегонка (дистилляция) (рис.46) применяется для разделения смесей жидкостей с различными температурами кипения. Жидкость с меньшей температурой кипения закипает быстрее и раньше проходит через фракционную колонку (или дефлегматор ). Когда эта жидкость достигает верха фракционной колонки, то попадает в холодильник , охлаждается водой и через аллонж собирается в приемник (колбу или пробирку).
Фракционной перегонкой можно разделить, например, смесь этанола и воды. Температура кипения этанола 78 0 С, а воды 100 0 С. Этанол испаряется легче и первым попадает через холодильник в приемник.
Возгонка
– метод
применяется для очистки веществ,
способных при нагревании переходить
из твердого состояния в газообразное,
минуя жидкое состояние. Далее пары
очищаемого вещества конденсируются, а
примеси, не способные возгоняться,
отделяются.
>> Чистые вещества и смеси. Отстаивание. Разделение смеси трех твердых веществ
Чистые вещества и смеси
Материал параграфа поможет вам:
> осознать, что абсолютно чистых веществ не существует;
> различать однородные и неоднородные смеси веществ;
> выяснить, в каких смесях физические свойства компонентов сохраняются, а в каких — нет;
> выбрать метод разделения смеси веществ в зависимости от ее типа.
Чистые вещества и смеси.
Каждое вещество всегда содержит определенное количество примесей. Вещество, в котором почти нет примесей, называют чистым. С такими веществами работают в научной лаборатории, школьном химическом кабинете. Заметим, что абсолютно чистых веществ не существует.
Каждое вещество, содержащееся в смеси, называют компонентом.
Смеси, в которых компоненты невозможно обнаружить наблюдением, называют однородными.
Большинство металлических сплавов — также однородные смеси. Например, в сплаве золота с медью (его используют для изготовления ювелирных украшений) отсутствуют красные частицы меди и желтые частицы золота.
Например, в сплаве золота с медью (его используют для изготовления ювелирных украшений) отсутствуют красные частицы меди и желтые частицы золота.
Из материалов, которые являются однородными смесями веществ, изготовляют много предметов разнообразного назначения (рис. 27).
К однородным смесям принадлежат все смеси газов , в том числе и воздух. Существует немало однородных смесей жидкостей.
Рис. 27. Предметы, изготовленные из однородных смесей
Такая смесь образуется при смешивании, например, спирта и воды.
Приведите свой пример однородной смеси.
Однородные смеси еще называют растворами, даже если они твердые или газообразные.
По некоторым физическим свойствам однородные смеси отличаются от их компонентов. Так, сплав олова со свинцом, используемый для паяния, плавится при более низкой температуре, чем чистые металлы. Вода закипает при температуре 100 °С, а водный раствор соли — при более высокой температуре. Если воду охладить до температуры 0 °С, она начнет превращаться в лед. Раствор соли при этих условиях остается жидкостью (он замерзает при температуре ниже 0 °С). В этом можно убедиться зимой, когда дороги и тротуары, покрытые льдом, посыпают смесью соли с песком. Лед под действием соли плавится; образуется водный раствор соли, не замерзающий на слабом морозе. А песок нужен для того, чтобы дорога не была скользкой.
Раствор соли при этих условиях остается жидкостью (он замерзает при температуре ниже 0 °С). В этом можно убедиться зимой, когда дороги и тротуары, покрытые льдом, посыпают смесью соли с песком. Лед под действием соли плавится; образуется водный раствор соли, не замерзающий на слабом морозе. А песок нужен для того, чтобы дорога не была скользкой.
Рис. 28. Неоднородная смесь мела и воды
Вам известно, что мел не растворяется в воде. Если его порошок всыпать в стакан с водой, то в образовавшейся смеси всегда можно обнаружить частицы мела, которые видны невооруженным глазом или в микроскоп (рис. 28).
Смеси, в которых компоненты можно обнаружить наблюдением, называют неоднородными.
К неоднородным смесям (рис. 29) относятся большинство минералов, почва, строительные материалы, живые ткани, мутная вода, молоко и другие продукты питания, некоторые лекарственные и косметические средства.
Приведите свой пример неоднородной смеси.
В неоднородной смеси физические свойства компонентов сохраняются. Так, железные опилки , смешанные с медными или алюминиевыми, не теряют способности притягиваться к магниту.
Так, железные опилки , смешанные с медными или алюминиевыми, не теряют способности притягиваться к магниту.
Рис. 29. Неоднородные смеси:
а — смесь воды и серы;
б — смесь растительного масла и воды;
в — смесь воздуха и воды
Вода в смеси с песком, мелом или глиной замерзает при температуре О 0C и закипает при 100 °С.
Некоторые виды неоднородных смесей имеют специальные названия: пена (например, пенопласт, мыльная пена), суспензия (смесь воды с небольшим количеством муки), эмульсия (молоко, хорошо взболтанные растительное масло с водой), аэрозоль (дым, туман).
В каких находятся компоненты в каждой названной смеси?
Материал, изложенный выше, обобщен в схеме 3.
Схема 3. Вещества и смеси
Часто возникает необходимость разделить смесь, чтобы получить ее компоненты или очистить вещество от примесей.
Существует много методов разделения смесей. Их выбирают, учитывая тип смеси, агрегатное состояние и различия в физических свойствах компонентов (схема 4). Некоторые методы вам известны из курса природоведения.
Некоторые методы вам известны из курса природоведения.
Схема 4. Методы разделения смесей
Объясните, благодаря каким свойствам компонентов возможно разделение каждой неоднородной смеси, указанной на схеме.
Рис. 30. Рабочий в распираторе
Рассмотрим, как используют некоторые методы разделения смесей.
Процесс фильтрования лежит в основе работы респиратора — устройства, которое защищает легкие человека, работающего в сильно запыленном помещении. В респираторе имеются фильтры, препятствующие попаданию пыли в легкие (рис. 30). Простейший респиратор — повязка из нескольких слоев марли. Фильтр, извлекающий пыль из воздуха, есть и в пылесосе.
С помощью магнита в промышленности обогащают железную руду — магнетит.
Благодаря способности притягиваться к магниту руда отделяется от песка, глины, земли и др. Таким способом извлекают железо из промышленных и бытовых отходов.
Важным методом разделения однородных смесей жидкостей является перегонка, или дистилляция1. Этот метод позволяет очистить природную воду от примесей. Полученную чистую (дистиллированную) воду используют в научно-исследовательских лабораториях, в производстве веществ для современной техники, в медицине для приготовления лекарств.
Этот метод позволяет очистить природную воду от примесей. Полученную чистую (дистиллированную) воду используют в научно-исследовательских лабораториях, в производстве веществ для современной техники, в медицине для приготовления лекарств.
1 Термин происходит от латинского слова distillatio — стекание каплями.
В промышленности перегонкой нефти (смесь многих веществ, преимущественно — жидкостей) получают бензин, керосин, дизельное горючее.
В лаборатории перегонку осуществляют на специальной установке (рис. 31). При нагревании смеси жидкостей сначала закипает вещество с наиболее низкой температурой кипения. Его пар выходит из сосуда, охлаждается, конденсируется1, и образовавшаяся жидкость стекает в приемник. Когда этого вещества уже не будет в смеси, температура начнет повышаться, и со временем закипает другой жидкий компонент. Нелетучие жидкости остаются в сосуде.
Рис. 31.Лабораторная установка для перегонки:
а — обычная;
1 — смесь жидкостей с разными температурами кипения;
2 — термометр;
3 — водяной холодильник;
4 — приемник
6 — упрощенная
Разделение различных смесей происходит и в природе. Из воздуха оседают частицы пыли, а во время дождя и снега — капельки воды, снежинки. В результате отстаивания мутная вода становится прозрачной. От нерастворимых веществ вода очищается и при прохождении через песок. После испарения воды на берегах лиманов остаются соли, которые были растворены в ней. Из воды, вытекающей из скважины, выделяются растворенные газы.
Из воздуха оседают частицы пыли, а во время дождя и снега — капельки воды, снежинки. В результате отстаивания мутная вода становится прозрачной. От нерастворимых веществ вода очищается и при прохождении через песок. После испарения воды на берегах лиманов остаются соли, которые были растворены в ней. Из воды, вытекающей из скважины, выделяются растворенные газы.
1 Термин происходит от латинского слова condensatio — сгущение, уплотнение.
Выводы
Каждое вещество содержит примеси. Чистым считают вещество, в котором примесей почти нет.
Смеси веществ бывают однородными и неоднородными. В однородной смеси компоненты невозможно обнаружить наблюдением, а в неоднородной смеси это возможно.
Некоторые физические свойства однородной смеси отличаются от свойств компонентов. В неоднородной смеси свойства компонентов сохраняются.
Неоднородные смеси веществ разделяют отстаиванием, фильтрованием, иногда — действием магнита, а однородные — выпариванием и перегонкой (дистилляцией).
?
29. Какие типы смесей существуют и чем они отличаются?
30. Запишите приведенные слова и словосочетания в соответствующие столбцы помещенной ниже таблицы: алюминий, пепел, газетная бумага, ртуть, воздух, йодная настойка, гранит, лед из чистой воды, углекислый газ, железобетон.
| Чистые вещества | Смеси | |
| однородные | неоднородные | |
31. Назовите несколько продуктов питания, которые являются растворами.
32. Какой популярный напиток в зависимости от способа приготовления бывает однородной или неоднородной смесью?
33. Можно ли водный раствор поваренной соли превратить в неоднород ную смесь? Если можно, то как это сделать?
34. Какие смеси можно разделить фильтрованием: а) смесь песка и глины; б) смесь спирта и медных опилок; в) смесь воды и бензина; г) смесь воды с кусочками пластмассы? Назовите вещества, которые останутся на фильтре.
35. Как бы вы разделили смесь: а) поваренной соли и мела; б) спирта и воды? Какие различия в свойствах веществ дают возможность использовать выбранный вами метод?
36. Продумайте эксперимент по разделению смеси поваренной соли, песка, железных и древесных опилок. Составьте его план, кратко опишите каждый этап эксперимента и расскажите об ожидаемых результатах.
Экспериментируем дома
Отстаивание
В два стакана налейте воды. В один стакан насыпьте 1/2 чайной ложки песка, а в другой — столько же крахмала. Одновременно перемешайте обе смеси. С одинаковой ли скоростью оседают частицы веществ в воде? Если нет, то какие частицы оседают быстрее и почему?
Свои наблюдения запишите в тетрадь.
Разделение смеси трех твердых веществ
Смешайте небольшие количества измельченного пенопласта, песка и поваренной соли.
Какие методы можно использовать для разделения этой смеси?
Разделите смесь 1 . Если необходимо нагревание, осуществляйте его очень осторожно.
Если необходимо нагревание, осуществляйте его очень осторожно.
Каждый этап эксперимента опишите в тетради.
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Существуют ли абсолютно чистые вещества? Вещества абсолютно чистые, в составе которых нет ни единого постороннего атома или молекулы? В природе таких веществ не существует. Любое вещество содержит определенное количество примесей. Даже хорошо очищенная вода не может считаться чистым веществом, так как в ней растворены кислород, углекислый газ, и другие газы, содержащиеся в воздухе. Все вещества в природе в том или ином виде являются смесями.
Если в веществе содержание посторонних веществ незначительно, то такие вещества условно считают чистыми.
Если из водопроводной воды в значительной мере удалить все растворенные в ней вещества, то такую воду можно считать чистым веществом. Растворимость газов воздуха в воде крайне мала и ею можно пренебречь.
Таким образом, все вещества и материалы в природе можно разделить на индивидуальные вещества и смеси веществ.
Представление о смесях и чистых веществах имели еще древнегреческие ученые. Согласно этим представлениям, чистое вещество состоит из частиц одного вида, а смеси состоят из различных частиц. Итак, чистое вещество состоит из одинаковых молекул, а смеси – из разных.
В смесях веществ свойства отдельных компонентов не меняются.
Смеси, в свою очередь, делят на однородные (гомогенные) и неоднородные (гетерогенные).
– смесь, в которой ее компоненты невозможно различить визуально
– смесь, в которой компоненты смеси можно различить визуально
Гомогенные смеси можно делить по агрегатному состоянию на твердые, жидкие и газообразные. Например, воздух – это гомогенная смесь различных газов. Гомогенными смесями являются сплавы металлов, растворы соли, сахара в воде.
Гетерогенные смеси могут быть различными. Рассмотрим два примера таких смесей. Первая смесь – смесь муки и воды. В данной смеси, после ее перемешивания, частицы муки какое-то время равномерно распределены в воде. Такие смеси называют суспензиями.
Рассмотрим два примера таких смесей. Первая смесь – смесь муки и воды. В данной смеси, после ее перемешивания, частицы муки какое-то время равномерно распределены в воде. Такие смеси называют суспензиями.
Суспензия – гетерогенная смесь, в которой частицы твердого вещества равномерно распределены в жидкости
Вторая смесь состоит из воды и подсолнечного масла. Данные жидкости не смешиваются друг с другом. Но если смесь энергично перемешать, то какое-то время капельки масла будут равномерно распределены в воде. Такие смеси называются эмульсиями.
Эмульсия – гетерогенная смесь, в которой частицы одной жидкости равномерно распределены в другой
Гетерогенные смеси могут состоять и из компонентов, находящихся в одном агрегатном состоянии. Например, смесь песка и древесных опилок – гетерогенная, так как ее компоненты легко различить визуально.
Существует множество способов, при помощи которых смеси веществ можно разделить на отдельные компоненты.
Способы разделения смесей
Действие магнита (магнитная сепарация)
Если в состав смеси входят порошки металлов, обладающих магнитными свойствами, то при помощи магнита эти металлы можно извлечь из смеси. Магнитными свойствами обладают такие металлы как железо, кобальт, никель . Необходимо просто рассыпать смесь по ровной поверхности и провести над ней магнитом. Частицы металла притянутся к магниту.
Отстаивание и декантация
Некоторые смеси можно разделить при помощи отстаивания и последующего сливания слоя жидкости с осевшего вещества (декантации). Данный способ основан на различной плотности веществ. Например, смесь древесных опилок и песка можно разделить при помощи данного метода. Смесь необходимо высыпать в стакан с водой. Тяжелые частицы песка осядут на дно, а легкие опилки будут плавать на поверхности воды. Осторожным сливанием верхнего слоя с опилками смесь будет разделена
Смесь двух твёрдых веществ, сильно различающихся по плотности, удобно разделять, пропуская через неё поток воды. Раньше так выделяли крупинки золота из измельчённой золотоносной породы. Золотоносный песок помещали на наклонный жёлоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжёлые крупинки золота оседали на дне жёлоба.
Раньше так выделяли крупинки золота из измельчённой золотоносной породы. Золотоносный песок помещали на наклонный жёлоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжёлые крупинки золота оседали на дне жёлоба.
Разделение смеси малорастворимых друг в друге жидкостей можно провести в делительной воронке. Например, смесь бензина и воды или подсолнечного масла и воды. Такие смеси быстро расслаиваются. При помощи делительной воронки нижний слой жидкости можно аккуратно слить, а верхний слой останется в воронке.
Фильтрование
Смеси, содержащие нерастворимые в воде вещества, можно разделить фильтрованием. В лаборатории для фильтрования используют стеклянную воронку, в которую вставлен фильтр — сложенный вчетверо круг фильтровальной бумаги. Фильтровальная бумага, в отличие от обычной, не содержит клеящих веществ, поэтому легко впитывает и пропускает жидкость. Размер пор в ней таков, что позволяет отделять от раствора частицы размером больше 0,01 мм.
Например, смесь из песка и поваренной соли следует всыпать в стакан с водой и хорошо перемешать стеклянной палочкой до полного растворения соли, песок при этом не растворится. Далее песок необходимо отделить от раствора соли, это можно сделать при помощи фильтрования. Фильтром будет служить специальная фильтровальная бумага.
После фильтрования раствора песок остается на бумажном фильтре, а раствор соли будет собран в стакане или колбе.
Фильтрованием легко очистить воду или раствор от попавших туда пылинок и других загрязнений, а также отделить осадок от раствора.
В промышленности в качестве фильтров часто используют ткани. Например, на маслобойных заводах измельчённые семена подсолнечника оборачивают плотной суконной тканью и сжимают между стальными плитами.
Растительное масло проходит через ткань, а внутри остаётся твёрдая масса — жмых.
Выпаривание
Метод выпаривания применяют для выделения растворителя из раствора, концентрирования раствора, кристаллизации растворенных веществ.
Раствор поваренной соли выливают в фарфоровую чашку, помещают в штативное кольцо и нагревают до полного испарения воды.
Перегонка
Способ разделения гомогенных смесей, основанный на различных температурах кипения веществ, называется перегонкой или дистилляцией.
Предположим, необходимо разделить смесь спирта и воды. Ни один из ранее рассмотренных способов не годится для разделения этой смеси.
Спирт и вода имеют различные температуры кипения. Так, вода кипит при +100°С а спирт при +78°С. При нагревании такой смеси спирт закипит раньше и начнет испаряться. Пары спирта поступают в холодильник – трубку, охлаждаемую проточной водой. В холодильнике пары спирта конденсируются в жидкость и собираются в колбе-приемнике. Вода остается в реакционной колбе. Таким образом, можно отделить спирт от воды. Схема установки для перегонки, представлена на рисунке.
- В природе нет абсолютно чистых веществ
- Однородная (гомогенная) смесь – смесь, в которой все ее компоненты находятся в одном агрегатном состоянии
- Неоднородная (гетерогенная) смесь – смесь, в которой компоненты смеси находятся в различных агрегатных состояниях
- Суспензия – гетерогенная смесь, в которой частицы твердого вещества равномерно распределены в жидкости
- Эмульсия – гетерогенная смесь, в которой частицы одной жидкости равномерно распределены в другой
- Основные способы разделения смесей: действие магнита, декантация, фильтрование, выпаривание, перегонка, экстракция
В нашей статье мы рассмотрим, что такое чистые вещества и смеси, способы разделения смесей.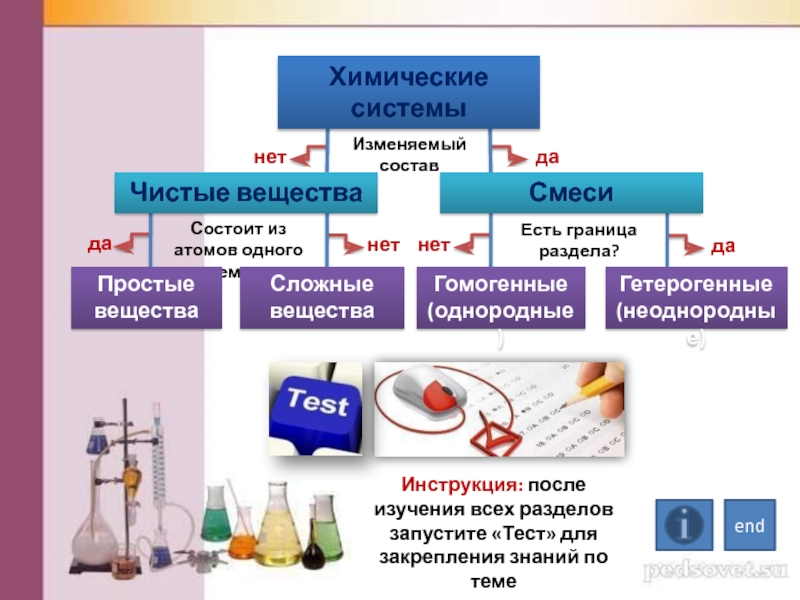 В повседневной жизни их использует каждый из нас. А встречаются ли вообще в природе чистые вещества? И как отличить их от смесей?
В повседневной жизни их использует каждый из нас. А встречаются ли вообще в природе чистые вещества? И как отличить их от смесей?
Чистые вещества и смеси: способы разделения смесей
Чистыми называют вещества, которые содержат частицы только определенного вида. Ученые считают, что в природе их практически не существует, поскольку все они, хоть и в ничтожных долях, содержат примеси. Абсолютно все вещества также являются растворимыми в воде. Даже если погрузить в эту жидкость, к примеру, серебряное кольцо, ионы этого металла перейдут в раствор.
Признаком чистых веществ являются постоянство состава и физических свойств. В процессе их образования происходит изменение количества энергии. Причем она может как увеличиваться, так и уменьшаться. Разделить чистое вещество на отдельные составляющие можно только с помощью химической реакции. К примеру, только дисциллированная вода обладает типичной для этого вещества температурой кипения и замерзания, отсутствием вкуса и запаха. А разложить ее кислород и водород можно только путем электролиза.
А чем отличаются от чистых веществ их совокупности? Ответить на этот вопрос нам поможет химия. Способы разделения смесей являются физическими, поскольку они не приводят к изменению химического состава веществ. В отличие от чистых веществ, смеси имеют непостоянный состав и свойства, а разделить их можно физическими методами.
Что такое смесь
Смесью называют совокупность индивидуальных веществ. Ее примером является морская вода. В отличие от дисциллированной, она обладает горьким или соленым вкусом, кипит при более высокой, а замерзает при более низкой температуре. Способы разделения смесей веществ являются физическими. Так, из морской воды можно добыть чистую соль путем выпаривания и последующей кристаллизации.
Виды смесей
Если добавить в воду сахар, через некоторое время его частички растворятся и станут невидимыми. В результате их невозможно будет отличить невооруженным глазом. Такие смеси называют однородными, или гомогенными. Их примерами также являются воздух, бензин, бульон, духи, сладкая и соленая вода, сплав меди и алюминия. Как видите, могут находиться в разных агрегатных состояниях, но чаще всего встречаются жидкости. Их также называют растворами.
Как видите, могут находиться в разных агрегатных состояниях, но чаще всего встречаются жидкости. Их также называют растворами.
В неоднородных, или гетерогенных смесях можно различить частицы индивидуальных веществ. Железные и деревянные опилки, песок и поваренная соль являются их типичными примерами. Неоднородные смеси также называют взвесями. Среди них различают суспензии и эмульсии. В состав первых входит жидкость и твердое вещество. Так, эмульсией является смесь воды и песка. Эмульсией называют совокупность двух жидкостей с разной плотностью.
Существуют неоднородные смеси и со специальными названиями. Так, примером пены является пенопласт, а к аэрозолям относятся туман, дым, дезодоранты, освежители воздуха, антистатики.
Способы разделения смесей
Безусловно, многие смеси обладают более ценными свойствами, чем отдельно взятые индивидуальные вещества, входящие в их состав. Но даже в быту возникают ситуации, когда их необходимо разделить. А в промышленности на этом процессе основаны целые производства. К примеру, из нефти в результате ее переработки получают бензин, газойль, керосин, мазут, соляровое и машинное масло, ракетное топливо, ацетилен и бензол. Согласитесь, выгоднее использовать эти продукты, чем бездумно сжигать нефть.
К примеру, из нефти в результате ее переработки получают бензин, газойль, керосин, мазут, соляровое и машинное масло, ракетное топливо, ацетилен и бензол. Согласитесь, выгоднее использовать эти продукты, чем бездумно сжигать нефть.
Теперь давайте разберемся, существует ли такое понятие, как химические способы разделения смесей. Допустим, из водного раствора соли нам необходимо получить чистые вещества. Для этого смесь необходимо нагреть. В результате вода превратится в пар, а соль кристаллизируется. Но при этом не произойдет превращения одних веществ в другие. Это значит, что основой данного процесса являются физические явления.
Способы разделения смесей зависят от агрегатного состояния, способности к растворимости, разнице в температуре кипения, плотности и состава ее компонентов. Рассмотрим каждый из них более подробно на конкретных примерах.
Фильтрование
Этот способ разделения подходит для смесей, в состав которых входят жидкость и нерастворимое в нем твердое вещество. К примеру, вода и речной песок. Эту смесь необходимо пропустить через фильтр. В результате чистая вода свободно пройдет через него, а песок останется.
К примеру, вода и речной песок. Эту смесь необходимо пропустить через фильтр. В результате чистая вода свободно пройдет через него, а песок останется.
Отстаивание
Некоторые способы разделения смесей основаны на действии силы тяжести. Таким образом на можно разложить суспензии и эмульсии. Если в воду попало растительное масло, такую смесь сначала необходимо взболтать. Потом оставьте ее на некоторое время. В результате вода окажется на дне сосуда, а масло в виде пленки будет покрывать ее.
В лабораторных условиях для отстаивания используют В результате ее работы более плотная жидкость сливается в сосуд, а легкая остается.
Отстаивание характеризуется низкой скоростью протекания процесса. Необходимо определенное время, чтобы сформировался осадок. В промышленных условиях этот способ осуществляют в специальных конструкциях, которые называются отстойники.
Действие магнитом
Если в состав смеси входит металл, то ее можно разделить при помощи магнита. К примеру, отделить железные и деревянные опилки. Но все ли металлы обладают такими свойствами? Вовсе нет. Для этого способа подойдут только смеси, содержащие ферромагнетики. Кроме железа к ним относятся никель, кобальт, гадолиний, тербий, диспрозий, гольмий, эрбий.
Но все ли металлы обладают такими свойствами? Вовсе нет. Для этого способа подойдут только смеси, содержащие ферромагнетики. Кроме железа к ним относятся никель, кобальт, гадолиний, тербий, диспрозий, гольмий, эрбий.
Дистилляция
Это название в переводе с латинского языка означает «стекание каплями». Дистилляция представляет способы разделения смесей, основанные на разнице в температурах кипения веществ. Таким образом, даже в домашних условиях можно разделить спирт и воду. Первое вещество начинает испаряться уже при температуре 78 градусов по Цельсию. Касаясь холодной поверхности пары спирта конденсируются, переходя в жидкое состояние.
В промышленности таким способом получают продукты переработки нефти, душистые вещества, чистые металлы.
Выпаривание и кристаллизация
Эти способы разделения смесей подходят для жидких растворов. Вещества, которые входят в их состав, отличаются температурой кипения. Таким образом, можно получить кристаллы соли или сахара из воды, в которой они растворены. Для этого растворы нагревают и выпаривают до насыщеного состояния. В этом случае кристаллы осаждаются. Если же необходимо получить чистую воду, тогда раствор доводят до кипения с последующей конденсацией паров на более холодной поверхности.
Для этого растворы нагревают и выпаривают до насыщеного состояния. В этом случае кристаллы осаждаются. Если же необходимо получить чистую воду, тогда раствор доводят до кипения с последующей конденсацией паров на более холодной поверхности.
Способы разделения газовых смесей
Газообразные смеси разделяют лабораторными и промышленными способами, поскольку этот процесс требует наличия специального оборудования. Сырьем природного происхождения является воздух, коксовый, генераторный, попутный и природный газ, представляющий собой совокупность углеводородов.
Физические способы разделения смесей, находящихся в газообразном состоянии следующие:
- Конденсация — это процесс постепенного охлаждения смеси, в ходе которого происходит конденсация ее составляющих. При этом в первую очередь в жидкое состоние переходят высококипящие вещества, которые собираются в сепараторах. Таким образом получают водород из а также отделяют аммиак из непрореагировавшей части смеси.

- Сорбирование — это поглощение одних веществ другими. Этот процесс имеет противоположные составляющие, между которыми в ходе реакции устанавливается равновесие. Для прямого и обратного процесса необходимы различные условия. В первом случае это сочетание высокого давления и низкой температуры. Такой процесс называют сорбцией. В обратном случае используют противоположные условия: низкое давление при высокой температуре.
- Мембранное разделение — способ, при котором используют свойство полупроницаемых перегородок избирательно пропускать молекулы различных веществ.
- Дефлегмация — процесс конденсации высококипящих частей смесей в результате их охлаждения. При этом температура перехода в жидкое состояние отдельных компонентов должна отличаться в значительной степени.
Хроматография
Название этого способа можно перевести как «пишу цветом». Представьте, что в воду добавлены чернила. Если опустить в такую смесь конец фильтровальной бумаги, она начнет впитываться. При этом вода будет поглощаться быстрее чернил, что связано с разной степенью сорбируемости этих веществ. Хроматография является не только способом разделения смесей, но и методом изучения таких свойств веществ, как диффузия и растворимость.
При этом вода будет поглощаться быстрее чернил, что связано с разной степенью сорбируемости этих веществ. Хроматография является не только способом разделения смесей, но и методом изучения таких свойств веществ, как диффузия и растворимость.
Итак, мы познакомились с такими понятиями, как «чистые вещества» и «смеси». Первые представляют собой элементы или соединения, состоящие только из частиц определенного вида. Их примерами являются соль, сахар, дистиллированная вода. Смеси — это совокупность индивидуальных веществ. Для их разделения используют ряд методов. Способ их разделения зависит от физических свойств его составляющих. К основным из них относятся отстаивание, выпаривание, кристаллизация, фильтрование, дистилляция, действие магнитом и хроматография.
Чем отличаются чистые вещества и смеси? Особо чистые вещества. Химия
Задачи: сформировать у учащихся понятие о
чистом веществе и смеси веществ; раскрыть
значение смесей в жизни человека и в природе;
познакомить со способами разделения смесей,
формировать навыки работы с лабораторным
оборудованием.
Планируемые результаты: знать: понятия «чистое вещество», «смесь»; способы разделения смесей; уметь: различать чистое вещество и смесь; работать с лабораторным оборудованием; освоить простейшие способы очистки веществ; применять полученные навыки и умения по очистке веществ в быту; делать выводы на основе результатов эксперимента.
Тип урока: изучение нового материала.
Методы: рассказ учителя, тестирование, беседа, демонстрация опыта, самостоятельная работа в группах по разноуровневым заданиям, лабораторная работа, составление обобщающей схемы, сообщения учащихся, выполнение упражнений.
Оборудование: бланки с тестом, бланки для самостоятельной работы. Оборудование для самостоятельной работы:
Вариант — I: стакан со смесью древесных, медных и железных опилок, магнит, 2 чистых стакана; инструкция к опыту, штатив с кольцом.
Вариант — II: стакан со смесью песка и
подкрашенной водой, 2 фильтра, стакан с
активированным углем, стеклянная палочка,
воронка, 2 чистых стакана, инструкция к опыту,
штатив с кольцом.
Вариант -III: магнит, стакан с водой, 2 листа бумаги, шпатель, инструкция.
Ход урока
I. Организация учащихся.
II. Актуализация знании.
Учитель. Многие вещества в природе состоят из молекул. Каждое конкретное вещество состоит только из собственных ему молекул: вода -из молекул воды, озон — из молекул озона. Молекулы различаются по форме, размеру и, в свою очередь, состоят из атомов. Общее название для всех атомов с одинаковым строением — элемент. Главное свойство атомов разных элементов — способность соединяться в молекулы разных веществ — соединений.
Каждое соединение имеет своё строение: решётку. Между типом решётки, видом химической связи и свойствами веществ существует взаимосвязь.
Задание (тест). Определите, о какой кристаллической решётке идёт речь:
- В узлах решётки находятся ионы
- Между частицами данной решётки существуют очень слабые силы межмолекулярного взаимодействия.
- В узлах решётки находятся и атомы, и ионы.

- Вещества обладают высокой твёрдостью и точностью.
- Вещества имеют ионную связь.
- В узлах решётки находятся отдельные атомы
- В узлах решётки находятся молекулы
- Вещества тугоплавки и нелетучи.
- Вещества обладают ковкостью, пластичностью, электро- и теплопроводностью.
- Частицы в данной решётке соединены между собой очень прочными ковалентными связями.
Учитель. Химическое строение определяет физические свойства вещества: агрегатное состояние, цвет, запах, температуры кипения и плавления и т.д. Знание свойств необходимо, что бы применять их с пользой для себя.
На доске выстраивается схема.
Состав ->строение ->свойства ->применение.
III. Изучение новой темы.
1. Понятие о чистом веществе и смеси.
Вопрос. Что же такое чистое вещество?
Учитель. Чистое вещество — это вещество,
которое состоит из одинаковых молекул или из
ионных атомных или металлических кристаллов,
постоянный состав которых может быть отражён с
помощью единственной формулы.
Только изучение веществ в чистом виде даёт представление об их истинных физических и химических свойствах, а следовательно, позволяет правильно использовать вещества. Вместе с тем, понятие «чистое вещество» условно, так как невозможно получить абсолютно чистое вещество, оно всё равно содержит примеси других веществ. Поэтому чистым веществом считается такое вещество, в котором примеси не влияют на его физические и химические свойства.
Запись. Чистым веществом называют вещество, обладающее постоянными физическими свойствами.
Беседа. 1. Что такое смеси?
Приведите примеры смесей.
Какие способы разделения смесей вам известны? На знании каких свойств они основаны?
Учитель. Смеси — это системы состоящие из
нескольких веществ — компонентов. Различные
образцы смесей могут содержать одни и те же
компоненты в любых соотношениях. Находясь в
смеси с другими веществами, каждое из них
сохраняет свои индивидуальные свойства, так что
свойства смеси определяются суммой свойств её
составных частей.
Демонстрация опыта. Разделение смеси растительного масла с водой с помощью делительной воронки.
Вопрос. Какие различия в физических свойствах веществ легли в основу данного способа разделения смеси? (различная плотность)
Учитель. Смеси могут быть однородными и неоднородными. Однородными называют такие смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, образующих смесь. Растворы, смеси газов и некоторые твёрдые смеси являются однородными.
Неоднородные смеси — это смеси, в которых невооружённым глазом или с помощью микроскопа можно заметить частицы веществ, составляющих смесь. Это мутная вода, бетонный раствор.
Задание. Приведите примеры однородных и неоднородных смесей.
2. Самостоятельная работа (групповая).
Цель: уметь различать чистое вещество и смесь, выработать умение находить рациональные способы разделения смесей, проводить простейший химический эксперимент.
Задания для 1-го варианта
Лёд, медь, туман, стекло, сода.
Назовите компоненты смеси: воздух
Дым, речная вода, чугун, глина.
2. Назовите способ разделения смеси, необходимой для выделения:
Соли из раствора поваренной соли в воде
Меди из смеси меди и древесных опилок
Бензина и нефти
3. Осуществите разделение смеси древесных, медных и железных опилок.
Составьте отчёт о проделанной работе в виде таблицы.
Задания для II варианта.
1. Выполните одно из предложенных заданий
Выпишите в две колонки: а) смеси, б) чистые вещества.
Чугун, дым, железо, кислород, чернила.
Назовите компоненты смеси: молоко.
Выпишите в две колонки: а) однородные, б) неоднородные смеси.
Туман, молоко, нефть, природный газ.
2. Назовите способ разделения смеси, необходимый для выделения:
Глины из смеси глины с водой.
Мела из смеси мела и поваренной соли.
Кислорода из воздуха.
3. Осуществите разделение смеси песка и
подкрашенной воды. Составьте отчёт о работе в
виде таблицы.
Задание III-го варианта.
1. Выполните одно из предложенных заданий.
Выпишите в две колонки: а) смеси, б) чистые вещества. Алюминий, воздух, сталь, золото, чернила.
Назовите компоненты смеси туман
Выпишите в две колонки: а) однородные, б) неоднородные смеси.
Чернила, воздух, строительный раствор, глина.
2.. Назовите способ разделения смеси, необходимый для выделения:
Речного песка из смеси речного песка с водой.
Минеральных солей из почвы.
Воды из смеси воды и машинного масла.
3. Осуществите разделение смеси железных и древесных опилок из песка. Составьте отчёт в виде таблицы.
(После обсуждения результатов самостоятельной работы, составляется обобщающая схема)
3. Значение смесей в жизни человека. Сообщения учащихся.
Выводы: (формулируют учащиеся).
Чистые вещества — это вещества с постоянными физическими свойствами.
Различные образцы смесей могут содержать одни
и те же компоненты в любых соотношениях, но
свойства этих компонентов не зависят от состава
смеси.
Смеси могут быть разделены на компоненты физическими способами.
IV. Домашнее задание.
Параграфы 23, 25, рабочая тетрадь № б с. 72
V. Закрепление рабочая тетрадь № 2 с. 72
Постарайтесь ответить на следующий вопрос: «Будет ли правильным изучать свойства воды, используя для этого морскую воду?». Естественно, нет, потому что морская вода представляет из себя не чистую H 2 O, а смесь разных веществ в ней. В первую очередь это соли (их главную массу составляет хлорид натрия), они придают морской воде своеобразный горько-соленый вкус. Абсолютно каждое вещество, которое можно выделить из воды, обладает определенными свойствами. Однако и сама вода, которая не загрязнена посторонними примесями или содержащая их чрезвычайно мало, – дистиллированная вода, обладает специфическими свойствами. Она замерзает при температуре 0°С, в то время как вода из океана – при температуре – 1,9 °С.
Природная вода не может быть совершенно чистой. Самой чистой является дождевая вода, однако и она содержит определенное количество примесей, которые захвачены из воздуха.
В повседневной жизни, мы, как правило, сталкиваемся не с чистыми веществами, а со смесями веществ. Подобные смеси могут быть неоднородными (к примеру, мутная вода из реки, содержит нерастворимые частицы песка и глины, их можно заметить невооруженным глазом) и однородными, (растворы сахара, спирта) в них нельзя заметить границу раздела между веществами.
Однородные смеси можно разделить на жидкие, твердые и газообразные. Самая важная газообразная смесь – воздух, он представляет собой смесь кислорода, азота, углекислого газа, аргона, а также других веществ. Из твердых смесей можно выделить стекло и различные сплавы – бронзу, латунь, сталь.
Состав различных смесей может быть достаточно разнообразным, они в отличие от чистых веществ, обладают другими свойствами. Чистая вода превращается в лед при температуре 0°С, если мы растворим в ней поваренную соль, то температура ее замерзания значительно понизится. Такими методами, к примеру, пользуются обленившиеся работники городского коммунального хозяйства, когда в период сильных заморозков и гололедицы посыпают тротуары технической поваренной солью.
Состав смеси можно установить при помощи химического анализа. Подобный способ широко распространен, он необходим при решении важнейших хозяйственных проблем, а также научно-технических задач.
Контроль состояния окружающей среды невозможен без определения концентрации примесей, которые загрязняют воздух, воду и почву. При разведке различных полезных ископаемых используется анализ горных пород и руд. Вспомним Шерлока Холмса, известного сыщика, главного героя многочисленных произведений А. Конан Дойла: ему всегда удавалось определить виновность или невиновность подозреваемого при помощи химического анализа, на который уходила значительная часть свободного времени сыщика. Без химического анализа не может обойтись как археолог, так и криминалист, как медик, так и искусствовед. Кроме этого, стоит упомянуть и космические исследования, изучение атмосферных газов планет, их горных пород, изучение состава лунного грунта невозможно без проведения этого трудоемкого процесса.
При помощи особых технологий и методов с применением химического анализа можно создать особо чистые вещества, содержание примесей в них, отражающееся на их свойствах, не превышает одной стотысячной и даже одной миллионной процента. Такие вещества играют важнейшую роль в атомной энергетике, волоконной оптике, полупроводниковой промышленности. Особо чистые вещества, а точнее их свойства, необходимы для создания принципиально новых приборов либо технологических процессов.
Такие вещества играют важнейшую роль в атомной энергетике, волоконной оптике, полупроводниковой промышленности. Особо чистые вещества, а точнее их свойства, необходимы для создания принципиально новых приборов либо технологических процессов.
Одной из важнейших проблем химии является очистка веществ. Для очищения природной воды от взвешенных частиц, ее пропускают через слой пористого вещества, к примеру угля, или обожженной глины. Если же идет речь о большом количестве воды, то в таких ситуациях используют фильтры из песка и гравия.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
Банальное яблоко — это целый комплекс которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное — это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества — это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также чистое вещество всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом — m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.
Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества — рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества — рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ — смесям. Смесь — это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.
Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные смеси однородные, а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Включают в себя различные вещества | |
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием делительной воронки. Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача — отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.
Хроматография
Последний метод отделения — хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот красящее вещество будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.
Тип урока. Изучение нового материала.
Цели урока. Обучающие – изучить понятия «чистое вещество» и «смесь», однородные (гомогенные) и неоднородные (гетерогенные) смеси, рассмотреть способы разделения смесей, научить учащихся разделять смеси на компоненты.
Развивающие – развить интеллектуальные и
познавательные умения учащихся: выделять
существенные признаки и свойства, устанавливать
причинно-следственные связи, классифицировать,
анализировать, делать выводы, выполнять опыты,
наблюдать, оформлять наблюдения в виде таблиц,
схем.
Воспитательные – содействовать воспитанию у учащихся организованности, аккуратности при проведении эксперимента, умения организовывать взаимопомощь при работе в парах, духа соревновательности при выполнении упражнений.
Методы обучения. Методы организации учебно-познавательной деятельности – словесные (эвристическая беседа), наглядные (таблицы, рисунки, демонстрации опытов), практические (лабораторные работы, выполнение упражнений).
Методы стимулирования интереса к учению – познавательные игры, учебные дискуссии.
Методы контроля – устный контроль, письменный контроль, экспериментальный контроль.
Оборудование и реактивы. На столах учащихся – листы бумаги, ложечки для веществ, стеклянные палочки, стаканы с водой, магниты, порошки серы и железа.
На столе учителя – ложечки, пробирки,
держатель для пробирок, спиртовка, магнит, вода,
химические стаканы, штатив с кольцом, штатив с
лапкой, воронка, стеклянные палочки, фильтры,
фарфоровая чашка, делительная воронка, пробирка
с газоотводной трубкой, пробирка-приемник,
«стакан-холодильник» с водой, лента
фильтровальной бумаги (2х10 см), красные чернила,
колба, сито, порошки железа и серы в массовом
отношении 7: 4, речной песок, поваренная соль,
растительное масло, раствор медного купороса,
манная, гречневая крупы.
ХОД УРОКА
Организационный момент
Отметить отсутствующих, объяснить цели урока и познакомить учащихся с его планом.
П л а н у р о к а
1. Чистые вещества и смеси. Отличительные особенности.
2. Однородные и неоднородные смеси.
3. Способы разделения смесей.
Беседа по теме «Вещества и их свойства»
Учитель. Вспомните, что изучает химия .
Ученик. Вещества, свойства веществ, изменения, происходящие с веществами, т.е. превращения веществ.
Учитель. Что называется веществом?
Ученик. Вещество – это то, из чего состоит физическое тело.
Учитель. Вы знаете, что вещества бывают простыми и сложными. Какие вещества называются простыми, а какие – сложными?
Ученик. Простые вещества состоят из атомов одного химического элемента, сложные – из атомов различных химических элементов .
Учитель. Какие физические свойства имеют вещества?
Ученик. Агрегатное состояние, температуры
плавления, кипения, электро- и теплопроводность,
растворимость в воде и др .
Агрегатное состояние, температуры
плавления, кипения, электро- и теплопроводность,
растворимость в воде и др .
Объяснение нового материала
Чистые вещества и смеси.
Отличительные особенности
Учитель. Постоянные физические свойства
имеют только чистые вещества. Только чистая
дистиллированная вода имеет t пл = 0 °С, t кип
= 100 °С, не имеет вкуса. Морская вода замерзает
при более низкой, а закипает при более высокой
температуре, вкус у нее горько-соленый. Вода
Черного моря замерзает при более низкой, а
закипает при более высокой температуре, чем вода
Балтийского моря. Почему? Дело в том, что в
морской воде содержатся другие вещества,
например растворенные соли, т.е. она представляет
собой смесь различных веществ, состав которой
меняется в широких пределах, свойства же смеси не
являются постоянными. Определение понятия
«смесь» было дано в XVII в. английским ученым
Робертом Бойлем: «Смесь – целостная система,
состоящая из разнородных компонентов».
Рассмотрим отличительные особенности смеси и чистого вещества. Для этого проделаем следующие опыты.
Опыт 1. Используя инструкцию к опыту, изучите существенные физические свойства порошков железа и серы, приготовьте смесь этих порошков и определите, сохраняют ли эти вещества свои свойства в смеси.
Обсуждение с учащимися результатов проведенного опыта.
Учитель. Опишите агрегатное состояние и цвет серы.
Ученик. Сера – твердое вещество желтого цвета.
Учитель. Каковы агрегатное состояние и цвет железа в виде порошка?
Ученик. Железо – твердое серое вещество .
Учитель. Как эти вещества относятся: а) к магниту; б) к воде?
Ученик. Железо притягивается магнитом, а сера – нет; в воде порошок железа тонет, т.к. железо тяжелее воды, а порошок серы всплывает на поверхность воды, т. к. не смачивается водой.
Учитель. Что можно сказать о соотношении железа и серы в смеси?
Ученик. Соотношение железа и серы в смеси
может быть различным, т.е. непостоянным.
Соотношение железа и серы в смеси
может быть различным, т.е. непостоянным.
Учитель. Сохраняются ли свойства железа и серы в смеси?
Ученик. Да, свойства каждого вещества в смеси сохраняются .
Учитель. Как можно разделить смесь серы и железа?
Ученик. Это можно сделать физическими методами: магнитом или водой.
Учитель. Опыт 2. Сейчас я покажу реакцию взаимодействия серы и железа. Ваша задача внимательно наблюдать этот опыт и определить, сохраняют ли свои свойства железо и сера в полученном в результате реакции сульфиде железа(II) и можно ли выделить из него железо и серу физическими методами.
Я тщательно перемешиваю порошки железа и серы в массовом отношении 7: 4:
m(Fе) : m(S) = А r (Fе) : А r (S) = 56: 32 = 7: 4,
помещаю смесь в пробирку, прогреваю в пламени
спиртовки, сильно накаливаю в одном месте и
прекращаю нагревание, когда начинается бурная
экзотермическая реакция. После остывания
пробирки осторожно разбиваю ее, предварительно
завернув в полотенце, и извлекаю содержимое.
Внимательно посмотрите на полученное вещество –
сульфид железа(II). Видны ли в нем отдельно серый
порошок железа и желтый — серы?
После остывания
пробирки осторожно разбиваю ее, предварительно
завернув в полотенце, и извлекаю содержимое.
Внимательно посмотрите на полученное вещество –
сульфид железа(II). Видны ли в нем отдельно серый
порошок железа и желтый — серы?
Ученик. Нет, полученное вещество имеет темно-серый цвет.
Учитель. Затем испытываю полученное вещество магнитом. Разделяются ли железо и сера?
Ученик. Нет, полученное вещество не намагничивается .
Учитель. Помещаю сульфид железа(II) в воду. Что вы наблюдаете при этом?
Ученик. Сульфид железа(II) тонет в воде .
Учитель. Сохраняют ли сера и железо свои свойства, входя в состав сульфида железа(II)?
Ученик. Нет, новое вещество обладает свойствами, отличными от свойств взятых для реакции веществ.
Учитель. Можно ли разделить сульфид железа(II) физическими методами на простые вещества?
Ученик. Нет, ни магнит, ни вода не могут
разделить сульфид железа(II) на железо и серу.
Учитель. Происходит ли изменение энергии при образовании химического вещества?
Ученик. Да, например, при взаимодействии железа и серы энергия выделяется.
Учитель. Занесем результаты обсуждения опытов в таблицу.
Таблица
Сравнительная характеристика смеси и чистого вещества
Для закрепления этой части урока выполните упражнение: определите, где на рисунке (см. с. 34) изображено простое вещество, сложное вещество или смесь.
Однородные и неоднородные смеси
Учитель. Выясним, отличаются ли смеси по внешнему виду друг от друга.
Учитель демонстрирует примеры суспензий (речной песок + вода), эмульсии (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Учитель. В суспензиях видны частицы твердого
вещества, в эмульсиях – капельки жидкости, такие
смеси называются неоднородными (гетерогенными),
а в растворах компоненты не различимы, они
являются однородными (гомогенными) смесями. Рассмотрим схему классификации смесей (схема
1).
Рассмотрим схему классификации смесей (схема
1).
Схема 1
Приведите примеры каждого вида смесей: суспензий, эмульсий и растворов.
Способы разделения смесей
Учитель. В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей (схема 2).
Схема 2
Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных смесей .
Как можно разделить суспензию – смесь речного песка с водой, т. е. очистить воду от песка?
Ученик. Отстаиванием, а затем фильтрованием.
Учитель. Верно. Разделение отстаиванием основано на различных плотностях веществ. Более
тяжелый песок оседает на дно. Так же можно
разделить и эмульсию: отделить нефть или
растительное масло от воды. В лаборатории это
можно сделать с помощью делительной воронки.
Нефть или растительное масло образует верхний,
более легкий слой . (Учитель демонстрирует
соответствующие опыты.)
В лаборатории это
можно сделать с помощью делительной воронки.
Нефть или растительное масло образует верхний,
более легкий слой . (Учитель демонстрирует
соответствующие опыты.)
В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке.
А на чем основано разделение гетерогенных смесей с помощью фильтрования ?
Ученик. На различной растворимости веществ в воде и на различных размерах частиц.
Учитель. Верно, через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка .
Ученик показывает опыт : наливает в смесь песка и соли воду, перемешивает, а затем пропускает взвесь (суспензию) через фильтр – раствор соли в воде проходит через фильтр, а крупные частицы нерастворимого в воде песка остаются на фильтре.
Учитель. А какие вещества можно использовать
в качестве фильтров?
А какие вещества можно использовать
в качестве фильтров?
Ученик. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие.
Учитель. Какие примеры применения фильтрования в жизни человека вы можете привести?
Ученик. Способ фильтрования – это основа работы бытовой техники, например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»).
Учитель. А теперь, познакомившись с этими способами разделения смеси, давайте поможем героине русской народной сказки «Василиса Прекрасная» .
Ученик. В этой сказке Баба-Яга приказала
Василисе отделить рожь от чернушки и мак от
земли. Героине сказки помогли голуби. Мы же
теперь можем разделить крупы фильтрованием
через сито, если крупинки имеют разные размеры,
или взбалтыванием с водой, если частицы имеют
разную плотность или различную смачиваемость
водой. Возьмем в качестве примера смесь,
состоящую из крупинок различного размера: смесь
манной и гречневой круп. (Ученик показывает,
как манка с меньшими размерами частиц проходит
через сито, а гречка остается на нем.)
Мы же
теперь можем разделить крупы фильтрованием
через сито, если крупинки имеют разные размеры,
или взбалтыванием с водой, если частицы имеют
разную плотность или различную смачиваемость
водой. Возьмем в качестве примера смесь,
состоящую из крупинок различного размера: смесь
манной и гречневой круп. (Ученик показывает,
как манка с меньшими размерами частиц проходит
через сито, а гречка остается на нем.)
Учитель. А вот со смесью веществ, имеющих разную смачиваемость водой, вы сегодня уже знакомились. О какой смеси я говорю?
Ученик. Речь идет о смеси порошков железа и серы. Мы проводили с этой смесью лабораторный опыт .
Учитель. Вспомните, как вы разделяли такую смесь.
Ученик. С помощью отстаивания в воде и с помощью магнита.
Учитель. Что вы наблюдали, разделяя смесь порошков железа и серы с помощью воды?
Ученик. Несмачивающийся порошок серы
всплывал на поверхность воды, а тяжелый
смачивающийся порошок железа оседал на дно .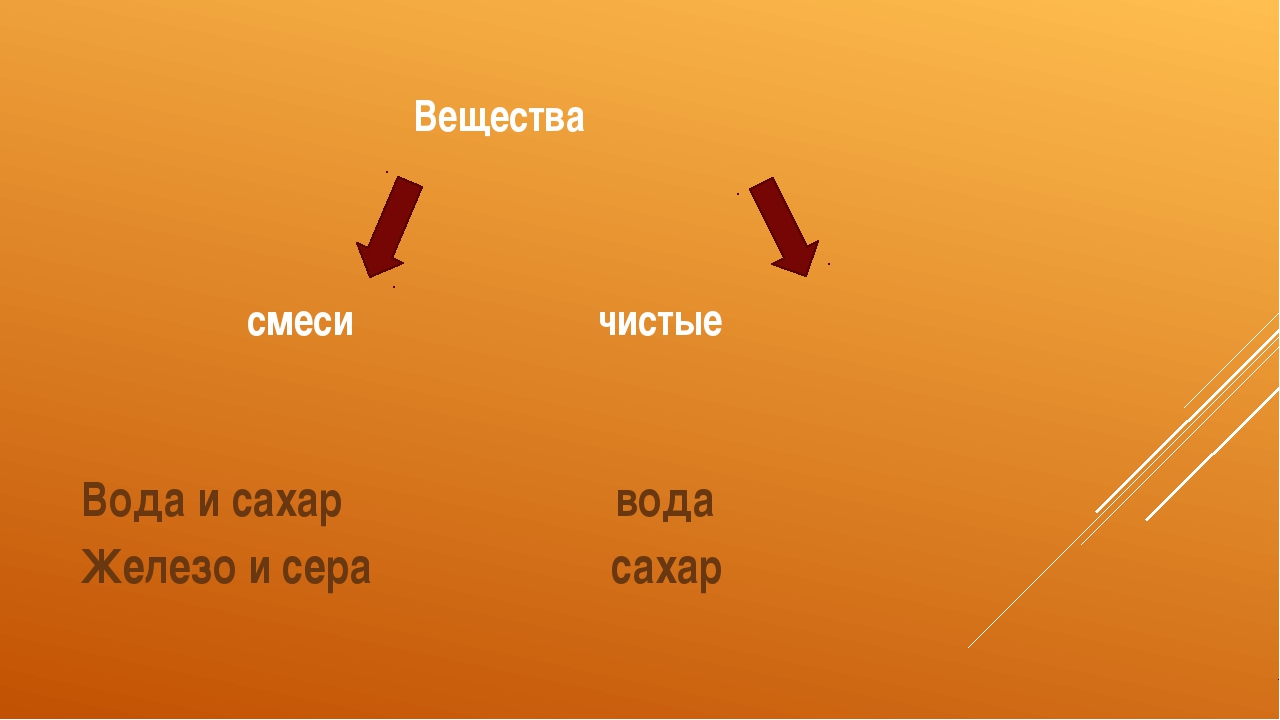
Учитель. А как происходило разделение этой смеси с помощью магнита?
Ученик. Порошок железа притягивался магнитом, а порошок серы – нет .
Учитель. Итак, мы познакомились с тремя способами разделения гетерогенных смесей: отстаиванием, фильтрованием и действием магнитом. А теперь рассмотрим способы разделения гомогенных (однородных) смесей . Вспомните, после отделения фильтрованием песка мы получили раствор соли в воде – гомогенную смесь. Как из раствора выделить чистую соль?
Ученик. Выпариванием или кристаллизацией .
Учитель демонстрирует опыт: вода испаряется, а в фарфоровой чашке остаются кристаллы соли.
Учитель. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества.
Если вещество, например сахар, разлагается при
нагревании, то воду испаряют неполностью –
упаривают раствор, а затем из насыщенного
раствора осаждают кристаллы сахара.
Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой .
Учитель показывает перегонку раствора медного купороса, вода испаряется при t кип = 100 °С, затем пары конденсируются в пробирке-приемнике, охлаждаемой водой в стакане.
Учитель. В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей.
Ученик демонстрирует рисунок сконструированного им «прибора» для дистилляции воды.
Учитель. Если же разделять смесь спирта и
воды, то первым будет отгоняться (собираться в
пробирке-приемнике) спирт с t кип = 78 °С, а
в пробирке останется вода. Перегонка
используется для получения бензина, керосина,
газойля из нефти.
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография .
Учитель демонстрирует опыт. Он подвешивает полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но граница подъема краски отстает от границы подъема воды. Так происходит разделение двух веществ: воды и красящего вещества в чернилах.
Учитель. С помощью хроматографии русский ботаник М.С.Цвет впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Ученик. Для различных целей необходимы
вещества с различной степенью очистки. Воду для
приготовления пищи достаточно отстоять для
удаления примесей и хлора, используемого для ее
обеззараживания.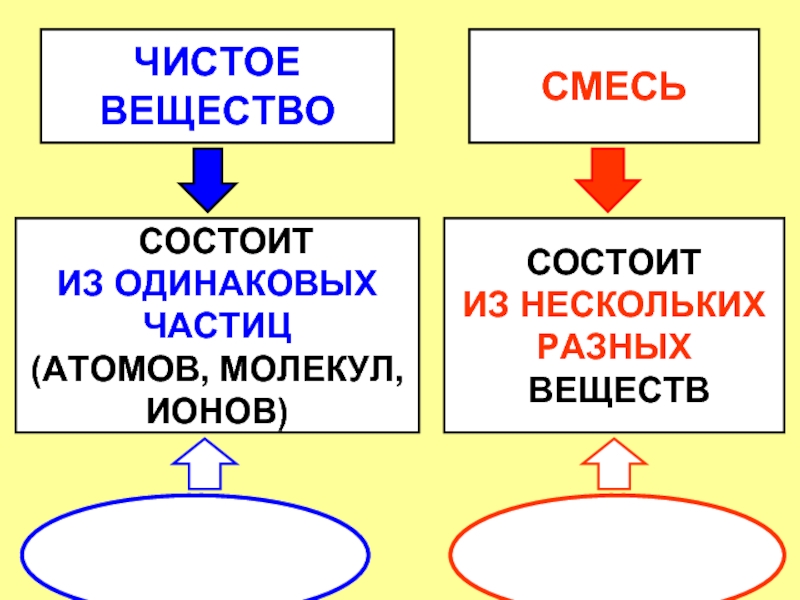 Воду для питья нужно
предварительно прокипятить. А в химических
лабораториях для приготовления растворов и
проведения опытов, в медицине необходима
дистиллированная вода, максимально очищенная от
растворенных в ней веществ. Особо чистые
вещества, содержание примесей в которых не
превышает одной миллионной процента,
применяются в электронике, в полупроводниковой,
ядерной технике и других точных отраслях
промышленности .
Воду для питья нужно
предварительно прокипятить. А в химических
лабораториях для приготовления растворов и
проведения опытов, в медицине необходима
дистиллированная вода, максимально очищенная от
растворенных в ней веществ. Особо чистые
вещества, содержание примесей в которых не
превышает одной миллионной процента,
применяются в электронике, в полупроводниковой,
ядерной технике и других точных отраслях
промышленности .
Учитель. Послушайте стихотворение Л.Мартынова «Дистиллированная вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Для закрепления и проверки усвоения материала
учащиеся отвечают на следующие вопросы .
1. При измельчении руды на горно-обогатительных фабриках в нее попадают обломки железных инструментов. Как их можно извлечь из руды?
2. Перед переработкой бытового мусора, а также бумажной макулатуры необходимо избавиться от железных предметов. Как проще всего это сделать?
3. Пылесос всасывает воздух, содержащий пыль, а выпускает чистый. Почему?
4. Вода после мойки автомобилей в крупных гаражах оказывается загрязненной машинным маслом. Как следует поступить перед сливом ее в канализацию?
5. Муку очищают от отрубей просеиванием. Почему это делают?
6. Как разделить зубной порошок и поваренную соль? Бензин и воду? Спирт и воду?
Л и т е р а т у р а
Аликберова Л.Ю. Занимательная химия. М.:
АСТ-Пресс, 1999; Габриелян О.С., Воскобойникова
Н.П., Яшукова А.В. Настольная книга учителя.
Химия. 8 класс. М.: Дрофа, 2002; Габриелян О.С. Химия.
8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В.,
Суровцева Р.П. Химия. 8 класс. М.: Дрофа, 1995; Ильф
И.А., Петров Е.П. Двенадцать стульев. М.:
Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара
Н.Н., Жегин А.Ю. Химия. Учебник для учащихся 8
класса общеобразовательных учреждений. М.:
Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г. Химия. Учебник для 8 класса общеобразовательных
учреждений. М.: Просвещение, 2000; Тыльдсепп А.А.,
Корк В.А . Мы изучаем химию. М.: Просвещение, 1998.
М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В.,
Суровцева Р.П. Химия. 8 класс. М.: Дрофа, 1995; Ильф
И.А., Петров Е.П. Двенадцать стульев. М.:
Просвещение, 1987; Кузнецова Н.Е., Титова И.М., Гара
Н.Н., Жегин А.Ю. Химия. Учебник для учащихся 8
класса общеобразовательных учреждений. М.:
Вентана-Граф, 1997; Рудзитис Г.Е., Фельдман Ф.Г. Химия. Учебник для 8 класса общеобразовательных
учреждений. М.: Просвещение, 2000; Тыльдсепп А.А.,
Корк В.А . Мы изучаем химию. М.: Просвещение, 1998.
Изучение параграфа поможет вам:
· различать чистые вещества и смеси;
· называть способы разделения смесей;
· приводить примеры природных смесей;
· характеризовать свойства смесей.
В химии различают чистые вещества и смеси веществ. Выясним, чем чистое вещество отличается от смеси.
ЧИСТЫЕ ВЕЩЕСТВА Если вещество чистое, то, кроме ее структурных частиц, другие частицы отсутствуют. Стоит помнить, что даже в химических лабораториях, не говоря уже о природные условия, абсолютно ЧИСТЫХ веществ не существует. Поэтому понятие чистого вещества применяют к веществам, в которых примесей настолько мало, что они заметно не влияют на свойства вещества.
Поэтому понятие чистого вещества применяют к веществам, в которых примесей настолько мало, что они заметно не влияют на свойства вещества.
Ученые пытаются выделять вещества в как можно более чистому виде для изучения их свойств и специального использования.
Чистое вещество — это вещество, не содержащее примесей других веществ.
СМЕСИ. В повседневной жизни вы в основном имеете дело не с чистыми веществами, а со смесями веществ или материалами, изготовленными из нескольких веществ.
Смеси получают сочетанием нескольких ЧИСТЫХ веществ.
Приведите примеры смесей, которыми вы пользуетесь в быту.
Па производстве также чаще всего имеют дело со смесями веществ. Знание свойств чистых веществ и их изменений под влиянием различных примесей чрезвычайно важное для правильного практического использования веществ.
В строительстве, косметологии и медицине, во время приготовления пищи, для стирки белья и тому подобное постоянно используют различные смеси. Существуют смеси и в природе. Вы знакомы с газообразными природными смесями — воздухом и природным газом, жидкими природными смесями — морской и минеральной водой, нефтью, молоком, твердыми смесями — грунтом, гранитом и тому подобное.
Вы знакомы с газообразными природными смесями — воздухом и природным газом, жидкими природными смесями — морской и минеральной водой, нефтью, молоком, твердыми смесями — грунтом, гранитом и тому подобное.
К веществам, из которых состоит смесь применяют название компоненты смеси. Смеси бывают однородные и неоднородные. Все зависит от размеров частиц компонентов смеси. В однородных смесях частицы одного вещества нельзя разглядеть среди частиц другого визуально (то есть с помощью зрения) или с помощью увеличительных приборов. Например, чистая вода и подслащенная сахаром снаружи и под лупой имеют одинаковый вид. Следовательно — это однородная смесь. Материал, из которого изготовлено оконное стекло (рис. 38) также является однородной смесью веществ, образованных в результате сплавления кварцевого песка, известняка и соды.
Гранит, грунт, смесь масла и воды — примеры неоднородных смесей. В них нетрудно обнаружить компоненты визуально или с помощью увеличительных приборов.
Смешиванием двух и более нерастворимых друг в друге веществ вы можете самостоятельно изготовить различные неоднородные смеси. Причем по вашему желанию их состав может быть разным.
Причем по вашему желанию их состав может быть разным.
СВОЙСТВА СМЕСЕЙ. Во-первых, смеси имеют произвольный состав. Так, на полках продуктовых магазинов можно увидеть сметану с разным процентом жира (15 %, 20 %, 30 %). Из сахара, высушенных листочков чая и воды вы готовите смесь под названием «чай». Вполне очевидно, что у кого-то из вас напиток будет слаще, в других — будет иметь темную окраску, но в каждом случае сахар не потеряет своего сладкого вкуса, а вещества чайной заварки — цвета. Сохранение вещества в составе смеси свои свойства — это еще одна характерная особенность смесей.
Рис. 38. Примеры однородных смесей (а — морская вода; б — водопроводная вода; — молоко; г — сок; д — стекло; е — бензин)
Количественный состав смесей произвольный. Вещества в смеси сохраняют свои индивидуальные свойства.
Благодаря сохранению индивидуальных свойств веществ в составе смеси их можно разделять на отдельные компоненты физическими методами.
Умение разделять смеси необходимо каждому человеку, независимо от того, будет она связывать свою будущую профессию с химией или нет.
СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ. Существует много способов разделения смесей, среди которых самые распространенные: отстаивание, фильтрование, выпаривание.
Отстаивание — это наиболее простой способ разделения неоднородных смесей, образованных из:
1) твердого вещества, что практически не растворяется в воде;
2) двух жидкостей, которые не смешиваются между собой.
Пример 1. Приготовим смесь песка и воды.
Сначала она будет мутной (рис. 39а), но пройдет немного времени, и песок, имея большую плотность, чем вода, осядет на дно, а слой воды над ним станет прозрачным (рис. 396). После этого осторожно сольем воду в другую посудину.
И какими бы осторожными вы не были, полное разделение смеси отстаиванием провести не удастся. Какая-то часть песка все же попадет в другой сосуд, а некоторое количество воды останется в стакане и змочуватиме песок.
Пример 2. Из жизненного опыта вам известно, что масло в воде не растворяется. Поэтому смесь указанных веществ достаточно быстро расслаивается, и ее после отстаивания можно легко разделить на компоненты. Для этого в химических лабораториях пользуются делительной воронкой (рис. 40).
Для этого в химических лабораториях пользуются делительной воронкой (рис. 40).
Посудите, в которой вещества — воды или масла — плотность большая.
Понятно, что нижний слой образован водой, а верхний — маслом (рис. 40а). Поэтому первой из делительной воронки через открытый край выльется вода (рис. 40б). Надо только вовремя его перекрыть, чтобы масло осталось в воронке.
Восстановите в памяти
Как на уроках природоведения вы наблюдать за приготовлением смесей учителем, сами изготовляли и разделяли смеси. Какие способы разделения смесей вы знаете?
Рис. 39. Разделение смеси нерастворимого твердого вещества и воды отстаиванием
Рис. 40. Разделение неоднородной смеси жидкости отстаиванием
РАЗДЕЛЕНИЕ СМЕСЕЙ ФИЛЬТРОВАНИЕМ Этим способом пользуются для разделения неоднородных смесей жидкости и нерастворимого в ней твердого вещества, например воды и мела (рис. 41). На лейку возложена фильтр, изготовленный из специальной пористой бумаги, который так и называют — фильтром.
Запомните! Края фильтра не должны выходить за пределы воронки, а быть на 0,2-0,5 см ниже ее краев. Следует следить, чтобы фильтр плотно прилегал к воронки (с этой целью внутреннюю стенку воронки предварительно смачивают водой).
Смесь осторожно выливают на фильтр по стеклянной палочке. Вода проникает сквозь поры фильтра в сосуд-приемник, а нерастворимая в ней мел остается на фильтре. Все, что прошло сквозь поры фильтра, называется фильтратом.
В быту фітльтром могут служить несколько слоев марли или другой ткани. Фильтром также может быть неплотный пучок ваты. Кстати, в домашних условиях, когда возникает необходимость в фильтровании, чаще всего пользуются ватным фильтром. Песчаные фильтры на водоочистных станциях (рис. 42), которые обеспечивают питьевой водой крупные города. Ныне в домашних условиях многие используют бытовые фильтры для очистки воды (рис. 43).
Рис. 41. Разделение неоднородной смеси воды и мела фильтрованием
Рис. 42. Использование фильтров на водоочистных станциях
Рис. 43. Бытовой переносной фильтр для очистки воды
43. Бытовой переносной фильтр для очистки воды
Рис. 44. Пылесос (а) и респиратор (6) фильтруют воздух от пыли
Фильтрация — отделение твердого вещества от жидкости посредством пропускания смеси веществ через пористый материал, проницаемый только для жидкости. Оно является самым распространенным способом разделения неоднородных смесей жидкостей и твердых веществ.
Также существуют фильтры, разделяющие смеси воздуха с частицами пыли (рис. 44).
РАЗДЕЛЕНИЕ СМЕСЕЙ ВЫПАРИВАНИЕМ. Однородные смеси отстаиванием или фильтрованием разделить нельзя. Частицы всех компонентов в них настолько малы, что не оседают и без задержки проходят через поры фильтра. Чтобы убедиться, что это действительно так, попробуем профильтровать однородную смесь, изготовленную из воды и медного купороса (твердого вещества голубого цвета) (рис. 45). Одинаковый голубой цвет смеси и фильтрата свидетельствует, что разделить эту смесь фильтрованием не удалось. На фильтре осадка не осталось, все компоненты смеси перешли в фильтрат (рис. 45а). Аналогично себя будет вести и однородная смесь поваренной соли и воды (рис. 45(5). Для разделения таких смесей следует использовать другой способ — выпаривание.
45а). Аналогично себя будет вести и однородная смесь поваренной соли и воды (рис. 45(5). Для разделения таких смесей следует использовать другой способ — выпаривание.
Рис. 45. Пропускания однородных жидких смесей через фильтр
Рис. 46. Разделение смеси поваренной соли и воды выпариванием
Для выпаривания необходимые спиртовка или другой нагревательный прибор, лабораторный штатив, фарфоровая чашка.
При нагревании смеси воды и соли (рис. 46а. (7) жидкий компонент (вода) испаряется, а твердое вещество (поваренная соль) остается на стенках и дне чашки (рис. 46.).
Разделить смесь — значит выделить из нее отдельные вещества. Разделение можно провести фильтрованием, отстаиванием, выпариванием и некоторыми другими способами.
1. Что называют чистым веществом, а смесью?
2. Какие виды смесей вам известны?
3. Чем однородная смесь отличается от неоднородной?
4. Приведите 2-3 примеры природных смесей, назовите их компонент.
5. Какие способы разделения смесей вы знаете?
6. Заполните таблицу (все необходимые сведения вы найдете в тексте параграфа). Используйте также самостоятельные примеры.
7. Установите соответствие между правой и левой колонками:
8. Какую смесь можно разделить фильтрованием, а какую выпариванием:
а) смесь мела и соли;
б) морскую воду?
9. Из приведенного перечня выпишите отдельно названия чистых веществ и смесей: сахар, минеральная вода, мед, молоко, углекислый газ, уксус, пищевая сода.
3 географии вам известно, что вода после испарения с морей и океанов возвращается на землю в виде дождя или снега. Тогда почему дождевая вода и снег не соленые?
Чистые вещества и смеси
Задачи: сформировать у учащихся понятие о
чистом веществе и смеси веществ; раскрыть
значение смесей в жизни человека и в природе;
познакомить со способами разделения смесей,
формировать навыки работы с лабораторным
оборудованием.
Планируемые результаты: знать: понятия «чистое вещество», «смесь»; способы разделения смесей; уметь: различать чистое вещество и смесь; работать с лабораторным оборудованием; освоить простейшие способы очистки веществ; применять полученные навыки и умения по очистке веществ в быту; делать выводы на основе результатов эксперимента.
Тип урока: изучение нового материала.
Методы: рассказ учителя, тестирование, беседа, демонстрация опыта, самостоятельная работа в группах по разноуровневым заданиям, лабораторная работа, составление обобщающей схемы, сообщения учащихся, выполнение упражнений.
Оборудование: бланки с тестом, бланки для самостоятельной работы. Оборудование для самостоятельной работы:
Вариант — I: стакан со смесью древесных, медных и
железных опилок, магнит, 2 чистых стакана;
инструкция к опыту, штатив с кольцом.
Вариант — II: стакан со смесью песка и подкрашенной водой, 2 фильтра, стакан с активированным углем, стеклянная палочка, воронка, 2 чистых стакана, инструкция к опыту, штатив с кольцом.
Вариант -III: магнит, стакан с водой, 2 листа бумаги, шпатель, инструкция.
Ход урока
I. Организация учащихся.
II. Актуализация знании.
Учитель. Многие вещества в природе состоят из молекул. Каждое конкретное вещество состоит только из собственных ему молекул: вода -из молекул воды, озон — из молекул озона. Молекулы различаются по форме, размеру и, в свою очередь, состоят из атомов. Общее название для всех атомов с одинаковым строением — элемент. Главное свойство атомов разных элементов — способность соединяться в молекулы разных веществ - соединений.
Каждое соединение имеет своё строение: решётку.
Между типом решётки, видом химической связи и
свойствами веществ существует взаимосвязь.
Задание (тест). Определите, о какой кристаллической решётке идёт речь:
- В узлах решётки находятся ионы
- Между частицами данной решётки существуют очень слабые силы межмолекулярного взаимодействия.
- В узлах решётки находятся и атомы, и ионы.
- Вещества обладают высокой твёрдостью и точностью.
- Вещества имеют ионную связь.
- В узлах решётки находятся отдельные атомы
- В узлах решётки находятся молекулы
- Вещества тугоплавки и нелетучи.
- Вещества обладают ковкостью, пластичностью, электро- и теплопроводностью.
- Частицы в данной решётке соединены между собой очень прочными ковалентными связями.
Учитель. Химическое строение определяет
физические свойства вещества: агрегатное
состояние, цвет, запах, температуры кипения и
плавления и т. д. Знание свойств необходимо, что бы
применять их с пользой для себя.
д. Знание свойств необходимо, что бы
применять их с пользой для себя.
На доске выстраивается схема.
Состав ->строение ->свойства ->применение.
III. Изучение новой темы.
1. Понятие о чистом веществе и смеси.
Вопрос. Что же такое чистое вещество?
Учитель. Чистое вещество — это вещество, которое состоит из одинаковых молекул или из ионных атомных или металлических кристаллов, постоянный состав которых может быть отражён с помощью единственной формулы.
Только изучение веществ в чистом виде даёт
представление об их истинных физических и
химических свойствах, а следовательно, позволяет
правильно использовать вещества. Вместе с тем,
понятие «чистое вещество» условно, так как
невозможно получить абсолютно чистое вещество,
оно всё равно содержит примеси других веществ.
Поэтому чистым веществом считается такое
вещество, в котором примеси не влияют на его
физические и химические свойства.
Запись. Чистым веществом называют вещество, обладающее постоянными физическими свойствами.
Беседа. 1. Что такое смеси?
Приведите примеры смесей.
Какие способы разделения смесей вам известны? На знании каких свойств они основаны?
Учитель. Смеси — это системы состоящие из нескольких веществ — компонентов. Различные образцы смесей могут содержать одни и те же компоненты в любых соотношениях. Находясь в смеси с другими веществами, каждое из них сохраняет свои индивидуальные свойства, так что свойства смеси определяются суммой свойств её составных частей.
Демонстрация опыта. Разделение смеси растительного масла с водой с помощью делительной воронки.
Вопрос. Какие различия в физических свойствах веществ легли в основу данного способа разделения смеси? (различная плотность)
Учитель.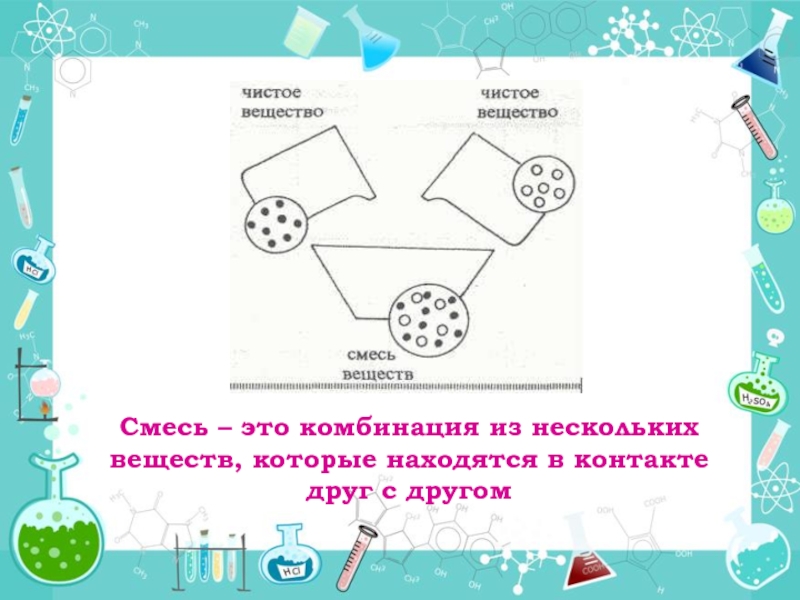 Смеси могут быть однородными и
неоднородными. Однородными называют такие смеси,
в которых даже с помощью микроскопа нельзя
обнаружить частицы веществ, образующих смесь.
Растворы, смеси газов и некоторые твёрдые смеси
являются однородными.
Смеси могут быть однородными и
неоднородными. Однородными называют такие смеси,
в которых даже с помощью микроскопа нельзя
обнаружить частицы веществ, образующих смесь.
Растворы, смеси газов и некоторые твёрдые смеси
являются однородными.
Неоднородные смеси — это смеси, в которых невооружённым глазом или с помощью микроскопа можно заметить частицы веществ, составляющих смесь. Это мутная вода, бетонный раствор.
Задание. Приведите примеры однородных и неоднородных смесей.
2. Самостоятельная работа (групповая).
Цель: уметь различать чистое вещество и смесь, выработать умение находить рациональные способы разделения смесей, проводить простейший химический эксперимент.
Задания для 1-го варианта
1. Выполните одно из предложенных заданий.
Выпишите в две колонки: а) смеси, б) чистые вещества.
Лёд, медь, туман, стекло, сода.
Назовите компоненты смеси: воздух
Выпишите в две колонки: а) однородные, б) неоднородные смеси.
Дым, речная вода, чугун, глина.
2. Назовите способ разделения смеси, необходимой для выделения:
Соли из раствора поваренной соли в воде
Меди из смеси меди и древесных опилок
Бензина и нефти
3. Осуществите разделение смеси древесных, медных и железных опилок.
Составьте отчёт о проделанной работе в виде таблицы.
| Смесь | Компоненты смеси | Способ выделения | Физические свойства, лежащие в основе выделения |
Задания для II варианта.
1.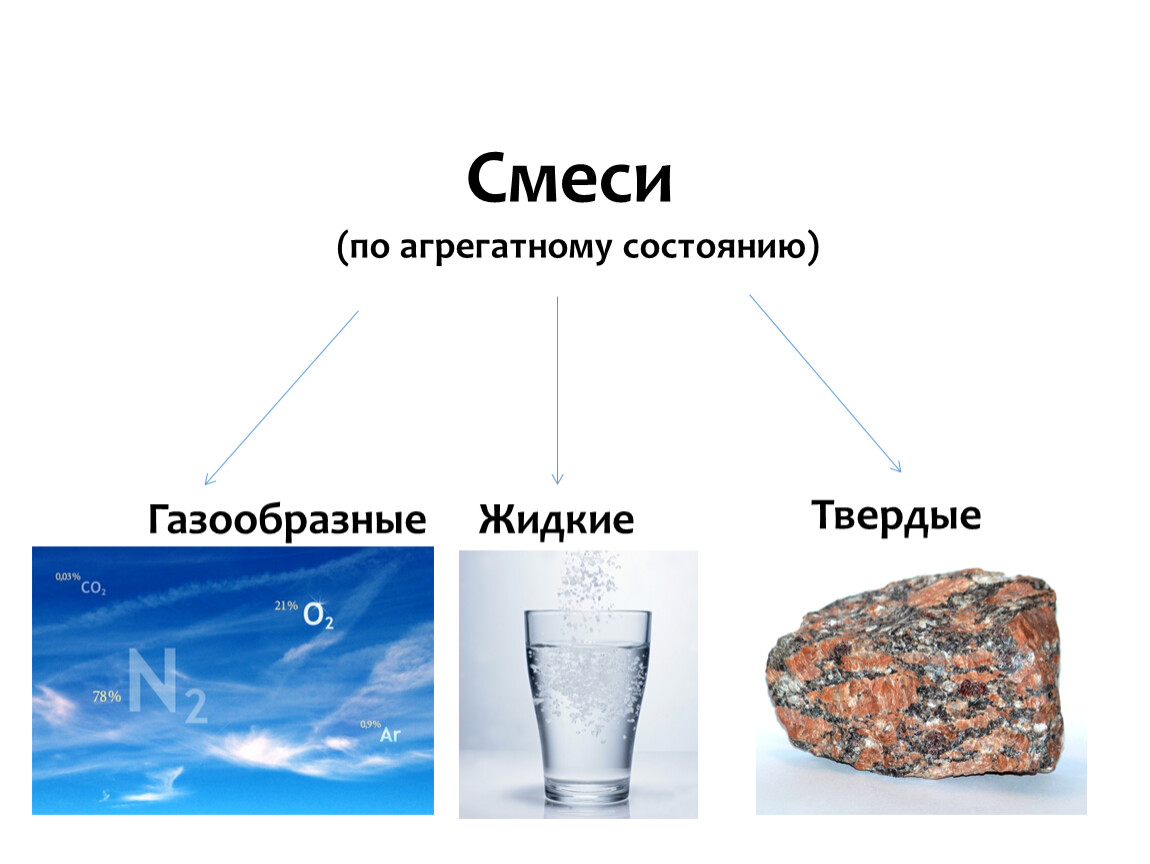 Выполните одно из предложенных заданий
Выполните одно из предложенных заданий
Выпишите в две колонки: а) смеси, б) чистые вещества.
Чугун, дым, железо, кислород, чернила.
Назовите компоненты смеси: молоко.
Выпишите в две колонки: а) однородные, б) неоднородные смеси.
Туман, молоко, нефть, природный газ.
2. Назовите способ разделения смеси, необходимый для выделения:
Глины из смеси глины с водой.
Мела из смеси мела и поваренной соли.
Кислорода из воздуха.
3. Осуществите разделение смеси песка и подкрашенной воды. Составьте отчёт о работе в виде таблицы.
| Смесь | Компоненты смеси | Способ выделения | Физические свойства, лежащие в основе выделения |
Задание III-го варианта.
1. Выполните одно из предложенных заданий.
Выпишите в две колонки: а) смеси, б) чистые вещества. Алюминий, воздух, сталь, золото, чернила.
Назовите компоненты смеси туман
Выпишите в две колонки: а) однородные, б) неоднородные смеси.
Чернила, воздух, строительный раствор, глина.
2.. Назовите способ разделения смеси, необходимый для выделения:
Речного песка из смеси речного песка с водой.
Минеральных солей из почвы.
Воды из смеси воды и машинного масла.
3. Осуществите разделение смеси железных и древесных опилок из песка. Составьте отчёт в виде таблицы.
| Смесь | Компоненты смеси | Способ выделения | Физические свойства, лежащие в основе выделения |
(После обсуждения результатов самостоятельной работы, составляется обобщающая схема)
3. Значение смесей в жизни человека. Сообщения
учащихся.
Значение смесей в жизни человека. Сообщения
учащихся.
Выводы: (формулируют учащиеся).
Чистые вещества — это вещества с постоянными физическими свойствами.
Различные образцы смесей могут содержать одни и те же компоненты в любых соотношениях, но свойства этих компонентов не зависят от состава смеси.
Смеси могут быть разделены на компоненты физическими способами.
IV. Домашнее задание.
Параграфы 23, 25, рабочая тетрадь № б с. 72
V. Закрепление рабочая тетрадь № 2 с. 72
Приложение.
Чистые вещества в химии: определение, свойства и примеры — Видео и расшифровка урока
Чистые вещества: понятие и свойства
Представьте себе кубик сахара, который вы можете добавить в чашку горячего кофе или чая. Если вы посмотрите на коробку с кубиками сахара, вы можете увидеть на этикетке слова «чистый тростниковый сахар». Означает ли слово «чистый» одно и то же во всех случаях и что означает это слово в контексте химии?
Чистое вещество в химии представляет собой очень простую для понимания концепцию. Чистые вещества определяются как вещества, состоящие только из одного типа атома или только одного типа молекулы (группы атомов, связанных вместе). Мера чистоты вещества известна как чистота . Например, чистое железо будет содержать только атомы железа, и, как и упомянутый выше кубик сахара, чистый сахар будет содержать только молекулы вещества, называемого сахарозой.
Чистые вещества определяются как вещества, состоящие только из одного типа атома или только одного типа молекулы (группы атомов, связанных вместе). Мера чистоты вещества известна как чистота . Например, чистое железо будет содержать только атомы железа, и, как и упомянутый выше кубик сахара, чистый сахар будет содержать только молекулы вещества, называемого сахарозой.
Чистые вещества обладают четко определенными физическими свойствами или свойствами, не связанными со способностью вещества соединяться с различными веществами.Температуры, при которых плавятся чистые твердые вещества, известные как точек плавления , особенно резки, что означает, что плавление происходит при одной температуре. Точно так же температуры, при которых чистые жидкости начинают кипеть, или 90 007 точек кипения 90 008 , возникают при одной температуре, когда контролируются другие факторы, такие как давление воздуха. Способность веществ проводить электричество, или проводимость , сильно зависит от чистоты. Например, медь, используемая в электропроводке, должна иметь очень высокую чистоту, чтобы обеспечить наиболее эффективную проводимость.С другой стороны, чрезвычайно чистая жидкая вода является очень плохим проводником электричества, потому что в ней нет растворенных электрических проводников, называемых электролитами, которые обеспечивают проводимость.
Например, медь, используемая в электропроводке, должна иметь очень высокую чистоту, чтобы обеспечить наиболее эффективную проводимость.С другой стороны, чрезвычайно чистая жидкая вода является очень плохим проводником электричества, потому что в ней нет растворенных электрических проводников, называемых электролитами, которые обеспечивают проводимость.
Чистота также может иметь важное влияние на химические свойства вещества. Чистые вещества могут образовывать предсказуемые продукты химических реакций. Причина такой надежности заключается в отсутствии примесей, которые могли бы инициировать другие реакции, способные помешать реакции, изучаемой химиком.Поэтому химики часто используют вещества высокой чистоты при проведении химических исследований.
3.5: Чистые вещества и смеси
Цель обучения
- Различать чистые вещества и смеси
- Идентифицировать смеси как гомогенные или гетерогенные
Чистые вещества
Когда мы говорим о чистом веществе , мы говорим о чем-то, что содержит только один вид материи. Это может быть либо один-единственный элемент, либо одно-единственное соединение, но каждый образец этого вещества, который вы исследуете, должен содержать точно такое же вещество с фиксированным, определенным набором свойств.
Это может быть либо один-единственный элемент, либо одно-единственное соединение, но каждый образец этого вещества, который вы исследуете, должен содержать точно такое же вещество с фиксированным, определенным набором свойств.
| Чистое вещество | Элемент или соединение? | Состоит из: |
|---|---|---|
| Свинец (Pb) | элемент | атомов свинца |
| Газообразный кислород (O 2 ) | элемент | молекул кислорода* |
| Вода (H 2 O) | компаунд | молекул воды |
| Аммиак (NH 3 ) | компаунд | молекул аммиака |
*Примечание: чистый газообразный кислород состоит из молекул, но он по-прежнему считается элементом, а не соединением, поскольку молекулы состоят из одного типа элемента. Соединения состоят из одного или нескольких элементов.
Соединения состоят из одного или нескольких элементов.
Смеси
Если мы возьмем два или более чистых вещества и смешаем их вместе, мы будем называть это смесью . Смеси всегда можно снова разделить на составные чистые вещества, потому что связи между атомами составляющих веществ в смеси не происходит. В то время как соединение может иметь свойства, сильно отличающиеся от составляющих его элементов, в смесях вещества сохраняют свои индивидуальные свойства.Например, натрий — мягкий блестящий металл, а хлор — едкий зеленый газ. Эти два элемента могут объединяться, образуя соединение, хлорид натрия (поваренная соль), которое представляет собой белое кристаллическое твердое вещество, имеющее , но не свойств натрия или хлора. Если же вы смешали поваренную соль с молотым перцем, то все равно смогли бы увидеть отдельные крупинки каждого из них и, если бы вы были терпеливы, вы могли бы взять пинцет и осторожно разделить их обратно на чистую соль и чистый перец .
Гетерогенная смесь
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп представляет собой неоднородную смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Гомогенная смесь/ Раствор
Однородная смесь представляет собой комбинацию двух или более веществ, которые настолько тесно перемешаны, что смесь ведет себя как единое вещество.Другое название однородной смеси — раствор. Таким образом, сочетание соли и стальной ваты представляет собой неоднородную смесь, поскольку легко увидеть, какие частицы вещества представляют собой кристаллы соли, а какие — стальную вату. С другой стороны, если вы возьмете кристаллы соли и растворите их в воде, очень трудно сказать, что у вас присутствует более одного вещества, просто взглянув, даже если вы используете мощный микроскоп. Соль, растворенная в воде, представляет собой однородную смесь или раствор (рис. \(\PageIndex{3}\)).
\(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Типы смесей © Thinkstock Слева комбинация двух веществ представляет собой гетерогенную смесь, поскольку частицы двух компонентов выглядят по-разному. Справа кристаллы соли растворились в воде так мелко, что нельзя сказать, присутствует ли соль. Однородная смесь выглядит как единое вещество.
Пример \(\PageIndex{3}\)
Идентифицируйте следующие комбинации как гетерогенные смеси или гомогенные смеси.
- газированная вода (Углекислый газ растворяется в воде.)
- смесь металлических опилок железа и порошка серы (и железо, и сера являются элементами.)
Рисунок \(\PageIndex{4}\): Смесь железных опилок и порошка серы ( Асульт, смесь Fe-S 03, CC BY 4.0)
Раствор
- Поскольку двуокись углерода растворена в воде, по поведению кристаллов соли, растворенных в воде, мы можем заключить, что растворенная в воде двуокись углерода (также) представляет собой гомогенную смесь.

- Если предположить, что железо и сера просто смешаны вместе, должно быть легко увидеть, что такое железо и что такое сера, так что это гетерогенная смесь.
Упражнение \(\PageIndex{3}\)
Являются ли следующие комбинации гомогенными смесями или гетерогенными смесями?
- тело человека
- амальгама, соединение некоторых других металлов, растворенных в небольшом количестве ртути
Ответы
- гетерогенная смесь
- гомогенная смесь
Категоризация вопроса
Рисунок \(\PageIndex{1}\): Взаимосвязь между типами веществ и методами разделения смесей Обычная поваренная соль называется хлоридом натрия.Он считается веществом , потому что имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода также является чистым веществом. Соль легко растворяется в воде, но соленую воду нельзя отнести к веществу, так как ее состав может быть разным.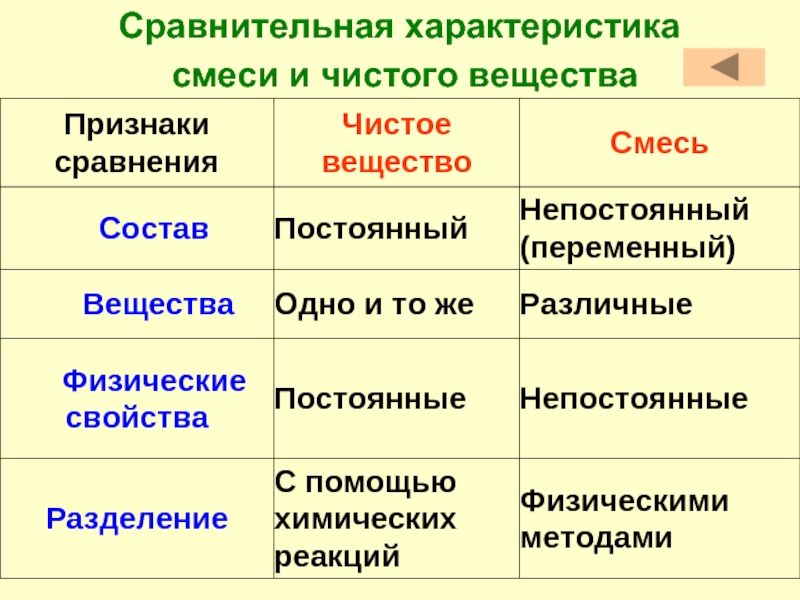 Вы можете растворить небольшое количество соли или большое количество в заданном количестве воды. Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою идентичность и свойства в смеси .Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Вы можете растворить небольшое количество соли или большое количество в заданном количестве воды. Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою идентичность и свойства в смеси .Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Фаза
Фаза – это любая часть образца, имеющая однородный состав и свойства. По определению чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя. Каждый из слоев называется фазой.
Пример \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок, содержащий атомы алюминия и кислорода в соотношении 2:3
- селен
Дано : химическое вещество
Запрашиваемый : его классификация
Стратегия:
- Определите, является ли вещество химически чистым.
 Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением.
Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением. - Если вещество не является химически чистым, оно представляет собой либо гетерогенную смесь, либо гомогенную смесь. Если его состав везде однороден, то это однородная смесь.
Решение:
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрованием.
B) Поскольку состав раствора везде однороден, это однородная смесь . - A) Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым.
B) Поскольку его состав не везде однороден, апельсиновый сок представляет собой гетерогенную смесь . - A) Компакт-диск представляет собой твердый материал, содержащий более одного элемента, по краям которого видны области разного состава.
 Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой неоднородную смесь. - A) Оксид алюминия представляет собой отдельное химически чистое соединение .
- А) Селен является одним из известных элементов .
Упражнение \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- заправка для салата «ранчо»
- сахар столовый (сахароза)
- Ответ а:
- гомогенная смесь (раствор)
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ д:
- компаунд
Пример \(\PageIndex{2}\)
Как бы химик классифицировал каждый пример материи?
- морская вода
- почва
- вода
- кислород
РАСТВОР
- Соленая вода действует так, как если бы она была одним веществом, даже если она содержит два вещества — соль и воду.
 Соленая вода представляет собой однородную смесь или раствор.
Соленая вода представляет собой однородную смесь или раствор. - Почва состоит из мелких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество; более конкретно, поскольку вода состоит из водорода и кислорода, она является соединением.
- Кислород, вещество, является элементом.
Упражнение \(\PageIndex{2}\)
Как бы химик классифицировал каждый пример материи?
- кофе
- водород
- яйцо
- Ответ а:
- однородная смесь (раствор), допустим, это фильтрованный кофе
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь.
Резюме
Вещество можно разделить на две широкие категории: чистые вещества и смеси. Чистое вещество – это форма материи, которая имеет постоянный состав и свойства, постоянные во всем образце. Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов.Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов.Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Ключевые выводы
- Чистые вещества состоят из одного элемента или соединений.
- Комбинации различных веществ называются смесями.
- Гомогенные смеси — это смеси двух или более соединений (или элементов), не визуально отличимых друг от друга.
- Гетерогенные смеси представляют собой смеси двух или более соединений (или элементов), которые визуально отличимы друг от друга.
Чистые вещества — BBC Bitesize
Мисс Фонг: Сегодня мы рассмотрим чистые и нечистые вещества и то, как мы можем проверить их чистоту.
Во-первых, давайте рассмотрим основы. Чистое вещество состоит только из одного соединения или только из одного элемента без каких-либо примесей других веществ. Подними эти два стакана, Кэти. Представьте, что помпоны представляют собой отдельные химические атомы внутри вещества. В каждом стакане находятся помпоны одного цвета.Таким образом, вещества будут классифицироваться как чистые.
Кэти: И нечистый — это когда они смешаны.
Мисс Фонг: Верно. Нечистое вещество — это вещество, которое содержит смесь элементов, смесь соединений или смесь обоих элементов и соединений.
Кэти: О-о-о, это весело. Кажется, я начинаю понимать. Но прежде чем мы двинемся дальше, давайте посмотрим на эту удобную инфографику о чистых и нечистых веществах.
ГОЛОС ЗА КАДРОМ: Чистые и нечистые вещества.
Слово «чистый» в повседневной жизни не имеет такого же значения в науке.
Например, чистый апельсиновый сок представляет собой смесь соединений, а вода в бутылках все еще содержит примеси. В науке слово «чистый» означает вещество, состоящее из одного элемента или всего лишь одного соединения. Помните, что соединение состоит из двух или более элементов, которые химически связаны друг с другом.
В науке слово «чистый» означает вещество, состоящее из одного элемента или всего лишь одного соединения. Помните, что соединение состоит из двух или более элементов, которые химически связаны друг с другом.
Большинство веществ содержат примеси. Но если частицы в этих смесях не связаны химически, их обычно можно разделить с помощью физического процесса.Примеси также могут изменять свойства веществ. Зимой пескоразбрасыватели разбрызгивают на дороги соленый песок. Это связано с тем, что соль снижает температуру замерзания воды, поэтому она должна стать даже ниже нуля градусов по Цельсию, прежде чем превратиться в лед. Брр!
Кэти: Итак, мисс Фонг, у меня к вам вопрос. У меня в холодильнике есть упаковка апельсинового сока, на которой написано «чисто», так что производители немного искажают правду?
Мисс Фонг: Нет, не совсем так.Производители используют слово «чистый» в его повседневном значении, которое говорит вам о том, что в апельсиновый сок ничего не добавлялось. Мы знаем, что с химической точки зрения натуральный апельсиновый сок представляет собой смесь воды, сахара, витаминов и других веществ.
Мы знаем, что с химической точки зрения натуральный апельсиновый сок представляет собой смесь воды, сахара, витаминов и других веществ.
Кэти: Итак, технически мой сок химически нечист?
Мисс Фонг: Да. Он содержит смесь элементов и соединений. Сейчас я собираюсь проверить вас по некоторым другим предметам. Скажи мне, если ты считаешь их чистыми или нечистыми.
Кэти: Хорошо, поехали. И дома тоже можно поиграть.
Мисс Фонг: ОК. Во-первых, воздух, которым мы дышим.
Кэти: О, конечно, воздух, которым мы дышим, нечист, потому что это больше, чем один газ.
Мисс Фонг: Верно. Воздух, которым мы дышим, содержит различные элементы и соединения, такие как азот, кислород, аргон, углекислый газ, а также следовые количества других веществ, таких как метан и оксиды азота.Далее гелий, как в этих воздушных шарах.
Кэти: Хм, я бы сказала, что это чисто, потому что это один элемент.
Мисс Фонг: Ты совершенно права, Кэти. Гелий — это газ, состоящий из одного элемента. Последнее, соль.
Кэти: О, соль. Я чувствую, что хочу сказать, что это нечисто, потому что соль должна быть смесью разных веществ.
Мисс Фонг: Нет, соль на самом деле чистая.
Кэти: Ах.
Мисс Фонг: Он содержит только одно соединение, что-то под названием хлорид натрия. Поскольку два элемента натрий и хлор химически связаны друг с другом. Они производят соединение, называемое хлоридом натрия, и, поскольку это единственное вещество в соли, соль является чистой.
Кэти: Это очаровательно, мисс Фонг. Спасибо. Я больше не буду смотреть на соль так же, как в следующий раз, когда буду посыпать ею рыбу с жареным картофелем.
Мисс Фонг: Прилипая к соли, я хочу показать вам еще кое-что увлекательное.Помните, ранее я говорил, что мы можем проверить чистоту? Мы можем сделать это с помощью обычной поваренной соли.
Кэти: Который чудесным образом теперь у меня в руке.
Мисс Фонг: У вас также есть две кастрюли, каждая из которых наполнена одним литром дистиллированной воды.
Кэти: Хорошо, если это дистиллированная вода, значит ли это, что она чистая?
Мисс Фонг: Абсолютно. Если бы вы могли насыпать 60 граммов соли только в одну из кастрюль.
Кэти: ОК.
Мисс Фонг: В лаборатории вы должны поставить обе кастрюли на источник тепла и наблюдать за ними, чтобы увидеть, когда вода достигнет точки кипения. Это не то, что можно попробовать дома. У нас есть изображения на экране. Что ты заметил?
Кэти: О, хорошо. Итак, есть разница. Дистиллированная вода кипит при 100 градусах Цельсия, а температура соленой воды выше, около 102 градусов Цельсия.Почему эта разница?
Мисс Фонг: Ну, добавление соли в воду делает воду нечистой, поэтому для кипячения соленой воды требуется больше времени, и температура кипения также выше.
Кэти: Вау, это увлекательно. Большое спасибо, мисс Фонг.
Чистые вещества – Анализ и идентификация веществ – AQA – GCSE Chemistry (Single Science) Revision – AQA
Значение слова «чистый»
Слово «чистый» используется в химии не так, как его повседневное значение.Например, в магазинах продаются упаковки с надписью «чистый» апельсиновый сок. Этикетка означает, что содержимое представляет собой просто апельсиновый сок, без добавления каких-либо других веществ. Однако сок не является чистым в химическом смысле, потому что он содержит различные вещества, смешанные вместе. В химии:
- чистое вещество состоит только из одного элемента или одного соединения
- смесь состоит из двух или более различных веществ, не связанных между собой химически
- элемент содержит только один тип атома
- соединение содержит два или более типа атома, соединенных вместе
- смесь содержит два или более различных вещества, которые не соединены вместе
- различные вещества в смеси могут быть элементами или соединениями
В таблице приведены некоторые примеры:
Обратите внимание, что различные вещества в смеси могут быть отдельными атомами, молекулами элементов или молекулами соединенийРазличие между чистыми веществами и смесями
0.0.0.1:0.1.0.$0.$3.$1″> Чистые вещества имеют резкое плавление точка, но смеси плавятся в диапазоне температур.Эту разницу легче всего увидеть, когда измеряют температуру жидкости при ее охлаждении и замерзании. На графике показана кривая охлаждения для образца соединения под названием салол. Температура остается неизменной при изменении состояния чистого веществаГоризонтальная часть графика показывает, что салол имеет резкую температуру плавления, поэтому он чистый. Нечистый салол (смесь салола и других веществ) будет вызывать постепенное падение температуры по мере замерзания.
Температура слегка изменяется по мере изменения состояния нечистого вещества.- Вопрос
Учащийся измеряет температуру плавления образца серы.
 Он начинает плавиться при 95-101°С, но полностью не плавится до температуры 113°С. Согласно справочнику, температура плавления серы составляет 115°С. Этот образец серы чистый или нечистый?
Он начинает плавиться при 95-101°С, но полностью не плавится до температуры 113°С. Согласно справочнику, температура плавления серы составляет 115°С. Этот образец серы чистый или нечистый?- Укажите ответ
Он нечист, потому что плавится в диапазоне температур, а температура плавления не совпадает со «стандартной» эталонной точкой плавления серы.
Примеры чистых веществ
Чистые вещества Чистое вещество – это любой материал одного типа, состоящий только из одного типа атомов или только одного типа молекул.Кроме того, чистое вещество может быть определено как любой отдельный тип материала, который не был загрязнен другим веществом. В химии чистое вещество имеет определенный состав. Это может быть соединение или отдельный элемент. Элемент — это чистое вещество, которое нельзя разделить на более простые химическими или физическими средствами. Существует около 117 элементов, но углерод, водород, азот и кислород — лишь немногие, составляющие большую часть Земли. Материал перестает быть чистым веществом, если он был смешан с другим чистым веществом.Два чистых вещества, смешанные вместе, называются смесью. Ученые часто используют фильтрацию для отделения чистых веществ от смеси с целью анализа материалов.
Существует около 117 элементов, но углерод, водород, азот и кислород — лишь немногие, составляющие большую часть Земли. Материал перестает быть чистым веществом, если он был смешан с другим чистым веществом.Два чистых вещества, смешанные вместе, называются смесью. Ученые часто используют фильтрацию для отделения чистых веществ от смеси с целью анализа материалов.
Химическое вещество может быть твердым, жидким, газообразным или плазменным. Чистые вещества часто называют чистыми, чтобы отличить их от смесей. Вещество может быть любым. Он не обязательно должен состоять из одного элемента или типа молекулы. Чистый водород — это чистое вещество. То же самое и с чистым медом, хотя он состоит из множества различных типов молекул.Что делает оба этих материала чистыми веществами, так это то, что они не содержат загрязнений. Если к водороду добавить немного кислорода, то полученный газ не будет ни чистым водородом, ни чистым кислородом. Если вы добавите в мед кукурузный сироп, у вас больше не будет чистого меда. Чистый спирт может быть этанолом, метанолом или смесью различных спиртов, но как только вы добавите воду, которая не является спиртом, у вас больше не будет чистого вещества.
Чистый спирт может быть этанолом, метанолом или смесью различных спиртов, но как только вы добавите воду, которая не является спиртом, у вас больше не будет чистого вещества.
Большинство чистых веществ, с которыми вы сталкиваетесь в повседневной жизни, были очищены людьми путем очистки.
Примеры чистых веществ:
1. Золото
У него один и тот же состав, откуда бы он ни исходил. Золото состоит из атомов золота. К золоту не добавляются никакие другие элементы или соединения.
2. Алмазы
Они образуются глубоко внутри Земли лишь в очень немногих областях. Все частицы в алмазе одинаковы.
3. Вода
Считается чистым веществом, если вода содержит только водород и кислород. Чистую воду трудно найти в природе.Даже самая чистая родниковая вода содержит растворенные минералы. В природе чистые вещества имеют тенденцию смешиваться с другими веществами
4. Пищевая сода
Несмотря на множество применений пищевой соды, в самой простой форме она не загрязнена никакими другими химическими соединениями.
5. Соль поваренная
Один из самых распространенных средств бытовой химии. Поваренная соль содержит от 97% до 99% хлорида натрия. Чистый хлорид натрия представляет собой твердое ионное кристаллическое вещество.
АтомыИонная и металлическая связь
Факты о соединениях
Примеры углеводородов
Факты о смесях
Викторина о свойствах воды
Факты о молях
Формула карбида кремния — Использование карбида кремния, свойства …
Факты о радии
Формула моляльности
Примеры чистых веществ
Странная наука: чистая вода и водные смеси
Морская вода представляет собой смесь множества различных веществ. Некоторые из этих веществ можно наблюдать, когда вода в морской воде испаряется и оставляет после себя соль. Вода, H 2 O, представляет собой чистое вещество, соединение водорода и кислорода. Хотя вода является самым распространенным веществом на Земле, она редко встречается в природе в чистом виде. Большую часть времени необходимо создать чистую воду. Чистая вода называется дистиллированной водой или деионизированной водой. В дистиллированной воде все растворенные в воде вещества удалены выпариванием. Когда вода испаряется, она дистиллируется или оставляет соль. Чистая испаренная вода собирается и конденсируется для получения дистиллированной воды.
Большую часть времени необходимо создать чистую воду. Чистая вода называется дистиллированной водой или деионизированной водой. В дистиллированной воде все растворенные в воде вещества удалены выпариванием. Когда вода испаряется, она дистиллируется или оставляет соль. Чистая испаренная вода собирается и конденсируется для получения дистиллированной воды.
Водопроводная вода не дистиллированная (SF рис. 2.9 А). Большая часть воды из водопровода содержит хлор. Хлор используется для уничтожения микробов в воде.В общественной водопроводной воде могут быть преднамеренно растворены и другие минералы, например, фторид, предотвращающий кариес. В некоторых районах водопроводная вода поступает прямо из колодцев и не подвергается очистке. Минеральный состав колодезной воды варьируется от места к месту и придает воде из разных местностей свой характерный вкус (СФ рис. 2.9 Б).
Многие люди покупают или производят дистиллированную воду самостоятельно. В районах, где вода загрязнена вредными веществами из-за природной среды или стихийного бедствия, употребление дистиллированной воды может сохранить здоровье людей.Если людям не нравится вкус воды в каком-либо районе из-за растворенных минералов, которые придают ей характерный вкус, они могут предпочесть более нейтральный вкус дистиллированной воды.
В районах, где вода загрязнена вредными веществами из-за природной среды или стихийного бедствия, употребление дистиллированной воды может сохранить здоровье людей.Если людям не нравится вкус воды в каком-либо районе из-за растворенных минералов, которые придают ей характерный вкус, они могут предпочесть более нейтральный вкус дистиллированной воды.
Дистиллированная вода может быть полезна для людей, но у них может быть слишком много хорошего. Возможно гипергидратация или слишком много воды в организме. Хотя человеческий организм в основном состоит из воды, важно поддерживать правильный баланс воды и других веществ.Когда спортсмены потеют, они теряют и воду, и соль (рис. 2.10 А). Если спортсмен пьет слишком много дистиллированной или водопроводной воды после сильного потоотделения, он может нарушить баланс воды и солей в своем организме. Это влияет на способность их органов функционировать должным образом. В редких случаях, если спортсмен выпил слишком много дистиллированной или водопроводной воды, водно-солевой дисбаланс слишком велик, и спортсмен может умереть. Именно по этой причине серьезные спортсмены пьют спортивные напитки, в которых сбалансировано содержание воды, солей и сахаров, чтобы поддерживать надлежащую гидратацию (SF Fig.2.10 Б). Большинство людей могут получить надлежащий баланс воды и солей с помощью обычной диеты, и им не нужно пить спортивные напитки.
Именно по этой причине серьезные спортсмены пьют спортивные напитки, в которых сбалансировано содержание воды, солей и сахаров, чтобы поддерживать надлежащую гидратацию (SF Fig.2.10 Б). Большинство людей могут получить надлежащий баланс воды и солей с помощью обычной диеты, и им не нужно пить спортивные напитки.
Что означают химические слова? Изучение ключевых терминов | 14-16 лет | План урока
Работая с рядом утверждений, учащиеся поясняют свои идеи о некоторых ключевых терминах, относящихся к химии и химическим процессам.
Этот ресурс исследует следующие заблуждения:
- Вещество не может быть газом или смесью.
- Чистое вещество – это то, что встречается в природе.
- Элемент состоит только из атомов одного типа и не может быть разделен дальше.
- Соединение обладает комбинированными свойствами элементов, из которых оно сделано.
- Атомы показывают макросвойства элемента.
- Молекулы всегда образуются при соединении атомов.

- Молекула всегда содержит разные виды атомов.
Цели обучения
Студенты смогут:
- Понимать использование основных терминов: вещество, чистое вещество, элемент, соединение, атом, молекула.
Последовательность действий
Введение
Спроецируйте или покажите изображение женской поп-группы Atomic Kitten и спросите учащихся, что означает слово «атомный».
Объясните, что:
- Они собираются прокомментировать подборку определений ряда основных химических слов.
- Их правильное понимание этих терминов является целью обучения.
Действие: этап 1
Раздайте рабочий лист каждому учащемуся.Попросите их работать индивидуально по номеру:
.- Посмотрите на двенадцать вопросов в рабочем листе.
- Для каждого вопроса поставьте галочку в одном из трех полей.
- Объясните причины своего выбора.
Используйте карточки «светофор» или «большой палец вверх», чтобы получить мнение класса о каждом из определений:
- Зеленый, если они считают утверждение правильным.

- Красный, если они считают, что это неправильно.
- Желтый, если они не уверены.
Деятельность: этап 2
Не комментируя ответы, соберите учащихся в группы по четыре человека. Распространяйте и поддерживайте пока они:
- Сравните их ответы.
- Обсудите любые альтернативные ответы или сомнения в группе.
- Разделите роль представителя группы (каждый учащийся отвечает на три вопроса).
Пленарное заседание
Организовать пленарное заседание. Спросите:
- Представители различных групп, чтобы прокомментировать определения.
- Другие группы, чтобы добавить к этим комментариям.
- Дополнительные вопросы, если необходимо, для уточнения затронутых вопросов.
Перед отделкой
Дайте учащимся время дополнить свой рабочий лист в свете того, что они услышали.
Обратная связь
Возьмите рабочие листы учащихся и прокомментируйте идеи, которые были ясно и точно выражены. Определите, где учащиеся должны развивать свои идеи дальше.
Определите, где учащиеся должны развивать свои идеи дальше.
Комментарий
Знакомый образ в необычном контексте оживляет объяснение целей обучения и стимулирует мышление.
Обмениваясь идеями в группах, учащиеся формулируют свои идеи и уточняют свое понимание. Это мягко способствует самооценке.
Степень оставшегося заблуждения можно оценить и устранить на пленарном заседании, но здесь важно качество вопросов.
Индивидуальное размышление учащихся – это отдельное задание в конце занятия. Позже это подтверждается комментариями учителя, подтверждающими прогресс и помогающими в следующих шагах.
Оборудование
- Набор светофорных карточек
- Изображение группы Atomic Kitten
Пояснения
Цель занятия – побудить учащихся задуматься над данными определениями.Какое поле они отмечают, гораздо менее важно, чем их причины.
Вопросы 1 и 2 исследуют «вещество». Вопросы выявляют учащихся, которые не думают, что этот термин описывает газы или смеси.
Вопросы 3 и 4 касаются «чистоты» в химическом контексте. Вопросы выявляют учащихся, которые, например, считают, что каменная соль является чистой, потому что она встречается в природе, но думают, что полученный из нее хлорид натрия не является чистым, потому что он подвергся химической обработке.
Вопросы 5 и 6 исследуют «элемент».Вопрос 5 должен вызвать дискуссию об изотопах. Вопрос 6 может вызвать дискуссию об электронах, протонах и нейтронах.
Вопросы 7 и 8 зонда «составной». Вопрос 7 должен подчеркнуть идею о том, что соединения могут состоять из атомов двух или более элементов. Вопрос 8 проверяет понимание того, что соединение имеет свои собственные свойства, которые могут отличаться от свойств составляющих его элементов.
Вопросы 9 и 10 исследуют «атомы». Вопрос 9 проверяет, понимают ли учащиеся, что в некоторых случаях в химических реакциях участвуют не атомы, а молекулы элементов.Вопрос 10 фокусируется на особенно сложной для многих учащихся концепции, заключающейся в том, что макросвойства элементов могут не проявляться отдельными атомами, например, блеск, твердость или цвет.
Вопросы 11 и 12 исследуют «молекулы». Вопрос 11 поднимает вопросы об образовании ионов, а не молекул, и идею о том, что молекулы могут содержать более двух атомов. Вопрос 12 проверяет, понимают ли учащиеся, что атомы одного и того же элемента также могут образовывать молекулы.
Ответы
- Вещество — это название, описывающее твердые и жидкие вещества, но не газы.
- Неправильно. Слово «вещество» может использоваться для обозначения газов, а также твердых и жидких тел.
- Вещество — это название для описания элементов и соединений, но не смесей.
- Неправильно. Многие часто встречающиеся вещества являются смесями.
- Чистое вещество — это название, описывающее то, что встречается в природе. Он никак не подвергался химической обработке.
- Неправильно. Чистота вещества относится к его составу, а не к тому, как оно было найдено или было ли оно обработано.
- Чистое вещество — это название для описания того, что состоит из одного вида вещества, а не из смеси двух или более веществ.

- Элемент состоит только из одного вида атомов.
- Правильно. Это определение не допускает изотопов.
- Элемент не может быть разделен на более простые вещества.
- Правильно. Это определение не учитывает субатомные частицы, такие как электроны, протоны или нейтроны.
- Соединение состоит из двух элементов, смешанных вместе.
- Неправильно. Соединение может состоять из более чем двух элементов, объединенных, но не смешанных вместе.
- Соединение обладает комбинированными свойствами элементов, из которых оно сделано.
- Неправильно. Соединение обладает собственным набором свойств, которые могут сильно отличаться от свойств элементов, из которых оно состоит.
- Атом – это наименьшая часть элемента, участвующая в химической реакции.
- Неправильно. В случае многих неметаллов молекула, а не атом, является частицей, которая участвует в химических реакциях.

- Неправильно. В случае многих неметаллов молекула, а не атом, является частицей, которая участвует в химических реакциях.
- Атом — это наименьшая частица элемента, которая все еще проявляет химические свойства элемента.
- Неправильно. Большинство химических свойств не проявляются отдельными атомами.
- Молекула — это то, что мы получаем, когда два атома соединяются вместе.
- Неправильно.Молекулы часто содержат более двух атомов.
- Молекула всегда содержит разные виды атомов.
- Неправильно. Возможны молекулы, содержащие одинаковые атомы.
Дополнительная информация
Первоначально этот план урока был частью веб-сайта Assessment for Learning , опубликованного в 2008 году.
Assessment for Learning — это эффективный способ активного вовлечения учащихся в процесс обучения.Каждый план занятия содержит предложения по организации занятий и рабочие листы, которые можно использовать со студентами.
Благодарности
В. Баркер, Beyond Appearances: Неправильные представления учащихся об основных химических идеях: отчет, подготовленный для Королевского химического общества, Лондон, Раздел 5.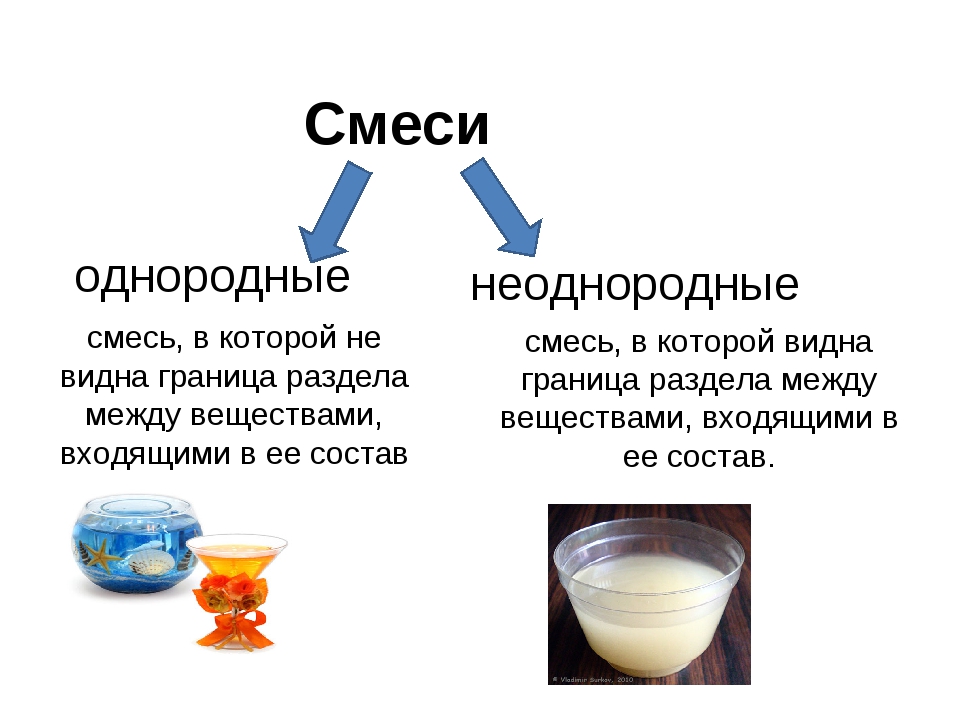
 Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.
Например, раствор сахара в воде содержит как молекулы воды, так и молекулы сахара.


 Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением.
Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением. Следовательно, компакт-диск не является химически чистым.
Следовательно, компакт-диск не является химически чистым.  Соленая вода представляет собой однородную смесь или раствор.
Соленая вода представляет собой однородную смесь или раствор. Он начинает плавиться при 95-101°С, но полностью не плавится до температуры 113°С. Согласно справочнику, температура плавления серы составляет 115°С. Этот образец серы чистый или нечистый?
Он начинает плавиться при 95-101°С, но полностью не плавится до температуры 113°С. Согласно справочнику, температура плавления серы составляет 115°С. Этот образец серы чистый или нечистый?