Урок по химии «Физические и химические явления. Химические реакции Л.О. примеры физических и химических явлений»»
Тема урока: Физические и химические явления. Химические реакции
Л.О. примеры физических и химических явлений.
Цель урока: охарактеризовать сущность физических и химических явлений; признаки и условия протекания химических реакций.
Задачи урока:
Образовательная: формировать умение наблюдать явления, узнавать их
делать выводы на основе наблюдений; формировать умение проводить эксперимент в целях бережного отношения к здоровью; формировать умение объяснять значение явлений в жизни природы и человека; способствовать усвоению понятий «физические явления», «химические явления», «признаки химических реакций», «условия протекания реакций»
Развивающая: развитие критического мышления учащихся, cамостоятельности и способности к рефлексии.
Тип урока: урок получения новых знаний.
Основные понятия: физические и химические явления, химическая реакция, условия
возникновения и протекания химической реакции.
Оборудование к уроку: интерактивная доска; компьютер
Ход урока.
1.Орг. момент
2. Изучение нового материала
2.1. Первый этап Активизация
№ 1кипение воды
№2
ржавление гвоздя
№ 3
плавление и охлаждение
парафина
№4
выделение газа
№5
извержение вулкана
№6
северное сияние
2 Пользуясь рисунками объясните , что объединяет все рисунки, по какой причине и почему? Какое явление? Дайте название каждому явлению. Какие вещества участвуют в представленных явлениях? Что происходит с каждым веществом в происходящем явлении?
Какие вещества участвуют в представленных явлениях? Что происходит с каждым веществом в происходящем явлении?
2 задание: «Составить мини-рассказ по картинкам
3 задание: сформулировать тему урока – учащиеся делают это самостоятельно.
2.2 Второй этап – Осмысление.
1 задание: формулировка цели урока учащимися.
Сказка «Один день Незнайки»
Незнайка решил, что он непременно должен быть полезен своим друзьям. Он проснулся к обеду, зажег газ и поставил чайник на плиту. А сам сел лепить из пластилина. Незнайка так увлеченно лепил маленьких человечков, что не заметил, как чайник закипел. Он все продолжал свое занятие, пока Шпунтик, сердито ворча, не убрал с плиты выкипевший чайник. Чай не получился. Незнайка задумал приготовить кашу. Для этого достал из холодильника молоко и поставил его на стол. Делать ему больше ничего не хотелось, и он развлекал себя тем, что доставал кубики льда из холодильника и катал их по кухонному столу.
Определите о каких явлениях идет речь?
Сколько явлений вы заметили?
Чем они различаются?
2 задание
Разделите эти явления на две группы и объясните, по какому признаку вы это сделали. (Происходит обсуждение вопроса, результат заносится в тетрадь).
Явления, при которых вещества не превращаются в другие, изменяется только их агрегатное состояние или форма. Примеры: кипение воды, плавление и охлаждение парафина, серное сияниеЯвления, при которых из данных веществ образуется одно или несколько новых веществ.
Примеры: ржавление гвоздя, выделение газа, извержение вулкана
Так как химия изучает химические явления, то нас интересуют именно они Химические явления называются химическими реакциями. Любая химическая реакция сопровождается изменениями, которые называются признаками химических реакций. Различают пять таких признаков.
Любая химическая реакция сопровождается изменениями, которые называются признаками химических реакций. Различают пять таких признаков.
3 задание
На примере конкретных химических реакций рассмотреть эти признаки (работа в группах с обсуждением) (напомнить правила ТБ при проведении опытов и результаты занести в тетрадь)
Лабораторные опыты
Инструкции к проведению лабораторных опытов
При выполнении опытов, заполните таблицу
Опыт 1. Кипение воды
Оборудование: спиртовка, держатель, пробирка, вода
1. В пробирку налить 3 мл воды.
2. Пробирку закрепить в держателе.
3. Поджечь спиртовку (соблюдая ТБ).
4. Над спиртовкой прогреть пробирку с водой по всей длине.
5. Аккуратно нагреть воду в пробирке до кипени
6. Какое явление вы наблюдаете? Почему?
Опыт 2. Ржавление гвоздя
Оборудование: ржавый гвоздь,
1. На нитку привязать ржавый гвоздь
2. Опустить в раствор серной кислоты (соблюдая правила ТБ)
3 Что наблюдаете?
Опыт 3.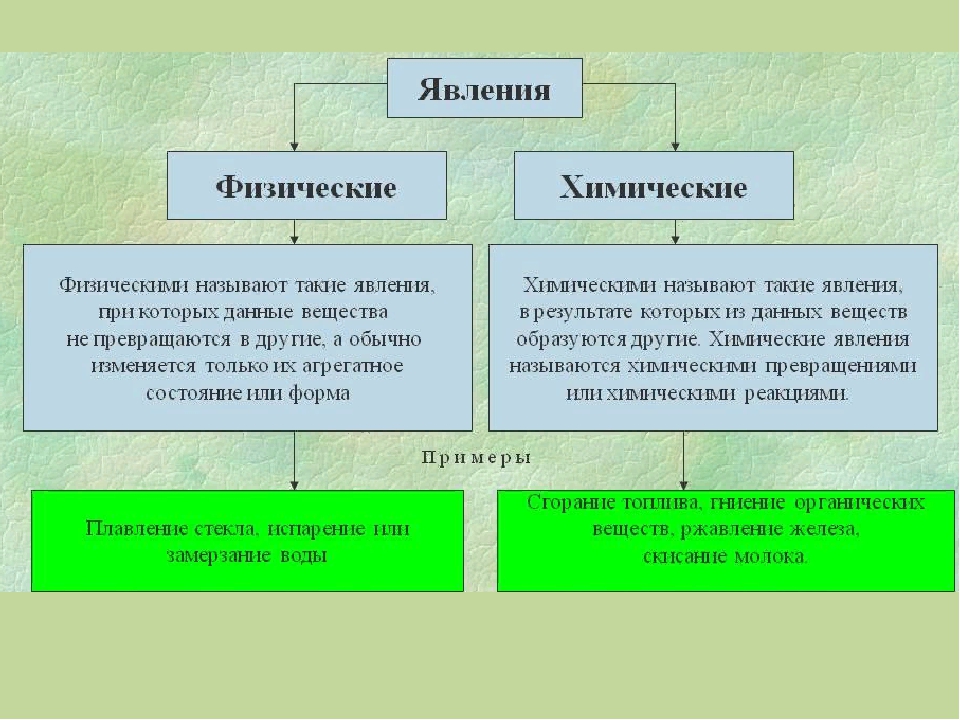 Плавление и охлаждение парафина
Плавление и охлаждение парафина
Оборудование: спиртовка, металлическая пластина, парафин.
1. Металлическую пластину закрепите в держателе.
2. Положите кусочек парафина на металлическую пластину.
3. С помощью спиртовки нагрейте металлическую пластину с парафином.
5. Вылейте расплав тонкой струйкой в фарфоровую чашку и охладите.
6. Какие изменения происходят?
Опыт 4.Выделение газа
В пробирку поместите 0,5 г соды. Осторожно прилейте 1 мл раствора соляной кислоты. Что наблюдаете? Сделайте вывод о том, какое это явление.
Заполнить таблицу
физическоеявление
2.
горение бумаги
изменение цвета, образование газа
химическое явление
3.
плавление и охлаждение парафина
плавление и затвердевание
физическое
явление
4.
гашение соды в соляной кислоте
наблюдается бурное вскипание Происходит выделение газа
Химическое
явление
Составить кластер
2. 3. Третий этап – Рефлексия
3. Третий этап – Рефлексия
В ходе урока вы пытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, то есть проводить исследования. Многие ученые прошлых веков опирались в своих изысканиях лишь на интуицию и в результате нередко ошибались.
Вы же с помощью опытов нашли свою истину.
1. Сегодня я понял …
2. Теперь я могу…
3. Я приобрел….
4. Меня удивило …
5. Я попробую …
6. Мне захотелось поделиться
1. задание тестирование с взаимопроверкой (тест )
Определите физические и химические явления. Рядом поставьте буквы
ф или х
Горение свечи
Ржавление стали
Плавление парафина
Брожение ягодного сока
Свечение электрической лампочки
Гашение соды уксусом
Запотевание стекол в автомобиле
Пригорание пищи
Перегнивание листьев
Листопад
Прокисание молока
Образование накипи в чайнике
2 задание: Отгадав ребус, узнаете, какой процесс происходит при химических явлениях. (Реакция)
(Реакция)
4. Домашнее задание
Подобрать стихи, загадки, пословицы о химических и физических
явлениях;
Привести примеры химических явлений, которые встречаются в
трудовой деятельности, в домашнем хозяйстве.
04. Химические и физические явления
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении – в лед.
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения по форме или агрегатному состоянию, не образовалось.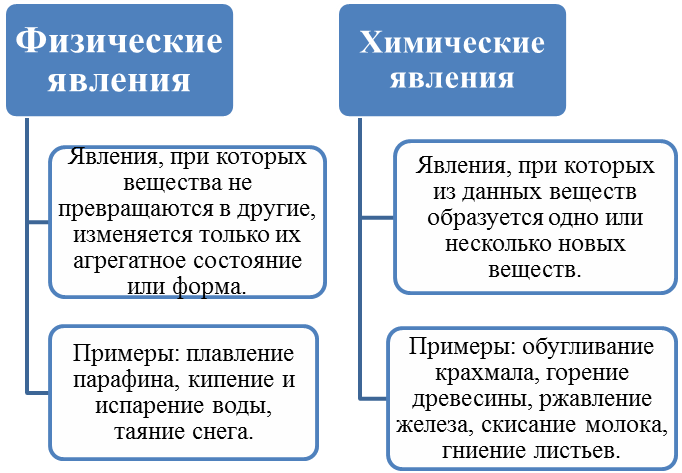
1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объем воздуха уменьшается, и вода входит в пробирку.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением. Запиши примеры в тетради.
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам можно определить, что произошла химическая реакция? При некоторых химических реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного вещества, изменение его вкуса, выделение газа, выделение или поглощение тепла и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | Признак |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе постоянно протекают различные химические реакции. Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
|
Вывод. Выделение газа – один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Поместите в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавьте к ним перекись водорода из домашней аптечки. Объясните, по какому признаку можно определить, что произошла химическая реакция.
Природные химические явления примеры: Привести по 5 примеров физических и химических явлений в природе и жизни. — ЭкоДом: Дом своими руками
Урок природоведения на тему «Химические явления в живой и неживой природе». 5-й класс
Цель урока:
- Закрепить понятие – явление.
- Уметь отличать физические явления от
химических.
- Уметь доказывать, что живая и неживая природа –
фабрика химических превращений.
Задачи урока.
- Образовательные: сформировать у учащихся
понятия о химических явлениях. - Развивающие: развивать творческое
мышление, интеллектуальные способности
учащихся; развивать умения наблюдать,
анализировать, делать выводы. - Воспитательные: продолжить формирование
познавательного интереса к предмету через
использование ИКТ, развить коммуникативные
качества, сформировать навыки работы в группах,
развивать творчество и сотрудничество,
формировать чувство прекрасного.
Оборудование: макет молекулы воды,
яблоко, задания для самостоятельной работы,
компьютер, проектор, экран.
Тип урока: закрепление материала
Ход урока
I. Организационный момент. (слайд 1-2)
Организационный момент. (слайд 1-2)
II. Актуализация знаний. (слайд 3)
В форме беседы учащиеся вспоминают, какие
явления называются физическими, химическими, чем
они отличаются. Вспоминают признаки химических и
физических явлений. Приводят примеры явлений уже
изученных ранее, особое внимание следует
обратить на реакцию горения и признаки
химических реакций.
Опыт с яблоком:
1. Разрезаем яблоко. Какое явление произошло?
2. Оставим яблоко на время.
III. Закрепление материала. (слайд 4-16)
1. Свойства химических и физических явлений.
(слайд 4)
Чем отличаются физические явления от
химических?
2. Определите, в каких из перечисленных случаев
речь идет о химических реакциях? (слайд 5).
Работа на листах – выбрать нужные фразы.
3. Назовите признаки химических явлений. (слайд
6)
В предложенных видео роликах опытов определить
конкретный признак химической реакции.
4. Вспомним состав тела. (слайд 7)
Тело природы состоит из веществ. Вещество – из
молекул. Молекула – из атомов.
5. Поясни схему: в каком случае схема
иллюстрирует физическое явление, а в каком –
химическую реакцию. (слайды 8-10)
Из моделей атомов воды (выполненных из
пластилина) продемонстрировать химическое и
физическое явления. (работа в группе).
6. Тело природы – фабрика химических
превращений. (слайд 11-16)
Назовите вещества, образуемые растениями.
Дайте определения каждому веществу.
В тетради приведите примеры растений,
образующие фитонциды, дубильные вещества,
витамины, яды.
Вернемся к опыту с яблоком. Какая химическая
реакция произошла с яблоком?
IV. Подведем итоги. (слайд 17)
1. На листах дописать определения.
Вариант 1
- Выделение света и тепла – признак химической
реакции __________. (горение)
(горение) - Для каждой химической реакции необходимы
определенные _______________. (условия) - Нагревание, измельчение, охлаждение веществ –
условия, оказывающие воздействия на ход _______________.
(химической реакции)
Вариант 2
- Присутствие кислорода в воздухе – первое
необходимое условие реакции ____________. (горения) - Фитонциды – вещества, которые _____________________________.
(убивают бактерии или подавляют их развитие) - Витамины – вещества, которые ______________________________.
(требуются организму для нормальной
жизнедеятельности).
2. Сделаем выводы.
3. Выставление оценок.
V. Домашнее задание
Определить, какие химические явления
происходят на кухне ежедневно.
Вещества и явления в окружающем мире
Изучая строение Земли, вы тоже знакомились с телами — это куски горных пород и минералов. Растения, животные, человек — тоже тела.
Растения, животные, человек — тоже тела.
А изделия состоят из веществ. Железо, стекло, соль, вода, полиэтилен — это вещества. В настоящее время известно более 7 млн разных веществ, и каждый год люди синтезируют новые, ранее неизвестные.
В природе вещества находятся в трёх состояниях: твёрдом, жидком и газообразном. Например, вода может находиться в твёрдом, в жидком и газообразном состояниях.
В различных состояниях вещества обладают разными свойствами. Большинство окружающих нас тел состоят из твёрдых веществ. Это дома, машины, инструменты и др.
Форму твёрдого тела можно изменить, но для этого необходимо приложить усилие. Например, чтобы согнуть гвоздь, нужно приложить довольно большое усилие. Твёрдые тела имеют собственную форму и объём.
В отличие от твёрдых тел жидкости легко меняют свою форму. Например, они принимают форму сосуда, в котором находятся. Молоко, наполняющее бутылку, имеет форму бутылки. Налитое же в стакан, оно принимает форму стакана. Но, изменяя форму, жидкость сохраняет свой объём.
Молоко, наполняющее бутылку, имеет форму бутылки. Налитое же в стакан, оно принимает форму стакана. Но, изменяя форму, жидкость сохраняет свой объём.
В обычных условиях только маленькие капельки жидкости имеют свою форму — форму шара. Это, например, капли дождя или капли, на которые разбивается струя жидкости.
Воздух, которым мы дышим, является газообразным веществом, или газом. Поскольку большинство газов бесцветны и прозрачны, то они не видны. Присутствие воздуха можно почувствовать, например, стоя у движущегося поезда, открытого окна. Его наличие в окружающем пространстве можно ощутить, если в комнате сквозняк, а также доказать с помощью простых опытов. Например, если стакан перевернуть вверх дном и попытаться опустить его в воду, то вода в стакан не войдёт, поскольку он заполнен воздухом.
Эти и многие другие примеры и опыты подтверждают, что в окружающем пространстве имеется воздух.
Газы легко изменяют свой объём. Например, когда мы сжимаем мячик, то тем самым меняем объём воздуха, наполняющего мяч. Газ, помещённый в закрытый сосуд, занимает весь его целиком. Нельзя газом заполнить половину бутылки так, как это можно сделать жидкостью. Газы не имеют собственной формы и постоянного объёма. Они принимают форму сосуда и полностью заполняют предоставленный им объём.
Газ, помещённый в закрытый сосуд, занимает весь его целиком. Нельзя газом заполнить половину бутылки так, как это можно сделать жидкостью. Газы не имеют собственной формы и постоянного объёма. Они принимают форму сосуда и полностью заполняют предоставленный им объём.
Все вещества разделяют на простые и сложные. Для того чтобы ответить на вопрос, чем они отличаются, нужно знать особенности строения вещества.
В настоящее время известно, что все вещества состоят из мельчайших частиц: молекул и атомов. Они так малы, что увидеть их невооружённым глазом невозможно. Молекулы — это частицы, состоящие из атомов.
Атомы одного вида называют элементами. В одной молекуле может быть два, три и даже сотни и тысячи атомов. Изучая строение атомов, учёные установили, что они отличаются друг от друга, то есть в природе существуют разные виды атомов: один вид — атомы кислорода, другой — атомы углерода и так далее. Современной науке известно 111 видов атомов (элементов). Соединяясь между собой в различных комбинациях, они образуют то многообразие веществ, которое существует в природе.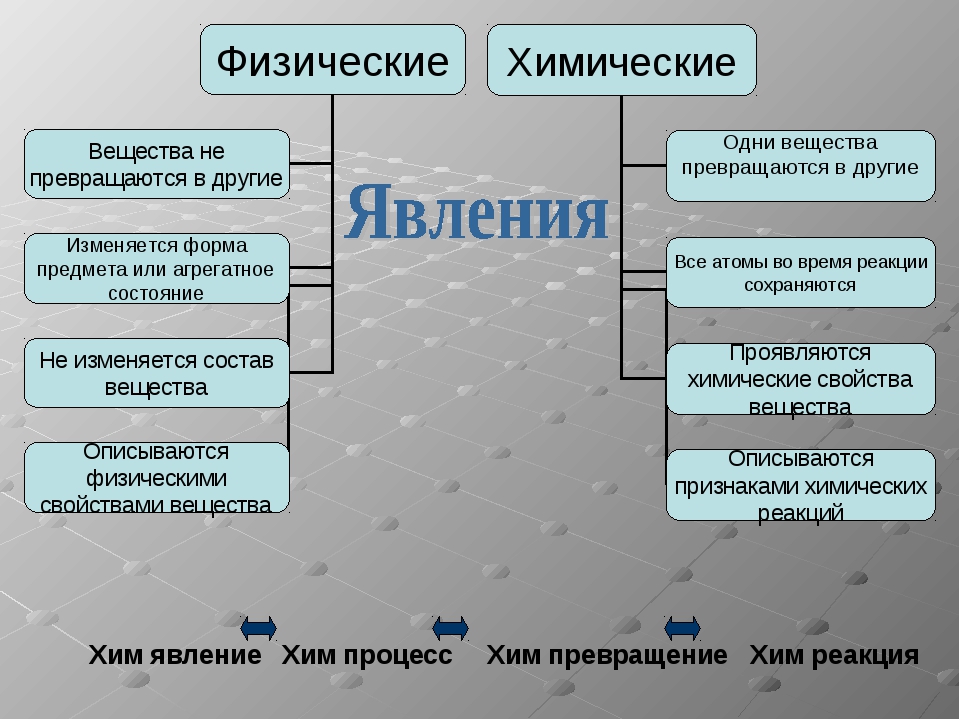
Таким образом, если в состав веществ входят атомы одного вида, то такие вещества называют простыми. Это хорошо известные вам металлы (например, железо, медь, золото, серебро) и неметаллы (например, сера, фосфор, кремний, мышьяк и многие другие).
Все вещества являются либо чистыми, либо смесями. Чистые вещества состоят из частиц одного вида, а смеси — из частиц разных видов. Медь состоит только из атомов меди, а цинк состоит только из атомов цинка. Значит, медь и цинк — это чистые вещества.
Следует иметь в виду, что идеально чистых веществ не существует, поскольку ни одно из веществ невозможно полностью очистить от содержащихся в нём примесей. Например, вода считается практически чистой, если образец жидкости не имеет цвета, вкуса и запаха, замерзает при температуре 0 °C, кипит при температуре +100 °С, имеет плотность 1000 кг/м³ при температуре +4 °С и практически не проводит электрический ток.
В большинстве случаев вещества встречаются в виде смесей. Иногда это хорошо заметно даже невооружённым глазом.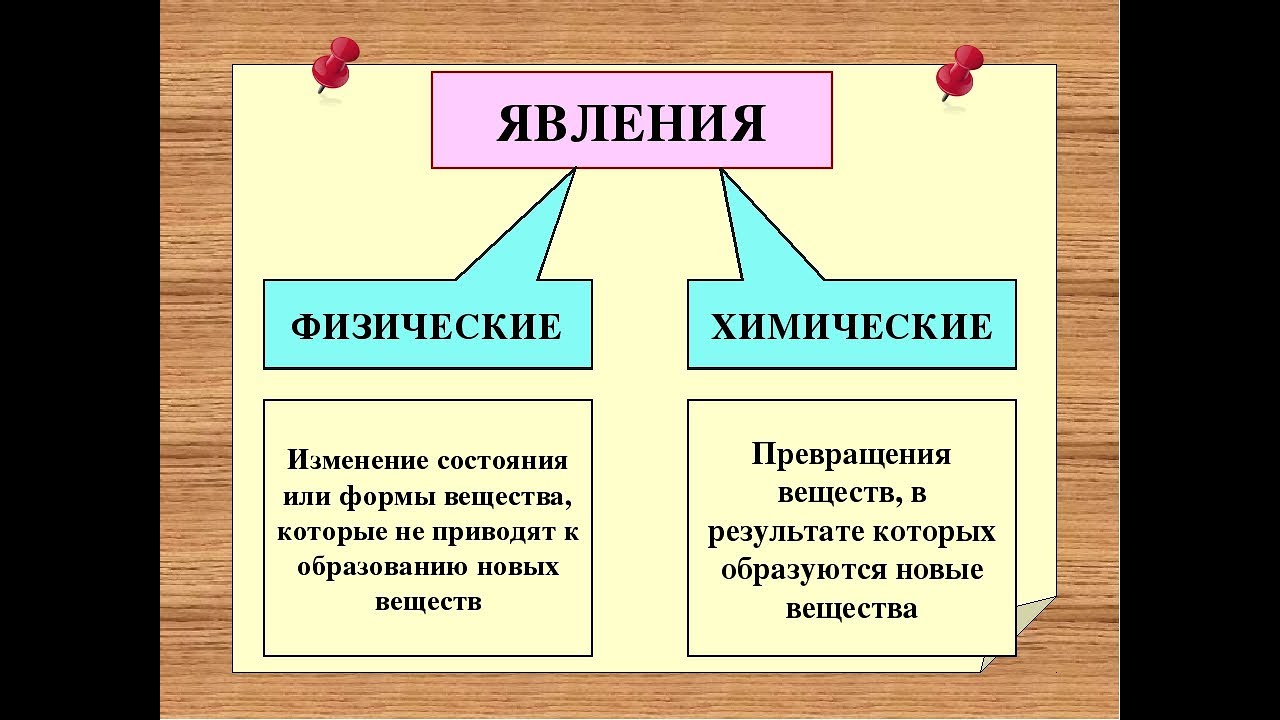 Например, глядя на кусочек гранита, можно увидеть, что он состоит из смеси веществ: кварца, слюды и полевого шпата, а вот в однородном на вид молоке только под микроскопом можно различить капельки жира и белки, плавающие в жидкости (воде).
Например, глядя на кусочек гранита, можно увидеть, что он состоит из смеси веществ: кварца, слюды и полевого шпата, а вот в однородном на вид молоке только под микроскопом можно различить капельки жира и белки, плавающие в жидкости (воде).
В смеси каждое вещество сохраняет свои свойства. Зная эти свойства, смеси можно разделять на составные части.
Многообразие явлений природы
Окружающий нас мир постоянно изменяется в результате различных явлений. Например, с повышением температуры происходит испарение воды. Испарение — это явление. Благодаря наличию кислорода в воздухе происходит горение. Горение ― тоже явление.
Гремит гром, сверкает молния. Гром — это звуковое явление в атмосфере, которое сопровождается разрядами молний.
Интересно, что можно определить расстояние, на котором находится гроза от нас. Для этого необходимо взять скорость звука и умножить её на время между раскатами грома и вспышкой молнии (как правило, речь идёт о нескольких секундах, например, 5 секунд). В результате мы получим определённую цифру, которая и будет означать удалённость грозы (в метрах). Конечно же, цифра эта будет примерной, поскольку скорость звука может сильно изменяться, например, при повышении или понижении температуры. Кстати, в большинстве случаев человек может слышать гром на расстоянии до 20 км.
В результате мы получим определённую цифру, которая и будет означать удалённость грозы (в метрах). Конечно же, цифра эта будет примерной, поскольку скорость звука может сильно изменяться, например, при повышении или понижении температуры. Кстати, в большинстве случаев человек может слышать гром на расстоянии до 20 км.
Что общего между всеми явлениями и чем они отличаются? При нагревании форма тела (кусочка льда) изменилась, однако состав вещества (воды) остался прежним.
При прокаливании медной пластинки образовалось новое вещество — оксид меди. Проведённые опыты показывают, что в одних случаях происходит образование новых веществ, в других — нет.
Химические и физические явления
На основании этого признака различают физические и химические явления. К физическим явлениям относятся распространение запаха в воздухе, свечение раскалённых металлов, прохождение электрического тока по металлической проволоке, растворение сахара в воде, выделение соли из раствора при выпаривании. В этих процессах вещества не изменяют состав и строение.
В этих процессах вещества не изменяют состав и строение.
Физические явления бывают: тепловыми, механическими, световыми, звуковыми, оптическими, электрическими и другими.
Тепловые явления связаны с изменением температуры тел и возникающими в следствие этого изменениями их физического состояния. Так, тела способны нагреваться и охлаждаться.
Некоторые при этом плавятся (как воск свечи при её горении), другие испаряются (вода при нагревании), третьи переходят из жидкого в твёрдое состояние (например, вода превращается в лёд).
При нагревании длина и объём тел увеличиваются, а при охлаждении — уменьшаются. Это явление необходимо учитывать в строительстве и промышленном производстве. Например, при прокладке железнодорожных путей на стыках рельсов оставляют небольшие промежутки, поэтому при нагревании и удлинении рельса путь не разрушается.
К механическим физическим явлениям относятся различные движения и взаимодействия тел, например: автомобили могут набирать скорость (ускоряться), человек может идти, мяч ― сталкиваться с поверхностью Земли и отскакивать, планеты двигаться по орбитам вокруг звёзд.
Световые явления связаны с особенностями светового луча. Например, прямолинейность его распространения объясняет образование теней. Способность света отражаться от тел, на которые он падает, даёт нам возможность видеть их.
Удивительно красивы световые явления в природе (например, радуга). Она образуется в результате разложения света в каплях дождя. Когда луч света «натыкается» на прозрачную преграду — каплю воды или стекло — он распадается на различные цвета.
К звуковым относят явления, связанные с распространением звука в различных средах, поведением звуковых волн при столкновении с препятствиями, и другие явления, связанные со звуком.
Где быстрее распространяется звук ― в воде или воздухе? Любопытно, что скорость распространения звука в воде почти в четыре раза выше, чем в воздухе. То есть рыбы «слышат» быстрее, чем мы.
Что такое эхо? Звуковое эхо — это отражённый звук. Эхо обусловлено тем, что звуковые волны могут отражаться твёрдыми поверхностями. Животные используют эхолокацию для ориентации в пространстве и для определения местоположения объектов вокруг (в основном при помощи высокочастотных звуковых сигналов).
Животные используют эхолокацию для ориентации в пространстве и для определения местоположения объектов вокруг (в основном при помощи высокочастотных звуковых сигналов).
Химические явления
К ним относится, например, образование в зелёных листьях растений крахмала и кислорода из углекислого газа и воды.
По-другому такие явления называют химическими превращениями или химическими реакциями. В результате таких реакций образуются новые вещества, которые отличаются от исходных по ряду признаков.
Некоторые химические реакции протекают очень медленно, и мы их не замечаем, они длятся миллиарды лет. Например, твёрдый камень горных пород — известняк ― под действием воды и углекислого газа разрушается и превращается в другие вещества. Вода вымывает их — так в горах образуются пустоты, пещеры.
Другие реакции происходят очень быстро (например, горение). Так, сгорает топливо в газовой горелке. При горении выделяется много тепла и света.
При гниении тоже выделяется тепло, но оно рассеивается в окружающем пространстве. Это тепло мы обычно не замечаем, но учитывать его должны. Например, неправильно сложенный стог сена, нарушенные условия хранения соломы приводят к развитию процесса гниения. Это может вызвать даже самовозгорание материала.
Это тепло мы обычно не замечаем, но учитывать его должны. Например, неправильно сложенный стог сена, нарушенные условия хранения соломы приводят к развитию процесса гниения. Это может вызвать даже самовозгорание материала.
Презентация урока по теме «Физические и химические явления»
Слайд 1
Исследование физических и химических явлений Цель урока: исследовать физические и химические явления и выявить их практическую значимость.
Слайд 2
Знать — признаки химических реакций; условия возникновения и течения химических реакций Уметь различать физические и химические явления Применять полученные знания в жизни
Слайд 4
Явления Физические Химические Явление не сопровождается образованием новых веществ. Оно проявляется в изменении формы тела или агрегатного состояния вещества. Явление (химическая реакция) заключается в превращении веществ, в результате которого образуется одно или несколько новых веществ.
Слайд 6
Этапы исследования Получение знаний по теме. Проведение опытов. Результат работы. Презентация.
Проведение опытов. Результат работы. Презентация.
Слайд 7
Задание Физикам 1. Какие физические явления вы изучали? Приведите примеры. Ответьте на вопрос. Какие явления произойдут с парафином при нагревании? 3. Выполните тест. Какое из перечисленных явлений не является физическим? Почему? Замерзание воды Растворение соли и сахара Горение древесины Таяние снега
Слайд 8
Задание Химикам 1. На основе вашего жизненного опыта приведите примеры химических явлений (реакций). 2. Ответьте на вопрос. Что произойдет при нагревании сахарного песка в пламени спиртовки? 3. Выполните тест. Какое из перечисленных явлений не является химическим: Прокисание молока Горение природного газа Ржавление железа Испарение воды
Слайд 9
Задание Химикам-экспериментаторам По каким признакам можно судить о протекании химического процесса? 2. Ответьте на вопросы. Какие изменения произойдут, если: а) в стакан с водой опустить кусочек лимона и добавить пищевую соду. б) в раствор медного купороса добавить раствор нашатырного спирта. в) в раствор крахмала добавить раствор йода. г) поджечь лучинку.
в) в раствор крахмала добавить раствор йода. г) поджечь лучинку.
Слайд 10
Задание физ.химикам Вам даны вещества: железные опилки, порошок серы. Подумайте, какие действия необходимо выполнить, чтобы произошла химическая реакция. Почему? Выполните опыт.
Слайд 11
Задание экспертной группе Внимательно прослушать презентацию каждой группы и сделать общий вывод: — чем физические явления отличаются от химических реакций и какова их практическая значимость?
Слайд 12
Практическая значимость химических и физических явлений
Слайд 13
Физические явления Экономить природные ресурсы может и должен каждый из нас. Плотно закрывать Водопроводные краны Выключать лишние электроприборы Сдавать в приемные пункты Вторичное сырье
Слайд 14
Мыло и моющие средства Кинопленка Минеральные удобрения Синтетические и искусственные волокна Продукты химических реакций
Слайд 15
Путем переработки получают Природный газ используется: в кухонных газовых плитах, в промышленных печах, а также как топливо для автомобильных двигателей.
примеров химических реакций в повседневной жизни
Химия происходит в мире вокруг вас, а не только в лаборатории. Материя взаимодействует с образованием новых продуктов посредством процесса, называемого химической реакцией или химическим изменением. Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Возникают реакции, когда вы принимаете лекарства, зажигаете спичку и делаете вдох. Эти примеры химических реакций из повседневной жизни представляют собой небольшую выборку из сотен тысяч реакций, которые вы испытываете в повседневной жизни.
Ключевые выводы: химические реакции в повседневной жизни
- Химические реакции обычны в повседневной жизни, но вы можете их не распознать.
- Ищите признаки реакции. Химические реакции часто включают изменение цвета, изменения температуры, образование газа или образование осадка.
- Простые примеры повседневных реакций включают пищеварение, сжигание и приготовление пищи.

Фотосинтез
Фрэнк Крамер / Getty Images
Растения применяют химическую реакцию, называемую фотосинтезом, для преобразования углекислого газа и воды в пищу (глюкозу) и кислород.Это одна из наиболее распространенных повседневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород. Уравнение реакции:
6 CO 2 + 6 H 2 O + светлый → C 6 H 12 O 6 + 6 O 2
Аэробное клеточное дыхание
Катерина Кон / Научная фотобиблиотека / Getty Images
Аэробное клеточное дыхание — это процесс, противоположный фотосинтезу, в котором молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислый газ и воду.Энергия, используемая клетками, — это химическая энергия в форме АТФ или аденозинтрифосфата.
Вот общее уравнение аэробного клеточного дыхания:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия (36 АТФ)
Анаэробное дыхание
Tastyart Ltd Роб Уайт / Getty Images
Анаэробное дыхание — это набор химических реакций, которые позволяют клеткам получать энергию от сложных молекул без кислорода. Ваши мышечные клетки выполняют анаэробное дыхание всякий раз, когда вы исчерпываете доставляемый к ним кислород, например, во время интенсивных или продолжительных упражнений. Анаэробное дыхание дрожжей и бактерий используется для ферментации с образованием этанола, углекислого газа и других химикатов, из которых делают сыр, вино, пиво, йогурт, хлеб и многие другие обычные продукты.
Ваши мышечные клетки выполняют анаэробное дыхание всякий раз, когда вы исчерпываете доставляемый к ним кислород, например, во время интенсивных или продолжительных упражнений. Анаэробное дыхание дрожжей и бактерий используется для ферментации с образованием этанола, углекислого газа и других химикатов, из которых делают сыр, вино, пиво, йогурт, хлеб и многие другие обычные продукты.
Общее химическое уравнение для одной формы анаэробного дыхания:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + энергия
Горение
WIN-Инициатива / Getty Images
Каждый раз, когда вы зажигаете спичку, зажигаете свечу, разводите огонь или зажигаете гриль, вы видите реакцию горения.Горение объединяет энергичные молекулы с кислородом, чтобы произвести углекислый газ и воду.
Например, уравнение реакции сгорания пропана в газовых грилях и некоторых каминах выглядит следующим образом:
C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + энергия
Ржавчина
Алекс Дауден / EyeEm / Getty Images
Со временем на железе образуется красный шелушащийся налет, называемый ржавчиной. Это пример реакции окисления.Другие повседневные примеры включают образование косточек на меди и потускнение серебра.
Это пример реакции окисления.Другие повседневные примеры включают образование косточек на меди и потускнение серебра.
Вот химическое уравнение ржавления железа:
Fe + O 2 + H 2 O → Fe 2 O 3 . XH 2 O
Пищеварение
Питер Дазли / Выбор фотографа / Getty Images
Во время пищеварения происходят тысячи химических реакций. Как только вы кладете еду в рот, фермент в вашей слюне, называемый амилазой, начинает расщеплять сахар и другие углеводы в более простые формы, которые ваше тело может усвоить.Соляная кислота в желудке реагирует с пищей и расщепляет ее, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровоток через стенки кишечника.
Кислотно-основные реакции
Lumina Imaging / Getty Images
Всякий раз, когда вы комбинируете кислоту (например, уксус, лимонный сок, серную или соляную кислоту) с основанием (например, пищевой содой, мылом, аммиаком или ацетон), вы выполняете кислотно-щелочную реакцию. Эти реакции нейтрализуют кислоту и основание с образованием соли и воды.
Эти реакции нейтрализуют кислоту и основание с образованием соли и воды.
Хлорид натрия — не единственная соль, которая может образоваться. Например, вот химическое уравнение кислотно-основной реакции, в результате которой образуется хлорид калия, обычный заменитель поваренной соли:
HCl + КОН → KCl + H 2 O
Реакции с мылом и моющими средствами
JGI / Джейми Грилл / Getty Images
Мыло и моющие средства очищаются путем химических реакций. Мыло эмульгирует грязь, а это означает, что жирные пятна прилипают к мылу, и их можно удалить водой.Моющие средства действуют как поверхностно-активные вещества, снижая поверхностное натяжение воды, чтобы она могла взаимодействовать с маслами, изолировать их и смывать.
Готовка
Фотографии Дины Беленко / Getty Images
При приготовлении пищи используется тепло, чтобы вызвать химические изменения в пище. Например, когда вы варите яйцо вкрутую, сероводород, образующийся при нагревании яичного белка, может реагировать с железом из яичного желтка, образуя серовато-зеленое кольцо вокруг желтка. Когда вы обжариваете мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желаемый вкус.
Когда вы обжариваете мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желаемый вкус.
Самый быстрый словарь в мире: Vocabulary.com
химическое явление любое природное явление, связанное с химией
физическое явление природное явление, связанное с физическими свойствами материи и энергии
механическое явление физическое явление, связанное с равновесием или движением предметов
оптическое явление физическое явление, связанное со светом или связанное с ним
электрическое явление физическое явление, связанное с электричеством
Феномен Любое состояние или процесс, известный через органы чувств
природные явления Все неискусственные явления
химический элемент любое из более чем 100 известных веществ (из которых 92 встречаются в природе), которые не могут быть разделены на более простые вещества и которые по отдельности или в комбинации составляют все вещество
психический феномен Явления, которые противоречат физическим законам и предполагают возможность причинной связи психическими процессами
органическое явление природное явление с участием живых растений и животных
химическое обозначение обозначение, используемое химиками для выражения технических фактов в химии
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
химическое машиностроение отрасль машиностроения, которая занимается проектированием, строительством и эксплуатацией установок и оборудования, используемых в промышленных химических процессах
Феномен Тарчанова — изменение электрических свойств кожи в ответ на стресс или тревогу; можно измерить либо путем регистрации электрического сопротивления кожи, либо путем регистрации слабых токов, генерируемых телом
химическая формула: обозначение вещества с использованием символов составляющих его элементов
Процесс химического изменения, определяемый составом и структурой веществ
химическая реакция процесс, в котором вещества превращаются в другие
эпифеномен вторичный феномен, являющийся побочным продуктом другого явления
естественных законов науки: определение и примеры — видео и стенограмма урока
Примеры
Когда упоминаются законы природы, одна из наиболее распространенных научных дисциплин, которая приходит на ум, — это физика.Законы физики включают такие понятия, как закон всемирного тяготения Ньютона. Этот закон описывает силу притяжения ( F ), которая существует между двумя массами ( M sub 1 и M sub 2). Вот закон всемирного тяготения, выраженный математическим уравнением:
Вот закон всемирного тяготения, выраженный математическим уравнением:
Другим примером естественного закона в физике является закон Ома, который описывает взаимосвязь между напряжением ( В, ), током ( I ) и сопротивлением ( R ).
Законы природы также присутствуют в химии. Один из важнейших законов химии — закон сохранения вещества. Этот закон гласит, что материю нельзя ни создать, ни уничтожить. Этот закон закладывает основу для понимания химических реакций, поскольку материя в реакциях просто рекомбинируется, образуя различные комбинации. Закон сохранения вещества предсказывает, что до и после химической реакции присутствует одинаковое общее количество атомов.
В биологии тоже есть законы, описывающие природные явления. Прекрасным примером является закон сегрегации Менделя. Этот закон описывает, как физические черты передаются от одного поколения к другому.
Законы против теорий
Разницу между законами и теориями часто понимают неправильно. Ключевое заблуждение состоит в том, что теории после тщательной проверки могут стать законами.Эта идея ложна, потому что она ошибочно предполагает, что эти продукты научного метода связаны друг с другом.
Ключевое заблуждение состоит в том, что теории после тщательной проверки могут стать законами.Эта идея ложна, потому что она ошибочно предполагает, что эти продукты научного метода связаны друг с другом.
Сфера действия закона ограничена описанием. Законы описывают взаимосвязь между явлениями. Они объясняют, как что-то работает, но не пытаются объяснить, почему вообще существуют отношения.
Теория — это объяснение взаимосвязи между различными явлениями, а также основных причин природных явлений.Объяснение теории выходит далеко за рамки простого описания. Другими словами, теории говорят нам, почему что-то происходит, а не просто как это происходит.
Чтобы лучше проиллюстрировать эту мысль, рассмотрим наше понимание гравитации. Основное притяжение между двумя массами описывается законом всемирного тяготения Ньютона, как было показано ранее. Этот закон, однако, не объясняет, почему массы вообще тянутся друг к другу. Общая теория относительности Эйнштейна объясняет гравитацию как результат того, что массы деформируют ткань пространства и времени.
Резюме урока
Законы природы — это краткие описания природных явлений. Законы природы, как и теории, являются продуктом научного метода. научный метод — это систематическое изучение мира природы посредством экспериментов и наблюдений. В то время как теории описывают причины природных явлений, естественные законы описывают только отношения между природными явлениями.Законы природы можно найти в виде простых утверждений, а также математических соотношений во всех естественных науках.
Примеры естественного закона: сводка
Закон всемирного тяготения Ньютона : Закон всемирного тяготения Ньютона описывает силу притяжения между двумя массами.
Закон Ома : Закон Ома описывает взаимосвязь между вольт, током и сопротивлением.
Закон сохранения материи : Закон сохранения материи описывает, как количество атомов остается неизменным до и после химической реакции.
Закон сегрегации Менделя : Закон сегрегации Менделя описывает, как черты характера передаются из поколения в поколение.
Результаты обучения
После просмотра этого урока вы должны уметь:
- Определять и описывать законы природы
- Список примеров естественных законов
- Противопоставьте естественный закон теории
Раскрытие тайного сияния природного явления — сейчас.Powered by Northrop Grumman
Хотя светящиеся в темноте скалы изучались с 19 века и их с нетерпением ждали черные светлые каменные гончие на берегах Великих озер, химический состав этого природного явления не был полностью исчерпан. какое-то время понимал.
Однако недавнее исследование, опубликованное в журнале Chemistry of Materials, раскрывает секреты светящихся горных пород и может стимулировать исследования материалов для создания лучшего синтетического материала. Эти результаты могут помочь улучшить средства безопасности, такие как аварийные вывески, которые могут загораться без источника питания.
Что делает рок светиться?
Прежде всего, что заставляет камень светиться в темноте? Первый закон термодинамики дает ключ к разгадке этого природного явления. В закрытой системе энергия не может быть создана или уничтожена — ее можно только изменить. Например, пропуская электрический ток через нить накаливания лампы накаливания, она нагревается до тех пор, пока она не начнет светиться.
В закрытой системе энергия не может быть создана или уничтожена — ее можно только изменить. Например, пропуская электрический ток через нить накаливания лампы накаливания, она нагревается до тех пор, пока она не начнет светиться.
В случае светящейся породы не используется тепло, и наблюдаемое природное явление описывается как холодный свет или люминесценция.По данным The Gem Society, многие камни и камни светятся при активации ультрафиолетовым светом. Эта функция часто используется для различения природных и выращенных в лаборатории драгоценных камней.
Камни светятся, поскольку электроны внутри них реагируют на изменение энергии. В отличие от биолюминесценции, где свет возникает в результате биологической ферментативной реакции, люминесценция горных пород больше похожа на явление северного сияния, когда заряженные частицы от солнца реагируют с атомами в атмосфере, чтобы активировать свои электроны.Когда драгоценные камни светятся в ультрафиолетовом свете, это сам свет активирует элементы внутри породы, переводя электроны в более высокое энергетическое состояние. Когда эти активированные электроны возвращаются к более низкому энергетическому уровню, они выделяют фотоны в виде света.
Когда эти активированные электроны возвращаются к более низкому энергетическому уровню, они выделяют фотоны в виде света.
Smashing Rocks for Science
Хакманит, или сероватый содалит, был впервые описан в 1800-х годах как горная порода, которая светится розовым светом, когда ее разбивают или помещают в темноту. Он также излучает характерное свечение при активации УФ-светом.Атлас-обскура описывает, как члены сообщества охотников за камнями после сумерек выходят на берега Великих озер, вооруженные ультрафиолетовыми фонариками, чтобы исследовать сиенитные породы, богатые содалитом.
Коллекционеры знают, что среди образцов породы есть множество; одни светятся, а другие — нет, от ярко-оранжевого до нежно-розового. Это свечение также зависит от того, как долго оно длится.
Как сообщает Science Alert, чтобы выяснить, почему существует разница в продолжительности, международная группа исследователей проанализировала образцы хакманита, собранные в Канаде, Гренландии, Афганистане и Пакистане. Используя такие методы, как спектрометрия и дифракция рентгеновских лучей, команда определила состав каждого образца, чтобы выяснить, как каждый элемент внес свой вклад в природное явление.
Используя такие методы, как спектрометрия и дифракция рентгеновских лучей, команда определила состав каждого образца, чтобы выяснить, как каждый элемент внес свой вклад в природное явление.
Преднамеренные примеси в синтетических материалах
Когда исследователи сравнили профили состава для каждого из образцов хакманита с люминесценцией, они обнаружили, что соотношение определенных примесей в породах влияет на яркость их свечения. Соотношения также объясняли, как долго свечение сохранялось после того, как камни были активированы.
Из анализа они обнаружили, что было две пары элементов, которые напрямую коррелировали с продолжительностью свечения. Что касается химического состава, образцы хакманита, содержащие больше титана по сравнению с железом и больше калия по сравнению с серой, светились ярче и дольше. Важным фактором были относительные концентрации между каждой парой элементов. Исследовательская группа пришла к выводу, что обилие одной пары может погасить возбуждение в другой и, таким образом, уменьшить люминесценцию.
Опираясь на природу
При исследовании материалов часто используются такие природные явления, как светящиеся камни. Создать новый синтетический материал зачастую проще, если в природе есть что копировать. Но сначала вам нужно узнать, что скрывается за волшебным сиянием.
Например, зеленый флуоресцентный белок (GFP) обычно используется в лабораторных исследованиях, чтобы показать активность внутри клетки. Поскольку его можно включать и выключать в зависимости от определенных внутриклеточных активностей, флуоресцентная микроскопия покажет не только то, что GFP находится внутри клетки, но и где он находится.ScienceMag отмечает, что изучение новых видов медуз открывает более мощные версии GFP.
Находки хакманитов показали, как природная примесь может влиять на яркость и продолжительность свечения горных пород. Благодаря этим новым знаниям, изменение состава новых синтетических материалов может помочь, например, в создании более ярких и долговечных указателей аварийной ситуации. Как отмечает исследовательская группа, изучение природы может помочь нам улучшить характеристики наших копий.
Как отмечает исследовательская группа, изучение природы может помочь нам улучшить характеристики наших копий.
Ознакомьтесь с возможностями карьерного роста в Northrop Grumman , чтобы узнать, как вы можете принять участие в этом увлекательном времени открытий в области науки, технологий и инженерии.
Что такое химия? | Живая наука
Вы можете думать о химии только в контексте лабораторных тестов, пищевых добавок или опасных веществ, но область химии включает в себя все, что нас окружает.
«Все, что вы слышите, видите, запах, вкус и прикосновение, связано с химией и химическими веществами (материей)», согласно Американскому химическому обществу (ACS), некоммерческой научной организации по развитию химии, учрежденной США. Конгресс. «А слышание, видение, дегустация и прикосновение — все это связано с запутанной серией химических реакций и взаимодействий в вашем теле.»
Итак, даже если вы не работаете химиком, вы занимаетесь химией или чем-то, что связано с химией, практически со всем, что вы делаете. В повседневной жизни вы занимаетесь химией, когда готовите, когда используете уборку. моющие средства, чтобы вытереть столешницу, когда вы принимаете лекарства или разбавляете концентрированный сок, чтобы вкус был не таким интенсивным.
В повседневной жизни вы занимаетесь химией, когда готовите, когда используете уборку. моющие средства, чтобы вытереть столешницу, когда вы принимаете лекарства или разбавляете концентрированный сок, чтобы вкус был не таким интенсивным.
Связано: Ого! Огромный взрыв «сахарной ваты» в детской химической лаборатории
Согласно ACS, химия — это изучение материи, определяемой как все, что имеет массу и занимает пространство, а также изменения, которые материя может претерпеть, когда она находится в различных средах и условиях.Химия стремится понять не только свойства материи, такие как масса или состав химического элемента, но также то, как и почему материя претерпевает определенные изменения — преобразовалось ли что-то из-за того, что оно соединилось с другим веществом, замерзло, потому что оно было оставлено на две недели в морозильник или изменил цвет из-за слишком большого количества солнечного света.
Основы химии
Причина, по которой химия затрагивает все, что мы делаем, заключается в том, что почти все, что существует, можно разбить на химические строительные блоки.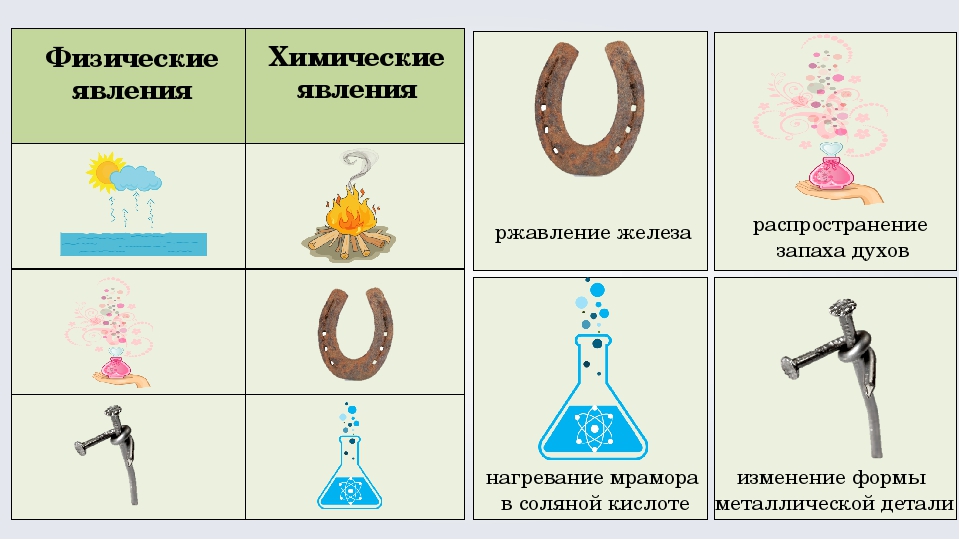
Основными строительными блоками в химии являются химические элементы, которые представляют собой вещества, состоящие из одного атома. Каждое химическое вещество уникально, состоит из определенного количества протонов, нейтронов и электронов и идентифицируется по названию и химическому символу, например «C» для углерода. Элементы, которые ученые обнаружили на данный момент, перечислены в периодической таблице элементов и включают как элементы, встречающиеся в природе, такие как углерод, водород и кислород, так и созданные человеком, например Лоуренсий.
Связанный: Как элементы сгруппированы в периодической таблице?
Химические элементы могут связываться вместе, образуя химические соединения, которые представляют собой вещества, состоящие из нескольких элементов, таких как диоксид углерода (который состоит из одного атома углерода, соединенного с двумя атомами кислорода), или нескольких атомов одного элемента, как газообразный кислород (который состоит из двух атомов кислорода, соединенных вместе). Эти химические соединения могут затем связываться с другими соединениями или элементами, образуя бесчисленное множество других веществ и материалов.
Эти химические соединения могут затем связываться с другими соединениями или элементами, образуя бесчисленное множество других веществ и материалов.
Химия — это физическая наука
Химия обычно считается физической наукой в соответствии с определением Британской энциклопедии, потому что изучение химии не связано с живыми существами. Большая часть химии, связанной с исследованиями и разработками, такими как создание новых продуктов и материалов для клиентов, относится к этой сфере.
Но, по мнению Биохимического общества, различия как физическая наука становятся немного размытыми в случае биохимии, которая исследует химию живых существ.Химические вещества и химические процессы, изучаемые биохимиками, технически не считаются «живыми», но их понимание важно для понимания того, как устроена жизнь.
Химия — это физическая наука, что означает, что она не затрагивает «живые» существа. Один из способов, которым многие люди регулярно занимаются химией, возможно, даже не осознавая этого, — это приготовление пищи и выпечка. (Изображение предоставлено Shutterstock)
(Изображение предоставлено Shutterstock)
Пять основных разделов химии
Согласно онлайн-учебнику химии, опубликованному LibreText, химия традиционно делится на пять основных разделов.Существуют также более специализированные области, такие как пищевая химия, химия окружающей среды и ядерная химия, но в этом разделе основное внимание уделяется пяти основным субдисциплинам химии.
Аналитическая химия включает анализ химических веществ и включает качественные методы, такие как изучение изменения цвета, а также количественные методы, такие как изучение точной длины (длин) волны света, которую поглощает химическое вещество, что приводит к изменению цвета.
Эти методы позволяют ученым охарактеризовать множество различных свойств химических веществ и могут принести пользу обществу разными способами.Например, аналитическая химия помогает пищевым компаниям делать замороженные обеды вкуснее, обнаруживая, как химические вещества в продуктах питания меняются с течением времени. Аналитическая химия также используется для мониторинга состояния окружающей среды, например, путем измерения химических веществ в воде или почве.
Аналитическая химия также используется для мониторинга состояния окружающей среды, например, путем измерения химических веществ в воде или почве.
Биохимия , как упоминалось выше, использует химические методы, чтобы понять, как биологические системы работают на химическом уровне. Благодаря биохимии исследователи смогли составить карту генома человека, понять, что различные белки делают в организме, и разработать лекарства от многих болезней.
Связано: Раскрытие генома человека: 6 молекулярных вех
Неорганическая химия изучает химические соединения в неорганических или неживых объектах, таких как минералы и металлы. Традиционно в неорганической химии считается, что соединения, которые не содержат , а не , содержат углерод (которые охватываются органической химией), но это определение не совсем точное, согласно ACS.
Некоторые соединения, изучаемые в неорганической химии, такие как «металлоорганические соединения», содержат металлы, которые связаны с углеродом — основным элементом, изучаемым в органической химии. Таким образом, такие соединения считаются частью обеих областей.
Таким образом, такие соединения считаются частью обеих областей.
Неорганическая химия используется для создания различных продуктов, в том числе красок, удобрений и солнцезащитных кремов.
Органическая химия занимается химическими соединениями, содержащими углерод — элемент, который считается необходимым для жизни. Химики-органики изучают состав, структуру, свойства и реакции таких соединений, которые наряду с углеродом содержат другие неуглеродные элементы, такие как водород, сера и кремний.Органическая химия используется во многих приложениях, как описано в ACS, таких как биотехнология, нефтяная промышленность, фармацевтика и пластмассы.
Физическая химия использует концепции физики, чтобы понять, как работает химия. Например, выяснение того, как атомы движутся и взаимодействуют друг с другом, или почему некоторые жидкости, включая воду, превращаются в пар при высоких температурах. Физические химики пытаются понять эти явления в очень малом масштабе — на уровне атомов и молекул — чтобы сделать выводы о том, как работают химические реакции и что придает конкретным материалам их уникальные свойства.
Согласно ACS, этот тип исследований помогает информировать другие отрасли химии и важен для разработки продуктов. Например, физико-химики могут изучать, как определенные материалы, такие как пластик, могут реагировать с химическими веществами, для контакта с которыми этот материал предназначен.
Чем занимаются химики?
Химики работают в различных областях, включая исследования и разработки, контроль качества, производство, защиту окружающей среды, консалтинг и право. Согласно ACS, они могут работать в университетах, в правительстве или в частном секторе.
Вот несколько примеров того, чем занимаются химики:
Исследования и разработки
В академических кругах химики, проводящие исследования, стремятся получить дополнительные знания по определенной теме и не обязательно имеют в виду конкретное приложение. Однако их результаты все еще могут быть применены к соответствующим продуктам и приложениям.
В промышленности химики, занимающиеся исследованиями и разработками, используют научные знания для разработки или улучшения конкретного продукта или процесса. Например, пищевые химики улучшают качество, безопасность, хранение и вкус пищи; химики-фармацевты разрабатывают и анализируют качество лекарств и других лекарственных форм; а агрохимики разрабатывают удобрения, инсектициды и гербициды, необходимые для крупномасштабного растениеводства.
Например, пищевые химики улучшают качество, безопасность, хранение и вкус пищи; химики-фармацевты разрабатывают и анализируют качество лекарств и других лекарственных форм; а агрохимики разрабатывают удобрения, инсектициды и гербициды, необходимые для крупномасштабного растениеводства.
Иногда исследования и разработки могут включать не улучшение самого продукта, а скорее производственный процесс, связанный с его изготовлением. Инженеры-химики и инженеры-технологи придумывают новые способы упростить производство своей продукции и сделать ее более рентабельной, например, увеличить скорость и / или выход продукта при заданном бюджете.
Охрана окружающей среды
Химики-экологи изучают, как химические вещества взаимодействуют с окружающей средой, характеризуя химические вещества и химические реакции, присутствующие в естественных процессах в почве, воде и воздухе. Например, ученые могут собирать почву, воду или воздух в интересующем месте и анализировать их в лаборатории, чтобы определить, загрязнила ли деятельность человека окружающую среду или повлияет на нее иным образом. Некоторые химики-экологи также могут помочь восстановить или удалить загрязняющие вещества из почвы.С. Бюро статистики труда.
Некоторые химики-экологи также могут помочь восстановить или удалить загрязняющие вещества из почвы.С. Бюро статистики труда.
Связано: Почему удобрения опасны (инфографика)
Ученые с опытом работы в области химии окружающей среды могут также работать консультантами в различных организациях, таких как химические компании или консалтинговые фирмы, предоставляя рекомендации о том, как можно выполнять практические действия и процедуры. соответствие экологическим нормам.
Закон
Химики могут использовать свое академическое образование, чтобы давать советы или защищать научные вопросы.Например, химики могут работать в сфере интеллектуальной собственности, где они могут применять свои научные знания в вопросах авторского права в науке или в области экологического права, где они могут представлять группы с особыми интересами и подавать заявки на одобрение регулирующих органов до того, как начнутся определенные действия.
Химики также могут выполнять анализы, помогающие правоохранительным органам. Судебные химики собирают и анализируют вещественные доказательства, оставленные на месте преступления, чтобы помочь определить личности причастных к делу людей, а также ответить на другие жизненно важные вопросы о том, как и почему было совершено преступление.Судебные химики используют широкий спектр методов анализа, таких как хроматография и спектрометрия, которые помогают идентифицировать и количественно определять химические вещества.
Судебные химики собирают и анализируют вещественные доказательства, оставленные на месте преступления, чтобы помочь определить личности причастных к делу людей, а также ответить на другие жизненно важные вопросы о том, как и почему было совершено преступление.Судебные химики используют широкий спектр методов анализа, таких как хроматография и спектрометрия, которые помогают идентифицировать и количественно определять химические вещества.
Дополнительные ресурсы:
Химия | Введение в химию
Цель обучения
- Изложить общие цели и предмет химии
Ключевые моменты
- Химию иногда называют «центральной наукой», потому что она связывает физику с другими естественными науками, такими как геология и биология.
- Химия — это изучение материи и ее свойств.
- Поддомены химии включают: аналитическую химию, биохимию, неорганическую химию, органическую химию, физическую химию и биофизическую химию.

Условия
- химия Раздел естествознания, изучающий состав вещества и изменения, которым он претерпевает в результате химических реакций.
- материя — то, что имеет массу, занимает пространство (имеет объем) и составляет почти все в мире.
Химия — это изучение вещества и химических реакций между веществами. Химия также изучает состав, структуру и свойства материи. Материя — это, по сути, все в мире, занимающее пространство и обладающее массой. Химию иногда называют «центральной наукой», потому что она связывает физику с другими естественными науками, такими как геология и биология.
История химии
Основная химическая гипотеза впервые возникла в классической Греции, когда Аристотель определил четыре элемента: огонь, воздух, землю и воду.Лишь в XVII и XVIII веках такие ученые, как Роберт Бойль (1627–1691) и Антуан Лавуазье (1743–1794), начали преобразовывать старые алхимические традиции в строгую научную дисциплину.
Антуан-Лоран де Лавуазье Антуан-Лоран де Лавуазье считается «отцом современной химии» за его работу над принципом сохранения массы и за разработку новой системы химической номенклатуры.
Как одна из естественных наук, химия дает ученым возможность познакомиться с другими физическими науками и дает мощные аналитические инструменты для инженерных приложений.Биологические науки и их ответвления, такие как психология, уходят корнями в биохимию, и ученые только сейчас начинают понимать, как различные уровни организации влияют друг на друга. Например, в основе современной медицины лежат биохимические процессы человеческого организма.
Химия и мир природы
Химия способна объяснить бесчисленные явления в мире, от обычных до причудливых. Почему ржавеет железо? Что делает пропан таким эффективным и экологически чистым топливом? Как сажа и алмаз могут быть такими разными по внешнему виду и при этом такими химически похожими? Химия дает ответы на эти и многие другие вопросы. Понимание химии — ключ к пониманию мира, каким мы его знаем.
Понимание химии — ключ к пониманию мира, каким мы его знаем.
Химия Химия — это изучение свойств, состава и превращения материи.
Различные отрасли химии
Изучение химии можно разделить на отдельные разделы, в которых особое внимание уделяется подмножествам химических понятий. Аналитическая химия стремится определить точный химический состав веществ. Биохимия — это исследование химических веществ, содержащихся в живых организмах (таких как ДНК и белки).Неорганическая химия изучает вещества, не содержащие углерода. Органическая химия изучает вещества на основе углерода. Физическая химия — это изучение физических свойств химических веществ. Биофизическая химия — это приложение физической химии в биологическом контексте.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Выбросы химических веществ, вызванные стихийными бедствиями и стихийными бедствиями: Информация для органов здравоохранения — Мир
Введение
Бедствия, возникающие в результате стихийных бедствий, таких как землетрясения, ураганы, цунами и наводнения, усиливаются по интенсивности, частоте и воздействию, отчасти из-за изменения климата (1, 2). Они могут нанести серьезный ущерб окружающей среде и инфраструктуре, а также привести к значительным экономическим потерям. Бедствия могут напрямую влиять на здоровье человека в виде травм, смерти и вспышек болезней, а более долгосрочные последствия могут включать неинфекционные заболевания, психические заболевания и инвалидность. Способность сектора здравоохранения реагировать на эти эффекты часто снижается из-за ущерба, нанесенного медицинским учреждениям, и перебоев в оказании медицинских услуг (3).
Они могут нанести серьезный ущерб окружающей среде и инфраструктуре, а также привести к значительным экономическим потерям. Бедствия могут напрямую влиять на здоровье человека в виде травм, смерти и вспышек болезней, а более долгосрочные последствия могут включать неинфекционные заболевания, психические заболевания и инвалидность. Способность сектора здравоохранения реагировать на эти эффекты часто снижается из-за ущерба, нанесенного медицинским учреждениям, и перебоев в оказании медицинских услуг (3).
Природная опасность может вызвать выброс химического вещества.Когда выброс является результатом технологической аварии, это называется «Natech» (технологическое событие, вызванное природными опасностями). События Natech могут усугубить воздействие стихийного бедствия на окружающую среду и здоровье человека из-за выброса опасных материалов, пожаров и взрывов (4–6).
Причины и последствия событий Natech — относительно недавняя область исследования менеджеров по рискам. Было замечено, что, хотя могут существовать меры по предотвращению и обеспечению готовности, а также планы реагирования и восстановления для борьбы с рисками, связанными с технологическими или стихийными бедствиями, они редко интегрируются (4). Более того, отсутствуют методы и инструменты для анализа и картирования рисков Natech (4). Поэтому в районах, подверженных стихийным бедствиям, важно разрабатывать планы, учитывающие возможность одновременной борьбы со стихийными бедствиями и вторичными техногенными катастрофами.
Более того, отсутствуют методы и инструменты для анализа и картирования рисков Natech (4). Поэтому в районах, подверженных стихийным бедствиям, важно разрабатывать планы, учитывающие возможность одновременной борьбы со стихийными бедствиями и вторичными техногенными катастрофами.
Цель, объем и структура этого документа
Этот документ призван предоставить краткую информацию плановикам в секторе здравоохранения и органам общественного здравоохранения, которые хотят узнать больше о выбросах химических веществ в результате опасных природных явлений.Хотя основной темой документа являются события Natech, также предоставляется информация о других источниках выбросов химических веществ после стихийного бедствия. Описываются конкретные проблемы, связанные с мероприятиями Natech. Затем в документе дается обзор роли и деятельности сектора здравоохранения на всех этапах цикла управления рисками. Приложения по конкретным опасностям (приложения A – C) предоставляют информацию о механизмах выброса химических веществ в результате землетрясений, наводнений и циклонов и последующего воздействия на здоровье, а также краткую информацию о мерах реагирования.
Примеры химических и физических явлений в природе
Динамические изменения встроены в саму природу. Все меняется так или иначе каждый момент. Если вы внимательно осмотритесь, вы найдете сотни примеров физических и химических явлений, которые являются вполне себе естественными преобразованиями.
Изменения – единственная константа во Вселенной
Как ни странно, изменение является единственной константой в нашей Вселенной. Чтобы понять физические и химические явления (примеры в природе встречаются на каждом шагу), принято классифицировать их по типам, в зависимости от характера конечного результата, вызванного ими. Различают физические, химические и смешанные изменения, которые содержат в себе и первые, и вторые.
Физические и химические явления: примеры и значение
Что такое физическое явление? Любые изменения, происходящие в веществе без изменения его химического состава, являются физическими. Они характеризуется изменениями физических атрибутов и материального состояния (твердое, жидкое или газообразное), плотности, температуры, объема, которые происходят без изменения его фундаментальной химической структуры. Не происходит создание новых химических продуктов или изменения общей массы. Кроме того, этот тип изменений обычно является временным и в некоторых случаях полностью обратимым.
Не происходит создание новых химических продуктов или изменения общей массы. Кроме того, этот тип изменений обычно является временным и в некоторых случаях полностью обратимым.
Когда вы смешиваете химикаты в лаборатории, можно легко увидеть реакцию, но в мире вокруг вас происходит множество химических реакций каждый день. Химическая реакция изменяет молекулы, в то время как физическое изменение только перестраивает их. Например, если мы возьмем газ хлора и металлический натрий и объединим их, мы получим столовую соль. Полученное вещество сильно отличается от любого из его составных частей. Это химическая реакция. Если затем растворить эту соль в воде, мы просто смешиваем молекулы соли с молекулами воды. В этих частицах нет изменений, это физическое преобразование.
Примеры физических изменений
Все состоит из атомов. При соединении атомов образуются разные молекулы. Различные свойства, которые наследуют объекты, являются следствием различных молекулярных или атомных структур. Основные свойства объекта зависят от их молекулярного расположения. Физические изменения происходят без изменения молекулярной или атомной структуры объектов. Они просто преобразуют состояние объекта, не изменяя его природы. Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Основные свойства объекта зависят от их молекулярного расположения. Физические изменения происходят без изменения молекулярной или атомной структуры объектов. Они просто преобразуют состояние объекта, не изменяя его природы. Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Дополнительные примеры физических изменений: металл, расширяющийся при нагревании, передача звука через воздух, замерзание воды зимой в лед, медь втягивается в провода, формирование глины на разных объектах, мороженое плавится до жидкости, нагревание металла и преобразование его в другую форму, сублимация йода при нагревании, падение любого объекта под действием силы тяжести, чернила поглощаются мелом, намагничивание железных гвоздей, снеговик, тающий на солнце, светящиеся лампы накаливания, магнитная левитация объекта.
Как различать физические и химические изменения?
Множество примеров химических явлений и физических можно встретить в жизни. Часто трудно определить разницу между ними, особенно когда оба могут происходить одновременно. Чтобы определить физические изменения, задайте следующие вопросы:
Чтобы определить физические изменения, задайте следующие вопросы:
- Является ли состояние состояния объекта изменением (газообразным, твердым и жидким)?
- Является ли изменение чисто ограниченным физическим параметром или характеристикой, такой как плотность, форма, температура или объем?
- Является ли химическая природа объекта изменением?
- Возникают ли химические реакции, приводящие к созданию новых продуктов?
Если ответ на один из первых двух вопросов да, и ответы на последующие вопросы отсутствуют, это, скорее всего, это физическое явление. И наоборот, если ответ на любой из двух последних вопросов положительный, в то время как первые два отрицательные, это, безусловно, химическое явление. Трюк состоит в том, чтобы просто четко наблюдать и анализировать то, что вы видите.
Примеры химических реакций в повседневной жизни
Химия происходит в окружающем вас мире, а не только в лаборатории. Материя взаимодействует для образования новых продуктов посредством процесса, называемого химической реакцией или химическим изменением. Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Есть реакции, когда вы принимаете лекарства, зажигаете спичку и вздыхаете. Вот 10 химических реакций в повседневной жизни. Это всего лишь небольшая выборка из тех примеров физических и химических явлений в жизни, которые вы видите и испытываете много раз каждый день:
Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Есть реакции, когда вы принимаете лекарства, зажигаете спичку и вздыхаете. Вот 10 химических реакций в повседневной жизни. Это всего лишь небольшая выборка из тех примеров физических и химических явлений в жизни, которые вы видите и испытываете много раз каждый день:
- Фотосинтез. Хлорофилл в листьях растений превращает углекислый газ и воду в глюкозу и кислород. Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
- Аэробное клеточное дыхание является реакцией с кислородом в человеческих клетках. Аэробное клеточное дыхание является противоположным процессом фотосинтеза. Разница заключается в том, что молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислый газ и воду.
 Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ.
Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ. - Анаэробное дыхание. Анаэробное дыхание производит вино и другие ферментированные продукты. Ваши мышечные клетки выполняют анаэробное дыхание, когда вы исчерпываете подаваемый кислород, например, при интенсивном или продолжительном упражнении. Анаэробное дыхание дрожжами и бактериями используется для ферментации для производства этанола, углекислого газа и других химических веществ, которые производят сыр, вино, пиво, йогурт, хлеб и многие другие распространенные продукты.
- Сгорание – это тип химической реакции. Это химическая реакция в повседневной жизни. Каждый раз, когда вы зажигаете спичку или свечу, разжигаете костер, вы видите реакцию горения. Сжигание объединяет энергетические молекулы с кислородом для получения двуокиси углерода и воды.
- Ржавчина – общая химическая реакция. Со временем железо развивает красное, шелушащееся покрытие, называемое ржавчиной. Это пример реакции окисления.
 Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра.
Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра. - Смешивание химических веществ вызывает химические реакции. Пекарский порошок и пищевая сода выполняют аналогичные функции при выпечке, но они по-разному реагируют на другие ингредиенты, поэтому вы не всегда можете заменить их на другой. Если вы комбинируете уксус и пищевую соду для химического «вулкана» или молока с порошком для выпечки в рецепте, вы испытываете реакцию двойного смещения или метатезиса (плюс некоторые другие). Ингредиенты рекомбинируют для получения газообразного диоксида углерода и воды. Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов.
- Батареи являются примерами электрохимии. Батареи используют электрохимические или окислительно-восстановительные реакции для превращения химической энергии в электрическую.
- Пищеварение. Тысячи химических реакций происходят во время пищеварения.
 Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника.
Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника. - Кислотно-базовые реакции. Всякий раз, когда вы смешиваете кислоту (например, уксус, лимонный сок, серную кислоту , соляную кислоту ) со щелочью (например, пищевой содой, мылом, аммиаком, ацетоном), вы выполняете кислотно-щелочную реакцию. Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + h3O.
- Мыло и моющие средства. Их очищают путем химических реакций. Мыло эмульгирует грязь, что означает, что масляные пятна связываются с мылом, чтобы их можно было снять водой.
 Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать.
Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать. - Химические реакции при приготовлении пищи. Кулинария – один большой практический эксперимент по химии. Приготовление использует тепло, чтобы вызвать химические изменения в пище. Например, когда вы сильно кипятите яйцо, сероводород, полученный нагреванием яичного белка, может реагировать с железом из яичного желтка, образуя серо-зеленое кольцо вокруг желтка. Когда вы готовите мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желательный вкус.
Другие примеры химических и физических явлений
Физические свойства описывают характеристики, которые не изменяют вещество. Например, вы можете изменить цвет бумаги, но это еще бумага. Вы можете кипятить воду, но когда вы собираете и конденсируете пар, это все еще вода. Вы можете определить массу листа бумаги, и это все еще бумага.
Химическими свойствами являются те, которые показывают, как вещество реагирует или не реагирует с другими веществами. Когда металлический натрий помещают в воду, он реагирует бурно, образуя гидроксид натрия и водород. Достаточное тепло выделяется тем, что водород вырывается в пламя, реагируя с кислородом в воздухе. С другой стороны, когда вы кладете кусок медного металла в воду, реакция не возникает. Таким образом, химическое свойство натрия заключается в том, что он реагирует с водой, а химическое свойство меди заключается в том, что это не так.
Когда металлический натрий помещают в воду, он реагирует бурно, образуя гидроксид натрия и водород. Достаточное тепло выделяется тем, что водород вырывается в пламя, реагируя с кислородом в воздухе. С другой стороны, когда вы кладете кусок медного металла в воду, реакция не возникает. Таким образом, химическое свойство натрия заключается в том, что он реагирует с водой, а химическое свойство меди заключается в том, что это не так.
Какие еще можно привести примеры химических явлений и физических? Химические реакции всегда происходят между электронами в валентных оболочках атомов элементов в периодической таблице. Физические явления на низких энергетических уровнях просто включают механические взаимодействия – случайные столкновения атомов без химических реакций, таких как атомы или молекулы газа. Когда энергии столкновений очень велики, целостность ядра атомов нарушается, что приводит к делению или слиянию вовлеченных видов. Спонтанный радиоактивный распад обычно считается физическим явлением.
Физические и химические явления Занятие 3 Содержание
Описание презентации Физические и химические явления Занятие 3 Содержание по слайдам
Физические и химические явления Занятие
Содержание Физические явления Примеры физических явлений Химические явления Примеры химических явлений Признаки химических реакций Условия возникновения и протекания химических реакций Проверим себя
Физические явления Состоят в изменении тел, при этом образование новых веществ не происходит При физических явлениях изменяются форма, агрегатное состояние
Дробление сахара Испарение воды Сгибание гвоздя Таяние мороженого Растворение сахара Нагревание вольфрамовой проволоки Проволока сплющивается
Химические явления (химические реакции) — это явления, при которых образуются новые вещества.
Протухание яйца Горение костра Ржавление гвоздя Смесь бертолетовой соли и фосфора взрывает от удара молотка Гасим соду уксусом
Признаки химических реакций • Выделение газа • Выпадение осадка • Появление запаха • Выделение или поглощение энергии • Изменение цвета
Условия возникновения и протекания химических реакций необходимое условие • Столкновение молекул иногда • Ультрафиолетовое облучение иногда • Нагревание иногда • Наличие катализатор а
Проверим себя: Из приведенных явлений выпишите те, которые относятся к химическим: 1. Сжатие пружины 2. Образование накипи при кипячении воды 3. Гниение растительных остатков 4. Ледоход на реке 5. Ковка металла 6. Горение спирта 7. Прокисание яблочного сока 8. Появление патины на медных и бронзовых памятниках 9. Растворение уксусной кислоты в воде 10. Обугливание лучинки 11. Замерзание воды 12. Прокисание молока 13. Горение природного газа 14. Образование инея
Прокисание молока 13. Горение природного газа 14. Образование инея
Из приведенных явлений выпишите физические: 1. Горение магния 2. Таяние льда 3. Почернение медной проволоки прокаливании 4. Плавление парафина 5. Переход газа в твёрдое состояние 6. Помутнение известковой воды при пропускании углекислого газа 7. Таяние снежинки 8. Гниение дерева 9. Растворение сахара в воде 10. Кипение воды 11. Подгорание пищи при жарении на сковородке 12. Горение лампочки 13. Испарение бензина 14. Возгорание спички
Часть 1. Физические явления. Поместите в фарфоровую чашечку кусочек льда и нагрейте. Что произошло со льдом? К каким явлениям следует отнести изменения льда при нагревании? Ответ обоснуйте. В ступке разотрите кусочек мела. Что произошло с мелом? К каким явлениям следует отнести изменение ? Изменилось ли вещество? Ответ обоснуйте. Поместите в небольшую фарфоровую чашечку небольшой кусочек парафина. Нагрейте. После расплавления парафина потушите пламя. Когда чашечка остынет, рассмотрите парафин. Что произошло с парафином? К каким явлениям следует отнести изменения при нагревании? Ответ обоснуйте. С помощью щипцов внесите тонкую стеклянную палочку в пламя спиртовки. Нагрейте посредине. После сильного накаливания его стекла попытайтесь трубочку согнуть или растянуть. Какое явление произошло со стеклянной трубочкой? Ответ обоснуйте.
Когда чашечка остынет, рассмотрите парафин. Что произошло с парафином? К каким явлениям следует отнести изменения при нагревании? Ответ обоснуйте. С помощью щипцов внесите тонкую стеклянную палочку в пламя спиртовки. Нагрейте посредине. После сильного накаливания его стекла попытайтесь трубочку согнуть или растянуть. Какое явление произошло со стеклянной трубочкой? Ответ обоснуйте.
Часть 2. Химические явления. В пробирку налить 2 мл мыльного раствора, а затем к нему добавить несколько капель уксусной кислоты. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. В пробирку налить 2 мл раствора уксусной кислоты, а затем опустить в нее кусочек мела. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. На свежий срез картофеля капнуть капельку раствора йода. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. В пробирку налить 2 мл молока, а затем добавить несколько капель лимонной кислоты и перемешать стеклянной палочкой. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. В пробирку налить 2 мл раствора крахмала, а затем добавить несколько капель йода. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. Внесите в пламя медную проволоку с помощью пробиркодержателя. Через 1 мин выньте из пламени прокаленную проволоку. Произошли ли изменения с медью? Образовалось ли новое вещество? Какое явление (физическое или химическое) наблюдаете? Обоснуйте свой выбор. Налейте в пробирку сначала 2 мл раствора сульфата меди (II) – Cu. SO 4, а потом 2 мл раствора гидроксида натрия – Na. OH. Что наблюдаете? Какое явление (физическое или химическое) наблюдаете? Обоснуйте свой выбор. Налейте в пробирку 2 мл пероксида водорода и добавьте 2 мл оксида марганца(4).
В пробирку налить 2 мл молока, а затем добавить несколько капель лимонной кислоты и перемешать стеклянной палочкой. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. В пробирку налить 2 мл раствора крахмала, а затем добавить несколько капель йода. Что наблюдали? Какие изменения произошли? Какое явление (физическое или химическое) наблюдаете? Образовалось ли новое вещество? Ответ обоснуйте. Внесите в пламя медную проволоку с помощью пробиркодержателя. Через 1 мин выньте из пламени прокаленную проволоку. Произошли ли изменения с медью? Образовалось ли новое вещество? Какое явление (физическое или химическое) наблюдаете? Обоснуйте свой выбор. Налейте в пробирку сначала 2 мл раствора сульфата меди (II) – Cu. SO 4, а потом 2 мл раствора гидроксида натрия – Na. OH. Что наблюдаете? Какое явление (физическое или химическое) наблюдаете? Обоснуйте свой выбор. Налейте в пробирку 2 мл пероксида водорода и добавьте 2 мл оксида марганца(4). Происходит бурное выделение газа. Опустите в пробирку тлеющую лучинку. Что наблюдали? Какой газ выделился? Признаки химической реакции?
Происходит бурное выделение газа. Опустите в пробирку тлеющую лучинку. Что наблюдали? Какой газ выделился? Признаки химической реакции?
Ответы | § 12. Явления физические и химические. Признаки химических реакций — Химия, 7 класс
1. Какие явления называются физическими? Приведите три примера физических явлений, которые вы можете наблюдать в повседневной жизни.
Физическими называются явления, при которых изменяется состояние вещества или внешняя форма физических тел.
Например, плавление металла, таяние льда, испарение воды.
2. Какие явления называются химическими? Как они называются иначе? Перечислите важнейшие признаки химических реакций.
Явления, при которых одни вещества превращаются в другие, называются химическим реакциями.
Признаки химических реакций: выделение газа, образование или исчезновение осадка, изменение цвета, появление запаха, излучение света, выделение или поглощение теплоты.
3.
 Приведите примеры химических реакций, протекающих в организме человека, в природе.
Приведите примеры химических реакций, протекающих в организме человека, в природе.В природе: ржавление железа, образование озона, фотосинтез.
В теле человека: дыхание (человек потребляет кислород, выделяет углекислый газ), жир превращается в углекислый газ и воду.
4. К каким явлениям — физическим или химическим относятся: а) испарение спирта; б) горение бензина; в) плавление сахара при нагревании; г) потемнение медной пластинки в пламени спиртовки; д) прокисание молока; е) гниение мяса?
Физические явление: испарение спирта, плавление сахара при нагревании.
Химические явления: горение бензина, потемнение медной пластинки в пламени спиртовки, прокисание молока, гниение мяса.
5. Опишите химические реакции, протекающие при нагревании малахита, горении магния, смешивании растворов медного купороса и соды.
При нагревании малахита наблюдается изменение цвета, при горении магния – изменение цвета, выделение теплоты, появление запаха. При смешивании растворов медного купороса и соды, выпадает осадок голубого цвета.
При смешивании растворов медного купороса и соды, выпадает осадок голубого цвета.
6. Какие условия необходимы для начала и осуществления химических реакций? Зачем перед началом реакции твердые вещества измельчают?
Главное необходимое условие для протекания реакций– это соприкосновение веществ. Но, некоторым может потребоваться нагревание, другим – освещение. Перед началом твердые вещества измельчают, чтобы увеличить площадь соприкосновения.
7. В каких случаях нагревание требуется только для начала реакций?
Деревянная лучинка, смесь железа и серы могу долгое время сохраняться при комнатной температуре, реакции начинаются только при нагревании.
8. Для удаления ржавчины с железных изделий их опускают в горячий водный раствор лимонной кислоты. Через некоторое время ржавчина исчезает, а жидкость окрашивается в желтый цвет. К каким явлениям — физическим или химическим — относится описанный процесс?
Эти признаки (исчезновение ржавчины, окрашивание жидкости в желтый цвет) свидетельствует о протекание химической реакции.
9. Какие признаки химических реакций наблюдаются при «извержении химического вулкана» — разложении одного из соединений хрома при нагревании (рис. 47)? Видеозапись данного опыта можно увидеть в Интернете, набрав в поисковике «Химический вулкан».
При таком явление можно наблюдать выделение газа, излучение света, выделение теплоты, изменение цвета.
Присоединяйтесь к Telegram-группе @superresheba_7, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Физические и химические явления
Физические и химические явления
Проводя опыты и наблюдения, мы убеждаемся, что вещества могут изменяться.
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении – в лед.
2. Длина
медных проводов изменяется
летом и зимой: увеличивается при нагревании
и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения, не образовалось.
Опыт
1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объем воздуха уменьшается, и вода входит в пробирку.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением. Запиши примеры в тетради.
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам
можно определить, что произошла химическая
реакция? При некоторых химических
реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного
вещества, изменение его вкуса, выделение
газа, выделение или поглощение тепла
и света.
Другие признаки – изменение цвета исходного
вещества, изменение его вкуса, выделение
газа, выделение или поглощение тепла
и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | Признак |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе
постоянно протекают различные химические
реакции. Наш с тобой организм тоже настоящая
фабрика химических превращений одних
веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
| Гашение соды уксусом |
Вывод. Выделение газа
– один из признаков химической реакции.
Выделение газа
– один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Помести в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавь к ним перекись водорода из домашней аптечки. Объясни, по какому признаку можно определить, что произошла химическая реакция.
3.5: Различия в физических и химических свойствах вещества
Цели обучения
Для отделения физических свойств от химических.
Все вещества обладают физическими и химическими свойствами. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическая собственность
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество.Из него можно формовать тонкие листы, это свойство называется пластичностью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. К физическим свойствам вещества относятся цвет, твердость, ковкость, растворимость, электропроводность, плотность, температура плавления и температура кипения.
Для элементов цвет не сильно отличается от одного элемента к другому.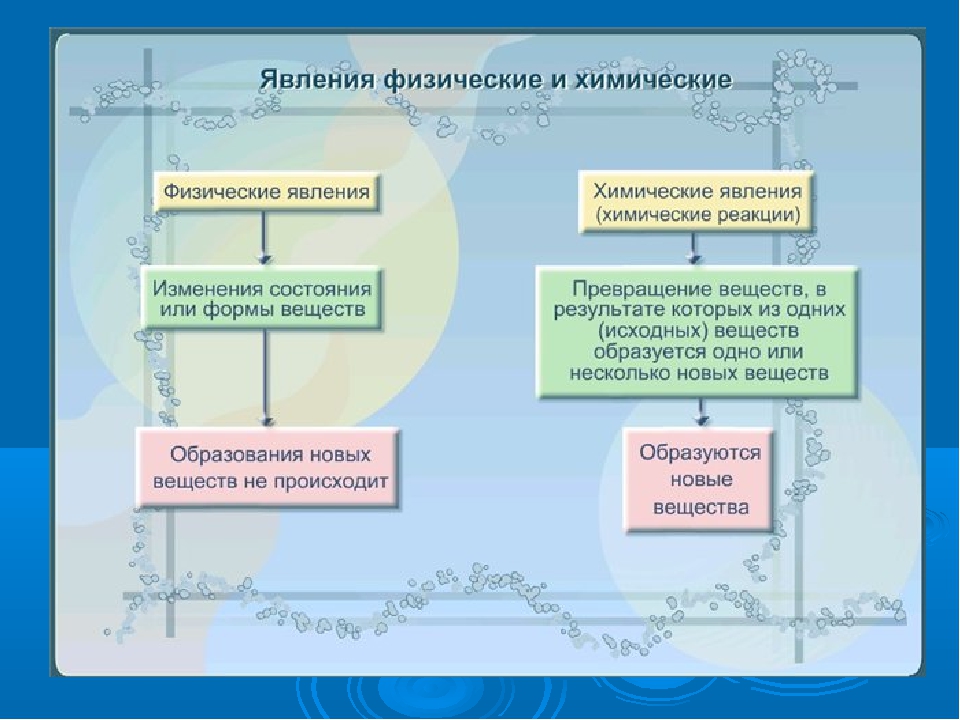 Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный.Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°С. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный.Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°С. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0. 922 922 |
| майонез | 0,910 |
| мед | 1,420 |
Твердость помогает определить, как можно использовать элемент (особенно металл). Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Рисунок \(\PageIndex{1}\): карандаш (слева) и кольцо с бриллиантом (справа). Оба являются формой углерода, но обладают очень разными физическими свойствами. Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывают его способность претерпевать некоторые химические изменения или реакции в силу своего состава.Присутствующие элементы, электроны и связи придают материи потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов, изучив химию в течение некоторого времени, вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы в целом обладают химическим свойством реагировать с кислотой.Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Рисунок \(\PageIndex{2}\): Сильная ржавчина на звеньях цепи возле моста Золотые Ворота в Сан-Франциско; он постоянно подвергался воздействию влаги и солевых брызг, что приводило к разрушению поверхности, растрескиванию и отслаиванию металла. (CC BY-SA 3.0; Marlith).
(CC BY-SA 3.0; Marlith).Химическим свойством железа является его способность соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия.Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физические свойства | Химические свойства |
|---|---|
Галлий металлический плавится при 30 o C. | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе.
- Плотность = 7.874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
Раствор
«Железо корродирует во влажном воздухе» — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответить
- в
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- точка плавления
- точка кипения
- плотность
- Ответить
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
1.3 Физические и химические свойства – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Определение свойств и изменений в материи как физических или химических
- Определите свойства материи как экстенсивные или интенсивные
Характеристики, отличающие одно вещество от другого, называются свойствами. Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Некоторые физические свойства, такие как плотность и цвет, можно наблюдать, не изменяя физического состояния вещества. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета).
Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Некоторые физические свойства, такие как плотность и цвет, можно наблюдать, не изменяя физического состояния вещества. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Фигура 1,18 (а) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Превращение одного типа материи в другой тип (или неспособность к изменению) является химическим свойством.Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Фигура
1. 19
а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает.(кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
19
а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает.(кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества.Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Фигура
1,20
а) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота.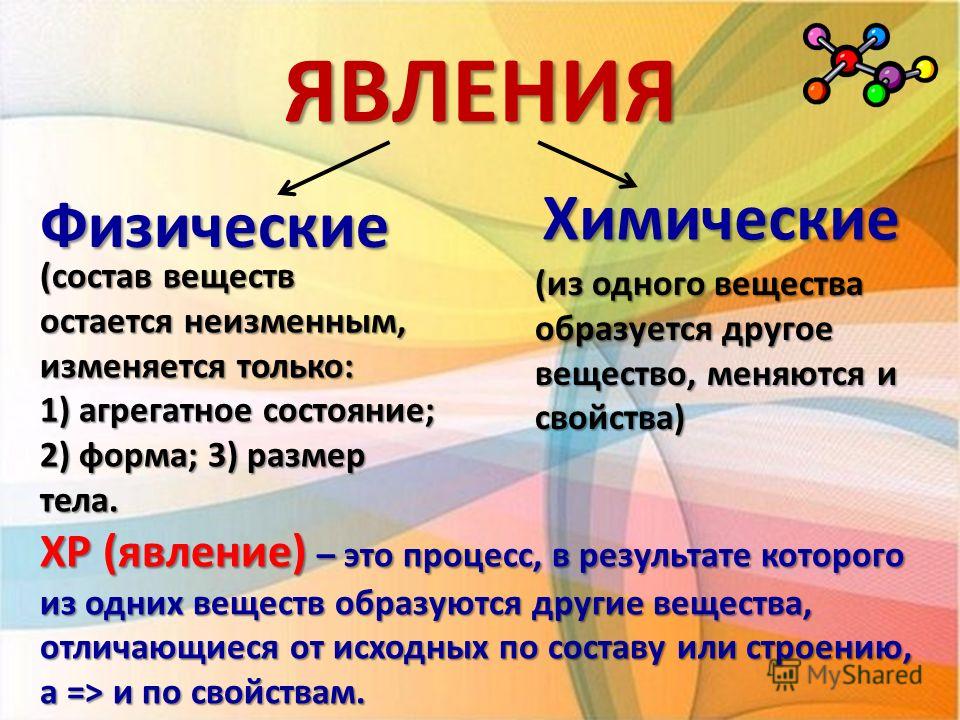 (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара.(c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
(b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара.(c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи попадают в одну из двух категорий. Если свойство зависит от количества присутствующей материи, это экстенсивное свойство.Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C.В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C.В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Химия в повседневной жизни
Опасный алмаз
Возможно, вы видели символ, показанный на рисунке 1.21 на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Фигура 1,21 Алмаз опасности Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ.Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы с промежуточной проводимостью).
Периодическая таблица — это таблица элементов, в которой элементы со схожими свойствами расположены близко друг к другу (рис. 1.22). Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Фигура
1,22
Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.
Chem4Kids.com: Материя: химические и физические изменения
Важно понимать разницу между химическими и физическими изменениями. Некоторые изменения очевидны, но есть несколько основных идей, которые вам следует знать. Физические изменения обычно связаны с физическим состоянием материи. Химические изменения происходят на молекулярном уровне, когда взаимодействуют две или более молекул. Химические изменения происходят, когда атомные связи разрываются или создаются во время химических реакций.
Когда вы наступаете на банку и раздавливаете ее, вы вызываете физическое изменение. Однако вы изменили только форму банки. Это не было изменением состояния материи, потому что энергия в банке не изменилась. Кроме того, поскольку это было физическое изменение, молекулы в банке остались теми же молекулами. Химические связи не создавались и не разрывались.
Когда вы растапливаете кубик льда (H 2 O), происходит физическое изменение, потому что вы добавляете энергии . Вы добавили достаточно энергии, чтобы вызвать фазовый переход из твердого состояния в жидкое.Физические действия, такие как изменение температуры или давления, могут вызывать физические изменения. Никаких химических изменений не произошло, когда вы растопили лед. Молекулы воды остаются молекулами воды.
Вы добавили достаточно энергии, чтобы вызвать фазовый переход из твердого состояния в жидкое.Физические действия, такие как изменение температуры или давления, могут вызывать физические изменения. Никаких химических изменений не произошло, когда вы растопили лед. Молекулы воды остаются молекулами воды.
Химические изменения происходят в гораздо меньших масштабах. В то время как некоторые эксперименты показывают очевидные химические изменения, такие как изменение цвета, большинство химических изменений не видны. Химическое превращение перекиси водорода (H 2 O 2 ) в воду невозможно увидеть, поскольку обе жидкости прозрачны.Однако за кулисами создаются и разрушаются миллиарды химических связей. В этом примере вы можете увидеть пузырьки газа кислорода (O 2 ). Эти пузырьки свидетельствуют о химических изменениях.
Плавление кубика сахара является физическим изменением, поскольку вещество по-прежнему остается сахаром. Сжигание кусочка сахара — это химическое изменение. Огонь активирует химическую реакцию между сахаром и кислородом. Кислород в воздухе вступает в реакцию с сахаром, и химические связи разрываются.
Огонь активирует химическую реакцию между сахаром и кислородом. Кислород в воздухе вступает в реакцию с сахаром, и химические связи разрываются.
Железо (Fe) ржавеет под воздействием газообразного кислорода воздуха.Вы можете наблюдать процесс, происходящий в течение длительного периода времени. Молекулы меняют свою структуру по мере того, как железо окисляется , в конечном итоге превращаясь в оксид железа (Fe 2 O 3 ). Ржавые трубы в заброшенных зданиях — реальные примеры процесса окисления.
Некоторые химические изменения очень малы и происходят в несколько этапов. Полученные соединения могут иметь одинаковое количество атомов, но они будут иметь другую структуру или комбинацию атомов. Сахара глюкоза, галактоза и фруктоза имеют шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода (C 6 H 12 O 6 ). Несмотря на то, что они состоят из одних и тех же атомов, они имеют очень разную форму и называются изомерами . Изомеры имеют атомы, связанные в разном порядке.
Изомеры имеют атомы, связанные в разном порядке.
Каждый из сахаров проходит различные химические реакции из-за различий в их молекулярной структуре. Ученые говорят, что расположение атомов обеспечивает высокую степень специфичности , особенно в молекулах живых существ.Специфичность означает, что молекулы будут работать только в определенных реакциях, а не во всех. Например, ваше тело использует глюкозы в качестве источника энергии. Если вы едите молекулы галактозы, они должны быть преобразованы в глюкозу, прежде чем ваше тело сможет их использовать.
Рецепты для химиков (видео NASA/NASA Connect)
Физические и химические свойства вещества | Химия
1.5: Физические и химические свойства вещества 90 199
Характеристики, которые позволяют нам отличить одно вещество от другого, называются свойствами.
Физические свойства вещества
Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи.Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.
Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи.Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.
Физическое изменение – это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (тождественности веществ, содержащихся в материи). Мы наблюдаем физическое изменение, когда, например, воск плавится, сахар растворяется в кофе, а пар конденсируется в жидкую воду. Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок.В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Химические свойства вещества
Превращение одного типа материи в другой тип (или неспособность к изменению) является химическим свойством. Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется.Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения), созревание фруктов и приготовление, переваривание или гниение пищи.
Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения), созревание фруктов и приготовление, переваривание или гниение пищи.
Этот текст взят из Openstax, Chemistry 2e, Section 1.3: Physical and Chemical Properties.
6 полезных примеров физических и химических изменений
На уроках естествознания вы, возможно, слышали о химических и физических изменениях.Но знаете ли вы, как определить разницу между ними? Ответ заключается в том, приводит ли изменение вещества к перестройке его молекул.
В этой статье мы определим химические и физические изменения. Затем мы рассмотрим конкретные примеры химических и физических изменений, чтобы лучше понять их различия и сходства.
Итак, приступим!
Когда мороженое тает (и переходит из твердого состояния в жидкое), оно претерпевает физические изменения.
Определение физических изменений
Во-первых, давайте поговорим о физических изменениях в химии. Физическое изменение происходит, когда вещество или объект меняет свой внешний вид, фазу или используется в смеси. Что еще более важно, физическое изменение не меняет молекулярной структуры вещества . И вы можете отменить физическое изменение, чтобы восстановить весь исходный материал, даже если он не выглядит точно таким же. Другими словами, при физических изменениях молекулы до и после изменения остаются прежними!
Что является примером физического изменения? Такие вещи, как разрезание листа бумаги пополам, превращение воды в лед или сгибание любимых маминых столовых приборов (не делайте этого!) — все это физические изменения.Это потому, что физические изменения влияют только на физические свойства вещества, а не на состав его молекул.
Все еще не знаете, что представляет собой физическое изменение? Не волнуйтесь: через минуту мы рассмотрим другие примеры физических изменений.
При горении бревна претерпевают химические изменения.
Химическое изменение Определение
Напротив, химическое изменение происходит, когда молекулы исходного вещества разбираются на части и снова собираются в новые комбинации , которые отличаются от первоначальных комбинаций.Кроме того, исходный материал не может быть восстановлен. И в отличие от физических изменений, эти изменения обычно требуют гораздо больше энергии, такой как тепло и свет, потому что молекулярные связи должны быть разорваны, чтобы перестроить их.
Что же является примером химического изменения? Некоторые примеры химических изменений включают горящий лист бумаги, ржавчину гвоздя или выпечку пирога. Как и в случае с физическими изменениями, совершенно очевидно, что эти вещи начинаются и заканчиваются совершенно по-разному: блестящий гвоздь становится оранжевым от ржавчины, а влажное тесто становится вкусным десертом.Причина, по которой это химические изменения, заключается в том, что изменение происходит на молекулярном уровне. Иными словами, объект, с которого вы начинаете, и объект, которым вы заканчиваете, — совершенно разные вещества.
Иными словами, объект, с которого вы начинаете, и объект, которым вы заканчиваете, — совершенно разные вещества.
Итак, давайте рассмотрим еще несколько примеров физических и химических изменений, чтобы лучше понять различия и сходства между ними.
Когда этот молоток ударит по яйцу, яйцо подвергнется (очень грязному) физическому изменению.(P.S. Не пытайтесь повторить это дома!)
Примеры физических изменений
Ранее мы говорили о некоторых примерах физических и химических изменений. Но иногда бывает трудно отличить физическое изменение от химического. Это особенно верно, когда физические изменения требуют или расходуют энергию. Важно помнить, что при физическом изменении молекулы остаются прежними .
Давайте рассмотрим три различных примера физических изменений, чтобы лучше понять эту идею.
Пример 1: фазовые переходы
youtube.com/embed/W8CTuj78RbY» xml=»lang»/>
Фазовые изменения включают изменения размера, объема и плотности. Например, когда вы превращаете воду в лед или пар, это называется фазовым переходом. Это связано с тем, что вода имеет 3 фазы : твердая (лед), жидкая (вода) и газообразная (пар или пар).
Может показаться, что часть молекул воды теряется при каждом фазовом переходе: кубик льда становится меньше, а пар словно растворяется в воздухе.Однако на каждой из этих трех стадий молекулы воды остаются неизменными. А если охладить пар, он превратится в воду. Охладите его достаточно, и он снова превратится в лед. В кубике льда будет такое же количество атомов водорода и кислорода, как и в паре, , и эти атомы будут оставаться в одной и той же молекулярной форме на всех стадиях.
Давайте подробнее рассмотрим, что происходит на молекулярном уровне. Пар состоит из h30, как и кубик льда.Единственная разница между паром и льдом состоит в том, что отдельные молекулы пара расходятся в стороны из-за приложения тепла. Между тем во льду молекулы группируются ближе друг к другу из-за отсутствия тепла. Хотя эти фазовые превращения требуют выделения энергии (экзотермические реакции) или применения (эндотермические реакции), число атомов и форма молекул в веществе остаются теми же . Вот что делает это физическим изменением!
Между тем во льду молекулы группируются ближе друг к другу из-за отсутствия тепла. Хотя эти фазовые превращения требуют выделения энергии (экзотермические реакции) или применения (эндотермические реакции), число атомов и форма молекул в веществе остаются теми же . Вот что делает это физическим изменением!
Пример 2: Изменения размера и формы
через GIPHY
Как мы упоминали ранее, физические изменения зависят от того, остаются ли молекулы неизменными или нет. Когда объект подвергается физическому изменению, он может стать другого размера и формы, если его состав остается прежним.
Вот что мы имеем в виду: если вы когда-нибудь уронили на пол кусок стекла, вы знаете, что оно разобьется на миллион осколков. Если бы вы действительно захотели, после того, как вы смели все это стекло в совок, вы, вероятно, могли бы собрать его обратно (хотя это заняло бы много времени и терпения). Это тоже физическая реакция, потому что стекло остается стеклом. Когда оно разбивается, стекло меняет размер и форму, но его молекулы не меняются.
Когда оно разбивается, стекло меняет размер и форму, но его молекулы не меняются.
Это физическое изменение, которое включает только изменение размера и формы. В то время как энергия помогла разбить стекло на куски, энергия не использовалась для перегруппировки молекул .
Пример 3: Смеси и растворы
Представьте, что вы проводите день на пляже. Светит солнце, песок теплый, а чайки пытаются украсть у людей обед.Поиграв немного с волнами, вы решаете построить замок из песка. Вы наполняете ведро песком и переворачиваете его вверх дном. Песок выходит, но не слипается. Вы забыли добавить воду! Вы пытаетесь снова, на этот раз с водой, и вуаля, вы создали свою первую башню, как мастер-архитектор замка из песка.
Но почему песок с первого раза не слипся? Это связано с физическим свойством, называемым поверхностным натяжением. Поверхностное натяжение показывает, насколько прочна связь между молекулами вещества. Вода имеет сильное поверхностное натяжение, поэтому добавление ее к песку создает достаточно прочную связь, чтобы песок сцеплялся, а не распадался.
Это отличается от химической реакции тем, что песок и вода, хотя и смешиваются вместе, не меняют своей молекулярной структуры. Вода остается водой, а песок остается песком . И если вы измерите количество воды, которая в конечном итоге испарится после высыхания замка из песка, вы обнаружите, что количество испарившейся воды равно количеству жидкой воды, которую вы изначально добавили в песок.
Это называется смесью , потому что оба вещества (песок и вода) сохраняют свои физические свойства.
То же самое верно, если вы добавите в воду соль или сахар. Кажется, что соль и сахар растворяются и образуют новые молекулы. Но если бы вы дождались испарения воды, вы бы обнаружили, что молекулы соли или сахара остаются в стакане. Это называется решением .
Кажется, что соль и сахар растворяются и образуют новые молекулы. Но если бы вы дождались испарения воды, вы бы обнаружили, что молекулы соли или сахара остаются в стакане. Это называется решением .
Растворы отличаются от смесей тем, что они гомогенны .В одной капле соленой воды будет такое же количество молекул соли (NaCl) на молекулу воды (h3O), что и в другой капле того же раствора. В смеси у вас может быть больше песка, чем воды в двух разных горстях, даже если они взяты из одного ведра.
Эти примеры физических изменений должны помочь вам понять разницу между физическими и химическими изменениями. Особенно, если сравнить их с приведенными ниже примерами химических изменений.
Тесто, превращающееся в хлеб, — вкусный пример химического превращения.
Примеры химических изменений
Как физические, так и химические изменения приводят к тому, что одно превращается в другое. Будь то разбитие стекла или сжигание листа бумаги, исходный предмет становится другим.
Будь то разбитие стекла или сжигание листа бумаги, исходный предмет становится другим.
Так как же отличить физическое изменение от химического? Все сводится, как вы уже догадались, к молекулам. При физическом изменении молекулы остаются точно такими же на протяжении всего преобразования. Однако при химическом изменении трансформируются сами молекулы!
Вот три примера химических изменений, которые помогут вам увидеть разницу!
Пример 1: сжигание
Горение — это химическая реакция между веществами, обычно включающая кислород, в результате которой выделяется тепло и свет. Энергия, высвобождаемая в результате реакции (в виде тепла и света), обусловлена разрывом молекулярных связей. В результате исходные вещества превращаются в совершенно другие вещества из-за перегруппировки молекул, что является примером химического изменения!
В результате исходные вещества превращаются в совершенно другие вещества из-за перегруппировки молекул, что является примером химического изменения!
Например, если вы смешаете кислород (O2) с типом углеводорода, называемым метаном (Ch5), молекулярные связи обоих веществ разорвутся, что создаст тепло и свет. Затем связи восстанавливаются, образуя две 90 347 различных 90 348 молекул: двуокись углерода (CO2) и воду (h3O).
Реакции горения тоже могут протекать с разной скоростью .Примером медленной реакции является горящая спичка. Быстрой реакцией был бы взрыв динамита. Количество энергии, выделяемой при любой реакции горения, зависит от того, сколько энергии необходимо для разрыва молекулярных связей. Чем труднее разорвать связи, тем больше энергии высвобождается в целом. Но независимо от того, быстрая реакция или медленная, горение представляет собой химическое изменение.
Пример 2: Разложение
youtube.com/embed/1ocQhkHw_MM» xml=»lang»/>
Разложение довольно простое. Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества.
Например, когда электрический ток пропускают через воду (h3O), она может разлагаться на водород и кислород или h3 + O2. В этом примере вода разбита на два элемента. Результатом является химическое изменение, потому что начальная и конечная молекулы различны.
Вы заметите, что для этой химической реакции требуется электричество. Реакции разложения обычно требуют применения тепла из внешнего источника , что делает эту реакцию эндотермической.
Имейте в виду, что не все реакции разложения должны распадаться на их элементарные формы. Более сложные вещества с более длинными молекулярными цепями могут распадаться на более мелкие соединения вместо элементов. Примером этого является воздействие тепла на 2Fe(OH)3 (также известный как оксид железа). Вместо того, чтобы распадаться на отдельные молекулы, он превращается в два соединения: Fe2O3 + 3h3O.
Вместо того, чтобы распадаться на отдельные молекулы, он превращается в два соединения: Fe2O3 + 3h3O.
Пример 3: Комбинация
Реакции соединения, также называемые реакциями синтеза, противоположны реакциям разложения . Эти реакции происходят, когда два вещества (называемые реагентами ) добавляются вместе для создания одного нового вещества . И поскольку это химическая реакция, результатом являются молекулярные изменения!
Одним из примеров этого может быть ржавчина гвоздя.Хотя это может показаться реакцией разложения, потому что кажется, что ноготь разлагается и разваливается. Но на самом деле это химическое изменение! Железо (Fe) и кислород (O) объединяются, образуя сложный оксид железа (Fe2O3), представляющий собой ржавчину. И, как видите, в результате получается совершенно новая молекула.
И, как видите, в результате получается совершенно новая молекула.
Что дальше?
Понимание химических и физических реакций только в части того, что вам нужно знать , чтобы успешно сдать экзамен AP по химии.Мы собрали самые важные темы AP Chem в этом всеобъемлющем руководстве.
Вместо этого брать IB Chemistry? Вот полная программа IB Chemistry, подробное учебное пособие и несколько примеров прошлых работ с экзамена IB Chemistry.
Нужна помощь в понимании других понятий химии? Узнайте, как сбалансировать химические уравнения шаг за шагом, каковы 11 правил растворимости и когда вам нужно использовать константу растворимости (K sp ).
Что такое физическая химия? — Определение и примеры — Видео и стенограмма урока
Дополнительные примечания
Идентификация элементов
Энергия, ударяющая атомы, может заставить их электроны прыгать с одного энергетического уровня на более высокий. Энергия, которую они поглощают, различна для каждого элемента, что-то вроде отпечатка пальца, по которому можно идентифицировать элементы, содержащиеся в веществе. Когда электрон падает обратно на свой первоначальный уровень, он излучает энергию, которая также характерна для элементов. Энергия, используемая для этих переходов, может быть пламенем, пучком электронов или электромагнитным излучением (светом). Здесь задействован раздел физической химии спектроскопия , а используемые приборы спектрофотометры .
Энергия, которую они поглощают, различна для каждого элемента, что-то вроде отпечатка пальца, по которому можно идентифицировать элементы, содержащиеся в веществе. Когда электрон падает обратно на свой первоначальный уровень, он излучает энергию, которая также характерна для элементов. Энергия, используемая для этих переходов, может быть пламенем, пучком электронов или электромагнитным излучением (светом). Здесь задействован раздел физической химии спектроскопия , а используемые приборы спектрофотометры .
Теплообмен
В химических реакциях теплота может передаваться в вещество или из него. Термохимия говорит нам, выделяет ли реакция тепло, как при сжигании дерева, или же она поглощает тепло, как химические холодные компрессы, используемые при травмах. Когда реакция выделяет тепло, ее называют экзотермической, а когда реакция поглощает тепло, ее называют эндотермической. Практические применения включают кондиционирование воздуха и отопление домов.
Насколько быстро протекает реакция
Область кинетики имеет дело со скоростями реакций.Они могут происходить за фемтосекунды (0,000000000000001 секунды) или за миллионы лет. Чтобы узнать скорость реакции, мы используем константу скорости реакции.
Электрохимия
Одним из практических применений электрохимии является гальваническое покрытие, при котором дорогой металл может быть нанесен на другой менее дорогой металл. Металлы также могут быть нанесены гальваническим способом на пластик или стекло. Батареи используют электрохимические процессы для разрыва связей и высвобождения содержащейся энергии в виде электричества.
Заполните поля
1. Археолог находит предмет и хочет узнать его состав. Раздел физической химии, который они должны использовать, это _____. Инструмент, который они могут использовать, это _____
2. Чтобы знать, как быстро происходит реакция, ученому необходимо знать _____ _____. Раздел физической химии, в котором используются скорости реакции, называется _____.
3. Фотосинтез – это процесс поглощения энергии. Этот процесс является примером _____ реакции.Раздел физической химии, связанный с переносом тепла, называется _____.
ответов
1. спектроскопия; спектрофотометры.
2. кинетика; постоянная скорость.
3. эндотермические; термохимия.
1.3 Физические и химические свойства – CHEM 1114 – Введение в химию
Цели обучения
К концу этого раздела вы сможете:
- Определение свойств и изменений в материи как физических или химических
- Определите свойства материи как экстенсивные или интенсивные
Напомним, что химия изучает материю, ее свойства, изменения, которые претерпевает материя, и энергию, связанную с этими изменениями.В этой главе мы более подробно рассмотрим материю и энергию и то, как они связаны.
При изменении вещества процесс часто сопровождается изменением энергии — тепла, света, звука, кинетической энергии движущегося вещества и т. д. Если при изменении выделяется (выделяется) теплота, то изменение экзотермическое . Если необходимо подать тепло, изменение эндотермическое .
д. Если при изменении выделяется (выделяется) теплота, то изменение экзотермическое . Если необходимо подать тепло, изменение эндотермическое .
Важным отличием является то, что тепло — это энергия, которая течет из-за разницы температур, а температура — это мера средней кинетической энергии молекул в веществе.Чем быстрее они двигаются, тем «горячее».
Характеристики, которые позволяют нам отличить одно вещество от другого, называются свойствами. Физическое свойство — характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи.Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния (рисунок 1) или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи), таких как растворение и разбавление.
Физическое изменение — это изменение состояния (рисунок 1) или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи), таких как растворение и разбавление.
Мы наблюдаем физические изменения, когда воск плавится, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 2).Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок 2. (a) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду.(кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
(b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду.(кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)Превращение одного типа материи в другой тип (или невозможность изменения) относится к химическому веществу . свойство . Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 3). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рис. 3. (а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons) Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 4).
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, реакция меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 4).
 (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
(c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)Пример 1
Классифицируйте каждое из следующих свойств как физическое или химическое:
a) Температура кипения воды 100 o C
b) Кислород представляет собой газ
c) Сахар сбраживается с образованием спирта
Решение
а) Хотя это свойство описывает изменение, это изменение не влечет за собой изменение существа.H 2 O остается H 2 O независимо от того, в каком состоянии он находится. Таким образом, это физическое свойство.
b) Это неотъемлемое свойство и, следовательно, физическое свойство.
c) Это свойство связано с изменением вещества с сахара на спирт. Это химическое свойство.
Проверь себя
Классифицируйте каждое из следующих свойств как физическое или химическое:
a) Эта страница белая b) Сгорает на дереве c) Молоко свертывается, если его не указать
Ответы
а) физическое свойство б) химическое свойство в) химическое свойство
Свойства материи попадают в одну из двух категорий.Если свойство зависит от количества присутствующей материи, то это экстенсивное свойство . Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца материи не зависит от количества присутствующей материи, то это интенсивное свойство . Температура является примером интенсивного свойства.Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Температура является примером интенсивного свойства.Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Пример 2
Классифицируйте каждое из следующих явлений как физическое или химическое изменение:
a) Конденсация пара на зеркале в душе
b) Железообразующая ржавчина
c) Таблетка антацида шипит при контакте с желудочной кислотой
d) Соль растворяется в воде
Решение
а) Пар представляет собой водяной пар, и когда он конденсируется, он образует жидкую воду на зеркале.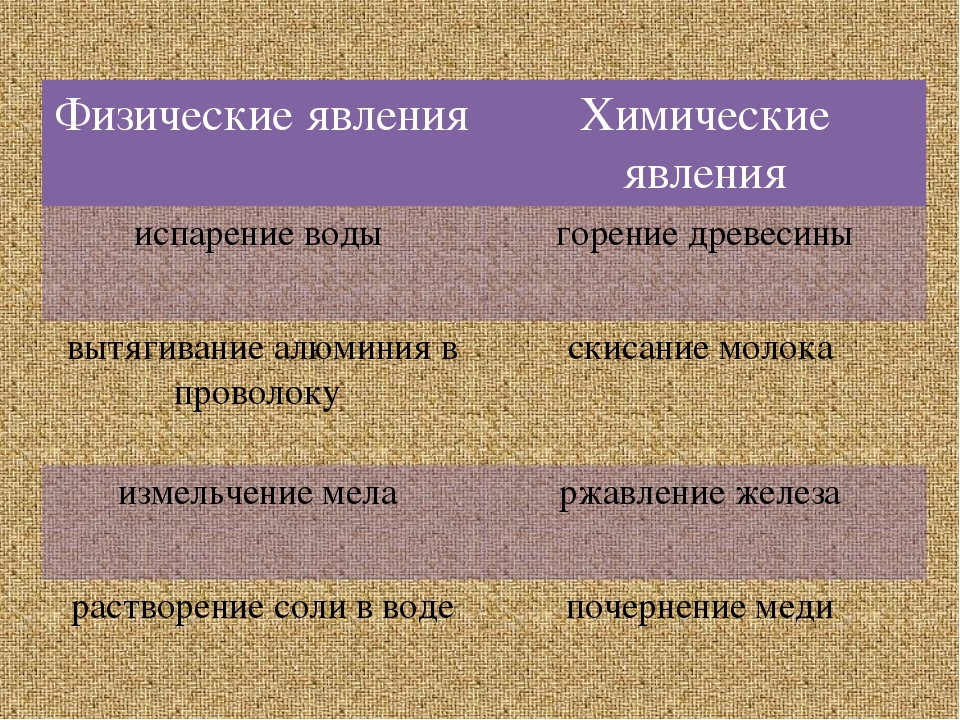
Это физическое изменение.
б) Железо реагирует с кислородом воздуха, образуя оксид железа, который представляет собой ржавчину.
Это химическое изменение.
c) Шипение воды – это выделение углекислого газа при контакте с кислотой. Это химическое изменение.
d) Растворение считается физическим изменением. Хотя связи соли при растворении разрываются, они не образуют новых связей или нового вещества. Если выпарить воду, останется соль.
Проверь себя
Классифицируйте каждое из следующих явлений как физическое или химическое изменение:
а) резиновая лента растягивается, когда вы ее тянете
б) ацетон удаляет лак для ногтей
в) медь плавится при высоких температурах
г) серебряный металл тускнеет со временем
Ответы
а) физическое изменение б) физическое изменение (растворение)
в) физическое изменение г) химическое изменение
Пример 3
Опишите каждый процесс как физическое или химическое изменение.
а) Вода в воздухе превращается в снег.
б) Человеку стригут волосы.
c) Тесто для хлеба превращается в свежий хлеб в духовке.
Раствор
а) Поскольку вода переходит из газообразной фазы в твердую, это физическое изменение.
б) Ваши длинные волосы укорачиваются. Это физическое изменение.
c) Из-за температуры печи в тесте для хлеба происходят химические изменения, в результате чего получается свежий хлеб.Это химические изменения. (На самом деле во многих процессах приготовления пищи происходят химические изменения.)
Проверь себя
Определите каждый процесс как физическое или химическое изменение.
а) В камине бушует огонь.
б) Вода нагревается для приготовления чашки кофе.
Ответы
а) химическое изменение б) физическое изменение
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 5, на контейнерах с химическими веществами в лаборатории или на рабочем месте.Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
5, на контейнерах с химическими веществами в лаборатории или на рабочем месте.Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ.Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее.Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее.Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Разложение воды/производство водорода
Вода состоит из элементов водорода и кислорода, соединенных в соотношении 2 к 1. Вода может подвергаться химическому изменению, в ходе которого молекулы воды расщепляются на водород и кислородные газы за счет добавления энергии. Один из способов сделать это — использовать батарею или блок питания, как показано на (Рисунок 6).
Рис. 6. Разложение воды показано на макроскопическом, микроскопическом и символическом уровнях. Батарея обеспечивает электрический ток (микроскопический), который разлагает воду. На макроскопическом уровне жидкость разделяется на газы водород (слева) и кислород (справа). Символически это изменение представлено, показывая, как жидкий H 2 O разделяется на газы H 2 и O 2 .
Символически это изменение представлено, показывая, как жидкий H 2 O разделяется на газы H 2 и O 2 .Расщепление воды включает перегруппировку атомов в молекулах воды в разные молекулы, каждая из которых состоит из двух атомов водорода и двух атомов кислорода соответственно.Две молекулы воды образуют одну молекулу кислорода и две молекулы водорода. Представление того, что происходит, [латекс]2\текст{H}_2\текст{O}(l) \rightarrow 2\text{H}_2(g) + \text{O}_2(g)[/latex] , будут более подробно рассмотрены в следующих главах.
Два образующихся газа имеют совершенно разные свойства. Кислород не воспламеняется, но необходим для сгорания топлива, а водород легко воспламеняется и является мощным источником энергии. Как эти знания можно применить в нашем мире? Одно приложение включает исследования в области более экономичного транспорта.Автомобили на топливных элементах (FCV) работают на водороде вместо бензина (рис. 7). Они более эффективны, чем автомобили с двигателями внутреннего сгорания, не загрязняют окружающую среду и сокращают выбросы парниковых газов, что делает нас менее зависимыми от ископаемого топлива. Однако FCV еще не являются экономически жизнеспособными, и текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производства водорода другим экологически безопасным способом, FCV могут стать способом будущего.
Однако FCV еще не являются экономически жизнеспособными, и текущее производство водорода зависит от природного газа. Если мы сможем разработать процесс экономичного разложения воды или производства водорода другим экологически безопасным способом, FCV могут стать способом будущего.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы со сходными свойствами расположены близко друг к другу (рис. 6). Вы узнаете больше о периодической таблице, когда продолжите изучение химии.
Рисунок 6. Периодическая таблица показывает, как элементы могут быть сгруппированы в соответствии с некоторыми сходными свойствами. Обратите внимание, что цвет фона обозначает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли он твердым, жидким или газообразным.Ключевые понятия и резюме
Все вещества обладают различными физическими и химическими свойствами и могут подвергаться физическим или химическим изменениям. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не связаны с изменением состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, связаны с образованием вещества, отличного от того, что было ранее.
Измеряемые свойства попадают в одну из двух категорий.Экстенсивные свойства зависят от количества присутствующего вещества, например, массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотность золота. Теплота — пример экстенсивного свойства, а температура — пример интенсивного свойства.
Упражнения
1. Классифицируйте каждое из следующих изменений как физическое или химическое:
а) конденсация пара
б) сжигание бензина
в) сквашивание молока
г) растворение сахара в воде
д) плавка золота
2.Объем образца газообразного кислорода изменялся с 10 мл до 11 мл при изменении температуры. Это химическое или физическое изменение?
3. Объясните разницу между экстенсивными и интенсивными свойствами.
4. Плотность (d) вещества – интенсивное свойство, определяемое как отношение его массы (m) к его объему (V).
[латекс]\text{плотность}= \frac{\text{масса}}{\text{объем}}[/latex] [латекс]\text{d} = \frac{\text{m}}{\ текст{V}}[/латекс]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
5. Представляет ли каждое утверждение физическое или химическое свойство?
а) Сера имеет желтый цвет.
b) Стальная вата горит при воспламенении от пламени.
c) Галлон молока весит более восьми фунтов.
6. Представляет ли каждое утверждение физическое или химическое свойство?
а) Куча листьев медленно гниет на заднем дворе.
b) В присутствии кислорода водород может взаимодействовать с образованием воды.
c) Золото можно растянуть в очень тонкую проволоку.
7. Представляет ли каждое утверждение физическое или химическое изменение?
а) Вода закипает и превращается в пар.
b) Пища преобразуется в пригодную для употребления форму пищеварительной системой.
c) Спирт во многих термометрах замерзает при температуре около -40 градусов по Фаренгейту.
8. Представляет ли каждое утверждение физическое или химическое изменение?
а) Графит, форма элементарного углерода, может быть превращен в алмаз, другую форму углерода, при очень высоких температурах и давлениях.
b) Элементы натрия и хлора объединяются, чтобы создать новое вещество, называемое хлоридом натрия.
Ответы
1. а) физические; б) химический; в) химический; г) физические; д) физический
2. физический
3. Ценность экстенсивного свойства зависит от количества рассматриваемой материи, тогда как ценность интенсивного свойства одна и та же независимо от рассматриваемого количества материи.
4.Будучи экстенсивными свойствами, и масса, и объем прямо пропорциональны количеству изучаемого вещества. Деление одного экстенсивного свойства на другое фактически «отменит» эту зависимость от количества, дав отношение, не зависящее от количества (интенсивное свойство).
5. а) физическое свойство б) химическое свойство в) физическое свойство
6. а) химическое свойство б) химическое свойство в) физическое свойство
7. а) физическое изменение б) химическое изменение в) физическое изменение
8. а) физическое изменение б) химическое изменение
а) физическое изменение б) химическое изменение
химическое изменение: изменение, приводящее к образованию вещества, отличного от исходного вида вещества
химическое свойство: поведение, связанное с превращением одного вида материи в другую материю
эндотермический: если необходимо подать тепло, чтобы произошло изменение
энергия: способность совершать «работу», то есть сила воздействовать на что-то и толкать на некоторое расстояние
экзотермический: , если при изменении выделяется тепло
экстенсивное свойство: свойство вещества, которое зависит от количества вещества
интенсивное свойство: свойство вещества, которое не зависит от количества вещества
физическое изменение: изменение состояния или свойств материи, не связанное с изменением ее химического состава
физическое свойство: характеристика вещества, не связанная с каким-либо изменением его химического состава
.

 (горение)
(горение)

 Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ.
Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ. Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра.
Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра..PNG) Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника.
Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника.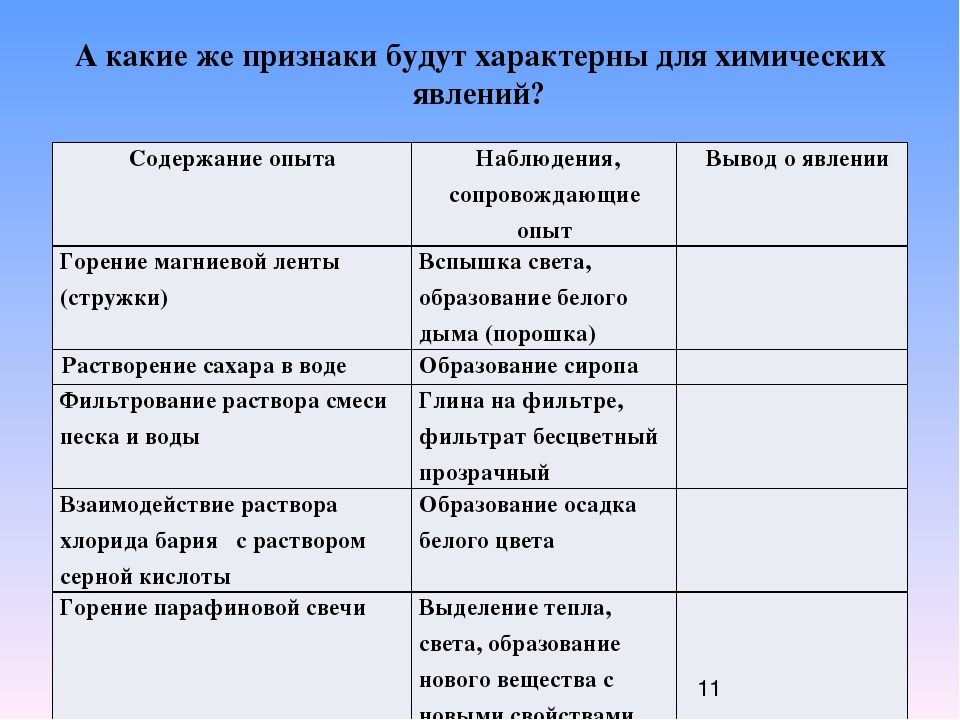 Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать.
Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать.