Основной оксид — это… Что такое Основной оксид?
- Основной оксид
Осно́вные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся:
Металлы в основных оксидах обычно проявляют валентность I и II.
Характерные реакции
- СаO + H2O = Са(OH)2
- Основные оксиды взаимодействуют с кислотами, образуя соотвествующие соли:
- CaO + 2HCl = CaCl2 + H2O
- Na2O + CO2 = Na2CO3
- Li2O+Al2O3 = 2LiAlO2
Все основные оксиды
См. также
Ссылки
Оксиды.
- Основной капитал
- Основной тензор
Смотреть что такое «Основной оксид» в других словарях:
основной оксид — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN basic oxide … Справочник технического переводчика
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
Оксид свинца(II) — Общие … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид хрома(III) — Оксид хрома(III) … Википедия
dic.academic.ru
Ответы@Mail.Ru: что такое основные оксиды
Это такие оксиды, которым соответствуют какие-нибудь основаноия. Например СаО, которому соответствует Са (ОН) 2. Основные оксиды образуются только металлами.
Осно́вные оксиды – оксиды, образующие соли и воду при взаимодействии с кислотами или кислотными оксидами. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra оксиды металлов переходных элементов в низших степенях окисления Все основные оксиды: Оксид лития Li2O; Оксид натрия Na2O; Оксид калия K2O; Оксид серебра Ag2O; Оксид магния MgO; Оксид кальция CaO; Оксид стронция SrO; Оксид бария BaO; Оксид ртути HgO; Оксид марганца (II) MnO; Оксид железа (III) Fe2O3; Оксид хрома (II) CrO; Оксид никеля NiO; Оксид франция Fr2O; Оксид цезия Cs2O; Оксид рубидия Rb2O; Оксид меди CuO.
Основные оксиды — это оксиды, которвм соответствует свое основание. Они образуются только с неметаллами, имеющими маленькую степень окисления (+1, +2): CaO — Ca(OH)2 (оксиду кальция соответствует гидроксид кальция) BaO — Ba(OH)2 (оксиду бария соответствует гидроксид бария) K2O — KOH (оксиду калия соответствует гидроксид калия)
Осно́вные оксиды – оксиды, образующие соли и воду при взаимодействии с кислотами или кислотными оксидами. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra оксиды металлов переходных элементов в низших степенях окисления Все основные оксиды: Оксид лития Li2O; Оксид натрия Na2O; Оксид калия K2O; Оксид серебра Ag2O; Оксид магния MgO; Оксид кальция CaO; Оксид стронция SrO; Оксид бария BaO; Оксид ртути HgO; Оксид марганца (II) MnO; Оксид железа (III) Fe2O3; Оксид хрома (II) CrO; Оксид никеля NiO; Оксид франция Fr2O; Оксид цезия Cs2O; Оксид рубидия Rb2O; Оксид меди CuO.
Посмотрите во тут: <a rel=»nofollow» href=»https://youtu.be/TcwvbllpHgk» target=»_blank»>https://youtu.be/TcwvbllpHgk</a>
НОРМ СУКА Г А Н Дtouch.otvet.mail.ru
Ответы@Mail.Ru: основные оксиды это
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие: K2O (окись калия) , CaO (окись кальция) , FeO (окись железа 2-валентного) . 1. Взаимодействие с водой с образованием основания (или щёлочи) : CaO+h3O = Ca(OH)2 2. Взаимодействие с кислотами с образованием солей: CaO+h3SO4 = CaSO4+ h3O 3. Взаимодействие с кислотными оксидами с образованием солей CaO+CO2=CaCO3 Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами. Примерами кислотных окислов могут быть: CO2 (всем известный углекислый газ) , P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора) , SO3 — триокись серы — это вещество используют для получения серной кислоты. — реакция с водой с образованием кислоты SO2+h3O=h3SO3 — реакция с щелочами (основаниями) с образованием соли: CO2+NaOH=Na2CO3 — реакция с основными оксидами с образованием соли: CO2+MgO=MgCO3 Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами) . Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов. Примером амфотерных оксидов могут быть: ZnO – оксид цинка, Al2O3 — оксид алюминия Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например: — реакция с кислотным оксидом с образованием соли: ZnO+h3CO3 = ZnCO3 + h3O — реакция с основаниями с образованием соли: ZnO+2NaOH=Na2ZnO2+h3O — реакция с кислотными и с основными оксидами с образованием содей: ZnO + SO2 = ZnSO3 ZnO + Na2O = Na2ZnO2
Основной оксид — это… Что такое Основной оксид?
- Основной оксид
Осно́вные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся:
Металлы в основных оксидах обычно проявляют валентность I и II.
Характерные реакции
- СаO + H2O = Са(OH)2
- Основные оксиды взаимодействуют с кислотами, образуя соотвествующие соли:
- CaO + 2HCl = CaCl2 + H2O
- Na2O + CO2 = Na2CO3
- Li2O+Al2O3 = 2LiAlO2
Все основные оксиды
См. также
Ссылки
Оксиды.
Wikimedia Foundation. 2010.
- Основной капитал
- Основной тензор
Смотреть что такое «Основной оксид» в других словарях:
основной оксид — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN basic oxide … Справочник технического переводчика
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
Оксид свинца(II) — Общие … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Оксид хрома(III) — Оксид хрома(III) … Википедия
dvc.academic.ru
ОКСИДЫ — это… Что такое ОКСИДЫ?
соединения элементов с кислородом. В О. степень окисления атома кислорода Ч2. К О. относятся все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг с другом (пероксиды, надпероксиды, озо-ниды), и соед. фтора с кислородом (OF2 и др.). Последние следует называть не оксидами, а фторидами кислорода, т. к. степень окисления кислорода в них положительная.
При комнатной т-ре большинство О.-твердые в-ва (СаО, Fe2O3 и др.), нек-рые-жидкости (Н 2 О, Сl2 О 7 и др.) и газы (NO, SO2 и др.). Хим. связь в О.-ионная и ионно-ковалент-ная. Т-ры плавления и кипения О. понижаются с возрастанием в них доли ковалентной связи. Многим О. в твердом состоянии присущ полиморфизм. Нек-рые О. элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные стекла. Оксиды s- и /^-элементов (напр., MgO, Аl2 О 3, SiO2 )-диэлектрики, О. переходных металлов (Fe, Сг и др.) часто обладают св-вами полупроводников. Нек-рые О.-пьезоэлектрики (напр., кварц), ферромагнетики [О. Fe, Cr(IV) и др.]. Вследствие своей многочисленности, разнообразия св-в и доступности О. представляют исключительно важный класс неорг. в-в.
Большинство О.-солеобразующие; при солеобразовании, протекающем обычно при нагр. (напр., Na2O + SiO2 Na2SiO3), степени окисления элементов не изменяются. Известно неск. несолеобразующих О. (напр., NO), не вступающих в подобные р-ции. Солеобразующие О.
подразделяют на основные, кислотные и амфотерные. Элемент основного О. (Li2O, BaO и др.) при образовании соли (напр., ВаО + SO3
Na2SiO3), степени окисления элементов не изменяются. Известно неск. несолеобразующих О. (напр., NO), не вступающих в подобные р-ции. Солеобразующие О.
подразделяют на основные, кислотные и амфотерные. Элемент основного О. (Li2O, BaO и др.) при образовании соли (напр., ВаО + SO3 BaSO4) становится катионом, элемент кислотного О. (напр., SO3, NO2, P2O5) входит в состав кислородсодержащего аниона соли. Амфотерные О. (напр., ZnO, BeO, А12 О 3) могут реагировать и как основные О., и как кислотные, напр.:
BaSO4) становится катионом, элемент кислотного О. (напр., SO3, NO2, P2O5) входит в состав кислородсодержащего аниона соли. Амфотерные О. (напр., ZnO, BeO, А12 О 3) могут реагировать и как основные О., и как кислотные, напр.:
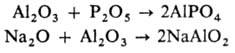
Уменьшение степени окисления элемента и увеличение радиуса его иона делает О. более основным, наоборот, увеличение степени окисления и уменьшение ионного радиуса-более кислотным (напр., МnО- основной оксид, Мn2 О 7 -кислотный). Многие О., напр. Рb3 О 4, Fe3O4, содержащие элемент в разных степенях окисления, являются двойными О.: (PbII2, PbIV)O4, (FeII, FeIII2)O4. Среди О., особенно среди О. d-элементов, много нестехиометрич. соединений.
О. щелочных и щел.-зем. металлов активно реагируют с водой, образуя щелочи, напр.: К 2 О + Н 2 О 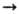 2КОН; нек-рые кислотные О. -ангидриды неорганических кислот- активно взаимод. с водой, давая к-ты, напр.: SO3 + Н 2 О
2КОН; нек-рые кислотные О. -ангидриды неорганических кислот- активно взаимод. с водой, давая к-ты, напр.: SO3 + Н 2 О  H2SO4. Большинство О. металлов в компактном состоянии при комнатной т-ре с водой не реагируют. Основные О. обычно быстро реагируют с к-тами в р-ре с образованием солей, напр.:
H2SO4. Большинство О. металлов в компактном состоянии при комнатной т-ре с водой не реагируют. Основные О. обычно быстро реагируют с к-тами в р-ре с образованием солей, напр.:
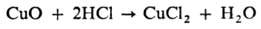
Восстановители (С, Н 2, активные металлы, в частности Mg, Al) при нагр. восстанавливают многие О. до металла, напр.:
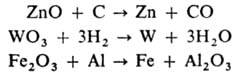
При сильном нагревании О. с углеродом часто образуются карбиды (напр., СаО + ЗС 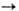 СаС 2 + СО), при хлорировании смеси О. с углем-хлориды (напр., В 2 О 3 + ЗС + + ЗСl2
СаС 2 + СО), при хлорировании смеси О. с углем-хлориды (напр., В 2 О 3 + ЗС + + ЗСl2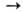 2ВСl3 + 3СО).
2ВСl3 + 3СО).
О. широко распространены в природе. В очень больших кол-вах встречаются Н 2 О и SiO2. Мн. минералы являются оксидами (гематит Fe2O3, магнетит Fe3O4, касситерит SnO2 и др.).
Многие О. образуются при взаимод. простых в-в с кислородом (Li2O, СаО, La2O3, SO2 и др.). О. металлов обычно получают термич. разложением гидроксидов, карбонатов, нитратов и др. солей кислородсодержащих к-т (напр., СаСО 3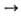 СаО + СО 2), анодным окислением металлов, О. неметаллов — окислением кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О 2
СаО + СО 2), анодным окислением металлов, О. неметаллов — окислением кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О 2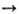 2SO2 + 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2 О 3, MgO, SO3, CO, CO2, NO и другие О. Используют О. как огнеупоры (SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2 -сшгака-гель, Аl2 О 3 и др.), катализаторы (V2O5, Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора, фаянса, магн. материалов, пьезоэлектриков и др. О. металлов (Fe, Ni, Al, Sn и др.)-сырье в произ-ве металлов, О. неметаллов (напр., S, Р, N)- в произ-ве соответствующих к-т.
2SO2 + 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2 О 3, MgO, SO3, CO, CO2, NO и другие О. Используют О. как огнеупоры (SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2 -сшгака-гель, Аl2 О 3 и др.), катализаторы (V2O5, Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора, фаянса, магн. материалов, пьезоэлектриков и др. О. металлов (Fe, Ni, Al, Sn и др.)-сырье в произ-ве металлов, О. неметаллов (напр., S, Р, N)- в произ-ве соответствующих к-т.
С. И. Дракин.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.
dic.academic.ru