Урок по химии 8 класс «Составление химических формул»
План – конспект урока:
«Использование электронных образовательных ресурсов в работе педагога».
2
Место работы: МКОУ «Хаилинская средняя школа».
3
Должность: учитель химии и биологии.
4
Предмет: химия.
5
Класс: 8
6
Базовый учебник: Г.Е. Рудзитис, Ф.Г. Фельдман
7
Цель урока: научить учащихся составлять формулы химических соединений по валентности и степени окисления.
8
Задачи:
обучающие: научить составлять формулы бинарных соединений.
развивающие: вырабатывать умение логически рассуждать, грамотно излагать свои мысли, глубже осмыслить и понять ег.
воспитательные: развивать самостоятельность, сообразительность.
9
Тема урока: Составление химических формул.
10
Тип урока: Урок изучения и первичного закрепления новых знаний.
11
Техническое оборудование: компьютер, мультимедийный проектор
12
Структура и ход урока:
Этапы урока:
Организация начала урока.
Мотивация учебной деятельности.
Важность понимания изучения данной темы, заключается в ее биологическом смысле.
Вся Вселенная, в том числе и планета Земля и все царства (бактерии, грибы, простейшие, растения и животные) состоят из одних и тех же химических атомов, элементов. Атомы одинаковые и разные, соединяясь, образуют вещества неорганические и органические. Из веществ состоят все тела и предметы. Выразим через формулы – состав веществ.
Подготовка учащихся к усвоению, актуализация опорных знаний.
Учащиеся уже изучили и познакомились с такими понятиями как:
Закон постоянства состава вещества. (1799 – 1806 гг. – Ж. Пруст)
Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
Н а основе закона постоянства состава веществ можно вывести химические формулы.
2. Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Индекс в химических формулах обозначает число атомов.
Al 2 индекс O 3 индекс Fe Cl 3 – индекс
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность водорода принята за единицу.
Валентность кислорода равна двум.
Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электротрицательностью.

Степень окисления – условный заряд элемента.
Величину степени окисления определяет число электронов, смещенных от атомов менее электроотрицательного элемента к атому более электроотрицательного элемента.
Изучение нового материала.
Химические формулы это аналоги слов, как слова записываются с помощью букв, так и формулы записываются с помощью химических символов, знаков. Химические формулы отражают состав вещества.
Цель урока.
Задачи урока.
Составление химических формул по валентности.
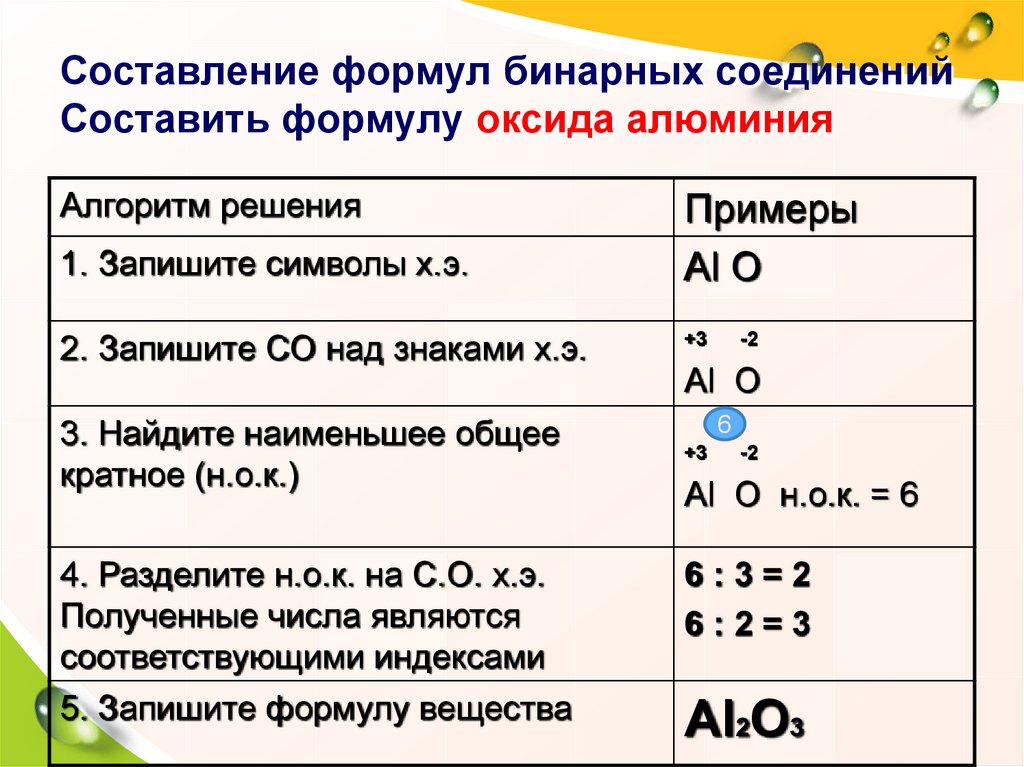
Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. При составлении химических формул необходимо соблюдать порядок действий:
1.Пишут рядом химические знаки элементов, которые входят в состав соединения:
K O Al Cl AlO
2. Над знаками химических элементов проставляют их валентность:
I II III I III II
K O Al Cl Al O
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов:
Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов:
2 3 6
I II III I III II
K O Al Cl Al O
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы
2 3 6
I II III I III II
K 2O Al Cl
5. В названии веществ, образованных элементами с переменной валентностью, пишут в скобках цифру, показывающую валентность данного элемента в этом соединении.
Например,
Cu O – оксид меди (II)
Cu 2 O – оксид меди ( I)
Fe Cl 2 – хлорид железа (II)
Fe Cl 3 – хлорид железа(III)
6. Некоторые элементы в разных соединениях проявляют различную валентность.
Некоторые элементы в разных соединениях проявляют различную валентность.
(см. таблицу)
Валентность некоторых элементов в химических соединениях.
Химические элементы.
С постоянной валентностьюI
H Na K Li
II
O Be Mg Ca Ba Zn
III
Al B
С переменной валентностью
I II
Cu
II III
Fe Co Ni
II IV
Sn Pb
III V
P
II III VI
Cr
II IV VI
S
При составлении химических формул по степени окисления необходимо знать:
степени окисления элементов, образующих данное химическое соединение;
их элекроотрицательность, так как самый электроотрицательный элемент ставится последним;
сумма отрицательных и положительных степеней окисления в правильно составленной формуле всегда равна нулю.

Первичная проверка усвоения знаний.
Правила составления химических формул.
гиперссылка
Первичное закрепление знаний.
Тесты по теме: «Валентность и степень окисления»
гиперссылка
Контроль и самопроверка знаний.
Работа с учебником: Страница 37, упражнение 4, 5
Подведение итогов урока. Рефлексия.
Информация о домашнем задании.
Учебник: 12 Стр. 33 – 35; упр. 6,7 на стр. 37 на составление формул бинарных соединений по валентности .
13
Гиперссылки на ЭОР: http://fcior.edu.ru, school-collection.edu.ru
Составление химических формул соединений по валентности элемента
Тема: Составление химических формул соединений по валентности элемента
Цель: научить школьников составлять формулы бинарных соединений по валентности.
разъяснять смысл изученных понятий, объяснять последовательность действий при определении валентности по формулам веществ и составлении химических формул соединений по валентности элемента;
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: Компьютер, мультимедийное сопровождение, алгоритм определения валентности по формулам веществ и составления химических формул соединений по валентности элемента
Оборудование для учащихся: на каждом столе «Алгоритм определения валентности», «Алгоритм составления химических формул по валентности».
Методы обучения: Репродуктивный, проблемно-поисковый.
Формы организации учебной деятельности: индивидуальная, самостоятельная
I. ОРИЕНТИРОВОЧНО-МОТИВАЦИОННЫЙ ЭТАП
Слайд 1. Учитель. Добрый день, юные мыслители! Я рада видеть ваши умные и добрые лица! Нам предстоит очень необычная работа. И я даже слегка волнуюсь: а все ли задуманное осуществится. Для этого мне понадобиться ваша помощь. Я готова начать работу и надеюсь на ваше сотрудничество и творческий подход к делу. Вы готовы? На внутренней стороне обложки тетради у вас приклеена табличка с шестью лицами – определите своё эмоциональное состояние. Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клеточку влево. Для этого нужно задуматься над вопросами: может ли человек полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать? Девиз урока: «Спрашивайте и отвечайте – это девиз познания и учения».
И я даже слегка волнуюсь: а все ли задуманное осуществится. Для этого мне понадобиться ваша помощь. Я готова начать работу и надеюсь на ваше сотрудничество и творческий подход к делу. Вы готовы? На внутренней стороне обложки тетради у вас приклеена табличка с шестью лицами – определите своё эмоциональное состояние. Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клеточку влево. Для этого нужно задуматься над вопросами: может ли человек полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать? Девиз урока: «Спрашивайте и отвечайте – это девиз познания и учения».
 Но я думаю, что все вы не растеряетесь и благополучно вернетесь из похода не с пустыми рюкзаками. Прежде чем отправиться в путь, мы должны сделать разминку, ведь путь очень долгий.
Но я думаю, что все вы не растеряетесь и благополучно вернетесь из похода не с пустыми рюкзаками. Прежде чем отправиться в путь, мы должны сделать разминку, ведь путь очень долгий.Химическая разминка
Слайд 3.1.Игра «Крестики и нолики» Выигрышный путь составляют атомы:
NaCaO
CuO
FeO
AgCl
Si
S
Ca
K
Слайд 4.2.Найдите «лишнее вещество», т.е. такое, которое не образует с остальными однородную группу: N2 SO2 Ba O2 P2O5 N2O5 ( Ва – атом среди молекул)
Слайд 5.3.Найдите «лишнее вещество», т.е. такое, которое не образует с остальными однородную группу: O2 Н2 СО К Li Ca (CО – сложное вещество, среди простых)
Учитель. Ну а теперь нам необходимо проверить вашу готовность к путешествию и собрать вещи. Кто быстрее соберет рюкзак?
Ну а теперь нам необходимо проверить вашу готовность к путешествию и собрать вещи. Кто быстрее соберет рюкзак?
Слайд 6.4.Выбери названия тел: алюминий, пластмасса, стакан, стекло, тетрадь, книга, ручка, дерево, линейка.
Слайд 7.5. Выбери чистые вещества: воздух, серебро, морская вода, сахар, золото, кислород, нефть, медь, туман.
Слайд 8.Учитель: Итак, в путь. На нашем пути – речка. Чтобы перебраться через нее, необходимо построить мост из досточек, которые образуются из соотношения химического символа элемента, его произношения и названия. Главное – не промочить ноги.
Слайд 9. 6. Установи соответствие между химическим символом элемента, его произношением и названием элемента
CuФеррум
Серебро
Pb
Силициум
Золото
Hg
Плюмбум
Медь
Fe
Аурум
Кремний
Au
Аргентум
Железо
Si
Цэ
Ртуть
Ag
Гидраргирум
Свинец
C
Купрум
Углерод
Слайд 10. Учитель. Через речку мы перебрались, а дальше густой лес. Чтобы найти тропинку необходимо произнести волшебные слова – прочитать формулы веществ.
Учитель. Через речку мы перебрались, а дальше густой лес. Чтобы найти тропинку необходимо произнести волшебные слова – прочитать формулы веществ.
Слайд 11.7. Как произносятся формулы следующих веществ? CuO, ZnO, P2O5, NO2 , SO3 , Al2O3, Н2О, SO2.
Слайд 12.Учитель. Молодцы, тропинку мы нашли. Осталось только пройти через лес, а для этого необходимо произвести расчёты, чтобы не заблудиться.
II. Индивидуальная работа по карточкам двух учащихся по теме “Относительная молекулярная масса” (Выполняют решение на доске, остальные в тетради). Проверка учителем.
Карточка № 1. Рассчитайте относительную молекулярную массу данных веществ: NaCl, K2O.
Справочные данные:
Аr (Na) = 23
Аr (Cl) = 35,5
Аr (K) = 39
Аr (O) = 16
Карточка № 2. Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2.
Справочные данные:
Аr (Cu) = 64
Аr (O) = 16
Аr (S) =3 2
Учитель. Если вы легко смогли выполнить все задания, скажите себе: «Я – молодец!»
Физминутка
А теперь все тихо встали,
Дружно руки вверх подняли,
В стороны, вперед, назад,
Повернулись вправо, влево,
Тихо сели, вновь за дело.
II. ОПЕРАЦИОНН-ИСПОЛНИТЕЛЬНЫЙ ЭТАП
Актуализация опорных знаний
Слайд 13.Учитель. Осталось нам преодолеть гору. Перед началом подъема вспомните, что до сих пор мы пользовались готовыми химическими формулами. Какие закономерности учитываются при составлении химических формул, которым подчиняются элементы, соединяясь между собой? Как называется эта закономерность? (валентность).
Учитель. Дайте определение валентности.
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Учитель. Как обозначается валентность? (Валентность обозначается римскими цифрами)
Учитель. Какие виды валентности вы знаете? (постоянная и переменная)
Учитель. Чему равна валентность водорода? кислорода? ( I, II)
Учитель. Какое правило вы должны знать при определении валентности атомов элементов в соединениях? (Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента).
Слайд 14.Учитель. Перед трудным подъёмом в гору, давайте сделаем ещё одну разминку.
Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). SiH4, CrO3, H2S, CO2, SO3, Fe2O3.
SiH4, CrO3, H2S, CO2, SO3, Fe2O3.
Слайд 15.Учитель. Как вы думаете, зачем нам необходимо знать валентность элементов? (чтобы составлять химические формулы соединений). Запишем тему урока в тетрадь. Какую цель мы поставим перед собой?
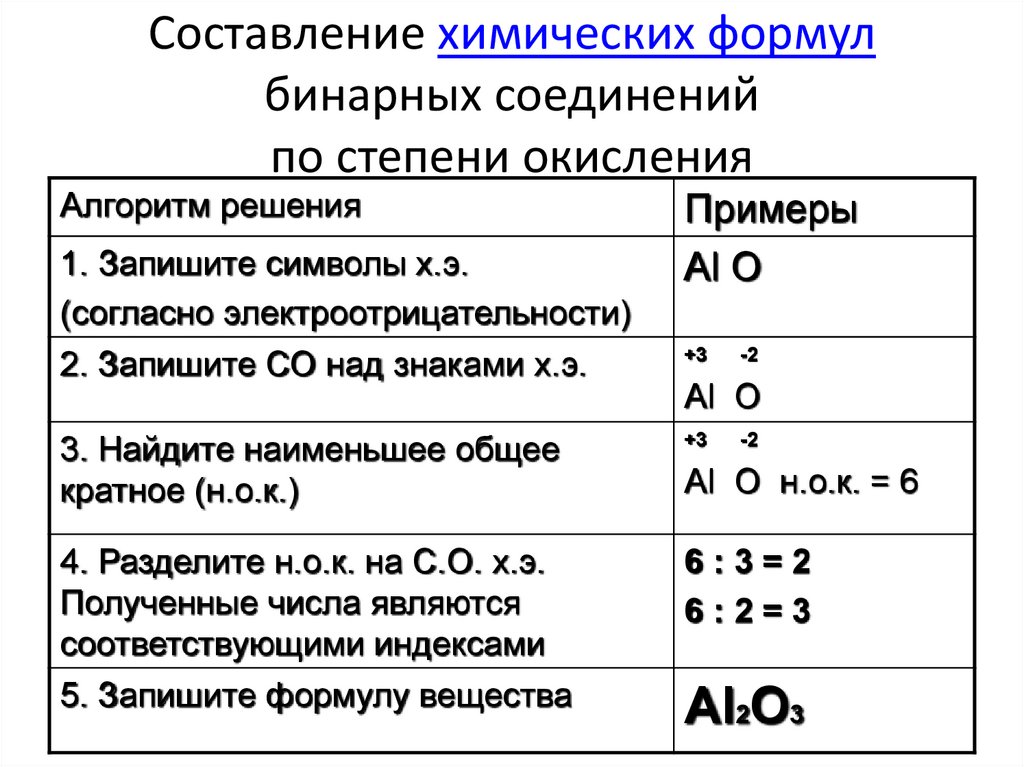
Слайд 16-19.Учитель. Чтобы преодолеть нашу гору без травм, вы должны пройти инструктаж, как составлять химические формулы по валентности элемента. Для этого удобно воспользоваться следующей таблицей.
Объяснение учителя.
Алгоритм составления химической формулы по валентности элемента.
Алгоритм составления формулы по валентности элементаПример
1. Запиши рядом знаки химических элементов, которые входят в состав вещества.
В О
2. Над знаками химических элементов поставь их валентность.
III II
В О
3. Определи Н.О.К (наименьшее общее кратное — это число, которое делится на исходные числа без остатка) чисел, выражающих валентность этих элементов.
Запиши Н.О.К. над формулой.
6
III II
В О
4. Раздели Н.О.К. на валентность каждого элемента.
Запиши полученный индекс.
6
III II
В О
6: III= 2
6:II=3
6
III II
В2 О3
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента
6
III II
В2 О3
( 6=6)
Слайд 20.Учитель. А теперь начинаем наше восхождение. Если у вас возникнут трудности, то у вас есть подсказка ( алгоритм).
Если у вас возникнут трудности, то у вас есть подсказка ( алгоритм).
Упражнение: составить химические формулы по валентности элементов (тренажёр: ученики цепочкой выходят к доске). Задание в рабочей тетради ( стр. 16 – 17. Упражнение № 49,50 б )
III. ОЦЕНОЧНО-РЕФЛЕКСИВНЫЙ ЭТАП
Слайд 21. Учитель. Молодцы. Мы благополучно добрались до места назначения. А теперь привал. Нам необходимо подкрепиться, каждый вправе выбрать блюдо на свой вкус.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь.
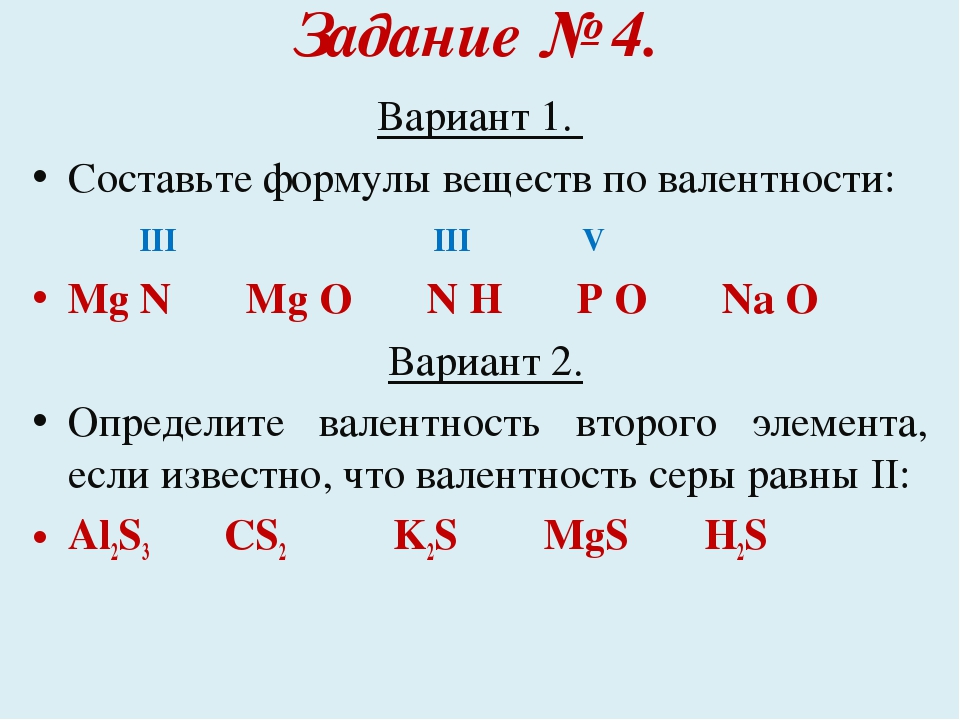
Репродуктивный уровень (“3”). Составьте химические формулы по валентности элементов: NH (III), AlO (III), CH (IV), CuO (II).
Прикладной уровень (“4”). Составьте формулы оксидов: Mn (VII), Fe (III) , Cr (VI), Cu (I), К (I).
Творческий уровень (“5”). Исправьте ошибки, допущенные в некоторых формулах: AlO3, BO3, NaO, КО.
Репродуктивный уровень (“3”).
NH3, AL2O3, CH4, CuO.
Прикладной уровень (“4”).
Mn2O7, Fe2O3 , CrO3, Cu2O, K2O.
Творческий уровень (“5”).
Al2O3, B2O3, Na2O, К2О.
IV. ПОДВЕДЕНИЕ ИТОГОВ УРОКА
Учитель. Все путешественники собрали хорошие знания в свои рюкзаки и заслуживают отличных оценок и наград. Оцените своё эмоциональное состояние в конце урока.
Объявить оценки за урок отвечавшим ученикам, поблагодарить всех за работу на уроке. Провести оценку эмоционального состояния по шкале (см. рис.). Учитель еще раз напоминает вопросы, над которыми необходимо подумать для эффективной работы на следующем уроке.
Что нужно знать, чтобы составить химическую формулу вещества?
Как можно найти число атомов в биэлементных соединениях, если валентности элементов известны?
Как проверить правильность составленной формулы биэлементных соединений?
Слайд 24. Учитель: Во время путешествия к вашим рюкзакам прицепились паразиты. Необходимо будет от них избавиться, выполнив домашнее задание.
Учитель: Во время путешествия к вашим рюкзакам прицепились паразиты. Необходимо будет от них избавиться, выполнив домашнее задание.
V. ДОМАШНЕЕ ЗАДАНИЕ § 12. РТ стр. 16-17 ( упр. 50а, 51,52)
Учитель. Благодарю за урок. До свидания.
Формула химическая составление — Справочник химика 21
Валентность, Понятие об эквиваленте. Грамм-эквивалент, Химические формулы. Определение валентности элементов по формулам их соединений. Составление формул ио валентности. Графическое изображение формул. Химические уравнения. Составление уравнений химических реакций. [c.11] Молекулы простых и сложных веществ могут быть изображены при помощи химических формул. Для составления формулы вещества необходимо знать, из какого числа атомов каждого элемента состоит молекула. При этом для обозначения атомов пользуются символами элементов.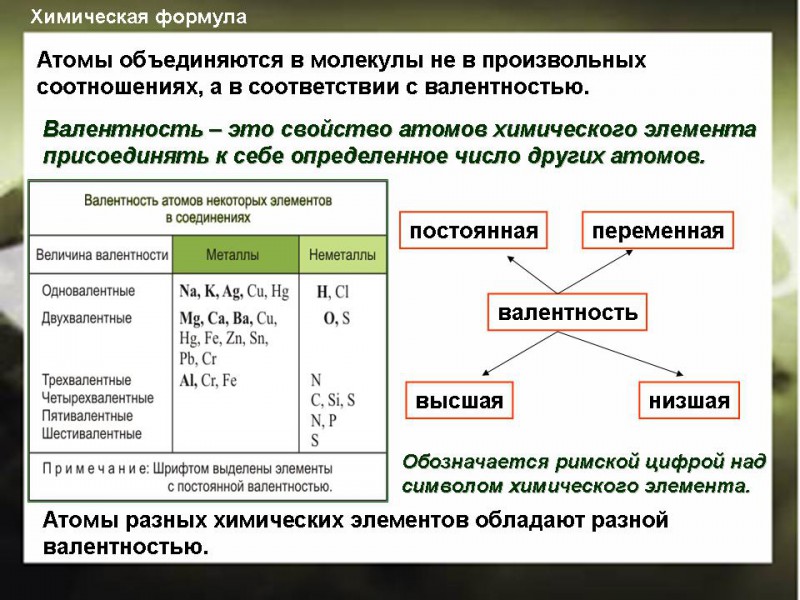 [c.32]
[c.32]
Степень окисления элемента — понятие условное, однако оно весьма полезно. Значениями степеней окисления элементов пользуются при составлении формул соединений при написании и подборе коэффициентов в уравнениях реакций для классификации соединений, характеристики их химической природы и свойств для пред- [c.82]
Для составления уравнения окислительно-восстановительной реакции надо знать химические формулы реагентов и продуктов реакции (они часто определяются на основании опыта). Сначала подбирают стехиометрические коэффициенты для соединений, атомы которых меняют степень окисления. При этом исходят из того, 410 число электронов, отданных восстановителем, должно быть равио числу электронов, полученных окислителем.
Расчет атомных масс. Составление формул химических соединений [c.20]
Первый путь состоит в том, что число валентности первоначально постулируется для данного атома в данном ряду соединений и составленные на основании его значения формулы химического строения этого ряда соединений проверяются экспериментальными методами, обычно применяющимися для установления строения тех или других химических частиц . Этот процесс может повторяться до тех пор, пока из рассматриваемого первоначально ряда не будут выделены такие более узкие ряды в которых оказывается возможным приписать данному атому постоянную целочисленную валентность и построить формулы химического строения соединений этого ряда, находящиеся в согласии с экспериментальными исследованиями строения соединений ряда. [c.135]
Этот процесс может повторяться до тех пор, пока из рассматриваемого первоначально ряда не будут выделены такие более узкие ряды в которых оказывается возможным приписать данному атому постоянную целочисленную валентность и построить формулы химического строения соединений этого ряда, находящиеся в согласии с экспериментальными исследованиями строения соединений ряда. [c.135]
Химическая формула, выведенная только с учетом весового состава вещества, называется эмпирической. Формулы же, составленные с учетом молекулярного веса вещества, носят название молекулярных. [c.46]
Молекула явилась основной единицей химии. Открылся путь к действительно научной химической символике, составлению химических формул веществ. Выдающийся шведский химик И. Берцелиус определил с большой точностью атомный вес многих веществ и изобрел условное обозначение атомов различных элементов. Символами стали начальные буквы их латинских названий. Теперь, зная состав молекулы, можно было легко вывести ее формулу, а тем самым и формулу химического соединения, так как молекула выра.
Одна из важнейших проблем, связанных с соединениями переменного состава, — это их термодинамическая характеристика. Дело в том, что термодинамическая характеристика системы предусматривает прежде всего точное написание уравнения, описывающего начальное и конечное состояния системы, в которой протекает реакция или установилось химическое равновесие. Очевидно, главным условием для точного составления уравнения являются правильные формулы компонентов в том или ином фазовом состоянии и выведенные на основе правильных их формул химические коэффициенты. Это азбучное положение химической термодинамики в исследованиях соединений переменного состава систематически нарушалось, что нашло отражение в учебниках, монографиях и справочниках. В (28, 29, 30, 31] на примере конкретных реакций была показана недопустимость такого подхода, а в [31] показан ряд ошибок известного издания Национального бюро стандартов США, циркуляра № 500 (1952 г. ). [c.250]
). [c.250]
Вторая причина трудностей в том, что в химии при расчетах приходится оперировать двумя рядами формул — химическими и математическими. Все эти трудности необходимо преодолеть, показывая учащимся, что все без исключения химические расчеты основаны на использовании моля как единицы количества вещества. Ученики должны это твердо осознать. Конечно, легче объяснить расчет через составление пропорции в граммах или объемах. Эти величины давно знакомы учащимся так же, как и пропорции. Но если учитель пойдет по этому пути, он рискует в дальнейшем никогда не научить учащихся мыслить количественными химическими понятиями. Они не смогут объяснить причины, по которым можно составлять такие пропорции и будут считать использование понятия моль совершенно лишним и ненужным. [c.92]
В молекулах сложных веществ сумма положительных зарядов атомов (ионов) всегда равна сумме отрицательных зарядов. Поэтому молекулы сложного вещества в целом всегда электронейтральны. Этим положением руководствуются при составлении и проверке формул химических соединений. [c.48]
Поэтому молекулы сложного вещества в целом всегда электронейтральны. Этим положением руководствуются при составлении и проверке формул химических соединений. [c.48]
Рассмотрим теперь математическое представление реактантов, учитывающее явление геометрической изомерии. Отметим сразу, что современные формулы строения химических веществ непригодны для проведения расчетов на ЭВМ химических реакций, так как их нельзя непосредственно ввести в оперативную намять ЭВМ или записать на внешние носители информации. Далее, для этой цели нецелесообразно использовать и векторное представление молекул, которое строилось на основе их брутто-формул. Следовательно, требуются дальнейшие обобщения, связанные с представлением молекул в виде матриц определенной размерности, равной числу содержащихся в молекуле атомов. При формировании элементов этой матрицы, называемой В-матрицей, учитывается, что каждый атом состоит из атомного остова, составленного из ядра атома и внутренних электронов и имеющего некоторый формальный заряд, и электронов валентной оболочки. Последние менее сильно связаны с атомным остовом и участвуют в образовании химических связей. [c.174]
Последние менее сильно связаны с атомным остовом и участвуют в образовании химических связей. [c.174]
Прежде чем начать поиск конкретных методик получения того или иного препарата, являющегося полупродуктом в многостадийном синтезе, необходимо составить схему синтеза. Обычно при составлении схем рекомендуется записывать структурные формулы исходных и промежуточных продуктов. В схеме следует обозначать только главный продукт (после стрелки) и исходный (перед стрелкой). Побочные продукты в генеральной схеме записывать не следует. Реагенты, катализатор и условия указывают над и под стрелкой. В тех случаях, когда реакция сопровождается окислением или восстановлением, но окислитель или восстановитель еще не известны или это не принципиально, то окисление принято обозначать символом атома кислорода в квадратных скобках [01, восстановление—символом атома водорода 1Н1. Обычно такие обозначения приводятся в схеме синтеза над стрелкой. Для обозначения повышенной температуры принято ставить латинскую букву ( или греческую А (дельта) если синтез проводится при повышенном давлении, то рядом с условным обозначением температуры ставят символ р. Если катализатором реакции является металл или молекула определенного химического вещества, то, как правило, над стрелкой пишется химический символ этого металла или формула катализатора, при кислотном катализе — символ Н при щелочном — ОН . [c.85]
Если катализатором реакции является металл или молекула определенного химического вещества, то, как правило, над стрелкой пишется химический символ этого металла или формула катализатора, при кислотном катализе — символ Н при щелочном — ОН . [c.85]
Начиная с 1859 г. в Горном журнале начинают постоянно приводиться атомные веса и формулы Жерара и Лорана. Заслуга здесь принадлежит Н. Н. Соколову, известному русскому химику, редактору химического отдела Горного журнала . В одной из своих статей он писал В химическом отделе Горного журнала будет постоянно обращаться особенное внимание на то, чтобы обозначение различных соединений делалось совершенно строго и последовательно с помощью следующих паев для каждого элемента и притом так, чтобы формула выражала два объема пара [43, стр. 99]. В этой же статье приводятся новые атомные веса элементов и несколько формул химических соединений, составленных по системе Жерара и Лорана. [c.134]
Химический потенциал применяют для составления самых разнообразных термодинамических уравнений для неоднородных систем правило фаз, изотермы химической реакции, формулы законов Генри и Вант-Гоффа и другие. [c.154]
[c.154]
Вещества могут обозначаться не только их названиями (в форме слов языка), но и химическими формулами различных типов, линейными цифровыми кодами или просто номерами по порядку. Но такие символические обозначения не являются удобопроизносимыми и почти не рассматриваются в этой книге. И даже в рамках языковых форм химик имеет некоторый выбор в обозначении соединений так, в зависимости от контекста речь может идти о 2-хлорнафталине, об указанном (выше) веществе или о соединении, обозначенном какой-либо цифрой по порядку. Для составления различных указателей и перечней, аннотаций и словарей сохраняется, однако, необходимость иметь конкретные, точно установленные (номенклатурные) названия соединений такие же названия нужны для научных статей, докладов, учебников, для устного и письменного общения химиков. [c.15]
Стехиометрия. Учение о количественных (массовых и объемных) соотнощениях вступивших в реакцию реагентов и образующихся продуктов называют стехиометрией. В это понятие входит вывод химических формул, составление уравнений химических реакций, расчеты, применяемые в химии. [c.10]
В это понятие входит вывод химических формул, составление уравнений химических реакций, расчеты, применяемые в химии. [c.10]
При составлении химических уравнений нельзя произвольно, наугад группировать атомы или ионы в молекулах. Нельзя, написав формулы молекул в левой части уравнения, по своему желанию группировать их в правой части уравнения в новые молекулы. [c.10]
Приведены физико-химические константы и реакционная способность более чем 3500 неорганических веществ, выпускаемых химической промышленностью и обычно используемых в лабораториях, свойства и строение атомов элементов, природных и радиоактивных изотопов. молекул, радикалов и ионов. Изложены номенклатурные правила составления химических формул и названий, даны тривиальные, устаревшие и минералогические названия веществ. [c.375]
Степень (состояние) окисления элемента — понятие условное, однако оно весьма полезно. Значениями степеней окисления элементов пользуются при составлении формул соединений написании и подборе коэффициентов в уравнениях реакций для классификации соединений, характеристики их химической природы и свойств предсказания направления течения и продуктов химических реакций и т. д. [c.79]
Значениями степеней окисления элементов пользуются при составлении формул соединений написании и подборе коэффициентов в уравнениях реакций для классификации соединений, характеристики их химической природы и свойств предсказания направления течения и продуктов химических реакций и т. д. [c.79]
Для составления химического уравнення первоначально записывают формулы молекул веществ, вступающих в реакцию и получающихся в результате реакции, а затем находят коэффициенты к молекулам тех и других веществ. После расстановки коэффициентов количество атомов в веществах, вступивших в реакцию, должно быть равно таковому в веществах, полученных после реакции. Например, в окончательном виде уравнение реакции взаимодействия металлического цинка с соляной кислотой может быть записано [c.19]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги.
При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги. [c.4]
[c.4]
Составление схемы реакции — написание химических формул для исходных веществ и продуктов реакции, отражающих их элементарный состав и агрегатное состояние. [c.28]
Для изучения свойств соединений часто получают их в чистом состоянии, применяя для этого кристаллизацию, выпаривание, сублимацию, фильтрование, перегонку и другие операции. Это—приемы препаративного метода исследования. Использование этого метода ограничено. С его помощью не всегда удается исследовать растворы, сплавы, стекла. Часто встречаются и экспериментальные трудности например, отделить кристаллы от маточного раствора становится сложным, если он обладает большой вязкостью, а соль разлагается под действием растворителей, служащих для отмывания раствора. Еще труднее отделить твердое вещество от жидкого при высоких температурах или разделить сплав на составные части. Для того чтобы выяснить характер взаимодействия веществ, т. е. узнать, дают ли они между собой механические смеси, растворы или химические соединения, необходимо /ибо отделить их друг от друга, либо применить другой метод, позволяющий установить природу и состав образующихся в системе соединений, не прибегая к их выделению и анализу, а именно метод физико-химического анализа. С его помощью устанавливают зависимость между изучаемым свойством и составом системы и выражают результаты исследования в виде диаграммы состав—свойство. Это целесообразнее, чем воспроизведение результатов опытов в виде таблиц (они недостаточно наглядны и требуют интерполяции) или формул (их составление трудоемко и не всегда осуще твимо). А главное — анализ диаграммы состав—свойство позволяет определить число и химическую природу фаз, г]заницы их существования, характер взаимодействия компонентов,наличие соединений, их состав и относительную устойчивость — словом, получить обширную и содержательную информацию. [c.254]
С его помощью устанавливают зависимость между изучаемым свойством и составом системы и выражают результаты исследования в виде диаграммы состав—свойство. Это целесообразнее, чем воспроизведение результатов опытов в виде таблиц (они недостаточно наглядны и требуют интерполяции) или формул (их составление трудоемко и не всегда осуще твимо). А главное — анализ диаграммы состав—свойство позволяет определить число и химическую природу фаз, г]заницы их существования, характер взаимодействия компонентов,наличие соединений, их состав и относительную устойчивость — словом, получить обширную и содержательную информацию. [c.254]
Для составления уравнения окислительно-восстановительной реакции необходимо прежде всего знать химические формулы исходных и получающихся веществ. Исходные вещества мы знаем, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В левой и правой частях уравнения реакции должно быть одинаковое число одних и тех же атомов. Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Молекулярнук рефракцию, вычисленную по формуле Лоренца — Лорентца, можно сравнить с молекулярной рефракцией, найденной как сумма атомных рефракций связен по табличным данным в соответствии с гипотетической формулой исследуемого вегцсства. Достаточно удовлетворительное совпадение служит подтверждением правильности представлений о состане и строепни исследуемого вевдества, составленных па основании данных химического анализа и изучения химических свойств. [c.87]
Истинное содержание определяемого элемента в химически чистых веществах может быть вычислено по их формулам. Для искусственно составленных смесей обычно тоже можно вычислить величину а, исходя из количества отдельных 5лементов в смеси и их формул. Наоборот, точное содержание отдельных элементов в различных природных объектах или продуктах производства нам не известно, и приходится судить о нем на основании результатов анализов, которые всегда содержат те или иные виды ошибок, В этом случае за истинное содержание какого-либо элемента принимают наиболее достоверное среднее значение из ряда определений его, проведенных с величайшей тщательностью несколькими различными методами в разных лабораториях. Например, стандартный образец стали № 146, согласно приложенному к нему паспорту, исследован на содержание хрома пятью различными методами в пяти ведущих лабораториях СССР, причем получены результаты, находящиеся в пределах 1,12—1,16%. Среднее арифметическое из всех полученных результатов (1,14%), называемое установленным содержанием данного элемента, и принимается за истинное содержание его (а). [c.57]
Наоборот, точное содержание отдельных элементов в различных природных объектах или продуктах производства нам не известно, и приходится судить о нем на основании результатов анализов, которые всегда содержат те или иные виды ошибок, В этом случае за истинное содержание какого-либо элемента принимают наиболее достоверное среднее значение из ряда определений его, проведенных с величайшей тщательностью несколькими различными методами в разных лабораториях. Например, стандартный образец стали № 146, согласно приложенному к нему паспорту, исследован на содержание хрома пятью различными методами в пяти ведущих лабораториях СССР, причем получены результаты, находящиеся в пределах 1,12—1,16%. Среднее арифметическое из всех полученных результатов (1,14%), называемое установленным содержанием данного элемента, и принимается за истинное содержание его (а). [c.57]
При изучении химии мы постоянно пользуемся уравнениями химических реакций, которые представляют собой запись происшедших при реакции превращений веществ. Таким образом, при составлении уравнения реакции мы должны знать, что образовалось в результате взаимодействия, и записать это при помощи химических формул. Например, водород реагирует с кислородом, давая воду [c.167]
Таким образом, при составлении уравнения реакции мы должны знать, что образовалось в результате взаимодействия, и записать это при помощи химических формул. Например, водород реагирует с кислородом, давая воду [c.167]
Стех.иометрия — раздел химии, включающий законы количественных (массовых и объемных) соотношений между реагирующими веществами, вывод химических формул и составление уравнений химических реакций. Такая область химии, связанная с количественными расчетами реагентов, и получила название стехиометрии (от греч. з1о1сНё1оп — первоначало, основа, элемент и те1гёо — мерю). [c.8]
К 1860 г. путаница с атомными массами зашла так далеко, что каждый сколько-нибудь уважаемый химик имел свой собственный метод составления химических формул. В связи с этим Август Кекуле (который предложил известную кекулевскую структуру бензола) созвал в немецком городе Карлсруэ конференцию, на которой следовало прийти к како-му-то общему согласию. Проблема была решена итальянским ученым Станислао Канниццаро (1826-1910), который предложил строгий метод нахождения атомных масс, основанный на давно забытой работе своего соотечественника Авогадро. [c.287]
[c.287]
В английском варианте Правил ШРАС одинаковые по типу заряда части формулы располагаются для различных типов соединений по-разному, но чаще всего по алфавиту символов элементов, например, sGaMn204(0H)4. При составлении названий Правила ШРАС рекомендуют перечислять одинаковые по типу заряда части в соответствии с алфавитом их названий Сз0аМп204 (ОН) 4 — тетрагидроксид-тетраоксид галлия-димар-ганца-цезия. Очевидно, что для русского химического языка алфавитный принцип при переходе от формулы к названию (и наоборот) крайне неудобен и создает лишь дополнительные трудности. [c.11]
Химический состав силикатов принято выражать в виде формул, составленных из символов элементов в порядке возрастания их валентности, или из формул их оксидов в том же порядке. Например, полевой шпат К2А1281б01б может быть представлен как КА181з08 или К2О А12О3 -68102. [c.305]
При составлении схемы использован один старый прием формулы оснований, кислот и солей нредставлемы на ней как комбинации окислов. В этом случае многие химические реакции выглядят просто как реакции двойною обмена так, реакция [c.217]
В этом случае многие химические реакции выглядят просто как реакции двойною обмена так, реакция [c.217]
«Составление формул химических соединений»
Сегодня на уроке мы научимся составлять химические формулы бинарных соединений по степени окисления химических элементов.(слайд 4)
За каждый правильный ответ ставим баллы в колонку «Дополнительные баллы по новой теме»
4. Постановка проблемы. (Логические задачи)
Что такое бинарные соединения?
Игра «Крестики-нолики». Найдите бинарные соединения. (слайды 5-7)
Cl2 O7 | K2 O | KCl |
Na2 O2 | KClO | KClO3 |
KOH | NaCl | HClO3 |
H2 O2 | SO2 | H2 SO3 |
H2 SO4 | H2 S | H3 PO4 |
H2 O | SO3 | H2 CO3 |
Что такое степень окисления?
Какие значения может принимать степень окисления?
От чего это зависит? (слайды 8-9)
Какая бывает степень окисления
5. Обобщение. Выведение алгоритма составления формулы бинарного соединения
Обобщение. Выведение алгоритма составления формулы бинарного соединения
Посмотрите на образец правильно составленных формул. Попробуйте найти закономерность и по образцу самостоятельно составить формулу. (слайды 10-11)
1 способ:
Найти наименьшее общее кратное для степеней окисления.
Разделить наименьшее кратное на значение степени окисления и получить индексы
Ввести индексы в формулу, т.е. приписать внизу справа после символа соответствующего элемента.
Определить суммарное значение степеней окисления атомов в соединении. Оно должно быть равно нулю.
2 способ:
Индекс элемента соответствует численному значению степени окисления соседнего атома.
Закрепление первичное:
1. Что нужно знать, чтобы составить формулу?
А. На первом месте пишется элемент с меньшей электроотрицательностью.
Б. У элемента стоящего на первом месте положительная степень окисления, на втором отрицательная
2. Кто помнит как найти минимальную степень окисления? ( № группы-8)
Кто помнит как найти минимальную степень окисления? ( № группы-8)
3. Составьте формулы следующих веществ: (слайды 12-14)
Сделайте вывод:
Если степени окисления четные числа, то сначала их надо сократить.
Итак, давайте обобщим. Какие действия необходимо выполнить, чтобы составить формулу бинарного соединения?
А сейчас вы получите алгоритм как составлять формулу бинарного соединения, который вклейте в тетрадь. Раздать раздаточный материал «Алгоритм составления формулы бинарного соединения»
(слайд 15)
Физкультминутка
6. Закрепление Составление химических формул бинарных соединений по степени окисления химических элементов (слайд 16)
7. Итоговое обобщение
Что мы узнали сегодня на уроке?
Что необходимо знать, чтобы составить формулу бинарного соединения?
Алгоритм составления формулы бинарного соединения.
Способ 1
На первом месте пишется элемент с меньшей электроотрицательностью (См. в таблицу Д.И. Менделеева).
Элемент написанный на первом месте имеет положительный заряд, а на втором отрицательный.
Указать для каждого элемента степень окисления.
Найти наименьшее общее кратное для значений степеней окисления.
Разделить наименьшее общее кратное на значение степени окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
Проверка. Суммарное значение степеней окисления равно 0.
Способ 2
См. п. 1, 2, 3 первого способа.
Если степени окисления четное-нечетное, то они ставятся рядом с символом справа внизу крест-накрест без знака «+» и «–».
Если степени окисления имеют четные значения, то их сначала надо сократить, и поставить крест-накрест.
Запомните! (слайд 17)
ЭxHy — гидриды
ЭxOy — оксиды
ЭxSy -сульфиды
ЭxCly -хлориды
ЭxBry -бромиды
ЭxFy — фториды
ЭxPy— фосфиды
ЭxNy -нитриды
ЭxIy –йодиды
ЭxCy -карбиды
ЭxSiy -силициды
Составление формул соединений – методическая разработка для учителей, Шалабаева Аэлита Жумабаевна
«Если мы хотим быть нацией со своим неповторимым местом на глобальной карте ХХІ века,
нужно, чтобы мир узнал нас по культурным достижениям»
Н. Назарбаев
Назарбаев
Разделение на 3 группы
(Random Team Gen)
Показ анимации из YouTube
Метод «Посмотри. Подумай. Ответь»
Учащиеся выполняют задания, отвечая на вопрос учителя:
«Почему формулы записываются так, а не по-другому?»
Задание: составить формулу веществ по количеству элементов: Li, О2, Са, Na, S, C.
Выполняют задание, зная валентности элементов.
Взаимопроверка
Новый материал
Определение цели урока.
Запись в тетради новой темы.
Объяснение о понятиях «степень окисления», катион, анион, «нулевая сумма».
Групповая работа
«Find the match»
1. У каких веществ степень окисления равна 0, +1, –1?
У каких веществ степень окисления равна 0, +1, –1?
Работа на интерактивной доске с приложением LearningApps.Org
Дескриптор
Ученики:
— могут определить вещества со степенью окисления равной 0, +1, –1;
— могут проговаривать элементы на латыни.
Парная работа «Одна голова хорошо, а два лучше»
1. Составить формулы соединений по степеням окислений:
1) оксид фосфора;
2) бромид алюминия;
3) хлорид магния.
2. Определите степень окисления в веществах:
СН4, FeCl3, CaF, Ph4, SO2, K2S, ZnO.
Дескриптор
Ученики:
— умеют составлять формулы соединений по степеням окислений;
— умеют определять степень окисления в веществах.
Индивидуальная работа
«Тry-find»
Life on Earth would impossible without metals. Green plants need magnesium to make chlorophyll for carrying out photosynthesis, calcium is essential for making calcium compounds that make bones and teeth hard and strong, and iron is needed to make the protein hemoglobin, which carries oxygen around the body in our red blood cells, and another protein myoglobin, which binds oxygen in our muscles. Copper plays a role similar to hemoglobin in hemocyanin, which transports oxygen in the blood of mollusks, spiders and lobsters. Zinc is needed to make many enzymes in our bodies work effectively, and cobalt atoms are present in Vitamin B12. Molybdenum and iron are essential for the nitrogenize enzyme used by bacteria in the root nodules of certain plants, to ‘fix’ atmospheric nitrogen.
Дескриптор
Ученики:
— могут находить элементы;
— умеют находить соединения;
— умения составлять формулы соединений.
ФО: самооценивание, через правильные ответы на слайде, делают самоанализ.
§ 17. Составление химических формул по валентности
Задание 1
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность.
Задание 2
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность. Потом уравнивается валентность и добавляются индексы.
Задание 3
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность.Потом уравнивается валентность и добавляются индексы. Валентность в скобках указывается у тех элементов, которые имеют переходную валентность.
Задание 4
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность. Азот имеет переходную валентность.
Задание 5
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность. Потом уравнивается валентность и добавляются индексы.
Задание 6
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность.Формулы составляются, основываясь на валентность постоянных элементов.
Задание 7
Условие:
Решение:
Советы:
Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф. Помни, что вначале в соединениях ставится валентность у того элемента, который имеет постоянную валентность. Потом уравнивается валентность и добавляются индексы.
Тест
Условие:
Решение:
Советы:
Советы: Никогда не списывай слово в слово, попробуй ответить сам, основываясь на предложенный вариант и параграф.
Как составлять химические формулы по валентности. Составление химических формул по валентности
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
Если сравнить между собой формулы таких веществ, как вода h3O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia — «сила») — свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей — валентных возможностей.
Например, водород — одну, кислород и кальций — по две, алюминий — три, углерод — четыре, фосфор — пять, сера — шесть, хлор — семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая — разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная — 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая — в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую — соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента — фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества — оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента — низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях — два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
8 класс
Тип урока. Комбинированный.
Методы обучения. Частично поисковый, репродуктивный, программированный опрос, беседа с элементами лекции.
Эпиграф к уроку. «Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны: свойства, состав, строение…» (Б.М.Кедров).
Цели. Дидактическая: рассмотреть понятие
«валентность» как атомность элемента,
познакомить учащихся с различными видами
валентности (высшей и низшей, переменной и
постоянной).
Психологическая: вызвать интерес к предмету, выработать умение логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно, оценивать ответы своих товарищей.
Оборудование. Модели молекул воды, углекислого газа, наборы для построения моделей молекул различных веществ, индивидуальные карточки для проверки домашнего задания и самостоятельной работы учащихся в группе, таблички-анаграммы для химической разминки, шкала для определения эмоционального состояния ученика.
ХОД УРОКА
Ориентировочно-мотивационный этап
Психологическая разминка
Цель разминки – определить эмоциональное состояние учащихся. У каждого ученика на внутренней стороне обложки тетради приклеена табличка с шестью лицами – шкала для определения эмоционального состояния (рис.). Каждый ученик ставит галочку под той рожицей, чье выражение отражает его настроение.
Учитель. Было бы
замечательно, если бы к концу урока каждому
удалось переместить галочку хотя бы на одну
клеточку влево.
Было бы
замечательно, если бы к концу урока каждому
удалось переместить галочку хотя бы на одну
клеточку влево.
Для этого нужно задуматься над вопросами: может ли человек полюбить не очень интересный ему учебный предмет? Что для этого нужно сделать?
Химическая разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая относительная атомная масса.
«Маилинюй» – этот элемент называют «крылатым» металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы непрочными и хрупкими.
«Росфоф» – веществом, состоящим из атомов этого элемента, была намазана шерсть собаки Баскервилей.
Учитель. Если вы легко разгадали
слова-анаграммы, скажите себе: «Я – молодец!»
Если вы легко разгадали
слова-анаграммы, скажите себе: «Я – молодец!»
Химические знаки и химические
формулы
(Проверка домашнего задания)
Индивидуальная работа у доски по карточкам.
Цифровой диктант
Контроль за выполнением диктанта учащиеся осуществляют методом взаимопроверки.
Задание. Напротив правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения и названия элемента, записаны два числа: верхнее – относительная атомная масса элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы
атома, выраженной в а. е. м., никогда не совпадают
численно.
6. Простыми называют вещества, состоящие из атомов одного элемента.
8. Массовая доля элемента показывает, какую часть (долю) составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н 2 О равна 20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 – 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
Операционно-исполнительный этап
Учитель. Вы знаете, что химические
формулы веществ показывают количественные
соотношения, в которых атомы соединяются между
собой, вы также научились рассчитывать массовую
долю элемента по химической формуле вещества.
Например, в воде Н 2 О на один атом
кислорода приходится два атома водорода, или 11% Н и 89% О. В углекислом газе СО 2 на
один атом углерода приходится два атома
кислорода. (демонстрация моделей молекул
данных веществ. )
)
Валентность
Учитель. Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H 2 O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности
элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н 2 О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО 2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность
элемента, исходя из таблицы Д. И.Менделеева?
И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
Последовательность действий | Составление формулы оксида фосфора |
1. | |
2. Определить валентности элементов | |
3. Найти наименьшее общее кратное численных значений валентностей | |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10: 5 = 2, 10: 2 = 5; |
5. Записать индексы при символах элементов | |
6. Формула соединения (оксида) |
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент,
который находится в таблице Д.И.Менделеева
правее и выше, а высшую валентность – элемент,
расположенный левее и ниже. (Демонстрация
таблицы Д.И.Менделеева.)
(Демонстрация
таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 1. Проверьте, правильно ли
написаны формулы следующих соединений: Na 2 S,
KBr, Al 2 O 3 ,
Mg 3 N 2 , MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
Закрепление изученного материала
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле
их соединения занимает 1-е место, а какой –
2-е? Поясните на примере оксида NO 2 , используя
таблицу Д. И.Менделеева.
И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом приводит анализ ошибок.
Задание на дом. По учебнику «Химия-8» Л.С.Гузея: § 3.1, задания № 3, 4, 5, с. 51. Желающие могут подготовить сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
Рефлексивно-оценочный этап и подведение итогов урока
Объявить оценки за урок отвечавшим ученикам,
поблагодарить всех за работу на уроке. Провести
оценку эмоционального состояния по шкале (см.
рис.). Учитель еще раз напоминает вопросы, над
которыми необходимо подумать для эффективной
работы на следующем уроке.
Л и т е р а т у р а
Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия-8, М.: Дрофа, 2000; Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1988; Букреева Р.В., Быканова Т.А. Уроки новых технологий по химии. Воронеж, 1997.
Тема урока: Валентность. Составление формул по валентности.
Цель урока: способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ
Планируемые результаты обучения:
- Учащиеся должны уметь формулировать определение “валентность”, знать валентность атомов водорода и кислорода в соединениях, определять по ней валентность атомов других элементов в бинарных соединениях,
- Уметь разъяснять смысл понятия “валентность” и последовательность действий при определении валентности атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: валентность.
Оборудование:
шаростежневые модели атомов, пластмассовые ящики с песком, инструктивные карты обучающихся, компьютер, проектор.
Ход урока
I.Организационный момент.(2 мин.)
Здравствуйте, ребята! Я очень рада вас видеть! Присаживаться могут те, кто назовёт по одному внешнему признаку химической реакции!
II.Проверка домашнего задания.(6 мин.)
Совсем недавно мы с вами изучили символы химических элементов, учились писать формулы и сейчас я предлагаю проверить ваши знания в игре «Химический тир», для этого разделимся на две команды: Саша и Никита пройдут к монитору, они будут «техническими исполнителями», напоминаю правила игры-перед вами всплывают пять мишеней, но только на одной правильное изображение, именно в эту мишень вы должны выстрелить! (Игра «Химический тир») Резко зажмурьте глаза и откройте!
III.Сообщение темы и цели урока.(2 мин.)
Тема нашего урока «Валентность. Составление формул по валентности.» Давайте попробуем сформулировать цель нашего урока! Запишите в тетрадь дату и тему урока.
IV.Объяснение нового материала. (20 мин.)
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: помогите мне, с помощью ваших карточек, записать формулы соединений водорода и хлора, водорода и кислорода, азота и водорода, углерода и водорода. Сравните качественный и количественный состав в молекулах: HCl , H 2 O, NH 3 , CH 4 .
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
А чем они отличаются друг от друга, мы ответим позже! Сейчас я предлагаю вам необычный фрагмент урока, он называется «Сенд-плэй», это английское слово, может кто-то переведёт? (Игра с песком).
Пройдите к столу, в этих ящиках спрятан сюрприз, но прежде чем мы доберёмся до него, давайте « поскользим» ладонями по поверхности песка, выполняя зигзагообразные и круговые движения,выполните те же движения, поставив ладонь на ребро,“пройдитесь” ладошками по проложенным трассам, оставляя на них свои следы, поиграйте по поверхности песка, как на клавиатуре пианино или компьютера. А теперь погрузитесь руками в песок и нащупайте «сюрприз», не доставая ничего попробуйте догадаться: Что это? Протрите руки влажными салфетками и соберите модели HCl , H
2
O, NH
3
, CH
4.
Работаем в парах.
А теперь погрузитесь руками в песок и нащупайте «сюрприз», не доставая ничего попробуйте догадаться: Что это? Протрите руки влажными салфетками и соберите модели HCl , H
2
O, NH
3
, CH
4.
Работаем в парах.
Предлагаю вернуться к вопросу, а чем же отличается состав этих молекул?
Предполагаемый ответ:
- HCl – один атом хлора удерживает один атом водорода,
- H 2 O – один атом кислорода удерживает два атома водорода,
- NH 3 – один атом азота удерживает три атома водорода,
- CH 4 – один атом углерода удерживает четыре атома водорода.
Возникает проблема: Почему различные атомы удерживают различное количество атомов водорода? (Выслушиваем варианты ответов учащихся).
Вывод:
У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью.(На доску прикрепить карточку с термином) Слово “валентность” происходит от лат. valentia – сила. Обратите внимание на орфограммы этого слова, они подчёркнуты! Нужно будет записать новый термин в словарик. Откройте учебник на странице 32, найдите определение, прочтите вслух.
Откройте учебник на странице 32, найдите определение, прочтите вслух.
Валентность обозначается римскими цифрами.
Валентность атома водорода принята за единицу, а у кислорода – II.
Я раздаю вам алгоритм определения валентности и мы пробуем применить его на практике: (учитель работает у доски)
Алгоритм определения валентности.
Пример | ||
H 2 S, Cu 2 O | ||
I | II | |
2 | 2 | |
2 | 2 | |
I II | I II |
V.Закрепление.(4 мин.)
В течение четырёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
- Определите валентность атомов химических элементов по формулам соединений: NH 3 , Au 2 O 3 , SiH 4 , CuO.
- Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
- Творческий уровень (“5”). Найдите закономерность в последовательности формул: N 2 O, NO, N 2 O 3
Работа над ошибками. Ответы на обратной стороне доски.
VI. Подведение итогов урока.(5 мин.)
Наш урок подходит к концу, у вас есть возможность сделать самооценку своей деятельности на уроке. Вам предлагается “Мишень эффективности”.
Отметьте свои знания по новой теме, отметив на рисунке буквой своего имени соответствующий сектор.
Беседа с учащимися, на следующем уроке мы продолжим изучение этой темы и сравним результаты «Мишени эффективности»
- Какую проблему мы поставили в начале урока?
- К какому выводу мы пришли?
- Дать определение “валентности”.

- Чему равна валентность атома водорода? Кислорода?
- Достигли цели урока?
Оценка работы учащихся в целом и отдельных учащихся.
VII. Домашнее задание:(1 мин.) § 11-12, стр. 32–34, упр.4 на стр.37.
Предварительный просмотр:
Sand-play.
Игры на песке — одна из форм естественной деятельности ребенка.
Принцип “терапии песком” был предложен еще Карлом Густавом Юнгом, замечательным психотерапевтом, основателем аналитической терапии. Быть может, естественная потребность человека возиться с песком, и сама его структура подсказали великому Юнгу эту идею. Формированием концепции “песочной терапии” (или “sand-play”) занимались, в основном, представители юнгианской школы.
Независимо от возрастной направленности, пескотерапия помогает:
— развивать познавательные процессы (восприятие, внимание, память, образно-логическое мышление, пространственное воображение), процессы саморегуляции;
— развивать сенсорно-перцептивную сферу, творческий потенциал, формировать коммуникативные навыки;
— тренировать мелкую моторику рук;
— гармонизировать психоэмоциональное состояние;
— формировать установку на положительное отношение к себе.
Познавательные игры на песке.
1. Знакомство с окружающим миром.
Дикие и домашние животные, насекомые, леса, поля, реки, озера, моря, острова, профессии, город, транспорт, быт.
2. Географические игры.
Моделируем в песочнице различные климатические зоны и жизнь в них.
3. Фантастические игры.
В песочнице имитируется жизнь на других планетах: лунный ландшафт, поверхность Марса.
4. Исторические игры.
Только в песочнице ребенок может все сам построить и проиграть, став участником исторических событий.
5. Игры-экскурсии по городу.
Родина начинается с родного города, селения. Его история оказывает существенное влияние на образ мыслей и жизни жителей. История города, как и жизненный путь человека, имеет свои радости и печали. Эти события можно разыгрывать на песке.
Предварительный просмотр:
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Алгоритм определения валентности | Пример | |
1. | H 2 S, Cu 2 O | |
2. Обозначьте известную валентность элемента | I | II |
3. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента. | 2 | 2 |
4. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности. | 2 | 2 |
5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента | I II | I II |
Предварительный просмотр:
В ал ентн о ст ь
N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
Репродуктивный уровень (“3”).
Прикладной уровень (“4”).
Творческий уровень (“5”).
N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений:
NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны:
MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул:
N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений:
NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны:
MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул:
N
2
O, NO, N
2
O
3
и проставьте валентности над каждым элементом.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений:
NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны:
MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул:
N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений:
NH 3 , Au 2 O 3 , SiH 4 , CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны:
MnO, Fe 2 O 3 , CrO 3 , CuO, K 2 O, СаH 2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул:
N 2 O, NO, N 2 O 3 и проставьте валентности над каждым элементом.
C
оставление
бинарных формул
по валентностям химических элементов
Бинарная
химическая формула – это формула химического соединения, в состав которого
входят два вида атомов. | |||||||||||||||||||||
ОКСИДЫ | СУЛЬФИДЫ | ХЛОРИДЫ | |||||||||||||||||||
Оксид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является кислород, с валентностью (II) . Na 2 ОCaО P2О5 | Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II) . K 2 SMgS Al 2 S 3 | Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I) . FeCl 3NaCl CaCl 2 | |||||||||||||||||||
Общая формула где Э – элемент; Х – валентность элемента | Общая формула Задание — Алгоритм Составьте бинарные формулы соединений по их названиям:Оксид калия, сульфид алюминия, хлорид меди (II ) Решение:
Запомните! Особенности составления химических формул соединений. 1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO 3. В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов. 2) Атом металла стоит в формуле на первое место. 2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами. 3) Атом металла ставится в формуле на первое место. Задания для закрепления №1. Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы: III №2. Составьте формулы молекул для следующих соединений: 1) меди и кислорода, 2) цинка и хлора, 3) калия и йода, 4) магния и серы. №3. Используя материалы лекции составьте бинарные формулы следующими элементами:А) бор и кислород; Б) алюминий и хлор; В) литий и сера.
Используя материалы лекции составьте формулы веществ по их названиям: №6. Определите валентность химических элементов по формулам их соединений: NH 3 FeCl 3 Cr 2 O 3 SO 3 CH 4 P 2 O 5 | ||||||||||||||||||||
Тип урока. Комбинированный.
Комбинированный.
Методы обучения. Частично поисковый.
Цели. Дидактическая: закрепить понятие “валентность”, навыки определения валентности по формуле и Периодической таблице.
Психологическая: вызвать интерес к предмету, выработать умение логически рассуждать, грамотно выражать свои мысли.
Воспитательная: развивать умение работать коллективно, оценивать ответы своих товарищей.
Оборудование. Наборы для построения моделей молекул различных веществ, таблички-анаграммы для химической разминки, мишень эффективности
ХОД УРОКА
1. Ориентировочно-мотивационный этап
Химическая разминка
Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
“Одоврод” – у этого элемента самая маленькая относительная атомная масса.
“Маилинюй” – этот элемент называют
“крылатым” металлом.
“Дикосолр” – входит в состав воздуха.
“Цалький” – без него наши кости были бы непрочными и хрупкими.
“Озежел” – этот элемент входит в состав крови и участвует в переносе кислорода.
Учитель. Если вы легко разгадали слова-анаграммы, скажите себе: “Я – молодец!”
2. Актуализация знаний
Лови ошибку (Ребята ищут ошибку, работают парами, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа)
Слово “валентность”(от лат. “valentia”) возникло
в середине XIX в., в период завершения
химико-аналитического этапа развития химии.
“Валентность – способность атомов одного
элемента присоединять определенное количество
атомов другого элемента”. С одним атомом
одновалентного элемента соединяется один атом
другого одновалентного элемента (HF, NaCl). С атомом
двухвалентного элемента соединяются один
атом одновалентного (H 2 O) или один
атом двухвалентного (CaO). Значит, валентность
элемента можно представить как число, которое
показывает, со сколькими атомами одновалентного
элемента может соединяться атом данного
элемента.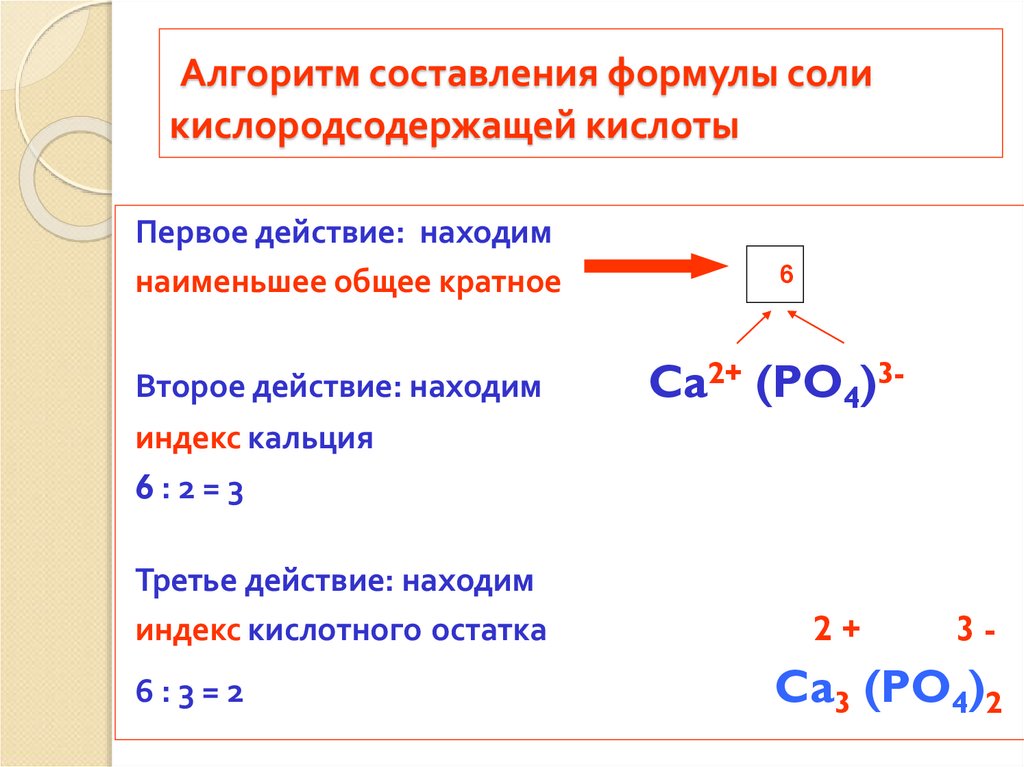
Есть элементы, которые имеют постоянную
валентность:
одновалентны (I) — H, Li, Na, Rb, Cs, F, I
двухвалентны (II) — Be, Mg, Ca, Sr, Ba, Zn, Cd K
трехвалентны (III) — B, Al, O
Крестики нолики: (Соедините элементы прямой, критерий правильного ответа – постоянная валентность выбранных элементов)
1 вариант
2 вариант
3. Изучение новых знаний
Задание 1: дана общая формула соединения водорода с каким-либо элементом
Зная, что валентность водорода равна I, определите валентность элемента.
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №1
схема 1
Задание для закрепления:
- определите валентности элементов в соединениях с водородом: PH 3 , HF, H 2 S, CaH 2 ,
- назовите соединения.

Задание 2: таким же способом можно определить валентности элементов в соединениях с кислородом зная, что кислород двухвалентен. Например:
Ребята работают парами, при необходимости объединяются в четвёрки, спорят, совещаются. Придя к какому-то мнению, предлагают свой аргументированный вариант ответа. В результате получаем схему №2
схема 2
Задание для закрепления:
- определите валентности элементов в соединениях с кислородом:
- Как называются бинарные соединения, содержащие кислород?
NO 2 , N 2 O 5 , SO 2 , SO 3 , Cl 2 O 7 .
Задание 3: что же нужно обязательно знать, чтобы определить валентность элементов в бинарном соединении? (валентность одного из элементов)
Определите валентность атомов в соединении
Ребята работают парами, при
необходимости объединяются в четвёрки, спорят,
совещаются. Придя к какому-то мнению, предлагают
свой аргументированный вариант ответа. В
результате получаем схему №3
В
результате получаем схему №3
Учитель: какая из приведённых схем
схема 2
наиболее полно отражает правило определения валентности по формуле? (схема 3, т.к.она отражает общий случай, а схемы 1 и 2 лишь частные)
4. Закрепление изученного материала.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 4. Проверьте, правильно ли написаны формулы следующих соединений: Na 2 S, KBr, Al 2 O 3 , Mg 3 N 2 , MgO.
5. Обобщение и систематизация знаний.
Творческая работа в группах
Задание 5. Используя наборы для составления моделей молекул различных веществ, составьте формулы и модели молекул для следующих соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы отчитывается о выполненном задании и вместе с классом проводит анализ ошибок.
Задание 6. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка.
Задание 7. Запишите порядок действия при составлении формул веществ, анализируя предложенный пример
Порядок действия | |
6. Рефлексия
У Вас есть возможность сделать самооценку своей деятельности на уроке. Вам предлагается “Мишень эффективности”.
Отметьте свои знания по новой теме, отметив на рисунке соответствующий им сектор штриховкой. Сдайте свои записи.
7. Домашнее задание. По учебнику
“Химия-8” (УМК Кузнецова Н.Е. и др.) § 14,
упражнение1-71 обязательное (дополнительные с 1-72
по 1-74).
Домашнее задание. По учебнику
“Химия-8” (УМК Кузнецова Н.Е. и др.) § 14,
упражнение1-71 обязательное (дополнительные с 1-72
по 1-74).
Сообщения о французском ученом Ж.Л.Прусте и английском ученом Дж.Дальтоне.
Литература
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений.- М.: Вентана-Граф, 2010. – 320с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8-9 классы: Учебно-методическое пособие.- М.: Вентана-Граф, 2004. – 352с.
- Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: В 2-х частях. Часть I.– М.: Школьная пресса, 2002.- 144с.
- Кузнецова Л.М. Новая технология обучения химии в 8 классе.- Обнинск: Титул,1999.- 208с.:ил
Химия рецептур — Американское химическое общество
Если вам нравится решать сложные головоломки и регулярно находить творческие решения необычных задач, эта карьера может быть для вас.
Типовые рабочие функции
Химия рецептур — это отрасль производства, которая имеет дело с веществами, которые не реагируют друг с другом, но тем или иным образом вносят свой вклад в конечный продукт. Например, таблетка аспирина содержит аспирин, красители, ароматизаторы, связующие вещества и т. д.Они не реагируют друг с другом, но все играют роль в конечном продукте.
Формулировка — это не только наука, но и искусство, и для ее освоения требуется много времени. Ученые в этой области находят увлекательным поиск правильной комбинации ингредиентов, соблюдая баланс между качеством продукта, стабильностью, стоимостью и многими другими факторами.
Типичные должностные обязанности химика-разработчика включают:
- Планирование и проведение исследований
- Разработка прототипов для использования фокус-группами или в клинических испытаниях
- Помощь в управлении клиническими испытаниями, пилотными исследованиями и панельными тестами
- Анализ результатов исследований и написание отчетов для корпоративных учетных записей и/или регулирующих органов
- Помощь в переходе от разработки к серийному производству
Терпение является ключевым качеством химика, так как могут потребоваться годы, чтобы подобрать правильную комбинацию ингредиентов для конкретного применения… и это может оказаться невозможным. Но награда за то, что вы увидели продукт, который вы помогли разработать, на полках магазина, является значительным источником удовлетворения.
Но награда за то, что вы увидели продукт, который вы помогли разработать, на полках магазина, является значительным источником удовлетворения.
Карьерный рост
Большинство возможностей для химиков-рецепторов открываются в крупных производственных компаниях в различных отраслях промышленности. Количество вакансий в любой отрасли невелико, а конкуренция жесткая. Большинство людей специализируются на определенном классе соединений или промышленности; перемещение между ними происходит исключительно редко.
Требуются химики-рецепторы в генерическую фармацевтическую промышленность.Другие области применения включают:
- Пестициды и инсектициды
- Краски и покрытия
- Продукты питания
- Клеи
- Косметика и парфюмерия
- Товары для дома
Наука о рецептурах — это практическая карьера. Большинство людей начинают работать у станка и остаются рядом с ним на протяжении всей своей карьеры. Продвижение происходит в форме более крупных и сложных проектов, большей ответственности и, в конечном итоге, обучения новых ученых-формулировщиков.
Продвижение происходит в форме более крупных и сложных проектов, большей ответственности и, в конечном итоге, обучения новых ученых-формулировщиков.
Начало работы
Для начала работы в этой области приемлема степень бакалавра или магистра. Большая часть обучения проводится на рабочем месте путем обучения у старшего химика по рецептурам.
Химия рецептуры
Химия рецептуры Дэвид ЯнгЦитоклонал Фармасьютикс Инк. Химия рецептуры является одним из несоответствий в химической промышленности. Есть много рабочих мест, но очень мало программ на получение степени, которые адекватно подготовить студентов к позиции формулировки.В результате большинство составов химики либо самоучки, либо, по сути, были учениками под руководством опытных исследователей.
Проще говоря, формулировка – это смешивание соединений, которые не реагируют в
для того, чтобы получить смесь с нужными характеристиками. Примеры
составы – это клеи, краски, чернила, косметика, моющие средства и
многие фармацевтические продукты. Это работа по разработке продукта, которая
очень сосредоточен на характеристиках, необходимых для того, чтобы продукт был
выгодно.
Это работа по разработке продукта, которая
очень сосредоточен на характеристиках, необходимых для того, чтобы продукт был
выгодно.
Поскольку никаких реакций не происходит, нет смысла работать с граммом. формульные массы соединений. Большинство составов изготавливаются путем измерения жидкости по объему и твердые вещества по массе. Продукт может выйти на рынок без написания каких-либо химических уравнений.
Химические принципы
Несмотря на отсутствие химических реакций, существует множество аспекты химии, присутствующие в рецептуре. Немного химии речь идет о термодинамике смешения, фазовых равновесий, растворов, химия поверхности, коллоиды, эмульсии и суспензии.Еще важнее как эти принципы связаны с адгезией, устойчивостью к атмосферным воздействиям, текстура, срок годности, биоразлагаемость, аллергическая реакция и многое другое. другие свойства. Довольно много было сделано методом проб и ошибок. В этом
схема, химик-разработчик продукта будет иметь список веществ
используются для модификации смесей (т. е. загустителей). Затем они пройдут через
метод проб и ошибок, чтобы увидеть, какая концентрация какого соединения будет
лучше всего подходят для конкретного приложения.Конечно, ученые и
инженеры, нанятые для выполнения этой работы, осознают ценность наличия
понимание вовлеченных процессов, чтобы направлять их выбор того, какой
пытаться. В продуктовом дизайне больше, чем во многих других областях, новые исследователи
нанимаются с очень базовыми знаниями и проходят внутреннюю подготовку, чтобы понимать
составы. В последние годы наблюдается рост
работать над развитием основных научных принципов и применять их
в виде программного обеспечения для прогнозирования составов.В данное время,
некоторые части поля следуют этому подходу, в то время как другие части
области до сих пор используют схему проб и ошибок.
е. загустителей). Затем они пройдут через
метод проб и ошибок, чтобы увидеть, какая концентрация какого соединения будет
лучше всего подходят для конкретного приложения.Конечно, ученые и
инженеры, нанятые для выполнения этой работы, осознают ценность наличия
понимание вовлеченных процессов, чтобы направлять их выбор того, какой
пытаться. В продуктовом дизайне больше, чем во многих других областях, новые исследователи
нанимаются с очень базовыми знаниями и проходят внутреннюю подготовку, чтобы понимать
составы. В последние годы наблюдается рост
работать над развитием основных научных принципов и применять их
в виде программного обеспечения для прогнозирования составов.В данное время,
некоторые части поля следуют этому подходу, в то время как другие части
области до сих пор используют схему проб и ошибок.
Какое место в учебной программе должна занимать химия рецептур? Лекция
обсуждение могло бы вписаться либо в общую химию, либо в физическую химию.
Лабораторный эксперимент может быть включен практически на любом уровне, но, возможно,
первокурсник лучше. К сожалению, составы не делают особенно
хороший дипломный исследовательский проект.Естественное сотрудничество и источник финансирования
для разработки проекта будет работать с промышленным партнером.
Тем не менее, стадия разработки продукта — это та стадия, на которой отрасли наиболее
чувствительны к безопасному хранению своих знаний в доме. Отрасли стремятся
работать с академическими партнерами над разработкой новых технологий, но
очень не решаются поделиться своими прибыльными коммерческими секретами с академическими
исследователи. Когда налажено сотрудничество, отрасль, естественно, положит
строгие ограничения на публикацию результатов (кроме патента,
ими).Поскольку академические исследователи основывают свой успех на количестве
публикациях, а не на прибыли, это неблагоприятный механизм для
также академические исследователи.
К сожалению, составы не делают особенно
хороший дипломный исследовательский проект.Естественное сотрудничество и источник финансирования
для разработки проекта будет работать с промышленным партнером.
Тем не менее, стадия разработки продукта — это та стадия, на которой отрасли наиболее
чувствительны к безопасному хранению своих знаний в доме. Отрасли стремятся
работать с академическими партнерами над разработкой новых технологий, но
очень не решаются поделиться своими прибыльными коммерческими секретами с академическими
исследователи. Когда налажено сотрудничество, отрасль, естественно, положит
строгие ограничения на публикацию результатов (кроме патента,
ими).Поскольку академические исследователи основывают свой успех на количестве
публикациях, а не на прибыли, это неблагоприятный механизм для
также академические исследователи.
Следующие разделы дают представление о проблемах, решаемых формулировкой
химики в ряде областей. Есть много других областей, в которых
составы важны. Дополнительные области исследований см. в ссылках.
Дополнительные области исследований см. в ссылках.
Клеи
Большинство клеев представляют собой смесь связующего вещества и растворителя. просачиваться в мельчайшие трещинки и затвердевать по мере испарения растворителя.Немного клеи, такие как суперклей и эпоксидная смола, на самом деле вступают в химическую реакцию по мере их затвердевания. Клеи на силиконовой основе используются при высоких температурах. приложений, таких как ремонт глушителя автомобиля.Краски
Компонентами краски являются основной пигмент, смесь соединений, придайте ему определенный цвет, связующее и растворитель, который испарится для придания твердой поверхности. Дополнительный пигмент может быть добавлен для придания глянцевый внешний вид. Некоторые из классов красок на водной основе, латексные, на масляной, акриловой и эпоксидной основе.Краски для дома разработаны для баланса долговечности и приемлемой стоимости. Более дорогие краски повышенной стойкости используются для кузовов автомобилей и самолетов.
Чернила
Совершенно разные рыночные силы стимулируют развитие разных типов чернил. Чернила, используемые для газетной бумаги, такой как газеты или романы в мягкой обложке, должен быть дешевым и иметь консистенцию густого ила для правильной подачи через красочные валики печатного станка. Истинное качество цвета важно для глянцевых журналов.Характеристики потока важны для ручек и компьютерные принтеры. Рецептура хорошего копировального аппарата или лазера тонер принтера зависит от его электростатических свойств.Косметика
За последние годы в косметике был сделан ряд достижений. То первичные изменения заключаются в неаллергенных составах и большей продолжительности износостойкость. Это очень конкурентный рынок, на котором особый взгляд, маркетинг или удобное приложение иногда могут сделать продукт более прибыльнее других факторов.Моющие средства
Детергенты относятся к типу поверхностно-активных веществ, поскольку они изменяют поверхностное натяжение. решения. Последние достижения в области моющих средств для стирки включают отбеливатель.
заменители и добавление ферментов. Идеальный фермент – это тот, который
эффективно разрушает органические вещества, из которых состоят некоторые пятна
при этом мы надеемся, что наносим минимальный ущерб органическим веществам, из которых состоит одежда.
сделаны из. Моющие средства для мытья посуды созданы для эффективной очистки
не повреждая кожу человека, моющего посуду.Еще один важный
областью являются промышленные моющие средства, которые могут иметь гораздо более мощные ингредиенты.
под конкретный производственный процесс.
решения. Последние достижения в области моющих средств для стирки включают отбеливатель.
заменители и добавление ферментов. Идеальный фермент – это тот, который
эффективно разрушает органические вещества, из которых состоят некоторые пятна
при этом мы надеемся, что наносим минимальный ущерб органическим веществам, из которых состоит одежда.
сделаны из. Моющие средства для мытья посуды созданы для эффективной очистки
не повреждая кожу человека, моющего посуду.Еще один важный
областью являются промышленные моющие средства, которые могут иметь гораздо более мощные ингредиенты.
под конкретный производственный процесс.Фармацевтика
Фармацевтическая промышленность – одна из немногих, в которой существуют превосходные курсы формулировок, преподаваемые в университетах. Аспект формулировки Фармацевтика относится к доставке лекарств. Полезность препарата заключается в основывается не только на его эффективности в лечении состояния, но и на насколько легко это может быть введено пациенту. Идеальный препарат это
в форме таблеток и мягкий вкус. Таблетки изготовлены с дополнительным
ингредиенты, чтобы предотвратить расстройство желудка, дать время выпуска и удерживать
таблетка вместе как твердое тело. Жидкие лекарства часто приходится смешивать с
крепкие ароматизаторы или спирт, чтобы скрыть вкус лекарства.
Идеальный препарат это
в форме таблеток и мягкий вкус. Таблетки изготовлены с дополнительным
ингредиенты, чтобы предотвратить расстройство желудка, дать время выпуска и удерживать
таблетка вместе как твердое тело. Жидкие лекарства часто приходится смешивать с
крепкие ароматизаторы или спирт, чтобы скрыть вкус лекарства.Ссылки
Отличным введением в отдельные области применения является номер. «Энциклопедия химической технологии Кирка-Отемера» Дж. И. Крошвиц, М.Howe-Grant Eds., John Wiley & Sons (1996)
См. статьи о клеях, аэрозолях, асфальте, строительных материалах, Цемент, покрытия, коллоиды, красители, композитные материалы, контролируемые Технология выпуска, косметика, пеногасители, моющие средства, стоматологические материалы, Диспергаторы, системы доставки лекарств, красители, эмульсии, эмали, эпоксидные смолы, Взрывчатые вещества и пропелленты, наполнители, пленки и пленочные материалы, ароматизаторы и Специи, флокулянты, пены, желатин, камеди, препараты для волос, чернила, Латексная технология, металлические покрытия, краска, бумага, парфюмерия, пигменты, Полироли, огнеупорные покрытия, антиадгезивы, репелленты, кровельные материалы, Герметики, мыло, золь-гелевая технология, спреи, припои и припои, Растворители, поверхностно-активные вещества, деготь и смола и гидроизоляция.

Документы в Интернете по промышленной органической химии находятся по адресу
. http://c.chem.ualberta.ca/~plambeck/che/struct/s0909.htm
Документы в Интернете, относящиеся к лекарственным препаратам:
. http://www.clinmark.com/drug-formulation.html
http://w3.ouhsc.edu/bsmith/Drug_Delivery_Systems_I/PHAR%207614%20Syllabus.html.html
Многие из фундаментальных принципов исходят из физической химии.Хороший
отправной точкой являются разделы о растворах, фазовом равновесии, поверхности
химия и твердые вещества и жидкости в
И. Н. Левин «Физическая химия» McGraw-Hill (1995)
Сборник методов прогнозирования химических свойств:
.
У. Дж. Лайман «Справочник по методам оценки химических свойств»
Макгроу-Хилл (1982)
Вернуться к оглавлению.
Составы в химии: определение, создание и использование
Составы
Сода является примером состава . Состав можно описать как смесь химических веществ, не вступающих в химические реакции. Химические вещества в рецептуре выбраны из-за их специфических свойств, и при их сочетании получается конечный продукт с желаемыми характеристиками. Химия рецептур — это широкая область, отвечающая за производство многих продуктов, используемых в повседневной жизни. Некоторыми примерами являются краски, лекарства, солнцезащитный крем, топливо, чистящие средства, удобрения и обработанные пищевые продукты. Есть много вещей, которые необходимо учитывать при разработке новых продуктов.Химик по рецептуре должен учитывать, как продукт будет использоваться потребителем, цену компонентов, любое негативное воздействие компонентов на здоровье, дополнительные желаемые эффекты, среди прочего.
Состав можно описать как смесь химических веществ, не вступающих в химические реакции. Химические вещества в рецептуре выбраны из-за их специфических свойств, и при их сочетании получается конечный продукт с желаемыми характеристиками. Химия рецептур — это широкая область, отвечающая за производство многих продуктов, используемых в повседневной жизни. Некоторыми примерами являются краски, лекарства, солнцезащитный крем, топливо, чистящие средства, удобрения и обработанные пищевые продукты. Есть много вещей, которые необходимо учитывать при разработке новых продуктов.Химик по рецептуре должен учитывать, как продукт будет использоваться потребителем, цену компонентов, любое негативное воздействие компонентов на здоровье, дополнительные желаемые эффекты, среди прочего.
Идентификация составов
Ключевым отличительным признаком составов является то, что смеси химических веществ не вступают в химическую реакцию друг с другом. Конечный продукт использует свойства всех ингредиентов для достижения желаемого эффекта. Составы отличаются от чистого вещества , вещества, состоящего только из атомов или молекул одного типа.Хорошим примером, который отличает чистое вещество от состава , является различие между металлом и сплавом. Блок железа — это чистое вещество, состоящее только из атомов железа. Сталь представляет собой сплав , смесь металла с другим элементом. Обычно сталь состоит из атомов железа и углерода. Добавление атомов углерода в сталь приводит к получению металлического сплава с характеристиками, отличными от характеристик железа. Например, сталь более долговечна, чем железо, что делает ее более предпочтительным продуктом для приложений, требующих прочного и долговечного материала.
Составы отличаются от чистого вещества , вещества, состоящего только из атомов или молекул одного типа.Хорошим примером, который отличает чистое вещество от состава , является различие между металлом и сплавом. Блок железа — это чистое вещество, состоящее только из атомов железа. Сталь представляет собой сплав , смесь металла с другим элементом. Обычно сталь состоит из атомов железа и углерода. Добавление атомов углерода в сталь приводит к получению металлического сплава с характеристиками, отличными от характеристик железа. Например, сталь более долговечна, чем железо, что делает ее более предпочтительным продуктом для приложений, требующих прочного и долговечного материала.
Примеры химических составов
Нам известно, что составы состоят из более чем одного типа атомов или молекул. Мы также знаем, что рецептуры производятся без химической реакции. Это определение состава является очень широким, поскольку область химии состава является очень широкой темой. Чтобы помочь в дальнейшем объяснении составов , мы рассмотрим подробный пример состава , чтобы дополнительно продемонстрировать, что такое состав и почему важны составы .
Чтобы помочь в дальнейшем объяснении составов , мы рассмотрим подробный пример состава , чтобы дополнительно продемонстрировать, что такое состав и почему важны составы .
Солнцезащитный крем
УФ-излучение высокой энергии, производимое солнцем, может достигать поверхности земли. Длительное воздействие этого высокоэнергетического света вызывает солнечные ожоги и связано с некоторыми видами рака кожи. Солнцезащитный крем — это продукт, который позволяет длительное время находиться на солнце, не страдая от негативных последствий солнечных ожогов. Активным ингредиентом солнцезащитного крема, который защищает нас от вредного ультрафиолетового излучения, является химическое вещество, которое действует как УФ-фильтр. Эти химические вещества либо поглощают, либо отражают УФ-свет высокой энергии.Примером такого химического вещества является диоксид титана. Как вы можете видеть на картинке ниже, диоксид титана поставляется в виде порошка. Хотя диоксид титана может предотвратить вредное воздействие УФ-излучения, сам по себе он не является хорошим солнцезащитным средством. Могли бы вы представить себе, как вы пытаетесь покрыть себя пудрой перед тем, как пойти на пляж, и в то же время пытаетесь удержать пудру от стекания с вашей кожи? По этой причине диоксид титана сочетается с некоторыми типами лосьонов, поэтому его можно наносить на кожу. Добавляются дополнительные ингредиенты, такие как масло, чтобы вода не удаляла солнцезащитный крем после нанесения на кожу, и увлажняющий крем, чтобы защитить кожу от высыхания.Все эти ингредиенты, наряду с другими химическими веществами, используются для производства солнцезащитного крема, который мы используем сегодня. У каждого ингредиента есть цель для получения полезного и описываемого продукта.
Могли бы вы представить себе, как вы пытаетесь покрыть себя пудрой перед тем, как пойти на пляж, и в то же время пытаетесь удержать пудру от стекания с вашей кожи? По этой причине диоксид титана сочетается с некоторыми типами лосьонов, поэтому его можно наносить на кожу. Добавляются дополнительные ингредиенты, такие как масло, чтобы вода не удаляла солнцезащитный крем после нанесения на кожу, и увлажняющий крем, чтобы защитить кожу от высыхания.Все эти ингредиенты, наряду с другими химическими веществами, используются для производства солнцезащитного крема, который мы используем сегодня. У каждого ингредиента есть цель для получения полезного и описываемого продукта.
Краткий обзор урока
Составы окружают нас повсюду и бывают разных форм. Состав представляет собой смесь химических веществ, не вступающих в химические реакции. Эта смесь химических веществ предназначена для производства конечного продукта с желаемыми характеристиками, например солнцезащитного крема.Составы отличаются от чистых веществ , веществ, состоящих только из одного типа химических веществ. Чтобы лучше понять и идентифицировать составы , лучше всего посмотреть конкретные примеры составов, такие как упомянутый выше пример солнцезащитного крема или соды. Как видно из приведенного выше примера, солнцезащитный крем состоит из нескольких компонентов (УФ-фильтр, лосьон, масло и т. д.), которые не вступают в химическую реакцию друг с другом. Все эти компоненты объединены для того, чтобы наилучшим образом предотвратить солнечные ожоги, сохраняя при этом простой в использовании и востребованный потребителем продукт.
Эта смесь химических веществ предназначена для производства конечного продукта с желаемыми характеристиками, например солнцезащитного крема.Составы отличаются от чистых веществ , веществ, состоящих только из одного типа химических веществ. Чтобы лучше понять и идентифицировать составы , лучше всего посмотреть конкретные примеры составов, такие как упомянутый выше пример солнцезащитного крема или соды. Как видно из приведенного выше примера, солнцезащитный крем состоит из нескольких компонентов (УФ-фильтр, лосьон, масло и т. д.), которые не вступают в химическую реакцию друг с другом. Все эти компоненты объединены для того, чтобы наилучшим образом предотвратить солнечные ожоги, сохраняя при этом простой в использовании и востребованный потребителем продукт.
Состав и действие | Карьера
Когда Даррен Рагеб искал свою первую работу, его внимание привлекло объявление в журнале New Scientist. «Наша должность называлась химик по рецептурам, — говорит он, — и первое, что я сделал, — погуглил, чтобы узнать, что это такое!» возможностей трудоустройства в этой сфере. Ученые-разработчики работают в самых разных отраслях, включая фармацевтику, косметику, товары для дома и личной гигиены, агрохимию, пищевую промышленность и топливо.Но всех их объединяет одно: умение умело смешивать ингредиенты для создания новых продуктов.
Ученые-разработчики работают в самых разных отраслях, включая фармацевтику, косметику, товары для дома и личной гигиены, агрохимию, пищевую промышленность и топливо.Но всех их объединяет одно: умение умело смешивать ингредиенты для создания новых продуктов.
Рагеб получил работу и присоединился к компании Syngenta, занимающейся наукой о растениях, где он разработал новые составы фунгицидов и гербицидов. Это была крутая кривая обучения. «Агрохимические исследования — захватывающая область, — говорит он. «Рецепты сложны, и сложно разрабатывать продукты, которые наносят активные ингредиенты на лист, а затем делают то, для чего они предназначены.
Сейчас Рагеб возглавляет программу разработки рецептур в Chemistry Innovation, одной из 15 британских сетей передачи знаний. Работая на национальном уровне, он знает, что ищут компании. Он говорит, что успешный ученый-формулист движим любопытством, умеет хорошо общаться, умеет хорошо сотрудничать и любит разнообразие. «Это идеальная работа для человека с менталитетом решения проблем», — говорит он. «Эта работа, в конечном счете, заключается в том, чтобы превратить химию в продукт, поэтому вы должны быть в восторге от того, что новое лекарство проходит клинические испытания или новый косметический продукт на полке.
«Эта работа, в конечном счете, заключается в том, чтобы превратить химию в продукт, поэтому вы должны быть в восторге от того, что новое лекарство проходит клинические испытания или новый косметический продукт на полке.
Я сделал это
Пол Дженкинс, директор по исследованиям конструкционных материалов и технологических процессов в Unilever, разделяет это мнение. Когда он впервые присоединился к Unilever, он помог запустить новую технологию для продуктов для волос. Недавно гостив у подруги, он обнаружил, что она уже выпила третью бутылку кондиционера для шелка, основанного на его запатентованной технологии. «Это настоящий кайф, когда люди покупают ваш продукт и любят его», — говорит Дженкинс.
Обученные специалисты по рецептурам обладают целым рядом передаваемых навыков, что означает, что эта роль может стать хорошей ступенькой на пути к поиску ниши в отрасли.«Ты действительно в центре всего; работая на стыке вопросов регулирования, производства и продаж», — говорит Рагеб. Он также добавляет, что эта работа предлагает хороший баланс между лабораторной и офисной работой. «Вы можете пойти на химический завод, чтобы помочь увеличить производство, на собраниях по планированию проекта, чтобы обсудить науку с техническими экспертами, или поговорить с группами потребителей, чтобы понять их потребности». Необязательно готовить соискателей к карьере в науке о рецептурах, говорит Рагеб, получивший степень магистра химии в Университете Лидса, Великобритания.«Степени по химии охватывают фундаментальные науки о коллоидах и поверхностно-активных веществах, которые имеют отношение к науке о рецептурах, но недостаточно сильны, чтобы перенести эти знания из лаборатории на рабочее место», — говорит он. В результате, большинство ученых-разработчиков учатся своему делу на работе.
Он также добавляет, что эта работа предлагает хороший баланс между лабораторной и офисной работой. «Вы можете пойти на химический завод, чтобы помочь увеличить производство, на собраниях по планированию проекта, чтобы обсудить науку с техническими экспертами, или поговорить с группами потребителей, чтобы понять их потребности». Необязательно готовить соискателей к карьере в науке о рецептурах, говорит Рагеб, получивший степень магистра химии в Университете Лидса, Великобритания.«Степени по химии охватывают фундаментальные науки о коллоидах и поверхностно-активных веществах, которые имеют отношение к науке о рецептурах, но недостаточно сильны, чтобы перенести эти знания из лаборатории на рабочее место», — говорит он. В результате, большинство ученых-разработчиков учатся своему делу на работе.
Тем не менее, существуют образовательные возможности, специально предназначенные для начинающих ученых-разработчиков. Все большее число ученых степеней в области фармацевтики и пищевых продуктов сосредоточено на науке о рецептурах, и в настоящее время в Великобритании доступны как минимум два специализированных курса: центр подготовки докторантов по промышленной разработке рецептур в Бирмингемском университете и степень магистра в области рецептуры в Гринвичском университете. .
.
«То, что ищут рекрутеры, — это реальный опыт решения промышленных проблем, поэтому я бы посоветовал выбрать программу, в которой есть учебные компоненты, актуальные для отрасли, и исследовательские проекты, спонсируемые отраслью», — говорит Рагеб, добавляя, что это также позволяет Студент знакомится с потенциальными работодателями. Еще один способ познакомиться с работой ученых, занимающихся разработкой рецептур, — присоединиться к соответствующим заинтересованным группам, таким как научно-технологическая группа RSC.
В компании Chemistry Innovation Рагеб создает национальный центр разработки рецептур, который позволит компаниям сотрудничать в решении общих проблем.«Наука о рецептурах в настоящее время переживает ренессанс, — говорит он.
На горизонте стоит множество задач, таких как создание экологически безопасных красок или новых составов для персонализированного здравоохранения. «Это проблемы, которые могут помочь решить ученые-разработчики», — говорит Рагеб. «Я ожидаю, что в ближайшие несколько десятилетий в этой области появятся значительные возможности для карьерного роста».
«Я ожидаю, что в ближайшие несколько десятилетий в этой области появятся значительные возможности для карьерного роста».
Химия рецептур Карьера
Химия рецептур — это отрасль производства, которая занимается соединениями, которые не реагируют друг с другом, но имеют предпочтительные свойства в смеси.Это смешивание веществ в определенных количествах, которые не реагируют друг с другом, но создают смесь (СОСТАВ) с желаемыми характеристиками/свойствами, подходящими для конкретного применения/применения. Эти предметы включают краски, лаки, косметику, нефтепродукты, краски для окрашивания волос, клеи, лак для ногтей, антиперспиранты, чистящие средства, гербициды, антиперспиранты, солнцезащитные кремы, пищевые добавки, топливо, фармацевтические продукты, такие как лекарства, сплавы и т. д.
Эффективная формула требует сочетания искусства и науки.Компоненты выбираются из соображений совместимости, а не реакционной способности.
Многочисленные современные продукты состоят из комбинации нескольких химических веществ, каждое из которых добавляет преимущества готовому продукту для конкретного применения.
Например, для Таблетка обезболивающего содержит не только аспирин, но и красители, ароматизаторы, связующие и многие другие ингредиенты, которые не вступают в реакцию друг с другом, но играют решающую роль в конечном продукте.
Некоторые из них добавляются для повышения безопасности или эффективности лекарства, а другие помогают в процессе производства.Наука и искусство определения правильного сочетания ингредиентов при стабилизации качества продукта, стабильности, стоимости, а также многих других факторов является привлекательной проблемой, которая увлекает химиков.
Образование, квалификация
- Степень бакалавра или магистра или предпочтительно степень доктора философии. в биохимии, материаловедении, химии или смежных отраслях требуется быть химиком по рецептуре.

- Вы можете найти работу начального уровня со степенью бакалавра в области химии.
- Можно найти программы по косметической науке, химической биологии, медицинской химии или прикладной химии, хотя программы колледжей, специально предназначенные для карьеры в области химии рецептур, встречаются редко.
- Существует несколько официальных программ получения степени по рецептуре, например, курсы по химии и анализу пищевых рецептур, разработке биоматериалов и клинических лекарств, составлению рецептур, тестированию полимеров и свойствам энтальпии и термодинамики.
- Ученая степень может дать вам конкурентное преимущество и может регулярно заменять большой профессиональный опыт.
Основные требования химика-рецептора
- Замечательные презентационные и коммуникативные навыки.
- Знание фундаментальных и передовых методов и приемов составления рецептур.
Технические навыки
- Базовые навыки работы в исследовательской лаборатории, особенно в области аналитических методов оценки продукции.

- Математические и статистические навыки для сложного спекулятивного проектирования, а также оценки.
- Командная работа и навыки межличностного общения для сотрудничества с большими междисциплинарными группами.
- Способность оценивать результаты экспериментов, делать выводы и предлагать рациональные следующие шаги для достижения бизнес-целей.
- Способность работать в быстро меняющейся среде и одновременно управлять несколькими, меняя приоритеты.
- Критическое мышление и сильные аналитические способности.
- Профессиональные знания в области исчисления и алгебры.
Должностные обязанности химика по рецептуре
- Они проводят химический и физический анализ перспективных материалов, а также составов, отвечающих глобальным потребностям.
- Планирование, проектирование, а также проведение экспериментов для оптимизации биологической, маркетинговой, нормативной и производственной эффективности продукции.

- Планирование и контроль/выполнение лабораторной работы по разработке, осмыслению, а также тестированию новых и усовершенствованных производственных процедур для достижения согласованных целей.
- Доставьте важную информацию руководству и коллегам.
- Примите активное участие в крупномасштабном и заводском внедрении свежеразработанных продуктов.
- Создание и разработка новых методов сортировки для обеспечения удовлетворенности клиентов продукцией в любых условиях на рынке.
- Провести исследования долгосрочной стабильности продуктов.
- Помощь в управлении клиническими испытаниями, пилотными исследованиями и панельными тестами, чтобы сравнить ответы потенциальных клиентов на предлагаемые составы.
- Изучайте результаты экспериментальных исследований, а также создавайте отчеты как для корпоративных документов, так и для регулирующих органов.
- Замените вспомогательные вещества (неактивные компоненты) для повышения биодоступности низкорастворимых АФИ.

- Химик-разработчик рецептур требуется для выполнения задачи по улучшению и определению уникальных образований, чтобы внести изменения в списки технологий платформы.
- Они несут ответственность за то, чтобы оставаться в курсе, а также повышать свою эффективность с помощью нового поля и соответствующих предметов.
- Помогите химической промышленности своими знаниями об общих рецептурах.
- Поддерживать профессиональные партнерские отношения с исследовательскими центрами и медицинскими учреждениями.
- Обеспечить соответствующую презентацию составов на бизнес-конференциях и ассоциациях.
- Производить условия для производимых изделий.
- Создайте стоимость, а также документы стоимости для распределенных формул.
Рабочее пространство
Химики-рецепторы работают в самых разных секторах. Они могут разделить свое время на изучение новых решений в лаборатории, написание отчетов и помощь в создании новых производственных центров на пилотном заводе.
Информация о заработной плате
BLS прогнозирует увеличение занятости химиков на 6% в период с 2012 по 2022 гг. 2. Эксперты определили, что ученые-материаловеды должны ожидать роста занятости почти на 5% на основе прогнозов BLS. Несмотря на то, что химики по рецептурам должны продолжать играть жизненно важную роль в производстве, недавний экономический спад в этом секторе может повлиять на рост числа рабочих мест для ученых, занимающихся исследованиями и разработками.
По состоянию на 25 сентября 2020 года средняя заработная плата химика-рецептора составляет 66 300 долларов США.Однако диапазон заработной платы обычно составляет от 59 203 до 74 784 долларов.
В зависимости от множества решающих факторов, включая образование, сертификаты, дополнительные способности, опыт, заработная плата варьируется.
Средняя зарплата специалиста по разработке рецептур в Индии составляет 5 30 000 фунтов стерлингов.
История заработной платыЗарплата по уровню опытаТенденции будущей занятости
Наука о рецептурах — это карьера, которая необходима, но о которой мало кто знает.
Начинает появляться несколько программ на получение степени, так что вход в поле может постепенно стать более формализованным. Количество вакансий в любой отрасли невелико, что делает конкуренцию жесткой.
Профессиональные организации химиков-химиков
Плюсы работы химиком-химиком
- Возможность разрабатывать безопасные фармацевтические продукты, товары для здоровья, продукты питания, косметику и чистящие средства.
- Возможно высокий доход.
- Способность использовать экологически безопасные химические вещества и методы.
- Возможности для сотрудничества (может работать с биологами, инженерами или физиками).
Где найти работу?
- Академия
- Животноводство
- Фармацевтическая промышленность
- Биотехнологические фирмы
- Альтернативная энергетика
- Компании по защите растений
Химия рецептур Карьера
Рабочая группа по химическим составам
Цели, задачи и задачи Рабочей группы Основной целью этой рабочей группы является служить общей платформой для сбора европейских химиков и специалистов с общими интересами в области рецептуры.
Составление химических продуктов, также известное как дизайн продукта, представляет собой научную и технологическую область, посвященную искусству объединения отдельных компонентов с помощью соответствующих методов для получения желаемых структур и достижения целевых характеристик продукта. Эти конечные продукты обозначаются как рецептуры, которые изготавливаются путем точной комбинации ингредиентов. Коммерческие составы чрезвычайно распространены, такие как фармацевтические продукты, косметика, краски и красители, чистящие средства и моющие средства, пищевые продукты, смазочные материалы, пестициды, удобрения и т. д., среди многих других примеров.
Например, галеновая рецептура — это наука, описывающая принципы приготовления лекарственных средств, включающих активные ингредиенты, с целью контроля транспорта, доставки и действия активного соединения. Составление рецептуры является ключевым процессом, так как от него в значительной степени зависят фармакокинетика и профиль безопасности лекарственного средства, и, следовательно, лекарственная форма определяет терапевтическую эффективность лекарства.
В широком смысле формулировка касается создания продуктов для конкретных применений безопасным, эффективным и экономичным способом.Соответствующие комбинации ингредиентов позволяют получать структурированные жидкости, мягкие материалы или аэрозоли с четко определенными характеристиками в их технологическом применении.
Миссии и цели Миссии- Содействовать сотрудничеству между европейскими учеными в области рецептуры
- Содействовать обмену между учеными из научных кругов и промышленности и развитию взаимодействия с компаниями
- Содействовать обмену мнениями и размышлениям о преподавании рецептуры
- Распространение нашей деятельности на другие организации по всей Европе
- Развитие сотрудничества с другими научными европейскими организациями
- Установление регулярных периодических обменов между организациями-партнерами и промышленными сотрудниками
- Достижение широкого признания рецептуры как дисциплины в преподавании химии
- Сотрудничество с дополнительными сетями с целью создания группы по интересам в отношении рецептур в Европе
Руководитель группы
Ален Дюран, Университет Лотарингии, Нанси, Франция
Ответственный за веб-контент
Хорди Эскена, Институт передовой химии Каталонии (IQAC-CSIC), Барселона, Испания
Нанять химика по рецептуре косметики и пищевых продуктов
Какие услуги предоставляют химики по рецептурам?
В организации старший химик по рецептуре или младший химик по рецептуре будет отвечать за разработку или тестирование нового продукта. В эпоху гиг-экономики вы можете легко нанять химика для производства продукта. Работа химиков-рецепторов даже не требует присутствия в доме и на полный рабочий день. Благодаря дистанционной революции они могут базироваться на другом конце земного шара и по-прежнему быть доступными для вашего проекта. Вот некоторые из услуг, которые предоставляют химики.
В эпоху гиг-экономики вы можете легко нанять химика для производства продукта. Работа химиков-рецепторов даже не требует присутствия в доме и на полный рабочий день. Благодаря дистанционной революции они могут базироваться на другом конце земного шара и по-прежнему быть доступными для вашего проекта. Вот некоторые из услуг, которые предоставляют химики.
Химик по разработке рецептур косметики может помочь в разработке продуктов по уходу за кожей и волосами, которые будут стабильными при хранении, эффективными и безопасными. Когда вы нанимаете химика-косметолога, вы можете искать специальные знания, которые могут вам понадобиться, например.g., опыт работы с веганскими или натуральными продуктами или опыт работы со специфическими духами и ароматизаторами. Химик по уходу за кожей может помочь вам разработать лосьоны или макияж, а химик по продуктам для волос может помочь вам создать шампуни, сыворотки, масла и другие продукты для волос. Спрос на внештатных химиков-косметиков растет с каждым днем, и они работают как с крупными компаниями, так и с малыми предприятиями, чтобы удовлетворить потребности быстро развивающейся отрасли FMCG.
Специалист по вкусовым добавкам может помочь вам создать новый или улучшить уже существующий вкус продуктов, начиная от соусов и заканчивая мороженым.
Химик, занимающийся составлением рецептур пищевых продуктов, может проанализировать состав пищевого продукта и предложить способы улучшения стабильности при хранении, вкуса, текстуры и т. д.
Химик по рецептуре напитков может помочь в разработке таких продуктов, как протеиновые коктейли, лечебные напитки и газированные напитки.
Составитель рецептур витаминов может помочь в изготовлении нутрицевтиков или фармацевтических продуктов в форме пилюль, напитков, сиропов или капсул.
Химик-фрилансер может иметь опыт работы в нескольких различных отраслях, особенно если он имеет опыт работы в области химии или материаловедения.Лучше всего ознакомиться с опытом работы, образованием и портфолио соискателя, чтобы принять правильное решение.
Как нанять химика по рецептуре
Чтобы нанять химиков, вам необходимо подготовить следующие вещи:
-Объем работы: перечислите, что именно вам нужно сделать, а также любые конкретные навыки или опыт, которые могут вам потребоваться. Вам может понадобиться косметический рецептур для средств личной гигиены, например, проявитель мыла.Или вам может понадобиться внештатный химик для проведения исследований и разработок рецептур, поиска конкретных ингредиентов или альтернатив и составления списка производителей. Вам также могут понадобиться специалисты, которые разрабатывают средства по уходу за кожей или волосами для определенных этнических групп и типов кожи, например, черные химики-косметологи.
Вам может понадобиться косметический рецептур для средств личной гигиены, например, проявитель мыла.Или вам может понадобиться внештатный химик для проведения исследований и разработок рецептур, поиска конкретных ингредиентов или альтернатив и составления списка производителей. Вам также могут понадобиться специалисты, которые разрабатывают средства по уходу за кожей или волосами для определенных этнических групп и типов кожи, например, черные химики-косметологи.
— Крайний срок и местонахождение: Как быстро вам нужно найти химика? Вам нужно найти химика рецептуры рядом с вами? Вы хотите обменяться физическими образцами или встретиться лично, чтобы обсудить рецепты?
-Бюджет: Сколько стоит нанять химика-косметолога? Ответ зависит от того, какой опыт вам нужен и как быстро он вам нужен.Однако ориентировочная цифра заключается в том, что он может стоить от 500 до 5000 долларов США. Если вам нужен кто-то, кто создаст продукт с нуля, это может стоить дороже, однако небольшие корректировки формул или рецептов могут стоить менее 1000 долларов США.
На Kolabtree вы можете бесплатно опубликовать свой проект и получить ряд предложений от заинтересованных экспертов, прежде чем нанять фрилансера, который лучше всего подходит для ваших требований.
Как нанять химика для производства продукта
Химики-фрилансеры могут ускорить разработку вашего продукта и быстро вывести его на рынок.От исследования ингредиентов и оптимизации срока годности до маркировки пищевой ценности и соблюдения требований — они могут помочь вам сократить время, усилия и затраты. Вы можете нанять химика с почасовой оплатой на Kolabtree для постоянной поддержки при разработке вашего продукта. Если у вас есть фиксированный объем работы, вы можете работать с химиком по рецептуре с определенными результатами и целями.
Эксперты Kolabtree работали с крупнейшими мировыми косметическими, фармацевтическими и пищевыми компаниями, включая Unilever, Nestle, Pfizer, Wyeth, McVitie’s, L’Oreal и другими.


 Потом уравнивается валентность и добавляются индексы. Валентность в скобках указывается у тех элементов, которые имеют переходную валентность.
Потом уравнивается валентность и добавляются индексы. Валентность в скобках указывается у тех элементов, которые имеют переходную валентность.
 Формулы составляются, основываясь на валентность постоянных элементов.
Формулы составляются, основываясь на валентность постоянных элементов.
 Написать символы элементов
Написать символы элементов
 Запишите формулу вещества.
Запишите формулу вещества. Запишите формулу вещества.
Запишите формулу вещества. Запишите формулу вещества.
Запишите формулу вещества. Запишите формулу вещества.
Запишите формулу вещества. Запишите формулу вещества.
Запишите формулу вещества. Запишите формулу вещества.
Запишите формулу вещества.
 Записать символы
Записать символы