Li2S, ZnS, h3S, SO2, CS2 и SF6. Используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) прояв
Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества, формулы которых следующие:Используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях. Ответ:
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
Составьте уравнения реакций, при которых из простых веществ
Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества: Li2S, ZnS, SO2, SF6
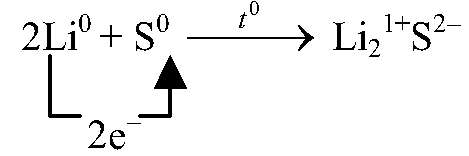
| 2Li + S ⟶ Li2S | ||
| S0 + 2ē ⟶ S-2 | 1 | окислитель (восстановление) |
| Li0 — 1ē ⟶ Li+ | 2 | восстановитель (окисление) |
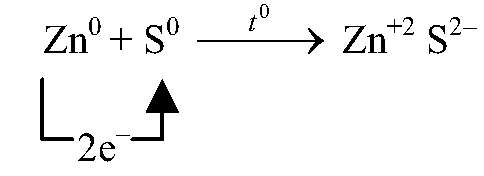
| Zn + S ⟶ ZnS | ||
| S0 + 2ē ⟶ S-2 | 1 | окислитель (восстановление) |
| Zn0 — 2ē ⟶ Zn+2 | 1 | восстановитель (окисление) |
| S + O2 ⟶ SO2 | ||
| O20 + 4ē ⟶ 2O-2 | 1 | окислитель (восстановление) |
| S0 — 4ē ⟶ S+4 | 1 | восстановитель (окисление) |
| S + 3F2 ⟶ SF6 | ||
| F20 + 2ē ⟶ 2F— | 3 | окислитель (восстановление) |
| S0 — 6ē ⟶ S+6 | 1 | восстановитель (окисление) |
gomolog.ru1https://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/18/zadanie-2.html
gomolog.ru11https://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/18/zadanie-2.html
Вопрос № 5 Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества,… решение задачи
Решение задачи:составьте уравнения реакций, при которых из простых веществ образуются сложные вещества, формулы которых следующие:
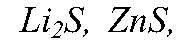
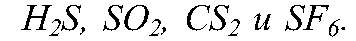 используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях. ответ:
используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях. ответ:
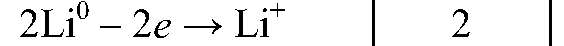 восстановитель, окисляется
восстановитель, окисляется
 окислитель, восстанавливается
окислитель, восстанавливается
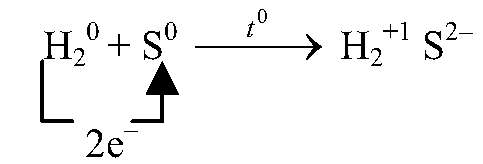
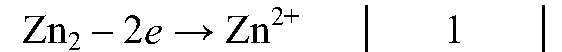 восстановитель, окисляется
восстановитель, окисляется
 окислитель, восстанавливается
окислитель, восстанавливается
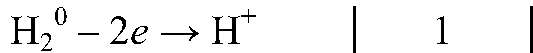 восстановитель, окисляется
восстановитель, окисляется
 окислитель, восстанавливается
окислитель, восстанавливается
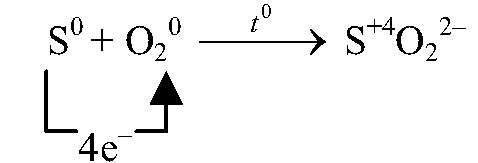
 восстановитель, окисляется
восстановитель, окисляется
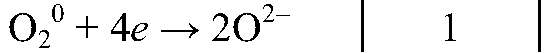 окислитель, восстанавливается
окислитель, восстанавливается
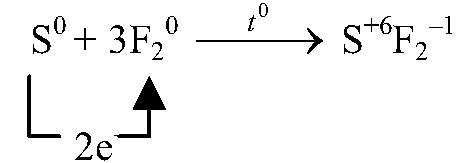
 восстановитель, окисляется
восстановитель, окисляется
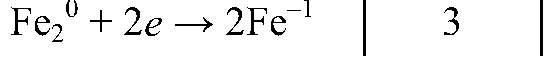 окислитель, восстанавливается
окислитель, восстанавливается
Физматика Вопрос № 5 Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества, формулы которых следующие: Li2S, ZnS, h3S, SO2, CS2 и SF6. Используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) прояв
Условие задачи: Вопрос № 5 Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества, формулы которых следующие: Li2S, ZnS, h3S, SO2, CS2 и SF6. Используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) прояв
Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества, формулы которых следующие:
Используя данные таблицы 8, поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях. Ответ:
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
восстановитель, окисляется
окислитель, восстанавливается
Типы химических реакций — параграф 21 ГДЗ химия 8 Рудзитис
1. Напишите по два уравнения каждого из известных вам типов химических реакций и объясните их с точки зрения атомно-молекулярного учения.
Реакции соединения. Из нескольких атомов или молекул простых веществ образуется одно сложное вещество:
2Al + 3S = Al2S3
2Cu + O2 = 2CuO
Реакции разложения. Из молекулы образуется несколько атомов или молекул (молекула распадается на составные части) простых или сложных веществ:
Cu(OH)2 = CuO + CO2
2H2O = 2H2 + O2
Реакции замещения. Атом простого вещества замещает атом в составе сложного вещества:
CuSO4 + Fe = FeSO4 + Cu
FeCl2 + Mg = MgCl2+ Fe
Необязательно, т.к. в учебнике это рассматривается позже и в этом задании быть не должно.
Ca(OH)2 + CO2 = CaCO3+ H2O
AgNO3 + NaCl = AgCl + NaNO3
2. Сравните реакции соединения и разложения (разложения и замещения, замещения и соединения): а) по числу взятых и полученных веществ; б) по тому, являются ли исходные и полученные вещества простыми или сложными.
Соединение и разложение.
В случае соединения из нескольких веществ (простых или сложных) образуется одно сложное, а в случае разложения наоборот — из одного сложного вещества образуется несколько веществ (простых или сложных) .
Разложение и замещение.
При разложении из одного сложного вещества образуется несколько веществ (простых или сложных). При замещении из сложного и простого вещества образуются сложное и простое вещество.
Замещение и соединение.
При замещении из сложного и простого вещества образуются сложное и простое вещество. При соединении из нескольких веществ (простых или сложных) образуется одно сложное.
3. Перепишите приведенные ниже схемы реакций, вместо знаков вопроса напишите формулы соответствующих веществ, расставьте коэффициенты и поясните, к какому типу относится каждая из указанных реакций:
Zn + ? → ZnO
Mg + HCl → MgCl2 + ?
Au2O3 → Au + ?
Al + CuCl2 → Cu + ?
2Zn + O2 = 2ZnO — реакция соединения — два простых вещества соединяются в одно сложное
Mg + 2HCl = MgCl2 + H2 — реакция замещения — магний замещает водород
2Au2O3 = 4Au + 3O2 — реакция разложения — оксид золота разлагается на золото и кислород
2Al + 3CuCl2 = 3Cu + 2AlCl3 — реакция замещения — алюминий замещает медь
Урок 19-20. Кислород, общая характеристика и нахождение в природе. Получение и свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе (Страницы 57,58,59,60,61,62,63,64)
Главная › 8 класс › Химия › Рабочая тетрадь по химии Боровских 8 класс
2. Дополните схему, отражающую распространенность кислорода в природе:

3. Вычислите массовую долю кислорода в некоторых веществах:

4. Отметьте, в каких случаях речь идет о химическом элементе кислороде, а в каких — о простом веществе кислороде. Обведите цифру правильного ответа: красным — элемент, синим — вещество.
1) Кислород входит в состав воды.
2) Кислород — газ, плохо растворимый в воде.
3) В воздухе содержится приблизительно 21% кислорода.
4) В земной коре содержится приблизительно 47% кислорода.
5) Валентность кислорода равна двум.
6) Рыбы дышат кислородом, растворенным в воде.
7) В промышленности кислород получают из воздуха.
5. Прочитайте §20 и занесите в таблицу сведения о физических свойствах кислорода.

6. Кислород в колбу можно собрать методом вытеснения воздуха и методом вытеснения воды. Объясните, на каких свойствах кислорода основаны эти методы свора газов.
1) О2 тяжелее воздуха.
2) О2 мало растворим в воде.
7. Рассчитайте объем кислорода, который растворится в 500 мл воды при 20 градусах Цельсия.
В 100 мл воды — 3,1 л кислорода
В 500 мл воды — х л кислорода
х = 15,5 л кислорода.
8. Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Из предложенного ряда веществ выпишите оксиды и дайте им названия:

9. Составьте формулы оксидов по следующим данным:

10. Поясните термин «химические свойства веществ».
Свойства, характерные для данного вещества при взаимодействии с другими веществами.
11. Какая реакция называется горением?
Горение — химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
12. Заполните пропуски в схемах реакций:

13. Составьте уравнения реакций горения следующих простых веществ (в скобках указана валентность данного элемента в получаемом оксиде):

14. Составьте уравнения взаимодействия кислорода со сложными веществами:

15. Какие вещества были взяты для реакции, если в результате образовались следующие вещества (в схемах стехиометрические коэффициенты не указаны):

16. Составьте уравнения реакций по следующим данным:
1) При оксилении алюминия кислородом образовался оксид.
4Al+3O2 -> 2Al2O3
2) При взаимодействии меди с кислородом получился оксид меди (II).
2Cu+O2 -> 2CuO
3) При горении этилена образовался углекислый газ.
C2H4+3O2 -> 2CO2+2H2O
4) Бензол сожгли в кислороде. Получился углекислый газ.
2C6H6+15O2 -> 12CO2+6H2O
5) Из железа получили оксид железа (III).
4Fe+3O2 -> 2Fe2O3
6) Уголь сожжен на воздухе.
C+O2 -> CO2
7) Кислород можно получить при разложении перекиси водорода.
2H2O ->t O2+2H2O
8) При сжигании серы получился оксид серы (IV).
S+O2 -> SO2
9) Пирит подвергли обжигу. При этом образовался оксид железа (III) и оксид серы (IV) (с примером и заданием для самостоятельной работы).
4FeS2+11O2 -> 2Fe2O3+8SO2
17. Составьте уравнения реакций, с помощью которых можно осуществить превращения:

18. Задача. Какое количество вещества кислорода понадобится для полного сгорания 160 г метана? Вычислите массу образующейся при этом воды.

19. Задача. Вычислить массу оксида алюминия, образующегося при окислении 2,7 г алюминия.

20. Задача. Вычислить массу кислорода, требуемого для получения 16 г оксида железа (III) из железа.

21. Задача. Хватит ли 3,2 г кислорода, чтобы полностью окислить железо массой 2,8 г?

Урок 18. Проверь свои знания по теме: Первоначальные химические понятия — стр. 54-56Урок 21. Практическая работа. Получение и свойства кислорода — стр. 64-65
Сохраните или поделитесь с одноклассниками: