Температура кипения жидкостей (Таблица)
Справочная таблица по химии, содержит информацию по жидкостям и их температуре кипения. Будет полезна для школьников и студентов при изучении химии, а также для подготовки к экзаменам и ЕГЭ.
Смотрите также таблицу температура кипения металлов.
Жидкости | Температура кипения, С° |
Азотная кислота | 82,6 |
Акриловая кислота | 140,9 |
Акрилонитрилл | 77,3 |
Анилин, C6H5NH2 | 184,4 |
Ацетальдегид | 20,2 |
Ацетон | 56,2 |
Ацетоуксусный эфир | 180,8 |
Бензол, C6H6 | 80,1 |
Бром | 59,2 |
Бутиловые спирты (1 — бутанол) | 117,4 |
Вода | 100 |
Диэтилоаксалат | 185,4 |
Изоамилацетат | 142 |
Изоамиловый спирт | 132 |
Метилакрилат | 80 |
Н — амилацетат | 149,2 |
Пентан | 36,07 |
Спирт | 78 |
Уксусная кислота | 117,8 |
Хлорбензол, C6H5Cl | 131,7 |
Хлорная кислота, HClO4 | 110 |
Хлоропрен | 59,4 |
| Хлороформ, CHCl3 | 61,2 |
Хлорсульфоновая кислота, SO2Cl(OH) | 155 |
Цетан, CH3(CH2)14CH3 | 286,8 |
Циклогексан, C6H12 | 80,74 |
Циклогексанон | 155,6 |
ТЕМПЕРАТУРА КИПЕНИЯ | Энциклопедия Кругосвет
ТЕМПЕРАТУРА КИПЕНИЯ (точка кипения) – температура, при которой жидкость столь интенсивно превращается в пар (т.е. газ), что в ней образуются паровые пузырьки, которые поднимаются на поверхность и лопаются. Бурное образование пузырьков во всем объеме жидкости и называется кипением.
В отличие от простого испарения при кипении жидкость переходит в пар не только со свободной поверхности, но и по всему объему – внутрь образующихся пузырьков. Температура кипения любой жидкости постоянна при заданном атмосферном или ином внешнем давлении, но повышается с повышением давления и понижается с его понижением. Например, при нормальном атмосферном давлении, равном 100 кПа (таково давление на уровне моря), температура кипения воды составляет 100° С.
На высоте же 4000 м над уровнем моря, где давление падает до 60 кПа, вода кипит примерно при 85° С, и для того, чтобы сварить пищу в горах, требуется больше времени. По той же причине пища готовится быстрей в кастрюле-«скороварке»: давление в ней повышается, а вслед за этим повышается и температура кипящей воды.
Температура кипения вещества зависит также от наличия примесей. Если в жидкости растворено летучее вещество, то температура кипения раствора понижается. И наоборот, если в растворе содержится вещество менее летучее, чем растворитель, то температура кипения раствора будет выше, чем у чистой жидкости.
ТЕМПЕРАТУРА КИПЕНИЯ НЕКОТОРЫХ ВЕЩЕСТВ (на уровне моря) | |
Вещество | Температура, °С |
| Вода | 100 |
| Золото | 2600 |
| Изопропиловый спирт | 82,3 |
| Метиловый спирт | 64,7 |
| Морская вода | 100,7 |
| Ртуть | 356,9 |
| Серебро | 1950 |
| Этиленгликоль | 197,2 |
| Этиловый спирт | 78,3 |
| Эфир | 34,6 |
См. также ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ; ТЕПЛОТА; ЖИДКОСТЕЙ ТЕОРИЯ.
Проверь себя!
Ответь на вопросы викторины «Физика»
Что такое изотоп, чему равно число Авогадро и что изучает наука реология?
что это такое, при каких условиях кипит и как это определить, как быстро остывает после закипания?
Что это за явление?
 Кипение — это процесс перехода воды из жидкого агрегатного состояния в газообразное, то есть ее превращение в пар.
Кипение — это процесс перехода воды из жидкого агрегатного состояния в газообразное, то есть ее превращение в пар.
От обычного испарения оно отличается высокой степенью интенсивности: если на испарение воды может потребоваться несколько дней или недель, то выкипеть такой же ее объем сможет за считанные часы.
При необходимости ёмкость можно прикрыть, тогда часть пара будет конденсироваться обратно, становясь капельками воды.
Процесс кипения условно можно разделить на два этапа:
- сначала вода нагревается до нужной температуры (при нормальном атмосферном давлении — это 100 градусов Цельсия),
- потом происходит её превращение в пар, в течение которого показания термометра уже не меняются.
Однако источник тепла нужен даже на этой стадии, ведь парообразование тоже требует энергетических затрат.
Какие факторы влияют на закипание?
На кипение влияет множество факторов:
- количество воды;
- наличие примесей;
- емкость, в которой она содержится;
- температура окружающей среды;
- высота, где происходит кипячение;
- давление атмосферы;
- мощность источника тепла.
Чем выше изначальная температура воды и воздуха вокруг, тем быстрее начнётся кипение: на нагревание будет затрачено меньше энергии, а значит, меньше времени уйдёт на её получение.
Также часть тепла забирает ёмкость, в которой содержится вода, ведь она должна дойти до нужной температуры ещё раньше, чем ее содержимое. Поэтому посуда с более тонкими стенками, сделанная из легко проводящего тепло материала, например, металла, лучше подходит для кипячения.
От массы, а значит и от объёма вещества, кипение находится в обратной зависимости. Чем больше вес, тем больше энергии требуется на его нагревание, тем дольше будет необходимо ждать.
 При прочих равных условиях вода без соли и других примесей закипает несколько быстрее, чем солёная. Однако, если концентрация соли очень низкая, этой разницы может быть практически незаметно.
При прочих равных условиях вода без соли и других примесей закипает несколько быстрее, чем солёная. Однако, если концентрация соли очень низкая, этой разницы может быть практически незаметно.
Давление также влияет на процесс. Чем оно выше, тем дольше будет закипать вода, потому что давление атмосферы как бы удерживает пузырьки газа внутри, а испаряться она начинает тогда, когда давление пара уравнивается с атмосферным.
Соответственно, влияние оказывает также высота, на которой происходит кипячение, ведь с высотой давление уменьшается, как и температура кипения, потому что слой атмосферы сверху становится тоньше.
Эта разница мало заметна, если сравнивать первый этаж жилого дома с пятым, однако становится ощутима, если речь идёт, например, о подъеме в горы.
В вакууме температура кипения всех веществ очень сильно снижается из-за понижения давления, обычно отличие составляет 100-200 градусов. Для воды она стремится к нулю по мере уменьшения количества воздуха, оставшегося в сосуде.
Не менее важны характеристики источника тепла. Чем больше его мощность, то есть количество выделяемой им энергии за единицу времени, тем быстрее идет процесс кипячения. На практике это означает, что на более сильном огне или при большей температуре конфорки на электроплите вода закипит скорее.
Сколько по времени закипает?
Становится понятно, что время кипения сильно зависит от условий, при которых оно происходит.
Чтобы узнать количество времени (секунд) точно до закипания, можно воспользоваться формулой: t= (c1m1t°C1+ c2m2t°C2 +Lm) / N
Величины:
 c1, L — табличные величины, теплоемкость и удельная теплота парообразования воды;
c1, L — табличные величины, теплоемкость и удельная теплота парообразования воды;- m1 — ее масса;
- t°C — разница между изначальной и нужной для кипения температурой;
- N — мощность нагревательного прибора;
- m2 и c2 — характеристики емкости, в которой проводится кипячение (масса и теплоемкость).
Даже эта формула учитывает не все, ведь также существуют потери тепла, которое уходит в окружающую среду.
Однако такая точность редко бывает нужна в быту, кроме того, необходимые данные для расчётов получить затруднительно. Чаще всего кипение литра воды на плите при достаточно большом огне занимает около 10 минут. Здесь некоторую роль играет материал, из которого сделана посуда. Быстрее всего нагревается металл.
Как понять, что жидкость кипит?
По мере приближения к точке кипения в воде появляется все больше пузырьков. Сначала их можно увидеть на стенках сосуда, а потом они начинают всплывать на поверхность, отчего она становится неровной. Пропустить этот момент сложно из-за характерного бурления.
Присмотревшись, над поверхностью воды можно будет увидеть поднимающийся пар. Если нет цели заставить воду выкипать, стоит снять её с плиты.
Даже спустя некоторое время после этого испарение будет продолжаться, потому что температура не сразу опустится ниже точки кипения. Например, от чашки горячего чая еще некоторое время идет пар.
Как быстро остывает после?
 Остывание зависит от тех же факторов, что и нагрев: от объема, температуры окружающей среды.
Остывание зависит от тех же факторов, что и нагрев: от объема, температуры окружающей среды.
Например, электрочайник, вскипевший за пять минут, будет остывать около двух часов, чтобы дойти до комнатной температуры.
Если объем воды большой, то остывание при прочих равных займет более длительный промежуток времени, а чем холоднее воздух вокруг, тем быстрее охладится и сам кипяток. Его температура будет опускаться до того момента, пока не сравняется с окружающей.
Нюансы процесса
Кипение воды в чайнике и кастрюле немного различается между собой, но в обоих случаях оно происходит при 100 градусах. Рассмотрим особенности каждого процесса.
В чайнике
В электрическом чайнике процесс пойдёт быстрее, чем при кипячении в кастрюле, он займёт 3-4 минуты, точное время зависит от конкретной модели и ее мощности. Не потребуется даже выключать прибор – он сделает это автоматически.
Обычный чайник несильно отличается от металлической кастрюли похожей конфигурации и размера, поэтому время закипания у них приблизительно одинаково.
Свист, которым чайник оповещает, что вода кипит, связан с прохождением пара через крышку на его носике.
В кастрюле
 При таком способе кипячения ждать потребуется дольше – около 10 мин. Лучше всего подойдет металлическая кастрюля, она нагреется быстрее, чем емкости из других материалов.
При таком способе кипячения ждать потребуется дольше – около 10 мин. Лучше всего подойдет металлическая кастрюля, она нагреется быстрее, чем емкости из других материалов.
Не стоит наполнять ее до самого верха, потому что в таком случае при кипении брызги будут выплескиваться на плиту. Момент закипания сопровождается громким бурлением. Почти сразу после этого воду можно выключать.
Если накрыть кастрюлю крышкой, можно ускорить нагрев и закипание воды, потому что снизится количество тепла, уходящего в окружающую среду. Однако желательно оставить щель, через которую будет выходить пар.
Видео по теме статьи
О кипении жидкости расскажет видео:
Заключение
Хотя с точки зрения физики кипение — далеко не самый сложный процесс, говорить о нем можно долго, так как он связан со множеством факторов, под воздействием которых особенности его протекания несколько отличаются.
Даже общие знания из этой области могут быть полезны и найдут практическое применение, ведь в быту с необходимостью вскипятить воду регулярно сталкивается каждый.
«Как зависит температура кипения от давления?» – Яндекс.Кью
Сначала отвечу на второй вопрос. «Давлением» обычно называют системное артериальное давление. Те, кто в школе хорошо учил физику и неплохо биологию, могут задать вопрос: не изменяется ли оно при сердечных сокращениях, да и как кровь вообще движется по сосудам в таких условиях? Ответ: давление (давайте АД для простоты)- это усредненная по времени величина. Сердце, как насос, выталкивает из себя кровь в аорту и дальше по сосудам. Давление создается сокращением мышечного слоя сердца — миокарда. В норме в минуту сердце совершает 60-90 толчков, и средняя величина АД во всех отделах кровеносной системы большого круга кровообращения (это важный момент) составляет, допустим, 120 в период сокращения сердца — систолы, и 70 в период его расслабления — диастолы. Максимальное давление — в аорте, минимальное — в полых венах (меньше нуля).
Почему ваше давление — важный показатель? Это один из основных и легко измеряемых параметров сердечно-сосудистой системы, а смертность от заболеваний этой системы стабильно держит 2-3 место в большинстве стран мира. Если бы каждый человек замерял АД раз в неделю, смертность бы очень снизилась. У кого-то в Африке нет техсредств, у кого-то нет желания. На самом деле нужно уметь правильно измерять АД, чтобы получить точные цифры. Но пускай даже так, люди вообще этого не делают. Так что же происходит, когда давление слишком высокое или низкое? Давайте разбираться.
Изменения давления, очевидно, влияют на сосуды. Если АД слишком высокое, то и влияние не очень хорошее. Высокое АД — это или больше 140 систолическое, или больше 90 диастолическое (или, очевидно, и то и другое). В артериях развиваются деструктивные изменения, которые, даже если впоследствии понизить давление препаратами, будут способствовать его повышению снова. Поэтому очень часто гипертоники (люди с повышенным АД) сидят на таблетках всю жизнь. Может показаться пугающим, но мне как раз не повезло быть одной из них и на самом деле ежедневный прием лекарств не напрягает. Не так напрягает, как нехилый шанс инсульта в старости. С инфарктом миокарда связь не так однозначна, но тут тоже риск вырастает. АД отражает состояние всей сердечно-сосудистой системы, но суть инсульта и инфаркта миокарда — двух самых грозных осложнений гипертонии — в местных изменениях. Вам необязательно знать все подробности — они очень сложны — но вкратце расскажу: курение — бросить однозначно, алкоголь — лучше бросить, физ.активность — желательно, ст
Температура — кипение — жидкость
Температура — кипение — жидкость
Cтраница 1
Температура кипения жидкости f определяется при концентрации а по кривой t ( d) так же, как в тепловом расчете процесса простой дистилляции при вычислении энтальпии пара. [1]
Температура кипения жидкости зависит от молекулярного веса и строения вещества, от сил притяжения молекул жидкости друг к другу. [3]
Температура кипения жидкости при нормальном давлении называется точкой кипения данной жидкости. [4]
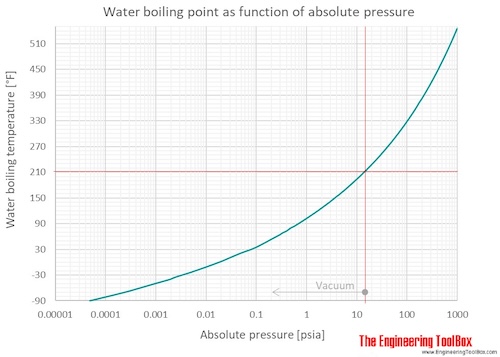
Температура кипения жидкости зависит от давления, под которым находится жидкость. Если мы кипятим воду в открытом сосуде при внешнем давлении, равном 1 am или 760 мм рт. ст., то температура кипения ее будет равна 100, если же над поверхностью воды создать разреженное пространство ( вакуум), то вода закипит при более низкой температуре. [5]
Температура кипения жидкости в К приблизительно равна двум третям критической температуры. [7]
Температура кипения жидкости может быть снижена также понижением давления в аппарате путем создания вакуума. В нефтепереработке часто применяют оба этих способа понижения температуры кипения смеси. [8]
Температура кипения жидкости может быть снижена также только понижением абсолютного давления в аппарате ( применение вакуума) или, как это чаще всего осуществляется в технике, одновременно воздействием и вакуума и водяного пара. [9]
Температура кипения жидкости
Температура кипения жидкости — это та температура, при которой упругость пара этой жидкости становится равной атмосферному давлению данной системы. Температура кипения жидкости очень сильно зависит от давления, так как объемные изменения при переходе из жидкого состояния в газовое весьма велики. Таким образом, фиксируя температуру кипения, нужно указывать и давление. Температуры кипения широко изменяются в зависимости от структуры веществ и служат удобными константами для идентификации и характеристики жидких веществ. Различия в температурах кипения позволяют путем фракционирования разделять жидкости. Чистые соединения имеют постоянную точку кипения, а у смесей, как правило, температурные интервалы кипения значительны и величина их зависит от температур кипения отдельных компонентов. Благодаря этим различиям температурные интервалы кипения становятся важным критерием чистоты. [11]
Температура кипения жидкости так же, как и температура плавления, является важной константой вещества. Температура кипения жидкости может быть определена несколькими способами. [12]
Температура кипения жидкости при заданных условиях постоянная. [13]
Температура кипения жидкости зависит от давления воздуха над ее поверхностью. [14]
Температура кипения жидкости при давлении р 1 01325 бар ( 760 мм рт. ст.) называется нормальной температурой кипения. [15]
Страницы: 1 2 3 4
Кипение жидкостей. Зависимость температуры кипения от давления | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Если жидкость получает теплоту, то она будет нагреваться и через некоторое время начнет кипеть. По наблюдениям этот процесс сопровождается образованием в объеме жидкости пузырьков насыщенного пара. С повышением температуры их количество на стенках сосуда возрастает, а размеры увеличиваются. При определенной температуре давление пара в пузырьках становится равным давлению в жидкости, и они под действием силы Архимеда начинают всплывать. Когда такой пузырек достигает поверхности жидкости, он лопается и выбрасывает пар наружу.
Кипение — это внутреннее парообразование, которое происходит во всем объеме жидкости при температуре, когда давление насыщенного пара равно давлению в жидкости.
Установлено, что при кипении температура жидкости остается постоянной — при достижении температуры кипения все предоставленное количество теплоты идет на парообразование. Если жидкость не получает теплоту, кипение прекратится, поскольку не будет поступать энергия для внутреннего парообразования.
Кипение осуществляется при температуре, когда давление насыщенного пара в пузырьках равно давлению в жидкости.
| Рис. 3.3. Зависимость температуры кипения воды от давления |
Каждое вещество имеет собственную температуру кипения. Очевидно, что ее значение определяется давлением насыщенного пара при данной температуре, поскольку кипение наступает тогда, когда давление насыщенного пара уравнивается с давлением в жидкости. Поэтому температура кипения жидкостей зависит от внешнего давления — чем оно выше, тем выше должна быть температура кипения, и наоборот. Графически зависимость температуры кипения воды от давления изображена на рис. 3.3.
При нормальном давлении жидкий аммиак кипит при -33 °C, вода — при 100 °C, ртуть — при 357 °C.
Это свойство жидкостей широко используют в разных технологических процессах. Например, в процессе нефтепереработки для разъединения нефтепродуктов — бензина, мазута и масел, имеющих разную температуру кипения; при сахароварении (благодаря пониженному давлению сироп кипит при низкой температуре, и поэтому сахар не пригорает). Материал с сайта http://worldofschool.ru
Чтобы вычислить количество теплоты, необходимой для кипения, следует учитывать: а) теплоту нагревания жидкости до температуры кипения Q1; б) теплоту парообразования Q2: Q = Q1 + Q2.
Таким образом, все жидкости имеют постоянную температуру кипения, которая зависит от рода вещества и внешнего давления. Чтобы кипение продолжалось, необходимо жидкость нагреть до температуры кипения и продолжать нагревать ее, предоставляя количество теплоты, необходимое для парообразования:
Q = cmΔt + rm.
На этой странице материал по темам:При каких условиях произходит кипение
Y формула температуры кипения
Зависимость температуры кипения от давления масла
Зависимость температуры кипения растворителя от давления
Строн жидкость для котлов
Чем отличается кипение от испарения?
При каких условиях происходит кипение?
От чего зависит температура кипения? Где используют это свойство жидкостей?
Будет ли кипеть вода в стакане, который находится в кастрюле с кипятком? А спирт?
Температура кипения жидкости определение — Справочник химика 21
ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ И ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ЖИДКОСТИ [c.166]На различии в равновесных составах жидкой и паровой фаз основано разделение неограниченно растворимых жидкостей перегонкой. На диаграмме кипения верхняя линия /д/ц выражает зависимость температуры конденсации пара от его состава. Нижняя линия /д/в выражает зависимость температуры кипения раствора от его состава. Диаграмма двумя линиями разделена на три поля. Поле / — область существования пара (С = 2 — 1 + 1 =2) поле 2 — область существования жидкости (С = 2 — 1 + 1 =2), системы однофазны, имеют по две степени свободы, т. е. произвольно можно задавать температуру и состав без нарушения равновесия поле 3 характеризует двухфазное состояние системы (пар и жидкость) с одной степенью свободы (С = 2—2+1 = 1), т. е. произвольно можно задавать только один параметр. Каждой температуре кипения соответствуют определенные составы жидкой и паровой фаз. Любая фигуративная точка в поле 3 (например, точка а) отражает валовый (общий) состав системы. Чтобы найти составы фаз, необходимо провести изотерму через точку а. Состав жидкой фазы определяется точкой / (Хв = 0,2), паровой — точкой 2 (уд = 0,6). Пар обогащен компонентом В. Согласно закону Коновалова, прибавление легколетучего компонента В в исходный раствор, например до состава х , вызывает понижение температуры кипения исходной жидкости (от изотермическом изменении валового состава системы (от х = 0,4 до Хв = 0,5, что на диаграмме соответствует перемещению фигуративной точки а в точку Ь) число фаз и их составы остаются прежними (лр = 0,4 у = 0,6), но происходит [c.95]
Определение температуры кипения жидкостей ——> [c.42]
Определение температуры кипения. Для определения температуры кипения жидкостей существует много приборов. Простейший из них изображен на рис. 146. Круглодонная колба небольшой емкости (около 50 лл), но можно применять и плоскодонную той же емкости с широким горлом, снабжена пробкой с двумя отверстиями одно—для термометра и другое—для трубки, соединяемой с обратным холодильником. [c.169]
Как приближенно определить температуру кипения жидкости, пользуясь только данными, приведенными в приложении 3 Какие сведения необходимо еще иметь для точного определения температуры кипения [c.150]
Для фракционной, или дробной, перегонки, когда перегоняемая жидкость должна быть разделена на части, или фракции, кипящие в определенных границах температур, нужно заранее подобрать определенное количество приемников. Приемники нумеруют восковым карандашом, отметив этим же карандашом ниже поставленного номера те температуры, в пределах которых дистиллят будет собираться Б данный приемник. При перегонке приемники меняют, как только температура кипения жидкости поднимается выше той, которая отмечена на приемнике. [c.132]
Нередко бывает необходимо определить температуру кипения жидкости. Если жидкость совершенно чистая и не содержит каких-либо примесей, то при определенном внешнем (атмосферном) давлении она всегда будет кипеть при постоянной, строго определенной температуре. Поэтому по температуре кипения жидкости можно судить о ее чистоте, и эта постоянная величина, или константа, является одной из важных характеристик жидкого вещества. Температура кипения, как указывалось выше, зависит от внешнего давления. Однако не все жидкости устойчивы при нагревании. Поэтому все термически стойкие вещества можно нагревать и кипятить при нормальном давлении, а термически нестойкие—только при уменьшенном давлении (под вакуумом). [c.166]
Динамический способ, основанный на измерении температуры кипения жидкости при определенном давлении. При испытании индивидуальных жидкостей этот способ дает хорошие результаты, но он не может быть применен для испытания нефтепродуктов, представляющих сложные смеси углеводородов, кипящих при разных температурах. [c.139]
Нормальная работа ректификационной колонны с получением ректификата и остатка заданных составов может быть обеспечена при различных состояниях сырья, подаваемого в колонну. Сырье может быть подано как в состоянии подогретой до температуры кипения жидкостью, так и перегретыми парами. Тепловое состояние сырья существенно влияет на потоки паров и жидкости в секции питания колонны и на работу колонны в целом (см. рис. 1У-8), обусловливает необходимость съема определенного количества тепла в конденсаторе и (или) подвода тепла в кипятильнике Ов- [c.151]
Закипание любой жидкости при данном внешнем давлении р может происходить лишь по достижении определенной температуры I, при которой давление Р насыщенных паров данной жидкости становится равным
Точки кипения для обычных жидкостей и газов
Точка кипения вещества — это температура, при которой оно меняет состояние с жидкости на газ во всем объеме жидкости. При температуре кипения молекулы в любом месте жидкости могут испаряться.
Точка кипения определяется как температура, при которой давление насыщенного пара жидкости равно окружающему атмосферному давлению.
Температура кипения при атмосферном давлении (14.7 psia, 1 бар (абс.)) для некоторых распространенных жидкостей и газов можно найти в таблице ниже:
| Продукт | Точка кипения при атмосферном давлении ( o C) | |||
|---|---|---|---|---|
| Ацетальдегид CH 3 CHO | 20,8 | |||
| Ангидрид уксусной кислоты (CH 3 COO) 2 O | 139 | |||
| Ацетон CH 3 COCH 3 | 56.08 | |||
| Ацентонитрил | 81,6 | |||
| Ацетилен | -84 | |||
| Акролеин | 52,3 | |||
| Акрилонитрил | 77,2 | |||
| Спирт — этил (зерно, этанол) C H 5 OH | 79 | |||
| Спирт — аллил | 97,2 | |||
| Спирт — бутил-н | 117 | |||
| Спирт — изобутил | 107.8 | |||
| Спирт — метил (метиловый спирт, древесный спирт, древесный нафта или древесный спирт) CH 3 OH | 64,7 | |||
| Спирт — пропил | 97,5 | |||
| Аллиламин | 54 | |||
| Аммиак | -35,5 | |||
| Анилин | 184,1 | |||
| Анизол | 153,6 | |||
| Аргон | -186 | |||
| Бензальдегид | 178.7 | |||
| Бензол (бензол) C 6 H 6 | 80,4 | |||
| Бензонитрил | 191,1 | |||
| Тормозная жидкость, точка 3 (сухая — влажная точки кипения) (влажная включает гигроскопическую влагу) | 205 — 140 | |||
| Тормозная жидкость Dot 4 (сухая — влажная точки кипения) | 230 — 155 | |||
| Тормозная жидкость Dot 5 (сухая — влажная точки кипения) | 260 — 180 | |||
| Тормозная жидкость Точка 5.1 (сухой — влажный, точки кипения) | 270-190 | |||
| Бром | 58,8 | |||
| Бромбензол | 156,0 | |||
| 1,2-Бутадиен | 10,9 | |||
| н-бутан | -0,5 | |||
| 1-бутан | -6,25 | |||
| Бутанал | 74,8 | |||
| 1-бутанол | 117,6 | |||
| 2-бутанон | 79.6 | |||
| Масляная кислота n | 162,5 | |||
| Камфора | 204,0 | |||
| Карболовая кислота (фенол) | 182,2 | |||
| Бисульфид углерода | 47,8 | |||
| Двуокись углерода CO 2 (сублимирует) | -78,5 | |||
| Дисульфид углерода CS 2 | 46,2 | |||
| Окись углерода | -192 | |||
| Тетрахлорид углерода (тетрахлорэтан) CCl 4 | 76.7 | |||
| Хлор | -34,4 | |||
| Хлорбензол | 131,7 | |||
| Хлороформ (трихлорметан) | 62,2 | |||
| Циклогексан | 80,7 | |||
| Циклогексан | 2529Циклогексан | 252949,3 | ||
| n — Декан | 174 | |||
| Дихлорметан — см. Метиленхлорид | ||||
| Диэтиловый эфир | 34.4 | |||
| Диметилсульфат | 186 | |||
| Диметилсульфид | 37,3 | |||
| Диизопропиловый эфир | 68,4 | |||
| 2,2 — Диметилпентан | 79,2 | |||
| 1,4-Диоксан 900 | 101,2 | |||
| Dowtherm | 258 | |||
| Этан | -88,78 | |||
| Эфир | 34.6 | |||
| Глицерин | 290 | |||
| Этан C 2 H 6 | -88 | |||
| Этанол | 78,24 | |||
| Этиламин | 16,6 | |||
| Этилацетат CH 3 COOC 2 H 3 | 77,2 | |||
| Этилбензол | 136 | |||
| Этилбромид C 2 H 3 Br | 38.4 | |||
| Этилен | -103,7 | |||
| Бромистый этилен | 131,7 | |||
| Этиленгликоль | 197 | |||
| 3 — Этилпентан | 93,5 | |||
| Фтор | -187 | Формальдегид | -19,1 | |
| Муравьиная кислота | 101,0 | |||
| Трихлорфторметановый хладагент R-11 | 23.8 | |||
| Дихлордифторметановый хладагент R-12 | -29,8 | |||
| Хлордифторметановый хладагент R-22 | -41,2 | |||
| 2,3 — Диметилбутан | 58 | |||
| Диизобутил | 25Фурфурол | 161,5 | ||
| Фирфуриловый спирт | 168 | |||
| Бензин | 38-204 | |||
| Глицерин | 290 | |||
| Гликоль | 19729 | |||
| Гликоль | ||||
| н-гептан | 98.4 | |||
| н-гексан | 68,7 | |||
| Гексиламин | 132 | |||
| Водород | -253 | |||
| Соляная кислота | -81,7 | |||
| Фтористоводородная кислота | Хлорид водорода | -81,7 | ||
| Сероводород | -60 | |||
| Йод | 184,3 | |||
| Изопропиловый спирт | 80.3 | |||
| Гидропероксид изопропилбензола | 153 | |||
| Изобутан | -11,72 | |||
| Изобутен | -6,9 | |||
| Изооктан | 99,2 | |||
| Изооктан | Изопрен | 34,1 | ||
| Изопропилбензол | 152 | |||
| Реактивное топливо | 163 | |||
| Керосин (парафин) | 150-300 | |||
| Льняное масло | 287 | |||
| Ртуть | .9 | |||
| Метан | -161,5 | |||
| Метанол (метиловый спирт, древесный спирт) | 64,5 | |||
| Метилацетат | 57,2 | |||
| Бромистый метил | 3,3 | |||
| Метилхлорид | -23,9 | |||
| Метиленхлорид (CH 2 Cl 2 , дихлорметан) | 39,8 | |||
| Метиламин | -6.4 | |||
| Метиловый эфир (C 2 H 6 O) | -25 | |||
| Метилциклогексан | 101 | |||
| Метилциклопентан | 71,8 | |||
| Метилиодид | 2 — Метилгексан | 90,1 | ||
| 3 — Метилгексан | 91,8 | |||
| 2 — Метилпентан | 60,3 | |||
| 3 — Метилпентан | 63.3 | |||
| Нафта | 100 — 160 | |||
| Нафталин (нафталин) | 217,9 | |||
| Неогексан | 49,7 | |||
| Неопентан | 9,5 | |||
| азотная кислота | Нитробензол | 210,9 | ||
| n — Нонан | 150,7 | |||
| Азотная кислота | 120 | |||
| Азот | -196 | |||
| n — Октан | 125.6 | |||
| Оливковое масло | 300 | |||
| Кислород | -183 | |||
| Паральдегид | 124 | |||
| n — Пентан | 36 | |||
| 1 — Пентен | 30 | |||
| Пероксиуксусная кислота | 110 | |||
| Бензин | 95 | |||
| Нефть | 210 | |||
| Петролейный эфир | 35-60 | |||
| Фенол | 182 | |||
| Фосген | 8.3 | |||
| Фосфорная кислота | 213 | |||
| Пропанал | 48 | |||
| Пропан | -42,04 | |||
| Пропен | -47,72 | |||
| 2-пропанол | 82,2 | 141 | ||
| Пропиламин | 47,2 | |||
| Пропилен | -47,7 | |||
| Пропиленгликоль | 187 | |||
| Насыщенный рассол | 108 145 | |||
| Стирол | 25||||
| Сера | 444.6 | |||
| Серная кислота | 330 | |||
| Дихлорид серы | 59,6 | |||
| Диоксид серы | -10 | |||
| Сульфурилхлорид | 69,4 | |||
| Смола | ||||
| Толуол | 110,6 | |||
| Триптан | 80,9 | |||
| Триэтаноламин | 350 | |||
| Скипидар | 160 | |||
| Вода | 100 | |||
| Вода | , морская вода | .7 | ||
| о-ксилол | 144,4 | |||
| м-ксилол | 139,1 | |||
| п-ксилол | 138,3 |
Каковы точки замерзания, плавления и кипения твердых тел, жидкостей и газов?
Определение точки кипения
Температура, при которой жидкость кипит и превращается в газ. Температура кипения будет ниже при понижении атмосферного давления. Например, температура кипения чистой воды при стандартном атмосферном давлении (или на уровне моря) составляет 100 ° C (212 ° F), а на высоте 10 000 футов (3048 м) — 90,39 ° C (194,7 ° F). Это уменьшение повлияет на время, необходимое для приготовления чего-либо в воде, до такой степени, что любая еда, для приготовления которой требуется пять минут на уровне моря, займет около 20 минут на расстоянии 3 км (10 000 футов).Теоретически вы также можете рассчитать свою высоту, записав температуру закипания воды.
Жидкости на основе растворителей обычно имеют более низкую температуру кипения, чем вода. Другими словами, им потребуется меньше тепла, чтобы превратить их в пар. Жидкости с гораздо более низкой температурой кипения, чем вода, обычно классифицируются как легковоспламеняющиеся.
Определение точки замерзания
Температура, при которой жидкость становится твердой. Температура точки замерзания будет выше при повышении давления.Это может быть незаметно из-за того, что изменение объема при плавлении намного меньше, чем изменение объема (расширение) при кипении. Например, точка замерзания чистой воды при стандартном атмосферном давлении (или нулевом футе) составляет 0 ° C (32 ° F), а на высоте 11 км (6 миль) над уровнем моря она будет только на 0,001 ° C выше.
Единственная известная жидкость, которая не замерзает даже при абсолютном нуле, — это жидкий гелий, если он не находится под давлением.
Определение точки плавления
Температура, при которой твердое вещество становится жидкостью.Некоторые твердые вещества не имеют жидкого состояния и сразу переходят из твердого в газообразное состояние. Это называется сублимацией, например Двуокись углерода (сухой лед).
Точка плавления / точка замерзания
Термины «точка плавления» или «точка замерзания» часто меняются местами в зависимости от того, нагревается или охлаждается вещество. Для жидкостей она называется точкой замерзания, а для твердых веществ — точкой плавления. Температура плавления твердого вещества и точка замерзания жидкости обычно одинаковы.
Таблица точек кипения и плавления / замерзания на уровне моря (стандартное атмосферное давление). Информация представлена в градусах Цельсия (Цельсия).
.Углеводороды, спирты и кислоты — точки кипения
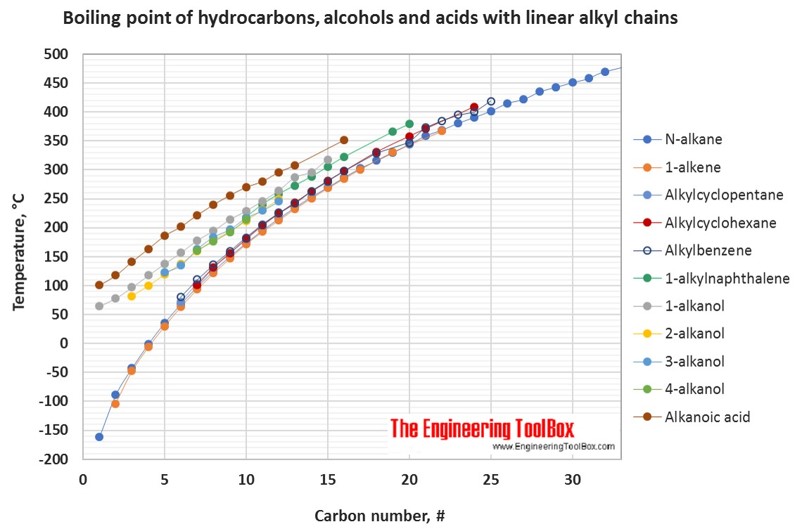
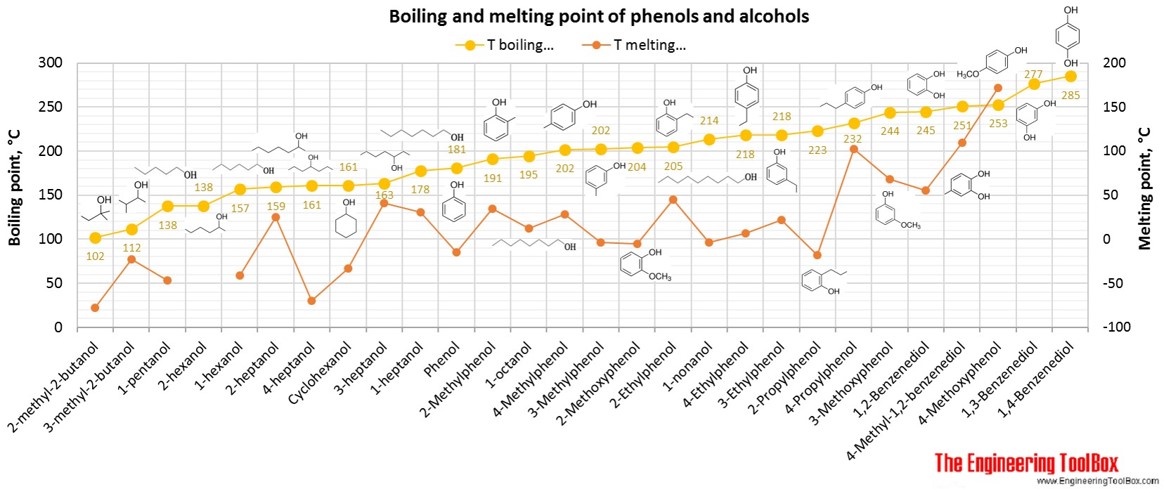
Таблицы и рисунки ниже показывают, как изменяется точка кипения с увеличением числа атомов углерода до C 33 для различных видов углеводородов, спиртов и карбоновых кислот. Более подробные определения и примеры молекулярных структур различных групп приведены под рисунками.
- Точка плавления — температура, при которой твердое вещество превращается в жидкость
- Точка кипения — температура, при которой жидкость превращается в газ
Для углеводородов с тем же числом атомов углерода точка кипения увеличивается в в следующем порядке:
мультизамещенный алкан <однозамещенный алкан <однозамещенный алкен <нормальный алкен <нормальный алкан <алкилциклогексан <алкилбензол <циклоалкен <циклоалкан <2-, 4- и 3-алканол / 1-алкилнафталин <1-алканол <нормальный алканоид кислота
Что касается точек плавления, тенденции более различаются с увеличением числа атомов углерода для различных типов углеводородов.
См. Также Точки плавления углеводородов, спиртов и кислот, плотности различных видов органических соединений и плотности, точки кипения и плавления соединений азота и серы.

См. Также значения pKa для фенолов, спиртов и карбоновых кислот.
Для полного стола — поверните экран!
| Температура кипения углеводородов, спиртов и кислот, C1-C16 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Число атомов углерода | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 1 130003 | 15 | 16 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2,2-диметилалкан | 10 | 50 | 79 | 106 | 133 | 155 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-метилалкан | -12 | 28 | 60 | 90 | 117 | 143 | 167 | 189 | 211 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-метилалкен | -7 | 31 | 62 | 92118 | 145 | 167 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3-метилалкан | 63 | 92 | 120 | 144 | 168 | 212 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алкен | -104 | -48 | -6 | 30 | 64 | 94 | 121 | 147 | 172 | 193 | 213 | 233 | 251 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н-алкан | -162 | -89 | -42 | -1 | 36 | 69 | 98 | 126 | 151 | 174 | 196 | 216 | 235 | 254 | 270 | 287 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алкин | -84 | -23 | 8 | 40 | 71 | 100 | 126 | 151 | 174 | 196 | 215 | 234 | 284 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкилциклогексан * | 101 | 132 | 156 | 178 | 204 | 225 | 244 | 263 | 72 | 104 | 131 | 156 | 180900 51 | 206 | 224 | 242 | 262 | 279 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкилбензол * | 80 | 111 | 136 | 159 | 183 | 159 | 242263 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Циклоалкен ** | -36 | 2 | 44 | 83 | 115 | ** | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Циклоалкен8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| -33 | 13 | 49 | 81 | 119 | 151 | 173 | 202 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-алканол | 82 | 99 | 119 | 138159 | 179 | 1 94 | 212 | 231 | 249 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4-алканол | 161 | 176 | 193 | 214 | 214 | 900 -алканол | 123 | 135 | 163 | 184 | 197 | 217 | 230 | 246 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1-алкилнафталин
218 | 240 | 258 | 273 | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алканол | 65 | 78 | 97 | 118 | 138 | 157 | 178 | 195 | 214 | 229 | 246 900 51 | 264 | 287 | 296 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкановая кислота | 101 | 118 | 142 | 164 | 186 | 202 | 222 | 240 | 256 | 270 | 280 | 296 | 308 | 351 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения углеводородов, C1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Углеродный номер | 1 | 2 | 3 | 4 | 5 | 6 | 1 04 | 9 | 10 9005 1 | 11 | 12 | 13 | 14 | 15 | 16 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2,2-диметилалкан | 174 | 223 | 271 | 311 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-метилалкан | 11 | 82 | 141 | 194 | 289 373 | 412 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-метилалкен | 20 | 88 | 144 | 198 | 244 | 293 | 333 | 9012 8 | 146 | 198 | 248 | 291 | 334 | 378 | 414 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алкен | -155 | -54 | 21 | 86 | 146200 | 250 | 297 | 342 | 379 | 415 | 451 | 484 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н-алкан | -259 | -127 | -44 | 31 | 97 | 156 | 209 | 258 | 303 | 345 | 385 | 421 | 456 | 488 | 518 | 549 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алкин | -119 | 10 | 47 | 104 | 160 | 212 | 259 | 303 | 345 | 385 | 419 | 453 | 543 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкилциклогексан * | 214 | 270 | 313 | 352 | 399 | 433 | 352 | 399 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкилциклопентан | 161 | 219 | 268 | 313 | 356 | 403 | 435 | 468 | 504 | 435 | 468 | 504 | 8 | 176 | 231 | 277 | 319 | 361 | 401 | 439 | 468 | 505 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Циклоалкен ** | 36-33 | 112 900 54 181239 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Циклоалкан ** | -27 | 55 | 121 | 177 | 246 | 304 | 343 | 343 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-алканол | 180 | 211 | 246 | 280 | 318 | 354 | 380 | 414 | 448 | 480 | 4-алканол | 322 | 349 | 379 | 417 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3-алканол | 25128 | 363 | 387 | 423 | 445 | 474 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1-алкилнафталин | 424 | 464 | 496| 523 | | 148 | 173 | 207 | 244 | 280 | 314 | 352 | 382 | 417 | 444 | 475 | 507 | 549 | 564 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алкановая кислота | 214 | 244 | 287 | 327 | 367 | 396 | 432 | 464 | 493 | 518 | 536 | 565 | 586 | 664 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ** кольца с без заместителей | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Определения органических соединений
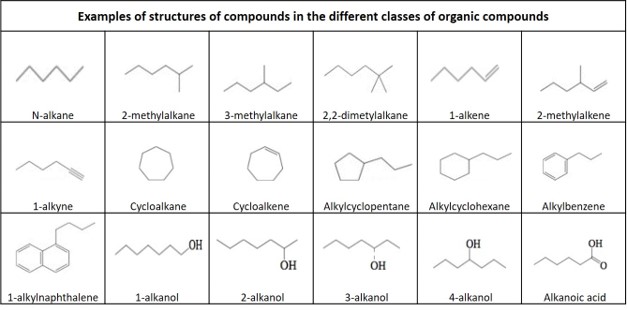
Углеводород: Органическое соединение, полностью состоящее из водорода и углерода.
Основные группы углеводородов:
Алкан: Ациклический насыщенный углеводород с общей формулой C n H 2n + 2 . Также называется парафин .
Алкен: Ненасыщенный углеводород, содержащий по крайней мере одну двойную связь углерод-углерод, с общей формулой C n H 2n . Также называется олефин .
Алкин : ненасыщенный углеводород, содержащий по меньшей мере одну тройную связь углерод-углерод, с общей формулой C n H 2n-2 .Также называется ацетилен .
Циклоалкан: Однокольцевый (моноциклический) насыщенный углеводород с общей формулой C n H 2n . Также называется нафтен .
Циклоалкен: Алкеновый углеводород, который содержит замкнутое кольцо атомов углерода, но не имеет ароматических свойств, с общей формулой C n H 2n-2 . Также называется циклоолефин .
Ароматический углеводород : Циклическая (кольцевая) плоская (плоская) молекула с кольцом резонансных связей, которая демонстрирует большую стабильность, чем другие геометрические или соединительные структуры с тем же набором атомов.Самый простой из ароматических углеводородов имеет 6 атомов углерода и содержит 3 двойные связи. Однокольцевое ароматическое соединение без каких-либо заместителей называется бензолом с формулой C 6 H 6 .
Полициклические ароматические углеводороды : углеводороды, состоящие из нескольких ароматических колец. Ароматическое соединение с двумя кольцами без каких-либо заместителей называется нафталином с формулой C 10 H 8 .
Некоторые подчиненные группы углеводородов, приведенные в этом документе:
Алкил: Алкановый заместитель без одного водорода, с общей формулой C n H 2n + 1
2-Метилалкан: A разветвленный алкан , с метильной группой, связанной со вторым атомом углерода в основной углеродной цепи.
3-Метилалкан: Разветвленный алкан с метильной группой, связанной с третьим атомом углерода в основной углеродной цепи.
2-Метилалкен: Разветвленный алкен с метильной группой, соединенной со вторым атомом углерода в основной углеродной цепи.
Алкилциклогексан: Монозамещенный циклогексан с одним разветвлением через присоединение одной алкильной группы к одному атому углерода циклогексанового кольца с общей формулой C n H (2n + 1) C 6 H 11 .
Алкилциклопентан : Монозамещенный циклопентан с одним разветвлением через присоединение одной алкильной группы к одному атому углерода циклогексанового кольца с общей формулой C n H 2n + 1 C 5 H 9 .
Алкилбензол: Монозамещенный бензол с одним разветвлением через присоединение одной алкильной группы к одному атому углерода бензольного кольца, с общей формулой C n H (2n + 1) C 6 H 5 .
Алкилнафталин: Монозамещенный нафталин с одним разветвлением через присоединение одной алкильной группы к одному атому углерода одного из ароматических колец с общей формулой C n H (2n + 1) C 10 H 7 .
Некоторые другие группы органических соединений:
Спирт: органическое соединение, в котором гидроксильная функциональная группа (–OH) связана с насыщенным атомом углерода
Алканол: Спирт, с которым связана гидроксильная группа алкан
Карбоновая кислота: органическое соединение, содержащее карбоксильную группу (C (= O) OH).Общая формула карбоновой кислоты — R – COOH, где R относится к остальной части молекулы.
Алкановая кислота: Карбоновая кислота, где R представляет собой алкан.
.точек кипения при высоком давлении
Когда вода нагревается, она достигает температуры — точки кипения — при которой давление пара достаточно велико, чтобы внутри воды образовывались пузырьки. Температура кипения воды зависит от давления.
Онлайн-калькулятор точки кипения воды
Калькулятор, представленный ниже, можно использовать для расчета точки кипения воды при заданном абсолютном давлении.
Температура на выходе указывается в ° C, ° F, K и ° R.
Примечание! Давление должно быть в пределах 1-220 бар, 14.7-3200 фунтов на квадратный дюйм, 760-165 000 мм рт. Ст. Или 30-6500 дюймов рт. Ст.
Точки кипения воды при абсолютном давлении в диапазоне от 1 до 70 бар или от 14,7 до 1000 фунтов на квадратный дюйм указаны на рисунках и в таблицах ниже:
См. Вода и тяжелая вода для получения информации о термодинамических свойствах при стандартных условиях.
См. Также другие свойства Вода при изменяющейся температуре и давлении : Точки кипения при давлении вакуума, плотность и удельный вес, динамическая и кинематическая вязкость, энтальпия и энтропия, теплота испарения, константа ионизации, pK w , нормальной и тяжелой воды, точки плавления при высоком давлении, число Прандтля, свойства в условиях равновесия газ-жидкость, давление насыщения, удельный вес, удельная теплоемкость (теплоемкость), удельный объем, теплопроводность, температуропроводность и давление пара в газе. жидкое равновесие.
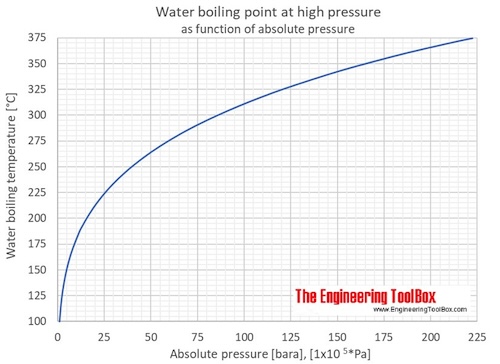
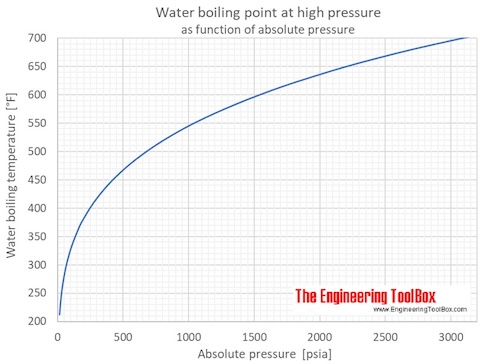

| Абсолютное давление | Температура кипения воды | |||||
| [бар] [1×10 5 * Па] 11 | фунтов / кв. дюйм] | [мм рт. ст.] | [дюйм рт. ст.] | [° C] | [° F] | |
| 1.013 | 14,7 | 760 | 29,92 | 100 | 212 | |
| 1,034 | 15,0 | 776 | 30,54 | 101 | 213 | |
| 1,103 | 16,0 | 827 900 | 102 | 216 | ||
| 1,172 | 17,0 | 879 | 34,61 | 104 | 219 | |
| 1.241 | 18,0 | 931 | 36,65 | 106 | 222 | |
| 1,310 | 19,0 | 983 | 38,68 | 107 | 225 | |
| 1,379 | 20,0 | 40,72 | 109 | 228 | ||
| 1,517 | 22,0 | 1138 | 44,79 | 112 | 233 | |
| 1.655 | 24,0 | 1241 | 48,86 | 114 | 238 | |
| 1,793 | 26,0 | 1345 | 52,94 | 117 | 242 | |
| 1,931 | 28,0 | 1448 900 | 119 | 246 | ||
| 2,068 | 30,0 | 1551 | 61,08 | 121 | 250 | |
| 2.206 | 32,0 | 1655 | 65,15 | 123 | 254 | |
| 2,344 | 34,0 | 1758 | 69,22 | 125 | 258 | |
| 2,482 | 36,0 | 1862 | 127 | 261 | ||
| 2,620 | 38,0 | 1965 | 77,37 | 129 | 264 | |
| 2.758 | 40,0 | 2069 | 81,44 | 131 | 267 | |
| 2,896 | 42,0 | 2172 | 85,51 | 132 | 270 | |
| 3,034 | 44,0 | 89,5844 | 134 | 273 | ||
| 3,172 | 46,0 | 2379 | 93,66 | 135 | 276 | |
| 3.309 | 48,0 | 2482 | 97,73 | 137 | 279 | |
| 3,447 | 50,0 | 2586 | 101,8 | 138 | 281 | |
| 3,585 | 52,0 | 2689 | 140 | 284 | ||
| 3,723 | 54,0 | 2793 | 109,9 | 141 | 286 | |
| 3.861 | 56,0 | 2896 | 114,0 | 142 | 288 | |
| 3,999 | 58,0 | 2999 | 118,1 | 144 | 291 | |
| 4,137 | 60,0 | 122,2 | 145 | 293 | ||
| 4,275 | 62,0 | 3206 | 126,2 | 146 | 295 | |
| 4.413 | 64,0 | 3310 | 130,3 | 147 | 297 | |
| 4,551 | 66,0 | 3413 | 134,4 | 148 | 299 | |
| 4,688 | 68,0 | 138 3517 900 | 149 | 301 | ||
| 4,826 | 70,0 | 3620 | 142,5 | 151 | 303 | |
| 4.964 | 72,0 | 3723 | 146,6 | 152 | 305 | |
| 5,102 | 74,0 | 3827 | 150,7 | 153 | 307 | |
| 5,240 | 76,0 | 3930 900 | 154 | 309 | ||
| 5,378 | 78,0 | 4034 | 158,8 | 155 | 310 | |
| 5.516 | 80,0 | 4137 | 162,9 | 156 | 312 | |
| 5,654 | 82,0 | 4241 | 167,0 | 157 | 314 | |
| 5,792 | 84,0 | 158 | 316 | |||
| 5,929 | 86,0 | 4447 | 175,1 | 158 | 317 | |
| 6.067 | 88,0 | 4551 | 179,2 | 159 | 319 | |
| 6,205 | 90,0 | 4654 | 183,2 | 160 | 320 | |
| 6,343 | 92,0 | 4758 900 | 161 | 322 | ||
| 6,481 | 94,0 | 4861 | 191,4 | 162 | 323 | |
| 6.619 | 96,0 | 4965 | 195,5 | 163 | 325 | |
| 6,757 | 98,0 | 5068 | 199,5 | 164 | 326 | |
| 6,895 | 100 | 5171 | 164 | 328 | ||
| 7,239 | 105 | 5430 | 213,8 | 166 | 331 | |
| 7.584 | 110 | 5689 | 224,0 | 168 | 335 | |
| 7,929 | 115 | 5947 | 234,1 | 170 | 338 | |
| 8,274 | 120 | 6206 | 172 | 341 | ||
| 10,34 | 150 | 7757 | 305,4 | 181 | 359 | |
| 12.07 | 175 | 9050 | 356,3 | 189 | 372 | |
| 13,79 | 200 | 10343 | 407,2 | 194 | 382 | |
| 15.51 | 225 | 11636 900 | 200 | 392 | ||
| 17,24 | 250 | 12929 | 509,0 | 205 | 401 | |
| 18.96 | 275 | 14222 | 559,9 | 210 | 410 | |
| 20,68 | 300 | 15514 | 610,8 | 214 | 417 | |
| 22,41 | 325 | 16807 66907 22,41 | 325 | 16807 | 218 | 425 |
| 24,13 | 350 | 18100 | 712,6 | 222 | 432 | |
| 25.86 | 375 | 19393 | 763,5 | 226 | 438 | |
| 27,58 | 400 | 20686 | 814,4 | 229 | 445 | |
| 29,30 | 425 | 233 | 451 | |||
| 31,03 | 450 | 23272 | 916,2 | 236 | 456 | |
| 32.75 | 475 | 24565 | 967,1 | 239 | 462 | |
| 34,47 | 500 | 25857 | 1018 | 242 | 467 | |
| 36.20 | 525 | 27150 | 245 | 472 | ||
| 37,92 | 550 | 28443 | 1120 | 247 | 477 | |
| 39.64 | 575 | 29736 | 1171 | 250 | 482 | |
| 41,37 | 600 | 31029 | 1222 | 252 | 486 | |
| 43.09 | 625 | 32322 | 255 | 491 | ||
| 44,82 | 650 | 33615 | 1323 | 257 | 495 | |
| 46.54 | 675 | 34908 | 1374 | 260 | 499 | |
| 48,26 | 700 | 36200 | 1425 | 262 | 503 | |
| 49,99 | 725 | 37493 | 264 | 507 | ||
| 51,71 | 750 | 38786 | 1527 | 266 | 511 | |
| 53.43 | 775 | 40079 | 1578 | 268 | 515 | |
| 55,16 | 800 | 41372 | 1629 | 270 | 518 | |
| 56,88 | 825 | 42665 | 272 | 522 | ||
| 58,61 | 850 | 43958 | 1731 | 274 | 525 | |
| 60.33 | 875 | 45251 | 1782 | 276 | 529 | |
| 62.05 | 900 | 46543 | 1832 | 278 | 532 | |
| 65,50 | 950 | 49129 | 281 | 539 | ||
| 68,95 | 1000 | 51715 | 2036 | 285 | 545 | |
| 75.06 | 1089 | 56301 | 2217 | 290 | 555 | |
| 84,64 | 1228 | 63485 | 2499 | 298 | 570 | |
| 98,78 | 1433 | 310 | 590 | |||
| 114,6 | 1662 | 85965 | 3384 | 321 | 610 | |
| 127.9 | 1854 | 95895 | 3775 | 329 | 625 | |
| 147,3 | 2136 | 110462 | 4349 | 341 | 645 | |
| 163,3 | 2369 | 349 | 660 | |||
| 186,8 | 2710 | 140127 | 5517 | 360 | 680 | |
| 213.5 | 3096 | 160131 | 6304 | 371 | 700 | |
| 222,4 | 3226 | 166829 | 6568 | 374 | 706 | |
- 51 C = o 5/9 [T ( o F) — 32]
- 1 фунт / дюйм (фунт / дюйм 2 ) = 6 894,76 Па (Н / м 2 ) = 0,068948 бар = 51,7149 мм рт. Ст. = 2,03602 дюйма рт. Ст.
См. Вода и тяжелая вода — термодинамические свойства.
См. Также Плотность воды, удельный вес и коэффициент теплового расширения, Динамическая и кинематическая вязкость, Энтальпия и энтропия, Теплота испарения, Константа ионизации, pK w , нормальной и тяжелой воды, Давление и точки кипения, Удельный вес, Удельная теплоемкость (теплоемкость) и Удельный объем для онлайн-калькуляторов, рисунков и таблиц.
 c1, L — табличные величины, теплоемкость и удельная теплота парообразования воды;
c1, L — табличные величины, теплоемкость и удельная теплота парообразования воды;