описание, свойства, формула и характеристика
Образование 8 ноября 2016Хром – химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно бихромат калия и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.
Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной свинцовой руды. Путем смешивания кроконта с соляной кислотой он получил оксид CrO3. Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.
Добыча и производство
Элемент производят из хромита (FeCr2O4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является кимберлитовой трубкой, богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na2CrO4), который восстанавливается углеродом до оксида Сг2O3. Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.
Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром – химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает анодированному алюминию рубиновый оттенок. Сг2O3, используемый для полировки металла, также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром – химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.
Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52Cr, 53Cr и
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53Cr образуется при радиоактивном распаде 53Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53Cr/52Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.
Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг2O3, также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи – хромиты.
Бихромат калия
K2Cr2O7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в концентрированной серной кислоте. Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.
Хромовая кислота
Соединение обладает гипотетической структурой H2CrO4. Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом – триоксидом CrO3.
Хромат свинца (II)
PbCrO4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar–Cr–Cr–Ar, где Ar представляет собой специфическую ароматическую группу.
Применение
Хром – химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром – химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента – около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: [Ar]3d54s1.
Источник: fb.ru
62. Общая характеристика подгруппы хрома
Элементы подгруппы хрома занимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных орбиталях. Элементы хром и
Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты.
Хром, молибден и вольфрам востребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов.
Хром. Элемент получают из хромитной руды Fe(CrO2)2, восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?.
Чистый хром получают восстановлением Cr2O3 с помощью алюминия или электролиза раствора, содержащего ионы хрома. Выделяя хром с помощью электролиза, можно получить хромовое покрытие, используемое в качестве декоративных и защитных пленок.
Из хрома получают феррохром, применяемый при производстве стали.
Молибден. Получают из сульфидной руды. Его соединения используют при производстве стали. Сам металл получают при восстановлении его оксида. Прокаливая оксид молибдена с железом, можно получить ферромолибден. Используют для изготовления нитей и трубок для обмотки печей и электроконтактов. Сталь с добавлением молибдена используют в автомобильном производстве.
Вольфрам. Получают из оксида, добываемого из обогащенной руды. В качестве восстановителя используют алюминий или водород. Получившийся вольфрам в идее порошка впоследствии формуют при высоком давлении и термической обработке (порошковая металлургия). В таком виде вольфрам используют для изготовления нитей накаливания, добавляют к стали.
63. Хром
Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы.
Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. Природный хром состоит из смеси 5 изотопов: 50, 52, 53, 54, 56. Это самый твердый из всех известных металлов, его плотность 7,2 г/см3. Температура плавления – 1855 °C, температура кипения – 2642 °C. При обычной температуре хром устойчив к воздействию воды и воздуха.
Химические свойства: электронная конфигурация: 1s22s22p2 3s23p63d54s1 . В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня.
При высокой температуре хром горит в кислороде: 4Cr + 3О2 = 2Cr2О3.
Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: 2Cr + 3Н2О = Cr2О3 + 3Н2?.
При нагревании реагирует с галогеноводородами, S, N2, P4, C, Si, B:
С галогенами реагирует не одинаково:
а) со фтором взаимодействует даже на холоде: Cr + 3F2 = CrF6;
б) с хлором реагирует при нагревании: 2Cr + 3Cl2 = 2CrCl3.
Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: CrО, Cr2О3 и CrО3.
Получение: В чистом виде хром получают двумя способами:
1) металлотермический – восстановление металла из его оксида с помощью другого металла;
2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме.
Металлический хром получают алюмотерми-ческим способом (способ Бекетова) из оксида Cr2О3 : Cr2О3 + 2Al = Al2О3 + 2Cr.
Нахождение в природе: в природе хром встречается только в виде соединений, важнейшим из которых является хромистый железняк FeCrO 4 или Fe(CrO)2 , из которого путем восстановления углеродом в электропечах получают сплав – феррохром . Используется хром в инструментальной и автомобильной промышленности: хромирование – покрытие хромом других металлов; в металлургии – при производстве легированной стали.
Химия d-элементов (медь, серебро, цинк, хром, марганец, железо) – HIMI4KA

Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29Cu 1s22s22p63s23p63d104s1, наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:


Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:
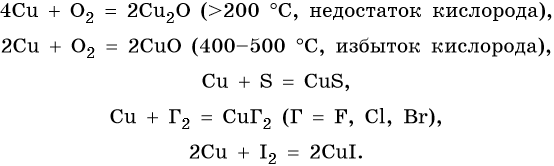
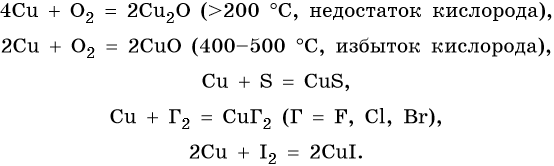
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:


В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:


Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
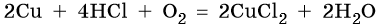
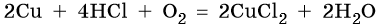
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
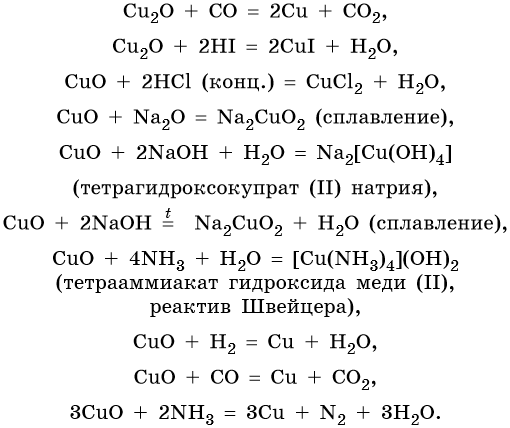
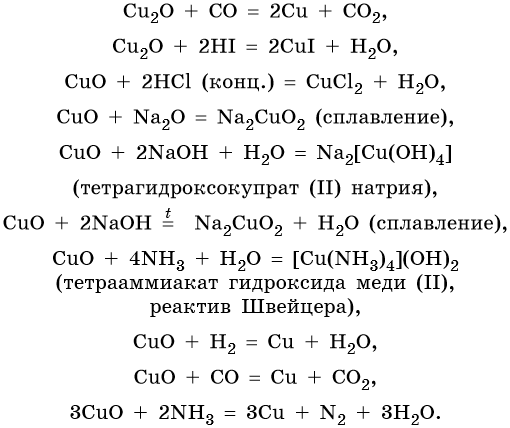
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
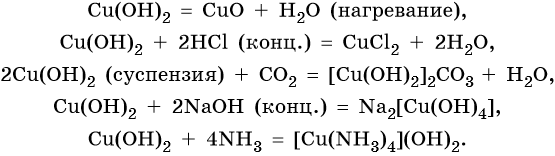
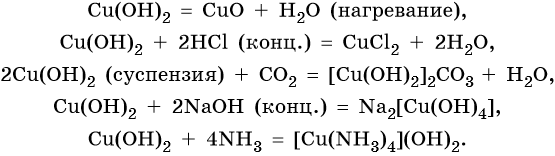
Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s22s22p63s23p63d104s24p64d105s1. В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:
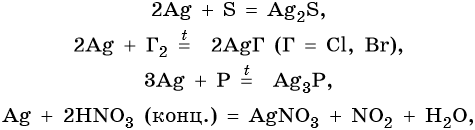
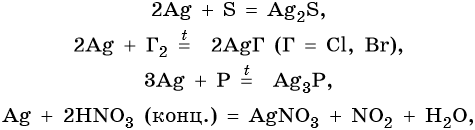


Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:
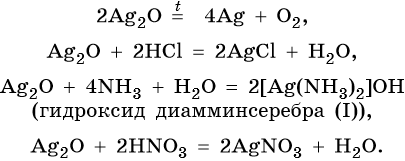
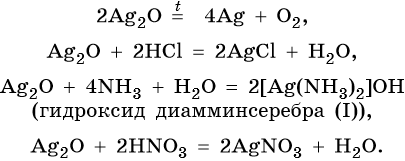
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30Zn 1s22s22p63s23p63d104s2. В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:


Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
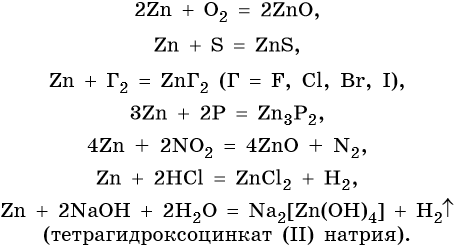
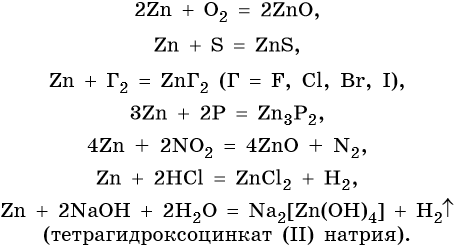
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:


Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:


Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24Cr 1s22s22p63s23p63d54s1. Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:


Его характерные химические реакции:


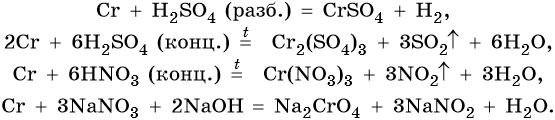
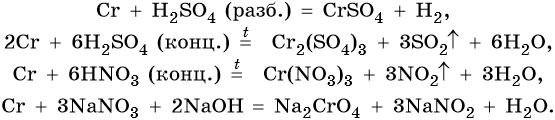
Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
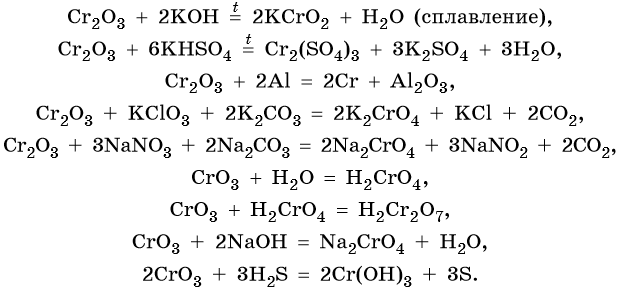
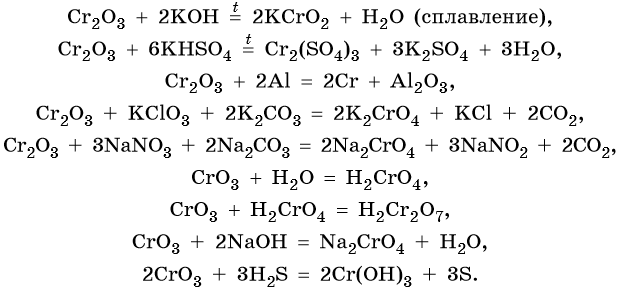
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:


Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p63d54s2. Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):


Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:


Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:


MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:


Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.


Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26Fe 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
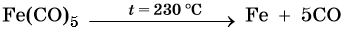
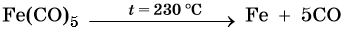
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:


Характерные для железа химические реакции:
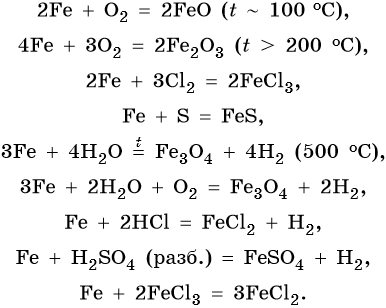
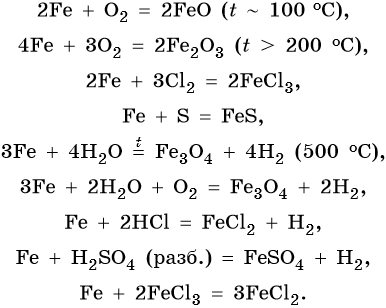
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
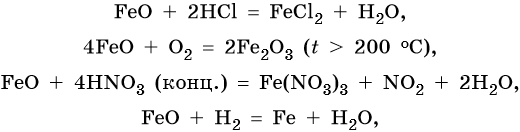
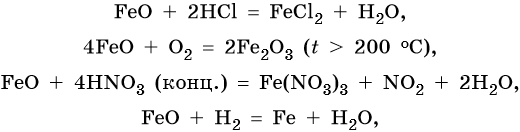


Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:


Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:


Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
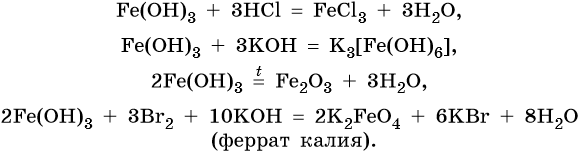
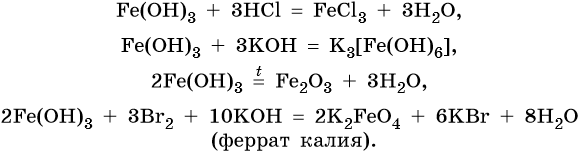
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:


Подгруппа хрома — Википедия
Материал из Википедии — свободной энциклопедии
| Группа → | 6 | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 4 | |||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Подгру́ппа хро́ма — химические элементы 6-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы VI группы)[1]. В группу входят хром Сr, молибден Mo и вольфрам W[2]. На внешнем энергетическом уровне у атомов хрома и молибдена находится один электрон, у вольфрама — два, поэтому характерным признаком данных элементов является металлический блеск, что и отличает эту побочную подгруппу от главной. Степень окисления в соединениях всех элементов подгруппы хрома равна +6, а также +5, +4, +3 и +2. По возрастанию порядкового номера элементов возрастает и температура плавления. Например, вольфрам — самый тугоплавкий металл, его температура плавления составляет 3390 °C. Элементы подгруппы достаточно устойчивы к внешним факторам (воздух, вода). По физическим и химическим свойствам молибден и вольфрам сходны, но отличаются от хрома[3].
Вольфрам, как самый тугоплавкий из всех элементов, широко применяется в металлургии[4]. Молибден широко применяется в металлургии. Наиболее часто хром находит своё применение при производстве легированных сталей[5].
Физические свойства[править | править код]
Химические свойства[править | править код]
Хром | Химия свойства элементов
Общие сведения и методы получения
Хром (Сг) — твердый блестящий металл. Как самостоятельный элемент был впервые выделен в 1797 г. Вокеленом из минерала крокоит, который открыл академик Паллас при изучении сибирских минералов в 1765 г. Свое название хром получил от греческого «chromos», что означает цвет, из-за различных цветов его соединений — от зеленого до красного.
Содержание в земной коре 0,035 % (по массе).
В свободном состоянии хром не встречается. Из многочисленных руд, содержащих хром, промышленное значение имеет только хромит FeO-Cr203, в котором содержится более 65 % Сг203 (по массе), остальное FeO. Хром входит в состав многих минералов, в частности в состав крокоита РЬСг04; к другим минералам, содержащим хром, относятся финицит, менахлоит или феникохлоит ЗРЬО-2Ст203, березовит, трапакалит, магнохромит и др. Известна большая группа силикатных минералов, содержащих хром, который придает этим минералам характерную окраску. Хромит относится к классу изоморфных минералов кубической системы, известных под названием шпинелей, которые можно охарактеризовать общей формулой -ТО-У203, где X — ион двухвалентного металла, У—ион трехвалентного металла. В промышленных хромовых рудах содержание С,г203 редко превышает 50 % (по массе). Феррохром с содержанием 65—70 % Сг, используемый в металлургии, получают прямым восстановлением хромовой руды с соотношением Cr:Fe=3:l. Хромит восстанавливают углеродом, причем для получения феррохрома содержание оксида хрома в руде должно быть не менее 48%. В процессе плавки протекает реакция: Fe0-Cr203+4C->—*-Fe + 2Cr + 4CO.
Хром технической чистоты получают алюминотермическим, силико-термическим, электролитическим и другими методами из оксида хрома, который получают из хромистого железняка. Из методов производства технически чистого металла, пригодного для дальнейшего рафинирования, наиболее прост и экономически выгоден электролитический. Стоимость электролитического хрома несколько выше, чем хрома, получаемого другими методами, но примеси из него могут быть удалены наиболее легко. Из методов очистки электролитического хрома от примесей наиболее широкое применение получила обработка хрома в сухом очищенном водороде. В процессе рафинирования из металла удаляется главным образом кислород, несколько понижается содержание азота и других металлических н неметаллических примесей, особенно элементов, имеющих высокое давление паров. Рафинирование электролитического хрома проводится длительным нагревом при 1300—1500 °С в условиях непрерывного притока водорода. Глубокую очистку хрома можно осуществлять также вакуумной дистилляцией с конденсацией Паров на холодной поверхности.
Наиболее чистый хром для лабораторных исследований получают иодидным методом. Этот процесс основан на образовании летучих
иодидов хрома (при 700—900 °С) и их диссоциации на нагретой поверхности (при 1000—1100 °С). Металлический хром после иодидного рафинирования пластичен в литом состоянии (удлинение при растяжении 9—18%).
Физические свойства
Атомные характеристики. Атомный номер хрома 24, атомная масса 51,996 а. е. м., атомный объем 7,23*10-6 м3/моль. Атомный (металлический) радиус хрома 0,128 нм, ковалентный 0,118 нм. Электронная конфигурация внешних оболочек 3d5 4s1. Электроотрицательность 1,6. Значения потенциалов ионизации J (эВ): 6,746; 16,49; 31. При атмосферном давлении хром обладает о. ц. к. решеткой, при комнатной температуре а=0,2884 нм. Энергия кристаллической решетки 337,5 мкДж/кмоль.
Химические свойства
В. В соединениях хром проявляет степени окисления +2, +3, +6, реже +4, +5, +1.
При нормальной температуре хром химически устойчив; почти не окисляется на воздухе, даже в присутствии влаги. При нагреве окисление протекает только на поверхности. Некоторые кислоты, например концентрированная азотная, фосфорная, хлорноватая, хлорная, образуют иа хроме окисную пленку, приводя к его пассивации. В этом состоянии хром обладает исключительно высокой коррозионной стойкостью и на него не действуют разбавленные минеральные кислоты. Хром является электроотрицательным по отношению к наиболее практически важным металлам и сплавам, и если он с ними образует гальванопару, то ускоряет их коррозию,
Электролитически осажденный хром содержит большое количество растворенного водорода — до ~5 % (ат.). В данной системе возможно образование СгН (1,9% Н), СгН2 (3,73% Н) или СгН3 (5,49% Н), которые обладают низкой термической стабильностью и легко разлагаются при незначительном нагревании. Теплота растворения водорода в твердом хроме при 797—1097 °С составляет 105 кДж/моль Н2, теплота образования СгН2Д//обр = 15,900 кДж/моль, Растворимость кислорода в твердом хроме при 1347 °С составляет 0,03% и снижается при понижении температуры. Наиболее распространенным оксидом хрома является Сг203 (31,6 % О), представляющий собой тугоплавкое вещество зеленого цвета (зеленый хром), применяемое для приготовления клеевой и масляной красок. Высший оксид хрома Сг03 — темно-красные игольчатые кристаллы представляет собой хромовый ангидрид, хорошо растворим в воде
Технологические свойства
Хром технической чистоты при комнатной температуре хрупок и приобретает пластичность лишь при нагреве выше 200—225 «С Хром относится к группе хладноломких металлов, пластичность которых резко падает при снижении температуры.
Области применения
Хром широко применяется в металлургии, главным образом в качестве легирующей добавки к сталям различного назначения. Добавка до 3 °/о Сг к обычным углеродистым сталям значительно повышает их механические свойства. Стали с содержанием 5—6 % Сг отличаются повышенным сопротивлением коррозии. При содержании хрома более 10 % стали обладают высокой коррозионной стойкостью (нержавеющие). Хром в качестве легирующей добавки входит также в состав
жаропрочных сплавов иа основе никеля и кобальта. Сплавов иа основе хрома не существует. Большое количество чистого хрома используется в гальванотехнике; хромирование является надежным средством борьбы с коррозией. Хромовые покрытия, помимо высокой коррозионной стойкости, обладают также высоким сопротивлением истиранию.
Хром в виде соединений используется при производстве огнеупорных материалов и пигментов.


