Модель атома Резерфорда — Студопедия
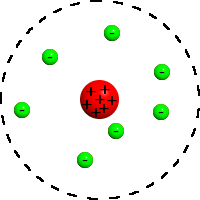
Планетарная модель атома, или модель Резерфорда — историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
К 1904 году японский физик Нагаока разработал раннюю, ошибочную «планетарную модель» атома («атом типа Сатурна»)[1]. Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из нее оказались пророческими:
• ядро атома действительно очень массивно;
• электроны удерживаются на орбите благодаря электростатическим силам (подобно тому, как кольца Сатурна удерживаются гравитационными силами).
Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеиванию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 −10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1).

Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Верна ли модель Томсона? Как в действительности распределены положительные и отрицательные заряды внутри атома? Чтобы ответить на эти вопросы, нужен был эксперимент, позволяющий проникнуть внутрь атома. Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными ?-частицами и смотреть, как они будут отклоняться положительным зарядом атома.
Что такое -частицы? Потоки этих частиц — так называемые «альфа-лучи» — были обнаружены при радиоактивном распаде некоторых элементов (например, радия). В результате тщательных исследований, проведённых опять-таки Резерфордом, было установлено, что каждая -частица имеет положительный заряд, равный по модулю удвоенному заряду электрона, и массу, превышающую массу электрона примерно в раз. То есть, -частица оказалась полностью ионизованным (лишённым электронов) атомом гелия.
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Энергия -частиц очень велика — достаточно сказать, что скорость их вылета из радиоактивного образца составляет примерно скорости света. Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах.
Пучок -частиц направлялся на тончайшую золотую фольгу. Как гласит история, Резерфорд не сомневался в том, что углы отклонения должны быть весьма малы: имея столь огромную энергию, -частицы должны проходить сквозь фольгу как нож сквозь масло. Только «для очистки совести», на всякий случай, он попросил учеников посмотреть, не возникает ли рассеяния -частиц на большие углы.
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший (рис. 2).

Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
А «бумагой» в образном сравнении Резерфорда служил атом, устроенный согласно модели Томсона. Действительно, допустим, что положительный заряд атома «размазан» по всему атому, то есть шару радиусом см. Этот положительный заряд создаёт электрическое поле, тормозящее и отклоняющее -частицы. Вблизи атома потенциал данного поля:
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала , а затем и размер положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
см.
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3).

Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!
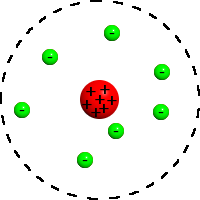
Планетарная модель атома: ядро (красное) и электроны (зелёные)
Планета́рная моде́ль а́тома, или модель атома Резерфо́рда, — исторически важная модель строения атома, предложенная Эрнестом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г.
В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
Планетарная модель атома соответствует современным представлениям о строении атома с уточнениями, что движение электронов не может быть описано законами классической механики и имеет квантовомеханическое описание.
Исторически планетарная модель Резерфорда пришла на смену «модели пудинга с изюмом» Томсона, которая предполагает, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома с распределённым по всему объёму атома положительным зарядом, подобно изюминкам в пудинге.
Энциклопедичный YouTube
1/3
Просмотров:8 056
987
1 338
✪ Опыт Резерфорда. Учебный фильм по атомной физике
✪ Планетарная модель атома
✪ Опыты Резерфорда. Планетарная модель атома
Предыстория

Схема модели атома Томсона. В модели Томсона «корпускулы» (электроны) расположены внутри облака положительного заряда, а не вокруг положительно заряженного ядра.
К 1904 году японский физик Нагаока Хантаро разработал раннюю, как оказалось впоследствии, ошибочную «планетарную модель» атома («атом типа Сатурна»)[2]. Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из неё оказались пророческими:
Новую модель строения атома Резерфорд предложил в 1911 году на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведённых в 1909 г. под его руководством[1].
При этом рассеянии большое, неожиданно статистически необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома.
Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10
Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10 −11 с.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора, постулирующая другие, отличные от классических законы орбитального движения электронов на основе волн де Бройля. Полностью противоречащие эксперименту выводы классической электродинамики смогло объяснить развитие квантовой механики.
Примечания
 Эта страница в последний раз была отредактирована 12 июля 2020 в 14:04.
Эта страница в последний раз была отредактирована 12 июля 2020 в 14:04.Планетарная модель атома — Википедия
Материал из Википедии — свободной энциклопедии

Планета́рная моде́ль а́тома, или модель атома Резерфо́рда, — исторически важная модель строения атома, предложенная Эрнстом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г.
В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
Планетарная модель атома соответствует современным представлениям о строении атома с уточнениями, что движение электронов не может быть описано законами классической механики и имеет квантовомеханическое описание.
Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая предполагает, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома с распределённым по всему объёму атома положительным зарядом, подобно изюминкам в пудинге.Предыстория
 Схема модели атома Томсона. В модели Томсона «корпускулы» (электроны) расположены внутри облака положительного заряда, а не вокруг положительно заряженного ядра.
Схема модели атома Томсона. В модели Томсона «корпускулы» (электроны) расположены внутри облака положительного заряда, а не вокруг положительно заряженного ядра.К 1904 году японский физик Нагаока разработал раннюю, как оказалось впоследствии, ошибочную «планетарную модель» атома («атом типа Сатурна»)[2]. Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из неё оказались пророческими:
Новую модель строения атома Резерфорд предложил в 1911 году на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведённых в 1909 г. под его руководством
При этом рассеянии большое, неожиданно статистически необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома.
Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10−10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд ядра пропорционален атомной массе. Связь электрического заряда ядра с атомным номером химического элемента установил Генри Мозли в экспериментах, выполненных в 1913 г.
Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Из классической электродинамики следует, что так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10−11 с.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора, постулирующая другие, отличные от классических законы орбитального движения электронов на основе волн де Бройля. Полностью противоречащие эксперименту выводы классической электродинамики смогло объяснить развитие квантовой механики.
Примечания
Модели атома.
1903 году Дж. Дж. Томсон, предложил модель атома, согласно которой атом представляет собой сферу, равномерно заполненную положительным электричеством. Электроны погружены в эту среду и взаимодействуют с элементами этой среды по закону Кулона (рис. 4.1, а). Согласно этой модели атом в целом нейтрален: суммарный заряд сферы и заряда электронов равен нулю.
Спектр такого атома должен был быть сложным, но никоим образом не линейчатым, что противоречило экспериментальным данным. По модели Томсона колеблющийся электрон (осциллятор) может испускать электромагнитную волну. При отклонении электрона от положения равновесия возникают силы, которые стремятся возвратить его в положение равновесия. Благодаря этому возникают колебания электрона, которые обусловливают излучение атома.
Была предложена также модель атома, изображенная на рис. 4.1,б: атом состоял из сферы, в центре которой находилось положительно заряженное ядро, а вокруг него располагались электроны. Однако и эта модель не смогла объяснить результаты экспериментов.
Наиболее известна планетарная модель атома, предложенная английским физиком Э. Резерфордом (рис. 4.1, в).
Первые эксперименты по изучению строения атома были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых
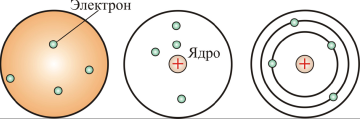
а б в
Рис. 4.1
других элементов. Эти опыты стали возможны благодаря открытию явления радиоактивности, при котором в результате естественного радиоактивного распада тяжелых элементов выделяются 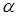 — частицы, имеющие положительный заряд, равный заряду двух электронов, масса
— частицы, имеющие положительный заряд, равный заряду двух электронов, масса 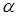 — частицы в 4 раза больше массы атома водорода, т.е. они являются ионами атома гелия
— частицы в 4 раза больше массы атома водорода, т.е. они являются ионами атома гелия 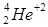 . Энергия
. Энергия 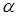 -частиц, испускаемых различными тяжелыми химическими элементами, изменяется от
-частиц, испускаемых различными тяжелыми химическими элементами, изменяется от 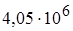 эВ для урана до
эВ для урана до 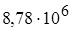 эВ для тория. Масса α-частиц примерно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В этих опытах использовались α-частицы с кинетической энергией 5 МэВ, что соответствовало их скорости около
эВ для тория. Масса α-частиц примерно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В этих опытах использовались α-частицы с кинетической энергией 5 МэВ, что соответствовало их скорости около 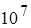 м/с.
м/с.
Эти частицы бомбардировали фольги из тяжелых металлов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не изменяют траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Цель опытов Резерфорда состояла в том, чтобы экспериментально проверить основные положения модели атома, предложенной Томсоном.
Схема опыта Резерфорда по рассеянию α-частиц показана на рис. 4.2.
Здесь K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп. От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Толщина фольги составляла 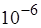 м (1 мкм), что эквивалентно примерно 400 слоям из атомов золота. Рассеянные фольгой α-частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом
м (1 мкм), что эквивалентно примерно 400 слоям из атомов золота. Рассеянные фольгой α-частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом
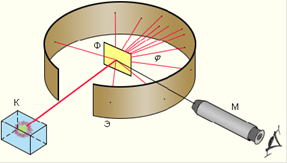 с помощью микроскопа. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги. Т.е. можно было всегда измерить угол отклонения α-частиц от прямолинейной траектории движения. Весь прибор помещался в вакуум, чтобы α-частицы не рассеивались при столкновении с молекулами воздуха.
с помощью микроскопа. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги. Т.е. можно было всегда измерить угол отклонения α-частиц от прямолинейной траектории движения. Весь прибор помещался в вакуум, чтобы α-частицы не рассеивались при столкновении с молекулами воздуха.
Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходило через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц все же отклонялась на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Этот результат был неожиданным, т.к. находился в противоречии с моделью атома Томсона, согласно которой положительный заряд распределён по всему объёму атома.
При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу по закону Кулона, возросла бы в n2 раз. Тогда при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объёме, имеющем размеры порядка
10-14 м. Эту часть атома Резерфорд назвал атомным ядром. Электроны, по мнению Резерфорда, движутся вокруг ядра с размерами порядка 10–14 м. Так возникла ядерная модель атома (рис. 4.1, в).
На основании полученных результатов Резерфорд, учитывая, что электроны атома не могут существенно влиять на рассеяние относительно тяжелых и быстрых 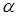 -частиц, сделал выводы, которые были положены в основу планетарной (ядерной) модели атомов:
-частиц, сделал выводы, которые были положены в основу планетарной (ядерной) модели атомов:
1) существует ядро, в котором сосредоточена вся масса атома и весь его положительный заряд, причем размеры ядра значительно меньше, чем размер самого атома;
2) электроны, которые входят в состав атома, движутся вокруг ядра по круговым орбитам.
Исходя из этих двух предпосылок и предполагая, что взаимодействие между налетающей 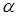 -частицей и положительно заряженным ядром определяется кулоновскими силами, Резерфорд установил, что атомные ядра имеют размеры
-частицей и положительно заряженным ядром определяется кулоновскими силами, Резерфорд установил, что атомные ядра имеют размеры 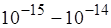 м, т.е. они в
м, т.е. они в 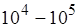 раз меньше размеров атомов. Ядро занимает только 10–12 часть полного объёма атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Вещество, составляющее ядро атома, имеет колоссальную плотность ρ≈1017 кг/м3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
раз меньше размеров атомов. Ядро занимает только 10–12 часть полного объёма атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Вещество, составляющее ядро атома, имеет колоссальную плотность ρ≈1017 кг/м3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Величина положительного электрического заряда атомного ядра Z определяется количеством протонов в ядре (и, следовательно, количеством электронов в атомных оболочках), которое совпадает с порядковым номером элемента в периодической таблице. Заряд равен Zе, где е = 1,602 · 10-19 Кл – абсолютная величина элементарного электрического заряда. Заряд определяет химические свойства всех изотопов данного элемента.
В 1911 Резерфорд, используя закон Кулона, получил формулу
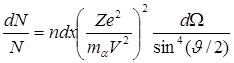 , (4.1)
, (4.1)
где N – количество α-частиц, падающих в единицу времени на рассеиватель; dN – количество рассеянных в единицу времени α-частиц в телесном угле dΩ под углом θ; Ze и n – заряд ядер рассеивателя и их концентрация; dx − толщина слоя фольги; V и mα – скорость и масса α-частиц.
Прямые опыты по измерению заряда ядер на основе формулы Резерфорда были выполнены Чедвиком в 1920 году. Схема опыта Чедвика приведена на рис. 4.3.
Рассеиватель в виде кольца (заштриховано на рис. 4.3) размещался соосно и на равных расстояниях между источником И и детектором α-частиц Д. При измерении количества dN рассеянных α-частиц отверстие в кольце закрывалось экраном, который поглощал прямой пучок α-частиц из источника
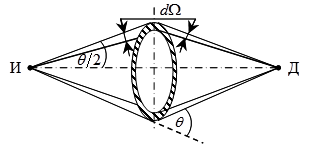
Рис. 4.3
в детектор. Детектор регистрировал только α-частицы, рассеянные в телесном
угле dΩ под углом θ к падающему пучку α-частиц. Затем кольцо перекрывалось экраном с отверстием, и измерялась плотность тока α-частиц в точке расположения детектора. По полученным данным, рассчитывали количество N α-частиц, падающих на кольцо в единицу времени. Таким образом, если известна энергия α— частиц, испускаемых источником, без труда определялась величина Z в формуле (4.1).
Формула Резерфорда позволила объяснить экспериментальные результаты по рассеянию α-частиц на тяжелых ядрах , что привело к открытию атомного ядра и созданию ядерной модели атома.
Модель атома, предложенная Резерфордом, напоминает Солнечную систему. Именно поэтому модель Резерфорда получила название планетарной модели атома. Эта модель стала значительным шагом на пути к современным представлениям о строении атома. Лежащее в ее основе понятие атомного ядра, в котором сосредоточены весь положительный заряд атома и практически вся его масса, сохранило свое значение до настоящего времени.
Однако, в отличие от планетарной модели Солнечной системы, планетарная модель атома оказывается внутренне противоречивой с точки зрения классической физики. И это, прежде всего, связано с наличием у электрона заряда. Согласно законам классической электродинамики вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица, будет излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным, то есть содержать электромагнитные волны с любой длиной волны. Уже этот вывод противоречит линейчатости спектров излучения атомов, наблюдаемой на опыте.
Кроме того, непрерывное излучение уменьшает кинетическую энергию электрона. Поэтому, за счет излучения радиус орбиты движущегося электрона обязан уменьшаться, и, в конце концов, электрон должен упасть на ядро, как показывают оценки, за время  . Однако в действительности атом водорода является устойчивой и «долгоживущей» электромеханической системой. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
. Однако в действительности атом водорода является устойчивой и «долгоживущей» электромеханической системой. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
Эксперимент по рассеиванию альфа-частиц
Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу \(XIX\) века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд.
Эрнест Резерфорд
В \(1904\) году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины.
Альфа-частица — ионизированный атом гелия.
Альфа-частица — это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда.
Схематично установка Резерфорда изображена на рисунке ниже.

В толстостенном свинцовом футляре (\(1\)) находится радиоактивное вещество (\(2\)), излучающее поток альфа-частиц. Через небольшое отверстие (\(3\)) поток альфа-частиц направляется на тонкую золотую фольгу (\(4\)) (толщиной порядка \(0,1\) мк). За фольгой располагается экран, покрытый сернистым цинком (\(5\)). При столкновении альфа-частицы на экране наблюдается вспышка.
Согласно модели строения атома по Томпсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (\(6\)). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (\(7\)). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (\(8\)).
Результаты опыта были удивительными. Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.
Ядерная модель строения атома
Так как большинство альфа-частиц свободно проходило через фольгу, это означало, что практически всё пространство, через которое проходит поток альфа-частиц — это пустота. Где же тогда «спрятана» вся масса атома? Резерфорд предположил, что практически вся масса атома сосредоточена в очень маленьком объёме — ядре атома. Было очевидно, что ядро должно быть положительно заряжено. Когда альфа-частица пролетает достаточно близко от такого ядра, то из-за Кулоновских сил отталкивания происходит отклонение от первоначального направления движения частицы. А при столкновении с ядром частица отскакивает в обратном направлении. По расчётам Резерфорда, ядро атома должно было иметь размер примерно в \(3000\) раз меньший, чем атом. Остальное пространство атома должны занимать электроны.
Планетарная модель строения атома
Итак, стало понятно, что «пудинговая модель строения атома» неверна. На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома».
Обрати внимание!
Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам.
Модель очень напоминала модель строения Солнечной системы, где вокруг массивного Солнца по круговым орбитам вращаются планеты.
Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию альфа — частиц. Однако объяснить стабильность атомов не удавалось. Движение электрона в атоме происходит с ускорением. В соответствии с классической электродинамикой это движение должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен был бы очень скоро упасть на него. Однако атомы стабильны. Следовательно, планетарная модель противоречила законам классической физики.
Планетарная модель строения атома
Компьютерная программа представляет собой демонстрацию по теме «Строение атома». Приводится информация о классическом опыте Резерфорда по зондированию атома с помощью α-частиц, приводятся примеры строения атомов шести различных химических элементов.
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах.
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света).
α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Планетарная модель атома, предложенная Резерфордом, явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Демонстрация состоит из семи экранов. Модель может быть использована в режиме ручного переключения кадров и в режиме автоматической демонстрации ().
модель Резерфорда | Определение и факты
Модель Резерфорда , также называемая Модель атома Резерфорда, атомный атом , или планетарная модель атома , описание структуры атомов, предложенное (1911) физиком из Новой Зеландии Эрнестом Резерфордом. Модель описывала атом как крошечное, плотное, положительно заряженное ядро, называемое ядром, в котором сосредоточена почти вся масса, вокруг которой свет, отрицательные составляющие, называемые электронами, циркулируют на некотором расстоянии, подобно планетам, вращающимся вокруг Солнца. ,
Модель атома Резерфорда Физик Эрнест Резерфорд представил атом в виде миниатюрной солнечной системы с электронами, вращающимися вокруг массивного ядра, и в виде в основном пустого пространства, где ядро занимает лишь очень небольшую часть атома. Нейтрон не был обнаружен, когда Резерфорд предложил свою модель, в которой ядро состояло только из протонов. Энциклопедия Британника, Инк.Основные вопросы
Какая модель атома предложена Эрнестом Резерфордом?
Атом, как описывает Эрнест Резерфорд, имеет крошечное массивное ядро, называемое ядром.Ядро имеет положительный заряд. Электроны — это частицы с отрицательным зарядом. Электроны вращаются вокруг ядра. Пустое пространство между ядром и электронами занимает большую часть объема атома.
Что такое эксперимент с золотой фольгой Резерфорда?
Кусок золотой фольги был поражен альфа-частицами, которые имеют положительный заряд. Большинство альфа-частиц прошли прямо через. Это показало, что атомы золота были в основном пустым пространством. У некоторых частиц их пути были согнуты под большими углами.Некоторые даже отскочили назад. Единственный способ, которым это могло бы произойти, был бы, если бы у атома была небольшая, тяжелая область положительного заряда внутри него.
Каковы были результаты эксперимента Резерфорда?
Предыдущая модель атома, модель атома Томсона или модель «сливового пудинга», в которой отрицательно заряженные электроны были подобны сливам в положительно заряженном пудинге атома, была опровергнута. Модель атома Резерфорда опиралась на классическую физику. Атомная модель Бора, опирающаяся на квантовую механику, построена на модели Резерфорда для объяснения орбит электронов.
Что атомная модель Эрнеста Резерфорда сделала правильно и неправильно?
Модель атома Резерфорда была верна в том, что атом в основном пустое пространство. Большая часть массы находится в ядре, а ядро заряжено положительно. Вдали от ядра находятся отрицательно заряженные электроны. Но модель атома Резерфорда использовала классическую физику, а не квантовую механику. Это означало, что электрон, окружающий ядро, испускает электромагнитное излучение. Электрон потерял бы энергию и упал бы в ядро.В модели Бора, в которой использовалась квантовая теория, электроны существуют только на определенных орбитах и могут перемещаться между этими орбитами
Какое влияние оказала теория Эрнеста Резерфорда?
Эксперимент с золотой фольгой показал, что атом состоит из небольшого массивного положительно заряженного ядра, причем отрицательно заряженные электроны находятся на большом расстоянии от центра. Нильс Бор создал модель Резерфорда, чтобы создать свою собственную. В модели Бора орбиты электронов объяснялись квантовой механикой.
Ядро было постулировано как маленькое и плотное для объяснения рассеяния альфа-частиц на тонкой золотой фольге, что наблюдалось в серии экспериментов, выполненных студентом Эрнестом Марсденом под руководством Резерфорда и немецкого физика Ганса Гейгера в 1909 году. Радиоактивный источник, излучающий альфа-частицы (т.е. положительно заряженные частицы, идентичные ядру атома гелия и в 7000 раз более массивные, чем электроны) был заключен в защитный свинцовый экран. Излучение фокусировалось в узкий луч после прохождения через щель на свинцовом экране.Тонкая часть золотой фольги была помещена перед щелью, а экран, покрытый сульфидом цинка для придания ему флуоресцентного света, служил в качестве счетчика для обнаружения альфа-частиц. Когда каждая альфа-частица падала на флуоресцентный экран, она производила вспышку света, называемую сцинтилляцией, которая была видна через микроскоп, прикрепленный к задней части экрана. Сам экран был подвижным, что позволяло Резерфорду и его сотрудникам определять, отклоняются ли какие-либо альфа-частицы золотой фольгой.
Эксперимент с золотой фольгой Резерфорда В 1909 году Резерфорд опроверг сэра Дж.Дж. Томсоновская модель атома как равномерно распределенного вещества. Поскольку только очень немногие альфа-частицы в его пучке были разбросаны под большими углами после удара золотой фольги, в то время как большинство прошло полностью сквозь него, Резерфорд знал, что масса атома золота должна быть сосредоточена в крошечном плотном ядре. Encyclopædia Britannica, Inc.Большинство альфа-частиц проходили прямо через золотую фольгу, что означало, что атомы в основном состоят из открытого пространства.Некоторые альфа-частицы были слегка отклонены, что предполагает взаимодействие с другими положительно заряженными частицами внутри атома. Другие альфа-частицы были разбросаны под большими углами, а очень немногие даже отскочили назад к источнику. (Резерфорд, как известно, позже сказал: «Это было почти так же невероятно, как если бы вы выпустили 15-дюймовую оболочку по куску папиросной бумаги, и она вернулась и ударила вас».) Только положительно заряженная и относительно тяжелая целевая частица, такая как предполагаемое ядро, может объяснить такое сильное отталкивание.Отрицательные электроны, которые электрически уравновешивали положительный заряд ядра, рассматривались как движущиеся по круговым орбитам вокруг ядра. Электростатическая сила притяжения между электронами и ядром сравнивалась с гравитационной силой притяжения между вращающимися планетами и Солнцем. Большая часть этого планетарного атома была открытым пространством и не оказывала сопротивления прохождению альфа-частиц.
Модель Резерфорда вытеснила атомную модель «сливового пудинга» английского физика сэра Дж.Дж. Томсон, в котором электроны были встроены в положительно заряженный атом, как сливы в пудинге. Основанная исключительно на классической физике, сама модель Резерфорда была заменена через несколько лет атомной моделью Бора, которая включала некоторую раннюю квантовую теорию.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодня Редакторы Британской энциклопедии. Эта статья была недавно исправлена и обновлена Эриком Грегерсеном, старшим редактором.Узнайте больше в этих связанных статьях Britannica:
,Модель атома Резерфорда— Ограничения модели атома Резерфорда
История Сегодня общеизвестно, что атом состоит из электронов, протонов и нейтронов. Первоначально считалось, что атом — это самая маленькая единица (атомный смысл неразрушимый) из существующих, но с тех пор эта теория оказалась избыточной благодаря открытию субатомных частиц, и исследования все еще продолжаются, чтобы выяснить, можно ли еще разделить эти субатомные частицы. дальше.Открытие и исследование кварков является шагом в этом направлении. Многие ученые предложили различные модели атома, начиная с древнегреческого и индийского языков. Тогда Атом считался неделимым, но когда Дж. Дж. Томпсон обнаружил в атоме отрицательно заряженные частицы, норма была оспорена, и научное сообщество отправилось в другую экспедицию. Дж. Дж. Томсон предложил модель сливового пудинга вскоре после того, как он обнаружил наличие отрицательно заряженных частиц, которые он назвал электронами.Итак, если был отрицательный заряд, и атом был электрически нейтральным, то должен был быть положительный заряд. Он постулировал, что атом похож на пудинг с массой и положительным зарядом, распределенными по его поверхности, и электроны, встроенные в пудинг, как сливы.
Модель Томпсона «Сливовый пудинг» не дала объяснения многим практическим наблюдениям, и после революционного эксперимента, теперь известного нам как эксперимент с золотой фольгой Альфа-рассеяния, классическая модель атома, которая была принятой нормой для значительной части недавней истории был тот, который предложил Эрнест Резерфорд.В настоящее время доказано, что это также является неточным объяснением многих наблюдаемых явлений. Давайте посмотрим на модель и ее отличительные особенности и некоторые ее ограничения.
В этом эксперименте Резерфорд бомбардировал альфа-частицы высокой энергии, направленные из радиоактивного источника, на очень тонкую золотую фольгу толщиной 100 нм. Это было направлено на наблюдение и изучение отклонения альфа-частиц.Вокруг золотой фольги был помещен флуоресцентный экран из сульфида цинка. Наблюдения, полученные в результате эксперимента, противоречили установленной норме и породили новую модель атома.
Наблюдения и выводы из эксперимента Резерфорда
Постулаты Резерфорда и их характерные особенности на основе экспериментальных наблюдений
Ограничения модели Атома Резерфорда
Хотя модель Резерфорда была огромным шагом вперед по сравнению с предыдущими моделями, она все же не могла объяснить довольно много физических явлений.
Эти недостатки были дополнительно разработаны Бором Нейлом, Джеймсом Чедвиком и многими учеными, пришедшими после него. Хотя они недостаточно объяснили все наблюдаемые явления, проведенные ими революционные эксперименты и наблюдения изменили понимание человеком атомной теории и легли в основу современной современной физики, которая получила множество применений во множестве отраслей промышленности и коммунальных услуг. ,
атом | Определение, история и примеры
Атом , наименьшая единица, на которую можно разделить вещество без выделения электрически заряженных частиц. Это также самая маленькая единица материи, которая имеет характерные свойства химического элемента. Таким образом, атом является основным строительным блоком химии.
Модель атома в оболочке В модели атома в оболочке электроны занимают разные уровни энергии, или оболочки. Оболочки K и L показаны для атома неона. Encyclopædia Britannica, Inc. Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома Атомная модель электронных конфигураций. Encyclopædia Britannica, Inc. Просмотреть все видео этой статьиБольшая часть атома — это пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются наиболее легкими заряженными частицами в природе.Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что, таким образом, вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некоторых отношениях электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие в положении вокруг ядра.Такие волновые структуры, называемые орбитали, описывают распределение отдельных электронов. На поведение атома сильно влияют эти орбитальные свойства, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья открывается широким обзором фундаментальных свойств атома, его составляющих частиц и сил. После этого обзора приведен исторический обзор наиболее влиятельных представлений об атоме, которые были сформулированы на протяжении веков.Для дополнительной информации, относящейся к ядерной структуре и элементарным частицам, см. субатомных частиц.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняБольшая часть вещества состоит из скопления молекул, которые можно относительно легко отделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые сложнее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер.Эти частицы электрически заряжены, и электрические силы на заряде отвечают за удержание атома вместе. Попытки отделить эти меньшие составляющие частицы требуют все возрастающего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечено во введении к этой статье, атом состоит в основном из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, которые имеют положительный заряд, и нейтронов, которые не имеют заряда.Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных, встречающихся в природе атомах. Другие субатомные частицы могут быть найдены в связи с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Все атомы примерно одинакового размера, имеют ли они 3 или 90 электронов. Примерно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0.4 дюйма). Удобной единицей длины для измерения атомных размеров является ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома, ядро еще более мелкое. Это в той же пропорции к атому, что и мрамор к футбольному полю. По объему ядро занимает всего 10 –14 метров пространства в атоме, т. Е. 1 часть на 100 000. Удобной единицей длины для измерения размеров ядер является фемтометр (фм), который равен 10 –15 метров.Диаметр ядра зависит от количества содержащихся в нем частиц и составляет от около 4 мкм для легкого ядра, такого как углерод, до 15 мкм для тяжелого ядра, такого как свинец. Несмотря на небольшой размер ядра, здесь сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного более массивны, чем протоны. Тот факт, что ядра могут иметь от 1 до 300 протонов и нейтронов, объясняет их широкое изменение массы.Самое легкое ядро из водорода в 1,836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как число единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану.Нейтральный атом имеет одинаковое количество протонов и электронов, так что положительные и отрицательные заряды точно сбалансированы. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно число протонов в ядре определяет химические свойства атома.
,Часть 1. Атомная модель Резерфорда
История атома и атомной теории
 Глава 5 История атома и теории атома. Вы приглашены на конференцию «Мышление внутри коробки». Каждая группа должна назначить: o Лидера o Писателя o Ведущего У вас есть 5 минут, чтобы прийти к наблюдениям
Глава 5 История атома и теории атома. Вы приглашены на конференцию «Мышление внутри коробки». Каждая группа должна назначить: o Лидера o Писателя o Ведущего У вас есть 5 минут, чтобы прийти к наблюдениям
5.1 Эволюция атомной модели
 5.1 Эволюция атомной модели Изучение атома было увлечением ученых на протяжении сотен лет. Даже греческие философы более 2500 лет назад обсуждали идею о наименьшем
5.1 Эволюция атомной модели Изучение атома было увлечением ученых на протяжении сотен лет. Даже греческие философы более 2500 лет назад обсуждали идею о наименьшем
Модели атома
 Модели атома Вся жизнь, будь то деревья, киты, грибы, бактерии или амебы, состоит из клеток.Точно так же все, будь то в форме аспирина, золота, витаминов, воздуха или минералов,
Модели атома Вся жизнь, будь то деревья, киты, грибы, бактерии или амебы, состоит из клеток.Точно так же все, будь то в форме аспирина, золота, витаминов, воздуха или минералов,
ЗАМЕЧАНИЯ О СТРУКТУРЕ АТОМА
 ЗАМЕЧАНИЯ ПО СТРУКТУРЕ АТОМНОЙ ХИМИИ — это изучение вещества и его свойств. Эти свойства можно объяснить, исследуя атомы, из которых состоит вещество. Атом — самая маленькая частица
ЗАМЕЧАНИЯ ПО СТРУКТУРЕ АТОМНОЙ ХИМИИ — это изучение вещества и его свойств. Эти свойства можно объяснить, исследуя атомы, из которых состоит вещество. Атом — самая маленькая частица
Планировщик Подразделения Науки APS
 APS Science Curriculum Unit Planner Уровень оценки / предметная химия Этап 1: Желаемые результаты Постоянное понимание Тема 1: Элементы и периодическая таблица: размещение элементов в периодической таблице
APS Science Curriculum Unit Planner Уровень оценки / предметная химия Этап 1: Желаемые результаты Постоянное понимание Тема 1: Элементы и периодическая таблица: размещение элементов в периодической таблице
Развитие атомной теории
 Развитие атомной теории Атом Самая маленькая частица, на которую можно разделить элемент и при этом быть одной и той же субстанцией.Элемент Чистое вещество, которое нельзя разделить на более простые вещества
Развитие атомной теории Атом Самая маленькая частица, на которую можно разделить элемент и при этом быть одной и той же субстанцией.Элемент Чистое вещество, которое нельзя разделить на более простые вещества
Основные ядерные концепции
 Раздел 7: В этом разделе мы представляем базовое описание атомных ядер, запасенную энергию, содержащуюся в них, их возникновение и стабильность Основные ядерные концепции РАННИЕ ОТКРЫТИЯ [см. Также Раздел
Раздел 7: В этом разделе мы представляем базовое описание атомных ядер, запасенную энергию, содержащуюся в них, их возникновение и стабильность Основные ядерные концепции РАННИЕ ОТКРЫТИЯ [см. Также Раздел
Катодные лучи Рисунок 1: Рисунок 2:
 Катодные лучи Первые идеи об электронах пришли из экспериментов с электронно-лучевыми трубками.Предшественник неоновых вывесок, флуоресцентных ламп и телевизионных кинескопов, типичная электронно-лучевая трубка частично
Катодные лучи Первые идеи об электронах пришли из экспериментов с электронно-лучевыми трубками.Предшественник неоновых вывесок, флуоресцентных ламп и телевизионных кинескопов, типичная электронно-лучевая трубка частично
Элементы, атомы и ионы
 Вводная химия: фундамент ЧЕТВЕРТОЕ ИЗДАНИЕ Стивена С. Зумдала Университет Иллинойса Элементы, атомы и ионы Глава 4 1 2 Элементы Цель: узнать об относительном содержании элементов,
Вводная химия: фундамент ЧЕТВЕРТОЕ ИЗДАНИЕ Стивена С. Зумдала Университет Иллинойса Элементы, атомы и ионы Глава 4 1 2 Элементы Цель: узнать об относительном содержании элементов,
Цели 404 ГЛАВА 9 ИЗЛУЧЕНИЕ
 Цели Объяснить разницу между изотопами одного и того же элемента.Опишите силу, которая удерживает нуклоны вместе. Объясните связь между массой и энергией в соответствии с теорией Эйнштейна
Цели Объяснить разницу между изотопами одного и того же элемента.Опишите силу, которая удерживает нуклоны вместе. Объясните связь между массой и энергией в соответствии с теорией Эйнштейна
Введение в ядерную физику
 Введение в ядерную физику 1. Структура атома и периодическая таблица Согласно модели атома Бора-Резерфорда, также называемой моделью солнечной системы, атом состоит из центрального ядра
Введение в ядерную физику 1. Структура атома и периодическая таблица Согласно модели атома Бора-Резерфорда, также называемой моделью солнечной системы, атом состоит из центрального ядра
Строение атома: Глава Проблемы
 Строение атома: глава «Задачи Бора».Опишите ядерную модель атома. 2. Объясните проблемы с ядерной моделью атома. 3. По словам Нильса Бора, что не стоит
Строение атома: глава «Задачи Бора».Опишите ядерную модель атома. 2. Объясните проблемы с ядерной моделью атома. 3. По словам Нильса Бора, что не стоит
Блок 1 Практический тест. согласование
 Блок 1 Практическое тестирование Соответствие каждого предмета с правильным утверждением ниже. а. протон д. электрон б. ядро е. нейтрон с. атом 1. самая маленькая частица элемента, который сохраняет свойства
Блок 1 Практическое тестирование Соответствие каждого предмета с правильным утверждением ниже. а. протон д. электрон б. ядро е. нейтрон с. атом 1. самая маленькая частица элемента, который сохраняет свойства
Радиоактивность и частицы
 Радиоактивность и введение частиц… 2 Атомная структура … 2 Как устроены эти частицы? … 2 Атомная запись … 4 Изотопы … 4 Что такое радиоактивность? … 5 Типы излучения: альфа, бета и
Радиоактивность и введение частиц… 2 Атомная структура … 2 Как устроены эти частицы? … 2 Атомная запись … 4 Изотопы … 4 Что такое радиоактивность? … 5 Типы излучения: альфа, бета и
Массы в атомных единицах
 Ядерный состав — силы, связывающие протоны и нейтроны в ядре, намного сильнее (энергия связи МэВ), чем силы, связывающие электроны с атомом (энергия связи ev) — составляющие
Ядерный состав — силы, связывающие протоны и нейтроны в ядре, намного сильнее (энергия связи МэВ), чем силы, связывающие электроны с атомом (энергия связи ev) — составляющие
Шкала достижений 3 уровня
 Модуль 1: Атомная шкала достижений 3-го уровня. Можно указать основные результаты экспериментов, связанных с Далтоном, Резерфордом, Томсоном, Чедвиком и Бором, и то, к чему это приведет каждый из них.Могу объяснить, что
Модуль 1: Атомная шкала достижений 3-го уровня. Можно указать основные результаты экспериментов, связанных с Далтоном, Резерфордом, Томсоном, Чедвиком и Бором, и то, к чему это приведет каждый из них.Могу объяснить, что
KE A = PE MAX 1 / 2M v 2 = k q1 q2 / R
 ГЛАВА 13 ЯДЕРНАЯ СТРУКТУРА ЯДЕРНАЯ СИЛА Ядро крепко помогает ядерная или сильная сила. Мы можем оценить ядерную силу, наблюдая, что протоны находятся на расстоянии около 1 фм = 10-15 м друг от друга
ГЛАВА 13 ЯДЕРНАЯ СТРУКТУРА ЯДЕРНАЯ СИЛА Ядро крепко помогает ядерная или сильная сила. Мы можем оценить ядерную силу, наблюдая, что протоны находятся на расстоянии около 1 фм = 10-15 м друг от друга
2 Структура атомов
 ГЛАВА 4 2 Структура атомов РАЗДЕЛ Атомы КЛЮЧЕВЫЕ ИДЕИ Когда вы читаете этот раздел, помните о следующих вопросах: что общего между атомами одного и того же элемента? Какие изотопы? Как выглядит элемент
ГЛАВА 4 2 Структура атомов РАЗДЕЛ Атомы КЛЮЧЕВЫЕ ИДЕИ Когда вы читаете этот раздел, помните о следующих вопросах: что общего между атомами одного и того же элемента? Какие изотопы? Как выглядит элемент
Атомная теория: история атома
 Атомная Теория: История Атома Атомная Теория: экспериментальные наблюдения, которые привели ученых к постулированию существования атома (мельчайший элемент).1. Закон сохранения массы — в течение
Атомная Теория: История Атома Атомная Теория: экспериментальные наблюдения, которые привели ученых к постулированию существования атома (мельчайший элемент).1. Закон сохранения массы — в течение
Строение атома Рон Робертсон
 Структура атома Рон Робертсон r2 n: \ files \ courses \ 1110-20 \ 2010 возможные слайды для web \ atomicstructuretrans.doc I. Что такое свет? Дискуссия в 1600-х годах: поскольку волны или частицы могут передавать энергию, то есть
Структура атома Рон Робертсон r2 n: \ files \ courses \ 1110-20 \ 2010 возможные слайды для web \ atomicstructuretrans.doc I. Что такое свет? Дискуссия в 1600-х годах: поскольку волны или частицы могут передавать энергию, то есть
Структура атома
 Структура атомного авторского права Glencoe / McGraw-Hill, подразделение McGraw-Hill Companies, Inc.Раздел 4. Ранние идеи о материалах страницы 02 05 Раздел 4. Оценка страницы 05. Сравните методы
Структура атомного авторского права Glencoe / McGraw-Hill, подразделение McGraw-Hill Companies, Inc.Раздел 4. Ранние идеи о материалах страницы 02 05 Раздел 4. Оценка страницы 05. Сравните методы
МАССОВАЯ ДЕФЕКТ И ОБЯЗАТЕЛЬНАЯ ЭНЕРГИЯ
 МАССОВАЯ ДЕФЕКТ И ВЯЗАННАЯ ЭНЕРГИЯ Отдельные законы сохранения массы и сохранения энергии не применяются строго на ядерном уровне. Можно конвертировать между массой и энергией. Вместо
МАССОВАЯ ДЕФЕКТ И ВЯЗАННАЯ ЭНЕРГИЯ Отдельные законы сохранения массы и сохранения энергии не применяются строго на ядерном уровне. Можно конвертировать между массой и энергией. Вместо
Вакуумное испарение
 Напыление при испарении в вакууме Используйте высокие температуры в высоком вакууме для испарения (выброса) атомов или молекул с поверхности материала.Используйте баллистический поток, чтобы транспортировать их к подложке и откладывать.
Напыление при испарении в вакууме Используйте высокие температуры в высоком вакууме для испарения (выброса) атомов или молекул с поверхности материала.Используйте баллистический поток, чтобы транспортировать их к подложке и откладывать.
Атомная Теория Часть 1
 Атомная теория Часть 1 Чтение: гл. 2 разделы 1 6, 8 Домашнее задание: Глава 2: 39, 47, 43, 49, 51 *, 53, 55, 57, 71, 73, 77, 99, 103 (необязательно) * = важно домашнее задание «Атомная теория» (Джон Далтон, 1803)
Атомная теория Часть 1 Чтение: гл. 2 разделы 1 6, 8 Домашнее задание: Глава 2: 39, 47, 43, 49, 51 *, 53, 55, 57, 71, 73, 77, 99, 103 (необязательно) * = важно домашнее задание «Атомная теория» (Джон Далтон, 1803)
Школы округа Сарасота
 ЕДИНИЦА 6 АТОМ: ЯДЕРНОЕ ВЗАИМОДЕЙСТВИЕ ЧТО ОТКРЫТИЕ привело к современному пониманию состава атомов? РАЗДЕЛ A Природа атомов (стр. 480) ПОЧЕМУ облучение человека некоторыми видами излучения
ЕДИНИЦА 6 АТОМ: ЯДЕРНОЕ ВЗАИМОДЕЙСТВИЕ ЧТО ОТКРЫТИЕ привело к современному пониманию состава атомов? РАЗДЕЛ A Природа атомов (стр. 480) ПОЧЕМУ облучение человека некоторыми видами излучения
Ядерная физика и радиоактивность
 Ядерная физика и радиоактивность 1.Число электронов в атоме с атомным номером Z и массовым числом A равно 1) A 2) Z 3) A + Z 4) A-Z 2. Сила отталкивания между положительно заряженными протонами составляет
Ядерная физика и радиоактивность 1.Число электронов в атоме с атомным номером Z и массовым числом A равно 1) A 2) Z 3) A + Z 4) A-Z 2. Сила отталкивания между положительно заряженными протонами составляет
Обзор для Атомной Теории Викторина # 1
 Обзор для викторины № 1 по атомной теории. Практикуйте вопросы с множественным выбором: 1. Что из следующего является количественным физическим свойством (ями) материи? а) масса в) плотность б) объем г) все вышеперечисленное 2.Который
Обзор для викторины № 1 по атомной теории. Практикуйте вопросы с множественным выбором: 1. Что из следующего является количественным физическим свойством (ями) материи? а) масса в) плотность б) объем г) все вышеперечисленное 2.Который
22.1 Ядерные реакции
 В средние века люди, которых называли алхимиками, проводили много времени, пытаясь сделать золото. Часто они обманывали людей, полагая, что они сделали золото. Хотя алхимикам никогда не удавалось сделать
В средние века люди, которых называли алхимиками, проводили много времени, пытаясь сделать золото. Часто они обманывали людей, полагая, что они сделали золото. Хотя алхимикам никогда не удавалось сделать
Структура и свойства атомов
 PS-2.1 Сравните субатомные частицы (протоны, нейтроны, электроны) атома с точки зрения массы, местоположения и заряда и объясните, как эти частицы влияют на свойства атома (включая идентичность,
PS-2.1 Сравните субатомные частицы (протоны, нейтроны, электроны) атома с точки зрения массы, местоположения и заряда и объясните, как эти частицы влияют на свойства атома (включая идентичность,
Введение в счетчики Гейгера
 Введение в счетчики Гейгера Счетчик Гейгера (трубка Гейгера-Мюллера) представляет собой устройство, используемое для обнаружения и измерения всех типов излучения: альфа, бета и гамма-излучения.В основном это
Введение в счетчики Гейгера Счетчик Гейгера (трубка Гейгера-Мюллера) представляет собой устройство, используемое для обнаружения и измерения всех типов излучения: альфа, бета и гамма-излучения.В основном это
Существование нейтрона
 J. Chadwick, PRSL, A136, 692 1932 г. Существование нейтрона J. Chadwick (Поступило в 1932 г.) Боте и Беккеру было показано, что некоторые легкие элементы при бомбардировке α-частицами полония испускают излучения
J. Chadwick, PRSL, A136, 692 1932 г. Существование нейтрона J. Chadwick (Поступило в 1932 г.) Боте и Беккеру было показано, что некоторые легкие элементы при бомбардировке α-частицами полония испускают излучения
ГЛАВА 4: АТОМЫ И ЭЛЕМЕНТЫ
 ГЛАВА 4: АТОМЫ И ЭЛЕМЕНТЫ Проблемы: 1-70, затем после Главы 9, завершите 71-94, 103-104, 107-108, 113-114 4.1 Опытные атомы на атоме тибурона: наименьшая идентифицируемая единица элемента Все вещество
ГЛАВА 4: АТОМЫ И ЭЛЕМЕНТЫ Проблемы: 1-70, затем после Главы 9, завершите 71-94, 103-104, 107-108, 113-114 4.1 Опытные атомы на атоме тибурона: наименьшая идентифицируемая единица элемента Все вещество
ПРАКТИКА ЭКЗАМЕН IV IV Р202 ВЕСНА 2004
 Практический экзамен IV P202 SPRING 2004 1. В двух отдельных экспериментах с двумя щелями наблюдается интерференционная картина на экране. В первом эксперименте используется фиолетовый свет (λ = 754 нм) и второго порядка
Практический экзамен IV P202 SPRING 2004 1. В двух отдельных экспериментах с двумя щелями наблюдается интерференционная картина на экране. В первом эксперименте используется фиолетовый свет (λ = 754 нм) и второго порядка
Понедельник 11 июня 2012 г.
 Понедельник, 11 июня 2012 г., полдень A2 GCE PHYSICS B (РАСШИРЕННАЯ ФИЗИКА) G495 Изображения поля и частиц * G412090612 * Ответ кандидатов на вопросный лист.OCR предоставил материалы: данные, формулы и взаимосвязи
Понедельник, 11 июня 2012 г., полдень A2 GCE PHYSICS B (РАСШИРЕННАЯ ФИЗИКА) G495 Изображения поля и частиц * G412090612 * Ответ кандидатов на вопросный лист.OCR предоставил материалы: данные, формулы и взаимосвязи