Презентация к уроку по химии (9 класс): Амфотерные оксиды и гидроксиды.
Слайд 1
Амфотерные оксиды и гидроксидыСлайд 2
Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ Цели урока:
Слайд 3
Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды План урока
Слайд 4
Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
Слайд 5
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2 Si O 2 Cl 2 O 7 C O 2 H 2 O Fe O оксиды
Слайд 6
Задание 1 Выберите из списка веществ оксиды: H 2 O , CO 2 , P 2 O 5 , WO 3 Fe 2 O 3 SO 3 , CaCl 2 , SCl 6 , CuO , H 2 SO 4 , NaOH ,
Слайд 8
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов ( ОН ) Основания — М(ОН) n __ где М – металл, n – число групп ОН и в то же время заряд иона металла NaOH Ca(OH) 2 Fe(OH) 3 + +2 +3 Называем: гидроксид металла
Слайд 9
Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид натрия (едкий натр) KOH – гидроксид калия (едкое кали) Ca(OH) 2 – гидроксид кальция (гашеная известь, известковое молоко, известковая вода) Ba(OH) 2 — гидроксид бария LiOH — гидроксид лития Основания Нерастворимые Растворимые (щелочи) NaOH , KOH , Ba(OH) 2 Fe(OH) 3 , Cu(OH) 2
Слайд 10
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты: Бескислородные Азотная кислота – H NO 3 Соляная кислота — H Cl Азотистая кислота – H NO 2 Сероводородная – H 2 S Серная кислота – H 2 SO 4 Бромоводородная — H Br Сернистая кислота – H 2 SO 3 Угольная кислота – H 2 CO 3 Фосфорная кислота – H 3 PO 4 Кислоты
Слайд 11
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков Соли KNO 3 NaCl CuSO 4 FeS CaCO 3 Ca 3 (PO 4 ) 2
Слайд 12
Распределите вещества по классам Оксиды Кислоты Основания Соли
Слайд 13
Задание 2 Распределите вещества по классам: H 2 S, SO 3 , CuSO 4 , FeCl 3 , KOH, Na 2 O, Al(OH) 3 , K 3 PO 4 , FeS, Al 2 (SO 4 ) 3 , Al 2 O 3 , H 2 CO 3 , Cl 2 O 7 , Ca(OH) 2 , H 3 PO 4 , Mg(NO 3 ) 2 , HCl, CaO, CuSO 4
Слайд 14
Проверьте себя: Оксиды Кислоты Основания Соли SO 3 Na 2 O Al 2 O 3 Cl 2 O 7 CaO H 2 S H 2 CO 3 H 3 PO 4 HCl KOH Al(OH) 3 Ca(OH) 2 CuSO 4 FeCl 3 K 3 PO 4 FeS Al 2 (SO 4 ) 3 Mg(NO 3 ) 2 CuSO 4
Слайд 15
М Основание нм Кислота (кислородосодержащая) Генетическая связь Основный оксид Кислотный оксид Соль
Слайд 16
CaO Ca(OH) 2 P 2 O 5 H 3 PO 4 P Ca Генетическая связь Ca 3 ( PO ) 4
Слайд 17
Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl 3 + 3NaOH Al(OH) 3 + 3NaCl Лабораторная работа
Слайд 18
Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи Лабораторная работа
Слайд 19
Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Слайд 20
Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO 3 H – O — N O H 2 SO 4 H – O O S H – O O NaOH Na – O — H = = — — = =
Слайд 21
Гидроксид алюминия можно записать как основание и как кислоту Al( OH ) 3 = H 3 AlO 3 Al O 3 H 3 = = Кислота Основание
Слайд 22
Al ( OH ) 3 + 3HCl = Al Cl 3 +3H 2 O H 3 AlO 3 + 3NaOH = Na 3 AlO 3 +3H 2 O Хлорид алюминия Алюминат натрия Запишите уравнения реакций:
Слайд 23
Al 2 O 3 + 6HCl = 2 Al Cl 3 + 3H 2 O Al 2 O 3 + 3NaOH = Na 3 AlO 3 + 3H 2 O Как основный Как кислотный Амфотерность оксида алюминия
Слайд 24
Амфотерные Оксиды металлов (с.о. +2,+3,+4)
Слайд 25
Амфотерные гидроксиды
Слайд 26
Какие из групп веществ проявляют амфотерные свойства? Ca (ОН) 2 , Cu (ОН) 2 , Na ОН, Fe ( O Н) 2 Fe 2 O 3 , Al 2 O 3 , Fe ( O Н) 3 , ZnO, Be ( O Н) 2 SO 3 , Cl 2 O 7 , WO 3 , Н 2 SO 4 , Н 2 CrO 4
Слайд 27
Допишите уравнение реакции: Zn(OH) 2 + 2NaOH в результате образуются Na 2 ZnO 2 + 2H 2 O Zn(OH) 2 + Na 2 O ZnSO 4 + 2 NaCl Реакция не идет
Слайд 28
Совершенно верно!!!
Слайд 29
Подумай ещё немного!
Слайд 30
Генетический ряд алюминия. Осуществите превращения: Na 3 AlO 3 Al Al 2 O 3 AlCl 3 Al(OH) 3 Al 2 (SO 4 ) 3
nsportal.ru
Разработка урока по химии в 9 классе на тему «Амфотерные оксиды и гидроксиды»
Открытый урок по химии для учащихся 9 класса:
« Амфотерные оксиды и гидроксиды»

Сведения об авторе:
Учитель химии
Лапина О.В.
Стаж работы 18 лет
с
Общеобразовательная цель:
формирование у учащихся представления о переходных элементах, амфотерных соединениях;
создание условий для выявления амфотерности соединений посредством решения экспериментальных задач;
отработка умений в написании уравнений реакций с участием амфотерных соединений.
Воспитательная цель: поддержание интереса к изучению темы через самостоятельную работу; воспитывать сотрудничество, способствовать развитию грамотной химической речи.
Развивающая цель: формирование исследовательских навыков учащихся при выполнении экспериментальной работы.
Тип урока: изучение нового материала
Методы обучения: частично-поисковый, исследовательский, репродуктивный.
Формы организации познавательной деятельности: групповая, общеклассная, индивидуальная
Оборудование: цинк Zn , хлорид цинка ZnCl2, гидроксид натрия NaOH, соляная кислота HCl, пробирки.
Структура урока:
Организационный этап.
Подготовительный этап (мотивация, актуализация знаний).
Основной этап (усвоение новых знаний и способов действий)
Закрепление и применение знаний.
Подведение итогов.
Домашнее задание.
1.Организационный этап.
Эпиграф « Ни одна наука не нуждается в эксперименте в такой степени, как химия.
А чтобы вы могли сравнить свои знания в начале и в конце урока, предлагаю определить свое место на «скале» (учитель раздает ученикам заранее приготовленные трафареты «скалы»).

2. Подготовительный этап (мотивация, актуализация знаний).
Вопросы для актуализации знаний:
1. Заполните кластер «Классификация веществ» (Приложение 1)
«Почему остались пустые фрагменты в кластере?»Заполните схемы «Генетические ряды металлов и неметаллов». Вспомните, какой характер имеют оксиды и гидроксиды типичных металлов и неметаллов? (Приложение 2)
Как опытным путем доказать, что выданный вам оксид или гидроксид является:
а) основным; б) кислотным.
1 вариант задание
Экспериментально докажите кислотный характер серной кислоты.
2 вариант задание Экспериментально докажите основный характер гидроксида натрия.
Но прежде чем приступать к работе следует вспомнить правила обращения с химическими реактивами. Как следует вести себя в кабинете химии.
Вывод: что кислотные оксиды и гидроксиды (кислоты) взаимодействуют с основаниями с образованием соли и воды, но кислотные оксиды и гидроксиды не взаимодействуют с кислотами. Основные оксиды и гидроксиды (основания) взаимодействуют с кислотами, но не взаимодействуют с основаниями.
3. Основной этап (усвоение новых знаний и способов действий)
Внимательно посмотрите на предложенные объекты: амфитеатр, амфора, амфибии, склянки с твердыми веществами Zn(OH)2 и ZnO. Что объединят все эти объекты, и какое отношение они имеют к предложенным веществам?

амфитеатр – места для зрителей, расположенные полукругом на склонах холмов с двух сторон от артистов

амфора – древний глиняный сосуд для жидких и сыпучих продуктов, c двумя вертикальными ручками и узким горлом

амфибии – по-русски земноводные, живущие двоякой жизнью: и на суше, и в воде, и как животные, и как рыбы.
— В чем их сходство?Можно выделить
греческую частицу «амфо» или «амфи» — (что означает: с двух сторон; и то, и другое), все они обладают двойственностью.
-Правильно, они все обладают двойственностью. В химии она называется амфотерностью.
Амфотерность — (от греч. amphoteros и тот и другой). Получается, в химии это понятие применяется к веществам.
— Каким свойством обладает оксид и гидроксид цинка?
Выход на тему урока «Амфотерность оксидов и гидроксидов»
Постановка цели и задач урока . Мотивация учебной деятельности учащихся
Постановка учащимися цели урока как собственной учебной задачи.
Учащиеся ставят следующие цели: проверить данное предположение о существовании таких веществ с двойственными свойствами на примере Zn(OH)2 . Обращаем внимание учащихся на эпиграф урока.
Предлагаю учащимся выполнить практическую работу. Цель работы: получить амфотерный гидроксид и изучить его свойства.
Учащимся раздаются технологические карты которые они заполняют по ходу работы. На экране слайд «Технологическая карта»
Слайд Слайд
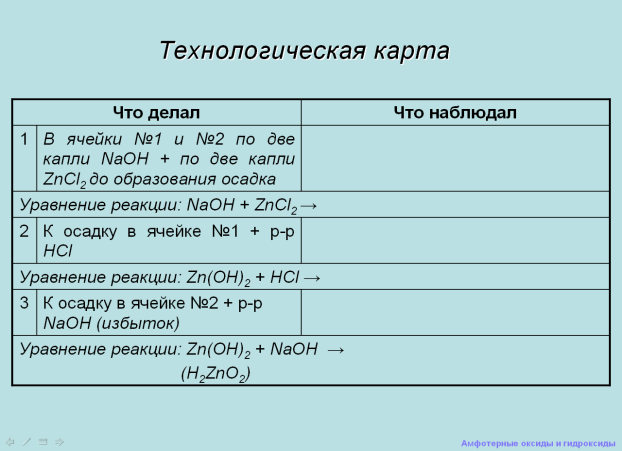

Учащиеся выполняют опыт «Получение гидроксида цинка».
Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.
Учитель: Как проверить основный характер гидроксида цинка?
Учащиеся проводят опыт «Взаимодействие гидроксида алюминия с кислотами».
Учащиеся сообщают о результатах исследования, самостоятельно делают вывод и записывают на доске уравнение реакции в молекулярной и ионной форме.
Учитель:Как проверить кислотные свойства гидроксида алюминия?
Учащиеся проводят опыт « Взаимодействие гидроксида алюминия с щелочами».
Учитель: Чтобы записать уравнение реакции гидроксида алюминия с щелочью, представим его в форме кислоты: Zn(OH)2 = H2AlO2. Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.
Подтверждение гипотезы:
Учитель: Будет цинк типичным металлом? (Ответы учащихся). Учитель. Предлагаю учащимся сформулировать определение амфотерных (оксидов) гидроксидов. Привести примеры.
ответы учащихся: амфотерные (оксиды) гидроксиды – вещества, которые в зависимости от условий проявляют кислотные или основные свойства.
амфотерные оксиды: Al2O3, ZnO, BeO
амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Be(OH)2,
Учащиеся записывают определения:
а) Амфотерные вещества, б) Переходные элементы.Учитель знакомит учащихся с другими переходными элементами, которые образуют амфотерные соединения.
Помимо цинка и алюминия амфотерные оксиды и гидроксиды имеют многие металлы побочных под-
групп, которые называются переходными.
В школьном мы курсе мы будем встречаться с
соединениями Be, Al, Zn, Cr+3.
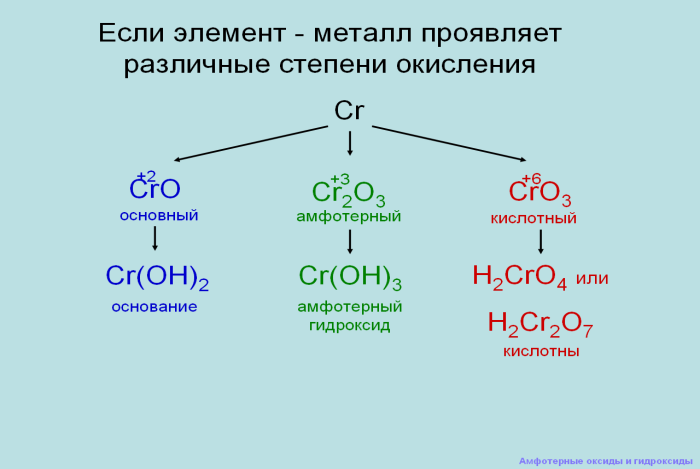
Почему хром, именно вс.о. +3 амфотерен?
Это вы поймете из схемы:
Дополнения учителя: если элемент металл проявляет различные степени окисления (демонстрация слайда)
Слайд
4. Закрепление новых знаний. Какие соединения называются амфотерными?
Какую степень окисления имеет металл в амфотерных соединениях?
Как опытным путем доказать амфотерный характер оксида и гидроксида?
5. Подведение итогов урока.
6. Домашнее задание. Параграф -2
Подсказка!
Кислоты, вещества, основные, металлы, сложные, основания, соли,
кислотные, щёлочи, неметаллы, бескислородные, нерастворимые,
кислородосодержащие, простые, оксиды.
Металлы | Неметаллы | Оксиды | Основания | Кислоты | Соли |
Кислотные
Щёлочи
Нераство-
римые
Кислородо-
содержащие
- Бескислород-
ные
Слайд № 3 « Генетические ряды металлов и неметаллов»
МЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ ______________
Na __________ ______________ ______________
НЕМЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ _______________
S __________ ______________ _____________
Что наблюдал | ||
1 | В 2 пробирки по две капли NaOH + по две капли ZnCl2 до образования осадка | |
Уравнение реаекции: NaOH + ZnCl2 = | ||
2 | К получившемуся осадку в 1 пробирке добавить раствор HCl | |
Уравнения реакции: Zn(OH)2 +HCl = | ||
3 | К получившемуся осадку во второй пробирке добавить избыток NaOH (в избытке) | |
Уравнение реакции: Zn(OH)2 + NaOH = (H2ZnO2) | ||
doc4web.ru
Самостоятельная работа по химии Амфотерные оксиды и гидроксиды 9 класс
Самостоятельная работа по химии Амфотерные оксиды и гидроксиды для учащихся 9 класса. Самостоятельная работа состоит из 3 вариантов в каждом по 2 задания и предназначена для проверки знаний по теме Общая характеристика химических элементов и реакций.
1 вариант
1. Напишите уравнения возможных реакций гидроксида цинка со следующими веществами:
КОН, Li2O, NaCl, HCl, К2SO4
2. Осуществите превращения:
Zn → ZnO → ZnSO4 → Zn(OH)2 → Na2ZnO2
Приведите уравнения реакций в молекулярном и ионном виде.
2 вариант
1. Напишите уравнения возможных реакций оксида цинка со следующими веществами:
NaOH, Н2O, Na2O, BaCl2 , Н2SO4
2. Осуществите превращения:
Al → А12O3 → AlCl3 → Al(OH)3 → NaAlO2
Приведите уравнения реакций в молекулярном и ионном виде.
3 вариант
1. Напишите уравнения возможных реакций гидроксида цинка со следующими веществами:
Ва(ОН)2, HNO3, Аl2O3, Р2O5, Rb2O, Na2CO3.
Укажите условия протекания реакций.
2. Осуществите превращения:
Zn → ZnC12 → Zn(OH)2 → ZnO → Na2ZnO2
Приведите уравнения реакций в молекулярном и ионном виде.
Ответы на самостоятельную работу по химии Амфотерные оксиды и гидроксиды
Вариант 1.
1.
Zn(OH)2 + 2КОН = K2ZnO2 + 2Н2О;
Zn(OH)2 + Li2O = Li2ZnO2 + Н2О;
Zn(OH)2 + 2НСl = ZnCl2 + 2Н2О.
2.
2Zn + O2 = 2ZnO;
H2SO4 + ZnO = ZnSO4 + Н2О;
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2;
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2Н2О.
Вариант 2.
1.
NaOH + ZnO = Na2ZnO2 + Н2O;
Na2O + ZnO = Na2ZnO2;
H2SO4 + ZnO = ZnSO4 + Н2О.
2.
4Al + 3O2 = 2Аl2O3;
Аl2O3 + 6НСl = 2АlСl3 + 3Н2О;
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl;
Al(OH)3 + NaOH = NaAlO2 + 2Н2O.
Вариант 3.
1.
При сплавлении: Zn(OH)2 + Ва(ОН)2 = ВaZnO2 + Н2O, в растворе: Zn(OH)2 + Ва(ОН)2 = Ba[Zn(OH)4];
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2Н2О,
при сплавлении: 3Zn(OH)2 + Р2O5 = Zn3(PO4)2 + 3Н2О;
при сплавлении: Zn(OH)2 + Rb2O = Rb2ZnO2 + Н2О,
при сплавлении: Zn(OH)2 + Na2CO3 = Na2ZnO2 + СО2 + Н2О.
2.
Zn + 2НСl = ZnCl2 + Н2;
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl;
Zn(OH)2 = ZnO + Н2O;
ZnO + 2NaOH = Na2ZnO2 + Н2О.
testschool.ru
Характеристика ХЭ по кислотно-основным свойствам. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Как же определить: кислотными или основными свойствами будет обладать то или иное соединение? Это совсем несложно, достаточно просто посмотреть Периодическую систему химических элементов Д.И. Менделеева.
Большинство химических элементов в таблице являются металлами, именно они и образуют основные оксиды, которым соответствуют основания. Однако, нужно знать, что если у металла степень окисления от +1 до +3, то оксид в таком случае будет основным, ему будет соответствовать основание, но если у металла будет высокая степень окисления, такая как +6, +7, то тогда его оксид будет проявлять кислотные свойства и соответствовать ему будет не основание, а кислота.


Например, у марганца (Mn) возможны степени окисления: +2, +4, +6, +7. Если в оксиде у марганца степень окисления +2, то такой оксид будет основным, если +4, то амфотерным, если +6 или +7, то такие оксиды будут кислотным. Поэтому, чем выше степень окисления элемента, тем ярче выражены кислотные свойства.

А что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка (Zn(OH)2) и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида цинка (ZnCl2) и добавим в каждую несколько капель раствора гидроксида натрия (NaOH). При этом можно наблюдать выпадение осадка белого цвета. Таким образом, мы получили гидроксид цинка реакцией обмена между хлоридом цинка и гидроксидом натрия.

Исследуем свойства гидроксида цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl), и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем раствора гидроксида натрия (NaOH), и в этом случае осадок тоже растворяется.
Какой же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и с основаниями, и с кислотами называются амфотерными. Они могут вести себя как кислоты в реакциях со щелочами и как основания в реакциях с кислотами. Т.е. в зависимости от условий они могут проявлять как кислотные свойства, так и основные. Значит, и записать химическую формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2 и в виде основания Zn(OH)2.
Давайте запишем уравнения этих реакций:

В первой реакции образуется соль хлорид цинка (ZnCl2), а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И цинк, и его оксид будут тоже амфотерными соединениями.
Например, цинк реагирует с кислотами: если в пробирку с цинком прилить серной кислоты (H2SO4), то будет выделяться газ. В результате этой реакции образуется соль – сульфат цинка (ZnSO4) и выделяется газ – водород (H2).

Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H2↑
Цинк будет реагировать и со щелочами. Запомните, если реакция протекает в растворе, то образуется комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), при сплавлении образуется соль – цинкат натрия (Na2ZnO2), но водород выделяется в обоих случаях.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2NaOH = Na2ZnO2 + H2↑
Аналогично ведет себя и оксид цинка, т.е. он реагирует с кислотами и с основаниями.
Например, в реакции оксида цинка (ZnO) с соляной кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия, а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H+ = Zn2+ + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
А сейчас послушайте историю про двуличного Алюминия.
Жил да был на свете хитрец-наглец по имени Алюминий. Его владения находились между двумя могущественными королевствами. Одним королевством правил молодой жизнерадостный король Натрий. Все в его королевстве было голубым: чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые люди. Работалось и жилось в королевстве легко, свободно, радостно. А это вызывало сильную зависть у правительницы другого королевства – Серы. Она вся пожелтела от зависти и злобы, порой даже начинала плавиться от внутреннего жара или гореть лиловым пламенем. Наконец ее терпение лопнуло после одного пышного празднества, устроенного Натрием в честь рождения сына, и Сера объявила войну Натрию.
Натрий, никогда и никому не желавший зла, по характеру мягкий, как воск, хоть ножом его режь, не был готов к войне. Он обратился к Алюминию: «Помоги, ведь мы с тобой из одного семейства – металлов». Алюминий согласился, но решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и тем, и другим королевством.
Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Как видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным, значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий, как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой (H2SO4) он также образует соль – сульфат алюминия (Al2(SO4)3) и при этом выделяется газ – водород (H2).
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Алюминий реагирует и со щелочами: если реакция алюминия с гидроксидом натрия (NaOH) протекает в растворе, то в этом случае, как и в случае с цинком, образуется комплексная соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑

Оксид алюминия и его гидроксид ведет себя тоже двойственно. При реакции оксида алюминия (Al2O3) с соляной кислотой (HCl), он ведет себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3). А при взаимодействии с раствором щелочи, этот же оксид ведет себя как кислота, при этом образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), что будет верно в любом случае. А вот при сплавлении со щелочью, образуется соль – метаалюминат натрия (NaAlO2).

Гидроксид алюминия (Al(OH)3)тоже является амфотерным, поэтому он реагирует с кислотами и с основаниями.
Например, в реакции соляной кислотой (HCl), он себя ведет, как основание, при этом образуется соль – хлорид алюминия (AlCl3) и вода (H2O) , а вот в реакции с гидроксидом натрия (NaOH), он ведет себя, как кислота. Если реакция протекает в растворе, то образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), а при сплавлении другая соль – метаалюминат натрия (NaAlO2).

Будьте внимательны, посмотрите амфотерные элементы в периодической таблице. Интересно, что элементы побочных подгрупп, в промежуточной степени окисления также могут проявлять амфотерные свойства, эти элементы еще называют переходными элементами или переходными металлами.

К амфотерным элементам относятся: Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, Cr, Mn, Fe, Zn, Cd, Au и др.
videouroki.net
| 1. |
Формулы амфотерных гидроксидов
Сложность: лёгкое |
1 |
| 2. |
Амфотерные гидроксиды
Сложность: лёгкое |
1 |
| 3. |
Уравнения реакций взаимодействия амфотерных гидроксидов с кислотами
Сложность: среднее |
2 |
| 4. |
Уравнения реакций взаимодействия амфотерных гидроксидов со щелочами
Сложность: среднее |
2 |
| 5. |
Взаимодействие амфотерных гидроксидов с кислотами
Сложность: сложное |
4 |
| 6. |
Взаимодействие амфотерных гидроксидов со щелочами
Сложность: сложное |
3 |
| 7. |
Расчёт по уравнению химической реакции взаимодействия амфотерного гидроксида с кислотой
Сложность: сложное |
3 |
| 8. |
Расчёт по уравнению химической реакции взаимодействия амфотерного гидроксида со щёлочью
Сложность: сложное |
3 |
| 9. |
Выбор способа получения амфотерного гидроксида
Сложность: среднее |
4 |
www.yaklass.ru
«Амфотерные оксиды и гидроксиды».
Тема. Амфотерные оксиды и гидроксиды.
Цель урока. Систематизировать знания учащихся о гидроксидах металлов. Начать формировать понятие «амфотерность». Научить доказывать амфотерный характер оксидов и гидроксидов.
Задачи:
Образовательные: углубить и повторить знания об оксидах, характерные свойства оснований; сформировать умения составлять уравнения химических реакций с участием амфотерных соединений.
Развивающие: развивать умения логически мыслить, высказывать гипотезы, наблюдать и делать выводы.
Воспитательные: формирование познавательного интереса к предмету.
Планируемые результаты обучения
Предметные. Уметь экспериментально доказывать амфотерный характер оксидов и гидроксидов. Метапредметные. Развивать умения соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, формулировать выводы.
Личностные. Формировать ответственное отношение к учению, коммуникативную компетентность в общении со сверстниками и учителем.
Основные понятия. Амфотерные оксиды. Амфотерные гидроксиды.
Оборудование и материалы: NaOH, ZnSO4, HCl, периодическая система химических элементов.
Тип урока: изучение нового материала.
Просмотр содержимого документа
«»Амфотерные оксиды и гидроксиды».»

Мыслящий ум не чувствует себя счастливым, пока не удается связать воедино, разрозненные факты, им наблюдаемые
Al 2 O 3
Д Хевеши.
Al ( OH) 3
Zn(OH) 2
Девиз нашего урока:
Fe 2 O 3
Cr 2 O 3

Что общего?
- АМФОРА
- АМФИБИИ
Что же обозначает приставка ?…..
- Греч. « амфо » — двоякий, двойной
- Амфора – древнегреческий сосуд с двумя ручками
- Амфибии – земноводные животные
- Возникает вопрос, а при чем здесь химия? Может уже кто-то догадался?

Al 2 O 3
Тема урока . «Амфотерные оксиды и гидроксиды»
ZnO
Al ( OH) 3
Zn(OH) 2
PbO 2
Оксид мышьяка (III)
As 2 O 3
Fe 2 O 3
Cr 2 O 3

Что такое амфотерность?
BeO
Это способность химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции.
Al(OH) 3
Вещества, проявляющие амфотерные свойства

Амфотерные оксиды и гидроксиды
- Fe2O3 — твердое вещество, имеющее красно-коричневый цвет. В природе встречается в виде минерала гематита.
- Fe2O3 — твердое вещество черного цвета.
- Al2O3 — твердое вещество белого цвета. В природе его часть можно встретить в виде глинозема, а также сапфира и рубина.
- ZnO — твердое вещество, не имеющее цвета, в воде не растворяется.
Использование:
- Fe(OН)2 — гидроксид железа (бесцветное твердое вещество) в изготовлении аккумуляторов;
- Al ( O Н) 3 — гидроксид алюминия — для очистки воды;
- Ве(ОН)2 -гидроксид бериллия — для получения оксида.

Используя прием «Один ум – хорошо, а два – лучше» будем работать в паре. Перед вами карточка- таблица с заданиями. Вам необходимо проставить знак + где происходит реакция
Откройте учебник §43 ст. 146 и продолжайте заполнять таблицу для амфотерных оксидов

СВЕРИМ ОТВЕТЫ о химических свойствах оксидов

ЗАПИШЕМ УРАВНЕНИЯ

Какие они, Гидроксиды?

Химические свойства гидроксидов

Лабораторный опыт №4 Взаимодействие гидроксида цинка с растворами кислот и щелочей

Что же мы узнали?
Амфотерность – способность элементов и веществ проявлять двойственные свойства.
Be Al Fe Zn
Al 2 O 3 Fe 2 O 3
ZnO



multiurok.ru