Агрегатное состояние вещества Википедия
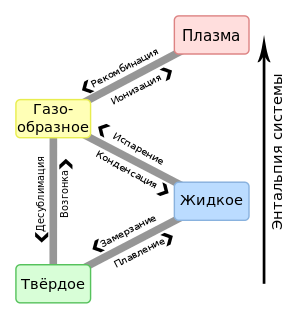
Агрега́тное состоя́ние вещества (от лат. aggrego «присоединяю») — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин.[1]
Традиционно выделяют три агрегатных состояния: твёрдое, жидкое и газообразное. К агрегатным состояниям принято причислять также плазму[2], в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Существуют и другие агрегатные состояния.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью[3].
Физические свойства веществ. Агрегатное состояние — урок. Химия, 8–9 класс.
Сходство и отличие различных веществ можно установить по отдельным признакам.
Признаки, по которым вещества схожи, или же по которым можно отличить одно вещество от другого, называют свойствами.
Первое (и важнейшее) свойство любого вещества — это его агрегатное состояние при так называемых нормальных условиях (н. у.).
Обрати внимание!
В науке нормальными условиями (н. у.) принято считать такие условия, когда температура составляет \(0°\)С, а давление равно \(101,3\) кПа (килопаскалям).
Агрегатное состояние может быть твёрдым, жидким или газообразным (в звёздах вещество существует ещё в одном — плазменном — состоянии).
В твёрдом агрегатном состоянии частички, из которых состоит вещество (атомы, молекулы или ионы), обладают наименьшим запасом энергии, расстояние между частичками наименьшее, а сами частички совершают колебательные движения.
Например, при нормальных условиях в твёрдом агрегатном состоянии находятся металлы (кроме ртути), алмаз, графит, поваренная соль, пищевая сода, сахар (сахароза).
В жидком агрегатном состоянии частички, из которых состоит вещество, обладают большим запасом энергии, расстояния между ними больше, и движутся они поступательно и хаотично (неупорядоченно).
Например, при нормальных условиях жидкостью является вода, глицерин, винный спирт, ацетон, а также ртуть.
Если вещество находится в газообразном агрегатном состоянии, частички, из которых состоит вещество, имеют наибольший запас энергии, расстояние между ними наибольшее, и движутся они хаотично с большой скоростью.
Например, при нормальных условиях в газообразном агрегатном состоянии находятся азот, кислород, озон, углекислый газ, аргон и гелий.
Обрати внимание!
При изменении условий агрегатное состояние может измениться.
Так, если температура опускается ниже \(0\) °С, вода переходит из жидкого в твёрдое агрегатное состояние, то есть превращается в лёд. Если же температура повышается до \(100\) °С, вода переходит из жидкого в газообразное агрегатное состояние, то есть превращается в водяной пар.
Обрати внимание!
Большинство веществ, в зависимости от условий, может существовать как в твёрдом, так в жидком или газообразном состояниях.
Однако некоторые вещества, такие как целлюлоза, из которой изготавливают бумагу, бывают только твёрдыми. Сахар можно расплавить, но перевести его в газообразное агрегатное состояние не получится. Дело в том, что такие вещества при нагревании начинают разлагаться, то есть превращаются в другие вещества, обладающие другими свойствами.
 |  |  |
| Хлор — газ жёлто-зелёного цвета, переходит в жидкое агрегатное состояние при температуре \(–34,04\) °С | Жидкая ртуть становится твёрдой при температуре \(–38,83\) °С и переходит в газообразное состояние при температуре \(+356,7\) °С | Лимонно-жёлтая сера переходит в жидкое агрегатное состоянии при нагревании до температуры \(+115,2\) °С |
Что такое агрегатное состояние? Агрегатное состояние вещества
Вопросы о том, что такое агрегатное состояние, какими особенностями и свойствами обладают твердые вещества, жидкости и газы, рассматриваются в нескольких учебных курсах. Существует три классических состояния материи, со своими характерными чертами строения. Их понимание является важным моментом в постижении наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучают физика, химия, география, геология, физическая химия и другие научные дисциплины. Вещества, находящиеся при определенных условиях в одном из трех базовых типов состояния, могут изменяться при повышении или понижении температуры, давления. Рассмотрим возможные переходы из одних агрегатных состояний в другие, как они осуществляются в природе, технике и повседневной жизни.
Что такое агрегатное состояние?
Слово латинского происхождения «aggrego» в переводе на русский язык означает «присоединять». Научный термин относится к состоянию одного и того же тела, вещества. Существование при определенных температурных значениях и разном давлении твердых тел, газов и жидкостей характерно для всех оболочек Земли. Помимо трех базовых агрегатных состояний, существует еще и четвертое. При повышенной температуре и неизменном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, необходимо вспомнить о мельчайших частицах, из которых состоят вещества и тела.

На схеме вверху показаны: а — газ; b — жидкость; с — твердое тело. На подобных рисунках кружочками обозначаются структурные элементы веществ. Это условное обозначение, на самом деле атомы, молекулы, ионы не являются сплошными шариками. Атомы состоят из положительно заряженного ядра, вокруг которого на большой скорости движутся отрицательно заряженные электроны. Знания о микроскопическом строении вещества помогают лучше понять различия, существующие между разными агрегатными формами.
Представления о микромире: от Древней Греции до XVII века
Первые сведения о частицах, из которых сложены физические тела, появились в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом. Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны к движению и взаимодействию друг с другом. Атомистика стала наиболее передовым для своего времени учением Древней Греции. Но ее развитие затормозилось в средние века. Так как тогда ученых преследовала инквизиция римской католической церкви. Поэтому вплоть до нового времени не было внятной концепции, что такое агрегатное состояние вещества. Только после XVII века ученые Р. Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Атомы, молекулы, ионы — микроскопические частицы строения материи
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных учеными ранее, удалось сложить стройную картину микромира. Теории, описывающие состояние и поведение мельчайших частиц вещества, довольно сложные, они относятся к области квантовой физики. Для понимания особенностей разных агрегатных состояний материи достаточно знать названия и особенности основных структурных частиц, которые образуют разные вещества.
- Атомы — химически неделимые частицы. Сохраняются в химических реакциях, но разрушаются в ядерных. Металлы и многие другие вещества атомарного строения имеют твердое агрегатное состояние при обычных условиях.
- Молекулы — частицы, которые разрушаются и образуются в химических реакциях. Молекулярное строение имеют кислород, вода, углекислый газ, сера. Агрегатное состояние кислорода, азота, диоксидов серы, углерода, кислорода при обычных условиях — газообразное.
- Ионы — заряженные частицы, в которые превращаются атомы и молекулы, когда присоединяют или теряют электроны — микроскопические отрицательно заряженные частички. Ионное строение имеют многие соли, например поваренная, железный и медный купорос.
Есть вещества, частицы которых определенным образом расположены в пространстве. Упорядоченное взаимное положение атомов, ионов, молекул называют кристаллической решеткой. Обычно ионные и атомарные кристаллические решетки характерны для твердых веществ, молекулярные — для жидкостей и газов. Высокой твердостью отличается алмаз. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит тоже состоит из атомов этого химического элемента. Только они по-другому расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество превращается в жидкость и аморфную массу.
Вещества в твердом агрегатном состоянии
Твердые тела при обычных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок горной породы или металла. Если нагревать сахар, то вещество начинает плавиться, превращаясь в вязкую коричневую жидкость. Прекратим нагревание — снова получим твердое вещество. Значит, одно из главных условий перехода твердого тела в жидкость — его нагревание или повышение внутренней энергии частиц вещества. Твердое агрегатное состояние соли, которую используют в пищу, тоже можно изменить. Но чтобы расплавить поваренную соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль — из заряженных ионов, которые сильнее притягиваются друг к другу. Твердые вещества в жидком виде не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при расплавлении объясняется разрывом связи между ионами в кристаллах. Освобождаются заряженные частички, которые могут переносить электрические заряды. Расплавы солей проводят электричество, являются проводниками. В химической, металлургической и машиностроительной промышленности твердые вещества превращают в жидкие для получения из них новых соединений или придания им разной формы. Большое распространение получили сплавы металлов. Есть несколько способов их получения, связанных с изменениями агрегатного состояния твердого сырья.

Жидкость — одно из базовых агрегатных состояний
Если налить в круглодонную колбу 50 мл воды, то можно заметить, что вещество сразу же примет форму химического сосуда. Но как только мы выльем воду из колбы, то жидкость сразу же растечется по поверхности стола. Объем воды останется тот же — 50 мл, а ее форма изменится. Перечисленные особенности характерны для жидкой формы существования материи. Жидкостями являются многие органические вещества: спирты, растительные масла, кислоты.
Молоко — эмульсия, т. е. жидкость, в которой находятся капельки жира. Полезное жидкое ископаемое — нефть. Добывают ее из скважин с помощью буровых вышек на суше и в океане. Морская вода тоже является сырьем для промышленности. Ее отличие от пресной воды рек и озер заключается в содержании растворенных веществ, в основном солей. При испарении с поверхности водоемов в парообразное состояние переходят только молекулы Н2О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
При полном удалении солей получают дистиллированную воду. Она кипит при 100 °С, замерзает при 0 °С. Рассолы кипят и превращаются в лед при других температурных показателях. Например, вода в Северном Ледовитом океане замерзает при температуре на поверхности 2 °С.
Агрегатное состояние ртути при обычных условиях — жидкость. Этим серебристо-серым металлом обычно заполняют медицинские термометры. При нагревании столбик ртути поднимается по шкале, происходит расширение вещества. Почему же в уличных термометрах используется подкрашенный красной краской спирт, а не ртуть? Объясняется это свойствами жидкого металла. При 30-градусных морозах агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, а ртуть вылилась, то собирать руками серебристые шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсичное. Детям в таких случаях надо обратиться за помощью к родителям, взрослым.

Газообразное состояние
Газы не способны сохранять ни свой объем, ни форму. Заполним колбу доверху кислородом (его химическая формула О2). Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в помещении. Это происходит благодаря броуновскому движению. Еще древнегреческий ученый Демокрит считал, что частички вещества находятся в постоянном движении. В твердых телах при обычных условиях у атомов, молекул, ионов нет возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Такое возможно только при поступлении большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей. К примеру, жидкое агрегатное состояние кислорода наблюдается только при снижении температуры газа до −183 °C. При −223 °C молекулы О2 образуют твердое вещество. При повышении температуры сверх приведенных значений кислород превращается в газ. Именно в таком виде он находится при обычных условиях. На промышленных предприятиях действуют специальные установки для разделения воздуха атмосферы и получения из него азота и кислорода. Сначала воздух охлаждают и сжижают, а затем постепенно повышают температуру. Азот и кислород превращаются в газы при разных условиях.
Атмосфера Земли содержит 21 % по объему кислорода и 78 % азота. В жидком виде эти вещества в газовой оболочке планеты не встречаются. Жидкий кислород имеет светло-синий цвет, им при высоком давлении заполняют баллоны для использования в медицинских учреждениях. В промышленности и строительстве сжиженные газы необходимы для проведения очень многих процессов. Кислород нужен для газовой сварки и резки металлов, в химии — для реакций окисления неорганических и органических веществ. Если открыть вентиль кислородного баллона, давление уменьшается, жидкость превращается в газ.
Сжиженные пропан, метан и бутан находят широкое применение в энергетике, на транспорте, в промышленности и хозяйственно-бытовой деятельности населения. Получают эти вещества из природного газа или при крекинге (расщеплении) нефтяного сырья. Углеродные жидкие и газообразные смеси играют важную роль в экономике многих стран. Но запасы нефти и природного газа сильно истощены. По оценкам ученых, этого сырья хватит на 100–120 лет. Альтернативный источник энергии — воздушный поток (ветер). Используются для работы электростанций быстротекущие реки, приливы на берегах морей и океанов.

Кислород, как и другие газы, может находиться в четвертом агрегатном состоянии, представляя собой плазму. Необычный переход из твердого состояния в газообразное — характерная черта кристаллического йода. Вещество темно-фиолетового цвета подвергается сублимации — превращается в газ, минуя жидкое состояние.
Как осуществляются переходы из одной агрегатной формы материи в другую?
Изменения агрегатного состояния веществ не связаны с химическими превращениями, это физические явления. При повышении температуры многие твердые тела плавятся, превращаются в жидкости. Дальнейшее повышение температуры может привести к испарению, то есть к газообразному состоянию вещества. В природе и хозяйстве такие переходы характерны для одного из главных веществ на Земле. Лед, жидкость, пар — это состояния воды при разных внешних условиях. Соединение одно и то же, его формула — Н2О. При температуре 0 °С и ниже этого значения вода кристаллизуется, то есть превращается в лед. При повышении температуры возникшие кристаллики разрушаются — лед тает, вновь получается жидкая вода. При ее нагревании образуется водяной пар. Испарение — превращение воды в газ — идет даже при низких температурах. Например, замерзшие лужи постепенно исчезают, потому что вода испаряется. Даже в морозную погоду мокрое белье высыхает, но только процесс этот более длительный, чем в жаркий день.
Все перечисленные переходы воды из одного состояния в другое имеют огромное значение для природы Земли. Атмосферные явления, климат и погода связаны с испарением воды с поверхности Мирового океана, переносом влаги в виде облаков и тумана на сушу, выпадением осадков (дождя, снега, града). Эти явления составляют основу Мирового круговорота воды в природе.

Как меняются агрегатные состояния серы?
При обычных условиях сера — это яркие блестящие кристаллы или светло-желтый порошок, т. е. это твердое вещество. Агрегатное состояние серы меняется при нагревании. Сначала при повышении температуры до 190 °C желтое вещество плавится, превращаясь в подвижную жидкость.
Если быстро вылить жидкую серу в холодную воду, то получается коричневая аморфная масса. При дальнейшем нагревании расплава серы он становится все более вязким, темнеет. При температуре свыше 300 °C агрегатное состояние серы снова изменяется, вещество приобретает свойства жидкости, становится подвижным. Эти переходы возникают благодаря способности атомов элемента образовывать цепочки разной длины.
Почему вещества могут находиться в разных физических состояниях?
Агрегатное состояние серы — простого вещества — твердое при обычных условиях. Диоксид серы — газ, серная кислота — маслянистая жидкость тяжелее воды. В отличие от соляной и азотной кислот она не летучая, с ее поверхности не испаряются молекулы. Какое агрегатное состояние имеет пластическая сера, которую получают при нагревании кристаллов?
В аморфном виде вещество имеет структуру жидкости, обладая незначительной текучестью. Но пластическая сера одновременно сохраняет форму (как твердое вещество). Существуют жидкие кристаллы, обладающие рядом характерных свойств твердых веществ. Таким образом, состояние вещества при разных условиях зависит от его природы, температуры, давления и других внешних условий.
Какие существуют особенности в строении твердых тел?
Имеющиеся различия между основными агрегатными состояниями материи объясняются взаимодействием между атомами, ионами и молекулами. Например, почему твердое агрегатное состояние вещества приводит к способности тел сохранять объем и форму? В кристаллической решетке металла или соли структурные частицы притягиваются другу к другу. В металлах положительно заряженные ионы взаимодействуют с так называемым «электронным газом» — скоплением свободных электронов в куске металла. Кристаллы солей возникают благодаря притяжению разноименно заряженных частиц — ионов. Расстояние между вышеперечисленными структурными единицами твердых тел намного меньше, чем размеры самих частиц. В этом случае действует электростатическое притяжение, оно придает прочность, а отталкивание недостаточно сильное.
Чтобы разрушить твердое агрегатное состояние вещества, надо приложить усилия. Металлы, соли, атомные кристаллы плавятся при очень высоких температурах. К примеру, железо становится жидким при температуре выше 1538 °С. Тугоплавким является вольфрам, из него изготавливают нити накаливания для электрических лампочек. Есть сплавы, которые становятся жидкими при температурах свыше 3000 °С. Многие горные породы и минералы на Земле находятся в твердом состоянии. Добывают это сырье с помощью техники в шахтах и карьерах.

Для отрыва даже одного иона от кристалла необходимо затратить большое количество энергии. Но ведь достаточно растворить соль в воде, чтобы кристаллическая решетка распалась! Это явление объясняется удивительными свойствами воды как полярного растворителя. Молекулы Н2О взаимодействуют с ионами соли, разрушая химическую связь между ними. Таким образом, растворение — это не простое перемешивание разных веществ, а физико-химическое взаимодействие между ними.
Как взаимодействуют молекулы жидкостей?
Вода может быть жидкостью, твердым веществом и газом (паром). Это ее основные агрегатные состояния при обычных условиях. Молекулы воды состоят из одного атома кислорода, с которым связаны два атома водорода. Возникает поляризация химической связи в молекуле, на атомах кислорода появляется частичный отрицательный заряд. Водород становится положительным полюсом в молекуле, притягивается атомом кислорода другой молекулы. Это слабое взаимодействие получило название «водородная связь».
Жидкое агрегатное состояние характеризуют расстояния между структурными частицами, сравнимые с их размерами. Притяжение существует, но оно слабое, поэтому вода не сохраняет форму. Парообразование происходит из-за разрушения связей, которое идет на поверхности жидкости даже при комнатной температуре.

Существуют ли межмолекулярные взаимодействия в газах?
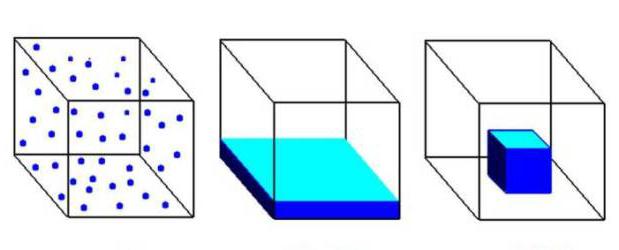
Газообразное состояние вещества по ряду параметров отличается от жидкого и твердого. Между структурными частицами газов существуют большие промежутки, намного превышающие размеры молекул. При этом силы притяжения совсем не действуют. Газообразное агрегатное состояние характерно для веществ, присутствующих в составе воздуха: азота, кислорода, диоксида углерода. На рисунке ниже первый куб заполнен газом, второй жидкостью, а третий — твердым вещество.
Многие жидкости являются летучими, с их поверхности отрываются и переходят в воздух молекулы вещества. Например, если к отверстию открытой бутылки с соляной кислотой поднести ватку, смоченную в нашатырном спирте, то появляется белый дым. Прямо в воздухе происходит химическая реакция между соляной кислотой и аммиаком, получается хлорид аммония. В каком агрегатном состоянии находится это вещество? Его частички, образующие белый дым, представляют собой мельчайшие твердые кристаллы соли. Этот опыт надо проводить под вытяжкой, вещества являются токсичными.
Заключение
Агрегатное состояние газа изучали многие выдающиеся физики и химики: Авогадро, Бойль, Гей-Люссак, Клайперон, Менделеев, Ле-Шателье. Ученые сформулировали законы, объясняющие поведение газообразных веществ в химических реакциях, при изменении внешних условий. Открытые закономерности не только вошли в школьные и вузовские учебники физики и химии. Многие химические производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях.
Агрегатные состояния вещества
Самые известные агрегатные состояния вещества
В зависимости от температуры и давления любое вещество способно принимать различные агрегатные состояния. Каждое такое состояние характеризуется определенными качественными свойствами, которые остаются неизменными в рамках температур и давлений, требуемых для данного агрегатного состояния.
К характерным свойствам агрегатных состояний можно отнести, например, способность тела, находящегося в твердом состоянии, сохранять свою форму, или наоборот – способность жидкого тела изменять форму. Однако, иногда границы между различными состояниями вещества довольно размыты, как в случаях с жидкими кристаллами, либо так называемыми «аморфными телами», которые могут быть упругими как твердые тела и текучими как жидкости.
Переход между агрегатными состояниями может происходить с выделением свободной энергии, изменением плотности, энтропии или других физических величин. Переход от одного агрегатного состояния к другому называется фазовым переходом, а явления, сопровождающие такие переходы – критическими явлениями.
Список известных агрегатных состояний
Твердое тело | |
|---|---|
Аморфные тела(в т. ч. стеклообразные) | Твердые тела, атомы или молекулы которых не образуют кристаллическую решетку. |
Кристаллы | Твердые тела, атомы или молекулы которых образуют кристаллическую решетку. |
Мезофаза | |
Жидкие кристаллы | Жидкий кристалл – это такое фазовое состояние, во время которого вещество одновременно обладает как свойствами жидкостей, так и свойствами кристаллов. |
Жидкость | |
Расплав | Состояние вещества при температурах, выше температуры плавления и ниже температуры кипения. |
Перегретая жидкость | Жидкость, температура которой превышает температуру кипения. |
Переохлажденная жидкость | Жидкость, температура которой меньше температуры кристаллизации. |
Растянутая жидкость | Состояние жидкого вещества при отрицательном давлении, вызываемым силами Ван-дер-Ваальса (силами притяжения между молекулами). |
Сверхкритическая жидкость | Состояние жидкости при температуре выше критической точки. |
Квантовая жидкость(сверхтекучесть) | Жидкость, на свойства которой влияют квантовые эффекты. |
Газ | |
Реальный газ | Состояние вещества, имеющего очень слабые связи между молекулами или атомами. Не поддается математическому описанию идеального газа. |
Вырожденный газ | Газ, на свойства которого влияют квантовые эффекты. |
Плазма | |
Электромагнитная | Агрегатное состояние, представленное набором отдельных заряженных частиц, суммарный заряд которых в любом объеме системы равен нулю. |
Кварк-глюонная | Состояние вещества, при котором оно представляет собой набор глюонов, кварков и антикварков. |
Глазма | Кратковременное состояние, во время которого глюонные силовые поля натягиваются между ядрами. Предшествует кварк-глюонной плазме. |
Квантовый газ | |
Ферми-газ | Газ, состоящий из фермионов, на свойства которого влияют квантовые эффекты. |
Конденсат Бозе-Эйнштейна | Газ, состоящий из бозонов, на свойства которого влияют квантовые эффекты. |
Агрегатное состояние вещества (стр. 1 из 2)
Содержание
Введение
1.Агрегатное состояние вещества – газ
2.Агрегатное состояние вещества – жидкость
3.Агрегатное состояние вещества – твердое тело
4.Четвертое состояние вещества – плазма
Заключение
Список использованной литературы
Как известно, многие вещества в природе могут находиться в трех состояниях: твердом, жидком и газообразном.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма.
Целью данной работы является – рассмотреть существующие агрегатные состояния вещества, выявить все их достоинства и недостатки.
Для этого необходимо выполнить и рассмотреть следующие агрегатные сотояния:
1. газ
2. жидкости
3. твердые вещества
4. плазма
Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из газов — нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём газов существенно зависит от давления и температуры. Коэффициент объёмного расширения газов в обычных условиях (0-100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1.
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление – р, температура – Т. При температурах ниже критической Тк эта область ограничена кривыми сублимации (возгонки)/парообразования. Это означает, что при любом давлении ниже критического рк существует температура Т, определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. Газ в этих состояниях обычно называют паром вещества.
При температурах ниже Тк можно сконденсировать газы — перевести его в другое агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение газа в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности, энтальпии, теплоёмкости и др.). Процессы конденсации газов, особенно сжижение газов, имеют важное техническое значение.
В связи с тем, что область газового состояния очень обширна, свойства газов при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0°С и атмосферном давлении) плотность газов примерно в 1000 раз меньше плотности того же вещества в твёрдом или жидком состоянии. При комнатной температуре, но давлении, в 1017 раз меньшем атмосферного (предел, достигнутый современной вакуумной техникой), плотность газов составляет около 10-20г/см3. В космических условиях плотность газов может быть ещё на 10 порядков меньше (~10-30/см3).
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать газом, обладает огромной плотностью (например, в центре некоторых звёзд ~109 г/см3). В зависимости от условий в широких пределах изменяются и другие свойства газов — теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория газов. Молекулярно-кинетическая теория рассматривает газы как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства газов, особенно полно — свойства разреженных газов.
У достаточно разреженных газов средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1см3 газа находится 1019 молекул и среднее расстояние между ними составляет ~ 10-6 см.
Жидкость, агрегатное состояние вещества, промежуточное между твёрдым и газообразным состояниями. Ж., сохраняя отдельные черты как твёрдого тела, так и газа, обладает, однако, рядом только ей присущих особенностей, из которых наиболее характерная — текучесть. Подобно твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д. С другой стороны, взятая в достаточном количестве Ж. принимает форму сосуда, в котором находится. Принципиальная возможность непрерывного перехода Ж. в газ также свидетельствует о близости жидкого и газообразного состояний.
По химическому составу различают однокомпонентные, или чистые. Ж. и двух- или многокомпонентные жидкие смеси (растворы). По физической природе Ж. делятся на нормальные (обычные), жидкие кристаллы с сильно выраженной анизотропией (зависимостью свойств от направления) и квантовые жидкости — жидкие 4He, 3He и их смеси — со специфическими квантовыми свойствами при очень низких температурах. Нормальные чистые Ж. имеют только одну жидкую фазу (т. е. существует один единственный вид каждой нормальной Ж.). Гелий 4He может находиться в двух жидких фазах — нормальной и сверхтекучей, а жидкокристаллические вещества — в нормальной и одной или даже двух анизотропных фазах.
Общим для всех нормальных Ж., в том числе и для смесей, является их макроскопическую однородность и изотропность при отсутствии внешних воздействий. Эти свойства сближают Ж. с газами, но резко отличают их от анизотропных кристаллических твёрдых тел. Аморфные твёрдые тела (например, стекла), с современной точки зрения, являются переохлажденными Ж. и отличаются от обычных Ж. только численными значениями кинетических характеристик (существенно большей вязкостью и др.). Область существования нормальной жидкой фазы ограничена со стороны низких температур фазовым переходом в твёрдое состояние — кристаллизацией или (в зависимости от величины приложенного давления) фазовым переходом в сверхтекучее состояние для 4He и в жидко-анизотропное состояние для жидких кристаллов. При давлениях ниже критического давления ркнормальная жидкая фаза ограничена со стороны высоких температур фазовым переходом в газообразное состояние — испарением. При давлениях р > рк фазовый переход отсутствует и по своим физическим свойствам Ж. в этой области неотличима от плотного газа. Наивысшая температура Tk,при которой ещё возможен фазовый переход Ж. — газ, называется критической. Значения pk?и Tk определяют критическую точку чистой Ж., в которой свойства Ж. и газа становятся тождественными. Наличие критической точки для фазового перехода Ж. — газ позволяет осуществить непрерывный переход из жидкого состояния в газообразное, минуя область, где газ и Ж. сосуществуют. Таким образом, при нагревании или уменьшении плотности свойства Ж. (теплопроводность, вязкость, самодиффузия и др.), как правило, меняются в сторону сближения со свойствами газов. Вблизи же температуры кристаллизации большинство свойств нормальных Ж. (плотность, сжимаемость, теплоёмкость, электропроводность и т. д.) близки к таким же свойствам соответствующих твёрдых тел. В табл. приведены значения теплоёмкости при постоянном давлении (Ср) ряда веществ в твёрдом и жидком состояниях при температуре кристаллизации. Малое различие этих теплоёмкостей показывает, что тепловое движение в Ж. и твёрдых телах вблизи температуры кристаллизации имеет примерно одинаковый характер.
Молекулярная теория жидкости. По своей природе силы межмолекулярного взаимодействия в Ж. и кристаллах одинаковы и имеют примерно одинаковые величины. Наличие в Ж. сильного межмолекулярного взаимодействия обусловливает, в частности, существование поверхностного натяжения на границе Ж. с любой др. средой. Благодаря поверхностному натяжению Ж. стремится принять такую форму, при которой её поверхность (при данном объёме) минимальна. Небольшие объёмы Ж. имеют обычно характерную форму капли. В отсутствии внешних сил, когда действуют только межмолекулярные силы (например, в условиях невесомости), Ж. приобретает форму шара. Влияние поверхностного натяжения на равновесие и движение свободной поверхности Ж., границ Ж. с твёрдыми телами или границ между несмешивающимися Ж. относится к области капиллярных явлений.
3. Агрегатное состояние вещества – твердое тело
Твёрдое тело, одно из четырёх агрегатных состояний вещества, отличающееся от др. агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Наряду с кристаллическим состоянием Т. т. существует аморфное состояние, в том числе стеклообразное состояние. Кристаллы характеризуются дальним порядком в расположении атомов. В аморфных телах дальний порядок отсутствует .
Четвертое агрегатное состояние вещества | Лаборатория космических исследований
Всем, я думаю, известно 3 основных агрегатных состояния вещества: жидкое, твердое и газообразное. Мы сталкиваемся с этими состояниями вещества каждый день и повсюду. Чаще всего их рассматривают на примере воды. Жидкое состояние воды наиболее привычно для нас. Мы постоянно пьем жидкую воду, она течет у нас из крана, да и сами мы на 70% состоим из жидкой воды. Второе агрегатное состояние воды — это обычный лед, который зимой мы видим на улице. В газообразном виде воду тоже легко встретить в повседневной жизни. В газообразном состоянии вода — это, всем нам известный, пар. Его можно увидеть, когда мы, к примеру, кипятим чайник. Да, именно при 100 градусах вода переходит из жидкого состояния в газообразное.
Это три привычных для нас агрегатных состояния вещества. Но знаете ли вы, что их на самом деле 4? Я думаю, хоть раз каждый слышал слово «плазма». А сегодня я хочу, чтобы вы еще и узнали побольше о плазме — четвертом агрегатном состоянии вещества.
Плазма — это частично или полностью ионизированный газ с одинаковой плотностью, как положительных, так и отрицательных зарядов. Плазму можно получить из газа — из 3 агрегатного состояния вещества путем сильного нагревания. Агрегатное состояние вообще, по сути, полностью зависит от температуры. Первое агрегатное состояние — это самая низкая температура, при которой тело сохраняет твердость, второе агрегатное состояние — это температура при которой тело начинает плавиться и становиться жидким, третье агрегатное состояние — это наиболее высокая температура, при ней вещество становиться газом. У каждого тела, вещества температура перехода от одного агрегатного состояние к другому совершенно разная, у кого-то ниже, у кого-то выше, но у всех строго в такой последовательности. А при какой же температуре вещество становиться плазмой? Раз это четвертое состояние, значит, температура перехода к нему выше, чем у каждого предыдущего. И это действительно так. Для того, чтобы ионизировать газ необходима очень высокая температура. Самая низкотемпературная и низкоионизированная (порядка 1%) плазма характеризуется температурой до 100 тысяч градусов. В земных условиях такую плазму можно наблюдать в виде молний. Температура канала молнии может превышать 30 тысяч градусов, что в 6 раз больше, чем температура поверхности Солнца. Кстати, Солнце и все остальные звезды — это тоже плазма, чаще все-таки высокотемпературная. Наука доказывает, что около 99% всего вещества Вселенной — это плазма.
В отличие от низкотемпературной, высокотемпературная плазма обладает практически 100% ионизацией и температурой до 100 миллионов градусов. Это поистине звездная температура. На Земле такая плазма встречается только в одном случае — для опытов термоядерного синтеза. Контролируемая реакция достаточно сложна и энергозатратна, а вот неконтролируемая достаточно зарекомендовала себя как оружие колоссальной мощности – термоядерная бомба, испытанная СССР 12 августа 1953 года.
Плазму классифицируют не только по температуре и степени ионизации, но и по плотности, и по квазинейтральности. Словосочетание плотность плазмы обычно обозначает плотность электронов, то есть число свободных электронов в единице объёма. Ну, с этим, думаю, все понятно. А вот что такое квазинейтральность знают далеко не все. Квазинейтральность плазмы — это одно из важнейших ее свойств, заключающееся в практически точном равенстве плотностей входящих в её состав положительных ионов и электронов. В силу хорошей электрической проводимости плазмы разделение положительных и отрицательных зарядов невозможно на расстояниях больших дебаевской длины и временах больших периода плазменных колебаний. Почти вся плазма квазинейтральна. Примером неквазинейтральной плазмы является пучок электронов. Однако плотность не-нейтральных плазм должна быть очень мала, иначе они быстро распадутся за счёт кулоновского отталкивания.
Мы совсем мало рассмотрели земных примеров плазмы. А ведь их достаточно много. Человек научился применять плазму себе во благо. Благодаря четвертому агрегатному состоянию вещества мы можем пользоваться газоразрядными лампами, плазменными телевизорами, дуговой электросваркой, лазерами. Обычные газоразрядные лампы дневного света — это тоже плазма. Существует в нашем мире также плазменная лампа. Ее в основном используют в науке, чтобы изучить, а главное — увидеть некоторые из наиболее сложных плазменных явлений, включая филаментацию. Фотографию такой лампы можно увидеть на картинке ниже:
Кроме бытовых плазменных приборов, на Земле так же часто можно видеть природную плазму. Об одном из ее примеров мы уже говорили. Это молния. Но помимо молний плазменными явлениями можно назвать северное сияние, “огни святого Эльма”, ионосферу Земли и, конечно, огонь.
Заметьте, и огонь, и молния, и другие проявления плазмы, как мы это называем, горят. Чем обусловлено столь яркое испускание света плазмой? Свечение плазмы обусловлено переходом электронов из высокоэнергетического состояния в состояние с низкой энергией послерекомбинации с ионами. Этот процесс приводит к излучению со спектром, соответствующим возбуждаемому газу. Именно поэтому плазма светиться.
Хотелось бы так же немного рассказать об истории плазмы. Ведь когда-то плазмой назывались лишь такие вещества, как жидка составляющая молока и бесцветная составляющая крови. Все изменилось в 1879 году. Именно в тот год знаменитый английский ученый Уильям Крукс, исследуя электрическую проводимость в газах, открыл явление плазмы. Правда, назвали это состояние вещества плазмой лишь в 1928. И это совершил Ирвинг Ленгмюр.
В заключении хочу сказать, что такое интересное и загадочное явление, как шаровая молния, о которой я не раз писала на этом сайте, это, конечно же, тоже плазмойд, как и обычная молния. Это, пожалуй, самый необычный плазмойд из всех земных плазменных явлений. Ведь существует около 400 самых различных теорий на счет шаровой молнии, но не одна из них не была признана воистину правильной. В лабораторных условиях похожие, но кратковременные явления удалось получить несколькими разными способами, так что вопрос о природе шаровой молнии остаётся открытым.
Обычную плазму, конечно, тоже создавали в лабораториях. Когда-то это было сложным, но сейчас подобный эксперимент не составляет особого труда. Раз уж плазма прочно вошла в наш бытовой арсенал, то и в лабораториях над ней немало экспериментируют.
Интереснейшим открытием в области плазмы стали эксперименты с плазмой в невесомости. Оказывается, в вакууме плазма кристаллизуется. Это происходит так: заряженные частицы плазмы начинают отталкиваться друг от друга, и, когда у них есть ограниченный объем, они занимают то пространство, которое им отведено, разбегаясь в разные стороны. Это весьма похоже на кристаллическую решетку. Не означает ли это, что плазма являеться замыкающим звеном между первым агрегатным состоянием вещества и третьим? Ведь она становиться плазмой благодаря ионизации газа, а в вакууме плазма вновь становиться как бы твердой. Но это только мое предположение.
Кристаллики плазмы в космосе имеют также и достаточно странную структуру. Эту структуру можно наблюдать и изучать только в космосе, в настоящем космическом вакууме. Даже если создать вакуум на Земле и поместить туда плазму, то гравитация будет просто сдавливать всю «картину», образующуюся внутри. В космосе же кристаллы плазмы просто взлетают, образуя объемную трехмерную структуру странной формы. После отправления результатов наблюдения за плазмой на орбите земным ученым, выяснилось, что завихрения в плазме странным образом повторяют структуру нашей галактики. А это значит, что в будущем можно будет понять, как зародилась наша галактика путем изучения плазмы. Ниже на фотографиях показаны та самая кристаллизованная плазма.
Это все, что мне бы хотелось сказать на тему плазмы. Надеюсь, она вас заинтересовала и удивила. Ведь это воистину удивительное явление, а точнее состояние — 4 агрегатное состояние вещества.
агрегатные состояния вещества — это… Что такое агрегатные состояния вещества?
- агрегатные состояния вещества
- агрега́тные состоя́ния вещества состояния (фазы) одного и того же вещества в различных интервалах температур и давлений. Обычно рассматривают газообразное, жидкое и твёрдое агрегатное состояние, переходы между которыми сопровождаются скачкообразными изменениями свободной энергии, энтропии, плотности и других физических характеристик вещества. С увеличением температуры газов при фиксированном давлении они переходят в состояние ионизованной плазмы, которую также принято считать агрегатным состоянием. См. также Газ, Жидкость, Твёрдое тело, Плазма.
Энциклопедический словарь. 2009.
- агрегат
- агрегатный станок
Смотреть что такое «агрегатные состояния вещества» в других словарях:
АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА — (от лат. aggrego присоединяю, связываю), состояния одного и того же в ва, переходы между к рыми сопровождаются скачкообразным изменением его свободной энергии, энтропии, плотности и др. физ. св в. Все в ва (за нек рым исключением) могут… … Физическая энциклопедия
агрегатные состояния вещества — [от лат.] – общее название трёх физических состояний – твёрдого (кристаллического), жидкого и газообразного, – в которых может находиться всякое вещество в зависимости от температуры и давления Большой словарь иностранных слов. Издательство… … Словарь иностранных слов русского языка
АГРЕГАТНЫЕ СОСТОЯНИЯ — вещества состояния (фазы) одного и того же вещества (напр., воды, железа, серы), переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств (плотности, энтропии и др.). Обычно рассматривают газообразное, жидкое и… … Большой Энциклопедический словарь
АГРЕГАТНЫЕ СОСТОЯНИЯ — вещества, состояния одного и того же вещества в различных интервалах температур и давлений. Традиционно агрегатными состояниями считают газообразное, жидкое и твердое состояния, переходы между которыми обычно сопровождаются скачкообразными… … Современная энциклопедия
Агрегатные состояния — вещества, состояния одного и того же вещества в различных интервалах температур и давлений. Традиционно агрегатными состояниями считают газообразное, жидкое и твердое состояния, переходы между которыми обычно сопровождаются скачкообразными… … Иллюстрированный энциклопедический словарь
АГРЕГАТНЫЕ СОСТОЯНИЯ — вещества (от лат. aggrego присоединяю) состояния одного и того же вещества в разл. интервалах темп р и давлений. Традиционно агрегатными считают газообразное, жидкое и твёрдое состояния, переходы между к рыми сопровождаются скачкообразными… … Физическая энциклопедия
АГРЕГАТНЫЕ СОСТОЯНИЯ — вещества, состояния (фазы) одного и того же вещества (напр., воды, железа, серы), переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств (плотности, энтропии и др.). Обычно рассматривают газообразное, жидкое и… … Энциклопедический словарь
Агрегатные состояния — вещества, состояния одного и того же вещества (например, воды, железа, серы), переходы между которыми сопровождаются скачкообразными изменениями свободной энергии (См. Свободная энергия), энтропии (См. Энтропия), плотности (См. Плотность) … Большая советская энциклопедия
АГРЕГАТНЫЕ СОСТОЯНИЯ — вещества, состояния (фазы) одного и того же в ва в разл. интервалах темп р и давлений. Обычно рассматривают газообразное, жидкое и твёрдое А. с., переходы между к рыми сопровождаются скачкообразными изменениями свободной энергии, энтропии,… … Естествознание. Энциклопедический словарь
Уравнение состояния — У этого термина существуют и другие значения, см. Уравнение состояния (космология). Уравнение состояния … Википедия

