Железо, Вступление | |
| Символ | Fe |
| Латинское название | Iron |
| Тип вещества | простой химический элемент |
| Год открытия | известно до нашей эры |
Основные параметры железа по таблице Менделеева | |
| Атомный номер Z | 26 |
| Атомная масса | 55.845 |
| Группа | 8 |
| Период | 4 |
| Принадлежность к группе | переходные металлы |
Механические свойства железа | |
| Плотность твердых веществ | 7.800 · 103 (Килограмм / Метр3) |
| Скорость звука | 4910 (Метр / Секунда) |
Термодинамические свойства железа | |
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 1811.15 (Кельвин) |
| Точка плавления по Цельсию | 1538 (°C) |
| Точка кипения по Кельвину | 3134.15 (Кельвин) |
| Точка кипения по Цельсию | 2861 (°C) |
| Коэффициент линейного теплового расширения твердых тел в интервале температур (0..100°C) | 12.2 · 10 − 6 (1 / Кельвин) |
Электрические свойства железа | |
| Тип электрической проводимости | проводник |
| Удельное электрическое сопротивление проводников (при 20°C) | 10.000 · 10 − 8 (Ом · Метр) |
Магнитные свойства железа | |
| Тип магнитной проницаемости | ферромагнетик |
Свойства атома железа | |
| Конфигурация электронного облака | 1s2 | 2s22p6 | 3s23p63d64s2 |
| Радиус атома | 156 · 10 − 12 (Метр) |
| Массовое число A | 55 |
Химические свойства железа | |
| Валентность | 3 |
Распространенность железа | |
| Вселенная состоит из железа на | 0.11% |
| Солнце состоит из железа на | 0.1% |
| Мировой океан состоит из железа на | 3×10-7% |
| Человеческое тело состоит из железа на | 0.006% |
Вселенная | |
| Вселенная состоит из железа на | 0.11% |
Агрегатные состояния вещества
МАТЕРИАЛОВЕДЕНИЕ
Конспект лекций
для студентов заочной формы обучения
Набережные Челны
ВВЕДЕНИЕ
Материаловедение – это наука о различных материалах, широко используемых в настоящее время для производства разнообразных деталей, механизмов, приборов и конструкций, а также для иных целей. Успех эксплуатации вышеназванных изделий во многом зависит от качеств (свойств) используемых в них материалов. Кроме того, свойства материалов во многом определяют и саму возможность получения из их различных изделий.
Материаловедение своей основной задачей считает установление взаимосвязи между свойствами изучаемых материалов их химическим составом и структурой. Получаемые материаловедением знания составляют основу для научного прогнозирования и управления свойствами материалов. Они помогают совершенствовать уже известные материалы и разрабатывать принципиально новые, уникальные материалы. За счёт применения этих, более совершенных материалов могут быть повышены точность, надёжность и долговечность выпускаемых приборов, механизмов и конструкций, а также созданы принципиально новые изделия и устройства, отвечающие современным высоким требованиям.
Среди всех материалов, используемых в настоящее время, лидирующее положение по объёму производства и потребления занимают металлы и сплавы. Поэтому важнейшей составной частью материаловедения является металловедение – наука о металлах и сплавах.
1. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
Агрегатные состояния вещества
Как известно, любое вещество может находиться в твёрдом, жидком и газообразном состоянии. Это зависит от температуры, давления, а также от того, как сильно взаимодействуют частицы вещества. Выражаясь точнее, реализация того или иного агрегатного состояния вещества определяется соотношением средней энергии движения его атомов или молекул (Е кин) и средней энергии их взаимодействия (Епот). Если Екин >> Епот , вещество находиться в газообразном состоянии. При этом частицы вещества располагаются на относительно больших расстояниях друг от друга и практически не взаимодействуют, за исключением случайных столкновений, в которых они разлетаются подобно биллиардным шарам. Двигаясь почти свободно, частицы газа занимают весь предоставленный им объём, и этим объясняется самое общее свойство всех газов – их летучесть.
С понижением температуры уменьшается энергия движения частиц вещества, и всё заметнее начинают проявляться силы межатомного или межмолекулярного взаимодействия. Частицы при случайном столкновении уже не отскакивают друг от друга подобно биллиардным шарам, а как бы «прилипают» друг к другу. Это приводит к переходу вещества в более плотное, конденсированное состояние – сначала в жидкое, а затем и в твёрдое.
В жидком состоянии энергия движения частиц вещества сравнима с энергией их взаимодействия (Екин @ Епот). В результате связи между частицами оказываются неустойчивыми, легко нарушаемыми тепловым движением. Частицы часто меняют своих ближайших соседей, совершая так называемые перескоки с места на место, чем и объясняется текучесть жидкостей.
В твёрдом состоянии средняя энергия движения частиц вещества не превышает энергию межатомных или межмолекулярных связей (Екин < Епот). Перескоки частиц совершаются крайне редко, и вещество длительное время сохраняет свою форму, т.е. остаётся твёрдым.
С изменением температуры или давления изменяется соотношение между энергией движения частиц вещества и энергией их взаимодействия. Повышение температуры приводит к возрастанию Екин , а повышение давления – к возрастанию Е пот , и наоборот. Следствием изменения соотношения энергий является переход вещества из одного агрегатного состояния в другое.
Как показывает опыт, чаще на практике находят применение материалы, находящиеся в твёрдом состоянии.
Структура кристаллов
Следует различать понятия кристаллическая решётка и структура кристалла. Структура кристалла – это физическая реальность, конкретное расположение в пространстве различных атомов. Кристаллическая решётка – это геометрический образ структуры, отражающий лишь симметрию расположения частиц кристалла. Для более полного описания структуры кристаллов используют понятие базис. Базисом кристаллической структуры называют совокупность определённым образом расположенных в пространстве различных атомов, приходящихся на одну элементарную ячейку. Т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. Таким образом, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Другими словами, базис это тот «элементарный блок вещества», периодическим повторением которого в пространстве воспроизводится весь рассматриваемый кристалл.
Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В простейшем случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Подобная ситуация характерна, в частности, для металлов. Если структуру металла описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то базис такой структуры состоит только из одного атома данного металла. (Действительно, в данном случае, каждый атом металла, расположенный в узле кристаллической решётки, находится на пересечении 8 аналогичных ячеек и принадлежит рассматриваемой ячейке только на ⅛ часть. Но поскольку таких узлов в ячейке 8, то полностью принадлежит ей ровно один атом, составляющий по определению базис. Перемещая этот атом–базис вдоль координатных осей с шагом, соответствующим периодам кристаллической решётки, воспроизводится вся пространственная структура металла). В случае объёмоцентрированной ячейки базис составляют 2 атома металла (атом в центре ячейки полностью принадлежит данной ячейке, плюс один атом дают узлы, расположенные в вершинах ячейки), а гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах граней, принадлежит рассматриваемой ячейке только на ½ часть).
Система симметрии, величина периодов решётки и базис полностью определяют кристаллическую структуру конкретного материала. Если известны эти параметры, то известной считается и структура кристалла. Однако для более полного описания структуры иногда используют такие дополнительные параметры как координационное число и коэффициент компактности.
Анизотропия кристаллов
Анизотропия – это зависимость свойств материала от направления.Материал считается изотропным, когда его свойства во всех направлениях одинаковые. Если же с изменением направления свойства материала изменяются, материал считается анизотропным.
Анизотропия характерна для кристаллов и обусловлена их упорядоченной структурой. В кристаллах в различных направлениях атомы располагаются с различной плотностью, т.е. на различном расстоянии друг от друга, что отражается на силе взаимодействия атомов. Как следствие, свойства кристаллов в различных направлениях оказываются различными. Например, в кубическом кристалле в направлении координатных осей атомы вещества располагаются на расстоянии друг от друга равном а (рис.1). В направлении диагонали атомы располагаются на расстоянии а , а в направлении пространственной диагонали – а . Очевидно, такой кристалл легче разорвать в направлении пространственной диагонали, чем в направлении координатных осей, где он обнаруживает наибольшую прочность из-за того, что атомы расположены ближе и сильнее взаимодействуют.
Анизотропия распространяется практически на все свойства кристаллов. Так, кристалл в одном направлении лучше, чем в другом может проводить тепло, электрический ток, свет, лучше намагничиваться и т.д. При этом, чем ниже система симметрии кристалла, тем сильнее проявляется анизотропия его свойств.
В аморфных материалах, из-за хаотического внутреннего строения, атомы в различных направлениях располагаются примерно с одинаковой плотностью. В результате свойства данных материалов в различных направлениях оказываются одинаковыми, т.е. вещество оказывается изотропным.
Металлы и сплавы, полученные в обычных условиях, также очень часто обнаруживают равенство свойств в различных направлениях, хотя и являются материалами кристаллическими, а не аморфными. Это объясняется их зернистым строением. Зёрна данных материалов, будучи кристаллами, в различных направлениях обнаруживают различные свойства, однако в целом материал оказывается изотропным, поскольку зёрна случайным образом ориентированы в пространстве и при сложении свойств в каждом направлении получается примерно одна, усреднённая величина. Такую изотропию называют ложной изотропией или квазиизотропией.
Иногда зёрна поликристаллических материалов оказываются ориентированными преимущественно в одном направлении. Например, зёрна металлов и сплавов при пластическом деформировании вытягиваются в направлении деформации. Такое явление называют текстурой. При появлении текстуры свойства кристаллических материалов вновь начинают зависеть от направления, т.е. материал оказывается анизотропным.
Полиморфизм металлов
Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения.
Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д.
Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен.
Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру.
Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
ОЦК ГЦК ОЦК жидкость
α-Fe β-Fe γ-Fe δ-Fe
768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа.
При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом.
В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца.
В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe.
При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав.
Другим ярким примером полиморфизма металлов является полиморфизм олова. При температурах ниже -30°С белое и пластичное β-олово (β –Sn) превращается в свою α-модификацию, т.е. в α-Sn, которое является серым порошком. Не имея никакого представления о природе данного явления, его, в своё время, назвали «оловянной чумой».
Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой.
3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ
И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Кривые охлаждения металлов
С увеличением степени переохлаждения расплава возрастает выигрыш в энергии (Δ F), связанный с переходом вещества из жидкого состояния в кристаллическое (на рис. 3.1. ΔF2 > ΔF1). Эту выделяющуюся при кристаллизации энергию называют скрытой теплотой кристаллизации. Скрытая теплота кристаллизации компенсирует отвод тепла от охлаждаемого жидкого металла пока идёт процесс его затвердевания. В результате температура металла при кристаллизации остается постоянной. Этот факт отражает теоретическая кривая охлаждения чистого металла, содержащая при температуре TS горизонтальную площадку (рис. 3.2.).
| |||
Реальная кривая охлаждения металла выглядит несколько иначе. Она отражает факт переохлаждения расплава и поэтому здесь горизонтальная площадка располагается при температурах ниже TS. Кроме того, на площадке наблюдается выброс вверх, обусловленный бурным выделением скрытой теплоты кристаллизации в начальный момент затвердевания расплава. Выброс тем больше, чем большая масса металла кристаллизуется.
Строение слитка металла
Зависимость размера зёрен металла от степени переохлаждения расплава наглядно демонстрирует структура слитка металла, в частности структура слитка затвердевшей углеродистой стали (рис. 3.4.).
Этот слиток обнаруживает три характерные зоны: мелкозернистую корочку – 1, зону вытянутых столбчатых кристаллов – 2 и зону неориентированных крупных кристаллов – 3.
Кристаллизация расплава начинается с формирования зоны 1, т.е. со стенок литейной формы, где горячий расплав соприкасается с относительно холодной поверхностью формы. Поскольку степень переохлаждения расплава здесь очень высокая, зёрна металла оказываются мелкими.
Рис. 3.4. Структура слитка стали
На следующем этапе кристаллизации формируется зона столбчатых кристаллов (зона 2). Степень переохлаждения расплава здесь значительно меньше и поэтому зёрна вырастают крупными. В тоже время рост кристаллов происходит в сторону противоположную отводу тепла – от стенок к центру слитка, поэтому зёрна оказываются ориентированными перпендикулярно стенкам формы.
Центральная часть слитка (зона 3) формируется на заключительном этапе кристаллизации. Поскольку степень переохлаждения расплава здесь небольшая, а тепло отводится во все стороны равномерно, зёрна в этой зоне оказываются крупными и неориентированными, т.е. округлыми.
В верхней части слитка формируется усадочная раковина, что связано с уменьшением объема металла при затвердевании. В этой области обычно собираются всевозможные загрязнения и неметаллические включения. Поэтому область слитка с усадочной раковиной подлежит удалению.
4. ДЕФОРМАЦИЯ И МЕХАНИЧЕСКИЕ СВОЙСТВА МАТЕРИАЛОВ
Разрушение материалов
Разрушение это заключительная стадия деформирования материала. Оно представляет собой разделение материала на отдельные составные части. С точки зрения атомной структуры, разрушение выглядит как разрыв межатомных связей. Разрыв может происходить двумя способами: 1) Под воздействием напряжений перпендикулярных плоскости разрыва (разрыв сколом или отрывом). 2) Под воздействием напряжений параллельных плоскости разрыва (то есть разрыв сдвигом или скольжением). В реальных материалах обычно имеют место оба вида разрыва.
Различают разрушение хрупкое и вязкое. При вязком разрушении наблюдается значительная пластическая деформация материала перед разрушением, при этом разрыв межатомных связей происходит преимущественно сдвигом или скольжением. При хрупком разрушении пластическая деформация значительно меньше или совсем отсутствует, а разрыв межатомных связей происходит преимущественно сколом или отрывом. Чисто вязкое разрушение наблюдают у таких материалов как глина, пластилин, а чисто хрупкое — у и т.д. Большинству реальных материалов присущи одновременно оба вида разрушения, а подразделение материалов на хрупкие или вязкие осуществляется по преобладающему механизму разрушения. Так, глина и пластилин являются вязкими материалами, а стекло и алмаз – хрупкими.
Вид разрушения характеризуется величиной работы разрушения, видом трещины и поверхности излома, а также скоростью распространения трещины.
При вязком разрушении работа разрушения значительно больше, чем при хрупком разрушении. Работа разрушения пропорциональна площади под кривой растяжения материала:
Хрупкое разрушение наиболее опасно. Обычно оно начинается с некоторого дефекта: царапины на поверхности, выбоины, поры, неметаллических включений, сварного шва, технологических отверстий и изгибов и т.д. Хрупкое разрушение происходит в три стадии:
1) Зарождение микротрещины на дефектах.
2) Подрастание трещины до критического размера.
3) Распространение трещины через весь образец, т.е. возникновение магистральной трещины.
При хрупком разрушении третья стадия происходит самопроизвольно без дополнительного деформирования образца, то есть без дополнительного подвода энергии извне. Трещина растёт за счёт упругой энергии, накопленной на предыдущей стадии деформирования. Скорость распространения такой трещины сравнима со скоростью распространения звука в данном материале.
При вязком разрушении скорость распространения трещины зависит от скорости деформирования материала. При этом требуется подвод энергии извне, т.е. дополнительная деформация.
Хрупкая трещина имеет малый угол раскрытия, т.е. является острой трещиной и, как правило, ветвится. Вязкая трещина имеет большой угол раскрытия, т.е. является тупой трещиной.
Поверхность излома при хрупком разрушении оказывается блестящей и под микроскопом обнаруживает платообразную структуру:
При вязком разрушении поверхность излома оказывается матовой и под микроскопом обнаруживает волокнистую структуру:
У многих вязких металлов при понижении температуры наблюдается смена преобладающего механизма разрушения. Свойство материалов разрушатся хрупко при низких температурах называют хладноломкостью.
В заключение необходимо отметить, что стадия разрушения материала, с момента появления первых повреждений, может составлять до 90% долговечности конструкции.
МАТЕРИАЛОВЕДЕНИЕ
Конспект лекций
для студентов заочной формы обучения
Набережные Челны
ВВЕДЕНИЕ
Материаловедение – это наука о различных материалах, широко используемых в настоящее время для производства разнообразных деталей, механизмов, приборов и конструкций, а также для иных целей. Успех эксплуатации вышеназванных изделий во многом зависит от качеств (свойств) используемых в них материалов. Кроме того, свойства материалов во многом определяют и саму возможность получения из их различных изделий.
Материаловедение своей основной задачей считает установление взаимосвязи между свойствами изучаемых материалов их химическим составом и структурой. Получаемые материаловедением знания составляют основу для научного прогнозирования и управления свойствами материалов. Они помогают совершенствовать уже известные материалы и разрабатывать принципиально новые, уникальные материалы. За счёт применения этих, более совершенных материалов могут быть повышены точность, надёжность и долговечность выпускаемых приборов, механизмов и конструкций, а также созданы принципиально новые изделия и устройства, отвечающие современным высоким требованиям.
Среди всех материалов, используемых в настоящее время, лидирующее положение по объёму производства и потребления занимают металлы и сплавы. Поэтому важнейшей составной частью материаловедения является металловедение – наука о металлах и сплавах.
1. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МАТЕРИАЛОВ
Агрегатные состояния вещества
Как известно, любое вещество может находиться в твёрдом, жидком и газообразном состоянии. Это зависит от температуры, давления, а также от того, как сильно взаимодействуют частицы вещества. Выражаясь точнее, реализация того или иного агрегатного состояния вещества определяется соотношением средней энергии движения его атомов или молекул (Екин) и средней энергии их взаимодействия (Епот). Если Екин >> Епот , вещество находиться в газообразном состоянии. При этом частицы вещества располагаются на относительно больших расстояниях друг от друга и практически не взаимодействуют, за исключением случайных столкновений, в которых они разлетаются подобно биллиардным шарам. Двигаясь почти свободно, частицы газа занимают весь предоставленный им объём, и этим объясняется самое общее свойство всех газов – их летучесть.
С понижением температуры уменьшается энергия движения частиц вещества, и всё заметнее начинают проявляться силы межатомного или межмолекулярного взаимодействия. Частицы при случайном столкновении уже не отскакивают друг от друга подобно биллиардным шарам, а как бы «прилипают» друг к другу. Это приводит к переходу вещества в более плотное, конденсированное состояние – сначала в жидкое, а затем и в твёрдое.
В жидком состоянии энергия движения частиц вещества сравнима с энергией их взаимодействия (Екин @ Епот). В результате связи между частицами оказываются неустойчивыми, легко нарушаемыми тепловым движением. Частицы часто меняют своих ближайших соседей, совершая так называемые перескоки с места на место, чем и объясняется текучесть жидкостей.
В твёрдом состоянии средняя энергия движения частиц вещества не превышает энергию межатомных или межмолекулярных связей (Екин < Епот). Перескоки частиц совершаются крайне редко, и вещество длительное время сохраняет свою форму, т.е. остаётся твёрдым.
С изменением температуры или давления изменяется соотношение между энергией движения частиц вещества и энергией их взаимодействия. Повышение температуры приводит к возрастанию Екин , а повышение давления – к возрастанию Епот , и наоборот. Следствием изменения соотношения энергий является переход вещества из одного агрегатного состояния в другое.
Как показывает опыт, чаще на практике находят применение материалы, находящиеся в твёрдом состоянии.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Агрегатные состояния вещества | Физика
Зимой вода на поверхности озер и рек замерзает, превращаясь в лед. Подо льдом вода остается жидкой (рис. 76). Здесь одновременно существуют два различных состояния воды — твердое (лед) и жидкое (вода). Существует и третье состояние воды — газообразное: невидимый водяной пар находится в окружающем нас воздухе. На примере воды мы видим, что вещества могут находиться в трех агрегатных состояниях — твердом, жидком и газообразном.
На примере воды мы видим, что вещества могут находиться в трех агрегатных состояниях — твердом, жидком и газообразном.
Жидкую ртуть можно увидеть в резервуаре термометра. Над поверхностью ртути находятся ее пары, которые представляют собой газообразное состояние ртути. При температуре -39 °С ртуть замерзает, переходя в твердое состояние.
Кислород в окружающем нас воздухе представляет собой газ. Но при температуре -193 °С он превращается в жидкость. Охладив эту жидкость до -219 °С, мы получим твердый кислород.
И наоборот, железо в обычных условиях твердое. Однако при температуре 1535 °С железо плавится и превращается в жидкость. Над расплавленным железом будет находиться газ — пар из атомов железа.
Свойства вещества в различных агрегатных состояниях различны.
Твердое тело в обычных условиях трудно сжать или растянуть. В отсутствие внешних воздействий оно сохраняет свою форму и объем.
Жидкость легко меняет свою форму. В обычных условиях она принимает форму сосуда, в котором находится (рис. 77). Но в состоянии невесомости (например, на орбитальной космической станции) жидкость характеризуется своей собственной — сферической — формой. Сферическую форму (форму шарика) имеют и маленькие дождевые капельки.
Свойство жидкости легко изменять свою форму учитывают, когда изготавливают посуду из расплавленного стекла (рис. 78).
Форму жидкости изменить легко, но объем ее изменить трудно. Сохранилось описание одного исторического опыта, в котором воду пробовали сжать таким способом. Ее налили в свинцовый шар и шар запаяли, чтобы вода не могла выливаться при сжатии. После этого ударили по свинцовому шару тяжелым молотом. И что же? Вода не сжалась вместе с шаром, а просочилась сквозь его стенки.
Итак, жидкости легко меняют свою форму, но сохраняют свой объем.
Газ не имеет своего собственного объема и не обладает собственной формой. Он всегда заполняет всю предоставленную ему емкость.
Чтобы исследовать свойства газов, необязательно располагать газом, имеющим цвет. Воздух, например, бесцветен, и мы его не видим. Но при быстром движении, находясь у окна автомобиля или поезда, а также когда дует ветер, мы замечаем присутствие воздуха вокруг нас. Его можно обнаружить и при помощи опытов.
Опустим в воду перевернутый вверх дном стакан — вода не заполнит стакан, так как в нем останется воздух. Если опускать в воду воронку, соединенную резиновым шлангом со стеклянной трубкой (рис. 79), то воздух начнет выходить из нее наружу.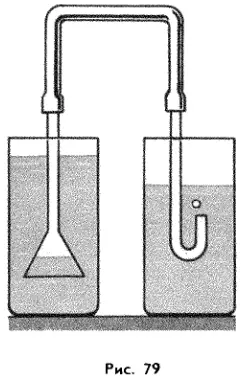 Объем газа изменить нетрудно. Нажав на резиновый мяч, мы заметно уменьшим объем воздуха, находящегося в мяче.
Объем газа изменить нетрудно. Нажав на резиновый мяч, мы заметно уменьшим объем воздуха, находящегося в мяче.
Попав в какой-нибудь сосуд или помещение, газ заполняет их целиком, принимая как их форму, так и объем.
1. В каких трех агрегатных состояниях может находиться любое вещество? Приведите примеры. 2. Тело сохраняет свой объем, но легко меняет форму. В каком состоянии находится это тело? 3. Тело сохраняет свою форму и объем. В каком состоянии находится это тело? 4. Что вы можете сказать о форме и объеме газа?
Агрегатные состояния вещества. Переходы из одного состояния в другое
Агрегатное состояние – это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.
Вещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии – жидким веществом или жидкостью, в газообразном – газообразным веществом или газом.
При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях.
Пример. В стандартных условиях:
- железо, сера, алюминий – твёрдые вещества.
- вода, бензол, ртуть – жидкости.
- кислород, аргон, углекислый газ – газы.
Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение – это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества.
Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар – ниже.
Пример. Критическая температура воды равна примерно 374 °C. Вода в газообразном состоянии, которая имеет температуру ниже критической, например, 5 °C или 120 °С, будет именно паром, а не газом. А вот, например, кислород, гелий и азот – газы, так как они имеют температуру выше критической (у каждого из них критическая температура ниже -100 °C).
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие – нет.
Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:

Агрегатные состояния веществ —
1. Подчеркните верные утверждения.а) Железо может быть жидким;
б) Кислород может быть твердым;
в) Уксусная кислота может быть газообразной.
2. Дополните предложения.
В каком агрегатном состоянии находится вещество, если:
а) оно не сохраняет ыорму, но сохраняет объем — газ;
б) тело из него сохраняет свою форму и обхем — твердое;
в) оно принимает форум того сосуда, в котором находится — жидкое.
3. Подчеркните «лишнее» слово в каждой группе.
а) кислород, углекислый газ, серебро;
б) уксусная кислота, лимонная кислота, спирт;
в) вода, мел, графит;
г) ртуть, вода, кислород;
д) неон, железо, сахар;
е) мел, угарный газ, сероводород.
4. Ответьте на вопрос.
Чем отличаются твердные кристаллические вещества от твердых аморфных?
Кристаллические вещества имеют кристаллическую решетку.
5. Заполните таблицу 9.
Харакетеристика свойств веществ в различный агрегатных состояниях
| ПРИЗНАК СРАВНЕНИЯ | АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА | ||
| ГАЗООБРАЗНОЕ | ЖИДКОЕ | ТВЕРДОЕ | |
| Примеры веещств (при температурах 0-100 гр.) | O2 кислород |
h3O вода |
Fe железо |
| Свойства веществ | бесцветный, сжижаемый | текучесть | электропроводимость |
| Собственная форма | нет | нет | есть |
| Собственный объем | да | да | нет |
| Расстояния между частицами | велико | среднее | близкое |
| Силы взаимодействия между частицами | слабые | межмолекулярные | электростатические |
| Характер движения частиц | хаотичный | колебание и броуновское движение | колебание |
6. Заполните пропуск в предложении.
Явления, при которых изменяются агрегатное состояние вещества, форма или размеры тел,но сохраняется его химический состав, называются физическими.
7. Назовите 2-3 синонима слова «явление».
Эффект, феномен, действие.
8. Запишите 2-3 пословицы или поговорки, в которых идет речь о физических явлениях.
Три года на камне просидишь — камень нагреется.
Земля вертится и мы с ней вместе.
Молния не сверкнет — грома не будет.
9. Домашний опыт. Опыты с пустой закрытой пластиковой бутылкой.
Оборудование: пластиковая бутылка с крышкой, холодильник.
Ход работы. Пустую пластиковую бутылку закройте крышкой и поставьте холодильник. Через минуту вы увидите, что стенки бутылки втянулись вовнутрь, будто кто-то откачал из нее часть воздуха. Почему так произошло?
При охлаждении воздух сжимается. Сжатие компенсирует разность внешнего и внутреннего давления.
Примет ли бутылка прежнюю фому, если ее вынуть из холодильника? Почему?
Примет, так как температура повысится и воздух вернет свое состояние.
Агрегатные состояние вещества. Плавление и отвердевание кристаллических тел. График плавления и отвердевания кристаллических тел. Удельная теплота плавления
820. Чем отличаются молекулы воды от молекул водяного пара?
Молекулы одинаковые. Различны расстояния между ними и скорости их движения.
821. Отличаются ли молекулы железа в болванке от молекул железа в расплавленном состоянии?
Нет.
822. С помощью таблиц определите, у какого вещества температура плавления выше: у серебра или стеарина?
Температура плавления серебра выше.
823. В сосуде с водой при 0 °С плавают куски льда. Что будет происходить: лед таять или вода замерзать? От чего это зависит?
При сохранении температуры воды система будет находиться в равновесии – лед не будет таять, а вода не будет замерзать.
824. Почему при плавлении или отвердевании температура тел не меняется?
Потому что вся энергия тратится на разрушение или восстановление кристаллической решетки.
825. Существует ли температура плавления для аморфных тел?
Нет.
826. Используя табличные данные, определите, у какого вещества температура плавления выше: у цезия или золота.
Температура плавления золота больше.
827. Можно ли для измерения температуры наружного воздуха использовать термометры со ртутью?
Нельзя, так как ртуть замерзает при -38,83°С.
828. В помещение, температура в котором 0 °C, внесли тающий лед. Будет ли он в этом помещении таять?
При сохранении постоянной температуры лед таять не будет.
829. Будет ли плавиться серебро, если его бросить в расплавленное железо?
Температура плавления серебра меньше температуры плавления железа, поэтому серебро будет плавиться.
830. Почему весной возле реки с плывущими по ней льдинами холоднее, чем вдали от нее?
Потому что льдины поглощают тепло.
831. Вода массой 125 кг при 0 °С превратилась в лед. Какое количество теплоты при этом выделилось?

832. Домашним ледником может служить ящик с двойными стенками, пространство между которыми заполнено льдом. Почему внутри такого ледника даже летом температура не поднимается выше 0 °С?
Лед будет постоянно охлаждать ящик, и температура внутри такого ледника не будет подниматься выше 0°С.
833. Почему поставленный на огонь чайник, когда в нем есть вода, просто кипит, а будучи пустым – раскаляется докрасна?
Потому что стенки чайника ведут теплообмен с водой и не раскаляются больше температуры кипения воды.
834. Будет ли плавиться свинец, если его довести до точки плавления и затем прекратить нагрев?
Не будет.
835. Удельная теплота плавления олова равна 59 кДж/кг. Что это означает?
Чтобы расплавить 1 кг олова нужно затратить 59 кДж энергии.
836. Во сколько раз больше теплоты идет на плавление 2 кг чугуна, чем на нагревание 2 кг чугуна на 1 °С?

837. Лед массой 3 кг при температуре 0 °С растаял. Сколько энергии при этом было затрачено?

838. Кусок алюминия массой 10 кг, взятый при температуре плавления 660 °С, полностью расплавился. Какое для этого потребовалось количество теплоты?

839. На рисунке 85 дан график изменения температуры твердого тела при нагревании.
Определите по этому графику:
а) при какой температуре плавится это тело;
б) как долго длилось нагревание от 60° до точки плавления;
в) как долго длилось плавление;
г) до какой температуры было нагрето вещество в жидком состоянии.
а) тело плавится при температуре 80°С;
б) нагревание длилось 4 мин;
в) плавление длилось 4 мин;
г) максимальная температура нагрева вещества 87,5°.
840. Почему для измерения температуры наружного воздуха в холодных районах применяют термометры со спиртом, а не с ртутью?
При низких температурах ртуть замерзает, а спирт — нет.
841. Будет ли плавиться олово, если его бросить в расплавленный свинец?
Будет, потому что температура плавления олова ниже, чем у свинца.
842. Чем выше температура накаленного тела, тем ярче оно светится. Волоски электрических ламп делают из металлов вольфрама, тантала и иридия. Чем можно объяснить употребление этих металлов для нитей лампочек?
Данные металлы обладают высокой температурой плавления и малой удельной теплоемкостью. Это позволяет нагревать металл до высоких температур, не расплавляя его.
843. В каком состоянии находится спирт при температуре -120 °С?
При данной температуре спирт замерзает и становится твердым телом.
844. В каком состоянии находится железо при температуре 1500 °С?
Температура плавления железа 1538°С, поэтому при 1500°С железо остается в твердом состоянии.
845. Кусок меди массой 4 кг расплавился. На сколько увеличилась его внутренняя энергия?

846. Сколько энергии понадобится для расплавления свинца массой 10 кг, взятого при температуре плавления?

847. Сколько энергии будет затрачено для расплавления свинца массой 10 кг, взятого при начальной температуре 27 °С?

848. Какое количество теплоты затрачено на расплавление 1 т железа, взятого при температуре 10 °С?

849. Свинец объемом 10 см3, взятый при начальной температуре 20 °С, полностью расплавился. Какое количество теплоты было при этом затрачено?

850. На плавление какого металла, взятого при температуре 20 °С, нужно большее количество энергии: на 1 г меди или 1 г серебра? На сколько больше?

851. В каком случае требуется большее количество энергии и на сколько: на плавление 1000 кг железа или 1000 кг алюминия, если и железо, и алюминий взяты при начальной температуре 10 °С?

852. На рисунке 86 изображены графики зависимости температуры от времени для слитка свинца (I) и слитка олова (II) одинаковой массы. Количество теплоты, получаемое каждым телом в единицу времени, одинаково. Определите по графику:
1) У какого слитка температура плавления выше?
2) У какого металла больше удельная теплоемкость?
3) У какого металла больше удельная теплота плавления?
1) у слитка свинца температура плавления выше;
2) удельная теплоемкость олова больше;
3) удельная теплота плавления у олова больше.
853. Нагревают два сосуда: в одном находится 0,2 кг воды при температуре 0 °С, в другом – 200 г снега. Одинаково ли будет повышаться температура в сосудах при одинаковой мощности нагревателя? Постройте график зависимости температуры каждого сосуда от получаемого количества теплоты.

854. Какое количество теплоты потребуется для превращения 10 кг льда в воду при 0 °С?

855. Какое количество теплоты потребуется для превращения 150 кг льда с температурой -8 °С в воду при температуре 0 °С?

856. Рассчитайте количество теплоты, потребное для превращения 20 кг льда при -4 °С в воду при 100 °С.

857. В банке содержится 2 кг воды при температуре 18 °С. Какое количество теплоты отдает вода охлаждающей смеси, в которую погружена банка, если вся вода в банке превращается в лед с температурой 0 °С?

858. В медный калориметр весом 200 г налито 100 г воды при 16 °С. В воду бросили кусочек льда при 0°С весом 9,3 г, который целиком расплавился. Окончательная температура воды после этого установилась 9 °С. Определите на основании этих данных удельную теплоту плавления льда.

859. Какое количество теплоты потребно для расплавления 1 кг железа, взятого при температуре 20 °С?

860. В 5 л воды при температуре 40 °С опустили 3 кг льда. Сколько льда растает?

861. В калориметр налили 0,2 кг воды при температуре 25 °С. Какова будет температура этой воды, если в ней растает 5 г льда?

862. Ледяной калориметр представляет собой массивный куб из льда, внутри которого выдолблено углубление и закрыто толстой крышкой из льда (рис. 87). В такой калориметр положили латунную гирю массой 1000 г, нагретую до 100 °С. Сколько граммов льда растает в этом калориметре к тому моменту, когда гиря остынет до 0 °С?

863. КПД спиртовки 10%. Сколько нужно сжечь спирта в спиртовке, чтобы расплавить 1 кг льда при 0 °С?

864. Сколько требуется сжечь каменного угля в печи, чтобы расплавить 100 т чугуна, взятого при температуре 20 °С, если КПД печи 40%?

865. В водопаде высотой 32 м ежесекундно падает 3,5 м3 воды. Какое количество энергии можно получить в час от этого водопада? Какое количество каменного угля надо сжигать каждый час, чтобы получить то же самое количество энергии?

В каком агрегатном состоянии может находится железо?
б) в твердом и жидком
В) твёрдом, жидком и газообразном Любой вещество может находится в 4 (+ плазма) агрегатных состояниях
железо — в любом состоянии. . а вот Вовкой я не соглашусь .. есть такие вещества которые сублимируются при нагревании …йод например
г) Эфир-свободная материя
Во всех. Всё зависит от т-ры.