Дихромат алюминия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
=3260°C23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,074d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t° пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| 1. |
Идентификация химической продукции |
|
| 1.1. | ||
| 1.1.1. | Техническое наименование: | АММОНИЯ ДИХРОМАТ, аммония двухромовокислый; аммония бихромат; аммоний бихромат; аммоний двухромовокислый; |
| 1.1.2 | Краткие рекомендации по применению (в т.ч. ограничения по применению): |
Аммония дихромат применяется в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности. Окислитель в производстве антрахинона, гидрохинона, бензойной кислоты, искусственной камфоры, красителей, ванилина. Для отбеливания масел, жиров, воска, парафина. Компонент взрывчатых веществ и пиротехнических составов. Для получения соединений хрома (III). Компонент светочувствительного слоя фотоматериалов. Для отбеливания масел, жиров, воска, парафина. Компонент взрывчатых веществ и пиротехнических составов. Для получения соединений хрома (III). Компонент светочувствительного слоя фотоматериалов.
|
| 2. |
Идентификация опасности (опасностей) |
|
| 2.1 | Степень опасности химической продукции в целом: | Класс опасности — 1 |
| 2.2. |
Гигиенические нормативы для продукции в целом в воздухе рабочей зоны: Гигиенические нормативы для продукции в целом в воздухе рабочей зоны: (ПДКр.з. или ОБУВ р.з.) |
ПДК р.з. максимальная разовая — 10 мкг/м3 |
2. 3. 3.
|
Сведения о маркировке (по ГОСТ 31340-07) | |
| 2.3.1. | Описание опасности: |
Символы: «Пламя над окружностью», «Череп и две скрещенные кости», «Сухое дерево и мертвая рыба» Сигнальное слово: «Опасно» Характеристика опасности: «Смертельно при проглатывании», «Смертельно при вдыхании», «При попадании на кожу и в глаза вызывает химические ожоги», «Сильный окислитель; может вызвать возгорание или взрыв», «Может быть смертельным при проглатывании и последующем попадании в дыхательные пути», «Опасность для здоровья человека», «Может вызывать раковые заболевания» |
| 3. |
Информация при перевозках (транспортировании) |
|
| 3.1 | Номер ООН (UN): (в соответствии с рекомендациями ООН по перевозке опасных грузов (типовые правила), последнее издание) | Номер ООН 1439 |
3. 2 2
|
Надлежащее отгрузочное наименование и/или транспортное наименование: | АММОНИЯ ДИХРОМАТ |
| 3.3 | Виды применяемых транспортных средств: | Транспортируют транспортом всех видов в соответствии с правилами перевозки грузов, действующими на транспорте данного вида |
| 3.4 | Классификация опасности груза: (по ГОСТ 19433 и рекомендациям ООН по перевозке опасных грузов) |
По ГОСТ 19433-88 — подкласс 5.1 классификационный шифр 5112 По рекомендация ООН, СМГС, МПОГ — 5.1, классификационный код О2 |
| 3.5 | Транспортная маркировка: (манипуляционные знаки; основные, дополнительные и информационные надписи) | Знак опасности в соответствии с ГОСТ 19433 по чертежу №5 |
3. 6 6
|
Группа упаковки: (в соответствии с рекомендациями ООН по перевозке опасных грузов) | II |
| 3.7 | Информация об опасности при автомобильных перевозках (КЭМ): | |
| 3.8 | Аварийные карточки: (при железнодорожных, морских и др. перевозках) | |
| При железнодорожных перевозках — 501 | ||
| 3.9 |
Информация об опасности при меж-дународном грузовом сообщении: (по СМГС, ADR (ДОПОГ), RID (МПОГ), IMDG Code (ММОГ), ICAO/IАTA (ИКАО) и др. , включая сведения об опасности для окружа-ющей среды, в т.ч. о «загрязнителях моря») , включая сведения об опасности для окружа-ющей среды, в т.ч. о «загрязнителях моря»)
|
Код опасности по СМГС — 50 |
| 4. |
Правила хранения химической продукции и обращения с ней при погрузочно-разгрузочных работах |
|
| 4.1 | Меры безопасности при обращении с химической продукцией | |
| 4.1.1 | Меры безопасности и коллективные средства защиты: (в т.ч. система мер пожаровзрывобезопасно-сти) |
Для химразведки и руководителю работ — ПДУ-3 (в течение 20 минут). Для аварийных бригад — изолирующий защитный костюм КИХ-5 в комплекте с изолирующим противогазом ИП-4М. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. При отсутствии указанных образцов: защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом с патроном КД. Промышленный противогаз малого габарита ПФМ-1, перчатки из дисперсии бутилкаучука, специальная обувь для защиты от нефти и нефтепродуктов. При малых концентрациях в воздухе (при превышении ПДК до 100 раз) — спецодежда, автономный защитный индивидуальный комплект с принудительной подачей в зону дыхания очищенного воздуха с патронами ПЗУ, ПЗ-2, фильтрующий противогазовый респиратор РПГ с патроном КД, фильтрующий респиратор «ФОРТ-П», универсальный респиратор «Снежок-КУ-М». Промышленный противогаз малого габарита ПФМ-1, перчатки из дисперсии бутилкаучука, специальная обувь для защиты от нефти и нефтепродуктов. При малых концентрациях в воздухе (при превышении ПДК до 100 раз) — спецодежда, автономный защитный индивидуальный комплект с принудительной подачей в зону дыхания очищенного воздуха с патронами ПЗУ, ПЗ-2, фильтрующий противогазовый респиратор РПГ с патроном КД, фильтрующий респиратор «ФОРТ-П», универсальный респиратор «Снежок-КУ-М».
|
| 4.1.2 | Меры по защите окружающей среды: |
Просыпания собрать и отправить для утилизации с соблюдением мер пожарной безопасности. Место россыпи изолировать песком, промыть большим количеством воды. Обработать 30% раствором пероксида водорода (гексохломеламин, дихлорамины). Не допускать соприкосновения вещества, промывных вод с нефтепродуктами и другими горючими материалами. Поверхности подвижного состава промыть большим количеством воды, моющими композициями.
|
| 4.1.3 | Рекомендации по безопасному перемещению и перевозке: |
Препарат упаковывают и маркируют в соответствии с ГОСТ 3885. Вид и тип тары: 2-4, 2-6, 2-7, 6-1, 6-4, 11-6 (вкладывается в металлические барабаны типов БТПБ1-25 и БТПБ1-50 массой до 50 кг). Группа фасовки: III, IV, V, VI, VII. Инструкция по упаковкеP002 IBC08 |
| 4.2 | Правила хранения химической продукции | |
| 4.2.1 | Условия и сроки безопасного хранения: (в т.ч. гарантийный срок хранения, срок годности) | Хранить в закрытом помещении, защищать от огня. Отдельно от горючих веществ и восстановителей, |
4. 2.2 2.2
|
Несовместимые при хранении вещества и материалы: | Отдельно от горючих веществ и восстановителей. |
| 4.2.3 | Материалы, рекомендуемые для тары и упаковки: | |
| 4.3 | Меры безопасности и правила хранения в быту: | В быту не используется |
| 5. |
Рекомендации по удалению отходов (остатков) |
|
| 5.1 | Меры безопасности при обращении с отходами, образующимися при применении, хранении, транспортировании и др. |
Не допускать попадания в объекты окружающей среды(водоемы, почву), канализационные коллекторы или систему оборотного водоснабжения.
|
| 5.2 | Сведения о местах и способах обезвреживания, утилизации или ликвидации отходов вещества (материала), включая тару (упаковку): | |
| 5.3 | Рекомендации по удалению отходов, образующихся при применении продукции в быту: | Не применяется |
Реальный ЕГЭ по химии 2018. Задание 30
Реальный ЕГЭ по химии 2018. Задание 30 | Подготовка к ЦТ и ЕГЭ по химии Skip to contentЗадания 30 из реальных КИМов ЕГЭ 2018 по химии
Для выполнения задания используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, кремнезём, нитрит калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.
 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.Для выполнения задания используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: йодид калия, серная кислота, гидроксид алюминия, оксид марганца (IV), нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, оксид фосфора (V), оксид марганца (IV), фторид аммония, нитрат кальция.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: дихромат натрия, серная кислота, йодид натрия, силикат натрия, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, углекислый газ, перманганат калия, фторид аммония, нитрат железа. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.
 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.Для выполнения задания используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора (V), нитрат меди (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.

Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, фтороводород, карбонат аммония, сульфат железа (II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома (III), оксид магния.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, сульфит калия, дихромат калия, серная кислота, гидроксид хрома (III), кремнезём. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, бром, нитрат бария, сульфат аммония, соляная кислота концентрированная, перманганат калия. Допустимо использование водных растворов веществ.

Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, сера, азотная кислота концентрированная, углекислый газ, фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.
 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома (III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.

Ответы:
K
2Cr2O7 + 3KNO2 + 4H2SO4→Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
2Cr
6++6e → 2Cr3+ – окислитель, восстановилсяN
3+–2e → N5+ – восстановитель, окислилсяK
2Cr2O7 + 3K2S + 7H2SO4→Cr2(SO4)3 + 3S + 4K2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
2- –2e → S0 – восстановитель, окислилсяОтвет (доп.): 3K
2S + 4H2SO4→ 4S + 3K2SO4 + 4H2O(сопропорционирование)2KI + MnO
2 + 2H2SO4→ I2 + MnSO4 + K2SO4 + 2H2O
2I
— –2e → I2– восстановитель, окислилсяMn
4+ +2e → Mn2+ – окислитель, восстановилсяОтвет (доп.
 ): 8KI + 5H2SO4→4I2 + H2S + 4K2SO4 + 4H2O
): 8KI + 5H2SO4→4I2 + H2S + 4K2SO4 + 4H2OMnO
2 + 4HCl → MnCl2 + Cl2 +2H2O
2Cl
— –2e → Cl2 – восстановитель, окислилсяMn
4+ +2e → Mn2+ – окислитель, восстановилсяNa
2Cr2O7 + 6NaI + 7H2SO4→ Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановился2I
— –2e → I2 – восстановитель, окислился2KMnO
4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn
7+ +5e → Mn2+ – окислитель, восстановился2Cl
— –2e → Cl2 – восстановитель, окислился2KMnO
4 + KNO2 + 2KOH → 2K2MnO4 + KNO3 + H2O
Mn
7+ +1e → Mn6+ – окислитель, восстановилсяN
3+ –2e → N5+ – восстановитель, окислилсяH
2S + 8HNO3(конц)→ H2SO4 + 8NO2 + 4H2O
S
2- –8e → S6+ – восстановитель, окислилсяN
5+ +1e → N4+ – окислитель, восстановилсяNa
2Cr2O7 + 3H2S + 4H2SO4→Cr2(SO4)3 + 3S + Na2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
2- –2e → S0 – восстановитель, окислилсяОтвет (доп.
 ): H2S + H2SO4→ S + SO2 + 2H2O
): H2S + H2SO4→ S + SO2 + 2H2OK
2Cr2O7 + 6FeSO4 + 7H2SO4→Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяFe
2+ –1e → Fe3+ – восстановитель, окислилсяKClO
3 + Cr2O3 + 4NaOH → KCl + 2Na2CrO4 + 2H2O
Cl
5+ +6e →Cl— – окислитель, восстановился2Cr
3+ –6e → 2Cr6+ – восстановитель, окислилсяK
2Cr2O7 + 3K2SO3 + 4H2SO4→Cr2(SO4)3 + 4K2SO4 + 4H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
4+ –2e → S6+ – восстановитель, окислился2KMnO
4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn
7+ +5e → Mn2+ – окислитель, восстановился2Cl
— –2e → Cl2 – восстановитель, окислилсяNa
2SO3 + Br2 + H2O →Na2SO4 +2HBr
Br
2 + 2e → 2Br— – окислитель, восстановилсяS
4+ –2e → S6+ – восстановитель, окислилсяОтвет (доп.
 ): Br2 + 2KOH →KBr + KBrO + H2O (или KBrO3если нагреваем)
): Br2 + 2KOH →KBr + KBrO + H2O (или KBrO3если нагреваем)Na
2SO3 + Br2 + 2KOH→Na2SO4 +2KBr + h3OS + 6HNO
3(конц)→H2SO4 + 6NO2 + 2H2O
S
0 –6e → S6+ – восстановитель, окислилсяN
5+ +1e → N4+ – окислитель, восстановился2H
2O2 + Cr2O3 + 4KOH → 2K2CrO4 + 5H2O (при нагревании)
2O
— +2e → 2O2- – окислитель, восстановился2Cr
3+ –6e → 2Cr6+ – восстановитель, окислился2Na
2CrO4 + 6NaBr + 8H2SO4→ Cr2(SO4)3 + 3Br2 + 5Na2SO4 + 8H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановился2Br
— –2e → Br2 – восстановитель, окислился
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2020 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaBocLsmshgNWlDqsoZh9n-» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Химия
Акватабс/дезинфицирующие таблетки (60 шт/ 8,68 г)
Алюминий сернокислый очищенный
Алюминий сульфат (сернокислый)
Алюминий сульфат (сернокислый) Им
Аминат А (кан.
 22 кг)
22 кг)Аминат ДС (22кг)
Аминат ДС (5 кг)
Аммиак водный (28кг)
Аммиак водный чда (канистра 9,0 кг)
Аммиак водный чда (склянка 0,9 кг)
Аммиак технический (0,5 л)
Аммоний бикарбонат(углекислый кислый) (25кг)
Аммоний надсернокислый (персульфат)
Аммоний сернокислый тех 50
Аммоний сернокислый хч (сульфат) (25 кг)
Аммоний хлористый (25 кг)
Аммоний хлористый технич.
 25 кг
25 кгАммоний хлористый ч ГОСТ 3773-72 (25 кг)
Ангидрид хромовый тех марка А (50 кг)
Арквад МСВ-50
Ацесульфам К
Ацетилен растворенный технический, бал. 40л (5,0 кг) Имп
Барий углекислый тех.(25кг)
Бета-Каротин 04012
Биомол КМ-К
Биоочиститель “Septic Gobbler”
Биопрепарат БАКТИ-БИО 9500
Бура десятиводная (25 кг) натрий тетраборнокис
Бура пятиводная (натрий тетраборнокислый)
Вазелин мед.

Гербицид “Тайфун” 20л
Диэтилдитиокарбамат натрия
Диэтиленгликоль (ДЭГ) марки А
Жавель син (№300)
Жавель солид (№320)
Железо (11) сернокислое (сульфат, купорос)
Железо карбонильное осч 13-2
Железо сернистое (сульфид)
Жидкость ГКЖ 136-41
Жидкость ГКЖ-11Н
Идитол (Смола СФ-0112)
Изобутиловый спирт Ч
Изопропиловый спирт (бочки 160кг)
Калий азотнокислый (нитрат)
Калий азотнокислый нитрат (Норвегия)
Калий двухромовокислый (бихромат) в/с
Калий железистосинеродистый (25 кг)
Калий марганцевокислый ч (50 кг)
Калий монофосфат (фосфорнокислый 1-з) (ф.
 -25 кг)
-25 кг)Калий сернокислый (сульфат) 25кг
Калий сорбиновокислый гранулы(сорбат) (25 кг),пищевой Е202
Калий сорбиновокислый порошок (сорбат) (25 кг),пищевой Е202
Калий углекислый (карбонат)25 кг
Калий фосфорнокислый двухзамещенный (25 кг) чда
Калий фосфорнокислый двухзамещенный 3*водн.
 чда
чдаКалий фосфорнокислый однозамещенный (25 кг)
Калий Хлористый марка «Мелкий белый»
Калий хлористый пищевой
Калия бихромат тех I сорт
Калия гидроокись техн.чешуиров. (25 кг)
Калия хлорид техн. (25кг)
Кальций гипохлорит (50 кг)
Кальций монофосфат
Кальций нитрат (25 кг)
Кальций нитрат (25 кг) Норвегия
Кальций сульфат
Кальций углекислый(карбонат) пищевой Е170 (Италия)
Кальций хлористый 2-водный (25 кг)
Кальций хлористый гран.
 техн. 98 %-й (1/25кг)
техн. 98 %-й (1/25кг)Кальций хлористый жидкий (кан 36кг)
Кальций хлористый жидкий (кан 36кг)
Кальций хлористый пищевой гранул. (1/25 кг)
Камедь гуаровая (1/25 кг)
Камедь ксантановая (1/25 кг)
Камедь рожкового дерева
Канифоль сосновая ВС ГОСТ 19113-84 (240 кг)
Карбамид
Карбамид (мешки с маркировкой по 50 кг)
Карбид кремния черный 53 С F20
Карбюризатор д/у (ф.
 15 кг)
15 кг)Карнал 2110 (25 кг)
Катамин А,Б
Катионит КУ-2-8 ЧС ГОСТ 20298-74
Катионит КУ-2-8 (Na+) ГОСТ 20298-74
Катионит КУ-2-8 (Н+) ГОСТ 20298-74
Катионит сильнокислый “Tulsion T-42″ (Na)
Кизельгур Extra 20 кг (мел) FP1 кг
Кизельгур Media 20 кг (ср) FP3 кг
Кизельгур Super 20 кг (кр) FW14 кг
Кислота аскорбиновая, имп.

Крахмал картофельный (25кг)
Крахмал кукурузны (25кг)
Литий углекислый ч (10 кг)
Магнезит
Магнезия “Ньювель”
Магний азотнокислый нитрат (1/25 кг)
Магний оксид
Магний сернокислый (сульфат) KRISTA MGS
Магний сернокислый (сульфат) Польша
Магний хлористый (хлорид) *6-водный чда
Марганец сернокислый (25 кг)
Марганца двуокись (82%)
Масло вазелиновое (бочка 164 кг)
Медный купорос (25 кг)
Медь двухлористая ч (25,0 кг)
Медь сернокислая 5-водная
Металин Т10
Металин Т20
Метилен хлористый (дихлорметан) (250 кг)
Монопропиленгликоль (215кг)
Моноэтиленгликоль (концентрат) 200л
Набор солей для приготовления маломинерализованной питьевой воды из дистиллята ТУ 2643-09-05761270-
Натр едкий (раствор 30 %)
Натрий азотистокислый (50 кг) техн.

Натрий азотистокислый (нитрит натрия) 50 кг(пищевой)
Натрий азотнокислый техн.,(селитра натриевая), (50
Натрий азотнокислый техн.,(селитра натриевая), (50
Натрий азотнокислый техн.1/50
Натрий азотнокислый ч
Натрий бензойнокислый (бензоат) пищ. (1/25 кг)
Натрий бикарбонат (сода пищевая)
Натрий бикарбонат (1/25 кг) (сода пищевая) без антислеживателя
Натрий бисульфат (натрий сернокислый кислый)
Натрий гипохлорит
Натрий глутамат (25 кг)
Натрий двухромовокислый (бихромат) (1/25кг)
Натрий додецил сульфат (лаурил сульфат) 70%
Натрий кремнефтористый (50 кг)
Натрий лактат (кан 25 кг)
Натрий лимоннокислый (цитрат) пищевой (25 кг)
Натрий метабисульфит ч, пищевой Е223
Натрий метасиликат 5-водн (25 кг)
Натрий пиросульфит (метабисульфит) ГОСТ 10575-76
Натрий полифосфат(гексаметафосфат) имп.
 ф.25кг
ф.25кгНатрий сернистокислый б/в техн. фото
Натрий сернокислый б/в, техн
Натрий тиосульфат (меш 25 кг)
Натрий триполифосфат (25кг) пищ.
Натрий уксуснокислый (1/25кг)
Натрий фосфорнокислый 2-замещенный (30 кг)
Натрий фтористый технический
Натрий хлористый техн.

Натрий эриторбат (изо-аскорбат) пищ.(ф.-25 кг)
Неонол АФ 9-12
Неостомазан 5л
Нигрозин спирторастворимый
Окись амина
Окись хрома пигментная ОХП-1
Окись цинка (25 кг)
Олигоэфиракрилат марки МГФ-9 сорт 1
Осушитель (влагопоглотитель) 1000 гр.

Осушитель (КСМГ) в ткан. мешке с виз контролем
Очиститель “Экстра-Драй” от накипи, 5л
Очиститель К-70 (0,5л)
Парафин техн (23кг)
Парафин технический (25кг)
Пенообразователь “ПБ-Формула-2012″
Перекись бензоила (25 кг)
Перекись водорода 35 % пищевая (24 кг)
Перекись водорода 35 % техническая
Перекись водорода 35 % техническая (24кг)
Перекись водорода 35-38%конц.
 медицинская (11,4 кг)
медицинская (11,4 кг)Перхлорэтилен технич., 330кг/боч (Франция)
Перхлорэтилен технич., 330кг/боч (Чехия)
Препарат Мажеф (ф.25 кг)
Противоморозная добавка Бетофрост М-15 (25кг)
Противоморозная добавка Ниткал 30%
Протиморозная добавка Реотех
Рофамин-Т (октадециламин стеариновый, флотамин)
Сал Карб жидкий (кан.
 25кг)
25кг)Свинец порошок ПС-1
Селитра аммиачная (1000кг)
Селитра аммиачная (мешки с маркировкой по 50 кг)
Селитра калиевая техническая, 50 кг
Сера техническая (ГОСТ 1274-93) (30 кг)
Силикагель индикаторный ГОСТ- 898475 (25кг)
Силикагель КСКГ ГОСТ 3956-76 (15 кг)
Силикагель КСКГ ГОСТ 3956-76 (20 кг)
Силикагель КСМГ (25 кг)
Сода кальцинированная (25 кг)
Сода кальцинированная 600 гр.
 (20 шт/кор)
(20 шт/кор)Сода кальцинированная 700 гр.(20 шт/кор)
Сода каустическая (гранулир.) 25кг Россия
Сода каустическая (гранулированная) 25 кг Китай
Сода каустическая (натр едкий, р-р 49 %) (30кг)
Соль весовая 3 помол (30 кг)
Соль таблетированная (25кг)
Солюбор ДФ удобрение (1/25 кг)
Сульфат никеля тех (меш 25кг)
Сульфат хрома
Сульфонол порошок (12,5кг)
Сульфонол раствор 40%
Сульфоуголь (1/30 кг)
Суперфосфат (биг-бэг 500кг)
Тальк технический (25 кг)
Тальк фармацевтический (25кг)
Титан двуокись пищевой (25кг)
Трилон-Б (25кг)
Тринатрийфосфат (25 кг)
Трихлорпропилфосфат
Уголь активированный МИУ-С.
 1:ФРАКЦИЯ 2-5 ММ
1:ФРАКЦИЯ 2-5 ММУголь активный древесный дробленый БАУ-А
Удобрение Кристалон (25кг)
Удобрение Суперба (25кг)
Уранин А
Фенилфосфорной кислоты динатриевая соль *2-вод
Химический препарат СФ-3
Хладагент R-134А (13,62кг)
Хладон 114 В2
Хладон R 22 (1/13,6)
Хладон R 227 ЕА
Хлорамин (фас.
 14 пак по 1 кг)
14 пак по 1 кг)Хлорамин (фас. 50 пак по 300 гр)
Хлоргексидин
Хлорилонг (5кг)
Хлормикс (таблетки) №300
ХПК (бихроматная окисляемость воды)
Хромовый дубитель низкоосновный (сульфат хрома)
Цинк Фосфорнокислый
Цинк фосфорнокислый 1-зам.
 (монофосфат) техн. ГОСТ 16992-78
(монофосфат) техн. ГОСТ 16992-78Цинк хлористый техн.ГОСТ 7345-78
Черные индикаторные чернила 7HF аэрозоль 400 мл
Электроклинер (жидкость д/промывки электрод) 10 л
Электролит калиево-литиевый щелочной (кан 28 кг)
Электролит калиево-литьевый жидкий (14 кг)
Электролит кислотный серный (29,0 кг)
Электролит кислотный серный (5,0 л)
Эмульсол НГЛ -205 (210л)
Эмульсол ЭКС-А
Этилацетат (180кг)
Эфир диэтиловый ЧДА (1,0 л) 0,65 кг
Исследование адсорбционных закономерностей анионов на поверхности красного шлама Текст научной статьи по специальности «Промышленные биотехнологии»
Серия 3. Естественные науки. Исследование адсорбционных закономерностей анионов на поверхности
Естественные науки. Исследование адсорбционных закономерностей анионов на поверхности
красного шлама
Терехова М.В., к.х.н. Русакова С.М.
Университет машиностроения 8(495)223-05-23, [email protected] Аннотация. В работе исследована возможность красного шлама (отход алюминиевого производства) адсорбировать фосфат-, молибдат и дихромат-ионы из водных растворов. Изучена зависимость адсорбции исследуемых ионов от рН и начальной концентрации ионов в анализируемом растворе. Разработан способ активации поверхности красного шлама.
Ключевые слова: красный шлам, адсорбция, молибдат-ионы, фосфат-ионы, дихромат-ион ы
Любое промышленное производство, особенно металлургия, сопряжено с экологическими рисками, среди которых преобладают выбросы загрязняющих веществ в атмосферу, а также образование и складирование вредных отходов. Не является исключением и алюминиевое производство.
Не является исключением и алюминиевое производство.
При производстве алюминия по методу Байера (процесс получения чистого оксида алюминия) образуется красный бокситовый шлам. На каждую тонну полученного оксида алюминия приходится в среднем от 360 до 800 кг шлама. Из-за отсутствия эффективных технологий переработки основная масса красных шламов не используется и складируется в специальных шламохранилищах, которые оказывают отрицательное воздействие на окружающую среду. Площадь одного такого шламохранилища составляет обычно 100-200 га, что практически равно территории алюминиевого завода. Несмотря на то, что шламохранилища обустраивают таким образом, чтобы содержащиеся в отходах щелочи не могли проникнуть в грунтовые воды, они в любом случае представляют угрозу как для окружающей среды, так и непосредственно для организма человека.
Вопреки устоявшемуся стереотипу, многие специалисты сегодня не считают красный шлам отходом, так как он содержит значительное количество железа и алюминия, и может служить сырьем для получения различных продуктов. В России красных шламов накопилось более 100 млн. т. Поэтому вопросы его использования в качестве сырья, а также полной его утилизации с каждым днем становятся все более актуальными. Благодаря наличию в составе красного шлама оксидов алюминия, железа, титана, кремния и др. одним из перспективных путей утилизации данного отхода является создание на его основе сорбентов для очистки различных объектов от загрязняющих веществ.
В России красных шламов накопилось более 100 млн. т. Поэтому вопросы его использования в качестве сырья, а также полной его утилизации с каждым днем становятся все более актуальными. Благодаря наличию в составе красного шлама оксидов алюминия, железа, титана, кремния и др. одним из перспективных путей утилизации данного отхода является создание на его основе сорбентов для очистки различных объектов от загрязняющих веществ.
Исследуемые в данной работе молибдат-, фосфат-, дихромат-ионы являются одними из распространенных и представляющих экологическую опасность веществ.
Молибден является одним из загрязняющих объектов водных сред. В поверхностных водах он находится в основном в форме молибдат-иона. Загрязнение окружающей среды обусловлено как потерей молибдена на разных этапах переработки сырья, так и выносом тяжелых металлов из отвалов рудника. При этом возможно отравление не только работающего персонала, но и жителей близлежащих территорий.
Проблема выбросов хрома в окружающую среду становится все более актуальной. Однако главный источник поступления антропогенного хрома — обработка металлов. Неконтролируемые выбросы представляют большую опасность загрязнения поверхностных вод относительно токсичной формой Сгв+.
Фосфаты широко используются в сельском хозяйстве для удобрения почв. Вынос растворимых форм фосфора в грунтовые воды происходит регулярно, поэтому проблема очистки вод от растворимого фосфора всегда остается актуальной.
В зарубежной и отечественной литературе накоплен экспериментальный материал по данной проблеме, который требует проведения систематических исследований в этом
Серия 3. Естественные науки.
направлении, что позволит детально изучить адсорбционные свойства красного шлама и выявить оптимальные условия для адсорбции на нем анионов[1-8].
Качественный и количественный состав красных шламов значительно отличается и зависит от состава исходного сырья и технологии его переработки, поэтому созданию эффективных адсорбентов на основе отходов алюмосиликатного производства должны предшествовать экспериментальные исследования адсорбционных закономерностей конкретных образцов красного шлама.
Цели работы
• Получение активированной формы красного шлама путем промывки его соляной кислотой.
• Исследование возможности использования красного шлама для адсорбции фосфат-, мо-либдат- и дихромат-ионов из водных растворов;
• Определение влияния рН и концентрации в растворе ионов на эффективность их адсорбции.
Объект исследования
В данном исследовании использовался красный шлам, являющийся отходом переработки алюминийсодержащего сырья на Уральском алюминиевом заводе (УАЗ). Компонентный и минеральный состав красного шлама (после предварительной обработки известью, промывки и фильтрации) приведен в таблице 1. Анализ был выполнен в лаборатории ОП ООО «РУСАЛ-ИТЦ» в г.С. Петербург.
Таблица 1.
Состав красного шлама
Компонентный состав Минеральный состав
Компонент Содержание, % Минерал Содержание, %
А17Оя 11.9 Диаспор 0.43
Ре203 40.9 Алюмогетит 1.85
$ю2 9.5 Гематит 31.19
СаО 21 Анатаз 0.59
тю2 4.1 Кальцит 5.27
Ыа20 0.О 0.4 Шамозит 12.93
к2о 0.15 Перовскит 5.97
МпО 0.25 ГАСН 2.03
Р. о. 0.68
шш 11.3
Методика проведения эксперимента
Активацию красного шлама проводили в следующей последовательности: шлам дважды промывали бидистиллированной водой и обрабатывали декантацией раствором соляной кислоты с концентрацией 0,1 моль/л, при этом уровень рН промывных вод снизился с 12 до 8. Далее образцы отфильтровывали и сушили в муфельной печи при температуре 110° С. Полученные образцы измельчали в ступке до порошкообразного состояния и без дальнейших изменений использовали в последующих экспериментах.
Адсорбционные исследования проводили при разной начальной концентрации исследуемых анионов в растворе (таблица 2.) при постоянной концентрации фонового электролита №С1 с концентрацией 0,1 моль/л. Масса адсорбента во всех случаях была равной 1 грамм, время контакта его с раствором составляло 1 час при непрерывном перемешивании с исполь-
зованием магнитной мешалки (частота вращения 350 об/мин).
Таблица 2.
Начальные концентрации исследуемых анионов
Исследуемый ион Начальная концентрация аниона, моль/л
МоО|» 0,0015 0,002 0.004
0,0015 0,002 0,0025 0,003
РОГ 0,0015 0,025 0.005
Эксперименты проводили при различных значениях рН (в диапазоне от 3 до 10). Необходимого уровня рН раствора достигали добавлением концентрированной соляной кислоты, значения рН измеряли с помощью прибора рН-метр Эксперт-001.
Для получения кривых адсорбции использовали метод отдельных навесок. Концентрацию анионов в растворах определяли по методикам, изложенным в [9]. Измерения оптической плотности испытуемых растворов по отношению к нулевому раствору проводили на спектрофотометре СФ-56.
Величину адсорбции определяли по разности начальной и конечной концентраций ионов, отнесенной к единице массы адсорбента и вычисляли по формуле:
р _ Сисх.~С-нач.
т
где: Г — адсорбция, моль/г-л, СИСх- — концентрация хромат-ионов в исходном растворе, моль/л, Скон. — концентрация хромат-ионов в растворе после адсорбции, моль/л, ш — масса адсорбента, г.
Результаты и их обсуждение
Экспериментально изучена адсорбция фосфат-, молибдат- и дихромат-ионов на активированном красном шламе при различных значениях начальных концентраций раствора. Установлено, что адсорбционная способность красного шлама значительно зависит от значений рН раствора (рисунки 1-3). Очевидно, что адсорбция этих анионов наиболее эффективна в кислой среде, а с увеличением рН она уменьшается. Так, при значении рН больше 5 удаление анионов из раствора незначительно.
Из рисунков 1 и 2 видно, что максимальная адсорбция достигается при рН=4. Предельная адсорбция не зависит от рН и при значении меньше 4 практически не изменяется. На рисунке 3 видно, что при значении рН больше 10 удаление фосфатов из раствора происходит незначительно и наибольшее значение адсорбции наблюдается при рН в диапазоне 3-4.
Рисунок 1. Адсорбция дихромат-ионов на красном шламе от рН при разных начальных
концентрациях раствора: _1 — 0,003; 2 — 0,0025; 3 — 0,002; 4 — 0,0015 моль/л_
Г моль/г*л
0.0015 —
0.0010
0.0005
Рисунок 2. Зависимость адсорбции молибдат-ионов на активированном красном шламе от рН при разных начальных концентрациях раствора: 1 — 0,004; 2 — 0,002; 3 — 0,0015 моль/л Г моль/г-л-
Рисунок 3. Зависимость адсорбции фосфат-ионов на активированном красном шламе от рН при разных начальных концентрациях раствора: 1 — 0,005; 2 — 0,0025; 3 — 0,0015 моль/л
Выводы
• С увеличением рН адсорбция анионов из растворов уменьшается.
• Оптимальное значение рН для максимальной адсорбции анионов на красном шламе находится в диапазоне от 3 до5.
• С увеличением равновесной концентрации анионов в исходном растворе их адсорбция возрастает.
• Для описания адсорбционных закономерностей применима кислотно-основная модель.
• Результаты экспериментального исследования адсорбционной способности активированного красного шлама по отношению к фосфат-, молибдат- и дихромат-ионам показывают
возможность утилизировать отходы глиноземного производства УАЗ, создавая на их основе сорбенты для очистки водных объектов.
Литература
1. Ahmed M. Yousif, Michael Rodgers, Eoghan Clifford. Studying the Adsorption Properties of Modified Red Mud towards Phosphate Removal from its Solutions. — International Journal of Environmental Science and Development. — 2012. Vol. 3, No. 4.
2. Jing Chenl, Zhaokun Luan. Enhancing phosphate removal by coagulation using polyelectro-lytes and red mud. — Fresenius Environmental Bulletin . — 2010. Vol. 19, No. 10.
3. Goldberg S., Johnston C.T. Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements, vibrational spectroscopy, and surface complexation modeling // Journal of Colloid and Interface Science. 2001. V. 234. P. 204-216.
4. Sara J. Palmer, Mitchell Nothling, Kathleen H. Bakon, Ray L. Frost. Thermally activated sea-water neutralised red mud used for the removal of arsenate, vanadate and molybdate from aqueous solutions // Journal of Colloid and Interface Science. 2010. V. 342. P. 147-154.
5. Артамонова И.В., Горичев И.Г., Лайнер Ю.А., Гололобова Е.А., Курмышева А.Ю., Терехова М.В. / Взаимодействие оксидов, оксигидроксидов и гидроксидов алюминия с растворами электролитов // Университет машиностроения. Москва, 2012.
6. Адамсон А. Физическая химия поверхностей. — М.: Мир, 1979. С. 506-590.
7. Русакова С.М., Горичев И.Г., Артамонова И.В., Забенькина Е.О. / Очистка вод с помощью оксида титана (IV) // Экология промышленного производства. 2010. № 1. С. 28-31.
8. ГОСТ 17.4.1.02-83. Охрана природы. Почвы. Классификация химических веществ для контроля загрязнения. -М.: Госстандарт, 1983.
9. Марченко 3. Фотометрическое определение элементов: Пер. с польск./ Под ред. Ю.А. Зо-лотова. — М.: Мир, 1971.- 502 с.
Заказные реактивы — реактив фишера, реактив несслера
Продукция заказного ассортимент
Соединение алюминия
| Наименование реактива | НТД | Квалификация | Код ОКП |
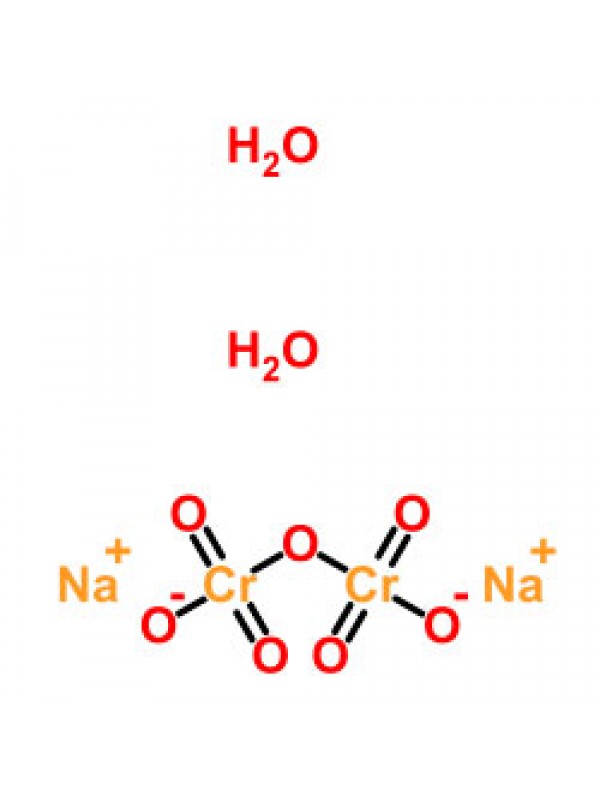
| Алюминий дихромат водный | ТУ 6-09-02-50-88 | Ч | 2621260101 |
| Алюминий метаванадат 1-водный | ТУ 6-09-02-412-86 | Ч | 2621260061 |
Соединения аммония
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Аммоний гексахлорстаннат (IV) | ТУ 6-09-02-186-85 | ХЧ | 2621160463 |
| Аммоний гексахлорстаннат (IV) | ТУ 6-09-02-186-85 | Ч | 2621160461 |
| Аммоний йодат | ТУ 6-09-02-160-85 | Ч | 2621160201 |
| Аммоний-ванадий (II) сульфат (2:1:2) 6-водный | ЛМ 6-09-02-82-90 | 2621161037 | |
| Аммоний-кадмий йодид (2:1:4) 2-водный | ТУ 6-09-02-320-89 | Ч | 2621160241 |
| Аммоний-кадмий сульфат (2:1:2) 6-водный | ТУ 6-09-02-264-89 | ХЧ | 2621160253 |
| Аммоний-кадмий сульфат (2:1:2) 6-водный | ТУ 6-09-02-264-89 | Ч | 2621160251 |
| Аммоний-магний сульфат (2:1:2) 6-водный | ТУ 6-09-02-270-88 | ЧДА | 2621210042 |
| Аммоний-цинк сульфат (2:1:2) 6-водный | ТУ 6-09-02-299-83 | ХЧ | 2621161003 |
| Аммоний-цинк сульфат (2:1:2) 6-водный | ТУ 6-09-02-299-83 | Ч | 2621161001 |
Соединения бария
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Барий бромат 1-водный | ТУ 6-09-02-182-85 | Ч | 2621240101 |
| Барий дихромат 2-водный | ТУ 6-09-02-445-87 | Ч | 2621240131 |
| Барий йодид 2-водный | ТУ 6-09-1481-85 | ХЧ | 2621240183 |
| Барий йодид 2-водный | ТУ 6-09-1481-85 | Ч | 2621240181 |
| Барий молибдат | ТУ 6-09-02-192-85 | Ч | 2621240241 |
| Барий ортованадат | ТУ 609-02-78-84 | ХЧ | 2621240603 |
| Барий пероксид | ТУ 6-09-5295-86 | Ч | 2611330011 |
| Барий пероксид | ТУ 6-09-5295-86 | ЧДА | 2611330012 |
Соединения ванадия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Ванадиевая кислота мета | ТУ 6-09-02-128-85 | ХЧ | 2612290053 |
| Ванадиевая кислота мета | ТУ 6-09-02-128-85 | Ч | 2612290051 |
| Ванадий (III) оксид | ТУ 6-09-02-390-85 | Ч | 2611210101 |
| Ванадий (IV) оксид | ТУ 6-09-02-243-88 | Ч | 2611210111 |
| Ванадий (IV) оксид фторид (1:1:2) 3-водный | ТУ 6-09-02-230-89 | Ч | 2622130021 |
Соединения висмута
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Висмут (III) гидроксид | ТУ 6-09-02-155-85 | Ч | 2611490071 |
| Висмут (III) гидроксид | ТУ 6-09-02-155-85 | ЧДА | 2611490072 |
| Висмут (III) гидротартрат 2-водный | ТУ 6-09-02-197-86 | ХЧ | 2634520203 |
| Висмут (III) гидротартрат 2-водный | ТУ 6-09-02-197-86 | Ч | 2634520201 |
| Висмут (III) дихромат оксид (2:1:2) | ТУ 6-09-02-297-88 | Ч | 2624240071 |
| Висмут (III) метаборат | ТУ 6-09-02-164-86 | Ч | 2624240041 |
| Висмут (III) оксалат 4-водный | ТУ 6-09-02-296-88 | Ч | 2634220121 |
| Висмут (IV) оксид | ТУ 6-09-02-210-85 | Ч | 2611210171 |
| Висмут (IV) оксид | ТУ 6-09-02-210-85 | ЧДА | 2611210172 |
| Висмут ортофосфат | ТУ 6-09-02-132-89 | Ч | 2624240261 |
| Висмут (III) сульфид | ТУ 6-09-02-255-87 | Ч | 2624240151 |
| Висмут (III) формиат | ТУ 6-09-02-1-93 | Ч | 2634212241 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-282-88 | ОСЧ.13-3 | 2624240244 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-392-85 | ХЧ | 2624240233 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-392-85 | Ч | 2624240231 |
| Висмут (III) хлорид | ТУ 6-09-02-189-86 | ХЧ | 2624240223 |
Соединения железа
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Железо (II) бромид | ТУ 6-09-02-218-89 | Ч | 2622210071 |
| Железо (III) бромид 4-водный | ЛМ 6-09-02-67-90 | 2622210087 | |
| Железо (III) медь (II) оксид (2:1:4) | ТУ 6-09-02-49-88 | Ч | 2611210261 |
| Железо (III) никель (II) оксид (2:1:4) | ТУ 6-09-02-277-93 | Ч | 2611211421 |
| Железо (III) хромат 1-водный | ТУ 6-09-02-236-88 | Ч | 2622210421 |
Жидкость тяжелая КК-2,6
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Жидкость тяжелая КК-2,6 | ТУ 6-09-02-424-87 | Ч | 2638430011 |
Соединения иода
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Йод (V) оксид | ТУ 6-09-5264-85 | Ч | 2611220031 |
| Йод (V) оксид | ТУ 6-09-5264-85 | ЧДА | 2611220032 |
Соединения кадмия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кадмий бромид 4-водный | ТУ 6-09-02-481-89 | Ч | 2623210071 |
| Кадмий гексафторосиликат 6-водный | ТУ 6-09-02-209-85 | Ч | 2623210181 |
| Кадмий гидроксид | ТУ 6-09-02-187-86 | Ч | 2611490111 |
| Кадмий метаванадат | ТУ 6-09-02-215-92 | Ч | 2623210091 |
| Кадмий метасиликат | ТУ 6-09-02-403-86 | Ч | 2623210171 |
| Кадмий молибдат для монокристаллов | ТУ 6-09-02-358-89 | ХЧ | 2623210653 |
| Кадмий пированадат | ТУ 6-09-02-70-89 | Ч | 2623210521 |
| Кадмий формиат 2-водный | ТУ 6-09-02-285-88 | Ч | 2634210571 |
Соединения калия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Калий гептамолибдат 10-водный | ТУ 6-09-02-52-88 | Ч | 2621130671 |
| Калий йодид для анализа органических перекисей | ТУ 6-09-02-244-90 | ХЧ | 2621130403 |
| Калий периодат | ТУ 6-09-02-364-99 | Ч | 2621130441 |
| Калий периодат | ТУ 6-09-02-364-99 | ЧДА | 2621130442 |
| Калий-кобальт (II) 10-ванадат (2:2:1) 16-водный | ТУ 6-09-02-24-85 | Ч | 2621131711 |
| Калий-медь йоднокислый | ТУ 6-09-02-83-84 | Ч |
|
| Калий-медь (II) сульфат (2:1:2) 6-водный | ТУ 6-09-02-305-88 | Ч | 2621130631 |
| Калий метаванадат | ТУ 6-09-02-193-99 | Ч | 2621130191 |
| Калий-никель (II) декаванадат (2:2:1) 17-водный | ТУ 6-09-02-25-87 | Ч | 2621131761 |
| Калий-никель (II) сульфат (2:1:2) 6-водный | ТУ 6-09-02-304-88 | ХЧ | 2621130773 |
Соединения кальция
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кальций бромат 1-водный | ТУ 6-09-02-278-93 | Ч | 2621220081 |
| Кальций йодид водный | ТУ 6-09-02-188-85 | Ч | 2621220181 |
| Кальций метаванадат 4-водный | ТУ 6-09-02-232-85 | Ч | 2621220091 |
| Кальций ортованадат | ТУ 6-09-02-447-87 | ХЧ | 2621220673 |
Соединения кобальта
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кобальт (II) амидосульфат 4-водный | ТУ 6-09-02-61-88 | Ч | 2622220391 |
| Кобальт (II) метаванадат водный | ТУ 6-09-02-258-89 | Ч | 2622220071 |
| Кобальт молибдат для монокристаллов | ТУ 6-09-02-362-89 | ХЧ | 2622220693 |
| Кобальт хлористый 6-водный | ГОСТ 4525-77 | ЧДА | 2638420252 |
| Кобальт хлористый 6-водный | ГОСТ 4525-77 | Ч | 2622220191 |
Соединения магния
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Магний амидосульфат 3-водный | ТУ 6-09-02-179-86 | Ч | 2621210301 |
| Магний метаванадат | ТУ 6-09-02-10-93 | Ч | 2621210633 |
| Магний ортованадат | ТУ 6-09-02-324-89 | ХЧ | 2621210703 |
Соединения меди
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Медь (I) бромид | ТУ 2622-591-00205087-2004 | Ч | 2622240221 |
| Медь (I) бромид | ТУ 2622-591-00205087-2004 | ЧДА | 2622240222 |
| Медь (II) бромид | ТУ 6-09-02-428-87 | Ч | 2622240091 |
| Медь (II) иодат (паста) | ТУ 6-09-02-573-2000 | ||
| Медь (II) ортованадат 3-водный | ТУ 6-09-02-64-89 | Ч | 2622240081 |
| Медь (I) сульфид | ТУ 6-09-02-555-95 | Ч | 2622240301 |
Соединения натрия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Натрий висмутат | ТУ 6-09-02-449-87 | ЧДА | 2621120222 |
| Натрий дигидроортопериодат | ТУ 6-09-02-276-88 | Ч | 2621121501 |
| Натрий метаванадат 2-водный | ТУ 6-09-02-151-88 | Ч | 2621120191 |
| Натрий метаванадат 2-водный | ТУ 6-09-02-151-88 | ЧДА | 2621120192 |
| Натрий селенистокислый | ТУ 6-09-17-209-88 | Ч | 2621120681 |
Соединения никеля
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Никель адипат | ТУ 6-09-02-315-89 | Ч | 2634220891 |
| Никель амидосульфат 4-водный электролит 55%-ный раствор | ТУ 6-09-02-554-99 |
|
|
| Никель (II) бромид | ТУ 6-09-02-257-87 | Ч | 2622230151 |
| Никель (II) гексафторосиликат 6-водный | ТУ 6-09-02-432-87 | Ч | 2622230251 |
| Никель (II) йодат 4-водный | ТУ 6-09-02-199-85 | Ч | 2622230231 |
| Никель (II) йодид | ТУ 6-09-02-438-87 | Ч | 2622230171 |
| Никель (II) метасиликат водный | ТУ 6-09-02-148-89 | Ч | 2622230241 |
| Никель (II) перхлорат 6-водный | ТУ 6-09-02-118-86 | Ч | 2622230491 |
| Никель (II) формиат 2-водный | ЛМ 6-09-02-3-88 | Ч | 2634212257 |
| Никель (II) фторид | ТУ 6-09-02-239-88 | Ч | 2622230551 |
Соединения олова
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Олово (II) йодид | ТУ 6-09-02-146-85 | Ч | 2623230031 |
| Олово (IV) йодид | ТУ 6-09-02-163-85 | ХЧ | 2623230143 |
| Олово (IV) йодид | ТУ 6-09-02-163-85 | Ч | 2623230141 |
Реактив Несслера K
2HgI4• KOH или K2HgI4• NaOH ТУ 6-09-2089-77 Внешний вид: раствор бледно-желтого цвета, разлагающийся на свету.Применение: в лабораторной практике.
Класс опасности 6, подкласс 6.1, классификационный шифр 6162, серийный номер ООН 1643.
| Показатели качества | ЧДА (2638420122) |
| Показатель цветности | ≤ 4 |
| Чувствительность к иону NH4 | выдерживает испытание |
Гарантийный срок хранения 3 года.
Применение: в лабораторной практике для количественного определения воды объемным методом.
Поставляется в виде двух растворов:
Раствор II – раствор Йода в метиловом спирте.
Класс опасности 3, подкласс 3.2, классификационный шифр 3222, серийный номер ООН 1230.
| Показатели качества | ЧДА (264000) |
| Прозрачность | выдерживает испытание |
| Титр реактива Фишера по воде | ≥ 3,2 мг воды в 1 см3 реактива |
| Определение концентрации йода в растворе II | выдерживает испытание |
| Определение концентрации активных компонентов в растворе I | испытание выдерживает |
Гарантийный срок хранения 6 месяцев.
Внешний вид: насыщенный раствор комплексной ртутно-йодистой соли
Применение: в минералогии при классификации концентратов по удельному весу, при технической обработке горных пород (отделением органической части от неорганической).
Физико — химические данные: М.В. 786,41
Класс опасности 6, подкласс 6.1, классификационный шифр 6163, серийный номер ООН 1643.
| Показатели качества | Ч (2638420111) |
| Плотность при t=200C | 3.17-3.20 г/см3 |
Гарантийный срок хранения 3 года.
Внешний вид: насыщенный раствор ртутно-йодистой соли бария от желто-оранжевого цвета до красного.
Применение: предназначен для разделения минералов по удельному весу при анализе горных пород.
Физико — химические данные: М.В. 845,548
Класс опасности 6, подкласс 6.1, классификационный шифр 6163, серийный номер ООН 1643.
| Показатели качества | ЧДА (2638420111) |
| Плотность при t=200C | 3.4-3.5 г/см3 |
Гарантийный срок хранения 1 год.
Соединения свинца
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Свинец вольфрамат для монокристаллов | ТУ 6-09-02-355-89 | ХЧ | 2624230733 |
| Свинец (II) гексанитрокобальтат (III) 4-водный | ТУ 6-09-02-241-88 | Ч | 2624230211 |
| Свинец (II) гексафторосиликат 4-водный | ТУ 6-09-02-65-89 | Ч | 2624230231 |
| Свинец (II) молибдат | ТУ 6-09-02-240-88 | Ч | 2624230241 |
| Свинец (II) хромат плавленный, гранулированный | ТУ 6-09-02-414-86 | ЧДА | 2624230532 |
Соединения цинка
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Цинк амидосульфат 4-водный | ТУ 6-09-02-167-86 | Ч | 2622250321 |
| Цинк бромид 2-водный | ТУ 6-09-02-72-84 | Ч | 2622250091 |
| Цинк (II) йодат 2-водный | ТУ 6-09-02-114-88 | Ч | 2622250151 |
| Цинк йодид | ТУ 6-09-02-443-87 | Ч | 2622250141 |
| Цинк йодид | ТУ 6-09-02-443-87 | ЧДА | 2622250142 |
| Цинк молибдат | ТУ 6-09-02-254-92 | Ч | 2622250191 |
| Цинк пированадат | ТУ 6-09-02-113-89 | Ч | 2622250471 |
| Цинк цитрат 2-водный | ТУ 6-09-02-510-91 | Ч | 2622250471 |
демонстраций — вулкан дихромата аммония
демонстрации — вулкан дихромата аммонияХимический вулкан:
Разложение дихромата аммония
Дихромат аммония, (NH 4 ) 2 Cr 2 O 7 , разлагается при нагревании с образованием оксида хрома (III) [Cr 2 O 3 ], газообразный азот и водяной пар:
(NH 4 ) 2 Cr 2 O 7 (с) ——> Cr 2 O 3 (с) + N 2 (г) + 4H 2 O (г)
При разложении дихромата аммония выделяются оранжевые искры и бросает зеленые кристаллы оксида хрома (III) в воздух, производя эффект это выглядит как миниатюрное извержение вулкана.
Образующиеся кристаллы оксида хрома (III) более «пушистые». чем исходные кристаллы дихромата аммония, и хотя многие масса исходных материалов улетучивается в виде пара, продукт выглядит как более крупный количество материала.
В следующих демонстрациях зажигается стопка дихромата аммония. с горелкой Бунзена, производящей эффект «вулкана». Обратите внимание на объем образовавшегося твердого зеленого оксида хрома (III) и расстояние до кристаллов были брошены.Во втором видеоролике показана аналогичная демонстрация на более близкое увеличение.
Видеоклип 1: НАСТОЯЩИЙ, 8,33 МБ
Видеоклип 2: НАСТОЯЩИЙ, 4,92 МБ
!!! Опасности !!!
Соли хрома вызывают раздражение кожи и дыхательных путей и являются также канцерогенный.(Дихромат аммония содержит хром в шестивалентная, форма Cr 6+ , показанная в фильме Эрин Брокович .) Лучше всего провести эту демонстрацию на большом кусок алюминиевой фольги, которую затем можно использовать для обертывания солей хрома произведено.
Процедуры
Разложение дихромата аммония: Bassam Z.Шахашири, Химическая Демонстрации: Справочник для учителей химии, том 1. Мэдисон: Издательство Висконсинского университета, 1983, стр. 81-82.
Список литературы
Марта Виндхольц (ред.), The Merck Index, 10-е изд. Rahway: Merck & Co., Inc., 1983.
Ингибирование водорода в системе влажного улавливания алюминиевой пыли с использованием раствора дихромата
Системы влажного пылеулавливания используются во всем мире для обработки алюминиевой пыли.Однако эти системы представляют опасность возгорания и взрыва водорода из-за реакции между алюминиевой пылью и водой с образованием водорода. В этом исследовании проводится полевое обследование системы влажного пылеулавливания на предприятии по производству распыленного алюминиевого порошка в Китае. Метод ингибирования водорода (HIM) был предложен для подавления образования водорода. Испытания на ингибирование образования водорода проводились на специализированном оборудовании, разработанном авторами. Экспериментальные данные показали, что HIM эффективно ингибирует реакцию алюминия с водой.Чтобы изучить изменения в частицах алюминия до и после нанесения HIM, использовали сканирующую электронную микроскопию (SEM), чтобы охарактеризовать морфологические изменения в алюминиевом порошке. Энергодисперсионная рентгеновская спектроскопия (EDS) показала, что Cr был равномерно распределен вокруг частиц алюминия, что указывает на то, что ингибирующая пленка равномерно покрывает эти частицы. Рентгеновскую фотоэлектронную спектроскопию (XPS) использовали для проверки валентности Cr в ингибирующей пленке, а дифракцию рентгеновских лучей (XRD) использовали для анализа химического состава пленки после обработки HIM.Результаты показали, что Cr (OH) 3 и Al (OH) 3 широко распространены в ингибирующей пленке, подтверждая эффективность HIM. Обсужден механизм реакции между алюминиевой пылью и растворами бихромата и установлена модель кинетики химической реакции ингибирования образования водорода. Обсуждались экологические вопросы использования бихроматных растворов. Использование HIM позволило максимально снизить стоимость влажной системы пылеулавливания и риска возгорания или взрыва в водороде.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?Содержит дихроматный вулкан | Выставка химии
Реакция вулкана с дихроматом аммония — одна из самых знаковых демонстраций химии, однако риски, связанные с использованием солей хрома (VI), привели к их запрету во многих странах, включая недавно Ирландию.Несмотря на риски, вполне возможно безопасно выполнить эту демонстрацию, если вы будете соблюдать надлежащие процедуры безопасности.
В начале своей карьеры я проводил эту демонстрацию несколько раз, но очистка всегда отталкивала. Я не думал, что будет справедливо оставлять потенциально канцерогенный порошок для воздействия на моих техников или уборщиков. Если урок не проводился непосредственно перед перерывом в день, я изо всех сил пытался найти время, чтобы как следует убрать после себя, особенно когда делил лабораторные работы с другими учителями.
Я был очень рад, когда увидел недавнее сообщение в блоге, предлагающее простую идею сделать все это в большой колбе, чтобы содержать весь отработанный порошок (готовый для переноса в мешок для утилизации). Похоже, дихроматный вулкан только что вернулся в меню.
Комплект
- Дихромат аммония (VI), 5 г (токсичен, вызывает серьезные ожоги кожи и повреждение глаз, может вызывать затруднение дыхания при вдыхании, может вызывать генетические дефекты, может вызывать рак, нарушать фертильность или нерожденного ребенка.См. Карту опасности CLEAPSS 7)
- Колба коническая или круглодонная ≥ 1 дм 3
- Стеклянная трубка или аналогичный материал для доставки порошка в небольшую кучку
- Штатив и сетка или подставка с зажимом
- Горелка Бунзена
- Минеральная вата
Препарат
Надевайте перчатки и брызгозащищенные очки. Работая в вытяжном шкафу, который не включен и с частично опущенной створкой, взвесьте не более 5 г дихромата аммония (VI) и с помощью стеклянной трубки или бумажного конуса перенесите твердое вещество в небольшую коническую кучку в помещении. центр основания колбы 1 дм. 3 коническая или круглодонная.Поместите колбу над бунзеном, используя зажим или штатив и марлю, затем используйте кусок минеральной ваты, чтобы плотно закрыть горлышко колбы, чтобы предотвратить выброс порошка во время реакции. С установленной минеральной ватой демонстрацию можно проводить в открытой лаборатории. Сверху горлышка колбы можно положить металлический шпатель, чтобы предотвратить вылет пробки газами, образующимися в результате реакции.
Перед классом
Зрители должны носить защитные очки.Держите кончик пламени Бунзена под центром кучи порошка. Не используйте другие методы розжига, так как это может привести к выбросу порошка до того, как можно будет снова вставить пробку из минеральной ваты. Через несколько секунд порошок начнет термически разлагаться, из центра будут выбрасываться искры, и порошок станет зеленым и расширится, образуя впечатляющий эффект вулканического происхождения.
Учебная цель
Общее уравнение реакции обычно цитируется как:
(NH 4 ) 2 Cr 2 O 7 (с) → Cr 2 O 3 (с) + N 2 (г) + 4H 2 O (л)
Использование заглушки для хранения продуктов делает эту демонстрацию полезной возможностью сравнить массу колбы и ее содержимое в конце с массой до реакции (подписчики CLEAPSS могут получить дополнительную информацию о руководстве по этому мероприятию, связавшись с ними).Однако было отмечено, что оставшееся соединение оливково-зеленого цвета содержит больше кислорода по массе, чем могло бы соответствовать этому уравнению, возможно, в виде поверхностных оксидов. Дальнейшее восстановление твердого вещества дает более бледный, более яркий зеленый цвет, более соответствующий другим солям Cr (III).
Изменение цвета с оранжевого на зеленый связано с изменением степени окисления хрома с (VI) на (III). Наблюдательные студенты могут заметить, что в степени окисления +6 ион хрома не должен иметь электронов, чтобы облегчить тип d – d-перехода, который, как их, возможно, учили, приводит к окрашиванию комплексов переходных металлов.Цвет здесь возникает, как и у иона MnO 4 —, в результате переноса заряда лиганд-металл: видимый свет поглощается, когда электрон перемещается от кислорода к центру хрома.
Здоровье и безопасность
- Носите брызгозащищенные очки.
- Защитите лицо.
- Надевайте перчатки для переноса или распределения твердого вещества.
- Используйте пробку из минеральной ваты, чтобы предотвратить утечку твердых частиц / пыли из емкости.
- Избегайте образования пыли и немедленно вытрите пролитую ткань влажной тканью / бумажным полотенцем.
- Не смешивайте дихромат аммония (VI) с другими веществами.
Утилизация
Затем дайте аппарату остыть, надев перчатки (в случае наличия непрореагировавшего дихромата аммония (VI)), с помощью щипцов или щипцов извлеките пробку из минеральной ваты и поместите ее с твердым остатком прямо в подходящий пластиковый пакет, который может быть опломбировано и помещено в обычные твердые отходы.
желтого покрытия дихроматом алюминия Гладханд 90 градусов держателя шарнирного соединения
/ {{vm.product.unitOfMeasureDescription || vm.product.unitOfMeasureDisplay}}
{{section.sectionName}}:
{{option.description}}
{{раздел.sectionName}} Выберите {{section.sectionName}}
.{{styleTrait.nameDisplay}} {{styleTrait.unselectedValue? «»: «Выбрать»}} {{styleTrait.unselectedValue? styleTrait.unselectedValue: styleTrait.nameDisplay}}
- Атрибуты
- Документы
- {{Технические характеристики.nameDisplay}}
- Атрибуты
- Документы
| Марка | |
| {{attributeValue.valueDisplay}} {{$ last? »: ‘,’}} |
| Марка | |
| {{attributeValue.valueDisplay}} {{$ last? »: ‘,’}} |
доля
Электронное письмо было успешно отправлено. Электронное письмо не было отправлено, проверьте данные формы.
× Плоская панель: использование дихромата алюминия
Дихромат алюминия используется для повышения устойчивости алюминиевых сплавов к коррозии.
Дихромат алюминия — это химическое соединение, которое в основном используется в промышленности. Он производится в виде сухих гранул, которые легко растворяются в воде, выделяя при этом ионы алюминия и хрома. Раствор используется для покрытия алюминиевых сплавов и обеспечивает защиту от коррозии. Дихромат алюминия также используется в покраске и электронике. Он также используется в пиротехнике и в качестве ингредиента при создании моделей вулканов для научных проектов. Как химическое соединение, он используется химиками, в химических лабораториях и для учебных экспериментов.
Химия
Химическая формула дихромата алюминия — Al2Cr6O21. Он имеет молекулярную массу 701,927076 и довольно сложную молекулярную структуру. Он состоит из атомов алюминия, хрома и кислорода. Он выделяет в растворе ионы хромата, которые используются в металлических покрытиях и электролизе.
Покрытия
Дихромат алюминия используется в процессе хромирования алюминиевых сплавов. Этот процесс также известен как «хроматирование» или «нанесение хроматного конверсионного покрытия».«Процесс включает химическую реакцию, в которой бихромат алюминия растворяется в воде или другом растворителе. Алюминий или сплав погружают в раствор, и ионы хрома осаждаются на поверхности металла, образуя покрытие или пленку. Это делает металл устойчивым к воздействию
Покраска
Металл, покрытый дихроматом алюминия , преобразование , процесс покрытия , имеет поверхность, на которую краска может легче прилипать.Хроматные покрытия используются в военных целях и должны быть достаточно высокого качества, чтобы соответствовать определенным военным требованиям. Пленочные покрытия устойчивы к истиранию и стабильны во времени.
Соображения
Дихромат алюминия используется в производстве плоскопанельных дисплеев излучения (FED), где он сочетается с люминофором и поливиниловым спиртом и используется для поддержания уровня вакуума в устройстве. Хроматы также часто используются в пиротехнике и в проектах научных выставок из-за их очень реактивной природы.Дихромат алюминия образует ионы хромата, которые обеспечивают повышенную устойчивость к нагреванию и хорошую проводимость при использовании в качестве покрытий в электронике.
Теги : алюминиевые сплавы , дихромат алюминия, использованный дихромат алюминия , процесс покрытия, использованный дихромат , алюминий хромМагниевые и алюминиевые покрытия / Анодирование
В Saporito вы найдете оборудование для анодирования алюминия и магния с полным спектром услуг, на котором можно наносить различные покрытия.Помимо предварительной и постобработки, мы предлагаем возможности маскировки и критического стеллажа ваших деталей. Удовлетворяя все ваши технические требования в одном месте, мы можем сократить время выполнения заказа и транспортные расходы. Справа перечислены некоторые из предлагаемых процессов.
Химические пленки
Квалифицированные материалы позволяют получать покрытия от прозрачного до радужно-желтого или коричневого. При использовании прозрачных покрытий могут возникнуть трудности при осмотре, поскольку визуальный осмотр не обнаруживает наличия покрытия.Покрытие по умолчанию желтое, если не указано иное. Подробнее о химической обработке пленки.
Dow # 7
(ASTM D1732, AMS M 3171 TIII)Дихромат, химическое преобразование погружением
Химическая обработка № 7 (дихромат) — это химическое конверсионное покрытие погружением, которое чаще всего используется для магния и его сплавов. Нанесенные покрытия могут варьироваться от светло-коричневого до темно-коричневого, без заметных изменений размеров, обычно наносятся после механической обработки и перед покраской.Покрытие обладает хорошими базовыми красочными качествами и защищает детали при транспортировке и хранении. Dow 7 соответствует спецификациям Mil-M-3171, тип III и AMS 2475.
Dow # 17-
Анодирование магниевых сплавовХимическая обработка № 17 (анодирование) Покрытия являются наиболее универсальными из всех видов химической обработки и применимы ко всем магниевым сплавам. Анодное покрытие обладает хорошей устойчивостью к истиранию и износостойкостью, отличными характеристиками лакокрасочной основы и коррозионной стойкостью.Тонкие покрытия (.0001-.0003) светло-зеленого цвета используются в большинстве областей применения, которые должны быть окрашены. Более толстые покрытия (.001 — .0015) темно-зеленого цвета обеспечивают повышенную коррозионную стойкость и стойкость к истиранию в неокрашенном состоянии.
Пассивный
Пассивная отделка включает в себя рекомендуемые методы очистки и удаления накипи с деталей, оборудования и систем из нержавеющей стали. Очистка включает в себя все операции, необходимые для удаления поверхностных загрязнений с металлов для обеспечения максимальной коррозионной стойкости металла, предотвращения загрязнения продукта и создания слоя оксида хрома, который придает исключительную коррозионную стойкость нержавеющей стали.
Для получения информации о том, как наши процессы анодирования алюминия и магния, включая DOW7, DOW9, DOW17, пассивирование и химические пленки, могут помочь улучшить ваш следующий проект отделки металла, свяжитесь с нами или запросите коммерческое предложение онлайн. (Вы даже можете прикрепить файл или схему ).
(Получите ответ) — Формула дихромата алюминия — Al2 (Cr2O7) 3 Какова формула …
Упражнение 1.3: Рассмотрим систему потребитель-ресурс drus = 6-acnn, 2 = Eachine — 8n2. Решите это …
Упражнение 1.3. Рассмотрим систему потребитель-ресурс drus = 6-acnn, 2 = Eachine — 8n2. Решите эту систему с заданными значениями параметров 0 = 10, c = 0,01, a = 1, E = 0,05, 8 = 0,1 для начальных условий (255).(300 10) и (50 50). Постройте …
Опубликовано 3 часа назадМихаил Ф.И.О. Шареян 714 Инструктор лаборатории.Энтони Дата 14 июня Лаборатория Day & Time CHEM 101L …
Михаил Ф.И.О. Шареян 714 Инструктор лаборатории. Энтони Дата 14 июня Лабораторный день и время Отчет CHEM 101L — эксперимент.6 3 раствора присутствуют в наборе Тестовый специфический тест Выполненный результат 1 2 3 5 6 7 8 9 10 Corces de la consthead этой страницы) Обсудите, как…
Опубликовано 3 часа назадQ3.Шунтирующий генератор постоянного тока мощностью 2 кВт / 240 В имеет Ra = 0,052 и Rsh = 10022. Рассчитайте общую мощность якоря.
Q3. Шунтирующий генератор постоянного тока мощностью 2 кВт / 240 В имеет Ra = 0,052 и Rsh = 10022. Рассчитайте общую мощность якоря, развиваемую при работе как A. Двигатель, потребляющий 90% номинальной мощности B. Генератор, обеспечивающий выходную мощность 85% номинальной мощности.
Опубликовано 3 часа назадStreamServlet / CHM121 Назначение главы +4 2.pdf? nfmgr & ts 14
146634 & ouTube SPA 122 ca Кампус …StreamServlet / CHM121 Chapter +4 assignment 2.pdf? Nfmgr & ts 14146634 & ouTube SPA 122 ca Книги факультета Campus Cruiser НАШ S D Мой виртуальный ребенок M Имя: Покажите свои расчеты на отдельных листах бумаги. 1.Определите окислитель в …
Опубликовано 3 часа назадЗадание 5: Однодольные и двудольные корни На приведенном ниже изображении показаны типы клеток и ткани…
Задание 5: Однодольные и двудольные корни На приведенном ниже изображении показаны типы клеток и ткани, которые вы должны идентифицировать. На изображении показано поперечное сечение корня однодольного и корня двудольного, расположенного рядом. Буквенные подсказки расположены рядом с …
Опубликовано 3 часа назадСогласно циркумплексной модели эмоций Рассела, чувство «депрессии» и «спокойствие» равны…
Согласно циркумплексной модели эмоций Рассела, ощущение «депрессии» и ощущение «спокойствия» — похожие эмоции, потому что они оба включают: A. высокую валентность B. высокое возбуждение C. низкую валентность D. низкую валентность. Паула опаздывает на встречу и узнает об этом. что…
Опубликовано 3 часа назадПоглощение в отсутствие Na * Чтобы понять механизм переносчика лейцина в кишечнике
Поглощение в отсутствие Na *. Чтобы получить представление о механизме переносчика лейцина в эпителиальных клетках кишечника, оценивали скорость поглощения L-лейцина, D-лейцина и L-валина в присутствии и в отсутствие Nat.Результаты оценки …
Опубликовано 3 часа назадСколько существует способов расположить колоду из 52 карт так, чтобы для каждой масти были все карты этой масти.
Сколько существует способов расположить колоду из 52 карт так, чтобы для каждой масти все карты этой масти были вместе? Напомним, что у нас есть 13 рангов (от туза до короля) и 4 масти (пики, червы, бубны и трефы).
Опубликовано 3 часа назад26-летняя женщина сегодня находится в клинике для оценки прибавки в весе и утомляемости.Она 5 футов.
26-летняя женщина сегодня находится в клинике для оценки прибавки в весе и утомляемости. Ее рост 5 футов 6 дюймов и вес 175 фунтов. До беременности она весила 130 фунтов, а ее максимальный вес во время беременности составлял 155 фунтов. Ей сейчас 18 …
Опубликовано 3 часа назад3.3 Специальный номер e Preview Activity 3.3.1. Откройте новый рабочий лист Desmos и определите …
3.3 Специальный номер e Preview Activity 3.3.1. Откройте новый рабочий лист Desmos и определите следующие функции: f (t) = 27, g (t) = 34, h (t) = () ‘и p (t) = f (kt). После того, как вы определите p, примите ползунок для k и установите диапазон ползунка равным -2.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.