404 — Документ не найден
Документ не найден.
Пожалуйста, воспользуйтесь поиском или нижним меню.
Обжимные фитинги муфты, штуцера, адаптеры, уголки, кресты, тройники Резьбовые фитинги ниппели, муфты, тройники.. Приварные фитинги VCR, VCO, БРС
Фитинги
Запорная арматура Игольчатые вентили Шаровые краны Мембранные клапаны Сильфонные вентили Манометрические вентили
Клапаны
Баллонные
Общепромышленные
Высокоточные
До себя
Для чистых сред
Двухступенчатые
Регуляторы давления
Фильтры и фильтрующие элементы
фильтры финишной очистки
Промышленные фильтры
Микронные фильтры
Фильтры
Калиброванные бесшовные трубки
Инструмент для труб
полимерные трубки
гибкие рукава
Зажимы, трубы, рукава и аксессуары
Изделия собственного производства газоразрядные рампы атмосферные испарители газовые шкафы устройства отбора пробы
Изделия
Поточные нагреватели жидкостей и газов
Нагреватели
Расходомеры Ротаметры
Средства контроля расхода
Уровнемеры Смотровые стёкла
Средства измерения уровня
Манометры
Преобразователи давления
Реле давления
Разделительные мембраны
Средства измерения давления
Средства измерения температуры
Анализаторы газов
Алюминиевые газовые баллоны:
— Одногорловые
— Двугорловые
Кабельные вводы
Задания на ОВР из реального ЕГЭ по химии 2018 года.

Задание №1
Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
8KMnO4 + 5PH3 + 12H2SO4 → 4K2SO4 + 8MnSO4 + 5H3PO4 + 12H2O
Mn+7 + 5e— → Mn+2 |⋅8
P-3 — 8e— → P+5 |⋅5
Mn+7 (KMnO4) — окислитель, P-3 (PH3) — восстановитель
Второй вариант ответа:
8KMnO4 + 3PH3 → 2K3PO4 + K2HPO4 + 8MnO2 + 4H2O
Mn+7 + 3e— → Mn+4 |⋅8
P-3 — 8e— → P+5 |⋅3
Mn+7 (KMnO4) — окислитель, P-3 (PH3) — восстановитель
Задание №2
Для выполнения заданий 30, 31 используйте следующий перечень веществ: хромат натрия, серная кислота, гидрокарбонат магния, оксид фосфора(V), нитрит натрия. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
2Na2CrO4 + 5H2SO4 + 3NaNO2 → Cr2(SO4)3 + 3NaNO3 + 2Na2SO4 + 5H2O
2Cr+6 + 6e— → 2Cr+3 |⋅1
N+3 — 2e— → N+5 |⋅3
N+3 (NaNO2) — восстановитель, Cr+6 (Na2CrO4) — окислитель
Второй вариант ответа:
2Na2CrO4 + 3NaNO2 + 5H2O → 2Cr(OH)3 + 4NaOH + 3NaNO3
Cr+6 + 3e— → Cr+3 |⋅2
N+3 — 2e— → N+5 | ⋅3
N+3 (NaNO2) — восстановитель, Cr+6 (Na2CrO4) — окислитель
Задание №3
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
Na2Cr2O7 + 3H2S + 4H2SO4 → Na2SO4 + Cr2(SO4)3 + 3S + 7H2O
2Cr+6 + 6e— → 2Cr+3 |⋅1
S-2 — 2e— → S0 |⋅3
Cr+6 (Na2Cr2O7) — окислитель, S-2(H2S) — восстановитель
Второй вариант ответа:
Na2Cr2O7 + 3H2S + H2O → 2Cr(OH)3 + 3S + 2NaOH
2Cr+6 + 6e— → 2Cr+3 |⋅1
S-2 — 2e— → S0 |⋅3
Cr+6 (Na2Cr2O7) — окислитель, S-2(H2S) — восстановитель
Задание №4
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфит калия, дихромат калия, серная кислота, гидроксид хрома(III), оксид кремния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
3K2SO3 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 4K2SO4 + 4H2O
S+4 — 2е— → S+6 |⋅3
2Cr+6 + 6e— → 2Cr+3 |⋅1
S+4 (K2SO3) — восстановитель, Cr+6 (K2Cr2O7) — окислитель
Второй вариант ответа:
3K2SO3 + K2Cr2O7 + 4H2O → 2Cr(OH)3 + 3K2SO4 + 2KOH
S+4 — 2е— → S+6 |⋅3
2Cr+6 + 6e— → 2Cr+3 |⋅1
S+4 (K2SO3) — восстановитель, Cr+6 (K2Cr2O7) — окислитель
Задание №5
Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, иодид калия, фторид аммония, ацетат натрия, сульфат магния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH
Mn+7 + 3e— → Mn+4 |⋅2
2I— — 2e— → I2 |⋅3
Mn+7 (KMnO4) — окислитель, I— (KI)- восстановитель
Второй вариант ответа
2KMnO4 + KI + H2O → 2MnO2 + KIO3 + 2KOH
Mn+7 + 3e— → Mn+4 |⋅2
I-1 — 6e— → I+5 |⋅1
Mn+7 (KMnO4) — окислитель, I— (KI)- восстановитель
Задание №6
Для выполнения заданий 30, 31 используйте следующий перечень веществ: гипохлорит натрия, гидроксид натрия, фторид цинка, оксид хрома(III), оксид кремния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение3NaClO + 4NaOH + Cr2O3 → 2Na2CrO4 + 3NaCl + 2H2O
Cl+1 + 2e— → Cl-1 |⋅3
2Cr+3 — 6e— → 2Cr+6 |⋅1
Cl+1 (NaClO) — окислитель, Cr+2(Cr2O3) — восстановитель
Задание №7
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сера, концентрированная азотная кислота, оксид углерода(IV), фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.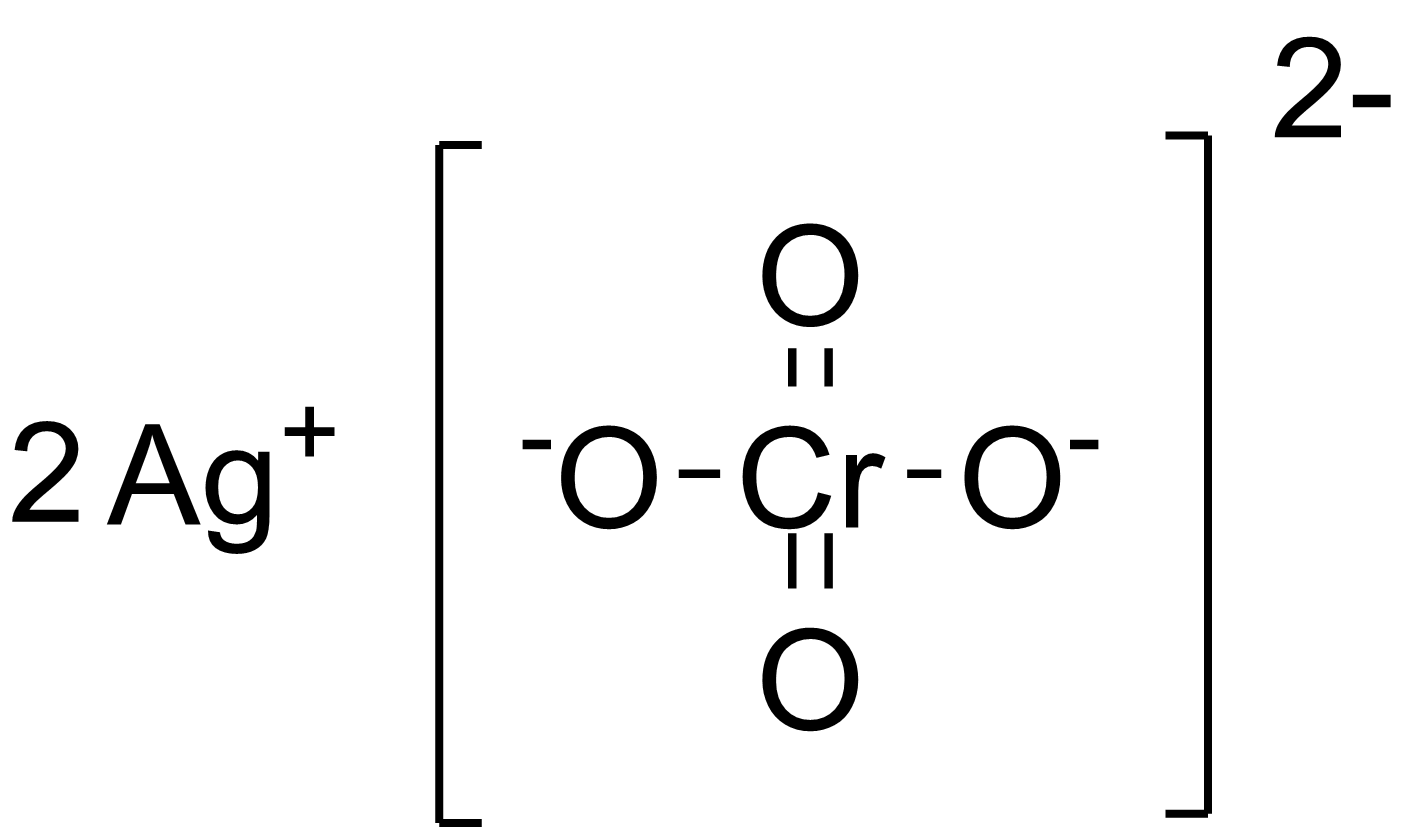 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
S0 — 6e— → S+6
N+5 + 3e— → N+2
S0 — восстановитель, N+5 (HNO3) — окислитель
Задание №8
Для выполнения заданий 30, 31 используйте следующий перечень веществ: фтороводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
2Fe+2 – 2e- → 2Fe+3 |⋅3
2Cr+6 + 6e— → 2Cr+3 |⋅1
Fe+2(FeSO4) – восстановитель, Cr+6(K2Cr2O7) — окислитель
Задание №9
Для выполнения заданий 30, 31 используйте следующий перечень веществ: пероксид водорода, гидроксид калия, оксид хрома(III), фосфат серебра, сульфат аммония. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение3H2O2 + 4KOH + Cr2O3 → 2K2CrO4 + 5H2O
2O-1 +2e— → 2O-2 |⋅1
2Cr+3 – 6e— → 2Cr+6 |⋅1
O-1 (H2O2) — окислитель, Cr+3 (Cr2O3) — восстановитель
Задание №10
Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, оксид кремния, нитрит калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
Первый вариант ответа:
K2Cr2O7 + 4H2SO4 + 3KNO2 → 3KNO3 + K2SO4 + Cr2(SO4)3 + 4H2O
2Cr+6 + 6e— → 2Cr+3 |⋅1
N+3 – 2e— → N+5 |⋅3
Cr+6 (K2Cr2O7) — окислитель, N+3 (KNO2)- восстановитель
Второй вариант ответа:
K2Cr2O7 + 3KNO2 + 4H2O → 3KNO3 + 2KOH + 2Cr(OH)3
2Cr+6 + 6e— → 2Cr+3 |⋅1
N+3 – 2e— → N+5 |⋅3
Cr+6 (K2Cr2O7) — окислитель, N+3 (KNO2)- восстановитель
Задание №11
Для выполнения заданий 30, 31 используйте следующий перечень веществ: хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение2Na2CrO4 + 6NaBr + 8H2SO4 → 5Na2SO4 + 3Br2 + Cr2(SO4)3 + 8H2O
2Cr+6 + 6e— → 2Cr+3 |⋅1
2Br— — 2e— → Br20 |⋅3
Cr+6 (Na2CrO4) — окислитель, Br— (NaBr)- восстановитель
Задание №12
Для выполнения заданий 30, 31 используйте следующий перечень веществ: бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Mn+7 + 5e— → Mn+2 |⋅1
2Cl— — 2e— → Cl20 |⋅1
Mn+7 (KMnO4) — окислитель, Cl— (HCl)- восстановитель
Задание №13
Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
Первый вариант ответа:
K2Cr2O7 + 7H2SO4 + 3K2S → 3S + 4K2SO4 + Cr2(SO4)3 + 7H2O
2Cr+6 + 6e— → 2Cr+3 |⋅1
S-2 — 2e— → S0 |⋅3
Cr+6 (K2Cr2O7) — окислитель, S-2 (K2S) — восстановитель
Второй вариант ответа:
K2Cr2O7 + 3K2S + 7H2O → 2Cr(OH)3 + 3S + 8KOH
2Cr+6 + 6e— → 2Cr+3 |⋅1
S-2 — 2e— → S0 |⋅3
Cr+6 (K2Cr2O7) — окислитель, S-2 (K2S) — восстановитель
Задание №14
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди(II). |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
2KMnO4 + 2KOH + KNO2 → KNO3 + 2K2MnO4 + H2O
Mn+7 + 1e— → Mn+6 |⋅2
N+3 — 2e— → N+5 |⋅1
Mn+7 (KMnO4) — перманганат калия, N+3 (KNO2) — восстановитель
Второй вариант ответа:
2KMnO4 + 3KNO2 + H2O → 3KNO3 + 2MnO2 + 2KOH
Mn+7 + 3e— → Mn+4 |⋅2
N+3 — 2e— → N+5 |⋅3
Mn+7 (KMnO4) — перманганат калия, N+3 (KNO2) — восстановитель
Задание №15
Для выполнения заданий 30, 31 используйте следующий перечень веществ: концентрированная соляная кислота, оксид фосфора(V), оксид марганца(IV), фторид аммония, нитрат кальция. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Решение4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2Cl-1 — 2e— → Cl20 |⋅1
Mn+4 + 2e— → Mn+2 |⋅1
Cl-1 (HCl) — восстановитель, Mn+4 (MnO2) — окислитель
Задание №16
Для выполнения заданий 30, 31 используйте следующий перечень веществ: концентрированная соляная кислота, оксид углерода(IV), перманганат калия, фосфат калия, нитрат железа(III). Допустимо использование водных растворов солей. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Mn+7 + 5e— → Mn+2 |⋅1
2Cl— — 2e— → Cl20 |⋅1
Mn+7 (KMnO4) — окислитель, Cl— (HCl)- восстановитель
Задание №17
Для выполнения заданий 30, 31 используйте следующий перечень веществ: нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди(II). Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
Na2SO3 + Br2 + H2O → Na2SO4 + 2HBr
S+4 — 2e— → S+6 |⋅1
Br20 + 2e— → 2Br-1 |⋅1
S+4 (Na2SO3) — восстановитель, Br20 — окислитель
Второй вариант ответа:
Na2SO3 + Br2 + 2KOH → Na2SO4 + 2KBr + H2O
S+4 — 2e— → S+6 |⋅1
Br20 + 2e— → 2Br-1 |⋅1
S+4 (Na2SO3) — восстановитель, Br20 — окислитель
Третий вариант ответа:
6KOH + 3Br2 → 5KBr + KBrO3 + 3H2O
Br20 + 2e— → 2Br-1 |⋅5
Br20 — 10e— → 2Br+5 |⋅1
Br20 является и окислителем, и восстановителем
Задание №18
Для выполнения заданий 30, 31 используйте следующий перечень веществ: хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома(III), оксид магния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеKClO3 + 4NaOH + Cr2O3 → KCl + 2Na2CrO4 + 2H2O
Cl+5 + 6e— → Cl-1 |⋅1
2Cr+3 — 6e— → 2Cr+6 |⋅1
Cl+5 (KClO3) — окислитель, Cr+3 (Cr2O3) — восстановитель
Задание №19
Для выполнения заданий 30, 31 используйте следующий перечень веществ: иодид калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния. Допустимо использование водных растворов веществ. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
2KI + MnO2 + 2H2SO4 → K2SO4 + MnSO4 + 2H2O + I2
Mn+4 + 2e— = Mn+2 |⋅1
2I— — 2e— = I20 |⋅1
I-1 (KI) — восстановитель, Mn+4(MnO2) — окислитель
Задание №20
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сероводород, концентрированная азотная кислота, сульфат алюминия, оксид фосфора(V), нитрат меди(II). Допустимо использование водных растворов солей. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеH2S + 8HNO3 → H2SO4 + 8NO2 + 4H2O
S-2 — 8e— → S+6 |⋅1
N+5 + 1e— → N+4 |⋅8
S-2(H2S) — восстановитель, S+6 (H2SO4) — окислитель
Задание №21
Для выполнения заданий 30, 31 используйте следующий перечень веществ: дихромат натрия, серная кислота, иодид натрия, силикат калия, нитрат магния. |
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
РешениеПервый вариант ответа:
Na2Cr2O7 + 7H2SO4 + 6NaI → Cr2(SO4)3 + 4Na2SO4 + 3I2 + 7H2O
2Cr+6 +6e— → 2Cr+3 |⋅1
2I-1 — 2e— → I20 |⋅3
I-1 (NaI) — восстановитель, Cr+6 (Na2Cr2O7) — окислитель
Второй вариант ответа:
Na2Cr2O7 + 6NaI + 7H2O → 3I2 + 2Cr(OH)3 + 8NaOH
2Cr+6 + 6e— → 2Cr+3 |⋅1
2I-1 — 2e— → I20 |⋅3
I-1 (NaI) — восстановитель, Cr+6 (Na2Cr2O7) — окислитель
Реальный ЕГЭ по химии 2018.
 Задание 30 Реальный ЕГЭ по химии 2018. Задание 30 | Подготовка к ЦТ и ЕГЭ по химии Skip to content
Задание 30 Реальный ЕГЭ по химии 2018. Задание 30 | Подготовка к ЦТ и ЕГЭ по химии Skip to contentЗадания 30 из реальных КИМов ЕГЭ 2018 по химии
Для выполнения задания используйте следующий перечень веществ: дихромат калия, серная кислота, карбонат аммония, кремнезём, нитрит калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: нитрат аммония, дихромат калия, серная кислота, сульфид калия, фторид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.
 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.Для выполнения задания используйте следующий перечень веществ: йодид калия, серная кислота, гидроксид алюминия, оксид марганца (IV), нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, оксид фосфора (V), оксид марганца (IV), фторид аммония, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.

Для выполнения задания используйте следующий перечень веществ: дихромат натрия, серная кислота, йодид натрия, силикат натрия, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: соляная кислота концентрированная, углекислый газ, перманганат калия, фторид аммония, нитрат железа. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сульфат аммония, гидроксид калия, перманганат калия, нитрит калия, оксид меди (II).
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора (V), нитрат меди (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.

Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, фтороводород, карбонат аммония, сульфат железа (II), дихромат калия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хлорат калия, гидроксид натрия, сульфат алюминия, оксид хрома (III), оксид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции.
 Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.Для выполнения задания используйте следующий перечень веществ: сероводород, сульфит калия, дихромат калия, серная кислота, гидроксид хрома (III), кремнезём. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, бром, нитрат бария, сульфат аммония, соляная кислота концентрированная, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.

Для выполнения задания используйте следующий перечень веществ: сероводород, нитрат цинка, сульфит натрия, бром, гидроксид калия, оксид меди. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, сера, азотная кислота концентрированная, углекислый газ, фторид серебра, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома (III), фосфат магния, сульфат аммония.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: сероводород, хромат натрия, бромид натрия, фторид калия, серная кислота, нитрат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Ответы:
K
2Cr2O7 + 3KNO2 + 4H2SO4→Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
2Cr
6++6e → 2Cr3+ – окислитель, восстановилсяN
3+–2e → N5+ – восстановитель, окислилсяK
2Cr2O7 + 3K2S + 7H2SO4→Cr2(SO4)3 + 3S + 4K2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
2- –2e → S0 – восстановитель, окислилсяОтвет (доп.
 ): 3K2S + 4H2SO4→ 4S + 3K2SO4 + 4H2O(сопропорционирование)
): 3K2S + 4H2SO4→ 4S + 3K2SO4 + 4H2O(сопропорционирование)2KI + MnO
2 + 2H2SO4→ I2 + MnSO4 + K2SO4 + 2H2O
2I
— –2e → I2– восстановитель, окислилсяMn
4+ +2e → Mn2+ – окислитель, восстановилсяОтвет (доп.): 8KI + 5H
2SO4→4I2 + H2S + 4K2SO4 + 4H2OMnO
2 + 4HCl → MnCl2 + Cl2 +2H2O
2Cl
— –2e → Cl2 – восстановитель, окислилсяMn
4+ +2e → Mn2+ – окислитель, восстановилсяNa
2Cr2O7 + 6NaI + 7H2SO4→ Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановился2I
— –2e → I2 – восстановитель, окислился2KMnO
4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn
7+ +5e → Mn2+ – окислитель, восстановился2Cl
— –2e → Cl2 – восстановитель, окислился2KMnO
4 + KNO2 + 2KOH → 2K2MnO4 + KNO3 + H2O
Mn
7+ +1e → Mn6+ – окислитель, восстановилсяN
3+ –2e → N5+ – восстановитель, окислилсяH
2S + 8HNO3(конц)→ H2SO4 + 8NO2 + 4H2O
S
2- –8e → S6+ – восстановитель, окислилсяN
5+ +1e → N4+ – окислитель, восстановилсяNa
2Cr2O7 + 3H2S + 4H2SO4→Cr2(SO4)3 + 3S + Na2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
2- –2e → S0 – восстановитель, окислилсяОтвет (доп.
 ): H2S + H2SO4→ S + SO2 + 2H2O
): H2S + H2SO4→ S + SO2 + 2H2OK
2Cr2O7 + 6FeSO4 + 7H2SO4→Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяFe
2+ –1e → Fe3+ – восстановитель, окислилсяKClO
3 + Cr2O3 + 4NaOH → KCl + 2Na2CrO4 + 2H2O
Cl
5+ +6e →Cl— – окислитель, восстановился2Cr
3+ –6e → 2Cr6+ – восстановитель, окислилсяK
2Cr2O7 + 3K2SO3 + 4H2SO4→Cr2(SO4)3 + 4K2SO4 + 4H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановилсяS
4+ –2e → S6+ – восстановитель, окислился2KMnO
4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn
7+ +5e → Mn2+ – окислитель, восстановился2Cl
— –2e → Cl2 – восстановитель, окислилсяNa
2SO3 + Br2 + H2O →Na2SO4 +2HBr
Br
2 + 2e → 2Br— – окислитель, восстановилсяS
4+ –2e → S6+ – восстановитель, окислилсяОтвет (доп.
 ): Br2 + 2KOH →KBr + KBrO + H2O (или KBrO3если нагреваем)
): Br2 + 2KOH →KBr + KBrO + H2O (или KBrO3если нагреваем)Na
2SO3 + Br2 + 2KOH→Na2SO4 +2KBr + h3OS + 6HNO
3(конц)→H2SO4 + 6NO2 + 2H2O
S
0 –6e → S6+ – восстановитель, окислилсяN
5+ +1e → N4+ – окислитель, восстановился2H
2O2 + Cr2O3 + 4KOH → 2K2CrO4 + 5H2O (при нагревании)
2O
— +2e → 2O2- – окислитель, восстановился2Cr
3+ –6e → 2Cr6+ – восстановитель, окислился2Na
2CrO4 + 6NaBr + 8H2SO4→ Cr2(SO4)3 + 3Br2 + 5Na2SO4 + 8H2O
2Cr
6+ +6e → 2Cr3+ – окислитель, восстановился2Br
— –2e → Br2 – восстановитель, окислился
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2020 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaBocLsmshgNWlDqsoZh9n-» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Исследование адсорбционных закономерностей анионов на поверхности красного шлама Текст научной статьи по специальности «Промышленные биотехнологии»
Серия 3. Естественные науки. Исследование адсорбционных закономерностей анионов на поверхности
красного шлама
Терехова М.В., к.х.н. Русакова С.М.
Университет машиностроения 8(495)223-05-23, [email protected] Аннотация. В работе исследована возможность красного шлама (отход алюминиевого производства) адсорбировать фосфат-, молибдат и дихромат-ионы из водных растворов. Изучена зависимость адсорбции исследуемых ионов от рН и начальной концентрации ионов в анализируемом растворе. Разработан способ активации поверхности красного шлама.
Изучена зависимость адсорбции исследуемых ионов от рН и начальной концентрации ионов в анализируемом растворе. Разработан способ активации поверхности красного шлама.
Ключевые слова: красный шлам, адсорбция, молибдат-ионы, фосфат-ионы, дихромат-ион ы
Любое промышленное производство, особенно металлургия, сопряжено с экологическими рисками, среди которых преобладают выбросы загрязняющих веществ в атмосферу, а также образование и складирование вредных отходов. Не является исключением и алюминиевое производство.
При производстве алюминия по методу Байера (процесс получения чистого оксида алюминия) образуется красный бокситовый шлам. На каждую тонну полученного оксида алюминия приходится в среднем от 360 до 800 кг шлама. Из-за отсутствия эффективных технологий переработки основная масса красных шламов не используется и складируется в специальных шламохранилищах, которые оказывают отрицательное воздействие на окружающую среду.
Вопреки устоявшемуся стереотипу, многие специалисты сегодня не считают красный шлам отходом, так как он содержит значительное количество железа и алюминия, и может служить сырьем для получения различных продуктов. В России красных шламов накопилось более 100 млн. т. Поэтому вопросы его использования в качестве сырья, а также полной его утилизации с каждым днем становятся все более актуальными. Благодаря наличию в составе красного шлама оксидов алюминия, железа, титана, кремния и др. одним из перспективных путей утилизации данного отхода является создание на его основе сорбентов для очистки различных объектов от загрязняющих веществ.
Исследуемые в данной работе молибдат-, фосфат-, дихромат-ионы являются одними из распространенных и представляющих экологическую опасность веществ.
Молибден является одним из загрязняющих объектов водных сред. В поверхностных водах он находится в основном в форме молибдат-иона. Загрязнение окружающей среды обусловлено как потерей молибдена на разных этапах переработки сырья, так и выносом тяжелых металлов из отвалов рудника. При этом возможно отравление не только работающего персонала, но и жителей близлежащих территорий.
Фосфаты широко используются в сельском хозяйстве для удобрения почв. Вынос растворимых форм фосфора в грунтовые воды происходит регулярно, поэтому проблема очистки вод от растворимого фосфора всегда остается актуальной.
Вынос растворимых форм фосфора в грунтовые воды происходит регулярно, поэтому проблема очистки вод от растворимого фосфора всегда остается актуальной.
В зарубежной и отечественной литературе накоплен экспериментальный материал по данной проблеме, который требует проведения систематических исследований в этом
Серия 3. Естественные науки.
направлении, что позволит детально изучить адсорбционные свойства красного шлама и выявить оптимальные условия для адсорбции на нем анионов[1-8].Качественный и количественный состав красных шламов значительно отличается и зависит от состава исходного сырья и технологии его переработки, поэтому созданию эффективных адсорбентов на основе отходов алюмосиликатного производства должны предшествовать экспериментальные исследования адсорбционных закономерностей конкретных образцов красного шлама.
Цели работы
• Получение активированной формы красного шлама путем промывки его соляной кислотой.
• Исследование возможности использования красного шлама для адсорбции фосфат-, мо-либдат- и дихромат-ионов из водных растворов;
• Определение влияния рН и концентрации в растворе ионов на эффективность их адсорбции.
Объект исследования
В данном исследовании использовался красный шлам, являющийся отходом переработки алюминийсодержащего сырья на Уральском алюминиевом заводе (УАЗ). Компонентный и минеральный состав красного шлама (после предварительной обработки известью, промывки и фильтрации) приведен в таблице 1. Анализ был выполнен в лаборатории ОП ООО «РУСАЛ-ИТЦ» в г. О 0.4 Шамозит 12.93
О 0.4 Шамозит 12.93
к2о 0.15 Перовскит 5.97
МпО 0.25 ГАСН 2.03
Р. о. 0.68
шш 11.3
Методика проведения эксперимента
Активацию красного шлама проводили в следующей последовательности: шлам дважды промывали бидистиллированной водой и обрабатывали декантацией раствором соляной кислоты с концентрацией 0,1 моль/л, при этом уровень рН промывных вод снизился с 12 до 8. Далее образцы отфильтровывали и сушили в муфельной печи при температуре 110° С. Полученные образцы измельчали в ступке до порошкообразного состояния и без дальнейших изменений использовали в последующих экспериментах.
Адсорбционные исследования проводили при разной начальной концентрации исследуемых анионов в растворе (таблица 2. ) при постоянной концентрации фонового электролита №С1 с концентрацией 0,1 моль/л. Масса адсорбента во всех случаях была равной 1 грамм, время контакта его с раствором составляло 1 час при непрерывном перемешивании с исполь-
) при постоянной концентрации фонового электролита №С1 с концентрацией 0,1 моль/л. Масса адсорбента во всех случаях была равной 1 грамм, время контакта его с раствором составляло 1 час при непрерывном перемешивании с исполь-
зованием магнитной мешалки (частота вращения 350 об/мин).
Таблица 2.
Начальные концентрации исследуемых анионов
Исследуемый ион Начальная концентрация аниона, моль/л
МоО|» 0,0015 0,002 0.004
0,0015 0,002 0,0025 0,003
РОГ 0,0015 0,025 0.005
Эксперименты проводили при различных значениях рН (в диапазоне от 3 до 10). Необходимого уровня рН раствора достигали добавлением концентрированной соляной кислоты, значения рН измеряли с помощью прибора рН-метр Эксперт-001.
Для получения кривых адсорбции использовали метод отдельных навесок. Концентрацию анионов в растворах определяли по методикам, изложенным в [9]. Измерения оптической плотности испытуемых растворов по отношению к нулевому раствору проводили на спектрофотометре СФ-56.
Величину адсорбции определяли по разности начальной и конечной концентраций ионов, отнесенной к единице массы адсорбента и вычисляли по формуле:
р _ Сисх.~С-нач.
т
где: Г — адсорбция, моль/г-л, СИСх- — концентрация хромат-ионов в исходном растворе, моль/л, Скон. — концентрация хромат-ионов в растворе после адсорбции, моль/л, ш — масса адсорбента, г.
Результаты и их обсуждение
Экспериментально изучена адсорбция фосфат-, молибдат- и дихромат-ионов на активированном красном шламе при различных значениях начальных концентраций раствора. Установлено, что адсорбционная способность красного шлама значительно зависит от значений рН раствора (рисунки 1-3). Очевидно, что адсорбция этих анионов наиболее эффективна в кислой среде, а с увеличением рН она уменьшается. Так, при значении рН больше 5 удаление анионов из раствора незначительно.
Установлено, что адсорбционная способность красного шлама значительно зависит от значений рН раствора (рисунки 1-3). Очевидно, что адсорбция этих анионов наиболее эффективна в кислой среде, а с увеличением рН она уменьшается. Так, при значении рН больше 5 удаление анионов из раствора незначительно.
Из рисунков 1 и 2 видно, что максимальная адсорбция достигается при рН=4. Предельная адсорбция не зависит от рН и при значении меньше 4 практически не изменяется. На рисунке 3 видно, что при значении рН больше 10 удаление фосфатов из раствора происходит незначительно и наибольшее значение адсорбции наблюдается при рН в диапазоне 3-4.
Рисунок 1. Адсорбция дихромат-ионов на красном шламе от рН при разных начальных
концентрациях раствора: _1 — 0,003; 2 — 0,0025; 3 — 0,002; 4 — 0,0015 моль/л_
Г моль/г*л
0. 0015 —
0015 —
0.0010
0.0005
Рисунок 2. Зависимость адсорбции молибдат-ионов на активированном красном шламе от рН при разных начальных концентрациях раствора: 1 — 0,004; 2 — 0,002; 3 — 0,0015 моль/л Г моль/г-л-
Рисунок 3. Зависимость адсорбции фосфат-ионов на активированном красном шламе от рН при разных начальных концентрациях раствора: 1 — 0,005; 2 — 0,0025; 3 — 0,0015 моль/л
Выводы
• С увеличением рН адсорбция анионов из растворов уменьшается.
• Оптимальное значение рН для максимальной адсорбции анионов на красном шламе находится в диапазоне от 3 до5.
• С увеличением равновесной концентрации анионов в исходном растворе их адсорбция возрастает.
• Для описания адсорбционных закономерностей применима кислотно-основная модель.
• Результаты экспериментального исследования адсорбционной способности активированного красного шлама по отношению к фосфат-, молибдат- и дихромат-ионам показывают
возможность утилизировать отходы глиноземного производства УАЗ, создавая на их основе сорбенты для очистки водных объектов.
Литература
1. Ahmed M. Yousif, Michael Rodgers, Eoghan Clifford. Studying the Adsorption Properties of Modified Red Mud towards Phosphate Removal from its Solutions. — International Journal of Environmental Science and Development. — 2012. Vol. 3, No. 4.
2. Jing Chenl, Zhaokun Luan. Enhancing phosphate removal by coagulation using polyelectro-lytes and red mud. — Fresenius Environmental Bulletin . — 2010. Vol. 19, No. 10.
— Fresenius Environmental Bulletin . — 2010. Vol. 19, No. 10.
3. Goldberg S., Johnston C.T. Mechanisms of arsenic adsorption on amorphous oxides evaluated using macroscopic measurements, vibrational spectroscopy, and surface complexation modeling // Journal of Colloid and Interface Science. 2001. V. 234. P. 204-216.
4. Sara J. Palmer, Mitchell Nothling, Kathleen H. Bakon, Ray L. Frost. Thermally activated sea-water neutralised red mud used for the removal of arsenate, vanadate and molybdate from aqueous solutions // Journal of Colloid and Interface Science. 2010. V. 342. P. 147-154.
5. Артамонова И.В., Горичев И.Г., Лайнер Ю.А., Гололобова Е.А., Курмышева А.Ю., Терехова М.В. / Взаимодействие оксидов, оксигидроксидов и гидроксидов алюминия с растворами электролитов // Университет машиностроения. Москва, 2012.
6. Адамсон А. Физическая химия поверхностей. — М.: Мир, 1979. С. 506-590.
7. Русакова С.М., Горичев И.Г., Артамонова И.В., Забенькина Е.О. / Очистка вод с помощью оксида титана (IV) // Экология промышленного производства. 2010. № 1. С. 28-31.
8. ГОСТ 17.4.1.02-83. Охрана природы. Почвы. Классификация химических веществ для контроля загрязнения. -М.: Госстандарт, 1983.
9. Марченко 3. Фотометрическое определение элементов: Пер. с польск./ Под ред. Ю.А. Зо-лотова. — М.: Мир, 1971.- 502 с.
Заказные реактивы — реактив фишера, реактив несслера
Продукция заказного ассортимент
Соединение алюминия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Алюминий дихромат водный | ТУ 6-09-02-50-88 | Ч | 2621260101 |
| Алюминий метаванадат 1-водный | ТУ 6-09-02-412-86 | Ч | 2621260061 |
Соединения аммония
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Аммоний гексахлорстаннат (IV) | ТУ 6-09-02-186-85 | ХЧ | 2621160463 |
| Аммоний гексахлорстаннат (IV) | ТУ 6-09-02-186-85 | Ч | 2621160461 |
| Аммоний йодат | ТУ 6-09-02-160-85 | Ч | 2621160201 |
| Аммоний-ванадий (II) сульфат (2:1:2) 6-водный | ЛМ 6-09-02-82-90 | 2621161037 | |
| Аммоний-кадмий йодид (2:1:4) 2-водный | ТУ 6-09-02-320-89 | Ч | 2621160241 |
| Аммоний-кадмий сульфат (2:1:2) 6-водный | ТУ 6-09-02-264-89 | ХЧ | 2621160253 |
| Аммоний-кадмий сульфат (2:1:2) 6-водный | ТУ 6-09-02-264-89 | Ч | 2621160251 |
| Аммоний-магний сульфат (2:1:2) 6-водный | ТУ 6-09-02-270-88 | ЧДА | 2621210042 |
| Аммоний-цинк сульфат (2:1:2) 6-водный | ТУ 6-09-02-299-83 | ХЧ | 2621161003 |
| Аммоний-цинк сульфат (2:1:2) 6-водный | ТУ 6-09-02-299-83 | Ч | 2621161001 |
Соединения бария
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Барий бромат 1-водный | ТУ 6-09-02-182-85 | Ч | 2621240101 |
| Барий дихромат 2-водный | ТУ 6-09-02-445-87 | Ч | 2621240131 |
| Барий йодид 2-водный | ТУ 6-09-1481-85 | ХЧ | 2621240183 |
| Барий йодид 2-водный | ТУ 6-09-1481-85 | Ч | 2621240181 |
| Барий молибдат | ТУ 6-09-02-192-85 | Ч | 2621240241 |
| Барий ортованадат | ТУ 609-02-78-84 | ХЧ | 2621240603 |
| Барий пероксид | ТУ 6-09-5295-86 | Ч | 2611330011 |
| Барий пероксид | ТУ 6-09-5295-86 | ЧДА | 2611330012 |
Соединения ванадия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Ванадиевая кислота мета | ТУ 6-09-02-128-85 | ХЧ | 2612290053 |
| Ванадиевая кислота мета | ТУ 6-09-02-128-85 | Ч | 2612290051 |
| Ванадий (III) оксид | ТУ 6-09-02-390-85 | Ч | 2611210101 |
| Ванадий (IV) оксид | ТУ 6-09-02-243-88 | Ч | 2611210111 |
| Ванадий (IV) оксид фторид (1:1:2) 3-водный | ТУ 6-09-02-230-89 | Ч | 2622130021 |
Соединения висмута
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Висмут (III) гидроксид | ТУ 6-09-02-155-85 | Ч | 2611490071 |
| Висмут (III) гидроксид | ТУ 6-09-02-155-85 | ЧДА | 2611490072 |
| Висмут (III) гидротартрат 2-водный | ТУ 6-09-02-197-86 | ХЧ | 2634520203 |
| Висмут (III) гидротартрат 2-водный | ТУ 6-09-02-197-86 | Ч | 2634520201 |
| Висмут (III) дихромат оксид (2:1:2) | ТУ 6-09-02-297-88 | Ч | 2624240071 |
| Висмут (III) метаборат | ТУ 6-09-02-164-86 | Ч | 2624240041 |
| Висмут (III) оксалат 4-водный | ТУ 6-09-02-296-88 | Ч | 2634220121 |
| Висмут (IV) оксид | ТУ 6-09-02-210-85 | Ч | 2611210171 |
| Висмут (IV) оксид | ТУ 6-09-02-210-85 | ЧДА | 2611210172 |
| Висмут ортофосфат | ТУ 6-09-02-132-89 | Ч | 2624240261 |
| Висмут (III) сульфид | ТУ 6-09-02-255-87 | Ч | 2624240151 |
| Висмут (III) формиат | ТУ 6-09-02-1-93 | Ч | 2634212241 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-282-88 |
ОСЧ. 13-3 13-3
|
2624240244 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-392-85 | ХЧ | 2624240233 |
| Висмут (III) хлорид 1-водный | ТУ 6-09-02-392-85 | Ч | 2624240231 |
| Висмут (III) хлорид | ТУ 6-09-02-189-86 | ХЧ | 2624240223 |
Соединения железа
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Железо (II) бромид | ТУ 6-09-02-218-89 | Ч | 2622210071 |
| Железо (III) бромид 4-водный | ЛМ 6-09-02-67-90 | 2622210087 | |
| Железо (III) медь (II) оксид (2:1:4) | ТУ 6-09-02-49-88 | Ч | 2611210261 |
| Железо (III) никель (II) оксид (2:1:4) | ТУ 6-09-02-277-93 | Ч | 2611211421 |
| Железо (III) хромат 1-водный | ТУ 6-09-02-236-88 | Ч | 2622210421 |
Жидкость тяжелая КК-2,6
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Жидкость тяжелая КК-2,6 | ТУ 6-09-02-424-87 | Ч | 2638430011 |
Соединения иода
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Йод (V) оксид | ТУ 6-09-5264-85 | Ч | 2611220031 |
| Йод (V) оксид | ТУ 6-09-5264-85 | ЧДА | 2611220032 |
Соединения кадмия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кадмий бромид 4-водный | ТУ 6-09-02-481-89 | Ч | 2623210071 |
| Кадмий гексафторосиликат 6-водный | ТУ 6-09-02-209-85 | Ч | 2623210181 |
| Кадмий гидроксид | ТУ 6-09-02-187-86 | Ч | 2611490111 |
| Кадмий метаванадат | ТУ 6-09-02-215-92 | Ч | 2623210091 |
| Кадмий метасиликат | ТУ 6-09-02-403-86 | Ч | 2623210171 |
| Кадмий молибдат для монокристаллов | ТУ 6-09-02-358-89 | ХЧ | 2623210653 |
| Кадмий пированадат | ТУ 6-09-02-70-89 | Ч | 2623210521 |
| Кадмий формиат 2-водный | ТУ 6-09-02-285-88 | Ч | 2634210571 |
Соединения калия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Калий гептамолибдат 10-водный | ТУ 6-09-02-52-88 | Ч | 2621130671 |
| Калий йодид для анализа органических перекисей | ТУ 6-09-02-244-90 | ХЧ | 2621130403 |
| Калий периодат | ТУ 6-09-02-364-99 | Ч | 2621130441 |
| Калий периодат | ТУ 6-09-02-364-99 | ЧДА | 2621130442 |
| Калий-кобальт (II) 10-ванадат (2:2:1) 16-водный | ТУ 6-09-02-24-85 | Ч | 2621131711 |
| Калий-медь йоднокислый | ТУ 6-09-02-83-84 | Ч |
|
| Калий-медь (II) сульфат (2:1:2) 6-водный | ТУ 6-09-02-305-88 | Ч | 2621130631 |
| Калий метаванадат | ТУ 6-09-02-193-99 | Ч | 2621130191 |
| Калий-никель (II) декаванадат (2:2:1) 17-водный | ТУ 6-09-02-25-87 | Ч | 2621131761 |
| Калий-никель (II) сульфат (2:1:2) 6-водный | ТУ 6-09-02-304-88 | ХЧ | 2621130773 |
Соединения кальция
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кальций бромат 1-водный | ТУ 6-09-02-278-93 | Ч | 2621220081 |
| Кальций йодид водный | ТУ 6-09-02-188-85 | Ч | 2621220181 |
| Кальций метаванадат 4-водный | ТУ 6-09-02-232-85 | Ч | 2621220091 |
| Кальций ортованадат | ТУ 6-09-02-447-87 | ХЧ | 2621220673 |
Соединения кобальта
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Кобальт (II) амидосульфат 4-водный | ТУ 6-09-02-61-88 | Ч | 2622220391 |
| Кобальт (II) метаванадат водный | ТУ 6-09-02-258-89 | Ч | 2622220071 |
| Кобальт молибдат для монокристаллов | ТУ 6-09-02-362-89 | ХЧ | 2622220693 |
| Кобальт хлористый 6-водный | ГОСТ 4525-77 | ЧДА | 2638420252 |
| Кобальт хлористый 6-водный | ГОСТ 4525-77 | Ч | 2622220191 |
Соединения магния
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Магний амидосульфат 3-водный | ТУ 6-09-02-179-86 | Ч | 2621210301 |
| Магний метаванадат | ТУ 6-09-02-10-93 | Ч | 2621210633 |
| Магний ортованадат | ТУ 6-09-02-324-89 | ХЧ | 2621210703 |
Соединения меди
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Медь (I) бромид | ТУ 2622-591-00205087-2004 | Ч | 2622240221 |
| Медь (I) бромид | ТУ 2622-591-00205087-2004 | ЧДА | 2622240222 |
| Медь (II) бромид | ТУ 6-09-02-428-87 | Ч | 2622240091 |
| Медь (II) иодат (паста) | ТУ 6-09-02-573-2000 | ||
| Медь (II) ортованадат 3-водный | ТУ 6-09-02-64-89 | Ч | 2622240081 |
| Медь (I) сульфид | ТУ 6-09-02-555-95 | Ч | 2622240301 |
Соединения натрия
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Натрий висмутат | ТУ 6-09-02-449-87 | ЧДА | 2621120222 |
| Натрий дигидроортопериодат | ТУ 6-09-02-276-88 | Ч | 2621121501 |
| Натрий метаванадат 2-водный | ТУ 6-09-02-151-88 | Ч | 2621120191 |
| Натрий метаванадат 2-водный | ТУ 6-09-02-151-88 | ЧДА | 2621120192 |
| Натрий селенистокислый | ТУ 6-09-17-209-88 | Ч | 2621120681 |
Соединения никеля
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Никель адипат | ТУ 6-09-02-315-89 | Ч | 2634220891 |
| Никель амидосульфат 4-водный электролит 55%-ный раствор | ТУ 6-09-02-554-99 |
|
|
| Никель (II) бромид | ТУ 6-09-02-257-87 | Ч | 2622230151 |
| Никель (II) гексафторосиликат 6-водный | ТУ 6-09-02-432-87 | Ч | 2622230251 |
| Никель (II) йодат 4-водный | ТУ 6-09-02-199-85 | Ч | 2622230231 |
| Никель (II) йодид | ТУ 6-09-02-438-87 | Ч | 2622230171 |
| Никель (II) метасиликат водный | ТУ 6-09-02-148-89 | Ч | 2622230241 |
| Никель (II) перхлорат 6-водный | ТУ 6-09-02-118-86 | Ч | 2622230491 |
| Никель (II) формиат 2-водный | ЛМ 6-09-02-3-88 | Ч | 2634212257 |
| Никель (II) фторид | ТУ 6-09-02-239-88 | Ч | 2622230551 |
Соединения олова
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Олово (II) йодид | ТУ 6-09-02-146-85 | Ч | 2623230031 |
| Олово (IV) йодид | ТУ 6-09-02-163-85 | ХЧ | 2623230143 |
| Олово (IV) йодид | ТУ 6-09-02-163-85 | Ч | 2623230141 |
Реактив Несслера K
2HgI4• KOH или K2HgI4• NaOH ТУ 6-09-2089-77 Внешний вид: раствор бледно-желтого цвета, разлагающийся на свету.
Применение: в лабораторной практике.
Класс опасности 6, подкласс 6.1, классификационный шифр 6162, серийный номер ООН 1643.
| Показатели качества | ЧДА (2638420122) |
| Показатель цветности | ≤ 4 |
| Чувствительность к иону NH4 | выдерживает испытание |
Гарантийный срок хранения 3 года.
Применение: в лабораторной практике для количественного определения воды объемным методом.
Поставляется в виде двух растворов:
Раствор II – раствор Йода в метиловом спирте.

Класс опасности 3, подкласс 3.2, классификационный шифр 3222, серийный номер ООН 1230.
| Показатели качества | ЧДА (264000) |
| Прозрачность | выдерживает испытание |
| Титр реактива Фишера по воде | ≥ 3,2 мг воды в 1 см3 реактива |
| Определение концентрации йода в растворе II | выдерживает испытание |
| Определение концентрации активных компонентов в растворе I | испытание выдерживает |
Гарантийный срок хранения 6 месяцев.
Внешний вид: насыщенный раствор комплексной ртутно-йодистой соли
Применение: в минералогии при классификации концентратов по удельному весу, при технической обработке горных пород (отделением органической части от неорганической).
Физико — химические данные: М.В. 786,41
Класс опасности 6, подкласс 6.1, классификационный шифр 6163, серийный номер ООН 1643.
| Показатели качества | Ч (2638420111) |
| Плотность при t=200C | 3.17-3.20 г/см3 |
Гарантийный срок хранения 3 года.
Внешний вид: насыщенный раствор ртутно-йодистой соли бария от желто-оранжевого цвета до красного.
Применение: предназначен для разделения минералов по удельному весу при анализе горных пород.
Физико — химические данные: М.В. 845,548
Класс опасности 6, подкласс 6.1, классификационный шифр 6163, серийный номер ООН 1643.
| Показатели качества | ЧДА (2638420111) |
| Плотность при t=200C | 3.4-3.5 г/см3 |
Гарантийный срок хранения 1 год.
Соединения свинца
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Свинец вольфрамат для монокристаллов | ТУ 6-09-02-355-89 | ХЧ | 2624230733 |
| Свинец (II) гексанитрокобальтат (III) 4-водный | ТУ 6-09-02-241-88 | Ч | 2624230211 |
| Свинец (II) гексафторосиликат 4-водный | ТУ 6-09-02-65-89 | Ч | 2624230231 |
| Свинец (II) молибдат | ТУ 6-09-02-240-88 | Ч | 2624230241 |
| Свинец (II) хромат плавленный, гранулированный | ТУ 6-09-02-414-86 | ЧДА | 2624230532 |
Соединения цинка
| Наименование реактива | НТД | Квалификация | Код ОКП |
| Цинк амидосульфат 4-водный | ТУ 6-09-02-167-86 | Ч | 2622250321 |
| Цинк бромид 2-водный | ТУ 6-09-02-72-84 | Ч | 2622250091 |
| Цинк (II) йодат 2-водный | ТУ 6-09-02-114-88 | Ч | 2622250151 |
| Цинк йодид | ТУ 6-09-02-443-87 | Ч | 2622250141 |
| Цинк йодид | ТУ 6-09-02-443-87 | ЧДА | 2622250142 |
| Цинк молибдат | ТУ 6-09-02-254-92 | Ч | 2622250191 |
| Цинк пированадат | ТУ 6-09-02-113-89 | Ч | 2622250471 |
| Цинк цитрат 2-водный | ТУ 6-09-02-510-91 | Ч | 2622250471 |
демонстраций — вулкан дихромата аммония
демонстрации — вулкан дихромата аммонияХимический вулкан:
Разложение дихромата аммония
Дихромат аммония, (NH 4 ) 2 Cr 2 O 7 , разлагается при нагревании с образованием оксида хрома (III) [Cr 2 O 3 ], газообразный азот и водяной пар:
(NH 4 ) 2 Cr 2 O 7 (с) ——> Cr 2 O 3 (с) + N 2 (г) + 4H 2 O (г)
При разложении дихромата аммония выделяются оранжевые искры и
бросает зеленые кристаллы оксида хрома (III) в воздух, производя эффект
это выглядит как миниатюрное извержение вулкана.
Образующиеся кристаллы оксида хрома (III) более «пушистые». чем исходные кристаллы дихромата аммония, и хотя многие масса исходных материалов улетучивается в виде пара, продукт выглядит как более крупный количество материала.
В следующих демонстрациях зажигается стопка дихромата аммония. с горелкой Бунзена, производящей эффект «вулкана». Обратите внимание на объем образовавшегося твердого зеленого оксида хрома (III) и расстояние до кристаллов были брошены.Во втором видеоролике показана аналогичная демонстрация на более близкое увеличение.
Видеоклип 1: НАСТОЯЩИЙ, 8,33 МБ
Видеоклип 2: НАСТОЯЩИЙ, 4,92 МБ
!!! Опасности !!!
Соли хрома вызывают раздражение кожи и дыхательных путей и являются
также канцерогенный.(Дихромат аммония содержит хром в
шестивалентная, форма Cr 6+ , показанная в фильме Эрин Брокович . ) Лучше всего провести эту демонстрацию на большом
кусок алюминиевой фольги, которую затем можно использовать для обертывания солей хрома
произведено.
) Лучше всего провести эту демонстрацию на большом
кусок алюминиевой фольги, которую затем можно использовать для обертывания солей хрома
произведено.
Процедуры
Разложение дихромата аммония: Bassam Z.Шахашири, Химическая Демонстрации: Справочник для учителей химии, том 1. Мэдисон: Издательство Висконсинского университета, 1983, стр. 81-82.
Список литературы
Марта Виндхольц (ред.), The Merck Index, 10-е изд. Rahway: Merck & Co., Inc., 1983.
Ингибирование водорода в системе влажного улавливания алюминиевой пыли с использованием раствора дихромата
Системы влажного пылеулавливания используются во всем мире для обработки алюминиевой пыли.Однако эти системы представляют опасность возгорания и взрыва водорода из-за реакции между алюминиевой пылью и водой с образованием водорода. В этом исследовании проводится полевое обследование системы влажного пылеулавливания на предприятии по производству распыленного алюминиевого порошка в Китае. Метод ингибирования водорода (HIM) был предложен для подавления образования водорода. Испытания на ингибирование образования водорода проводились на специализированном оборудовании, разработанном авторами. Экспериментальные данные показали, что HIM эффективно ингибирует реакцию алюминия с водой.Чтобы изучить изменения в частицах алюминия до и после нанесения HIM, использовали сканирующую электронную микроскопию (SEM), чтобы охарактеризовать морфологические изменения в алюминиевом порошке. Энергодисперсионная рентгеновская спектроскопия (EDS) показала, что Cr был равномерно распределен вокруг частиц алюминия, что указывает на то, что ингибирующая пленка равномерно покрывает эти частицы. Рентгеновскую фотоэлектронную спектроскопию (XPS) использовали для проверки валентности Cr в ингибирующей пленке, а дифракцию рентгеновских лучей (XRD) использовали для анализа химического состава пленки после обработки HIM.Результаты показали, что Cr (OH) 3 и Al (OH) 3 широко распространены в ингибирующей пленке, подтверждая эффективность HIM. Обсужден механизм реакции между алюминиевой пылью и растворами бихромата и установлена модель кинетики химической реакции ингибирования образования водорода. Обсуждались экологические вопросы использования бихроматных растворов. Использование HIM позволило максимально снизить стоимость влажной системы пылеулавливания и риска возгорания или взрыва в водороде.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй еще раз?желтого покрытия дихроматом алюминия Гладханд 90 градусов держателя шарнирного соединения
/ {{vm.product.unitOfMeasureDescription || vm.product.unitOfMeasureDisplay}}
{{section.sectionName}}:
{{option.description}}
{{раздел.sectionName}} Выберите {{section.sectionName}}
.{{styleTrait.nameDisplay}} {{styleTrait.unselectedValue? «»: «Выбрать»}} {{styleTrait.unselectedValue? styleTrait.unselectedValue: styleTrait.nameDisplay}}
- Атрибуты
- Документы
- {{Технические характеристики.nameDisplay}}
- Атрибуты
- Документы
| Марка | |
| {{attributeValue.valueDisplay}} {{$ last? »: ‘,’}} |
| Марка | |
| {{attributeValue.valueDisplay}} {{$ last? »: ‘,’}} |
доля
Электронное письмо было успешно отправлено. Электронное письмо не было отправлено, проверьте данные формы.
×Состав и использование дихроматного уплотнения для анодированного алюминия
Образование, Алоха и большинство
весело вы можете получить в отделке
№1 в мире по отделочным материалам с 1989 года
Вход в систему не требуется: звоните прямо сейчас
Обсуждение началось в 1998 г., но продолжаются до 2019 г.
Дихромат натрия vs.дихромат калия
1998 г.В. У меня есть работа по анодированию на Mil-A-8625 [ссылка на бесплатную спецификацию в Управлении логистики обороны, dla.mil] Тип II, класс 1 с печатью из бихромата калия . В настоящее время при необходимости мы используем уплотнение из дихромата натрия . Кто-нибудь знает о каких-либо преимуществах дихромата калия или они взаимозаменяемы?
Дэвид А. Крафт— Лонг-Айленд-Сити, Нью-Йорк
1998
А. Привет, Дэйв,
Калий представляет собой атом немного меньшего размера, чем натрий, и немного быстрее проходит через диффузионный слой.Я серьезно сомневаюсь, есть ли какая-либо разница с функциональной точки зрения между ними при использовании в качестве уплотнения.
Вы должны будете получить «откуп» клиента, чтобы получить законную сертификацию на соответствие требованиям Mil Spec. Вы можете попросить контролирующее агентство сделать его натрием или калием. У вас есть веские основания. На обработку изменений у них уйдет около года. Государственные служащие не заинтересованы в том, чтобы работать на себя, и прежде чем они осмелятся принять решение, им нужно согласовать множество представителей отрасли.
Джеймс Уоттс— Наварра, Флорида
1998
A. С химической точки зрения они почти идентичны. И натрий, и калий отдают ванне один + заряд.
Джеральд Янссенанодирование рулона — Стримвуд, Иллинойс
1998
A. MIL-A-8625E, 25 апреля 88, в соответствии с 3.8.1.1, частично заявляет, что вы можете использовать бихромат натрия, кипящую деионизированную воду или другие подходящие химические растворы. Бихромат калия подходит для моей книги, потому что мы указали его в спецификации процесса в Bendix.Если ваш клиент позвонит, я бы сказал, что он подходит.
Tom Pullizzi
Falls Township, Пенсильвания
2003
В. Привет!
У НАС УЖЕ ЕСТЬ МАЛЕНЬКАЯ УСТАНОВКА ДЛЯ АНОДИРОВАНИЯ И МЫ ХОЧЕМ СДЕЛАТЬ ДИХРОМАТНОЕ УПЛОТНЕНИЕ НА ДЕТАЛЯХ (ВЫГЛЯДИТ ЗЕЛЕНО-ЖЕЛТЫМ).
ГДЕ Я МОГУ НАЙТИ ИНФОРМАЦИЮ ОБ ЭТОМ ПРОЦЕССЕ?
СПАСИБО,
STEVE POUDRIER— Виктириавиль, Квебек, Канада
Требуется анодирование черного цвета, но уплотнение из дихромата зеленоватого цвета
2004 г.В.У меня проблема с получением алюминиевых деталей, которые должны быть черными, но на самом деле имеют зеленоватый оттенок. Наше приложение таково, что детали должны быть черными … зеленоватый оттенок не допускается. Мой процесс финишной обработки — анодирование TY 2, CL 2 Black по стандарту подачи 595, 37038 и запечатывание дихроматом по стандарту Mil-A-8625 [ссылка на бесплатную спецификацию в Defense Logistics Agency, dla.mil]. Кажется, что у разных пластин разные причины проблемы, но иногда детали имеют черный, а иногда зеленый оттенок. Как добиться однородного черного цвета? Достаточно ли моей финишной выноски?
Спасибо!
Скотт Хиггинсmfgr — Орландо, Флорида, США
2004
А.Полуобоснованное предположение состоит в том, что черный цвет представляет собой краситель на основе металла, а зеленый цвет представляет собой краситель на органической основе, с которым реагирует хромат. Переключитесь на уплотнение на основе никеля, и у вас должны быть хорошие результаты и черная отделка с обоими красителями, плюс вы устранили источник шестигранного хрома, который радует многих любителей дерева.
Джеймс Уоттс— Наварра, Флорида
2004
A. Дихроматные уплотнения ВСЕГДА при правильном применении имеют желто-зеленоватый оттенок. Дихроматные уплотнения обеспечивают лучшую защиту от коррозии.Дихроматные уплотнения никогда не следует использовать для окрашенных работ: не только потому, что они меняют цвет красителя, но также потому, что дихроматные уплотнения обеспечивают максимальную защиту от коррозии, а ВСЕ красители немного снижают защиту от коррозии. Так зачем же нанести черный краситель, чтобы снизить защиту от коррозии, а затем обесцветить его дихроматом, который повысит защиту от коррозии? Или просто выстрелил себе в ногу !
Роберт Х. ПробертРоберт Х. Проберт Техническая служба
Гарнер, Северная Каролина
2005
А.Привет, прочтите раздел 6.11 Mil-a-8625f, в котором объясняется, как дуплексное уплотнение — никелевое уплотнение, а затем дихромат. Также 3.5 последнее предложение.
Джон Дж. Кроуэлл— Нью-Порт-Бич, Калифорния
Состав разбавленного хроматного уплотнения?
2007 г.В. У меня возникли проблемы с поиском информации о макияже на герметичном резервуаре для разбавленного хромата. У меня есть деионизированная вода и хлопья Cr, но я знаю, что в макияже есть еще кое-что. Если бы кто-нибудь мог предоставить рецепт резервуара на 841 галлон, я был бы очень признателен.Спасибо за ваше время и внимание.
Дерек МакКаслендХимический аналитик — Камден, Арканзас
2007 г.
A. 1. Дихроматное уплотнение для обычного анодирования алюминия типа II будет состоять из 100 г / литр (13,333 авивир. Унций / галлон) дихромата натрия или калия, 200-212 ° F, pH 5,0-6,0, скорректированный натрием. или гидроксид калия и уксусная кислота.
2. Уплотнением для анодирования хромовой кислотой типа I будет бихромат натрия от 6 до 8 унций / галлон, pH 5,0-6,0 с NaOH или уксусной кислотой, 194–212 ° F
3.Однако, если это анодирование хромовой кислотой для Boeing, используйте: на 100 галлонов: 26 граммов хромовой кислоты и 26 граммов хромата натрия или магния, pH 3,2–3,8, 180–200 ° F.
Роберт Х. ПробертРоберт Х. Проберт Техническая служба
Гарнер, Северная Каролина
Уплотнение из бихромата калия оставляет зеленую порошкообразную окраску
5 мая 2014 г.В. Привет всем,
Мы столкнулись с некоторыми проблемами при герметизации алюминиевого материала 2219 дихроматом калия.Покрытие становится зеленоватой пудрой. Мы проверили резервуар для серного анодирования, и процесс стабильный без порошка. Порошок появляется только после запайки. Требуемая толщина соответствует, за исключением порошкообразной поверхности.
Первоначально мы думали, что дихромат калия был исчерпан после непрерывной доливки в течение нескольких лет, но после новой смеси порошкообразная поверхность все еще существует. Здесь нам нужна помощь с некоторыми профессиональными идеями. Спасибо.
HL Yap— Пенанг, Малайзия
23 мая 2014 г.
А.Привет, HL,
Мне кажется, что вы чрезмерно обрабатываете детали, слишком долго оставляя их в уплотнении. Простое решение — сократить время нахождения в уплотнении.
Брайан ТерриAerospace — Йовил, Сомерсет, Великобритания
26 марта 2015
В. Сэр, мой вопрос о окрашивании деталей, анодированных алюминием, заключается в том, есть ли альтернатива бихромату калия или натрия, поскольку эти химические вещества являются высококанцерогенными из-за содержания Cr VI. Можно ли использовать органические зеленые красители вместо таких канцерогенных химикатов?
Хаммад Абдул Хасиб— Исламабад, Пакистан
марта 2015
А.Привет, Хаммад Абдул. Большинство анодированных деталей, вероятно, не содержат Cr VI. Так что да, теоретически возможно окрашивание в зеленый цвет с последующим другим типом уплотнения.
Но, пожалуйста, не оставляйте вопрос абстрактным. Вместо этого постарайтесь как можно лучше описать вашу реальную ситуацию: кто вы (спецификатор, анодизатор и т. Д.) … кто пишет спецификацию … какова спецификация … какие части … как они использовали … и т.д. Простой ответ на вопрос о том, что теоретически возможно, может ввести вас в заблуждение, а не помочь вам 🙁
С уважением,
Тед Муни, П.E. RET
Алоха — идея, достойная распространения
finish.com — Пайн-Бич, Нью-Джерси
27 марта 2015 г.
В. Сэр, мой вопрос о канцерогенности дихромата калия (источник Cr VI) возникает во время окрашивания, когда анодированные детали погружаются в этот краситель, непрерывно нагреваются до точки кипения и испаряются Cr VI. Не вопрос об анодированной части после запечатывания в дихромате калия, в которой краситель заключен, а затем в порах, которые не открываются и также уменьшены до некоторой степени, я думаю, до Cr III (неканцерогенный), если я могу объяснить свой вопрос, как указано выше, для вас, сэр ,
Я студент университета НИТУ, работаю над проектом анодирования нанопористой структуры, а также над ее окрашиванием некоторыми безопасными химическими веществами в поисках; это простой вопрос, если у вас есть какое-то представление о крашении безопасными химикатами, пожалуйста.
С уважением
Хаммад Абдул Хасиб [возвращается]— Исламабад, Пакистан
марта 2015 г.
A. Привет еще раз. Как уже отмечалось ранее, да, детали можно красить органическими красителями, и обычно это так. Я лично никогда не слышал об этом процессе погружения анодированных деталей в кипящую Cr VI для их окраски. Почему вы хотите окунуть их в шестивалентный хром вместо зеленого органического красителя?
С уважением,
Тед Муни, P.E. RET
Алоха — идея, достойная выкладывания
отделки.com — Пайн-Бич, Нью-Джерси,
, 2 апреля 2015 г.
A. Hi Hammad,
Анодирование уплотнений в растворах Cr (VI) обычно выполняется для повышения коррозионной стойкости. Получающийся в результате желто-зеленый цвет является побочным продуктом процесса, дихроматные уплотнения на самом деле не используются для придания цвета.
Если вам нужен только цвет, используйте органические красители, можно использовать многие имеющиеся в продаже красители, я даже раньше успешно использовал красители для одежды (не идеальные, но подходящие условия, и это сработает).
Aerospace — Йовил, Сомерсет, Великобритания
2 апреля 2015 г.
В. Сэр,
И снова остается вопрос, являются ли герметизирующие растворы дихроматом калия или натрия источниками CrVI, которые являются канцерогенными или нет?
— Исламабад, Пакистан
апрель 2015 г.
A. Еще раз привет, Хаммад. Да, дихроматы калия или натрия являются канцерогенными источниками CrVI — как вы сами сказали в своей первой публикации. Возможный источник путаницы в этом состоит в том, что для практических целей постановления правительства, а не знания Бога определяют то, что мы называем «канцерогенным».Например, пару десятилетий назад их называли «возможными канцерогенами» или «вероятными канцерогенами» … фактические факты, касающиеся канцерогенности, не изменились в тот период — изменились знания и законы.
С уважением,
Тед Муни, P.E. RET
Алоха — идея, достойная распространения
finish.com — Пайн-Бич, Нью-Джерси
27 февраля 2018
В. Можно ли покрасить деталь, которая должна быть черной после печати из бихромата натрия?
Может ли печать быть окрашена в черный цвет или, по крайней мере, в более черный цвет, чем тот светло-зеленый серый цвет, который мы имеем сейчас?
Спасибо
Механический цех — Бриджпорт, Нью-Йорк, США
9 апреля 2018
А.Привет, Боб,
. То, как работает подавляющее большинство анодирующих красителей, осаждается в порах анодированной поверхности, а затем навсегда закрепляется на месте во время процесса герметизации — вы просто не добьетесь успеха, пытаясь покрасить поверх уплотнения. Я также не стал бы пытаться тонировать ванну с дихроматным уплотнением, поскольку это недопустимо согласно спецификации, и я бы не стал доверять уплотнению — добавление азокрасителя к тому, что в конечном итоге будет поверхностным слоем, побеждает цель использования такого прочного уплотнения. метод для начала.Я собираюсь предположить, что вы используете дихроматное уплотнение, потому что на него есть вызов клиента, и вы не сможете обеспечить покрытие, как это было сказано, из-за того, что возитесь с составом уплотнительной ванны.
Черный краситель под никелевым уплотнением довольно стандартный и не меняет цвет, если покупатель согласен с никелевым уплотнением.
В стороне, в этой теме много упоминаний о «порошкообразной» отделке поверхности на деталях, запечатанных дихроматом, и работа при pH 6,6, который выше общепринятого целевого значения, но приемлемый в рамках спецификации, очень сработал. хорошо для нас как с точки зрения визуальных результатов, так и с точки зрения солевого тумана.
Рэйчел Макинтош
Специалист по контролю за решениями для нанесения покрытий /
Очистка промышленных сточных вод — Браттлборо, Вермонт
30 августа 2019
В. Согласно техническим условиям заказчика температура кипения дихроматной герметизирующей ванны должна быть> = 98 ° C. Наша ванна для уплотнения из дихромата, расположенная в Бангалоре, кипит около 94 ° C. Помещение пластиковых шариков в эту ванну повысит температуру кипения, ограничив испарение?
Дебашиш ШильMach Aero Components Pvt.Ltd. — Бангалор, Карнатака, Индия
сентябрь 2019
А. Привет, Дебашиш. Я не думаю, что пластиковые шарики действительно изменят температуру кипения. Температура кипения воды должна быть 94 ° C на высоте около 1700 метров (5600 футов), что, я считаю, выше, чем в Бангалоре — вы проверяли это с помощью нескольких термометров? Но кажется, что температура кипения воды в Бангалоре действительно ниже 98 ° C.
Хромовая кислота должна поднять точку кипения, но, вероятно, ненамного (я не могу легко найти диаграмму для дихромата).Не могли бы вы дать нам номер спецификации, чтобы мы могли лучше понять это требование?
С уважением,
Тед Муни, P.E. RET
Алоха — идея, достойная распространения
finish.com — Пайн-Бич, Нью-Джерси
finish.com стало возможным благодаря …
этот текст заменен на bannerText
Заявление об ограничении ответственности: на этих страницах невозможно полностью диагностировать проблему отделки или опасности операции. Вся представленная информация предназначена для общего ознакомления и не отражает профессионального мнения или политики работодателя автора.Интернет в основном анонимный и непроверенный; некоторые имена могут быть вымышленными, а некоторые рекомендации могут быть вредными.
Если вы ищете продукт или услугу, связанную с отделкой металлов, посетите следующие каталоги:
О нас / Контакты — Политика конфиденциальности — © 1995-2021 finish.com, Pine Beach, New Jersey, USA
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Изготовление супергидрофобной поверхности алюминиевого сплава методом фосфорной кислоты-дихромата
[1] Р.М. Ву, С. К. Лян, З. К. Юань и др.: Appl. Прибой. Sci., Vol. 258 (2012), стр 5933-5937.
[2] З.Г. Го, W.M. Лю, Б. Вс: Дж.Коллоид. Интерф. Sci., Vol. 353 (2011), стр. 335-355.
[3] Мак-Кинли, К. Глисон: Nano Lett., Vol. 3 (2003), стр 1701-1705.
[4] Н.Дж. Шермклифф, Г. Макхейл, М. И. Ньютон: J. Polym. Sci., Часть B: Polym. Физ., 49 (2011) 1203-1217.
[5] Накадзима А., Фудзисима А., Хашимото К. и др.: Adv.Mater., Vol. 11 (1999), стр. 1365-1368.
[6] Накадзима А: Дж. Керам. Soc. Jpn., Vol. 112 (2004), стр. 533-540.
[7] Z.H, Lamb R, Lewis J: Sci. Technol. Adv. Мат., Т. 6 (2005), стр 236-239.
[8] З. Ф. Хуанг, Л. Ю. Сунь, Ю. Т. Ло, Ю. Лю, Р.M. Wu, Z. Q. Yuan: Journal of Hunan University of Technology, Vol. 25 (2011), стр. 5-8.
Анодирование для морского применения?
Есть четыре типа уплотнений, которые обычно используются для серного анодирования. и твердое анодирование:
- Уплотнение горячей водой
- Дихроматное уплотнение (дихромат натрия или дихромат калия — ионы натрия / калия не влияют на производительность, дихромат-ион обеспечивает функциональное преимущество).
- Уплотнение из ацетата никеля (уплотнение из ацетата кобальта очень похоже, но не широко используется, по крайней мере, в Великобритании)
- Холодное уплотнение
Первые три используются в морских целях и заслуживают обсуждения. При использовании на море лучше избегать холодного запечатывания. Все первые три уплотнения имеют один и тот же механизм действия (хотя уплотнение из ацетата никеля является двойным). действие), которое заключается в гидратации оксида алюминия, в результате чего он расширяется и закрывает поры. Никель Ацетат также имеет второй механизм уплотнения, он образует пробку из гидроксида никеля в поре.Дихромат уплотнение не улучшает само уплотнение, но дихромат-ионы являются ингибитором коррозии и становятся герметизирован в покрытии, что значительно улучшает коррозионную стойкость, особенно на алюминии с высоким содержанием меди сплавы (серия 2000, которые могут быть проблематичными с точки зрения коррозионной стойкости).
Ваш выбор действительно между уплотнением с горячей водой и уплотнением из ацетата никеля. Все соединения шестивалентного хрома, включая бихроматы, становятся все более ограниченными (в частности, регламенты REACH и RoHS), а также мы бы не рекомендовали их для новых продуктов за пределами аэрокосмической / оборонной промышленности и даже в тех случаях мы бы не поощряли их использование.Дуплексные уплотнения с дихроматом натрия и ацетатом никеля обеспечивают лучшая коррозионная стойкость, но действуют те же проблемы, что и выше
Поскольку уплотнение из ацетата никеля осуществляется двумя отдельными механизмами, оно должно обеспечивать превосходные характеристики. тем не мение как никель-ацетатное уплотнение, так и уплотнение для кипящей воды обеспечивают очень хорошую коррозионную стойкость. В выдержка в нейтральном солевом тумане, соответствующая отраслевому стандарту, составляет 336 часов (которую мы регулярно тестируем на 2024-T3 алюминий), не имеют разницы между ними, и они оба проходят без проблем.На более длительный срок Мы ожидаем, что ацетат никеля обеспечит превосходные характеристики, но обычно это не проверяется.
Обратите внимание, что в этой статье упоминается уплотнение из ацетата никеля, которое мы используем, что термостойкое уплотнение (96 ° C и выше, как у кипятка). На корпусе есть другие уплотнения из ацетата никеля. рынок, работающий при более низких температурах — они могут не получить выгоду от двойных механизмов уплотнения.
Нет существенной разницы в стоимости, времени выполнения работ или другом качестве ни для горячей воды, ни для никеля. ацетатное уплотнение.
При необходимости коррозионную стойкость анодирования можно дополнительно повысить путем нанесения подходящая схема окраски. Если нанесение схемы окраски поверх анодированного покрытия практично и экономично, это обеспечит самый долгий срок службы продукта.
Заявление об ограничении ответственности
Эта страница предназначена только для информации, ее не следует рассматривать как совет, и мы не несем никакой ответственности за использование вами информации на этой странице.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов солей.
Допустимо использование водных растворов солей. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.