Оксид цинка — Википедия
| Оксид цинка | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Цинка оксид |
| Хим. формула | ZnO |
| Состояние | твёрдое |
| Молярная масса | 81,408 г/моль |
| Плотность | 5,61 г/см³ |
| Температура | |
| • плавления | 3587 ± 1 °F[1] |
| • сублимации | 1800 °C |
| Мол. теплоёмк. | 40,28 Дж/(моль·К) |
| Энтальпия | |
| • образования | -350,8 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Показатель преломления | 2,015 и 2,068 |
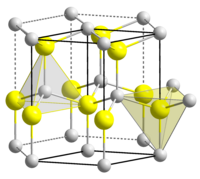
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 |
| Рег. номер CAS | 1314-13-2 |
| PubChem | 14806 |
| Рег. номер EINECS | 215-222-5 |
| SMILES | |
| InChI | |
| RTECS | Zh5810000 |
| ChEBI | Zh5810000 |
| ChemSpider | 14122 |
| Предельная концентрация | аэрозоль в воздухе рабочей зоны 0,5 мг/м3 в атмосферном воздухе 0,05 мг/м3 |
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку |
| Фразы риска (R) | R50/53 |
| Фразы безопасности (S) | S60, S61 |
| Краткие характер. опасности (H) | h510 |
| Меры предостор. (P) | P273 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Окси́д ци́нка (о́кись цинка) ZnO — бесцветный кристаллический порошок, нерастворимый в воде, желтеющий при нагревании и сублимирующийся при 1800 °C.
Физические свойства[править | править код]
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ. Естественное смещение стехиометрического отношения в сторону обогащения кислородом придаёт ему электронный тип проводимости.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещённой зоны и сдвигом края в спектре поглощения из УФ-области в синюю область видимого спектра.
Химические свойства[править | править код]
Химически оксид цинка амфотерен — реагирует с кислотами с образованием соответствующих солей цинка, при взаимодействии с растворами щелочей образует комплексные три- тетра- и гексагидроксоцинкаты (например, Na 2[Zn(OH)4], Ba2[Zn(OH)6] и др.):
- [Zn(OH)3]−+OH−⟶[Zn(OH)4]2−⋅{\displaystyle {\ce {[Zn(OH)3]- + OH- -> [Zn(OH)4]^2-.}}}
Оксид цинка растворяется в водном растворе аммиака, образуя комплексный аммиакат:
- ZnO+4Nh4+h3O⟶[Zn(Nh4)4](OH)2⋅{\displaystyle {\ce {ZnO + 4Nh4 + h3O -> [Zn(Nh4)4](OH)2.}}}
При сплавлении со щелочами и оксидами некоторых металлов оксид цинка образует цинкаты:
- ZnO+2NaOH⟶Na2ZnO2+h3O;{\displaystyle {\ce {ZnO + 2NaOH -> Na2ZnO2 + h3O;}}}
- ZnO+CoO⟶CoZnO2⋅{\displaystyle {\ce {ZnO + CoO -> CoZnO2.}}}
При сплавлении с оксидом бора и диоксидом кремния оксид цинка образует стеклообразные бораты и силикаты:
- ZnO+B2O3⟶Zn(BO2)2;{\displaystyle {\ce {ZnO + B2O3 -> Zn(BO2)2;}}}
- ZnO+SiO2⟶ZnSiO3⋅{\displaystyle {\ce {ZnO + SiO2 ->ZnSiO3.}}}
При смешивании порошка оксида цинка с концентрированным раствором хлорида цинка образуется быстро (за 2—3 минуты) твердеющая масса — цинковый цемент[3].
Известен природный минерал цинкит, состоящий в основном из оксида цинка.
- Сжиганием паров цинка в кислороде («французский процесс»).
- Термическим разложением некоторых солей цинка:
- Окислительным обжигом сульфида ZnS.
- С помощью гидротермальный синтез[4]
- Извлечением из пылей и шламов заводов чёрной металлургии, особенно перерабатывающих металлолом (он содержит значительную долю оцинкованного железа).
Оксид цинка широко применяют в химической, фармацевтической промышленности. Применяется в составе зубных паст и цементов в терапевтической стоматологии, в косметических кремах для загара и косметических процедурах, в производстве в качестве наполнителя резины, искусственной кожи и резинотехнических изделий. Применяется в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка применяют при производстве стекла и керамики.
В химической промышленности[править | править код]
Известно также, что оксид цинка обладает фотокаталитической активностью[источник не указан 366 дней], что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется[источник не указан 366 дней].
В электронике[править | править код]
Оксид цинка применяется для производства варисторов, которые используются в современных ограничителях перенапряжений (ОПН) взамен морально устаревших газонаполненных разрядников.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров[источник не указан 366 дней]. На основе оксида цинка создан светодиод голубого цвета[источник не указан 366 дней].
Тонкие плёнки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры[источник не указан 366 дней].
Также оксид цинка входит в состав теплопроводных паст, например, пасты КПТ-8.
В медицине[править | править код]
 Туба с цинковой мазью
Туба с цинковой мазьюВ медицине используется в качестве компонента лекарственных средств наружного применения, используемых в дерматологии. Обладает противовоспалительным, подсушивающим, адсорбирующим, вяжущим и антисептическим действием.
Применяют в виде присыпки, мази, пасты, линимента. Является одним из компонентов ряда комплексных дерматологических и косметических препаратов, таких как «Цинковая мазь», «Паста Лассара» и пр.
Фармакологическое действие обусловлено тем, что оксид цинка образует альбуминаты и денатурирует белки. При нанесении на поражённую поверхность уменьшает явления экссудации, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов.
Может применяться при дерматите, в том числе пелёночном, опрелостях, потнице, поверхностных ранах и ожогах (солнечные ожоги, порезы, царапины), язвенных поражениях кожи (трофических язвах), пролежнях, экземе в стадии обострения, простом герпесе, стрептодермии.
Соединение малотоксично, но его пыль вредна для органов дыхания, ПДК в воздухе рабочих помещений — 0,5 мг/м³ (по ГОСТ 10262-73). Пыль соединения может образовываться при термической обработке изделий из латуни.
- Перельман В. И. Краткий справочник химика. — М.-Л.: Химия, 1964.
- Бовина Л. А. и др. Физика соединений AIIBVI / под ред. А. Н. Георгобиани, М. К. Шейнкмана. — М.: Наука, Гл. ред. физ.-мат. лит., 1986. — 319, [1] с.: рис., табл. — 2600 экз.
- Статья «Цинка окись» в Большой советской энциклопедии.
- Özgür Ü., Alivov Ya. I., Liu C., Teke A., Reshchikov M. A., Doğan S., Avrutin V., Cho S.-J., Morkoç H. A comprehensive review of ZnO materials and devices // Journal of Applied Physics. — 2005. — Vol. 98. — P. 041301. — ISSN 00218979. — DOI:10.1063/1.1992666.
Вопрос№62. Цинк. Общая характеристика. Амфотерность гидроксида. Комплексные соединения. Ферменты. Применение в животноводстве.
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn. Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + h3O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + h3↑,
Zn + h3SO4(разб.) = ZnSO4 + h3↑
и растворами щелочей:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. Сульфид цинка используется для синтеза люминофоров временного действия и разного рода люминесцентов на базе смеси ZnS и CdS. Люминофоры на базе сульфидов цинка и кадмия, так же применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
Гидрокси́д ци́нка — амфотерный гидроксид, имеющий формулу Zn(OH)2. Находит широкое применение в различных отраслях химии.
Получение


Химические свойства




Вопрос№63. Ртуть. Свойства ртути и ее соединений. Соединения ртути как лекарственные препараты.
Ртуть — элемент побочной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 80. Обозначается символом Hg. Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии.
Получение
Ртуть получают сжиганием киновари (Сульфида ртути(II)). Этот способ применяли алхимики древности. Уравнение реакции горения киновари: HgS+O2→Hg+SO2
Химические свойства
При нагревании до 300 °C ртуть вступает в реакцию с кислородом: 2Hg + O2 → 2HgO Образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ. Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II).
Ртуть не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте, образуя соли двухвалентной ртути. При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
Соединения ртути
Ртуть и её соединения применяются в технике, химической промышленности, медицине. Желтый оксид ртути(II) входит в состав глазной мази и мазей для лечения кожных заболеваний. Красный оксид ртути(II) применяется для получения красок. Хлорид ртути(I), который называется каломель, используется в пиротехнике, а также в качестве фунгицида. В ряде стран каломель используется в качестве слабительного. Токсическое действие каломели проявляется особенно тогда, когда после приема её внутрь не наступает слабительное действие и организм долгое время не освобождается от этого препарата. Хлорид ртути(II), который называется сулема, является очень токсичным. Сулема применялась в медицине как дезинфицирующее средство, в технике она используется для обработки дерева, получения некоторых видов чернил, травления и чернения стали. В сельском хозяйстве сулема применяется как фунгицид. Амидохлорид ртути (белый преципитат ртути) входит в состав некоторых мазей. В ветеринарии амидохлорид ртути применяется как средство против паразитарных заболеваний кожи. Нитрат ртути(II) применяется для отделки меха и получения других соединений этого металла. Токсичность нитрата ртути(II) примерно такая же, как и токсичность сулемы. Многие органические соединения ртути используются в качестве пестицидов и средств для обработки семян. Отдельные органические соединения ртути применяются как диуретические средства.
Оксид цинка, характеристика, свойства и получение, химические реакции
Оксид цинка, характеристика, свойства и получение, химические реакции.
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка
Физические свойства оксида цинка
Получение оксида цинка
Химические свойства оксида цинка
Химические реакции оксида цинка
Применение и использование оксида цинка
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 оС сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.) цинкит (рус.) цинковые белила (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5610 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,61 |
| Температура сублимации, °C | 1800 |
| Температура плавления, °C | 1975 |
| Молярная масса, г/моль | 81,408 |
| Теплопроводность, Вт/(м·К) | 54 |
* Примечание:
— нет данных.
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
- 1. сжиганием цинка в кислороде:
2Zn + О2 → 2ZnО (t > 250 oC).
- 2. путем термического разложения гидроксида цинка:
Zn(OH)2 → ZnO + H2О (t = 100-250 oC).
- 3. путем термического разложения карбоната цинка:
ZnCO3 → ZnO + CO2 (t = 200-300 oC).
- 4. путем термического разложения нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2 (t = 300-500 oC).
- 5. путем окислительного обжига сульфида цинка:
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 oC).
- 6. путем термического разложения ацетата цинка.
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 oC).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 oC.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 oC),
2ZnО + SiО2 → Zn2SiО4 (t = 900-1000 oC).
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
ZnО + SО2 → ZnSО3.
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
ZnО + B2О3 → Zn(BО2)2.
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО → Zn + CO2 (t = 700 oC).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО → BaZnО2 (t = 1100 oC).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
ZnО + CrО3 → ZnCrО4.
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
ZnО + Fe2О3 → Fe2ZnО4 (t = 800-1000 oC),
ZnО + Fe2О3 → ZnFe2О4 (t = 800-1000 oC).
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
ZnО + MoО3 → ZnMoО4.
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
2ZnО + VО2 → Zn2VО4 (t = 1500-1700 oC).
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
3ZnО + MnО2 → MnZn3О5 (t = 700-800 oC),
ZnО + Mn2О3 → ZnMn2О4 (t = 900 oC).
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 → ZnWО4 (t = 600-800 oC).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 oC).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
ZnO + 2HF → ZnF2 + H2O.
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
ZnO + 2HNO3 → 2Zn(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
3ZnO + 2H3PO4 → Zn3(PO4)2 + 3H2O.
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
ZnO + 2HBr → ZnBr2 + H2O.
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
ZnO + 2HI → ZnI2 + H2O.
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 oC).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 oC).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 oC),
ZnO + 2NaOH + H2O → Na2[Zn(OН)4] (t = 90 oC).
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 oC.
23. реакция оксида цинка с гидратом аммиака:
ZnО + 4(NH3•H2O) → [Zn(NH3)4](OH)2 + 3H2O.
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
ZnО + 2NH4Cl → ZnCl2 + 2NH3 + H2O (t°).
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
оксид цинка реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида цинка
реакции с оксидом цинка
Коэффициент востребованности 2 060
Цинк — общая характеристика элемента, химические свойства цинка и его соединений
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d104s2. В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Краткий конспект подготовки к ЗНО по химии №12 Амфотерные соединения
Конспект 12. Амфотерные соединения
Амфотерность (двойственность свойств) гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов солей.
Эти соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры амфотерных оксидов
|
Амфотерные оксиды |
|
|
Формула |
Названия |
|
Оксид берия (II) |
|
|
Оксид цинка |
|
|
Оксид алюминия |
|
|
Оксид хрома III) |
|
|
Оксид мышьяка (III) |
|
|
Оксид германия (II) |
|
|
Оксид свинца (IV) |
|
|
Оксид марганца (IV) |
|
|
Оксид железа (III) |
|
|
Оксид олова (II) |
|
Химические свойства амфотерных оксидов цинка и алюминия
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
1. Взаимодействие с основными оксидами и основаниями:
(цинкат натрия). Оксид цинка ведет себя как кислотный.
2. Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
(фосфат цинка)
Аналогично оксиду цинка ведет себя и оксид алюминия:
3. Взаимодействие с основными оксидами и основаниями:
(метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
4. Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
(фосфат алюминия)
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
Химические свойства амфотерных оксидов цинка и алюминия в растворах
(тетрагидроксоцинкат натрия)
(тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
Химические свойства амфотерных гидроксидов цинка и алюминия
Реакции гидроксидов цинка и алюминия с оксидом натрия происходят при сплавлении, потому что эти гидроксиды твердые и не входят в состав растворов.
Гидроксид алюминия.
соль называется цинкат натрия.
соль называется метаалюминат натрия.
Реакции амфотерных оснований со щелочами характеризует их кислотные свойства. Данные реакции можно проводить как при сплавлении твердых веществ, так и в растворах. Но при этом получатся разные вещества, т.е. продукты реакции зависят от условий проведения реакции: в расплаве или в растворе.
тетрагидроксоалюминат натрия
гексагидроксоалюминат натрия.
Получается тетрагидроксоалюминат натрия или гексагидроксоалюминат натрия зависит от того, сколько щелочи мы взяли. В последней реакции щелочи взято много и образуется гексагидроксоалюминат натрия.
Химические свойства амфотерных цинка и алюминия
Элементы, которые образуют амфотерные соединения, могут сами проявлять амфотерные свойства.
Разложение амфотерных оснований при нагревании
Напомним о том, что амфотерные гидроксиды являются нерастворимыми основаниями. И при нагревании разлагаются , образуя оксид и воду.
Гидроксид цинка — Википедия
Материал из Википедии — свободной энциклопедии
Гидрокси́д ци́нка — амфотерный гидроксид, имеющий формулу Zn(OH)2. Находит широкое применение в различных отраслях химии.
Гидроксид цинка при стандартных условиях представляет собой бесцветные кристаллы, является аморфным веществом. В настоящее время известно 5 полиморфных модификаций, из которых устойчивой является только модификация с ромбической сингонией. Гидроксид цинка практически нерастворим в воде, проявляет амфотерные свойства (с преобладанием основных).[1]
ZnCl2+2NaOH⟶Zn(OH)2↓+2NaCl{\displaystyle {\mathsf {ZnCl_{2}+2NaOH\longrightarrow Zn(OH)_{2}\downarrow +2NaCl}}}
Zn(NO3)2+2KOH⟶Zn(OH)2↓+2KNO3{\displaystyle {\mathsf {Zn(NO_{3})_{2}+2KOH\longrightarrow Zn(OH)_{2}\downarrow +2KNO_{3}}}}
Zn(OH)2+2HCl⟶ZnCl2+2 h3O{\displaystyle {\mathsf {Zn(OH)_{2}+2HCl\longrightarrow ZnCl_{2}+2\ H_{2}O}}}
Zn(OH)2+h3SO4⟶ZnSO4+2 h3O{\displaystyle {\mathsf {Zn(OH)_{2}+H_{2}SO_{4}\longrightarrow ZnSO_{4}+2\ H_{2}O}}}
Zn(OH)2+CO2⟶ZnCO3+h3O{\displaystyle {\mathsf {Zn(OH)_{2}+CO_{2}\longrightarrow ZnCO_{3}+H_{2}O}}}
Zn(OH)2+4Nh4⟶[Zn(Nh4)4](OH)2{\displaystyle {\mathsf {Zn(OH)_{2}+4NH_{3}\longrightarrow [Zn(NH_{3})_{4}](OH)_{2}}}};
- Взаимодействие со щелочами с образованием:
- Zn(OH)2+2NaOH⟶Na2ZnO2+2h3O{\displaystyle {\mathsf {Zn(OH)_{2}+2NaOH\longrightarrow Na_{2}ZnO_{2}+2H_{2}O}}} — соли и воды в сплаве
- Zn(OH)2+2NaOH⟶Na2[Zn(OH)4]{\displaystyle {\mathsf {Zn(OH)_{2}+2NaOH\longrightarrow Na_{2}[Zn(OH)_{4}]}}} — соли (тетрагидроксоцинката натрия) в растворе
- Термическое разложение :
Zn(OH)2⟶ZnO+h3O{\displaystyle {\mathsf {Zn(OH)_{2}\longrightarrow ZnO+H_{2}O}}};
Гидроксид цинка применяют для синтеза различных соединений цинка, в основном, солей.
основные, кислотные, амфотерные оксиды. Примеры
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:K2O (окись калия) , CaO (окись кальция) , FeO (окись железа 2-валентного) .
1. Взаимодействие с водой с образованием основания (или щёлочи) :
CaO+h3O = Ca(OH)2
2. Взаимодействие с кислотами с образованием солей:
CaO+h3SO4 = CaSO4+ h3O
3. Взаимодействие с кислотными оксидами с образованием солей
CaO+CO2=CaCO3
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ) , P2O5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора) , SO3 — триокись серы — это вещество используют для получения серной кислоты.
— реакция с водой с образованием кислоты
SO2+h3O=h3SO3
— реакция с щелочами (основаниями) с образованием соли:
CO2+NaOH=Na2CO3
— реакция с основными оксидами с образованием соли:
CO2+MgO=MgCO3
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами) . Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO – оксид цинка, Al2O3 — оксид алюминия
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
— реакция с кислотным оксидом с образованием соли:
ZnO+h3CO3 = ZnCO3 + h3O
— реакция с основаниями с образованием соли:
ZnO+2NaOH=Na2ZnO2+h3O
— реакция с кислотными и с основными оксидами с образованием содей:
ZnO + SO2 = ZnSO3
ZnO + Na2O = Na2ZnO2