C — Википедия
Материал из Википедии — свободной энциклопедии
C (латиница), С (кириллица)
- c — предлог (часть речи).
- (င) — буква Нга бирманского алфавита.
- C (Си) — язык программирования.
- C# (C Sharp, Си-Шарп) — язык программирования.
- C++ — язык программирования.
- C — 16-ричное представление числа 12 (а также представление числа 12 в 13-ричной системе счисления или в любой другой системе счисления с основанием, большим числа 12).
- C: (чаще в составе фраз вроде «диск C:») — наиболее частоупотребляемое имя диска в ПК с ОС семейств DOS и Windows, а также OS/2; «диск по умолчанию»; стартовое имя в IDE-нумерации разделов.
- C — в музыке обозначение ноты «до» либо аккорда до мажор.
- C — в музыке размер такта, эквивалентен 4/4.
- Паровоз С
- Электровозы:
- C — маршрут нью-йоркского метро.
- C — число 100 римскими цифрами.
- © — Знак охраны авторского права.
- C — типоразмер батареек и аккумуляторов длиной 50 мм и диаметром 26,2 мм.
- C — аниме-сериал 2011 года.
- C — дюймовый формат видеозаписи.
- С — тип советских подводных лодок.
- С — форматы конвертов для листов серии А.
- В трёхфазном токе и трёхфазном электроснабжении:
- C («цэ») — одна из трёх фаз (A, B, C — а, бэ, цэ) (фазовых проводов или контактов) при трёхфазном электроснабжении.
- C1, C2, C3 (Цэ-1, Цэ-2, Цэ-3) — вариант обозначения фаз в трёхфазном токе (вместо A, B, C).
Химия — это… Что такое Химия?
Хи́мия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца — «черная земля»; другие возможные варианты: др.-греч. χυμος — «сок», «эссенция», «влага», «вкус», др.-греч. χυμα — «сплав (металлов)», «литье», «поток», др.-греч. χυμευσις — «смешивание») — одна из важнейших и обширных областей естествознания, наука о веществах, их свойствах, строении и превращениях, происходящих в результате химических реакций, а также фундаментальных законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается в основном изучением взаимодействий между атомами и молекулами, полученными в результате таких взаимодействий. Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. Химия [1] имеет много общего с физикой и биологией, по сути граница между ними условна. Современная химия является одной из самых обширных дисциплин среди всех естественных наук.
История химии
Зачатки химии возникли ещё со времён появления человека разумного. Поскольку человек всегда так или иначе имел дело с химическими веществами, то его первые эксперименты с огнём, дублением шкур, приготовлением пищи можно назвать зачатками практической химии. Постепенно практические знания накапливались, и в самом начале развития цивилизации люди умели готовить некоторые краски, эмали, яды и лекарства. Вначале человек использовал биологические процессы, такие, как брожение, гниение, но с освоением огня начал использовать процессы горения, спекания, сплавления. Использовались окислительно-восстановительные реакции, не протекающие в живой природе — например, восстановление металлов из их соединений.
Такие ремёсла, как металлургия, гончарство, стеклоделие, крашение, парфюмерия, косметика, достигли значительного развития ещё до начала нашей эры. Например, состав современного бутылочного стекла практически не отличается от состава стекла, применявшегося в 4000 году до н. э. в Египте. Хотя химические знания тщательно скрывались жрецами от непосвящённых, они всё равно медленно проникали в другие страны. К европейцам химическая наука попала главным образом от арабов после завоевания ими Испании в 711 году. Они называли эту науку «алхимией», от них это название распространилось и в Европе.
Известно, что в Египте уже в 3000 году до н. э. умели получать медь из её соединений, используя древесный уголь в качестве восстановителя, а также получали серебро и свинец. Постепенно в Египте и Месопотамии было развито производство бронзы, а в северных странах — железа. Делались также теоретические находки. Например, в Китае с XXII века до н. э. существовала теория об основных элементах (Вода, Огонь, Дерево, Золото, Земля). В Месопотамии возникла идея о противоположностях, из которых построен мир: огонь—вода, тепло—холод, сухость—влажность и т. д.
В V веке до н. э. в Греции Левкипп и Демокрит развили теорию о строении вещества из атомов. По аналогии со строением письма они заключили, что как речь делится на слова, а слова состоят из букв, так и все вещества состоят из определённых соединений (молекул), которые в свою очередь состоят из неделимых элементов (атомов).
В V веке до н. э. Эмпедокл предложил считать основными элементами (стихиями) Воду, Огонь, Воздух и Землю. В IV веке до н. э. Платон развил учение Эмпедокла: каждому из этих элементов соответствовал свой цвет и своя правильная пространственная фигура атома, определяющая его свойства: огню — красный цвет и тетраэдр, воде — синий и икосаэдр, земле — зелёный и гексаэдр, воздуху — жёлтый и октаэдр. По мнению Платона, именно из комбинаций этих «кирпичиков» и построен весь материальный мир. Учение о четырёх превращающихся друг в друга было унаследовано Аристотелем.
Алхимия
Культура Египта, как известно, обладала хорошо развитыми технологиями, что демонстрируют объекты и сооружения, создание которых возможно только при наличии теоретической и практической базы. Подтверждение развития первичных теоретических знаний в Египте наука получает в последнее время. Тем не менее, на такое происхождение указывает, в большей степени эзотерическую, концептуальную принадлежность имеющие подобия теоретических — традиционные источники алхимии — этого причудливого и цветистого «симбиоза» искусства и, в определённой степени — примата одного из основных разделов естествознания — химии, только формально берущей начало в этом комплексе знаний и опыта. Среди таких источников в первую очередь следует назвать — «Изумрудную скрижаль» (лат. «Tabula smaragdina») Гермеса Трисмегиста, как и ряд других трактатов «Большого алхимического свода».[2][3]
Имел место ещё в IV—III веках до н. э. на Востоке (в Индии, Китае, в арабском мире) ранний «прототип» алхимии. В этот и последующие периоды были найдены новые способы получения таких элементов как ртуть, сера, фосфор, охарактеризованы многие соли, уже были известны и использовались кислота HNO3 и щёлочь NaOH. С раннего Средневековья получает развитие то, что сейчас принято понимать под алхимией, в которой традиционно соединились, наряду с вышеназванными наукообразными компонентами (в смысле современного понимания методологии науки), философские представления эпохи и новые для того времени ремесленные навыки, а также магические и мистические представления; последними, впрочем, и была наделена в отдельных своих проявлениях и особенностях философская мысль той поры. Известными алхимиками того времени были Джабир ибн Хайян (Гебер), Ибн Сина (Авиценна) и Абу Бакр ар-Рази. Ещё в античности, благодаря интенсивному развитию торговли, золото и серебро становятся
 Алхимики в поисках философского камня
Алхимики в поисках философского камняВ VII веке н. э. алхимия проникла в Европу. В то время, как и на протяжении всей истории, у представителей господствовавших слоёв общества особой «популярностью» пользовались предметы роскоши, в особенности — золото, поскольку именно оно являлось, как уже отмечено, эквивалентом торговой оценки. Алхимиков, в числе прочих вопросов, продолжали интересовать способы получения золота из других металлов, а также проблемы их обработки. Вместе с тем, к тому времени арабская алхимия стала отдаляться от практики и утратила влияние. Из-за особенностей технологий, обусловленных, в числе прочего — системой герметических взглядов, различием знаковых систем, терминологии и сугубо корпоративного распространения знаний «алхимическое действо» развивалось очень медленно. Наиболее известными европейскими алхимиками считаются Никола Фламель, Альберт Великий, Джон Ди, Роджер Бэкон и Раймонд Луллий. Эпоха алхимиков ознаменовала получение многих первичных веществ, разработку способов их получения, выделения и очистки. Только в XVI веке, с развитием различных производств, в том числе металлургии, а также фармацевтики, обусловленным возрастанием её роли в медицине, начали появляться исследователи, чья деятельность выразилась существенными преобразованиями в этой науке, которые приблизили становление хорошо осмысленных и актуальных практических методов этой дисциплины. Среди них, прежде всего, следует назвать Георгия Агриколу и Теофраста Бомбаста Парацельса.
Химия как наука
Химия как самостоятельная дисциплина определилась в XVI—XVII веках, после ряда научных открытий, обосновавших механистическую картину мира, развития промышленности, создания фабрик, появления буржуазного общества. Однако из-за того, что химия, в отличие от физики, не могла быть выражена количественно, существовали споры, является ли химия количественной воспроизводимой наукой или это некий иной вид познания. В 1661 году Роберт Бойль создал труд «Химик-скептик», в котором объяснил разность свойств различных веществ тем, что они построены из разных частиц (корпускул), которые и отвечают за свойства вещества. Ван Гельмонт, изучая горение, ввёл понятие газ для вещества, которое образуется при нём, открыл углекислый газ. В 1672 году Бойль открыл, что при обжиге металлов их масса увеличивается, и объяснил это захватом «весомых частиц пламени».
М. В. Ломоносов уже в первой известной своей работе, именно к данной области естествознания отношение имеющей — «Элементы математической химии» (1741), в отличие от большинства химиков своего времени, считавших эту сферу деятельности искусством, классифицирует её как науку, начиная труд свой словами[4]:
 | Химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное. …Не сомневаюсь, что найдутся многие, которым это определение покажется неполным, будут сетовать на отсутствие начал разделения, соединения, очищения и других выражений, которыми наполнены почти все химические книги; но те, кто проницательнее, легко усмотрят, что упомянутые выражения, которыми весьма многие писатели по химии имеют обыкновение обременять без надобности свои исследования, могут быть охвачены одним словом: смешанное тело. В самом деле, обладающий знанием смешанного тела может объяснить все возможные изменения его, и в том числе разделение, соединение и т. д. |  |
Тепло и флогистон. Газы
В начале XVIII века Шталь сформулировал теорию флогистона — вещества, удаляющегося из материалов при их горении.
В 1749 году М. В. Ломоносов написал «Размышления о причине теплоты и холода» (замысел работы относится к 1742—1743 годам — см. его же «Заметки по физике и корпускулярной философии»). Высочайшую оценку этому труду дал Л. Эйлер (письмо 21 ноября 1747 года). В 1848 году профессор Д. М. Перевощиков, обстоятельно излагая важнейшие идеи М. В. Ломоносова, подчёркивает, что его теория теплоты опередила науку на полстолетия («Современник», январь 1848, т. VII, кн. 1, отд. II, с. 41—58) — с мнением этим, до того и в дальнейшем, согласуется мнение многих других исследователей.[4]
В 1754 году Блэк открыл углекислый газ, Пристли в 1774 — кислород, а Кавендиш в 1766 — водород.
В период 1740—1790 годов Лавуазье и Ломоносов[4] химически объяснили процессы горения, окисления и дыхания, доказали, что огонь — не вещество, а следствие процесса. Пруст в 1799—1806 годах сформулировал закон постоянства состава. Гей-Люссак в 1808 открыл закон объёмных отношений (закон Авогадро). Дальтон в труде «Новая система химической философии» (1808—1827) доказал существование атомов, ввёл понятие атомный вес, элемент — как совокупность одинаковых атомов.
Реинкарнация атомарной теории вещества
В 1811 году Авогадро и предложил гипотезу о том, что молекулы элементарных газов состоят из двух одинаковых атомов; позднее на основе этой гипотезы Канниццаро осуществил реформу атомно-молекулярной теории.
В 1869 году, Д. И. Менделеев открыл периодический закон химических элементов и создал периодическую систему химических элементов. Он объяснил понятие химический элемент и показал зависимость атомной массы от свойств элемента. Открытием этого закона он основал химию как количественную науку, а не только как описательную и качественную.
Радиоактивность и спектры
Важную роль в познании структуры вещества сыграли открытия XIX века. Исследование тонкой структуры эмиссионных спектров и спектров поглощения натолкнуло учёных на мысль о их связи со строением атомов веществ. Открытие радиоактивности показало, что некоторые атомы нестабильны (изотопы) и могут самопроизвольно превращаться в новые атомы (радон — «эманация»).
Квантовая химия
Основные понятия
Элементарная частица
- Основная статья: Элементарная частица
Это все частицы, не являющиеся атомными ядрами или атомами (протон — исключение). В узком смысле — частицы, которые нельзя считать состоящими из других частиц (при заданной энергии воздействия/наблюдения). Элементарными частицами также являются электроны (-) и позитроны (+).
Атом
- Основная статья: Атом
Наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и «облака» электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы.
Атом — предел химического разложения любого вещества. Простое вещество (если оно не является одноатомным, как, например, гелий He) разлагается на атомы одного вида, сложное вещество — на атомы разных видов.
Атомы неделимы химическим путём.
Молекула
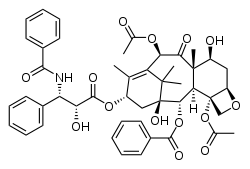 Молекулярная структура изображает связи и относительное положение атомов в молекуле. На иллюстрации показана молекула паклитаксела (номенклатурное название: (2α,4α,5β,7β,10β,13α)-4,10-бис(ацетилокси)-13-{[(2R,3S)- 3-(бензоиламино)-2-гидрокси-3-фенилпропаноил]окси}- 1,7-дигидрокси-9-оксо-5,20-эпокситакс-11-ен-2-ил бензоат).
Молекулярная структура изображает связи и относительное положение атомов в молекуле. На иллюстрации показана молекула паклитаксела (номенклатурное название: (2α,4α,5β,7β,10β,13α)-4,10-бис(ацетилокси)-13-{[(2R,3S)- 3-(бензоиламино)-2-гидрокси-3-фенилпропаноил]окси}- 1,7-дигидрокси-9-оксо-5,20-эпокситакс-11-ен-2-ил бензоат).Частица, состоящая из двух или более атомов, которая может самостоятельно существовать. Имеет постоянный качественный и количественный состав. Её свойства зависят от атомов, входящих в её состав, и от характера связей между ними, от молекулярной структуры и от пространственного расположения (изомеры). Может иметь несколько разных состояний и переходить от одного состояния к другому под действием внешних факторов. Свойства вещества, состоящего из определённых молекул, зависят от состояния молекул и от свойств молекулы.
Вещество
- Основная статья: Вещество
В соответствии с классическими научными воззрениями различаются две физические формы существования материи — вещество и поле. Вещество — это форма материи, обладающая массой покоя (масса покоя не равна нулю). Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Те, в свою очередь, состоят из элементарных частиц: электронов, протонов, нейтронов и т. д.
Простые и сложные вещества. Химические элементы
Среди чистых веществ принято различать простые (состоящие из атомов одного химического элемента) и сложные (образованы из атомов нескольких химических элементов) вещества.
Простые вещества следует отличать от понятий «атом» и «химический элемент».
Химический элемент — это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
- Основная статья: Химический элемент
Простые вещества представляют собой формы существования химических элементов в свободном виде; каждому элементу соответствует, как правило, несколько простых веществ (аллотропных форм), которые могут различаться по составу, например атомный кислород O, кислород O2 и озон O3, или по кристаллической решетке, например алмаз и графит для элемента углерод C. Очевидно, что простые вещества могут быть одно- и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин означает, что вещества могут быть получены с помощью химических реакций соединения из простых веществ (химического синтеза) или разделены на элементы в свободном виде (простые вещества) с помощью химических реакций разложения (химического анализа).
Простые вещества представляют собой конечные формы химического разложения сложных веществ. Сложные вещества, образующиеся из простых веществ, не сохраняют химические свойства составляющих веществ.
Суммируя всё сказанное выше, можно записать:
, где
E — простые вещества (элементы в свободном виде),
C — сложные вещества (химические соединения),
S — синтез,
A — анализ.
В настоящее время понятия «синтез» и «анализ» химических веществ используются в более широком смысле. К синтезу относят любой химический процесс, который приводит к получению необходимого вещества и при этом существует возможность его выделения из реакционной смеси. Анализом считается любой химический процесс, позволяющий определить качественный и количественный состав вещества или смеси веществ, то есть установить, из каких элементов составлено данное вещество и каково содержание каждого элемента в этом веществе. Соответственно различают качественный и количественный анализ — две составные части одной из химических наук — аналитической химии.
Металлы и неметаллы
Все химические элементы по их свойствам, то есть свойствам свободных атомов и свойствам образуемых элементами простых и сложных веществ, делят на металлические и неметаллические элементы. Условно к неметаллам относят элементы He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, N, P, C и H. К полуметаллам относят B, Si, Ge, As, Sb, Te, иногда — Po. Остальные элементы считаются металлами.
Чистые вещества и смеси веществ
Индивидуальное чистое вещество обладает определённым набором характеристических свойств. От чистых веществ следует отличать смеси веществ, которые могут состоять из двух или большего числа чистых веществ, сохраняющих присущие им свойства.
Смеси веществ делятся на гомогенные (однородные) и гетерогенные (неоднородные).
| Агрегатное состояние составных частей (до образования смеси) | Гомогенная смесь (гомогенная система) | Гетерогенная смесь (гетерогенная система) |
|---|---|---|
| Твёрдое — твёрдое | Твёрдые растворы, сплавы (например латунь, бронза) | Горные породы (например гранит, минералосодержащие руды и др.) |
| Твёрдое — жидкое | Жидкие растворы (например, водные растворы солей) | Твёрдое в жидком — суспензии или взвеси (например, частицы глины в воде, коллоидные растворы) |
| Жидкое в твёрдом — жидкость в пористых телах (например, почвы, грунты) | ||
| Твёрдое — газообразное | Хемосорбированный водород в платине, палладии, сталях | Твёрдое в газообразном — порошки, аэрозоли, в том числе дым, пыль, смог |
| Газообразное в твёрдом — пористые материалы (например, кирпич, пемза) | ||
| Жидкое — твёрдое | Твёрдые жидкости (например, стекло — твёрдое, но всё же жидкость) | Может принимать разную форму и фиксировать её (например, посуда — разной формы и цвета) |
| Жидкое — жидкое | Жидкие растворы (например, уксус — раствор уксусной кислоты в воде) | Двух- и многослойные жидкие системы, эмульсии (например, молоко — капли жидкого жира в воде) |
| Жидкое — газообразное | Жидкие растворы (например, раствор диоксида углерода в воде) | Жидкое в газообразном — аэрозоли жидкости в газе, в том числе туманы |
| Газообразное в жидком — пены (например, мыльная пена) | ||
| Газообразное — газообразное | Газовые растворы (смеси любых количеств и любого числа газов), напр. воздух. | Гетерогенная система невозможна |
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твёрдых веществ, например сплавы.
В гетерогенных смесях либо визуально, либо с помощью оптических приборов можно различить области (агрегаты) разных веществ, разграниченные поверхностью раздела; каждая из этих областей внутри себя гомогенна. Такие области называются фазой.
Гомогенная смесь состоит из одной фазы, гетерогенная смесь состоит из двух или большего числа фаз.
Гетерогенные смеси, в которых одна фаза в виде отдельных частиц распределена в другой, называются дисперсными системами. В таких системах различают дисперсионную среду (распределяющую среду) и дисперсную фазу (раздробленное в дисперсионной среде вещество).
С помощью физических методов разделения можно провести разделение смесей на их составные части, то есть на чистые вещества.
| Агрегатное состояние составных частей смеси | Физическое свойство, используемое для разделения | Метод разделения |
|---|---|---|
| Твёрдое — твёрдое | Плотность | Отстаивание, седиментация |
| Смачиваемость | Флотация, пенная флотация | |
| Размер частиц | Просеивание | |
| Растворимость | Экстракция, выщелачивание | |
| Магнетизм | Магнитная сепарация | |
| Твёрдое — жидкое | Плотность | Седиментация, декантация (сливание жидкости с осадка), центрифугирование |
| Температура кипения жидкости | Выпаривание, дистилляция, осушка | |
| Размер частиц | Фильтрование | |
| Растворимость твёрдого вещества | Кристаллизация | |
| Твёрдое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Размер частиц | Фильтрование | |
| Электрический заряд | Электрофильтрование | |
| Жидкое — жидкое | Плотность | Отстаивание (в делительной воронке, в маслоотделителе), центрифугирование |
| Температура кипения | Дистилляция | |
| Растворимость | Экстракция | |
| Жидкое — газообразное | Плотность | Седиментация, центробежная сепарация |
| Растворимость газа | Отгонка газа (путём повышения температуры), промывание с помощью другой жидкости | |
| Газообразное — газообразное | Температура конденсации | Конденсация |
| Абсорбируемость | Абсорбция (поглощение объёмом сорбента) | |
| Адсорбируемость | Адсорбция (поглощение поверхностью сорбента) | |
| Размер частиц | Диффузия | |
| Масса | Центрифугирование |
Чистыми веществами называются вещества, которые при проведении физических методов не разделяются на два или более других веществ и не изменяют своих физических свойств.
В природе не существует абсолютно чистых веществ. Например, так называемый особо чистый алюминий ещё содержит 0,001 % примесей других веществ. Таким образом, абсолютно чистое вещество — это абстракция. Правда, когда речь идет о каком-либо веществе, то химия пользуется этой абстракцией, то есть считает, что вещество истинно чистое, хотя практически берется вещество с некоторым содержанием примесей. Конечно, химик должен стремиться использовать в своей практике по возможности чистые вещества, содержащие минимальное количество примесей. Следует учитывать, что даже незначительное содержание примесей может существенно изменить химические свойства вещества.
| Смесь | Сложное вещество |
|---|---|
| Образуется с помощью физического процесса (смешивание чистых веществ) | Образуется с помощью химической реакции (синтез из простых веществ) |
| Свойства чистых веществ, из которых составлена смесь, остаются неизменными | Свойства простых веществ, из которых получено сложное вещество, в последнем не сохраняются |
| Чистые вещества (простые и сложные) могут находиться в смеси в любом массовом соотношении | Элементы, входящие в состав сложного вещества, всегда находятся в определённом массовом отношении |
| Может быть разделена на составные части (чистые вещества) с помощью физических методов | Может быть разложено на составные части (элементы в виде простых веществ) только с помощью химической реакции (анализ) |
Ион
Основная статья: ИонЭто заряженная частица, атом или молекула, которая имеет неодинаковое количество протонов и электронов. Если у частицы больше электронов, чем протонов, то она заряжена отрицательно и называется анион. Например — Cl−. Если в частице электронов меньше, чем протонов, значит, она заряжена положительно и называется катион. Например — Na+.
Радикал
Это частица (атом или молекула), содержащая один или несколько неспаренных электронов. В большинстве случаев химическая связь образуется при участии двух электронов. Частица, имеющая неспаренный электрон, очень активна и легко образует связи с другими частицами. Поэтому время жизни радикала в среде, как правило, очень мало.
Химическая связь
удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, водородную.
Периодический закон
Открыт Д. И. Менделеевым 1 марта 1869 года. Современная формулировка: Свойства элементов, а также образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Химические реакции
Процессы, протекающие в химическом веществе, или в смесях различных веществ, представляют собой химические реакции. При протекании химических реакций всегда образуются новые вещества.
В сущности это процесс изменения структуры молекулы. В результате реакции количество атомов в молекуле может увеличиваться (синтез), уменьшаться (разложение) или оставаться постоянным (изомеризация, перегруппировка). В ходе реакции изменяются связи между атомами и порядок размещения атомов в молекулах.
Химические реакции выявляют и характеризуют химические свойства данного вещества.
Исходные вещества, взятые для проведения химической реакции, называются реагентами, а новые вещества, образующиеся в результате химической реакции, — продуктами реакции. В общем виде химическая реакция изображается так:
Реагенты → Продукты
Химия изучает и описывает эти процессы как в макромасштабе, на уровне макроколичеств веществ, так и в микромасштабе, на атомно-молекулярном уровне. Внешние проявления химических процессов, протекающих в макромасштабе, нельзя непосредственно перенести на микроуровень взаимодействия веществ и однозначно их интерпретировать, однако такие переходы возможны при правильном использовании специальных химических законов, присущих только микрообласти (атомам, молекулам, ионам, взятым в единичных количествах).
Номенклатура
Это свод правил наименования химических соединений. Поскольку общее число известных соединений больше 20 млн, и их число принципиально неограниченно, необходимо пользоваться чёткими правилами при их наименовании, чтобы по названию можно было воспроизвести их структуру. Существует несколько вариантов наименования органических и неорганических соединений, но стандартом считается номенклатура IUPAC.
Разделы химии
Современная химия — настолько обширная область естествознания, что многие её разделы по существу представляют собой самостоятельные, хотя и тесно взаимосвязанные научные дисциплины.
По признаку изучаемых объектов (веществ) химию принято делить на неорганическую и органическую. Объяснением сущности химических явлений и установлением их общих закономерностей на основе физических принципов и экспериментальных данных занимается физическая химия, включающая квантовую химию, электрохимию, химическую термодинамику, химическую кинетику. Самостоятельными разделами являются также аналитическая и коллоидная химия (см. ниже перечень разделов).
Технологические основы современных производств излагает химическая технология — наука об экономичных методах и средствах промышленной химической переработки готовых природных материалов и искусственного получения химических продуктов, не встречающихся в окружающей природе.
Сочетание химии с другими смежными естественными науками представляют собой биохимия, биоорганическая химия, геохимия, радиационная химия, фотохимия и др.
Общенаучные основы химических методов разрабатываются в теории познания и методологии науки.
- Агрохимия
- Аналитическая химия занимается изучением веществ с целью получить представление об их химическом составе и структуре, в рамках этой дисциплины ведётся разработка экспериментальных методов химического анализа.
- Биоорганическая химия
- Биохимия изучает химические вещества, их превращения и явления, сопровождающие эти превращения в живых организмах. Тесно связана с органической химией, химией лекарственных средств, нейрохимией, молекулярной биологией и генетикой.
- Вычислительная химия
- Геохимия — наука о химическом составе Земли и планет (космохимия), законах распределения элементов и изотопов, процессах формирования горных пород, почв и природных вод.
- Квантовая химия
- Коллоидная химия
- Компьютерная химия
- Косметическая химия
- Космохимия
- Математическая химия
- Материаловедение
- Металлоорганическая химия
- Нанохимия
- Неорганическая химия изучает свойства и реакции неорганических соединений. Чёткой границы между органической и неорганической химии нет, напротив, существуют дисциплины на стыке этих наук, например, металлоорганическая химия.
- Органическая химия выделяет в качестве предмета изучения вещества, построенные на основе углеродного скелета.
- Нейрохимия своим предметом имеет изучение медиаторов, пептидов, белков, жиров, сахара и нуклеиновых кислот, их взаимодействия и роли, которую они играют в формировании, становлении и изменении нервной системы.
- Нефтехимия
- Общая химия
- Препаративная химия
- Радиохимия
- Супрамолекулярная химия
- Фармацевтика
- Физическая химия изучает физический и фундаментальный базис химических систем и процессов. Важнейшие области исследования включают химическую термодинамику, кинетику, электрохимию, статистическую механику и спектроскопию. Физическая химия имеет много общего с молекулярной физикой. Физическая химия предполагает использование инфинитезимального метода. Физическая химия является отдельной дисциплиной от химической физики.
- Фотохимия
- Химия высокомолекулярных соединений
- Химия одноуглеродных молекул
- Химия полимеров
- Химия почв
- Теоретическая химия своей задачей ставит теоретическое обобщение и обоснование знаний химии через фундаментальные теоретические рассуждения (как правило, в области математики или физики).
- Термохимия
- Токсикологическая химия
- Электрохимия
- Экологическая химия; химия окружающей среды
- Ядерная химия изучает ядерные реакции и химические последствия ядерных реакций.
Химическая технология
Методы физико-химического анализа
См. сравнение и полную классификацию методов анализа в основной статье Аналитическая химия, а также в частности:
См. также
Примечания
- ↑ Философия науки под ред. А. И. Липкина М.: Эксмо, 2007
- ↑ 1 2 3 Возникновение и развитие химии с древнейших времён до XVIII века. Всеобщая история химии. М.: Наука. 1989
- ↑ 1 2 3 Рабинович В. Л. Алхимия как феномен средневековой культуры. М.: Наука. 1979
- ↑ 1 2 3 Михаил Васильевич Ломоносов. Избранные произведения. В двух томах. Т. 1. Естественные науки и философия. — М.: Наука. 1986
Литература
- Менделеев Д. И. Периодический закон: В 3 т. на сайте Руниверс
- Некрасов Б. В. Основы общей химии, т. 1. — М.: «Химия», 1973
- Химическая энциклопедия, п. ред. Кнунянц И. Л., т. 5. — М.: «Советская энциклопедия», 1988
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989
- Джон Мур. Химия для чайников = Chemistry For Dummies. — М.: «Диалектика», 2011. — 320 с. — ISBN 978-5-8459-1773-7
- Н. Л. Глинка. Общая химия. — М.: Интеграл-Пресс, 2008. — С. 728. — ISBN 5-89602-017-1
- Дубинская А. М., Призмент Э. Л. Химические энциклопедии, в кн.: Химический энциклопедический словарь. — М., 1983
- Потапов В. М., Кочетова Э. К. Химическая информация. Где и как искать химику нужные сведения. — М., 1988
- Кузнецов В. И. Общая химия: тенденции развития. М.: Высшая школа, 1989.
Ссылки
Разделы химии
Биохимия — Википедия
Биохи́мия (биологи́ческая, или физиологи́ческая хи́мия) — наука о химическом составе живых клеток и организмов, а также о лежащих в основе их жизнедеятельности химических процессах. Термин «биохимия» эпизодически употреблялся с середины XIX века, в классическом смысле он был предложен и введён в научную среду в 1903 году немецким химиком Карлом Нейбергом[1].
Биохимия — сравнительно молодая наука, которая находится на стыке биологии и химии[2].
Как самостоятельная наука биохимия сформировалась примерно 100 лет назад, однако биохимические процессы люди использовали ещё в глубокой древности, не подозревая, разумеется, об их истинной сущности. В самые отдалённые времена уже была известна технология таких основанных на биохимических процессах производств, как хлебопечение, сыроварение, виноделие, выделка кож. Необходимость борьбы с болезнями заставляла задумываться о превращениях веществ в организме, искать объяснения целебным свойствам лекарственных растений. Использование растений в пищу, для изготовления красок и тканей также приводило к попыткам понять свойства веществ растительного происхождения. Древние мыслители рассуждали о том, какую роль играют воздух и пища в жизнеобеспечении живых существ, о том что вызывает процесс брожения[3].
Персидский учёный и врач X века Авиценна в своей книге «Канон врачебной науки» подробно описал многие лекарственные вещества[4].
В XVII веке ван Гельмонт ввёл в обиход термин фермент для обозначения химического реагента участвующего в процессе пищеварения[5].
XVIII век ознаменовался трудами М. В. Ломоносова и А. Л. Лавуазье. На основе открытого ими закона сохранения массы веществ и накопленных к концу столетия экспериментальных данных, была объяснена сущность дыхания и исключительная роль в этом процессе кислорода[6].
 Портрет Уильяма Праута работы Генри Виндхама Филипса
Портрет Уильяма Праута работы Генри Виндхама ФилипсаИзучение химии жизни уже в 1827 г. привело к принятому до сих пор разделению биологических молекул на белки, жиры и углеводы. Автором этой классификации был английский химик и врач Уильям Праут[7]. В 1828 году немецкий химик Ф. Вёлер синтезировал мочевину: сначала — из циановой кислоты и аммиака (выпариванием раствора образующегося цианата аммония), а позже в этом же году — из углекислого газа и аммиака. Тем самым впервые было доказано, что химические вещества живого организма могут быть синтезированы искусственно, вне организма. Работы Вёлера нанесли первый удар по теориям представителей школы виталистов, предполагавших присутствие во всех органических соединениях некой «жизненной силы»[6]. Последующими мощными толчками в этом направлении химии явились лабораторные синтезы липидов (в 1854 году — П. Бертло, Франция) и углеводов из формальдегида (1861 — А. М. Бутлеров, Россия). Бутлеровым была также разработана теория строения органических соединений[8].
Новый толчок развитию биологической химии дали работы по изучению брожения, инициированные Луи Пастером. В 1897 г. Эдуард Бухнер доказал, что ферментация сахара может происходить в присутствии бесклеточного дрожжевого экстракта, и это процесс не столько биологический, сколько химический[9]. На рубеже XIX и XX веков работал немецкий биохимик Э. Фишер. Он сформулировал основные положения пептидной теории строения белков, установил структуру и свойства почти всех входящих в их состав аминокислот. Но лишь в 1926 г. Джеймсу Самнеру удалось получить первый чистый фермент, уреазу, и доказать, что фермент — это белок[10].
Биохимия стала первой биологической дисциплиной с развитым математическим аппаратом благодаря работам Холдейна, Михаэлиса, Ментена и других биохимиков, создавших ферментативную кинетику, основным законом которой является уравнение Михаэлиса-Ментен[11].
В 1928 г. Фредерик Гриффит впервые показал, что экстракт убитых нагреванием болезнетворных бактерий может передавать признак патогенности неопасным бактериям. Исследование трансформации бактерий в дальнейшем привело к очистке болезнетворного агента, которым, вопреки ожиданиям, оказался не белок, а нуклеиновая кислота. Сама по себе нуклеиновая кислота не опасна, она лишь переносит гены, определяющие патогенность и другие свойства микроорганизма. В 1953 году американский биолог Дж. Уотсон и английский физик Ф. Крик опираясь на работы М. Уилкинса и Р. Франклин описали структуру ДНК — ключ к пониманию принципов передачи наследственной информации. Это открытие означало рождение нового направления науки — молекулярной биологии[12].
В 1958 Джордж Бидл и Эдуард Тейтем получили Нобелевскую премию за работу проведённую на грибах, выводом которой стала гипотеза «один ген — один фермент»[13]. В 1988 Колин Питчфорк стал первым человеком, осуждённым за убийство на основе доказательств, полученных в результате ДНК-дактилоскопии доказательств, и первым преступником, пойманным в результате массового применения процедуры дактилоскопии[14]. Из последних вех в развитии биохимии следует отметить получение Эндрю Файером и Крейгом Мелло Нобелевской премии по физиологии и медицине за «открытие РНК-интерференции — эффекта гашения активности определённых генов»[15][16].
Возникнув как наука о химии жизни в конце XIX века[2], чему предшествовало бурное развитие органической химии, биохимия отличается от органической химии тем, что исследует только те вещества и химические реакции, которые имеют место в живых организмах, прежде всего в живой клетке. Согласно этому определению, биохимия охватывает также многие области клеточной биологии и включает в себя молекулярную биологию[17]. После выделения последней в особую дисциплину, размежевание между биохимией и молекулярной биологией в основном сформировалось как методологическое и по предмету исследования. Молекулярные биологи преимущественно работают с нуклеиновыми кислотами, изучая их структуру и функции, в то время как биохимики сосредоточились на белках, в особенности на ферментах, катализирующих биохимические реакции. В последние годы термины «биохимия» и «молекулярная биология» часто используются как синонимы[9].
- Статическая биохимия (Биоорганическая химия) — наука о химическом составе организмов и структур составляющих их молекул (белков, аминокислот, нуклеиновых кислот, нуклеотидов, углеводов и их производных, липидов, витаминов, гормонов). Ее основные объекты — биополимеры, превращения которых составляют химическую сущность биологических процессов, и биорегуляторы, которые химически регулируют обмен веществ.
- Динамическая биохимия — изучает химические реакции, представляющие обмен веществ (метаболизм), а именно пути превращения молекул и механизмы происходящих между ними реакций[31][32].
- Молекулярная биология — наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела.
- Биоэнергетика — раздел динамической биохимии, который изучает закономерности образования, аккумуляции и потребления энергии в биологических системах.
- Функциональная биохимия — раздел биохимии, изучающий химические превращения, лежащие в основе функций органов, тканей и организма в целом[33].
В основе биохимической методологии лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества. Методы биохимии преимущественно формировались в XX веке; наиболее распространенными являются хроматография, изобретённая М. С. Цветом в 1903 г.[49], центрифугирование (Т. Сведберг, 1923 г., Нобелевская премия по химии 1926 г.) и электрофорез (А. Тизелиус, 1937 г., Нобелевская премия по химии 1948 г.)[50][51].
С конца XX в. в биохимии всё шире применяются методы молекулярной и клеточной биологии, в особенности искусственная экспрессия и нокаут генов в модельных клетках и целых организмах (см. генная инженерия, биотехнология). Определение структуры всей геномной ДНК человека выявило приблизительно столько же ранее неизвестных генов и их неизученных продуктов, сколько уже было известно к началу XXI века благодаря полувековым усилиям научного сообщества. Оказалось, что традиционный химический анализ и очистка ферментов из биомассы позволяют получить лишь те белки, которые в живом веществе присутствуют в сравнительно большом количестве. Не случайно основная масса ферментов была открыта биохимиками в середине XX века и к концу столетия распространилось убеждение, что все ферменты уже открыты. Данные геномики опровергли эти представления, но дальнейшее развитие биохимии требовало изменения методологии. Искусственая экспрессия ранее неизвестных генов предоставила биохимикам новый материал для исследования, часто недоступный традиционными методами. В результате возник новый подход к планированию биохимического исследования, который получил название обратная генетика или функциональная геномика[52]. В последние десятилетия большое развитие произошло в области компьютерного моделирования. Эта методика позволяет исследовать свойства биомолекул там, где невозможно (или очень затруднительно) провести прямой эксперимент. Методика основана на компьютерных программах, которые позволяют визуализировать структуру биомолекул, задать их предполагаемые свойства и наблюдать результирующие интеракции между молекулами, такие например как энзим — субстрат, энзим — коэнзим, энзим — ингибитор[51].
Из 90 химических элементов, встречающихся в естественном состоянии в природе, для поддержания жизни необходимо чуть больше четверти. Большинство редких элементов не являются необходимыми для поддержания жизни (исключениями являются селен и иод). Большинством живых организмов не используются также два распространённых элемента, алюминий и титан. Списки необходимых для живых организмов элементов различаются на уровне высших таксонов. Всем животным необходим натрий, а некоторые растения обходятся без него. Растениям необходим бор и кремний, а животным — нет (или же необходим в ультрамикроскопических количествах). Всего шесть элементов (так называемые макронутриенты, или органогенные элементы) составляют до 99% от массы человеческого организма. Это углерод, водород, азот, кислород, кальций и фосфор. Кроме этих шести основных элементов, человеку необходимы малые или микроскопические количества ещё 19 элементов: натрий, хлор, калий, магний, сера, железо, фтор, цинк, кремний, медь, иод, бор, селен, никель, хром, марганец, молибден, кобальт[53] и, как показано в 2014 году, бром[54].
Четыре основных типа молекул, исследованием которых занимается биохимия, — это углеводы, липиды, белки и нуклеиновые кислоты, а также их гибриды, протеогликаны, гликопротеины, липопротеины и т. п. Многие биомолекулы являются полимерами (макромолекулами), строительными «блоками» которых являются более простые биомолекулы. Например, полисахариды состоят из простых сахаров, белки из аминокислот. Биологические полимеры часто составляют комплексы, строение которых диктуется их биологической функцией[55]. В иерархии химической сложности живых систем макромолекулы стоят выше химических элементов, функциональных групп и простых биомолекул, а на следующих ступенях этой иерархии — метаболические пути, клетка, многоклеточные организмы и экосистемы[56].
Углеводы[править | править код]
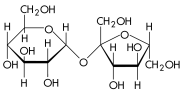
Углеводы состоят из мономеров, называемых моносахариды, как например глюкоза (C6H12O6), фруктоза (C6H12O6)[57], и дезоксирибоза (C5H10O4). Во время синтеза молекулы дисахарида из двух молекул моносахаридов образуется молекула воды. Полисахариды служат для аккумуляции энергии (крахмал у растений, гликоген у животных) и как структурообразующие молекулы (например основным компонентом клеточных стенок растений является полисахарид целлюлоза, а хитин является структурным полисахаридом низших растений, грибов и беспозвоночных животных (в основном роговые оболочки членистоногих — насекомых и ракообразных)[58].
Липиды[править | править код]
 Схема строения триглицерида: молекула глицерина, к которой прикреплены три молекулы жирных кислот
Схема строения триглицерида: молекула глицерина, к которой прикреплены три молекулы жирных кислотЛипиды (жиры), как правило составлены из молекулы глицерина, к которой сложно-эфирной связью крепятся от одной (моноглицериды) до трёх (триглицериды) жирных кислот. Жирные кислоты делятся на группы по длине углеводородной цепочки и по степени насыщенности (наличия и количества двойных связей в цепочке). Липиды служат у животных основными энергоёмкими молекулами. Кроме того у них есть различные функции, связанные с передачей клеточных сигналов и переноса липофильных молекул[59].
Белки[править | править код]
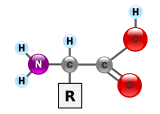
Белки как правило являются крупными молекулами — макробиополимерами. Их мономерами являются аминокислоты. Большинство организмов синтезируют белки из 20 разных типов аминокислот. Аминокислоты отличаются друг от друга так называемой R-группой, строение которой имеет большое значение в свёртывании белка в трёхмерную структуру. Аминокислоты образуют между собой пептидные связи выстраивая при этом цепочку — полипептид. Сравнение последовательности аминокислот в белках позволяет биохимикам определить степень гомологичности двух (или более) белков[60].
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и нуклеиновых кислот. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле. Многие белки, как ферменты так и структуральные белки создают комплексы с небелковыми биомолекулами. Комплексы с олигосахаридами называются (в зависимости от сравнительной доли белка и полисахарида в комплексе) гликопротеинами или протеогликанами. Комплексы с липидами называются липопротеинами[61].
Нуклеиновые кислоты[править | править код]

Нуклеиновая кислота — это комплекс макромолекул, состоящий из полинуклеотидных цепочек. Основная функция нуклеиновых кислот это хранение и кодирование генетической информации. Нуклеиновая кислота синтезируется из макроэргических мононуклеозидтрифосфатов (АТФ, ГТФ, ТТФ, ЦТФ, УТФ), один из которых аденозинтрифосфат (АТФ), является к тому же основной энергоёмкой молекулой всех живых организмов. Самыми распространёнными нуклеиновыми кислотами являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Нуклеиновые кислоты можно обнаружить во всех живых клетках от архей до эукариотов, а также в вирусах[62].
Название «нуклеиновые кислоты» было дано этой группе биополимеров из-за их основного местонахождения — в клеточном ядре. Мономеры этих молекул называются нуклеотиды. Нуклеотиды состоят из трёх компонентов: азотистого основания (пурина или пиримидина), моносахарида типа пентоза и фосфатной группы. ДНК и РНК различаются между собой типом пентозы (в ДНК это 2-дезоксирибоза, а в РНК это рибоза), а также возможным составом азотистых оснований (в то время как аденин, гуанин и цитозин присутствуют как в ДНК так и в РНК, тимин присутствует исключительно в ДНК, а урацил — исключительно в РНК)[63].
- ↑ Vasudevan, 2013, p. 3.
- ↑ 1 2 Северин, 2003, с. 6.
- ↑ Зубаиров Д. М. Вехи истории первой кафедры медицинской химии и физики в России (2007) Архивная копия от 23 декабря 2014 на Wayback Machine
- ↑ Авиценна «Канон врачебной науки» [1]
- ↑ Harré, R. Great Scientific Experiments (англ.). — Oxford: Oxford University Press, 1983. — P. 33 — 35.
- ↑ 1 2 Березов, 1998, p. 16.
- ↑ William Prout
- ↑ Бутлеров А. О химическом строении веществ // Учёные записки Казанского университета (отд. физ.-мат. и мед. наук). Вып.1, отд.1. — 1862. — С. 1—11.
- ↑ 1 2 Березов, 1998, p. 17.
- ↑ The Nobel Prize in Chemistry 1946
- ↑ Chen, W.W.,Neipel, M., Sorger, P.K. Classic and contemporary approaches to modeling biochemical reactions (англ.) // Genes Dev : journal. — 2010. — Vol. 24, no. 17. — P. 1861—1875. — DOI:10.1101/gad.1945410. — PMID 20810646.
- ↑ Crick F. H., Barnett L., Brenner S., Watts-Tobin R. J. General nature of the genetic code for proteins (англ.) // Nature. — 1961. — December (vol. 192). — P. 1227—1232. — DOI:10.1038/1921227a0. — PMID 13882203.
- ↑ Beadle G. W., Tatum E. L. Genetic Control of Biochemical Reactions in Neurospora (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1941. — 15 November (vol. 27, no. 11). — P. 499—506. — DOI:10.1073/pnas.27.11.499. — PMID 16588492.[2]
- ↑ Butler, John M. Fundamentals of Forensic DNA Typing (неопр.). — Academic Press, 2009. — С. 5. — ISBN 978-0-08-096176-7.
- ↑ Andrew Fire, Siqun Xu, Mary K. Montgomery, Steven A. Kostas, Samuel E. Driver und Craig C. Mello: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. In: Nature. Band 391, 1998, S. 806—811, PMID 9486653 PDF Архивировано 12 января 2006 года.
- ↑ Sen, Chandan K.; Roy, Sashwati. miRNA: Licensed to kill the messenger (неопр.) // DNA Cell Biology. — 2007. — Т. 26, № 4. — С. 193—194. — DOI:10.1089/dna.2006.0567. — PMID 17465885.
- ↑ Р. Марри и др. Биохимия человека. Т. 1. — М., 1993. — с. 10.
- ↑ Майстер А. Биохимия аминокислот : [монография] / Под ред. и с предисл.: А. Е. Браунштейн; пер. с англ.: Г. Я. Виленкина — М.: Иностр. лит., 1961 . — 530 с.
- ↑ Синютина С. Е. Биохимия белков и ферментов. — Тамбов: ТГУ им. Г. Р. Державина, 2010.
- ↑ Химия и биохимия ферментов: [Сб. статей]. — К.: Наук. думка, 1981. — 90 с.: ил.; 26 см. — (Биохимия животных и человека : Респ. межвед. сб. / АН УССР, Ин-т биохимии им. А. В. Палладина; Вып. 5).
- ↑ Химия и биохимия углеводов: Учеб. пособие. — Владивосток : Изд-во ДВГАЭУ, 1999. — 56 с.
- ↑ Дэвидсон Дж. Биохимия нуклеиновых кислот / Пер. с англ. к. ф.-м. н. В. В. Борисова; Под ред. и с предисл. А. А. Баева. — М.: Мир, 1976. — 412 с.
- ↑ Терентьева Н. А. Химия и биохимия нуклеиновых кислот: учебное пособие. — Владивосток: Дальнаука, 2011. — 268 с.
- ↑ Степаненко Б.Н. Химия и биохимия углеводов (полисахариды): Учеб. пособие для вузов. — М.: Высш. Школа, 1978. — 256 с.
- ↑ Соболев А. С. Радиационная биохимия циклических нуклеотидов. — М.: Энергоатомиздат, 1987. — 100 с.
- ↑ Препаративная биохимия липидов / [Л. Д. Бергельсон, Э. В. Дятловицкая, Ю. Г. Молотковский и др.; Отв. ред. Л. Д. Бергельсон, Э. В. Дятловицкая]. — М.: Наука, 1981. — 259 с.
- ↑ Иваненко Е. Ф. Биохимия витаминов: [Учеб. пособие для биол. специальностей вузов]. — К.: Вища школа, 1970. — 210 с.
- ↑ Биохимия витаминов [Электронный ресурс]: учебно-методическое пособие для студентов / А. И. Конопля, Н. А. Быстрова. Курск: КГМУ, 2012.
- ↑ Биохимия гормонов и гормональной регуляции: монография / [С. А. Афиногенова, А. А. Булатов, В. Н. Гончарова и др.; Отв. ред. акад. Н. А. Юдаев]. — М.: Наука, 1976. — 379 с.
- ↑ Шушкевич Н. И. Биохимия гормонов : учебное пособие по медицинской биохимии. — Владимир: Изд-во ВлГУ, 2009. — 67 с.
- ↑ Гофман Э. Г. Динамическая биохимия / Пер. с нем. канд. мед. наук А. И. Арчакова и канд. мед. наук В. М. Девиченского; Под ред. и с предисл. д-ра мед. наук проф. Л. Ф. Панченко. — М.: Медицина, 1971. — 311 с.
- ↑ Динамическая биохимия: учебное пособие / [В. Е. Толпекин и др.]. — М.: Изд-во МАИ-Принт, 2011. — 71 с.
- ↑ Гомазков О. А. Функциональная биохимия регуляторных пептидов: монография. — М.: Наука, 1992. — 159, [1] с.
- ↑ Неверова О. А. Биохимия микроорганизмов: учебное пособие: для студентов вузов / О. А. Неверова; Федер. агентство по образованию, Кемер. технол. ин-т пищевой пром-ти. — Кемерово: КемТИПП, 2005. — 83 с.
- ↑ Клетович В. Л. Биохимия растений: Учебник. 2-е изд., перераб. и доп. — М.: Высшая школа, 1986. — 503 с.
- ↑ Биохимия растений [Электронный ресурс / Г.-В. Хелдт; пер. с англ. — 2-е изд. (эл.). — М.: БИНОМ. Лаборатория знаний, 2014. — 471 с.: ил. — (Лучший зарубежный учебник)
- ↑ Рогожин В. В. Биохимия животных: Учебник. — СПб.: ГИОРД, 2009. — 552 с: ил. ISBN 978-5-98879-074-7
- ↑ Биохимия человека: [Учеб.]: В 2 тт. / Р. Марри, Д. Греннер, П. Мейес, В. Родуэлл; Пер. с англ. к. ф.-м. н. В. В. Борисова и Е. В. Дайниченко Под ред. д. х. н. Л. М. Гинодмана. — М. : Мир, 2004.
- ↑ Наточин Ю. В. Биохимия крови и диагностика / Клинич. б-ца РАМН. — СПб. : Б. и., 1993. — 149 с.
- ↑ Барышева Е. С. Биохимия крови [Электронный ресурс]: лабораторный практикум/ Барышева Е. С., Бурова К. М. — Электрон. текстовые данные. — Оренбург: Оренбургский государственный университет, ЭБС АСВ, 2013. — 141 c.
- ↑ Языкова М. Ю. Биохимия тканей: учебное пособие для студентов, обучающихся по биологическим специальностям / М. Ю. Языкова. — Самара: Самарский университет, 2004. — 75 с.
- ↑ Солвей Дж. Г. Наглядная медицинская биохимия: [учеб. пособие] / пер. с англ. А. П. Вабищевич, О. Г. Терещенко; под ред. Е. С. Северина. — 3-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2015. — 168 с. ISBN 978-5-9704-2037-9
- ↑ Калинский М. И. Биохимия мышечной деятельности. — К.: Здоровья, 1989. — 143 с.
- ↑ Биохимия мышечной деятельности: Учеб. для студентов вузов физ. воспитания и спорта / Н. И. Волков, Э. Н. Несен, А. А. Осипенко, С. Н. Корсун. — К.: Олимп. лит., 2000. — 502,[1] с.
- ↑ Мохан Р. Биохимия мышечной деятельности и физической тренировки / Рон Мохан, Майкл Глессон, Пауль Л. Гринхафф; [Пер. с англ. Валерий Смульский]. — К.: Олимп. лит., 2001. — 295 с.
- ↑ Яковлев Н. Н. Биохимия спорта. — М.: Физкультура и спорт, 1974. — 288 с.
- ↑ Михайлов С. С. Спортивная биохимия: учебник / С. С. Михайлов. — 6-е изд., стер. — М.: Советский спорт, 2010. — 347 с.
- ↑ Михайлов С. С. Биохимия двигательной деятельности: учебник / С. С. Михайлов. — М.: Спорт, 2016. — 292 с.
- ↑ Березов, 1998, p. 26.
- ↑ Березов, 1998, p. 30-32.
- ↑ 1 2 Monique Laberge. Biochemistry. — USA: Infobase Publishing, 2008. — С. 4. — 112 с. — ISBN 97807910196932.
- ↑ Koonin E., Galperin M. Sequence — Evolution — Function.
- ↑ Ultratrace minerals. Authors: Nielsen, Forrest H. USDA, ARS Source: Modern nutrition in health and disease / editors, Maurice E. Shils … et al.. Baltimore : Williams & Wilkins, c1999., p. 283-303. Issue Date: 1999 URI: [3]
- ↑ McCall A. S., Cummings C. F., Bhave G., Vanacore R., Page-McCaw A., Hudson B. G. Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture (англ.) // Cell : journal. — Cell Press (англ.)русск., 2014. — Vol. 157, no. 6. — P. 1380—1392. — DOI:10.1016/j.cell.2014.05.009. — PMID 24906154.
- ↑ Monique Laberge. Biochemistry. — USA: Infobase Publishing, 2008. — С. 2. — 112 с. — ISBN 97807910196932.
- ↑ Новая медицинская энциклопедия [Электронный ресурс] Биохимия
- ↑ Whiting, G.C. Sugars // The Biochemistry of Fruits and their Products (англ.) / A.C. Hulme. — London & New York: Academic Press, 1970. — Vol. Volume 1. — P. 1—31.
- ↑ Н. А. Тюкавкина, Ю. И. Бауков. Биоорганическая химия. — 1-е изд. — М.: Медицина, 1985. — С. 349—400. — 480 с. — (Учебная литература для студентов медицинских институтов). — 75 000 экз.
- ↑ Nelson D.L., Cox M.M. Lehninger Principles of Biochemistry (неопр.). — 5th. — W. H. Freeman (англ.)русск., 2008. — ISBN 978-0-7167-7108-1.
- ↑ Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288 с.
- ↑ А. Н. Несмеянов, Н. А. Несмеянов. Начала органической химии. Книга вторая (неопр.) 221. Дата обращения 26 декабря 2012. Архивировано 27 декабря 2012 года.
- ↑ Collier, 1998, pp. 96—99.
- ↑ Tropp, 2012, pp. 5–9.
- Марри Р. и др. Биохимия человека. — М., 1993.
- Введение в биохимическую экологию. — М.: Издательство Московского университета, 1986.
- Fromm, Herbert J.; Hargrove, Mark. Essentials of Biochemistry (неопр.). — Springer, 2012. — ISBN 978-3-642-19623-2.
- Hunter, Graeme K. Vital Forces: The Discovery of the Molecular Basis of Life (англ.). — Academic Press, 2000. — ISBN 978-0-12-361811-5.
- Tropp, Burton E. Molecular Biology. — 4th. — Jones & Bartlett Learning, 2012. — ISBN 978-1-4496-0091-4.
- Vasudevan, D. M. et al. Textbook of Biochemistry for Medical Students. — 7th. — JP Medical Publishers, 2013. — ISBN 978-9-3509-0530-2.
- Collier, Leslie; Balows, Albert; Sussman, Max. Topley and Wilson’s Microbiology and Microbial Infections / Mahy, Brian and Collier, Leslie. Arnold. — ninth edition. — Virology, 1998. — Т. 1. — ISBN 0-340-66316-2.
- Северин, Е.С. Биохимия: Учеб. для вузов / Под ред. Е.С. Северина. — ГЭОТАР Медиа, 2003. — 779 с. — ISBN 5-9231-0254-4.
- Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник. — Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- Николаев А. Я. Биологическая химия. — Высшая школа, 1989. — 495 с. — 50 000 экз. — ISBN 5-06-001400-2.
Символы химических элементов — Википедия
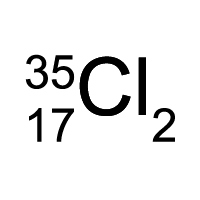
Химический знак двухатомной молекулы хлора-35
Символы химических элементов на почтовой марке СССР, посвящённой 20 конгрессу ИЮПАК, проводившемуся в 1965 году в МосквеСимволы химических элементов — условное обозначение химических элементов. Вместе с химическими формулами, схемами и уравнениями химических реакций образуют формальный язык химии — систему условных обозначений и понятий, предназначенную для краткой, ёмкой и наглядной записи и передачи химической информации.
В зависимости от контекста символ химического элемента может обозначать:
- название химического элемента;
- один атом элемента;
- один моль атомов этого элемента.
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п.
Для неоткрытых и новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uue — унуненний (лат. Ununennium, 119), Ubh — унбигексий (лат. Unbihexium, 126).
Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H.
Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре.
Для обозначения заряженного атома вверху справа указывается заряд иона (напр., Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
| массовое число | заряд иона | |
| Символ элемента | ||
|---|---|---|
| порядковый номер | число атомов в молекуле |
Международные и национальные символы[править | править код]
Приведённые в Периодической таблице элементов символы являются международными, но наряду с ними в некоторых странах употребительны обозначения, произведённые от национальных названий элементов. Например, во Франции вместо символов азота N, бериллия Be и вольфрама W могут использоваться Az (Azote), Gl (Glucinium) и Tu (Tungstène). В США вместо знака ниобия Nb нередко применяют Cb (Columbium).
В Китае используется свой вариант химических знаков, основанный на китайских символах. Большинство символов были изобретены в XIX — XX веках. Символы для металлов (кроме ртути) используют радикал 钅 или 金 («золото», металл вообще), для твёрдых при нормальных условиях неметаллов — радикал 石 («камень»), для жидкостей — 水 («вода»), для газов — 气 («пар»). Например, символ молибдена 钼 состоит из радикала 钅 и фонетика 目, задающего произношение mu4.
История символов химических элементов[править | править код]
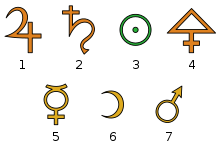 Алхимические символы. 1 — олово; 2 — свинец; 3 — золото; 4 — сера; 5 — ртуть; 6 — серебро; 7 — железо
Алхимические символы. 1 — олово; 2 — свинец; 3 — золото; 4 — сера; 5 — ртуть; 6 — серебро; 7 — железоУчёные древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Систематическое применение алхимиками особых химических знаков начинается с XIII в. Одними из первых начинают прививаться следующие обозначения четырёх элементов-стихий Аристотеля:
 Огонь
Огонь  Земля
Земля  Воздух
Воздух  Вода
Вода 
В то же время формируется символика металлов. Так, у Раймунда Луллия семь металлов, известных с древности, имеют обозначения, тождественные с астрологическими знаками семи небесных светил: Солнца (☉, золото), Луны (☽, серебро), Юпитера (♃, олово), Венеры (♀, медь), Сатурна (♄, свинец), Меркурия (☿, ртуть), Марса (♁, железо). Происхождение и смысл этих символов достоверно неизвестны. Возможно, что знак свинца должен изображать косу Сатурна, знак железа — щит и копьё Марса, знак меди — ручное зеркало Венеры и т. п.: тогда их можно рассматривать, как знаки мифологических божеств, под названиями которых были известны металлы; но одинаково вероятно, что эти знаки являются и сокращениями имён тех же божеств. У алхимиков XIV—XVI вв. встречаются и такие объяснения, что замкнутый круг есть знак совершенства металла, полукруг (полумесяц) — знак приближения его к совершенству[1].
Металлы, открытые в XV—XVIII веках, — висмут, цинк, кобальт — стали обозначаться первыми буквами их названий. Тогда же появились символы сложных веществ, связанные с их названиями. Например, знак винного спирта составлен из букв S и V (лат. spiritus vini). Знаки крепкой водки (лат. aqua fortis) — азотной кислоты, и царской водки (лат. aqua regis), смеси соляной и азотной кислот, составлены из знака воды  и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V — прямой и перевёрнутой.
и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V — прямой и перевёрнутой.
А.-Л. Лавуазье, работая над новой классификацией и номенклатурой, предложил весьма громоздкую систему химической символики для элементов и соединений. Попытки упорядочить старинные химические знаки продолжались до конца XVIII века. Более целесообразная знаковая система была предложена в 1787 г. Ж.-А. Гассенфратцем и П.-О. Аде; их химические знаки приспособлены уже к антифлогистической теории Лавуазье и имеют некоторые особенности, сохранившиеся впоследствии. Они предложили ввести в качестве общих для каждого класса веществ символы в виде простых геометрических фигур и буквенных обозначений, а также прямые линии, проведённые в различных направлениях, для обозначения «истинных элементов» — света и теплорода, а также элементарных газов — кислорода, азота и водорода. Так, все металлы должны были обозначаться кружками с начальной буквой (иногда две буквы, причём вторая строчная) французского названия металла посередине; все щёлочи и щёлочные земли (отнесённые Лавуазье тоже к числу элементов) — различным образом расположенными треугольниками с латинскими буквами посреди и т. д.[2]
В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др.[3] Символы химических элементов Дальтона получили некоторое распространение в химической литературе, но вскоре были вытеснены новой буквенной символикой, предложенной шведским химиком Й. Я. Берцелиусом.
В 1814 г. Берцелиус подробно изложил систему химической символики, основанную на обозначении элементов одной или двумя буквами латинского названия элемента[4]; число атомов элемента предлагалось указывать надстрочными цифровыми индексами (принятое в настоящее время указание числа атомов подстрочными цифрами предложил в 1834 г. Юстус Либих). Система Берцелиуса получила всеобщее признание и сохранилась до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 московский врач И. Я. Зацепин[5].
Концептуальная система химии — Википедия
Материал из Википедии — свободной энциклопедии
Концептуальная система в химии — система взаимосвязанных теорий, объединённых общими фундаментальными принципами, понятиями, законами, методами и проблемами. Теорию концептуальных систем развития химии создал и развивал русский химик и философ В. И. Кузнецов совместно с другими химиками, историками науки, философами. Наиболее полно эта теория изложена в его книге «Общая химия: тенденции развития» (1989).
Выделяют четыре концептуальные системы:
- Учение о составе.
- Структурная химия.
- Учение о химическом процессе.
- Эволюционная химия.
Каждая концептуальная система химии включает несколько теорий, объединённых общими фундаментальными принципами, законами, методами и проблемами.
В развитии химии происходит не смена, а последовательное появление концептуальных систем[1]. Развитие химии в настоящее время происходит параллельно как на каждом из четырех уровней, так и путём подъема с нижних уровней на высшие, то есть от одной концептуальной системы к другой[2].
Первая концептуальная система: Учение о составе[править | править код]
Первой концептуальной системой химии было учение о составе. В рамках этого учения решались две основные проблемы: проблема химического элемента и проблема зависимости свойств вещества от его химического состава. Основной постулат учения о составе состоит в том, что свойства вещества определяются его составом, то есть тем, из каких химических элементов и в каком их соотношении образовано данное вещество. Объектом учения о составе является вещество как совокупность атомов (квантовая микросистема).
Вторая концептуальная система: Структурная химия[править | править код]
Структурная химия, появление которой относят к первой половине XIX-го века, исходит из постулата, что свойства вещества определяются структурой молекул вещества, то есть не только составом, но и порядком соединения атомов между собой и их расположением в пространстве. Основным объектом структурной химии становится молекула как единое целое. С появлением второй концептуальной системы химия превращается из науки аналитической в науку синтетическую.
Третья концептуальная система: Учение о химическом процессе[править | править код]
Учение о химическом процессе, начало формирования которого относят ко второй половине XIX-го века, базируется на постулате, что свойства вещества определяются его составом, структурой и организацией системы, в которой это вещество находится. Зарождение новой концепции химии связано с появлением экспериментальных фактов, указывающие на невозможность объяснения химических реакций только на основе особенностей состава вещества и структуре его молекул. Свойства веществ в общем случае зависят и от концентрации реагентов, от внешних условий и окружающей среды, в которых находится система, и от наличия в системе веществ (катализаторов, растворителя, примесей, и т. п.), стехиометрически не участвующих в химической реакции. Предметом изучения в рамках этой концептуальной системы является вся химическая кинетическая система, для которой само вещество, его состав и структура его молекул рассматриваются как подсистема, как часть системы. Многие эмпирические понятия получают теоретическое обоснование в рамках статистической механики и термодинамики, химической термодинамики, химической кинетики и теории каталитических реакций. Создание учения о химическом процессе позволило решать вопросы управления химическими реакциями и процессами, создать новую химическую технологию.
Четвертая концептуальная система: Эволюционная химия[править | править код]
Четвертая концептуальная система, эволюционная химия, еще только формируется и связана с включением в химическую науку принципа историзма и понятия времени, с построением теории химической эволюции материи. Эволюционная химия изучает процессы самоорганизации вещества: от атомов и простейших молекул до живых организмов. Одним из первых открытий, которые относят к эволюционной химии, является эффект самосовершенствования катализаторов в реакциях, исследованный в работах американских химиков А. Гуотми и Р. Каннингем в 1958—1960 гг. В 1964—1969 гг. советский химик А. П. Руденко, учитывая это открытие, создал теорию саморазвития открытых каталитических систем. В работах немецкого химика М.Эйгена была развита теория гиперциклов, объясняющая объединение самовоспроизводящихся макромолекул в замкнутые автокаталитические химические циклы. Теория гиперциклов является абиогенетической теорией химической эволюции и происхождения жизни. Нобелевский лауреат Жан-Мари Лен, основатель супрамолекулярной химии, ввёл[3] понятие «самоорганизация» и «самосборка» для описания явлений упорядочения в супрамолекулярной химии. Супрамолекулярной самосборкой является процесс спонтанной ассоциации двух и более компонентов, приводящий к образованию супермолекул или полимолекулярных ансамблей, происходящий за счет нековалентных взаимодействий. Это процесс был описан при изучении спонтанного образования неорганических комплексов (двойных геликатов), протекающего как процесс самосборки. Наиболее известным проявлением самосборки в живой природе является самосборка молекул нуклеиновых кислот, матричный синтез белков.
- Кузнецов В. И. Общая химия: тенденции развития. М.: Высшая школа, 1989. 288 с.
- Кузнецов В. И., Диалектика развития химии. От истории к теории развития химии. М.: Наука, 1973. 327 с.
- Кузнецов В. И., Развитие учения о катализе. М.: Наука, 1964. 424 c.
- Кузнецов В. И., Печенкин А. А. «Концептуальные системы химии: структурные и кинетические теории» Вопросы философии. 1971, N.1. С.46-56.
См. также о Концептуальных системах химии[править | править код]
- Вихалемм Р. «К вопросу о концептуальных системах химии» стр.49 — 70. в книге: История науки в философском контексте. Под ред. Печенкина А. А. Санкт-Петербург: РХГА, 2007. 589 с.
- Левченков С. И. Краткий очерк истории химии. Ростов-на-Дону: Изд-во Рост. ун-та, 2006. 112 с.
- Статьи в сборнике «История науки в философском контексте. Посвящается памяти В. И. Кузнецова (1915—2005)» Рос. акад. наук, Ин-т истории естествознания и техники им. С. И. Вавилова. под ред. Печенкина А. А. Санкт-Петербург: РХГА, 2007. 589 с.
- Развитие учения о валентности. М.: Химия, 1977.
- Н.И. Зейле «О трудностях методологических прививок в истории химии» Вестник Томского Государственного Университета. Философия. Социология. Политология. 2012 No. 4. (20), Вып. 1. С.20-26. (Цитата: «Привлечение идей В.И. Кузнецова о четырёх концептуальных уровнях химии и опора на некоторые положения синергетики позволили глубже представить исторически сложный процесс системы организации знаний современной химии.»)
- Н.М. Черемных, Глава 5. Философские проблемы современной химии. в книге «Философия естественных наук» Под редакцией С. А. Лебедева М.: Академический проект, 2006. С. 193-212. ISBN 5-8291-0673-6, ISBN 5-902357-42-X
- В.Л. Чечулин «К философии истории химии» Вестник Пермского Университета. Серия: Философия. Психология. Социология. 2011. Выпуск 4 (8) С.38-43.
- «Разработанная Кузнецовым В.И. концепция развития химии, получившая название «Концептуальные системы химии», включена в программу курса общей химии Московского государственного университета, в учебник «Общая химия» под ред. Е.М. Соколовской и Л.С. Гузея. (3-ие изд. М.: МГУ, 1989. 724 с.), и в учебник Г.А. Крестов «Теоретические основы неорганической химии» (М.: Высшая школа, 1982) для студентов химико-технологических специальностей.» Цитата стр.582 из книги История науки в философском контексте. Санкт-Петербург: РХГА, 2007.
Литература к четвертой концептуальной системе химии[править | править код]
- Жданов Ю. А., Материалистическая диалектика и проблема химической эволюции. Вопросы философии. 1980. N. 2. С.59-80; Марксизм и современность. 2001. N. 1-2. С.50-61.
- Жданов Ю. А., Исторический метод в химии. Вопросы философии. 1980. N. 2. С.125-141.
- Руденко А. П. Теория саморазвития открытых каталитических систем. М.: Изд-во МГУ, 1969. 276 с.
- Эйген М., Шустер П., Гиперцикл. Принципы самоорганизации макромолекул. М.: Мир, 1982. 270 с. (недоступная ссылка)
- Эйген М., Самоорганизация материи и эволюция биологических макромолекул. М.: Мир, 1973, 224 с.
- Лен Ж.-М., Супрамолекулярная химия. Концепции и перспективы. Новосибирск: Наука, 1998. 333 с.
- Стид Д. В., Этвуд Д. Л., Супрамолекулярная химия. В двух томах. Москва, Академкнига, 2007. Том 1. 480 с. Том 2. 416 c.
- Зоркий П. М., Лубнина И. Е., Супрамолекулярная химия: возникновение, развитие, перспективы. Вестник Моск. Ун-та. Серия. 2. Химия, 1999, Том.40. N.5. C.300-307.
- Пожарский А. Ф., Супрамолекулярная химия. Часть 2. Самоорганизующиеся молекулы. Соросовский образовательный журнал. 1997. Том.9. C.40-47. (недоступная ссылка)
- N. Russo, V. Ya. Antonchenko, E. S. Kryachko. Self-organization of molecular systems: from molecules and clusters to nanotubes and proteins. — New York: Springer Verlag, 2009. — 400 с. — ISBN 9048124832, ISBN 9789048124831.
Химическая номенклатура — Википедия
Материал из Википедии — свободной энциклопедии
Хими́ческая номенклату́ра — совокупность названий индивидуальных химических веществ, их групп и классов, а также правила составления этих названий.
Система наименований химических соединений длительное время развивалась хаотично, наименования давались в основном первооткрывателями каких-либо соединений. Многие вещества известны настолько давно, что происхождение их наименований носит легендарный характер. Исторически сложившиеся «собственные имена» выделяют как тривиальные названия. Они не вытекают из каких-либо единых систематических принципов, не выражают строения соединения и чрезвычайно разнообразны. Например: рудничный газ, винный спирт, ванилин, сода.
В 1798 году первую упрощённую химическую номенклатуру предложил А. Л. Лавуазье.
В 1801 году В. М. Севергин принимает новую химическую классификацию Лавуазье, переводит и вводит русскоязычные химические термины[1]. Например, он впервые назвал: «кислотворное вещество» (кратко «кислотвор», совр. кислород), водотворное — водород, удушливое — (азот), угольное — углерод. Оксиды металлов назвал — «земли». Дал химическое обозначение солям. В дальнейшем он переводил[2] и составлял химические словари[3], что способствовало закреплению его химической номенклатуры.
Типы номенклатур[править | править код]
- Рациональная номенклатура лежит в основе номенклатуры неорганических соединений, и часто всю современную номенклатуру называют рациональной. Это может создавать определённые трудности, потому что для органических соединений существует отдельная рациональная номенклатура, значительно отличающаяся от современной. Так, этан в рациональной номенклатуре имеет название метилметан.
- Систематическая номенклатура. Исходя из смыслового содержания этого термина, систематической можно назвать любую номенклатуру, имеющую в основе какую-либо систему. Поэтому все научные номенклатуры, за исключением системы тривиальных названий, являются систематическими. Однако следует помнить, что в 1951 году в СССР группой учёных под руководством А. П. Терентьева была предложена оригинальная «систематическая номенклатура», основанная на строгом едином принципе именования органических соединений. Распространения она не получила из-за значительных отличий от привычных наименований.
- Женевская номенклатура органических соединений. 19—22 апреля 1892 на Женевском конгрессе Международной комиссии для реформы химической номенклатуры были приняты правила номенклатуры, называемой Женевской. Это были первые научно обоснованные правила, до настоящего времени заложенные в ней принципы являются наиболее точными и сохраняют актуальность. Неполная разработанность этой номенклатуры для современного состояния органической химии не позволяет однозначно применять её для наименований сложных соединений.
- Льежская номенклатура органических соединений. В 1930 Международный союз химии (IUC) принял правила, называемые Льежской номенклатурой. Она имеет ряд отличий от Женевской номенклатуры, но в ряде случаев позволяет давать одному соединению различные названия. В настоящее время практически не применяется.
- Номенклатура ИЮПАК. Разнообразие номенклатурных систем органических соединений и возникающие из-за этого сложности в научной и практической деятельности привели к тому, что в 1947 на совещании ИЮПАК в Лондоне было принято решение о пересмотре существовавших на тот момент правил и выработке новых международных правил номенклатуры. Созданная комиссия выработала такие правила, и в 1957 они были опубликованы под названием Правила номенклатуры органических соединений IUPAC 1957. Эти правила получили широкое распространение.
Основная статья Номенклатура ИЮПАК.
- Современная номенклатура химических соединений в основном базируется на правилах ИЮПАК (IUPAC), которые разрабатывались начиная с 40-х годов XX века. Правила ИЮПАК определяют общие принципы и приемы построения названий соединений и периодически пересматриваются. Наиболее значительные изменения вводились в 1979 и в 1993 годах.
В XX в. для образования названий соединений была принята номенклатура [которая зачастую действует и поныне], основанная на рекомендациях Международного союза теоретической и прикладной химии (IUPAC) с учётом «Проекта правил номенклатуры неорганических соединений», разработанного Комиссией по номенклатуре неорганических соединений Отделения общей и технической химии АН СССР[4], и адаптированная к традициям русского языка[5]. - В конкретных случаях разрабатываемые национальные номенклатуры учитывают номенклатурные традиции и особенности языка. В русской химической номенклатуре наблюдается постепенное приближение к структуре и семантике английской, что связано с увеличением доли англоязычной химической информации, начавшимся в конце XX века и с развитием Интернета, ещё больше эта тенденция выражена в новой украинской химической номенклатуре.
Соединения, названные по рациональной номенклатуре[править | править код]
Тривиальные названия — названия, исторически закрепившиеся за какими-либо соединениями, и не соответствующие никакой номенклатуре.
- ↑ Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: ИАН, 1801. XVI, [15], 370 c.
- ↑ Каде де Гассикур Ш. Словарь химический, содержащий в себе теорию и практику химии с приложением её к естественной истории и искусствам /Перевод В. М. Севергина: В 4 т. СПб.: тип. ИАН, 1810—1813.
- ↑ Севергин В. М. Руководство к удобнейшему разумению химических книг иностранных, заключающее в себе словари: латинско-российский, французско-российский и немецко-российский, по старинному и новейшему словознанию. СПб.: тип. ИАН, 1815. V, 291, 4 с.
- ↑ «Материалы к проекту номенклатуры неорганических соединений». М., «Наука», 1968
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л., Цветков А.А. Основы номенклатуры неорганических веществ / Под ред. Б. Д. Степина. М., Химия, 1983.
- Химический энциклопедический словарь. М.: «Советская энциклопедия», 1983.
Что означает сокращение «с. о. «? «характерные с. о. » (в химии)
это степень окисления. например, характерные степени окисления для данного элемента. самое удивительно то, что никто не дал до этого правильныи ответ.
Может быть свойства объекта? Как химик, не могу догадаться, что это за сокращение. Если приведете весь смысловой отрывок, тогда можно будет строить догадки.
свойства оксидов?
Среда Обитания ))))