Гидроксид кальция — хим. свойства и получение CHEMEGE.RU
Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства.
Относительная молекулярная масса Mr = 74,09; относительная плотность для тв. и ж. состояния d = 2,08.
1. Гидроксид кальция получают в результате взаимодействия гидрида кальция и воды, на выходе образуется водород и гидроксид кальция:
CaH2 + 2H2O = Ca(OH)2↓ + 2H2↑
2. При взаимодействии кальция с водой при комнатной температуре образуется гидроксид кальция и водород:
Ca + 2H2O = Ca(OH)2↓ + H2↑
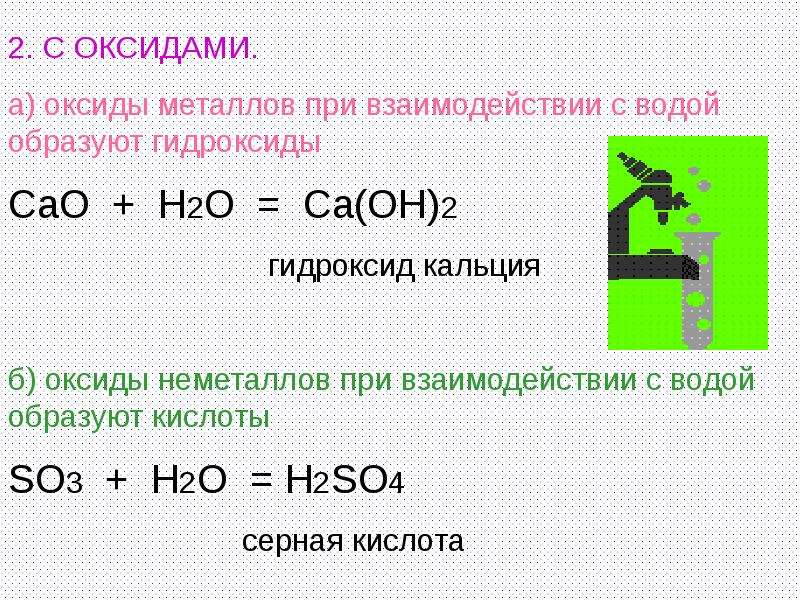
3. Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
CaO + H2O = Ca(OH)2
Качественная реакция на гидроксид кальция — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид кальция вступает в реакцию с простыми веществами:
1.1. Холодный гидроксид кальция (суспензия) взаимодействует с хлором и образует гипохлорит кальция, хлорид кальция и воду:
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O,
если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода:
Ca(OH)2 + 6Cl2 = Ca(ClO3)2 + 5CaCl2 + 6H2O
2. Гидроксид кальция взаимодействует со сложными веществами:
Гидроксид кальция взаимодействует со сложными веществами:
2.1. Гидроксид кальция реагирует с кислотами:
2.1.1. В результате реакции между гидроксидом кальция и разбавленной соляной кислотой образуется хлорид кальция и вода:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2.1.2. Гидроксид кальция взаимодействует
Ca(OH)2 + H2SO4 = CaSO4↓ + 2H2O
2.1.3. В результате взаимодействия гидроксида кальция и разбавленной фосфорной кислоты образуется фосфат кальция и вода:
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2↓ + 6H2O,
если с гидроксидом кальция будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции образуется гидрофосфат кальция и вода:
Ca(OH)2 + H3PO4 = CaHPO4↓ + 2H2O
2.
 1.4. С гидроксидом кальция реагирует сероводородная кислота, образуя гидросульфид кальция и воду:
1.4. С гидроксидом кальция реагирует сероводородная кислота, образуя гидросульфид кальция и воду:
Ca(OH)2 + 2H2S = Ca(HS)2 + 2H2O
2.2. Гидроксид кальция взаимодействует с оксидами:
2.2.1. В результате взаимодействия гидроксида кальция и углекислого газа образуется карбонат кальция и вода:
Ca(OH)2 + СO2 = CaСO3 + H2O,
если с углекислым газом реагирует карбонат кальция в виде суспензии, то образуется гидрокарбонат кальция в растворе:
Ca(OH)2 + 2СO2 = Ca(HСO
2.2.2. Гидроксид кальция вступает в реакцию с оксидом серы (IV), образуя на выходе сульфит кальция и воду:
Ca(OH)2 + SO2 = CaSO3 + H2O,
если с оксидом серы (IV) взаимодействует гидроксид кальция в виде суспензии, то на выходе происходит образование гидросульфита кальция в растворе:
Ca(OH)2 + 2SO2 = Ca(HSO3)2
2. 4. Гидроксид кальция реагирует с солями:
4. Гидроксид кальция реагирует с солями:
2.4.1. Гидроксид кальция (суспензия) взаимодействует с холодным гипохлоритом натрия, образуя гипохлорит кальция
и гидроксид натрия:
Ca(OH)2 + 2NaClO = Ca(ClO)2↓ + 2NaOH
2.5. Гидроксид кальция взаимодействует с пероксидом водорода при 40 — 50º С с образованием пероксида кальция и воды:
Ca(OH)2 + H2O2 = CaO2↓ + 2H2O
3. Гидроксид кальция разлагается при температуре 520 — 580º С, образуя на выходе оксид кальция и воду:
Ca(OH)2 = CaO + H2O
Гидроксид кальция — свойства, получение и применение
Гидроксид кальция» title=»Известь»>известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание.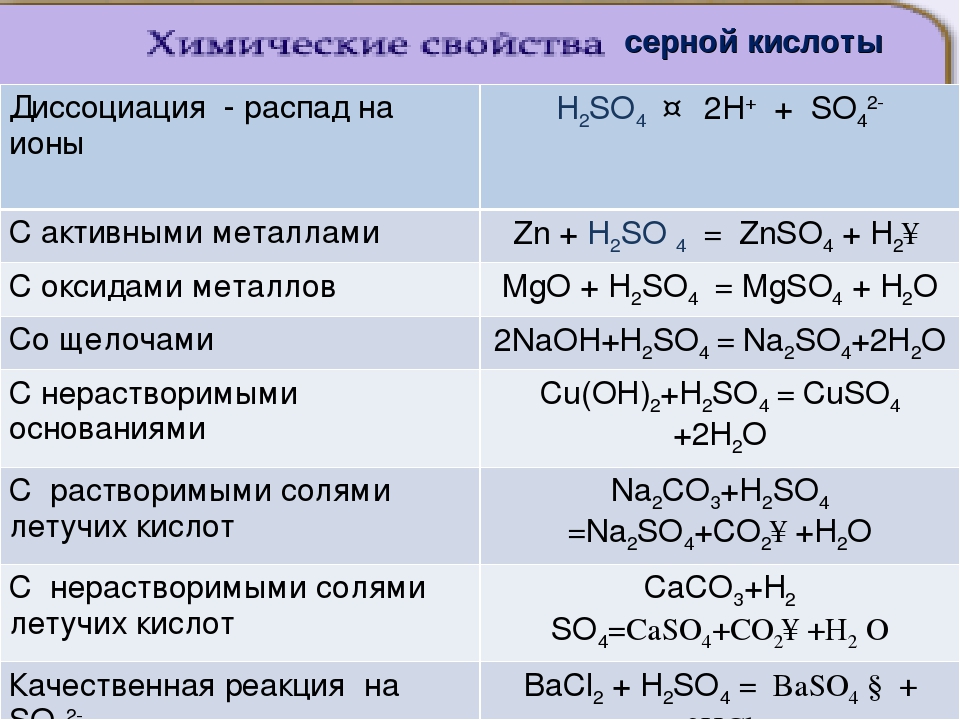
| Гидроксид кальция | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | HO-Ca-OH |
| Состояние | белые кристаллы |
| Молярная масса | 74,093 г/моль |
| Плотность | 2,211 г/см³ |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,185 г/100 мл |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
Рег. номер EINECS номер EINECS | 215-137-3 |
| SMILES | |
| InChI |
1S/Ca.2h3O/h;2*1h3/q+2;;/p-2 AXCZMVOFGPJBDE-UHFFFAOYSA-L |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| NFPA 704 | |
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.

Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
Применение
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.

- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора, долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.

- Для устранения карбонатной жёсткости воды (умягчение воды).
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- В Латинской Америке в известковом молоке отваривают зёрна кукурузы для размягчения мякины, активизации клейковины и улучшения перевариваемости — т. н. «никстамализация».
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.

- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.
Подробнее… | Lhoist — Minerals and lime producer
Компания Lhoist — ведущий поставщик извести, доломитовой извести, известняка, доломита и другого минерального сырья, такого как комовая глина.
Что такое…
Изображения каждого из этих продуктов вы найдете в ФОТОГАЛЕРЕЕ ПРОИЗВОДСТВЕННОГО ЦИКЛА ИЗВЕСТИ И ОБОЖЖЕННОГО ДОЛОМИТА.
Что такое известь?
Известь — это общее обозначение гашеной и негашеной извести, хотя в результате переработки эти продукты получают разные химические свойства.
- Известняк (карбонат кальция, CaCO₃) в больших количествах присутствует в естественной породе по всему миру.

- Известь (оксид кальция, CaO) — это щелочноземельный оксид и результат химического преобразования известняка при нагреве свыше 1000 °C с потреблением энергии (3,2 ГДж на тонну CaO). Оксид кальция (или обожженная известь) быстро вступает в реакцию с водой и часто называется негашеной известью.
- Гашеная известь (гидроксид кальция, Ca(OH)₂) — сильная щелочь, образованная в результате реакции оксида кальция с водой. В ходе данной реакции выделяется тепло. В зависимости от количества воды можно использовать гидроксид кальция в виде сухого гидрата (порошка), известковой пасты или жидкого известкового молока, которое также называют известковым тестом (водная суспензия сухого материала).
- Химически осажденный карбонат кальция (PCC, CaCO3) — синтетический карбонат кальция. Данный продукт можно производить в промышленных масштабах, при помощи реакции между гидроксидом кальция и CO₂.
Что такое доломитовая известь?
- Доломит (двойной карбонат кальция и магния, CaCO₃.
 MgCO₃) — результат частичной или полной доломитизации карбоната кальция.
MgCO₃) — результат частичной или полной доломитизации карбоната кальция. - Полуобожженный доломит (карбонат кальция + оксид магния, CaCO₃.MgO) образуется, если карбонат магния окисляется только частично.
- Доломитовая известь (оксид кальция и магния, CaO.MgO) образуется в результате химического преобразования двойного карбоната кальция и магния при нагреве свыше 1000 °C с потреблением энергии (2,935 ГДж на тонну CaO.MgO). Как и известь, доломитовая известь вступает в реакцию с водой. CaO более близок к структуре воды, чем MgO.
- Полугашеная доломитовая известь (гидроксид кальция + оксид магния, Ca(OH)₂.MgO) образуется в результате реакции доломитовой извести с водой при обычных условиях.
- Гашеная доломитовая известь (тетрагидроксид кальция и магния, Ca(OH)₂.Mg(OH)₂) образуется по завершении реакции гидратации, осуществляемой в реакторах под давлением при температуре около 150 °C.
Что такое минералы
Различные минералы используются в самых разных отраслях промышленности и сельского хозяйства. На наших месторождениях мы добываем такие минералы, как известняк высокой степени чистоты и доломитовый известняк. Они присутствуют на различных наших рынках сбыта. Lhoist также является основным поставщиком наполнительного материала, используемого в основном в дорожном и гражданском строительстве. На наших предприятиях в пределах США мы разрабатываем различные специальные глины, например комовую глину, каолин, сепиолит, сапонит и кальциевый бентонит.
На наших месторождениях мы добываем такие минералы, как известняк высокой степени чистоты и доломитовый известняк. Они присутствуют на различных наших рынках сбыта. Lhoist также является основным поставщиком наполнительного материала, используемого в основном в дорожном и гражданском строительстве. На наших предприятиях в пределах США мы разрабатываем различные специальные глины, например комовую глину, каолин, сепиолит, сапонит и кальциевый бентонит.
- Комовая глина — это гидросиликат окиси алюминия, получающийся из каолинов, образованных из водонасыщенного осадка, подвергшегося химическому изменению и смешанного с песком, органическими материалами и другими компонентами. В состав комовой глины входят такие минералы, как каолин, иллит, слюда, полевой шпат и кварц. В ней присутствуют и другие «сопутствующие» минералы, а также некоторые углеродистые вещества. Комовая глина — довольно редкий материал, который встречается всего в нескольких местах на Земле.
- Каолин — это разговорное название минерала каолинита, шестигранного пластинчатого кристалла, состоящего из оксидов и гидроксидов кремния и алюминия.
 Каолин, известный также как каолинит или китайская глина, представляет собой слоистый силикат окиси алюминия, образованный вследствие химического выветривания таких алюмосиликатов, как полевой шпат; обладает низкой способностью к сжатию-разбуханию и низкой емкостью катионного обмена (ЕКО).
Каолин, известный также как каолинит или китайская глина, представляет собой слоистый силикат окиси алюминия, образованный вследствие химического выветривания таких алюмосиликатов, как полевой шпат; обладает низкой способностью к сжатию-разбуханию и низкой емкостью катионного обмена (ЕКО). - Сепиолит — это силикат магния с особым строением лейсты, обнаруживающий крайне высокую внутреннюю и внешнюю удельную поверхность, низкую ЕКО, низкую удельную плотность и способность диспергировать как в пресной, так и в соленой воде.
- Сапонит представляет собой магниевую бентонитовую глину, обнаруживающую значительное расстояние между слоями своей пластинчатой структуры, и ЕКО, намного более высокую чем у сепиолита, однако также способную диспергировать как в пресной, так и в соленой воде.
- Кальциевый бентонит — это видоизмененная глина на основе кальция, обнаруживающая высокую способность к катионному обмену и намного менее выраженную способность к поглощению и разбуханию, чем у натриевого бентонита.

Продукция | Угловский известковый комбинат
Гидроксид кальция — химическое вещество, сильное основание, формула Ca(OH)2. Представляет собой порошок белого цвета, плохо растворимый в воде.
Тривиальные названия- гашёная известь — так как получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести;
- известковая вода — прозрачный (близкий к насыщенному) водный раствор;
- известковое молоко — водная суспензия.
- пушонка — сухой гидроксид кальция.
Часто называют просто известь или извёстка (так же называют и оксид кальция).
ПолучениеПолучают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O > Ca(OH)2
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием из-за чего водный раствор имеет щелочную реакцию.
Как и все гидроксиды, реагирует с кислотами с образованием соответствующих солей кальция:
Ca(OH)2 + CaSO4 + 2H2O,
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гироксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Ca(OH)2 + CO2 > CaCO3v + H2O
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
CaCO3 + CO2 + H2O > Ca(HCO3)2,
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
2Ca(HCO3)2 >(t) CaCO3v + CO2^ + H2O
Гидроксид кальция реагирует с монооксидом углерода при температуре около 400°C:
Ca(OH)2 + CO >(t) CaCO3 + H2^
Применение
- при побелке помещений;
- для приготовления известкового строительного раствора.

Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора долгое время сохранется повышенная влажность. В связи с этим, а также бладодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов;
- для приготовления силикатного бетона. Состав силикатного бетона одинаков с составом известкового строительного раствора, однако он готовится другим методом — смесь оксида кальция и кварцевого песка обрабатывается не водой, а перегретым (174,5—197,4°C) водяным паром в автоклаве при давлении 9—15 атмосфер;
- для устранения карбонатной жёсткости воды (умягчение воды). Реакция идёт по уравнению:
Ca(HCO3)2 + Ca(OH)2 > 2CaCO3v + 2H2O;
- для производства хлорной извести;
- для производства известковых удобрений;
- каустификация карбоната натрия и калия;
- дубление кож;
- получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.

Химия
- Подробности
Просмотров: 18717
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см.
 реакцию №2
реакцию №25) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния.
 Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду.
 Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния:Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1.
 Взаимодействуют с кислотными оксидами с образованием соли.
Взаимодействуют с кислотными оксидами с образованием соли.Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3.
 Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
Железо. Нахождение в природе. Свойства железа. * 43 у 1-5 с 135
задача 102 с 136
Оксиды, гидроксиды и соли железа (II) и железа (Ш). * 44 у 6-11
з 3-4 с 136
91
Железо. Нахождение в природе. Свойства железа.
Оксиды, гидроксиды и соли железа (II) и железа (Ш).
* 43 у 1-5 с 135
з 102 с 136
* 44 у 6-11
з 3-4 с 136
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы.
Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
* 45 у 1-4
з 1-3 с 147,
* 46- *47
у 5-14
з 4-6с147
10АБ
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Получение карбоновых кислот и применение.
Краткие сведения о непредельных карбоновых кислотах.
Генетическая связь карбоновых кислот с другими классами органических соединений
**27 -29
у 1-4,
11- 18
с 117-118
З 1 с118
111
Окислительно–восстановительные реакции
* 11, записи в тетради 12АБ
Металлы побочных подгрупп (Б — групп) периодической системы химических элементов ** 22 – 27
У 1- 12 с 118 з 1-4 с 118
Оксиды и гидроксиды металлов *29 у 16-18 с 118
З 6 с 118
Сплавы металлов. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. * 28 у 13- 15 с 118 121
Генетическая связь неорганических и органических веществ
* 33 у с 143 Гидроксид кальция
Гидроксид кальция Систематическое
наименованиеГидроксид кальция Традиционные названия гашёная (едкая) известь Хим. формула Ca(OH)2 Рац. формула Ca(OH)2 Состояние белые кристаллы Молярная масса 74.093 г/моль Плотность 2.211 г/см³ Температура • плавления 512 °C • разложения 580 °C Давление пара 0 ± 1 мм рт.ст. Растворимость • в воде 0.185 г/100 мл ГОСТ ГОСТ 9262-77 Рег. номер CAS [1305-62-0] PubChem 6093208 Рег. номер EINECS 215-137-3 SMILES InChI 1S/Ca.2h3O/h;2*1h3/q+2;;/p-2
AXCZMVOFGPJBDE-UHFFFAOYSA-L
Кодекс Алиментариус E526 RTECS EW2800000 ChEBI 31341 ChemSpider 14094 и 21170965 Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. Гидроксид кальция (гашёная известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
- CaO + H2O → Ca(OH)2 .
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
Растворимость гидроксида кальция в воде при разных температурах Температура, °C Растворимость,
г Ca(OH)2/100 г H2O0 0,173 20 0,166 50 0,13 100 0,08 По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
- Ca(OH)2 →600oC CaO + H2O .
Кристаллизуется в гексагональной кристаллической структуре.
Химические свойства
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
- Ca(OH)2 + H2SO4 → CaSO4↓ + 2H2O .
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
- CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2 .
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
- Ca(OH)2 + CO →400oC CaCO3 + H2 .
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
- Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH .
Применение
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды).
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.
Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
Амфотерный гидроксид (основная и кислотная форма)
Комплексный ион
Zn(OH)2 / H2ZnO2
ZnO2 (II)
[Zn(OH)4]2–
Al(OH)3 / HAlO2
AlO2 (I)
[Al(OH)4]–, [Al(OH)6]3–
Be(OH)2 / H2BeO2
BeO2 (II)
[Be(OH)4]2–
Sn(OH)2 / H2SnO2
SnO2 (II)
[Sn(OH)4]2–
Pb(OH)2 / H2PbO2
PbO2 (II)
[Pb(OH)4]2–
Fe(OH)3 / HFeO2
FeO2 (I)
[Fe(OH)4]–, [Fe(OH)6]3–
Cr(OH)3 / HCrO2
CrO2 (I)
[Cr(OH)4]–, [Cr(OH)6]3–
Физические свойства. Основания — твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2диссоциирует по двум ступеням:
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
Гидроксид tразл, °C Гидроксид tразл, °C Гидроксид tразл, °C LiOH 925 Cd(OH)2 130 Au(OH)3 150 Be(OH)2 130 Pb(OH)2 145 Al(OH)3 >300 Ca(OH)2 580 Fe(OH)2 150 Fe(OH)3 500 Sr(OH)2 535 Zn(OH)2 125 Bi(OH)3 100 Ba(OH)2 1000 Ni(OH)2 230 In(OH)3 150 4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+ 6H2О ® 2[Al(OH)4]– + 3H2.
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2® Na2CO3 + H2O 2OH–+ CO2 ® CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3® 2NaOH + BaCO3¯ Ba2+ + CO32– ® BaCO3¯.
Л.А. Яковишин
Формула гидроксида кальция — гидроксид кальция Использование, свойства, структура и формула
Формула и структура: Химическая формула гидроксида кальция — Ca (OH) 2 , а его молярная масса составляет 74,09 г / моль.
Это ионное соединение имеет катион металлического кальция, связанный с двумя гидроксидными анионами. В твердой форме гидроксид кальция существует в полимерной структуре, чему способствует образование водородных связей между слоями.
Происхождение: Гидроксид кальция встречается в природе, но редко, в минеральной форме в виде портландита, который встречается в некоторых вулканических и метаморфических породах.
Приготовление: Гидроксид кальция получают в промышленных масштабах путем взаимодействия оксида кальция (извести или негашеной извести) с водой:
CaO + H 2 O → Ca (OH) 2
Его также получают в меньших масштабах путем реакции между водным хлоридом кальция и гидроксидом натрия.
Физические свойства: Получают в виде бесцветных кристаллов или белого порошка с плотностью 2,21 г / см³ и температурой плавления 580 ° C.
Химические свойства: Гидроксид кальция относительно растворим в воде.Он частично растворяется в воде с образованием раствора, называемого известковой водой, который является умеренным основанием. Известковая вода или водн. Ca (OH) 2 реагирует с кислотами с образованием солей и может разрушать некоторые металлы, такие как алюминий. Известковая вода легко реагирует с диоксидом углерода с образованием карбоната кальция, полезный процесс, называемый карбонатацией:
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
Применение: Гидроксид кальция имеет множество промышленных применений, например, в производстве крафт-бумаги, в качестве флокулянта при очистке воды и сточных вод, при получении аммиака и в качестве модификатора pH.Он также является важным ингредиентом цемента, гипса и строительных растворов. Как довольно нетоксичная и мягкая основа, она имеет множество применений в пищевой промышленности, включая регулировку pH, обогащение кальцием, помощь пищеварению и заменитель пищевой соды.
Воздействие на здоровье / опасность для здоровья: Гидроксид кальция не токсичен при низких концентрациях. Однако при более высоких концентрациях контакт с глазами / кожей, вдыхание или проглатывание водного раствора гидроксида кальция может вызвать слепоту, сильное раздражение кожи, химические ожоги или повреждение легких.
Гидроксид кальция — объяснение, свойства, использование и часто задаваемые вопросы
Гидроксид кальция обычно называют гашеной известью и описывается химической формулой Ca (OH) 2. Это также белое неорганическое соединение, которое в твердом состоянии имеет порошкообразный вид. Однако в кристаллической форме он имеет бесцветный вид.
Другие названия этого соединения могут быть даны как гашеная известь, гашеная известь, каустическая известь и травильная известь.Обычно гидроксид кальция получают путем смешивания оксида кальция (также называемого негашеной известью) и воды.
Объяснение гидроксида кальция
Кроме того, химическая реакция между хлоридом кальция и гидроксидом натрия, растворенным в воде (водный CaCl2), дает это соединение. Структурное представление молекулы Ca (OH) 2 можно проиллюстрировать ниже.
(изображение будет скоро загружено)
Молекулы гидроксида кальция удерживаются вместе ионными связями между двумя ионами гидроксида (OH–) и ионами кальция (Ca2 +).Незащищенное воздействие этого соединения может оказаться опасным для человека, вызывая раздражение кожи и химические ожоги. Воздействие концентрированного Ca (OH) 2 может привести к повреждению легких и даже к слепоте.
Некоторые важные свойства гидроксида кальция можно свести в таблицу следующим образом:
Свойства гидроксида кальция
Название IUPAC или идентификатор IUPAC
Гидроксид кальция
Химическая формула для символа гидроксида кальция или формула гидроксида кальция
Ca (OH) 2
Плотность
2.211 грамм / кубический сантиметр
Молекулярная масса или молярная масса
74,093 грамма на моль
Точка плавления
852K
Внешний вид или цвет гидроксида кальция цвет гидроксида кальция
Бесцветный кристалл или белый порошок
Физические свойства
Давайте рассмотрим некоторые физические свойства гидроксида кальция, перечисленные ниже:
Ca (OH) 2 имеет структура гексагональных кристаллов.
Это соединение плохо растворяется в воде. Но его растворимость снижается с повышением температуры. Предположим, его растворимость при растворимости составляет 1,73 г / л при 20 ℃, а при 0 ℃ — 1,89 г / л.
Это соединение также имеет тенденцию терять воду и разлагаться при температурах, приближающихся к температуре плавления.
Произведение растворимости (Ksp) гидроксида кальция может быть выражено как 5,5 * 10 -6 .
Химические свойства
Давайте рассмотрим некоторые химические свойства гидроксида кальция, перечисленные ниже.
Гидроксид кальция хорошо растворим в кислотах и глицерине, но мало растворим только в воде. Он дает раствор, который действует как умеренная основа (называемая известковой водой), когда он растворяется в воде до точки насыщения.
Известковая вода вступает в реакцию с кислотами и образует соли.
Насыщенный раствор гидроксида кальция в воде также вступает в реакцию с металлами, такими как алюминий, и растворяет их.
Он также реагирует с диоксидом углерода и образует карбонат кальция (CaCO3).В общем, эту реакцию можно назвать карбонатацией.
Использование гидроксида кальция
Существует множество различных применений гидроксида кальция, некоторые из которых перечислены ниже. Давайте посмотрим на них.
Ca (OH) 2 может быть использован в бумажной промышленности в процессе крафт-бумаги, который превращает древесину в древесную массу.
В процессе очистки сточных вод гидроксид кальция может использоваться в качестве флокулянта или осветлителя.
Это важное соединение при получении аммиака.
Обычно маринование огурцов производится с помощью Ca (OH) 2.
Кроме того, это соединение используется в качестве модификатора pH из-за его основности.
При производстве различных пластмасс используется гидроксид кальция в качестве основного ингредиента.
При лечении корневых каналов этот состав используется для пломбирования полостей человеческих зубов.
Мы можем использовать его в пестицидах, производстве эбонита и в средствах по уходу за волосами.
Гидроксид кальция может использоваться в кожевенной промышленности для отделения меха или волос от шкуры животного.
Сахарный тростник и сахарная свекла перерабатываются путем карбонизации, в которой используется Ca (OH) 2.
Индейцы используют
На испанском языке гидроксид кальция известен как кал. Кукуруза, приготовленная с калом (в процессе никстамализации), превращается в хомячок (никстамал), что значительно увеличивает биодоступность ниацина (витамина B3), а также считается более вкусным и более легким для переваривания.
Гидроксид кальция обычно пережевывают вместе с листьями коки, чтобы химические стимуляторы алкалоидов оставались доступными для усвоения организмом. Точно так же коренные американцы жевали листья табака, традиционно с гидроксидом кальция, полученным из сожженных раковин моллюсков, чтобы усилить его действие. Кроме того, он использовался несколькими коренными американскими племенами в качестве основного ингредиента йопо, психоделического нюхательного табака, приготовленного из бобов некоторых видов Anadenanthera.
Известь гашеная — структура, получение, свойства и применение
Структура гидроксида кальция
Как указано выше, химическая формула гидроксида кальция — Ca (OH) 2.Это ионное соединение. В котором кальций теряет два электрона на многоатомные гидроксид-ионы. Таким образом, в гашеной извести ионы Ca + 2 образуют одну ионную связь с каждым из ионов OH-. Хотя атомы кислорода и водорода многоатомного гидроксид-аниона обладают ковалентными связями между собой. Между слоями гидроксидов кальция существуют прочные водородные связи. Вот почему он имеет гексагональную кристаллическую структуру.
[Структура гидроксида кальция-изображение будет загружено в ближайшее время]
[Определение формулы гидроксида кальция-изображение будет загружено в ближайшее время]
Получение гидроксида кальция
из оксида кальция — промышленное производство гидроксида кальция осуществляется компанией обработка негашеной извести водой.Оксид кальция широко известен как негашеная известь. Процесс производства гидроксида кальция из извести называется гашением извести, так как при смешивании ограниченного количества воды с негашеной известью она распадается и крошится. Соответствующая реакция приведена ниже —
CaO + h3O 🡪 Ca (OH) 2
Из хлорида кальция — в лабораториях гашеную известь готовят путем смешивания водных растворов хлорида кальция и каустической соды. Каустическая сода — это общее название гидроксида натрия.
CaCl2 + 2NaOH 🡪 Ca (OH) 2 + 2NaCl
Свойства гидроксида кальция
Физические свойства —
Его молярная масса 74.09 г / моль.
В виде бесцветных кристаллов или белого порошка.
Не имеет запаха.
Его температура плавления составляет 580 ℃.
Растворим в воде, глицерине и кислотах. Водный раствор гидроксида кальция называется известковой водой. Его растворимость уменьшается с повышением температуры. Его суспензия в воде называется известковым молоком.
Не растворяется в спирте.
Является основным или щелочным по природе.
Химические свойства —
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
Ca (OH) 2 → CaO + H 2 O
Ca (OH) 2 + 2HCl (разбавленный) 🡪 CaCl2 + 2h3O
Ca (OH) 2 + h3SO4 (конц.) 🡪 CaSO4 ↓ + 2h3O
Ca (OH) 2 + 2h3S 🡪 Ca (HS) 2 + 2h3O
Получение аммиака — При реакции с хлоридом аммония гидроксид кальция дает аммиак, хлорид кальция и воду.Реакция приведена ниже —
Ca (OH) 2 + 2Nh5Cl → 2Nh4 + CaCl2 + 2h3O
3Ca (OH) 2 + 12S → 2CaS5 + CaS2 O3 + 3h3 O
Использование гидроксида кальция
Мы используем гидроксид кальция от древних войн, времен Римской империи до современной промышленности. Вы будете удивлены, узнав, что в Римской империи широко использовались растворы на основе извести в своей архитектуре, а известь присутствует в строительном материале Великой китайской стены. Некоторые из ее современных применений перечислены ниже —
Для стирки белила — Гашеная известь используется для стирки белизны.Он медленно вступает в реакцию с углекислым газом и образует на стене слой карбоната кальция, который придает стене блеск.
Для производства сахара — Гашеная известь используется при производстве сахара из сахарного тростника. Он делает сок сахарного тростника щелочным и осаждает его примеси.
Применяется для очистки сточных вод. Он используется как флокулянт в воде.
Используется в бумажной промышленности.
Используется в соленьях.
Используется для обработки воды для различных напитков.
Используется для удаления целлюлозной оболочки зерен кукурузы.
Используется в качестве вспомогательного средства пищеварения.
Используется при изготовлении пападума.
Он также используется в паане и табаке.
Это все о гашеной извести. Если вы ищете решения NCERT или подробные заметки по изучению различных тем химии, войдите в Vedantu или загрузите приложение Vedantu Learning App.Таким образом вы получите доступ к бесплатным PDF-файлам решений NCERT, заметкам об исследованиях, заметкам о пересмотрах, пробным тестам и т. Д.
Гидроксид кальция — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Использование
- Участник
Гидроксид кальция, Ca (OH) 2 , образует бесцветные кристаллы (в результате получается белый порошок) и получается путем смешивания оксида кальция с водой (гидроксид кальция также называют гашеной известью ) .Гидроксид кальция в промышленных масштабах производится в огромных количествах путем термического разложения известняка и последующей экзотермической реакции оксида кальция с водой:
CaCO 3 CaO + CO 2
CaO + H 2 O Ca (OH) 2 (+65,2 кДж)Экзотермическая реакция с водой дает достаточно энергии для испарения воды.
В лаборатории гидроксид кальция можно получить путем смешивания водных растворов хлорида кальция и гидроксида натрия:
CaCl 2 + 2 NaOH Ca (OH) 2 + 2 NaCl
При нагревании гидроксида кальция до 512 ° C гидроксид кальция разлагается на оксид кальция и воду:
Ca (OH) 2 CaO + H 2 O
Ca (OH) 2 плохо растворяется в воде (0.16 г Ca (OH) 2 /100 г воды при 20 ° C) с образованием основного раствора, называемого известковой водой . Растворимость уменьшается с повышением температуры. Суспензия частиц гидроксида кальция в воде называется известковым молоком .
Известковая вода становится молочной в присутствии диоксида углерода из-за образования карбоната кальция:
Ca (OH) 2 + CO 2 CaCO 3 + H 2 O
Использование
Гидроксид кальция используется в строительной индустрии в составе строительных растворов, поскольку его реакция с углекислым газом воздуха связывает частицы песка и гравия с образованием карбоната кальция.Другими важными приложениями являются использование гидроксида кальция в качестве флокулянта при очистке воды и сточных вод, а также восстановление гидроксида натрия в бумажной промышленности.
кальция_гидроксид
Гидроксид кальция Название ИЮПАК гидроксид кальция Другие названия Гидроксид кальция (II),
гашеная известь,
гашеная известь,
Известковое молоко.Идентификаторы Номер CAS 1305-62-0 Недвижимость Молекулярная формула Ca (OH) 2 Молярная масса 74,093 г / моль Внешний вид Мягкий белый порошок / бесцветная жидкость Плотность 2,211 г / см³, твердый Точка плавления 512 ° C (разлагается).
Температура кипения Н / Д
Растворимость в воде 0,185 г / 100 см³
K sp = 7,9 x 10 −6Основность (p K b ) -2,37 pH = 12,0-12,5
Опасности Паспорт безопасности Внешний паспорт безопасности материала Классификация ЕС Коррозийный ( C ) R-фразы R34, R36, R37, R38, R41. S-фразы S22, S26, S39, S45. Температура вспышки Невоспламеняющийся. Родственные соединения Анионы прочие Не указаны. Прочие катионы Не указаны. Связанные базы Оксид кальция. Страница дополнительных данных Структура и
свойстваn , ε r и т. Д. Термодинамические данные Фазовое поведение
Твердое, жидкое, газовоеСпектральные данные УФ, ИК, ЯМР, МС Если не указано иное, данные приведены для
материалов в их стандартном состоянии
(при 25 ° C, 100 кПа)
Заявление об отказе от ответственности и ссылки на InfoboxГидроксид кальция , также известный как гашеная известь , представляет собой химическое соединение с химической формулой Ca (OH) 2 .Это бесцветный кристалл или белый порошок, который получают, когда оксид кальция (называемый известь или негашеная известь ) смешивают или «гашивают» водой. Его также можно осаждать путем смешивания водного раствора хлорида кальция и водного раствора гидроксида натрия. Традиционное название гидроксида кальция — гашеная известь или гашеная известь . Название природного минерала — портландит.
Рекомендуемые дополнительные знания
При нагревании до 512 ° C [1] гидроксид кальция разлагается на оксид кальция и воду.Суспензия мелких частиц гидроксида кальция в воде называется известковым молоком. Этот раствор называется известковой водой и представляет собой основу средней прочности, которая бурно реагирует с кислотами и разрушает многие металлы в присутствии воды. Он становится молочным, если через него проходит углекислый газ из-за осаждения карбоната кальция.
использует
Благодаря своим сильным основным свойствам гидроксид кальция находит разнообразное применение, например:
- Флокулянт для очистки воды и сточных вод и улучшения кислых почв.
- Ингредиент для побелки, строительного раствора и штукатурки.
- Щелочь, используемая в качестве заменителя щелока в средствах для расслабления волос без щелока.
- В Наире обнаружено химическое средство для удаления волос.
- Ингредиент в детских смесях
- Химический реактив
- В рифовом аквариуме хобби для добавления биодоступного кальция в раствор для потребляющих кальций животных, таких как водоросли, улитки, жесткие трубчатые черви и кораллы (часто называемая смесью Кальквассера)
- В кожевенной промышленности для нейтрализации лишней кислоты
- В нефтеперерабатывающей промышленности для производства присадок к маслам (саликатическим, сульфатным, фенатическим).
- В химической промышленности для производства стеарата кальция.
- В пищевой промышленности для обработки воды (для алкогольных и безалкогольных напитков)
- Для очистки рассола от карбонатов кальция и магния при производстве пищевой соли и фармакопеи.
- В кулинарии коренных американцев и латиноамериканцев гидроксид кальция называется «кал».Кукуруза, приготовленная с кальцием, становится никстамалом, что значительно увеличивает ее пищевую ценность, а также считается более вкусной и легкой для переваривания.
- При жевании орехов бетеля или листьев коки гидроксид кальция обычно жуют вместе, чтобы химические стимуляторы алкалоидов оставались доступными для усвоения организмом.
- Наполнитель
- В нефтехимической промышленности для производства солидола различных марок.
- При производстве тормозных колодок
- При производстве эбонита
- Для приготовления сухих смесей для отделочных работ.
- При производстве смесей для пестицидов
- В производстве препарата «Поликар» для борьбы с гнилью (грибковой) фруктов и овощей при хранении.
- Повязка в виде пасты, используемая для антимикробного эффекта во время процедуры лечения корневых каналов зубов.[1]
Риски для здоровья
Передозировка гидроксида кальция может иметь опасные симптомы, в том числе:
- Затруднение дыхания [ ссылка ]
- Внутреннее кровотечение [ цитата ]
- Гипотония [ ссылка ]
- Паралич скелетных мышц, вмешательство в актиновую систему.
- Повышение pH крови, разрушающее внутренние органы. Температура, при которой давление паров H 2 O достигает 101 кПа, Halstead, Moore, J.Chem.Soc (1957) 3873
Оксид кальция — обзор
ПАРАМЕТР ЕДИНИЦА ЗНАЧЕНИЕ ОБЩАЯ ИНФОРМАЦИЯ Имя EC # — 215–138–9 Общее название известь Общий синоним негашеная известь Химическая категория — металл -содержащее соединение Тип продукта — 2,3 Молекулярная формула CaO Молекулярная масса дальтон 56.08 Смесь — N Номер RTECS — EW3100000 Содержание мас.% 96+ Используется в США — Y Используется в Европе — Y ФИЗИЧЕСКИЕ СВОЙСТВА Состояние — твердый Запах — без запаха Цвет —белый Точка кипения ° C 2850 Точка замерзания ° C 2614 Плотность кг л -1 3.3 Температура плотности ° C 25 Показатель преломления при 20 ° C — 1,83 pH — 12,5–12,8 Растворимость в воде при 25 ° C мг кг -1 растворимый ЗДОРОВЬЕ И БЕЗОПАСНОСТЬ Классификация NFPA Воспламеняемость 0 Здоровье 3 43Реакционная способность 0 Классификация HMIS Горючесть 0 Здоровье 3 Реакционная способность 0 Класс DOT не опасные грузы / Класс IATA, группа упаковки не опасные товары Класс опасности ООН / NA — 8 Группа упаковки ООН — III Правильное отгрузочное наименование Оксид кальция Канцерогенность IARC — N Канцерогенность NTP — N Канцерогенность OSHA — N Путь проникновения Inh, Ing, Skin, Eye Первая помощь: глаза Тщательно промыть запить большим количеством воды не менее 15 минут и проконсультироваться с врачом.Продолжайте промывать глаза во время транспортировки в больницу. Первая помощь: кожа Смыть большим количеством воды с мылом. Проконсультируйтесь с врачом. Первая помощь: при вдыхании При вдыхании вывести человека на свежий воздух. Если нет дыхания проведите искусственную вентиляцию легких. Проконсультируйтесь с врачом. Пороговое предельное значение — TWA 8h, ACGIH мг м −3 2 Пороговое предельное значение — TWA 8h, NIOSH мг · м −3 2 Предельное пороговое значение — TWA 8h, OSHA мг · м −3 5 Номер ООН — 1910 Фразы риска ООН, R 34,41 США фразы безопасности, S 26,36 / 37 / 39,45,25,39 ИСПОЛЬЗОВАНИЕ И ЭФФЕКТИВНОСТЬ Производитель Andaluza de cales, Asvestopoiia Synergies, Aumale Cal de Castilla, Cal Industrial, Calcidrata — Industrias de Cal, Calcidrata, Calcis Lienen, Calcis Warstein, Calcisernia, Calero de Alzo, Cales de la Plana, Calles de Llierca, Cales de Pachs, Calgov, CaO Hellas Makedoniki Asvest opoiia, CaO Hellas Thessaliki Asvestopoiia, Carmeuse Chaux, Carmeuse Czech Republic, Carmeuse Holding, Cartmeuse Hungaria, Carmeuse Netherland, Carmeuse Research and Technology, Carmeuse, Carmeuse Slovakia, Carrières & Chaux Balthazard & Cotte, Carrières & Fours deugnya Boran, Chaux de Bretagne, Chaux de la Tour, Chaux de Provence, Chaux et Dolomies du Boulonnais, Clogrennane Lime, Dolomitas del Norte, Domiki P.Pavlides, Dumont Wautier, ECL, Ernstbrunner Kalktechnik, Etablissement Leon Lhoist, Fassa, Faxe, Fels-Werke, Fornaci Calce Grigolin, Hans G. Hauri KG Mineralstoffwerke, Heidelberg Cement, Hermann Trollius, Italcalce K., J. Berkosg. Nestal, Kalproduktion Storugns, Kalkwerk Hufgard, Kalkwerke Meister, Kalkwerke Oetelshofen, Kalkwerke Otto Breckweg, Kotouc Stramberk, Lafarge Tarmac Trading, Leone La Ferla, Lhoist Bukowa, Lhoist France, Lhoist France, Lhoist France Ouestr, Lhoist France Ouest, Lhoist France Ouest, de Cal e Derivados, Minermix, Moccia Industria, Nikolaus Müller Kalkwerk und Natursteinwerke, Nordkalk, Ostrauer Kalkwerke, Paraschou Bros, Positive Impact Waste Solutions, Rheinkalk, S.Doukeri, Schaeffer Kalk, Schretter & Cie, See Bruyeres & Fils, Singleton Birch, SMA Mineral, SMA Mineral Burgas Var, SMA Mineral Oy, Societe Bocahut, Société des Fours à Chaux de Sorcy, Trzuskawica, Unicalce, V. Devetzápenka Č schody, Vápenka Vitosov, Velestino Lime, Verdalskalk, Villaga Calce, Voestalpine Stahl, Volos Lime K. Papadopoulos & Sons, Walhalla Kalk, Wietersdorfer & Peggauer Zementwerke, Wolfgang Endress Kalk- und Schotterwerk, Wopitenscheustfinger.Tsaroucha & SIA, Zakłady Wapiennicze Lhoist, Zement- und Kalkwerke Otterbein, Zementwerk Leube
ГИДРОКСИД КАЛЬЦИЯ | CAMEO Chemicals
Химический лист данных
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названияХимические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз Знаки опасности Министерства транспорта США и общие описание химического вещества.Информация в CAMEO Chemicals поступает из множества источники данных.NFPA 704
данные недоступны
Общее описание
Гранулы белого цвета без запаха. Тонет в воде. (USCG, 1999)
Опасности
Оповещения о реактивности
Реакции воздуха и воды
Вода. Количество тепла, выделяемого при гидролизе, может быть большим.
Пожарная опасность
Нет доступной информации.
Опасность для здоровья
Пыль раздражает глаза, нос и горло. (USCG, 1999)
Профиль реактивности
Нитропарафины, нитрометан, нитропропан и т. Д. Образуют соли с неорганическими основаниями, такими как ГИДРОКСИД КАЛЬЦИЯ. Сухие соли взрывоопасны [Chem. Англ. news 30: 2344 1952]. Основания химически подобны гидроксиду натрия (NaOH) или оксиду натрия (Na2O). Они экзотермически нейтрализуют кислоты с образованием солей и воды. Когда они растворяются в воде, они дают растворы с pH более 7.0. Смешивание этих материалов с водой может вызвать неприятное количество тепла, поскольку основа растворяется или разбавляется. Основания реагируют с некоторыми металлами (такими как алюминий и цинк) с образованием оксидов или гидроксидов металла и образования газообразного водорода. Основания могут инициировать реакции полимеризации в полимеризуемых органических соединениях, особенно в эпоксидах). Они могут выделять легковоспламеняющиеся и / или токсичные газы с солями аммония, нитридами, галогенированными органическими веществами, различными металлами, пероксидами и гидропероксидами.Материалы этой группы часто служат катализаторами. Прочная база. Образует щелочной раствор в воде [Merck, 11-е изд. 1989].
Принадлежит к следующей реактивной группе (группам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь.В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Нет доступной информации.
Пожарная
Нет доступной информации.
Non-Fire Response
Нет доступной информации.
Защитная одежда
Кожа: Носите соответствующую личную защитную одежду для предотвращения контакта с кожей.Глаза: Используйте соответствующие средства защиты глаз, чтобы избежать контакта с глазами.
Промыть кожу: Рабочий должен немедленно промыть кожу, если она загрязнится. Рабочий должен мыться ежедневно в конце каждой рабочей смены.
Удаление: Намокшую или сильно загрязненную рабочую одежду следует снять и заменить.
Изменение: Рабочие, чья одежда могла быть загрязнена, должны переодеться в незагрязненную одежду перед тем, как покинуть рабочее место.
Предоставить: Фонтаны для промывки глаз должны быть предусмотрены в местах, где есть вероятность контакта рабочих с веществом; это независимо от рекомендаций, связанных с ношением средств защиты глаз.В непосредственной рабочей зоне должны быть предусмотрены средства для быстрого обмачивания тела для экстренного использования, где есть вероятность воздействия. [Примечание: предполагается, что эти устройства обеспечивают достаточное количество или поток воды для быстрого удаления вещества из любых участков тела, которые могут подвергнуться воздействию. Фактическое определение того, что представляет собой адекватное средство быстрого слива, зависит от конкретных обстоятельств. В некоторых случаях должен быть легко доступен дренчерный душ, тогда как в других наличие воды из раковины или шланга можно считать достаточным.] (NIOSH, 2016)
Ткани для костюмов DuPont Tychem®
Нет доступной информации.
Первая помощь
Глаза: При попадании этого химического вещества в глаза немедленно промойте глаза большим количеством воды, иногда приподнимая нижнее и верхнее веко. Немедленно обратитесь за медицинской помощью. Контактные линзы нельзя носить при работе с этим химическим веществом.Кожа: При попадании этого химического вещества на кожу немедленно промойте загрязненную кожу водой с мылом.Если это химическое вещество проникает в одежду, немедленно снимите одежду и промойте кожу водой. Если раздражение не исчезнет после мытья, обратитесь за медицинской помощью.
Дыхание: Если человек вдыхает большое количество этого химического вещества, немедленно выведите пострадавшего на свежий воздух. Если дыхание остановилось, выполните реанимацию «рот в рот». Держите пострадавшего в тепле и покое. Как можно скорее обратитесь за медицинской помощью.
Проглатывание: Если это химическое вещество было проглочено, немедленно обратитесь за медицинской помощью.(NIOSH, 2016)
Физические свойства
Химическая формула: Точка воспламенения: данные недоступны
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: Не горючий (USCG, 1999)
Температура плавления: 1076 ° F (Разлагается) (Теряет h3O) (NIOSH, 2016)
Давление газа: 0 мм рт. (приблизительно) (NIOSH, 2016)
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес: 2.24 при 68 ° F (USCG, 1999)
Точка кипения: Разлагается (NIOSH, 2016)
Молекулярный вес: 74,09 (USCG, 1999)
Растворимость воды: 0,2% при 32 ° F (NIOSH, 2016)
Потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендуемые уровни острого воздействия)
Нет доступной информации AEGL.ERPG (Руководство по планированию действий в чрезвычайных ситуациях)
Нет доступной информации по ERPG.PAC (Критерии защитного действия)
Химическая промышленность PAC-1 PAC-2 PAC-3 Гидроксид кальция (1305-62-0) 15 мг / м3 240 мг / м3 1500 мг / м3 (DOE, 2016)
Нормативная информация
В Поля нормативной информации включать информацию из U.S. Сводный список раздела III Агентства по охране окружающей среды Списки, химический объект Министерства внутренней безопасности США Стандарты борьбы с терроризмом, и Управления по охране труда и здоровья США Стандартный список управления производственной безопасностью особо опасных химических веществ (подробнее об этих источники данных).Сводный список списков Агентства по охране окружающей среды
Нет нормативной информации.Стандарты по борьбе с терроризмом для химических объектов DHS (CFATS)
Нет нормативной информации.Список стандартов управления безопасностью процессов (PSM) OSHA
Нет нормативной информации.Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества, включая торговые наименования и синонимы.
- ГИДРАТ КАЛЬЦИЯ
- ГИДРОКСИД КАЛЬЦИЯ
- КАУСТИЧЕСКАЯ ИЗВЕСТЬ
- УВЛАЖНЕННАЯ ИЗВЕСТЬ
- ИЗВЕСТЬ ГЛАЖЕННАЯ





 MgCO₃) — результат частичной или полной доломитизации карбоната кальция.
MgCO₃) — результат частичной или полной доломитизации карбоната кальция.  Каолин, известный также как каолинит или китайская глина, представляет собой слоистый силикат окиси алюминия, образованный вследствие химического выветривания таких алюмосиликатов, как полевой шпат; обладает низкой способностью к сжатию-разбуханию и низкой емкостью катионного обмена (ЕКО).
Каолин, известный также как каолинит или китайская глина, представляет собой слоистый силикат окиси алюминия, образованный вследствие химического выветривания таких алюмосиликатов, как полевой шпат; обладает низкой способностью к сжатию-разбуханию и низкой емкостью катионного обмена (ЕКО).


 реакцию №2
реакцию №2 Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты: Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния: Взаимодействуют с кислотными оксидами с образованием соли.
Взаимодействуют с кислотными оксидами с образованием соли. Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.