Упражнение: 1 Что означают записи: 3Н; 2Н2О; 5О2? 3Н – 3 атома водорода; Упражнение: 3 Используя рисунок 6 (см. с.11), запишите формулы веществ и рассчитайте их относительные молекулярные массы. Кислород О2, Мr(O2) = 16 • 2 = 32 Угарный газ CO, Мr(CO) = 12 + 16 = 28. Упражнение: 5 Почему относительная атомная и относительная молекулярная массы не имеют единиц измерения?
Упражнение: 7 Вычислите массовые доли элементов в азотной кислоте HNO3 HNO3 | Упражнение: 2 Запишите формулу сахара, если известно, что в состав его молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода. С12Н22О11 Упражнение: 4 О какой форме существования химического элемента кислорода говорит каждая из следующих записей: 3О; 5О2; 4СО2? 3О — 3 атома. Свободные атомы. Упражнение: 6 В каком из веществ – SO2 или SO3 – массовая доля серы больше? Ответ подтвердите расчетами.
Упражнение: 8 Дайте полную характеристику глюкозы C6H12O6, используя пример описания СО2 (см. с. 36). 1. Конкретное вещество – глюкоза C6H12O6. 3. Тип вещества – сложное. 4. Количественный состав вещества – в молекуле содержится 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. 5. Относительная молекулярная масса — Mr(C6H12O6) = 12 • 6 + 1 • 12 + 16 • 6 = 180 6. Соотношение масс элементов в глюкозе: m(C) : m(H) : m(O) = 72 : 12 : 96 = 12 : 1 : 8 7. Массовые доли элементов в глюкозе: Mr(C6H12O6) = 12 • 6 + 1 • 12 + 16 • 6 = 180 ω(C) = n • Ar(C)/ Mr (C6H12O6) = 12 • 6 / 180 = 0,04 или 40% ω(H) = n • Ar(H)/ Mr(C6H12O6) = 1 • 12 / 180 = 0,067 или 6,7% ω(O) = n • Ar(O)/ Mr(C6H12O6) = 16 • 6 / 180 = 0,533 или 53,3% 40 + 6,7 + 53,3 = 100% |
Единицы измерения, подготовка к ЕГЭ по химии
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества. В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) + Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 10
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 10 23 молекул воды и 12.04 × 1023 атомов углерода.
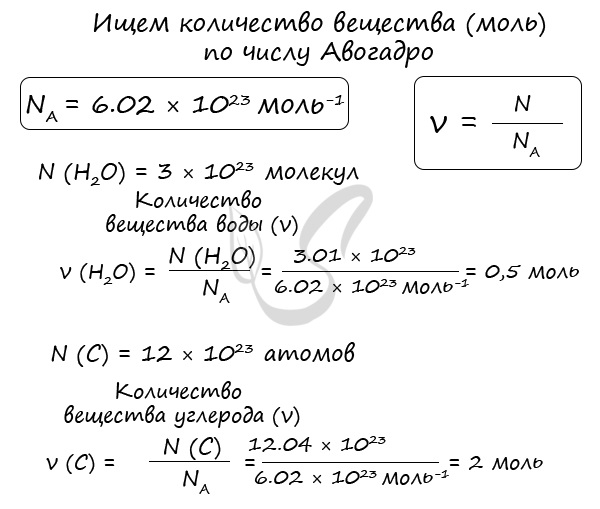
Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул), молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции. Сейчас мы определим количество вещества (моль) 70 грамм N 2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества. Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом 33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 🙂

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере. Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки, если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Урок 5. Химическая формула – HIMI4KA
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.


Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:


и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
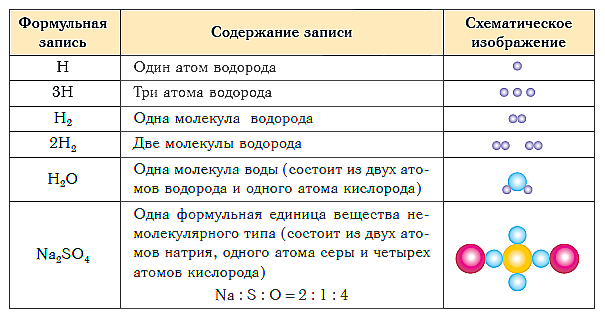

Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Кто разбирается в ХИМИИ? Что означают записи? 3н , 2н2о , 5о2
учебник открой!!!
3 атома водорода, это первое =дальше сама
3Н=3 атома водорода, 2Н2О=2 атома водорода и 2 кислородатоесть воды, а (5О) 2 только так пишется и будет 10 или 25 атомов кислорода.
<a rel=»nofollow» href=»https://yandex.kz/» target=»_blank»>https://yandex.kz/</a>
touch.otvet.mail.ru
Что означает 2 в h3O? Именно цифра 2
2 атома водорода и 1 атом кислорода — химическая формула воды.
Это означает твою оценку по химии.
2 атомо водорода и 1 атом кислорода
это индекс. Она показывает число атомов в формуле. В данном случае означает 2 атома водорода (Н) а у кислорода (О) нету индекса это означает что у него 1 атом
Молекула воды состоит из 3 атомов, из них 2 обозначает количество атомов водорода и 1 атом кислорода. Эти цифры называются индекс и обозначают количество атомов в молекуле
2 атома водорода.
H-ЭТО КИСЛОРОД! 2O-ЭТО ВОДОРОД!!! ГЛУПЫЕ
touch.otvet.mail.ru
Что означают записи 3H, 2h3O, 5O2 и какую информацию получают с их помощью
Тем, кто только начинает знакомиться с химией и присущими ей видами обозначения различных веществ и уравнений, необходимо знать определенные правила, применяемые в международной практике. Следующие примеры помогут разобраться, что означают записи 3H, 2h3O, 5O2 и какую информацию получают из данного набора цифр и букв.
Числа в выражениях и их возможные виды
Если читать выражения слева направо, то первыми всегда записываются так называемые коэффициенты. Эти показатели характеризуют количество частиц или вещества (атомов, молекул, ионов, моль), участвующих в реакции. Коэффициенты принято записывать арабскими цифрами: обычно это все положительные натуральные числа (1, 2, 3…), если только речь не идет об эквивалентах, где они могут записываться как дробные (1/2, 1/3, 1/4…).
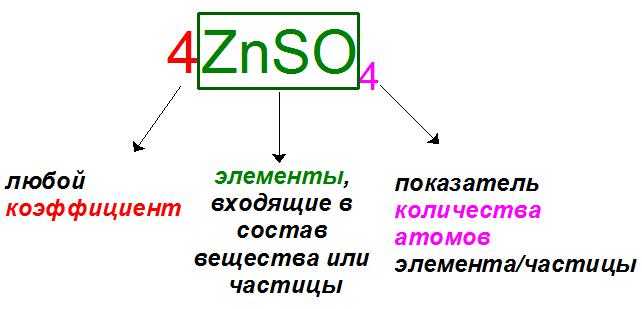
Например, цифры в записях 3H, 2h3O и 5O2 в химии означают, что нам даны 3 атома водорода H, 2 и 5 молекул воды H2O и газообразного кислорода O2 соответственно. Следует обратить внимание, что первый пример является неверным, так как атомарный H в природе не существует, а присутствует только в виде молекулы H2 или же в растворе в качестве положительно заряженного иона H+.
Если в уравнении частица или вещество участвует в единственном числе, например ион хлора 1Cl— или молекула серной кислоты 1H2SO4, коэффициент «1» опускают и записывают без него: Cl— и H2SO4.
В случае записи уравнений в общем виде, характерном для реакции полимеризации, поликонденсации, электролиза и других химических взаимодействий, в условиях задачи могут использовать буквенные обозначения количества частиц или веществ, вроде n или x, y, z . Коэффициент n обычно обозначает любое натуральное число, он обязательно должен присутствовать в обеих частях уравнения (пример 1), а любые другие буквы английского алфавита обозначают неизвестные, которые необходимо найти по условию задачи (пример 2).
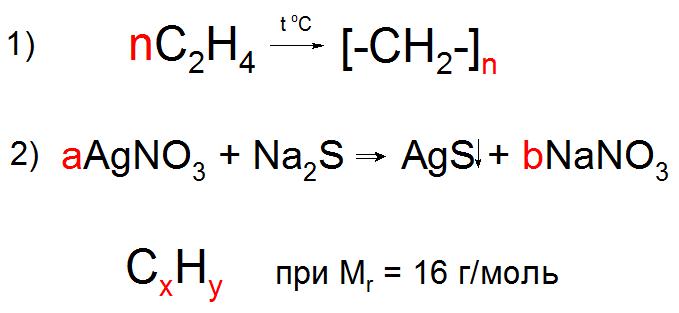
Буквенные выражения и их информативность
Символы английского алфавита в записях 3H, 2h3O и 5O2 означают, что в веществах содержатся определенные химические элементы, а также их соединения. Такую запись без цифр спереди называют химической формулой. Так, записи 3H+, 2h3O и 5O2 означают, что, допустим, в реакции участвуют 3 иона водорода, 2 и 5 молекул воды и кислорода соответственно. Но такого рода выражения также могут быть указаны в тексте и в обособленном от уравнений виде в качестве описания реагентов или продуктов реакции.
Подстрочные символы и их обозначения
В состав веществ может входить множество атомов отдельно взятых элементов, а также сами соединения иметь повторяющиеся звенья в зависимости от их природы и структуры. Для указания количества тех или иных частиц используются подстрочные цифры или буквы, имеющие тот же характер обозначения, что и основные коэффициенты. Например, нижние числа в записях 3H+, 2h3O и 5O2 означают, что подобные символы могут быть только в комплексных ионах типа [Cu(NH3)4]2+, а в молекулах таких веществ, как вода и кислород, содержатся по 2 атома водорода и кислорода.
Буквы применяют в подстрочных символах в качестве обозначений некоторого количества атомов или звеньев (n), а также неизвестного количества атомов в соединениях при составлении задач (a, b, x, y).
fb.ru
h3 — это… Что такое h3?
h3 — открытая кроссплатформенная СУБД полностью написанная на языке Java.
Несмотря на малый размер (чуть более 1 МБ) h3 поддерживает следующие возможности «из коробки»:
- Два режима работы(клиент-сервер, встроенный)
- Два режима хранения данных(файловая система, память)
- Поддержка планов выполнения запросов
- Поддержка кластеризации и репликации
- Шифрование данных
- Внешние(связанные) таблицы
- Драйвер ODBC
- Полнотекстовый поиск
- Определение доменов
- Мультиверсионный конкурентный доступ
- Поддержка последовательностей
- Поддержка ключевых слов LIMIT и OFFSET в запросах
- Временные таблицы
- Вычисляемые столбцы
- Пользовательские агрегатные функции
- Пользовательские хранимые процедуры
- Сжатие CLOB/BLOB объектов
- Работа с CSV файлами на чтение и запись
- Браузерная консоль управления
- Запуск как сервис Windows
Что ещё не реализовано
- Оконные функции(реализована только функция ROW_NUMBER() OVER())
- Многопоточная обработка запросов
- Полная поддержка стандарта SQL 2003
Применяется h3, например, в проекте Grails как базовая СУБД для разработки.
История создания
Разработка h3 началась в мае 2004 года, первый релиз состоялся в 14 декабря 2005 года. Главным разработчиком является Томас Мюллер, один из разработчиков Hypersonic SQL (HSQLDB). Сокращение h3 означает Hypersonic 2 однако h3 не использует код HSQLDB и была написано заново.
Почему выбрана платформа Java
- Легкая интеграция с Java приложениями
- Кроссплатформенность
- Большая защищенность, чем у нативных приложений
- Пользовательские функции и триггеры работают очень быстро
- Поддержка Юникода
Сравнения с существующими СУБД
На сайте h3 расположены результаты сравнения тестов производительности h3 и некоторых других популярных СУБД (в частности HSQLDB, PostgreSQL и MySQL), в которых указано, что h3 в целом более производительна, чем указанные СУБД. Сравнения с коммерческими СУБД (Oracle, DB2, MSSQL) не проводились ввиду ограничений наложенных лицензиями на эти продукты.
Планируемые нововведения
- Улучшение производительности
- Серверные курсоры
Новые версии
Над СУБД продолжается активная работа, новые версии выпускаются практически каждый месяц.
Примечания
Весьма примечателен факт того, что несмотря на богатую функциональность при разработке СУБД не используются сторонние библиотеки. Весь необходимый функционал реализован разработчиками самостоятельно с целью облегчения развертывания приложения. Фактически вся СУБД умещается в файле размером 1 МБ, а весь архив включая примеры и исходный код в 5 МБ (для сравнения дистрибутив СУБД Oracle 11g для Microsoft Windows занимает 1,7 ГБ)
Ссылки
med.academic.ru