Планетарная модель атома — это… Что такое Планетарная модель атома?
 | В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 6 мая 2012. |
Планетарная модель атома, или модель Резерфорда, — историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеянием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, — подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10-10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
dic.academic.ru
Планетарная модель атома – ответы на главные вопросы
А вслед за боровской моделью атома появился принцип неопределенности Гейзенберга, который наконец объяснял, почему падение электрона на ядро невозможно. Гейзенберг обнаружил, что в возбужденном атоме электрон находится на дальних орбитах, а в момент, когда он излучает фотон, он падает на основную орбиту, потеряв свою энергию. Атом же переходит в устойчивое состояние, при котором электрон будет вращаться вокруг ядра до тех пор, пока его ничто не возбуждает снаружи. Это стабильное состояние, дальше которого электрон падать не будет.
Благодаря тому, что основное состояние атома — это устойчивое состояние, материя существует, мы все существуем. Без квантовой механики у нас вообще не было бы устойчивой материи. В этом смысле основной вопрос, который неспециалист может задать квантовой механике, — это почему все вообще не падает? Почему все вещество не собирается в точку? И квантовая механика способна ответить на этот вопрос.
Зачем это знать? В некотором смысле эксперимент Резерфорда повторился снова при открытии кварков. Резерфорд открыл, что положительные заряды — протоны — сосредоточены в ядрах. А что внутри протонов? Теперь мы знаем, что внутри протонов находятся кварки. Мы узнали это, проведя аналогичный эксперимент по глубокому неупругому рассеянию электронов на протонах в 1967 году в SLAC (Национальной ускорительной лаборатории, США).
Этот эксперимент проводился по тому же принципу, что и эксперимент Резерфорда. Тогда падали альфа-частицы, а здесь электроны падали на протоны. В результате столкновения протоны могут оставаться протонами, а могут возбудиться из-за большой энергии, и тогда при рассеянии протонов могут рождаться другие частицы, например пи-мезоны. Выяснилось, что это сечение ведет себя так, как будто внутри протонов есть точечные составляющие. Сейчас мы знаем, что эти точечные составляющие — кварки. В каком-то смысле это был опыт Резерфорда, но уже на следующем уровне. С 1967 года мы уже имеем кварковую модель. Но что будет дальше, мы не знаем. Теперь нужно что-то рассеивать на кварках и смотреть, на что они развалятся. Но это следующий шаг, пока это сделать не удается.
postnauka.ru
5.2.1 Планетарная модель атома
Видеоурок: Физика атома и атомного ядра
Лекция: Планетарная модель атома
 Строение атома
Строение атома
Наиболее точный способ определения структуры любого вещества — это спектральный анализ. Излучение у каждого атома элемента исключительно индивидуальное. Однако, прежде, чем понять, каким образом происходит спектральный анализ, разберемся, какую структуру имеет атом любого элемента.
Первое предположение о строении атома было представлено Дж. Томсоном. Этот ученый длительное время занимался изучением атомов. Более того, именно ему принадлежит открытие электрона — за что он и получил Нобелевскую премию. Модель, что предложил Томсон, не имела ничего общего с действительностью, однако послужила достаточно сильным стимулом в изучении строения атома Резерфордом. Модель, предложенная Томсоном, называлась «пудингом с изюмом».

Томсон считал, что атом является сплошным шаром, имеющим отрицательный электрический заряд. Для его компенсации в шар вкраплены электроны, как изюминки. В сумме заряд электронов совпадает с зарядом всего ядра, что делает атом нейтральным.
ВО время изучения строения атома выяснили, что все атомы в твердых телах совершают колебательные движения. А, как известно, любая двигающаяся частица излучает волны. Именно поэтому каждый атом имеет свой собственный спектр. Однако данные утверждения никак не вкладывались в модель Томсона.
 Опыт Резерфорда
Опыт Резерфорда
Чтобы подтвердить или опровергнуть модель Томсона, Резерфордом был предложен опыт, в результате которого происходила бомбардировка атома некоторого элемента альфа-частицами. В результате данного эксперимента было важно увидеть, как будет вести себя частица.
Альфа частицы были открыты в результате радиоактивного распада радия. Их потоки представляли собой альфа-лучи, каждая частица которых имела положительный заряд. В результате многочисленных изучений было определено, что альфа-частица походит на атом гелия, в котором отсутствуют электроны. Используя нынешние знания, мы знаем, что альфа частица — это ядро гелия, в то время Резерфорд считал, что это были ионы гелия.
Каждая альфа-частица имела огромную энергию, в результате чего она могла лететь на рассматриваемые атомы с высокой скоростью. Поэтому основным результатом эксперимента являлось определение угла отклонения частицы.
Для проведения опыта Резерфорд использовал тонкую фольгу из золота. На нее он направлял высокоскоростные альфа-частицы. Он предполагал, что в результате данного эксперимента все частицы будут пролетать сквозь фольгу, причем с небольшими отклонениями. Однако, чтобы выяснить это наверняка, он поручил своим ученикам проверить, нет ли больших отклонений у данных частиц.

Результат эксперимента удивил абсолютно всех, ведь очень многие частицы не просто отклонились на достаточно большой угол — некоторые углы отклонения достигали более 90 градусов.
Данные результаты удивили абсолютно всех, Резерфорд говорил, что такое чувство, будто на пути снарядов был поставлен листок бумаги, который не дал альфа-частице проникнуть во внутрь, в результате чего, она повернулась обратно.
Если бы атом действительно был сплошным, то он должен был иметь некоторое электрическое поле, которое затормаживало частицу. Однако, сила поля была недостаточной, чтобы остановить её полностью, а уж тем более отбросить обратно. А это значит, что модель Томсона была опровергнута. Поэтому Резерфорд начал работать над новой моделью.
 Модель Резерфорда
Модель РезерфордаЧтобы получить такой результат эксперимента, необходимо сосредоточить положительный заряд в меньшем размере, в результате чего получится большее электрическое поле. По формуле потенциала поля можно определить необходимый размер положительной частицы, которая смогла бы оттолкнуть альфа-частицу в противоположном направлении. Радиус её должен быть порядка максимум 10-15 м. Именно поэтому Резерфорд предложил планетарную модель атома.

Данная модель названа так неспроста. Дело в том, что внутри атома имеется положительно заряженное ядро, подобное Солнцу в Солнечной системе. Вокруг ядра, как планеты вращаются электроны. Солнечная система устроена таким образом, что планеты притягиваются к Солнцу с помощью гравитационных сил, однако, они не падают на поверхность Солнца в результате имеющейся скорости, которая держит их на своей орбите. То же самое происходит и с электронами — кулоновские силы притягивают электроны к ядру, но за счет вращения они не падают на поверхность ядра.
Одно предположение Томсона оказалось абсолютно верно — суммарный заряд электронов соответствует заряду ядра. Однако в результате сильного взаимодействия электроны могут быть выбиты со своей орбиты, в результате чего заряд не компенсируется и атом превращается в положительно заряженный ион.
Очень важной информации относительно строения атома является то, что практически вся масса атома сосредоточена в ядре. Например, у атома водорода имеется всего один электрон, чья масса более, чем в полторы тысячи раз меньше, чем масса ядра.
cknow.ru
Конспект «Опыты Резерфорда. Планетарная модель атома»
Опыты Резерфорда. Планетарная модель атома
Раздел ОГЭ по физике: 4.2. Опыты Резерфорда по рассеянию альфа-частиц. Планетарная модель атома.
Первую модель строения атома предложил Джозеф Джон Томсон, после того как он открыл электрон — частицу с наименьшим электрическим зарядом. Он представлял атом в виде шара из положительно заряженного вещества, в который вкраплены электроны. При этом положительный заряд шара равен суммарному заряду электронов. Модель атома Томсона называют «пудингом с изюмом». Используя эту модель, можно было объяснить электрическую проводимость веществ, явление электризации тел и др.
Проводя опыты по изучению строения вещества, Резерфорд показал несостоятельность модели Томсона. Резерфорд облучал тонкую металлическую фольгу α-частицами, имеющими большую энергию. В соответствии с моделью Томсона а-частицы должны были отражаться от атома. Однако очень небольшое число частиц рассеивалось на углы от 90° до 180°. Большинство частиц проходило через фольгу, отклоняясь от направления движения на незначительные углы.

В результате экспериментов Резерфорд предложил новую модель строения атома, названную планетарной моделью. Он сделал следующие выводы:
- в атоме существует положительно заряженная частица, названная ядром атома, которая отталкивает α-частицы;
- размеры ядра малы по сравнению с размерами атома, поскольку отталкивается очень небольшое число α-частиц, а большинство α-частиц свободно проходит через фольгу; ядро имеет диаметр порядка 10–14 — 10–15 м.
- масса ядра сравнима с массой β-частицы, поскольку масса электронов в 8000 раз меньше массы а-частицы и электроны не смогли бы изменить направление её движения.
Таким образом, в соответствии с моделью атома Резерфорда в центре атома расположено положительное ядро, вокруг которого движутся отрицательно заряженные электроны. Поскольку масса электронов мала, то масса атома в основном сосредоточена в ядре.
Так как атом в целом нейтрален, то положительный заряд ядра должен быть равен суммарному заряду электронов. Число электронов в нейтральном атоме равно порядковому номеру Z элемента в периодической системе Д.И. Менделеева. Заряд атомного ядра qR равен произведению Z и заряда электрона е: qR= Z • е.
Конспект урока «Опыты Резерфорда. Планетарная модель атома».
Следующая тема: «Состав атомного ядра. Изотопы».
uchitel.pro
Планетарна модель атома — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
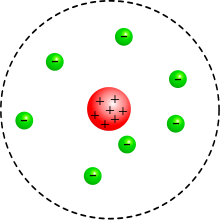 Схематичне зображення будови атома в планетарній моделі
Схематичне зображення будови атома в планетарній моделіПланетарна модель атома або модель Резерфорда — історична модель будови атома, яку запропонував Ернест Резерфорд внаслідок експерименту з розсіяння альфа-частинок. За цією моделлю атом складається із невеликого додатньо зарядженого ядра, в якому зосереджена майже вся маса атома, навколо якого рухаються електрони, подібно до того, як планети рухаються навколо Сонця. Планетарна модель атома відповідає сучасним уявленням про будову атома з врахуванням того, що рух електронів має квантовий характер і не описується законами класичної механіки.
Історично планетарна модель Резерфорда прийшла на заміну «моделі сливового пудинга» Джозефа Джона Томсона, яка постулювала, що від’ємно заряджені електрони поміщені усередину додатньо зарядженого атома.
Нову модель будови атома Резерфорд запропонував 1911 року, як висновок із експеримету з розсіяння альфа-частинок на золотій фользі, проведеного під його керівництвом. При цьому розсіянні несподівано велика кількість альфа-частинок розсіювалася на великі кути, що свідчило про те, що центр розсіяння має невеликі розміри й в ньому зосереджений значний електричний заряд. Розрахунки Резерфорда показали, що розсіювальний центр, заряджений додатньо або від’ємно, повинен бути принаймні у 3000 разів менший від розміру атома, який на той час уже був відомий і оцінювався як, приблизно, 10-10 м. Оскільки на той час електрони вже були відомі, а їхня маса й заряд визначені, то розсіювальний центр, який пізніше назвали ядром, повинен був мати протилежний до електронів заряд. Резерфорд не пов’язав величину заряду з атомним номером. Цей висновок був зроблений пізніше. А сам Резерфорд припустив, що заряд пропорційний атомній масі.
Недоліком планетарної моделі була її несумісність із законами класичної фізики. Якщо електрони рухаються навколо ядра як планети навколо Сонця, то їхній рух прискорений, і, отже, за законами класичної електродинаміки вони повинні були б випромінювати електромагнітні хвилі, втрачати енергію й падати на ядро. Наступним кроком у розвитку планетарної моделі стала модель Бора, що постулювала інші, відмінні від класичних, закони руху електронів. Повністю протиріччя з електродинамікою змогла розв’язати квантова механіка.
- Білий М.У. (1973). Атомна фізика. Київ: Вища школа.
uk.wikipedia.org
Планетарная модель атома Википедия
Планетарная модель атома: ядро (красное) и электроны (зелёные)Планета́рная моде́ль а́тома, или модель атома Резерфо́рда, — исторически важная модель строения атома, предложенная Эрнестом Резерфордом в классической статье[1], опубликованной в 1911 г. на основании анализа и статистической обработки результатов экспериментов по рассеиванию альфа-частиц в тонкой золотой фольге, выполненных Гейгером и Марсденом в 1909 г.
В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
Планетарная модель атома соответствует современным представлениям о строении атома с уточнениями, что движение электронов не может быть описано законами классической механики и имеет квантовомеханическое описание.
Исторически планетарная модель Резерфорда пришла на смену «модели пудинга с изюмом» Томсона, которая предполагает, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома с распределённым по всему объёму атома положительным зарядом, подобно изюминкам в пудинге.
Предыстория
Схема модели атома Томсона. В модели Томсона «корпускулы» (электроны) расположены внутри облака положительного заряда, а не вокруг положительно заряженного ядра.К 1904 году японский физик Нагаока разработал раннюю, как оказалось впоследствии, ошибочную «планетарную модель» атома («атом типа Сатурна»)[2]. Модель была построена на аналогии с расчётами устойчивости колец Сатурна (кольца уравновешены из-за очень большой массы планеты). Модель Нагаоки была неверна, но два следствия из неё оказались пророческими:
Новую модель строения атома Резерфорд предложил в 1911 году на основе анализа экспериментов по рассеиванию альфа-частиц в золотой фольге, проведённых в 1909 г. под его руководством[1].
При этом рассеянии большое, неожиданно статистически необъяснимое, количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры, в нём сосредоточен значительный электрический заряд и масса атома.
Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10−10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд ядра пропорционален атомной массе. Связь электрического заряда ядра с атомным номером химического элемента установил Генри Мозли в экспериментах, выполненных в 1913 г.
Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов. Из классической электродинамики следует, что так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10−11 с.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора, постулирующая другие, отличные от классических законы орбитального движения электронов на основе волн де Бройля. Полностью противоречащие эксперименту выводы классической электродинамики смогло объяснить развитие квантовой механики.
Примечания
wikiredia.ru
Планетарная модель атома: опыт Резерфорда :: SYL.ru
Планетарную модель атома предложил Э. Резерфорд в 1910 году. Первые исследования структуры атома были сделаны им при помощи альфа-частиц. На основе результатов, полученных в экспериментах по их рассеянию, Резерфорд предположил, что весь положительный заряд атома сосредоточен в крошечном ядре в его центре. С другой стороны, отрицательно заряженные электроны распределены внутри всего остального его объема.
Немного предыстории
Первую гениальную догадку о существовании атомов сделал древнегреческий ученый Демокрит. С тех пор идея о существовании атомов, комбинации которых дают все окружающие нас вещества, не покидала воображения людей науки. Периодически к ней обращались различные ее представители, но до начала XIX века их построения были всего лишь гипотезами, не подкрепленными опытными данными.
Наконец, в 1804 году, более чем за сто лет до того как появилась планетарная модель атома, английский ученый Джон Дальтон представил доказательства его существования и ввел понятие атомного веса, явившееся его первой количественной характеристикой. Как и его предшественники, он представлял атомы мельчайшими частями материи, похожими на твердые шарики, которые не могут быть разделены на еще более мелкие частицы.
Открытие электрона и первая модель атома
Прошло почти целое столетие, когда, наконец, в конце XIX века также англичанин Дж. Дж. Томсон открыл первую субатомную частицу, отрицательно заряженный электрон. Поскольку атомы электрически нейтральны, Томсон думал, что они должны состоять из положительно заряженного ядра с электронами, разбросанными по его объему. Основываясь на различных результатах, полученных экспериментально, он в 1898 году предложил свою модель атома, иногда называемую «сливы в пудинге», потому что атом в ней представлялся в виде сферы, заполненной некоторой положительно заряженной жидкостью, в которую электроны были внедрены, как «сливы в пудинг». Радиус такой сферической модели был около 10-8 см. Общий положительный заряд жидкости симметрично и равномерно сбалансирован отрицательными зарядами электронов, как показано на рисунке ниже.

Эта модель удовлетворительно объясняла то обстоятельство, что при нагревании вещества оно начинает излучать свет. Хотя это была первая попытка понимания того, что же такое атом, она не смогла удовлетворить результатам экспериментов, выполненных позже Резерфордом и другими. Томсон в 1911 году согласился, что его модель просто не может ответить, как и почему происходит наблюдаемое в опытах рассеяние α-лучей. Поэтому она была оставлена, а на смену ей пришла более совершенная планетарная модель атома.
Как же все таки устроен атом?
Эрнест Резерфорд дал объяснение явления радиоактивности, которое принесло ему Нобелевскую премию, однако его наиболее значительный вклад в науку был сделан позднее, когда он установил, что атом состоит из плотного ядра, окруженного орбитами электронов, подобно тому, как Солнце окружено орбитами планет.
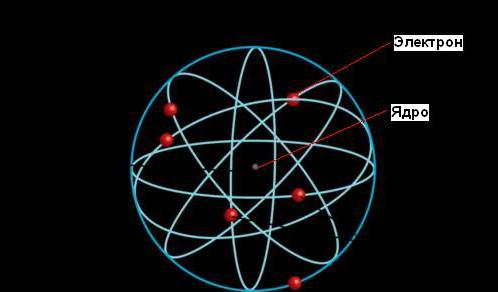
Согласно планетарной модели атома, большая часть его массы сконцентрирована в крошечном (по сравнению с размерами всего атома) ядре. Электроны двигаются вокруг ядра, путешествуя с невероятной скоростью, но большая часть объема атомов является при этом пустым пространством.
Размер ядра настолько мал, что его диаметр в 100 000 раз меньше, чем у атома. Диаметр ядра была оценен Резерфордом как 10-13 см, в отличие от размера атома — 10-8 см. За пределами ядра электроны вращаются вокруг него с высокими скоростями, в результате чего возникают центробежные силы, уравновешивающие электростатические силы притяжения между протонами и электронами.
Опыты Резерфорда
Планетарная модель атома возникла в 1911, после знаменитого эксперимента с золотой фольгой, позволившего получить некоторые фундаментальные сведения о его строении. Путь Резерфорда к открытию атомного ядра является хорошим примером роли творчества в науке. Его поиски начались еще в 1899 году, когда он обнаружил, что некоторые элементы испускают положительно заряженные частицы, которые могут проникать через что угодно. Он назвал эти частицы альфа (α) частицами (теперь мы знаем, что они были ядрами гелия). Как и все хорошие ученые, Резерфорд был любопытен. Он задавался вопросом, можно ли использовать альфа-частицы, чтобы узнать структуру атома. Резерфорд решил нацелить луч альфа-частиц на лист очень тонкой золотой фольги. Он выбрал золото, потому что из него можно получать листы толщиной всего 0,00004 см. За листом золотой фольги он поставил экран, который светился, когда альфа-частицы ударяли в него. Его использовали для обнаружения альфа-частиц после их прохождения через фольгу. Небольшая прорезь в экране позволяла лучу альфа-частиц достичь фольги после выхода из источника. Часть из них должна пройти сквозь фольгу и продолжать двигаться в том же направлении, другая их часть должна отскакивать от фольги и отражаться под острыми углами. Вы можете увидеть схему эксперимента на рисунке ниже.
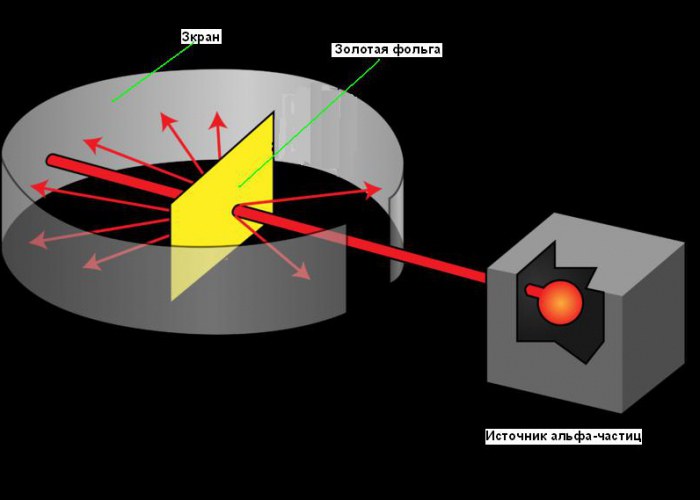
Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.
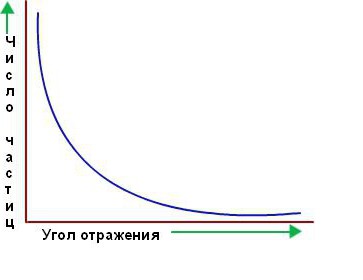
Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
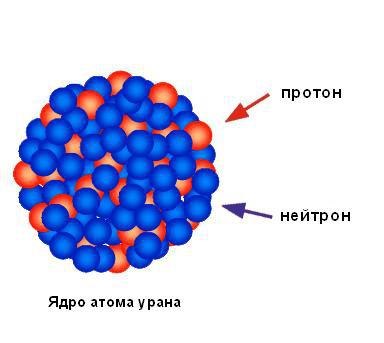
Ядро занимает центральное место
Исходя из ничтожного процента отразившихся от фольги альфа-частиц, можно сделать вывод, что весь положительный заряд и практически вся масса атома сосредоточены в одной маленькой области, а в остальной части атома в основном находится пустое пространство. Резерфорд назвал площадь концентрированного положительного заряда ядром. Он предсказал и вскоре обнаружил, что оно содержит положительно заряженные частицы, которые он назвал протонами. Резерфорд предсказал существование нейтральных атомных частиц, называемых нейтронами, но он не смог обнаружить их. Тем не менее его ученик Джеймс Чедвик открыл их через несколько лет. На рисунке ниже показана структура ядра атома урана.
Атомы состоят из положительно заряженных тяжелых ядер, окруженных вращающимися вокруг них отрицательно заряженными чрезвычайно легкими частицами-электронами, причем на таких скоростях, что механические центробежные силы просто балансируют их электростатическое притяжение к ядру, и в этой связи якобы обеспечивается стабильность атома.
Недостатки этой модели
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Кроме того, стабильность атома Резерфорда была возможна только при непрерывном движении электронов по орбитам без потерь кинетической энергии. Но электродинамические расчеты показали, что движение электронов по любым криволинейным траекториям, сопровождающееся изменением направления вектора скорости и появлением соответствующего ускорения, неизбежно сопровождается излучением электромагнитной энергии. При этом, согласно закону сохранения энергии, кинетическая энергия электрона должна очень быстро израсходоваться на излучение, и он должен упасть на ядро, как схематически показано на рисунке ниже.
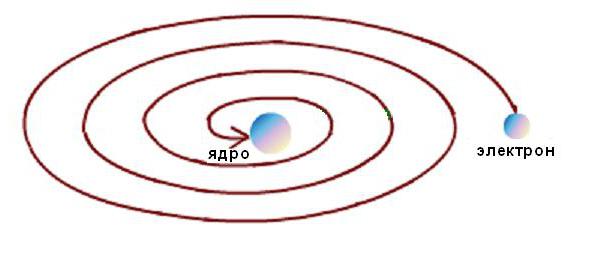 Но этого не происходит, так как атомы являются стабильными образованиями. Возникло типовое для науки противоречие между моделью явления и опытными данными.
Но этого не происходит, так как атомы являются стабильными образованиями. Возникло типовое для науки противоречие между моделью явления и опытными данными.От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике – физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Что же нового привнес Бор в модель атома?
Будучи еще молодым человеком, Бор работал в лаборатории Резерфорда в Англии. Поскольку в модели Резерфорда была слабо проработана концепция электронов, Бор сосредоточился именно на них. В результате была существенно доработана планетарная модель атома. Постулаты Бора, которые он сформулировал в своей статье «О строении атомов и молекул», вышедшей в 1913 году, гласят:
1. Электроны могут двигаться вокруг ядра только на фиксированных расстояниях от него, определяемых тем количеством энергии, которое у них есть. Он назвал эти фиксированные уровни энергетическими уровнями или электронными оболочками. Бор представлял их в виде концентрических сфер, с ядром в центре каждой из них. При этом электроны с меньшей энергией будут найдены на более низких уровнях, ближе к ядру. Те же из них, у кого больше энергии, будут найдены на более высоких уровнях, дальше от ядра.
2. Если электрон поглощает некоторое (вполне определенное для данного уровня) количество энергии, то он будет прыгать на следующий, более высокий энергетический уровень. И наоборот, если он потеряет такое же количество энергии, то вернется назад к исходному уровню. Однако электрон не может существовать на двух энергетических уровнях.
Эта идея иллюстрируются рисунком.
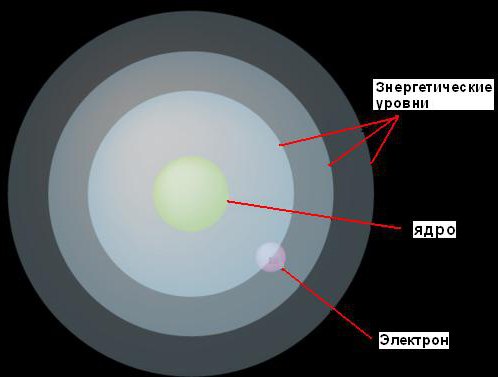
Энергетические порции для электронов
Модель атома Бора на самом деле является сочетанием двух различных идей: атомной модели Резерфорда с электронами, вращающимися вокруг ядра (по сути это планетарная модель атома Бора-Резерфорда), и идеи немецкого ученого Макса Планка о квантовании энергии вещества, опубликованной в 1901 году. A квант (во множественном числе — кванты) является минимальным количеством энергии, которая может быть поглощена или излучена веществом. Он является своего рода шагом дискретизации количества энергии.
Если энергию сравнить с водой и вы хотите добавить ее к материи в виде стакана, вы не можете просто залить воду непрерывной струей. Вместо этого вы можете добавить ее в небольших количествах, например, по чайной ложке. Бор считал, что если электроны могут поглощать или терять только фиксированные количества энергии, то они должны варьировать свою энергию только этими фиксированными количествами. Таким образом, они могут занимать только фиксированные энергетические уровни вокруг ядра, которые соответствуют квантованным приращениям их энергии.
Так из модели Бора вырастает квантовый подход к объяснению, что же из себя представляет строение атома. Планетарная модель и модель Бора явились своеобразными ступенями от классической физики к квантовой, являющейся основным инструментом в физике микромира, включая и атомную физику.
www.syl.ru