Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H2, O2, О3).
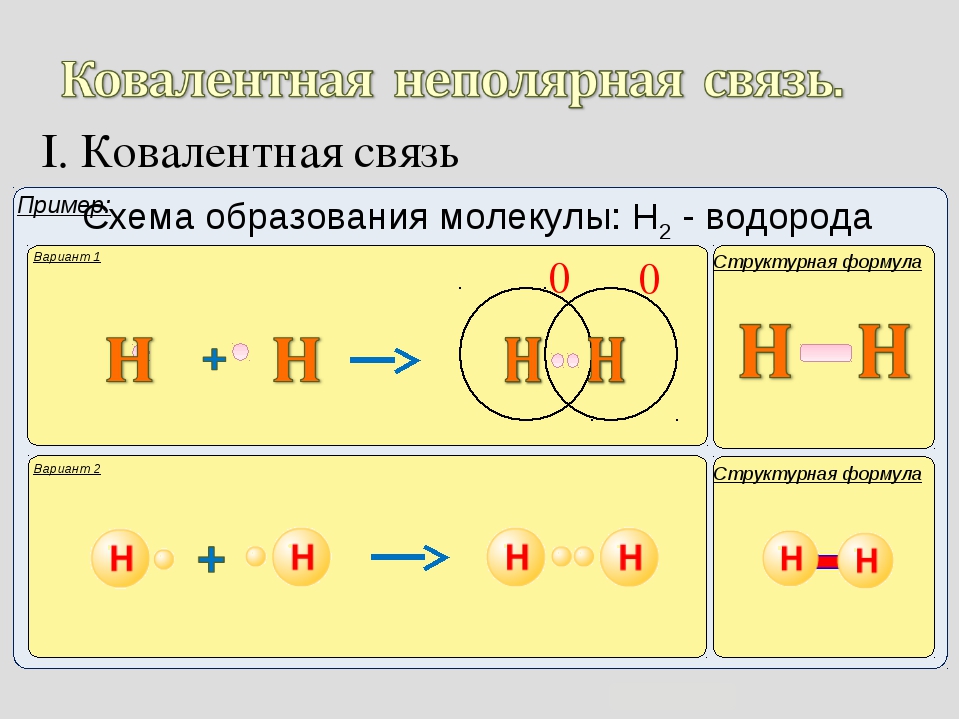
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
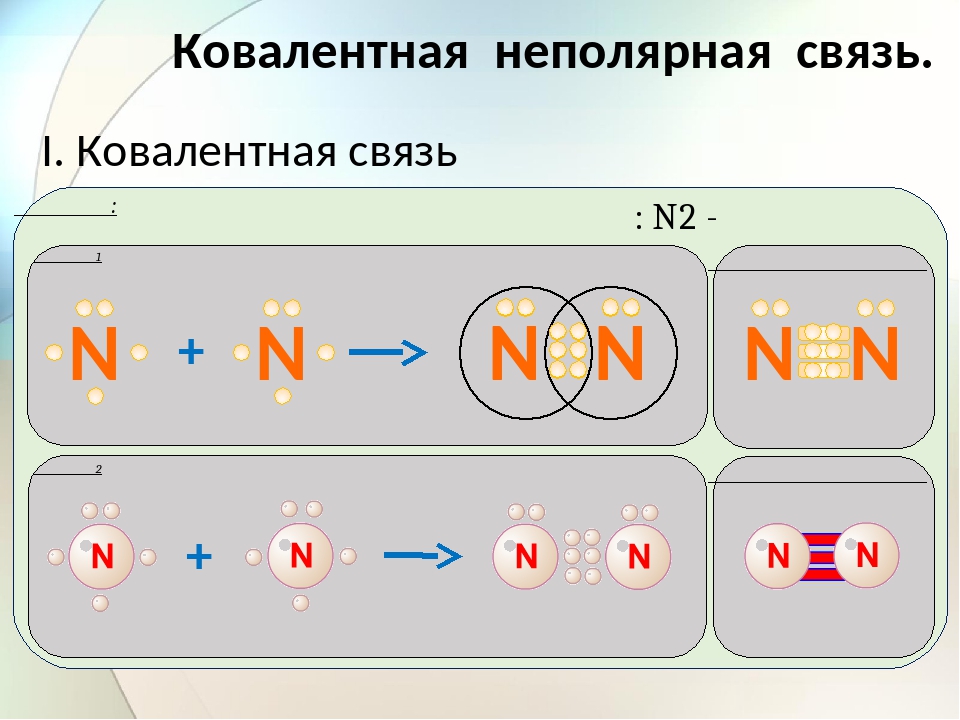
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.
Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2:
σ
Cl – Cl , σ (p – p) — одинарная связь
Демонстрация образования молекулы водорода
Рассмотрим механизм образования молекулы кислорода:
О2 – кнс.
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p – p)
и одна π (р – р)
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) —
образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности (ЭО) некоторых элементов (приведены в порядке возрастания ЭО).
Элемент | K | Na | Ca | Al | H | Br | N | Cl | O | F |
ЭО | 0. | 0.93 | 1 | 1.61 | 2.2 | 2.96 | 3.04 | 3.16 | 3.44 | 4.0 |
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
НCl – кпс.
Электронная схема образования молекулы НCl:
Структурная формула молекулы НCl:
σ
Н → Cl ,
σ (s – p)
— одинарная связь σ
Свойства ковалентной связи
1) Длина – межъядерное расстояние
2) Энергия –
энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической
связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
F – F | O = O | N ≡ N | C ≡ O Одна из трёх связей О→С по донорно-акцепторному механизму |
155 кДж/моль | 498 кДж/моль | 946 кДж/моль | 1065 кДж/моль |
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в
молекуле аммиака NH3 и четырёхвалентен в ионе
аммония NH4+ (валентные возможности
расширяются за счёт участия неподелённой электронной пары атома азота в
образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность* – обуславливает форму молекулы в пространстве.
* — подробнее будет изучено в старших классах. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. (см. «гибридизация»)
Закрепление
№2. Напишите механизм образования молекул с ковалентным типом связи, определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный): H2S, KCl, O2, Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2
Ковалентная неполярная связь.
 Химия. 8 класс. Конспект урока
Химия. 8 класс. Конспект урокаУМК «Химия. 8 класс» О. С. Габриеляна.
Тип урока: изучение нового материала.
Цель урока: продолжить знакомство учащихся с типами химической связи.
Задачи:
- познакомить с ковалентной химической связью и её видом – неполярной связью;
- научить записывать схемы образования ковалентной неполярной связи;
- формировать понятие о кратности связи;
- формирование умение выделять главное, делать выводы;
- стимулирование познавательной активности учащихся, развитие познавательного интереса к предмету.
Использованные источники:
- Габриелян О.С. Химия. 8 класс – М.: Дрофа, 2012г.
- Габриелян О.С. Настольная книга учителя. Химия. 8 класс – М.
 : Дрофа, 2012г.
: Дрофа, 2012г. - Штремплер Г.И. Химия на досуге. Загадки, игры, ребусы — М.: Просвещение, 1993г.
- Алигберов А.И.Занимательная химия- М., Просвещение, 2002 г.
Оборудование: периодическая система химических элементов, магнитофон, «Следы колобков», карточки с заданиями.
Уроки изучения нового материала, проведенные в необычной игровой форме, особенно на начальных этапах изучения химии помогают развитию познавательного интереса к предмету, снимают психологические моменты (трудность восприятия, сложность предмета), помогают привлечь в работу на уроке максимальное число учащихся.
Одним из таких уроков является урок изучения нового материала с необычным названием «Волшебный конверт» (детективная история). В основу – положен игровой момент – «подслушанный разговор ночной разговор известных детских киногероев Колобков», который и обыгрывается потом на уроке. Поэтому, необходимо создать соответствующий настрой – музыкальное сопровождение беседы Колобков (монтаж из фильмов), портреты Колобков, спрятанные по кабинету «следы» и т.
Ход урока
I. Актуализирующее начало
Случилось это вчера вечером. Было уже совсем поздно… На улице темно и неуютно.… Все дома заснули — а я всё готовлюсь к урокам. Нервничаю… Переживаю.… Устало опускаю голову и, о, боже засыпаю. … И в это короткий миг между сном и явью мне вдруг показалось, что слышу я чьи – то голоса.… Всё … Галлюцинации. … Не может быть. … Нет снова … Голоса все громче и громче … Спорят. … Ругаются. Прислушиваюсь и узнаю их. Да это же Колобки…
Да и история очень уж интересная. Слушаю …. Удивляюсь. … Ухмыляюсь.… Просыпаюсь.… Смотрю в окно. … И всё забываю.… Решаю – галлюцинации. Прихожу в школу, открываю кабинет. И …. Вижу их портрет и записку. Прочитаем?
|
Уважаемая Ирина Александровна! Услышанная вами история является чистой правдой!!!!
Нам кажется, что эта история будет полезной и познавательной для всех восьмиклассников, ведь в город, в который мы совершили путешествие по анонимному звонку женщины, вам как химикам, тоже будет полезно побывать. Но чтобы попасть в этот город Вам надо воспользоваться нашими подсказками… Следы от наших ног еще не смыла вода. P. S. Чтобы следы оказались полезными напишите электронную и молекулярную формулы тех веществ, о которых идет речь. Дерзайте !!! |
II. Анализ знаний учащихся
(Работа учащихся у доски по составлению электронных и молекулярных формул веществ с подробными комментариями)
** Это чисто «алюминиевый минерал» – боксит состоит из двух элементов:
Из глины я обыкновенной
Но я на радость современный
Я не боюсь электротока
Бесстрашно в воздухе лечу
Служу на кухне я без срока
Мне все задачи по плечу
Горжусь своим я именем:
Зовусь я … алюминием!
Я жилец квартиры восемь
Я могу зажечь на спор
Спичку, свечку и костёр
Кто вам всем дышать даёт,
Атмосферный кислород.
*Рубин (карбункул) – это окрашенная в кроваво–красный цвет, прозрачная разновидность минерала корунда (его формулу вам и надо написать) – «кто яхонт червленый при себе носит, снов страшных и лихих не видит» — прозрачная, блестящая, окрашенная в синий
цвет другая разновидность корунда называется сапфиром.
(задание следа дифференцировано и рассчитано на разные классы: обязательно написание молекулярной формулы, а электронной только в сильном классе)
Расположите следы по порядку и прочитайте слово.
- Какая связь существует между полученным словом и отгаданными нами веществами?
- Какой тип связи во всех этих веществах?
- Что такое ион?
- Какие силы лежат в основе притяжения ионов?
- Как образуются ионы? Как образуются положительно заряженные ионы? Как образуются отрицательно заряженные ионы?
- Какое еще определение ионной связи можно дать?
Ой, что это? Еще одна записка?! Действительно. …
…
И как мы её не заметили? Прочитаем.
III. Изучение нового материала
(Идёт параллельно чтению записки и работой с картинами – загадками)
|
Молодцы! Вот вы и дошли до пункта назначения.… Не забудьте, заветное слово вам еще пригодится. А вот он и город. Посмотрите вокруг.… Удивились? … Мы тоже – одни близнецы – двойники. Да такие дружные.…* Жаль, что разговаривать с вами они не будут. Но мы всё записали – читайте. Угадали вещества? Но чтобы приблизиться к разгадке тайны, воспользуйтесь подсказками нашей коллеги – криминалиста Колбочкиной:
Ирина Александровна! Вы не спите? Подсказывайте…**
Молодцы!!! Много узнали нового? Мы тоже… Так кто же пригласил нас в этот город? Мы догадались. Кто она – химическая связь? Какие её типы Вы знаете? А чтобы быть уверенными, напишите на наших визитках ответы на наши вопросы (не забудьте указать координаты!)*** До свидания! Не прощаемся! До скорой встречи! |
*Вниманию учащихся предлагается макет дома, квартиры в котором занимают картинки с изображением близнецов. Учащиеся читают задания на картинках и отгадывают загадки. После этого продолжается чтение записки и выполнение заданий с подробными комментариями.
|
Жили в этой квартире 2 старичка. Ростом они были невелики, зато глаза у них были большие и голубые. На месте не стояли ни минутки. Говорили много. Хвастались. — Сколько нам лет? — Не помним! Родились … в 1787 году,… а может быть раньше… — Как зовут? — «Рождающие воду»…, а вообще… не помним…»
Н2 Н–Н |
А здесь живут высокие поэты.
Поэзия есть тот же кислород. Но стихи их нам бывает понять тяжело. Одно мы поняли – без них умрем мы.
О2 О=О |
|
Странные эти братья. Не от мира сего. А главное – высокого мнения о себе. Парят в облаках и постоянно смотрят на всех свысока. Ведь, как они говорят, без них нет жизни на Земле. Они — составная часть, какой – то белковины, которую плетут круглосуточно с самого рождения.
N2 N≡N |
|
**Объяснение учителя (подробное объяснение учителя механизма образования ковалентной связи, её кратности, длины, электронных и структурных формул, запись основных положений в тетрадь)
Подводим итог, связь, образующаяся за счет обобществления электронов, называется ковалентной связью.
Ковалентная связь – это связь, возникающая в результате образования общих электронных пар (запись в тетради).
Ковалентная неполярная связь – это связь, возникающая в результате образования общих электронных пар между атомами одного и того же элемента – неметалла.
IV. Закрепление знаний
Вот такая история приключилась с нами. Именно её я просто забыла. А вот колобкам спасибо! Ведь именно они помогли мне объяснить новый материал. Спасибо колобкам! Спасибо Вам!
Домашнее задание §10.
Урок химии «Ковалентная связь» — химия, уроки
Тема: Ковалентная связь
Цель
Свойства веществ зависят не только от качественного и количественного состава, но и от того как атомы удерживаются в молекулах и кристаллах.
- узнаете, что такое химическая связь;
- познакомитесь с одним из ее видов — ковалентной связью;
научитесь составлять электронные и графические формулы веществ с ковалентной связью.
Задачи урока:
Образовательные:
• изучить виды ковалентной связи (полярная и неполярная)
- изучить механизм образования ковалентной химической связи
• научиться составлять электронные формулы молекул бинарных соединений.
Развивающие:
• формировать умения определять вид ковалентной связи
- формировать умения написания электронных формул бинарных соединений;
• развивать навыки аналитического мышления;
• развитие самостоятельности, памяти, внимания, логического мышления, умения анализировать и систематизировать, самостоятельно делать выводы посредством обобщений.
Воспитательные:
- создание условий для воспитания активности и самостоятельности, убежденности в познаваемости мира.
- воспитывать культуру научного труда; повышать интерес к проблемам современной науки.
Ход урока
Изучение нового материала
Химическая связь
В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом.
В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны.
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического уровня. Они расположены дальше от ядра и менее прочно связаны с ним. В зависимости от способа образования завершённых электронных структур атомов различают несколько видов химической связи.
Ковалентная связь
Ковалентная связь — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H2, HCl, H2O, O2).
В образовании ковалентной связи принимают участие неспаренные валентные электроны атома, которые располагаются на внешнем уровне по одному.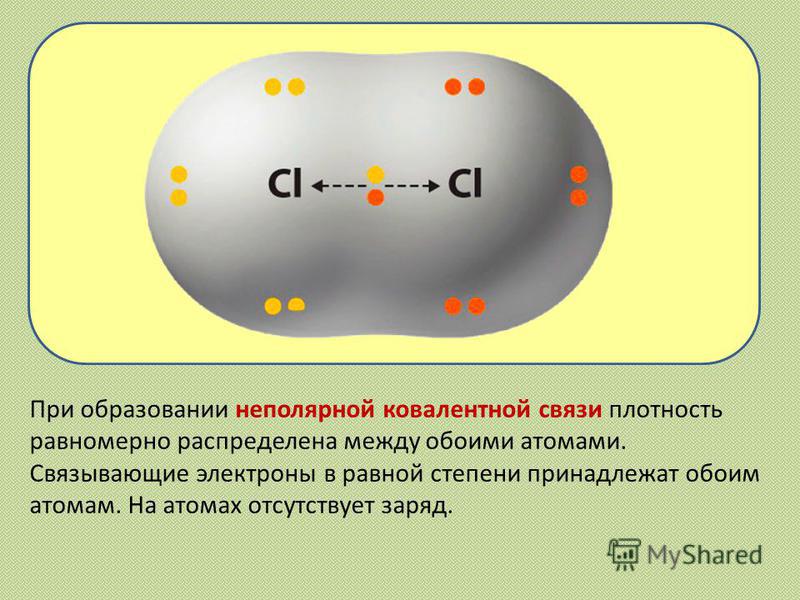
Например: у серы число неспаренных электронов равно 8-6=2.
Вопрос: Атомы химических элементов в простых и сложных веществах удерживаются электростатическим притяжением между ядрами притяжением между электронными облаками химическими связями
(химическими связями)
Алгоритм составления ковалентной связи
1. Определить валентные электроны.
2. Определить количество неспаренных электронов.
3. Записать электронную и структурную формулы получившейся молекулы.
Например:
1. Валентные электроны у серы 2s22p4
у хлора 2s22p6
2. Количество неспаренных электронов
3.
Ковалентная неполярная и полярная связи
По степени смущенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
а) Ковалентная неполярная связь (КНС) – связь между атомами неметалла с одинаковой ЭО, когда общие электронные пары находятся на одинаковом расстоянии от обоих взаимодействующих атомов и в равной степени принадлежат им обоим. (Например, H2, O2, О3).
Механизм образования связи:
Например, образование молекул водорода Н2 и хлора F2:
Каждый атом неметалла отдает в общее пользование другому атому наружные неспаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Связь между двумя атомами образуется тогда, когда они приближаются друг к другу на расстояние, достаточное для того, чтобы электроны каждого из них оказались в пределах взаимодействия с ядром другого атома.
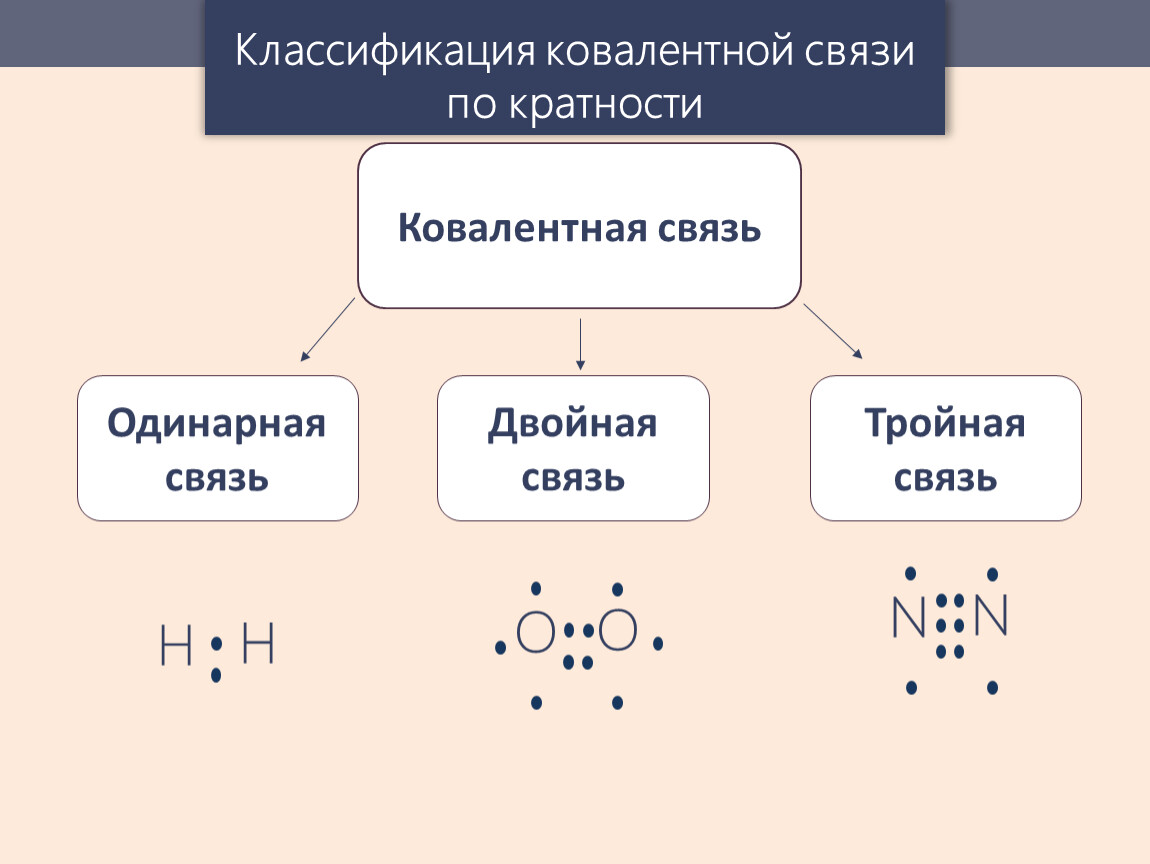
Электронную пару можно обозначить черточкой:
F2 F – F одинарная
О2 О = О двойная
N2 N ≡ N тройная
Электронная формула – валентные электроны изображены точками.
Структурная формула – общие электронные пары изображаются чёрточкой.
б) Ковалентная полярная связь (КПС) – образуют атомы разных неметаллов и общие электронные пары смещены в сторону более ЭО химического элемента (Например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.<1,7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Закрепление
1. Химическую связь, образованную общими электронными парами, называют
Химическую связь, образованную общими электронными парами, называют
(Ковалентной)
2. Порядок построения молекул
Задания:
1. Составьте формулу вещества с ковалентной полярной связью.
2. Составьте формулу вещества с ионной связью.
3. Составьте формулу вещества с ковалентной неполярной связью.
4. Укажите наиболее электроотрицательный элемент.
5. Укажите наименее электроотрицательный элемент.
Самопроверка
3. Найдите соответствие между формулой вещества и ее названием
O=C=O
H2O
O::O
Выберите. ..
..
электронная
молекулярная
графическая
4. Выполнение тестовых заданий
1. В каком ряду находятся вещества только с ковалентной связью – назвать выбранные вещества, указать полярная или неполярная связь:
А) K2O, Na2S, LiCl Б) MgO, h3O, h3S В) h3SO4, CO2, Cl2
2. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) N а) 1
2) S б) 3
3) F в) 2
3. Напишите схему образования химической связи в молекуле Н2S
Выводы
— Химическая связь — это сила, которая удерживает атомы в соединении.
— Химическая связь, образованная общими электронными парами, называется ковалентной.
— Общие электронные пары образуются при объединении неспаренных валентных электронов атомов неметаллов.
— При образовании химической связи атомы получают завершенный внешний электронный слой.
— Атомы образуют химические связи, чтобы приобрести устойчивую 8-электронную конфигурацию внешнего энергетического уровня.
— Состав вещества можно выражать в виде:
Covalent Bonds | Protocol (Translated to Russian)
2.10: Ковалентные связи
Обзор
Когда два атома делят электроны для завершения своих валентных оболочек, они создают ковалентную связь. Электронегативность атома – сила, с которой общие электроны тянутся к атому– определяет, как электроны делятся. Молекулы, образованные ковалентными связями, могут быть полярными или неполярными. Атомы с одинаковыми электронегативностями образуют неполярные ковалентные связи; электроны делятся поровну. Атомы разной электронегативности разделяют электроны неравномерно, создавая полярные связи.
Электронегативность атома – сила, с которой общие электроны тянутся к атому– определяет, как электроны делятся. Молекулы, образованные ковалентными связями, могут быть полярными или неполярными. Атомы с одинаковыми электронегативностями образуют неполярные ковалентные связи; электроны делятся поровну. Атомы разной электронегативности разделяют электроны неравномерно, создавая полярные связи.
Ковалентная связь формируется двумя общими электронами
Количество ковалентных связей, которые может образовывать атом, продиктовано количеством валентных электронов. Кислород, например, имеет шесть из восьми возможных валентных электронов, а это означает, что каждый атом кислорода нуждается еще в двух электронах, чтобы стать стабильным. Кислород может образовывать одиночные связи с двумя другими атомами, как это происходит, когда он образует воду с двумя атомами водорода (химическая формула H2O). Кислород может также образовывать двойную связь только с одним другим атомом, который также нуждается еще в двух электронах для завершения своего «октета» (например, другого атома кислорода).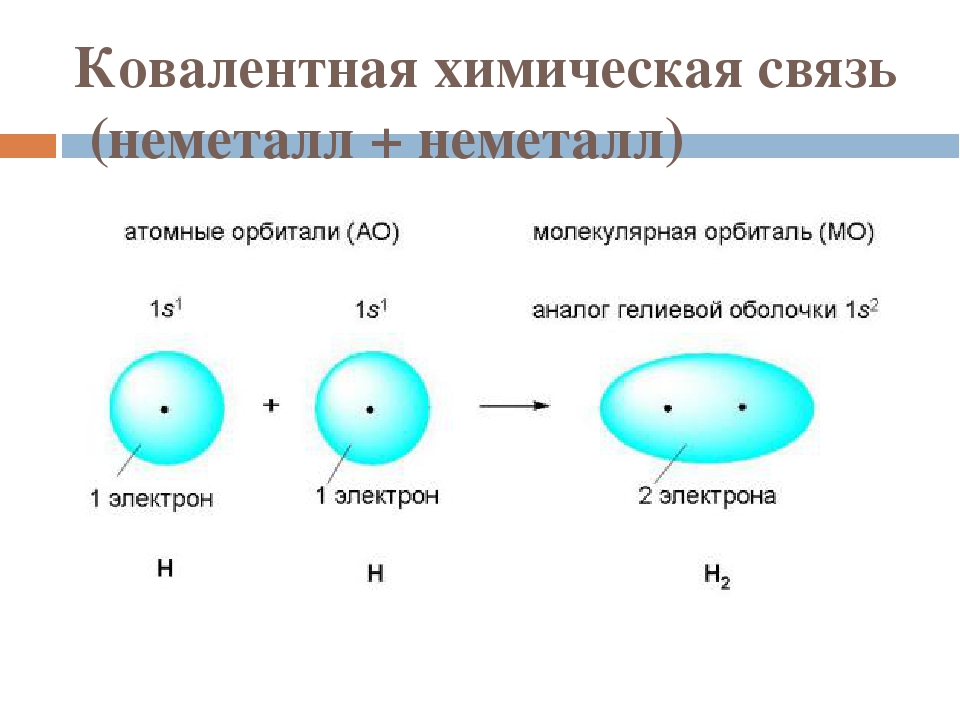 Углерод имеет четыре валентных электрона и поэтому может образовывать четыре ковалентных связи, как это происходит в метане (CH4).
Углерод имеет четыре валентных электрона и поэтому может образовывать четыре ковалентных связи, как это происходит в метане (CH4).
Когда осуществляется ковалентная связь, оба атома разделяют пару электронов в гибридной орбите, которая отличается по форме от обычной орбиты. Электроны, участвующие в связи, таким образом, вращаются по измененной траектории вокруг ядер обоих атомов. Ковалентные связи сильны и, как только сформируются, не могут быть нарушены физическими силами.
Электроотрицательность определяет, является ли молекула полярной или неполярной
Электроотрицательность – это тенденция атома привлекать электроны в связи. Наиболее электроотрицательным атомом является фтор. Начиная со фтора в правом верхнем углу периодической таблицы (не учитывая благородные газы в правом столбце), электроотрицательность атомов имеет тенденцию к снижению с диагональным движением влево вниз по периодической таблице, так что атомы с самыми низкими электроотрицательностями находятся в левом нижнем углу (например, Франций, или Fr). Если атомы имеют резко отличающиеся электроотрицательности, они, скорее всего, образуют ионные связи вместо ковалентных. Однако для атомов, которые образуют ковалентные связи друг с другом, их значения электроотрицательности определяют, будет ли связь полярной или неполярной.
Если атомы имеют резко отличающиеся электроотрицательности, они, скорее всего, образуют ионные связи вместо ковалентных. Однако для атомов, которые образуют ковалентные связи друг с другом, их значения электроотрицательности определяют, будет ли связь полярной или неполярной.
Неполярная связь – это связь, в которой электроны делятся поровну, и нет разницы в заряде в молекуле. Полярная связь, напротив, возникает, когда один атом является более электроотрицательным, чем другой, и тянет электроны к себе. Полярные связи имеют частичный отрицательный заряд с одной стороны и частичный положительный заряд с другой, что важно, потому что это заставляет полярные молекулы вести себя иначе, чем неполярные.
Полярные молекулы — гидрофильные, потому что их частичные заряды привлекают их к другим заряженным молекулам, что также означает, что они растворимы в воде. Неполярные молекулы, содержащие длинные участки углеводородов, такие как жиры, называются гидрофобными. В отличие от полярных молекул, неполярные молекулы не растворяются в воде. Клетки часто окружены жидкостью и имеют цитоплазмы, которые содержат воду. Таким образом, способ взаимодействия молекулы с водой и другими заряженными молекулами влияет на то, как она транспортируется и используется клетками.
Клетки часто окружены жидкостью и имеют цитоплазмы, которые содержат воду. Таким образом, способ взаимодействия молекулы с водой и другими заряженными молекулами влияет на то, как она транспортируется и используется клетками.
ХиМиК.ru — КОВАЛEНТНАЯ СВЯЗЬ — Химическая энциклопедия
КОВАЛEНТНАЯ СВЯЗЬ (от лат. со- — приставка, означающая совместность, и valens — имеющий силу), тип химической связи, характеризуемый увеличением электронной плотности в области между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в своб. атомах. Уменьшение энергии системы при образовании ковалентной связи не может быть описано электростатич. моделью и требует учета квантовых св-в молекулы, напр. симметрии многоэлектронной волновой ф-ции относительно перестановок индексов электронов. В рамках классич. теории хим. строения ковалентная связь объясняется как образование электронных пар, общих для связываемых атомов и достраивающих их электронные оболочки в молекуле до замкнутых (с числом электронов 8, 18 и т. д.). Квантовохим. описание ковалентной связи проводят обычно в рамках метода валентных связей (валентных схем) или методов мол. орбиталей. В последнем случае ковалентную связь связывают с мол. орбиталью, локализованной в области, охватывающей неск. (два, три и т.д.) ядер (двухцентровые, трехцентровые и т.д. связи). Такая мол. орбиталь м. б. заполнена одним или двумя электронами. Все электроны молекулы одинаковы, однако обычно считают, что при образовании электронной пары от каждого атома на мол. орбиталь поставляется по одному электрону, и отдельно выделяют случай донорно-акцепторной связи (см. Координационная связь), когда оба электрона поставляются одним из атомов. В зависимости от числа образующихся для данной ковалентной связи электронных пар говорят об ординарной (простой) и кратных связях (двойной, тройной).
Идеальная ковалентная связь существует лишь в гомоядерных системах, напр. Н2, Н+2, Н+3, С2, N2 и т.
д.). Квантовохим. описание ковалентной связи проводят обычно в рамках метода валентных связей (валентных схем) или методов мол. орбиталей. В последнем случае ковалентную связь связывают с мол. орбиталью, локализованной в области, охватывающей неск. (два, три и т.д.) ядер (двухцентровые, трехцентровые и т.д. связи). Такая мол. орбиталь м. б. заполнена одним или двумя электронами. Все электроны молекулы одинаковы, однако обычно считают, что при образовании электронной пары от каждого атома на мол. орбиталь поставляется по одному электрону, и отдельно выделяют случай донорно-акцепторной связи (см. Координационная связь), когда оба электрона поставляются одним из атомов. В зависимости от числа образующихся для данной ковалентной связи электронных пар говорят об ординарной (простой) и кратных связях (двойной, тройной).
Идеальная ковалентная связь существует лишь в гомоядерных системах, напр. Н2, Н+2, Н+3, С2, N2 и т. д. Если атомы в молекуле различны, электронная плотность смещается к одному из ядер атомов, между к-рыми образуется ковалентная связь, т. е. происходит поляризация связи. Случаю предельной поляризации отвечает идеальная ионная связь. Характер поляризации ковалентной связи существенно связан с конкретным электронным и колебат. состояниями молекулы. Так, молекула СО при малых межъядерных расстояниях (близких к равновесному) м. б. описана как Сd- Оd+, а при расстояниях несколько больших равновесного — как Сd+ Оd- (d — эффективный заряд атома в молекуле). При приближении к диссоциац. пределу d стремится к нулю и молекула диссоциирует на нейтральные атомы. Гомоядерная молекула Н2 в возбужденных электронных состояниях может диссоциировать на Н+ и Н— и т. п. Характер поляризации ковалентной связи может меняться при переходе молекулы в к.-л. из ее возбужденных состояний.
Сложность этой картины связана с тем, что представление о ковалентной связи (как и об ионной связи) возникло в классич.
д. Если атомы в молекуле различны, электронная плотность смещается к одному из ядер атомов, между к-рыми образуется ковалентная связь, т. е. происходит поляризация связи. Случаю предельной поляризации отвечает идеальная ионная связь. Характер поляризации ковалентной связи существенно связан с конкретным электронным и колебат. состояниями молекулы. Так, молекула СО при малых межъядерных расстояниях (близких к равновесному) м. б. описана как Сd- Оd+, а при расстояниях несколько больших равновесного — как Сd+ Оd- (d — эффективный заряд атома в молекуле). При приближении к диссоциац. пределу d стремится к нулю и молекула диссоциирует на нейтральные атомы. Гомоядерная молекула Н2 в возбужденных электронных состояниях может диссоциировать на Н+ и Н— и т. п. Характер поляризации ковалентной связи может меняться при переходе молекулы в к.-л. из ее возбужденных состояний.
Сложность этой картины связана с тем, что представление о ковалентной связи (как и об ионной связи) возникло в классич. химии и выделялось не по особенностям электронного распределения, а по специфике хим. поведения молекул при нормальных условиях, когда в осн. заселены низшие электронно-колебат. состояния. Представление о ковалентной связи корректно определено вблизи равновесной конфигурации для тех молекул, у к-рых смещения ядер от положения равновесия малы.
Одно из существ. св-в ковалентной связи-ее насыщаемость: при ограниченном числе валентных электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома. Именно это число тесно связано с традиц. понятием валентности атома в молекуле. Др. важное св-во ковалентной связи — ее направленность в пространстве, проявляющаяся в примерно одинаковом геом. строении родственных по составу мол. фрагментов. Напр., фрагмент СН2 в разл. насыщ. углеводородах имеет примерно одно и то же строение. Направленность ковалентной связи часто связывают с гибридизацией атомных орбиталей, из к-рых составляется мол. орбиталь, отвечающая ковалентной связи.
химии и выделялось не по особенностям электронного распределения, а по специфике хим. поведения молекул при нормальных условиях, когда в осн. заселены низшие электронно-колебат. состояния. Представление о ковалентной связи корректно определено вблизи равновесной конфигурации для тех молекул, у к-рых смещения ядер от положения равновесия малы.
Одно из существ. св-в ковалентной связи-ее насыщаемость: при ограниченном числе валентных электронов в областях между ядрами образуется ограниченное число электронных пар вблизи каждого атома. Именно это число тесно связано с традиц. понятием валентности атома в молекуле. Др. важное св-во ковалентной связи — ее направленность в пространстве, проявляющаяся в примерно одинаковом геом. строении родственных по составу мол. фрагментов. Напр., фрагмент СН2 в разл. насыщ. углеводородах имеет примерно одно и то же строение. Направленность ковалентной связи часто связывают с гибридизацией атомных орбиталей, из к-рых составляется мол. орбиталь, отвечающая ковалентной связи. Лит. см. при ст. Химическая связь. Н.Ф. Степанов.
Лит. см. при ст. Химическая связь. Н.Ф. Степанов.
===
Исп. литература для статьи «КОВАЛEНТНАЯ СВЯЗЬ»: нет данных
Страница «КОВАЛEНТНАЯ СВЯЗЬ» подготовлена по материалам химической энциклопедии.
Еще по теме:
Ковалентная связь. Ковалентная связь — Документ
Строение молекул. Химическая связь.
Выделяют следующие типы химической связи: ковалентная, ионная, металлическая.
Ионная связь.
Ионы – это заряженные частицы, которые образуются в результате отдачи или присоединения электронов атомами или группами химически связанных атомов.
Катионы – положительно заряженные ионы, анионы – отрицательно заряженные ионы.
Ионы могут быть простыми (образованными одним атомом Na+,Al3+, S2-) и сложными
(образованными группой атомов NH4+ ,NO3— ,SO42-).
Причина образования связи заключается в тенденции атомов элементов приобрести устойчивую восьмиэлектронную оболочку.
Атомы металлов отдают электроны с последнего энергетического уровня. В результате этого образуется положительный ион. Например: Na0 — 1 e → Na+
Атомы неметаллов присоединяют электроны, необходимые для завершения внешнего энергетического уровня (до 8). В результате образуется отрицательный ион. Например:
Cl0 + 1e→ Cl— . Ионы Na+ и Cl— притягиваются, благодаря электростатическому взаимодействию образуется ионная связь.
Ионная связь – связь между ионами противоположного знака в результате их электростатического взаимодействия. (Образуется между типичными металлами и неметаллами).
Ковалентная связь.
Ковалентная связь –
это связь между атомами, возникающая
за счет образования общих электронных пар. (Образуется между атомами неметаллов).
(Образуется между атомами неметаллов).
Электроотрицательность – величина, характеризующая способность атомов смещать к себе электроны, участвующие в образовании связи.
По степени полярности различают ковалентную неполярную и ковалентную полярную связь.
Ковалентная неполярная связь – связь между атомами одного и того же элемента.
Электронные пары находятся симметрично относительно атомов, например: Cl-Cl, O=O.
Ковалентная полярная связь – связь между атомами элементов, которые отличаются электроотрицательностью. В этом случае общая электронная пара смещается к атому более электроотрицательного элемента, например: H →Cl , C→N.
Металлическая связь.
Металлическая связь – тип связи в кристаллах металлов между атомами или ионами металлов и свободными (обобществленными) электронами.
Атомы большинства металлов на
внешнем уровне содержат небольшое число
электронов..PNG) Эти электроны легко
отрываются, и атомы превращаются в
положительные ионы. Оторвавшиеся
электроны перемещаются от одного иона
к другому, связывая их в единое целое.
Например: Al0 — 3e
↔ Al3+.
Эти электроны легко
отрываются, и атомы превращаются в
положительные ионы. Оторвавшиеся
электроны перемещаются от одного иона
к другому, связывая их в единое целое.
Например: Al0 — 3e
↔ Al3+.
Структура кристаллического вещества характеризуется правильным (регулярным) расположением частиц. При мысленном соединении этих точек линиями получается пространственный каркас, который называют кристаллической решеткой.
В случае ковалентной связи возможны два типа кристаллических решеток — атомная и молекулярная. В веществах молекулярного строения силы межмолекулярного взаимодействия довольно слабы, поэтому молекулярные кристаллические решетки не являются прочными. Вещества с таким типом решеток характеризуются низкими температурами плавления.
В веществах с атомной, ионной и металлической кристаллическими решетками нет молекул. Эти вещества относятся к веществам немолекулярного строения.
Вещества с атомной кристаллической
решеткой обладают очень высокими
значениями температур плавления, высокой
прочностью, твердостью. (алмаз, графит,
кремний, оксид кремния и т.д.)
(алмаз, графит,
кремний, оксид кремния и т.д.)
Вещества с металлической кристаллической решеткой обладают высокой пластичностью, тепло- и электропроводностью, металлическим блеском.
Вещества с ионной кристаллической решеткой представляют собой твердые тугоплавкие вещества с высокими температурами плавления.
Задание для самостоятельной работы. Выполните тест и отправьте ответы для проверки по distanced.sch@mail.ru
Ковалентная полярная связь образуется между атомами
1)натрия и брома 2)серы и водорода 3) водорода 4)калия и иода
2. Для хлорида кальция характерен вид связи
1) металлическая 2) ионная 3) ковалентная полярная 4)ковалентная неполярная
3. Для какого вещества характерна ковалентная полярная связь?
1) CaO 2)S8 3) CO 4)Zn
4. Ионная связь характерна для
Ионная связь характерна для
1) оксида кремния 2) бромида калия 3) магния 4) сероводорода
5. Одинаковый вид связи имеют сероводород и
1) фосфор 2) аммиак 3) бромид натрия 4) азот
6. Какое из указанных веществ имеет ковалентную неполярную связь?
1) сахароза 2) вода 3) алмаз 4) каменная соль
7. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) сероводород и негашеная известь 2)гипс и нитрид натрия
3) фосфин и водород 4) аммиак и сероуглерод
8. Ионная связь характерна для каждого из двух веществ:
1) карбид кальция и сернистая кислота 2) хлорид бария и гидрид натрия
3) угарный газ и этиловый спирт
4) железо и фосфат алюминия.
9. Какое из указанных веществ имеет металлическую связь?
1) Fe3C 2) Na2O2 3)Zn 4) Si
10. Пластичность и теплопроводность характерны для веществ, в которых химическая связь
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
11. Во всех перечисленных соединениях связь ковалентная полярная
1) HF, OF2, NF3 2) F2, H2 , N2 3) NaF, HF , SF6 4) BaO , HCl , PCl3
12. Ионная и ковалентная полярная связи характерны для соединений соответственно
1) BaO и O2 2) BaCl2 и Na2O 3) H2SO4 и SO2 4) CaO и NH3
13. Из молекул состоит каждое из веществ
Из молекул состоит каждое из веществ
1) поваренная соль и кислород 2) оксид магния и хлороводород
3) вода и хлор 4) алмаз и сода
14. Ионную кристаллическую решетку имеет каждое из веществ
1) серная кислота и оксид углерода (4) 2) гидроксид натрия и хлорид калия
3) карбонат кальция и хлороводород 4) оксид кремния и гидроксид меди (2).
Ковалентная связь — Энциклопедия по машиностроению XXL
Длина связи или расстояние между атомами определяется в первую очередь размерами атомов, соединенных связью. Вообще, чем больше атомы, тем больше длина связи. Для настоящей цели кажущийся радиус может быть принят для отдельного атома таким, чтобы сумма кажущихся радиусов атомов была равна длине связи. На длину связи в некоторой степени также влияет прочность связи чем прочнее связь, тем короче длина. Поэтому кажущийся атомный радиус будет изменяться с типом связи например, кажущийся атомный радиус углерода для одинарной ковалентной связи равен 0,77 А, для двойной связи он понижается до 0,67 А и для тройной связи до 0,60 А.
[c.137]
Поэтому кажущийся атомный радиус будет изменяться с типом связи например, кажущийся атомный радиус углерода для одинарной ковалентной связи равен 0,77 А, для двойной связи он понижается до 0,67 А и для тройной связи до 0,60 А.
[c.137]
Валентные силы индивидуальных атомов строго направлены в пространстве, и угол между двумя ковалентными связями атома является прежде всего свойством атома общая молекулярная структура только незначительно влияет на него. Обобщенные данные по длинам и углам связей суммированы в табл. 6. [c.137]
Для всех неметаллов характерна ионная или ковалентная связь. Эти виды связи жесткие, обусловленные электростатическим притяжением двух разнородно заряженных ионов. [c.60]
Возможно, что присутствие алюминия в стали, кроме нитридов перечисленных элементов, вызывает образование нитрида AIN, ковалентные связи в котором обусловливают очень высокую его термическую устойчивость.
[c. 332]
332]
Ковалентная связь может снова превратиться в исходную металлическую. Так, в результате длительных выдержек карбидов при высокой температуре происходит их распад, сопровождающийся образованием металла. [c.11]
В качестве примера смешанной формы связей (металлической и ковалентной) можно указать на графит атом углерода в решетке графита связан с тремя соседними ковалентной связью, а четвертый электрон каждого атома является общим для всего атомного слоя, обусловливая электропроводность графита. Смешанные связи встречаются также в мышьяке, висмуте, селене и других простых веществах. Чисто металлическая связь характерна только для некоторых металлических монокристаллов.
[c.11]
Смешанные связи встречаются также в мышьяке, висмуте, селене и других простых веществах. Чисто металлическая связь характерна только для некоторых металлических монокристаллов.
[c.11]
При температурах, близких к абсолютному нулю, в идеальном кристалле 5 или Ое ковалентные связи полностью заполнены и все электроны связаны с атомами, вследствие чего электропроводность отсутствует. При нагревании или освещении кристалла происходит освобождение электронов от ковалентной связи, возникает электропроводность — переход электронов из валентной зоны в зону проводимости. При этом на месте ушедшего электрона образуется незаполненная связь (дырка), которая может быть занята электроном из другой какой-нибудь связи. Одновременно незаполненная связь (дырка) может перемещаться по кристаллу. [c.387]
С другой стороны, адсорбционная теория опирается на тот факт, что большинство металлов, подчиняющихся определению 1, являются переходными металлами в периодической системе (т.
 е. они имеют электронные вакансии или неспаренные электроны в d-оболочках атома). Наличие неспаренных электронов объясняет образование сильных связей с компонентами среды, особенно с Оа, который также содержит неспаренные электроны (что приводит к появлению парамагнетизма) и образует ковалентные связи в дополнение к ионным. Кроме того, переходные металлы имеют высокую температуру возгонки по сравнению с непереходными, что благоприятствует адсорбции компонентов окружающей среды, так как атомы металла стремятся остаться в кристаллической решетке, а образование оксида требует выхода из нее. Образование химических связей при адсорбции кислорода переходными металлами требует большой энергии, поэтому такие пленки называются хемосорбционными, в отличие от низкоэнергетических пленок, называемых физически адсорбированными. На поверхности непереходных металлов (например, меди и цинка) оксиды образуются очень быстро и любые промежуточные хемосорбционные пленки являются короткоживущими. На переходных металлах хемосорбированный кислород термодинамически более стабилен, чем оксид металла [22].
е. они имеют электронные вакансии или неспаренные электроны в d-оболочках атома). Наличие неспаренных электронов объясняет образование сильных связей с компонентами среды, особенно с Оа, который также содержит неспаренные электроны (что приводит к появлению парамагнетизма) и образует ковалентные связи в дополнение к ионным. Кроме того, переходные металлы имеют высокую температуру возгонки по сравнению с непереходными, что благоприятствует адсорбции компонентов окружающей среды, так как атомы металла стремятся остаться в кристаллической решетке, а образование оксида требует выхода из нее. Образование химических связей при адсорбции кислорода переходными металлами требует большой энергии, поэтому такие пленки называются хемосорбционными, в отличие от низкоэнергетических пленок, называемых физически адсорбированными. На поверхности непереходных металлов (например, меди и цинка) оксиды образуются очень быстро и любые промежуточные хемосорбционные пленки являются короткоживущими. На переходных металлах хемосорбированный кислород термодинамически более стабилен, чем оксид металла [22]. Многослойная адсорбция кислорода, характеризующаяся ослаблением связей с металлом, приводит с течением времени к образованию оксидов. Но подобные оксиды менее существенны при объяснении пассивности, чем хемосорбционные пленки, которые продолжают образовываться в порах оксида.
[c.81]
Многослойная адсорбция кислорода, характеризующаяся ослаблением связей с металлом, приводит с течением времени к образованию оксидов. Но подобные оксиды менее существенны при объяснении пассивности, чем хемосорбционные пленки, которые продолжают образовываться в порах оксида.
[c.81]Сильная ковалентная связь с энергией порядка 10 Дж/моль определяет высокую температуру плавления и прочность кристаллов. Ковалентной связью обусловлены структуры так называемых атомных кристаллов — алмаза, кремния, германия, серого олова и др. [c.9]
Число образуемых атомом ковалентных связей в первом приближении может служить количественной мерой валентности. [c.9]
Каждая ковалентная связь между атомами образуется при спаривании их валентных электронов (с противоположными спинами). Поскольку валентные возможности атомов ограничены, важнейшее свойство ковалентной связи — насыщаемость химических сил сродства. [c.9]
Рассмотрим случай ковалентной связи. Вокруг ядер по своим орбитам вращаются электроны, образуя электронное облако. Обозначим один атом через А, а второй через Б. Электроны в свою очередь делятся на две группы
[c.43]
Вокруг ядер по своим орбитам вращаются электроны, образуя электронное облако. Обозначим один атом через А, а второй через Б. Электроны в свою очередь делятся на две группы
[c.43]
Типичными полупроводниками являются кристаллы германия и кремния, в которых атомы объединены ковалентной связью. При температуре около 300 К средняя энергия теплового движения атомов в полупроводниковом кристалле составляет около 0,04 эВ. Это значительно меньше энергии, необходимой для отрыва валентного электрона, на- [c.154]
Донорные и акцепторные примеси. Свойства полупроводников сильно зависят от содержания примесей. Примеси бывают двух типов — донорные и акцепторные. Если, например, в кристалле кремния имеется примесь атомов мышьяка, то эти атомы замещают в узлах кристаллической решетки атомы кремния. Пятивалентный атом мышьяка вступает в ковалентные связи с четырьмя атомами кремния, а его пятый электрон оказывается незанятым в связях (рис. 155).
[c. 155]
155]
Если относительная ионность равна 1, т. е. составляет 100%, то связь между атомами чисто ионная если же она равна О, то связь чисто ковалентная. В промежутке между О и 1 имеем ковалентную связь с частично ионным характером. Чем больше разность электроотрицательностей, т. е. чем дальше отстоят два элемента один от другого в ряду электроотрицательности, тем отчетливее проявляется ионный характер связи. [c.59]
Ниже, при оценке энергии сцепления металлов, мы ограничимся лишь грубо приближенной ионной моделью металла, а для понимания особенностей ковалентной связи ограничимся рассмотрением задачи об образовании молекулы водорода при взаимодействии двух атомов водорода. [c.64]
К ковалентным кристаллам относят твердые тела, кристаллическая структура которых образована за счет ковалентной связи. Типичными представителями кристаллов с чисто ковалентной связью являются алмаз, кремний, германий, серое олово, которые построены по типу структуры алмаза (см. рис. 1.28).
[c.75]
рис. 1.28).
[c.75]
Существует большой класс алмазоподобных соединений А В , А В » со структурой типа сфалерита н вюрцита (см. рис. 1.26 и 1.27), при образовании которых наряду с ковалентной связью всегда возникает дополнительная ионная компонента связи, которая увеличивается при переходе от соединений к соеди- [c.75]
Для понимания существа ковалентной связи мы ограничимся рассмотрением механизма образования молекулы водорода Нг при взаимодействии двух атомов водорода. [c.76]
Переходя от молекулы водорода к кристаллам, отметим основной характерной особенностью ковалентных кристаллов является то, что количество ковалентных связей, образуемых каждым атомом со своими соседями, равно количеству неспаренных внешних электронов атома в свободном состоянии или в возбужденном валентном состоянии. В этом смысле ковалентная связь является насыщенной. [c.81]
[c.81]
В заключение подчеркнем, что наиболее характерная черта ковалентной связи—ее сильная направленность в пространстве, т. е. она образуется в тех направлениях, в которых локализуется электронная плотность. Вследствие направленности связи ковалентные кристаллы обладают высокой твердостью и хрупкостью. [c.81]
Образование точечных дефектов требует значительных затрат энергии. Эта энергия находится в прямой зависимости от прочности химических связей и пропорциональна энергии связи в кристалле. Так, чтобы создать вакансию в кристалле германия или кремния, надо разорвать четыре ковалентные связи. Вычисления показывают, что энергия образования вакансии в германии равна примерно 3,2-10— 9 Дж (2 эВ), а в кремнии 3,7-Ю- Дж (2,3 эВ). Однако несмотря на это, при относительно высоких температурах существование дефектов является энергетически выгодным. Дело в том, что введение дефектов не только увеличивает внутреннюю энергию кристалла, но и увеличивает его энтропию.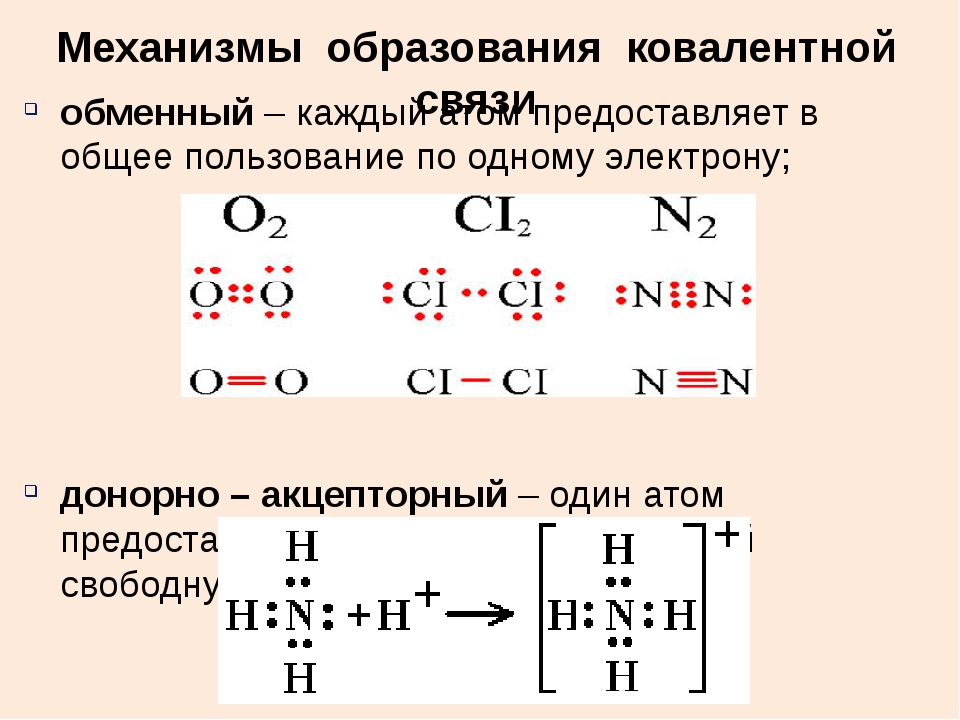 Таким образом, для заданной термодинамической температуры Т свободная энергия F—E—TS минимальна при некоторой концентрации дефектов. Последняя определяется балансом энергетической и энтропийной составляющих F.
[c.88]
Таким образом, для заданной термодинамической температуры Т свободная энергия F—E—TS минимальна при некоторой концентрации дефектов. Последняя определяется балансом энергетической и энтропийной составляющих F.
[c.88]
Найдем, в качестве примера, положение локальных разрешенных уровней примесных атомов V группы таблицы Менделеева в элементарных полупроводниках IV группы. Предположим, например, что в одном из узлов кристалла германия находится атом мышьяка, имеющий пять электронов в валентной оболочке. Четыре валентных электрона участвуют в образовании ковалентных связей с четырьмя соседними атомами германия.- Поскольку ковалентная связь является насыщенной, пятый электрон новой связи образовать не может. Находясь в кристалле, он сравнительно слабо взаимодействует с большим числом окружающих мышьяк атомов германия. Вследствие этого его связь с атомом As уменьшается и он движется по орбите большого радиуса. Его поведение подобно поведению электрона в атоме водорода. Таким образом, задача сводится к отысканию уровней энергии водородоподобного атома. При ее решении необходимо учесть следующие обстоятельства. Поскольку электрон движется не только в кулоновском поле иона мышьяка, но и в периодическом поле решетки, ему необходимо приписать эффективную массу т. Кроме того, взаимодействие электрона с атомным остатком As+, имеющим заряд Ze, происходит в твердом теле, обладающем диэлектрической проницаемостью г. С учетом этого потенциальная энергия электрона примесного атома
[c.237]
Таким образом, задача сводится к отысканию уровней энергии водородоподобного атома. При ее решении необходимо учесть следующие обстоятельства. Поскольку электрон движется не только в кулоновском поле иона мышьяка, но и в периодическом поле решетки, ему необходимо приписать эффективную массу т. Кроме того, взаимодействие электрона с атомным остатком As+, имеющим заряд Ze, происходит в твердом теле, обладающем диэлектрической проницаемостью г. С учетом этого потенциальная энергия электрона примесного атома
[c.237]
Отметим, что локализованные магнитные моменты могут быть связаны не только с магнитными атомами. Так, А. Ф. Хохлов и П. В. Павлов наблюдали возникновение ферромагнитного упорядочения в аморфном кремнии. Здесь нет атомов с недостроенными внутренними оболочками, однако имеются оборванные ковалентные связи. На каждой такой связи локализован неспаренный электрон. В обычных условиях концентрация оборванных связей в аморфном кремнии невелика ( —10 —lO s см- ), поэтому взаимодействия между локализованными на связях магнитными моментами нет. Такое вещество представляет собой парамагнетик. Однако при высокой плотности оборванных связей, которую можно создать, облучая аморфный кремний ускоренными ионами инертных газов, возникает обменное взаимодействие, приводящее к ферромагнетизму.
[c.340]
Такое вещество представляет собой парамагнетик. Однако при высокой плотности оборванных связей, которую можно создать, облучая аморфный кремний ускоренными ионами инертных газов, возникает обменное взаимодействие, приводящее к ферромагнетизму.
[c.340]
Влияние примесей на электрические свойства аморфных полупроводников. Долгое время считалось, что аморфные полупроводники в отличие от кристаллических нечувствительны к введению в них примесей. Попытки легирования их атомами, которые в кристаллических полупроводниках являются донорами или акцепторами, не приводили к успеху. Одно из объяснений такого поведения было дано Губановым и несколько позднее Моттом. Оно сводится к тому, что в аморфных веществах может осуществляться такая перестройка связей, что все валентные электроны примесного атома будут участвовать в связях. Так, например, в кристаллическом кремнии атом фосфора образует четыре ковалентные связи. Пятый валентный электрон примесного атома в образовании связей не участвует. Предполагается, что в аморфном кремнии (или германии) атом фосфора окружен пятью атомами кремния (рис. 11.10). Если это так, то в аморфных полупроводниках не должны образовываться примесные уровни.
[c.364]
Предполагается, что в аморфном кремнии (или германии) атом фосфора окружен пятью атомами кремния (рис. 11.10). Если это так, то в аморфных полупроводниках не должны образовываться примесные уровни.
[c.364]
Ковалентная связь — связь в твердом теле, обусловленная обобществлением валентных электронов ближайших соседних атомов характеризуется выраженной направленностью. [c.282]
Линейные макромолекулы (рис. 8.5, а) имеют форму цепей, в которых атомы соединены между собой ковалентными связями. Отдельные цепи связаны межмолекулярными силами, в значительион степени определяющими свойства полимера. Наличие в цепях разветвлений (рис. 8.5, б) приводит к ослаблению межмолекулярных сил и тем самым к снижению температуры размягчения полимера. Пространственные структуры (рис. 8.5, й) получаются в результате химической связи (сшивки) отдельных цепей полимеров либо в результате поликонденсации или полимеризации. Большое значение для свойств сшитого полимера имеет частота поперечных связей. Если эти связи располагаются сравнительно редко, то образуется полимер с сетчатой структурой.
[c.427]
Если эти связи располагаются сравнительно редко, то образуется полимер с сетчатой структурой.
[c.427]
Ковалентная связь образуется в кристаллах некоторых простых веществ (алмаз, кремний) или в кристаллах сое-днпсний двух элементов, если они близки между собой по элект-роотрпцателыюсти (некоторые карбиды, нитриды и др.). В качестве идеального примера кристалла с ковалентной связью [c.8]
МОЖНО привести алмаз, в котором каждый атом углерода связан с четырьмя другими атомами углерода в направлении от центра тетраэдра к его вершинам (рис. 3). Таким образом создастся устойчивая восьмиэлектронная орбита около каждого атома углерода и вместе с тем каждый атом углерода приобретает по четыре ковалентных связи. Обилием ковалентных связей и высокой степенью симметрии решетки алмаза объясняется его исключительно высокая твердость. [c.9]
В ковалентных керамиках электронный газ отсутствует (рис. 4,6), а ковалентные связи затрудняют относительное перемещение атомов под действием нагрузок. Благодаря сильному сопротивлению со стороны соседних атомов в перемещении учаотвует меньшее количество атомов, т.е. диояокаций образуются более узкими по сравнению с металлами.
[c.10]
4,6), а ковалентные связи затрудняют относительное перемещение атомов под действием нагрузок. Благодаря сильному сопротивлению со стороны соседних атомов в перемещении учаотвует меньшее количество атомов, т.е. диояокаций образуются более узкими по сравнению с металлами.
[c.10]
В связи с затруднонвостью пластической деформации предел текучести у керамик фактически соответствует раэрушахщему напряжению. Пээ»ому керамики о ковалентной связью хрупки как в виде монокристаллов, так и в поликриоталличеокон состоянии. [c.10]
В ионных керамиках, в отлвчие от ковалентных, связи не направлены, Они определяются оу>шарныи влектростатичаским взаимодействием чередующихся цепочкой положительных и отрицательных ионов (рис. 4, в). [c.10]
Противополоокным предельным структурным типом являются полимеры с заглкнутой пространственной сетчатой структурой, где макромолекулы образованы мономерами, имеющими более двух активных связей, в результате чего получается двух- или трехмерная молекула. Основные ковалентные связи соединяют все звенья структуры, поэтОцу данные материалы лишь незначительно размягчаются при нагреве и разлагаются перед расплавлением. Такие полимеры являются основой термо-
[c.18]
Основные ковалентные связи соединяют все звенья структуры, поэтОцу данные материалы лишь незначительно размягчаются при нагреве и разлагаются перед расплавлением. Такие полимеры являются основой термо-
[c.18]
К полупроводниковым материалам относятся большинство минералов, неметаллические элементы IV, V и VI групп периодической системы Менделеева, неорганические соединения (оксиды, сульфиды), некоторые сплавы металлов. Наибольшее применение получили элементы IV группы — Ое и 51, обладающие тетрагональной кристаллической решеткой типа алмаза. В вершинах тетраэдра раеположены четыре атома, окружающие атом, находящийся в центре. Каждый атом связан с четырьмя ближайшими атомами силами ковалентной связи, поскольку все они обладают четырьмя внешними валентными электронами. [c.387]
Для разрыва ковалентных связей при весьма низких температурах необходима энергия около 0,1922 айж для 51 и около 0,1201 аджАля Ое. Идеальные кристаллы с одинаковым количеством электронов и дырок
[c. 387]
387]
Металлическая связь по своей природе имеет значительное сходство с ковалентной связью. В обоих случаях электронные орбиты сливаются, но в металле происходит обобщение не отдельных, а всех валентных электронных орбит. При этом устанавливаются общие уровни энергии во всем объеме кристалла. Число уровней будет одного порядка с числом атомов в данном )бъеме металла. Уровни весьма близки между собой и образуют нергетические полосы или зоны, которые иногда рассматривают как расщепление валентных уровней (орбит) отдельных атомов. [c.10]
Например, при контакте полиамидного клея со сталью возникают химические соединения, где атом азота (полиамида) делит свои два электрона с атомами железа (стали). Одновременно между атомами кетогруппы С=0 и атомом кислорода в оксиде железа возникает дополнительная ионная связь. Таким образом, возникает так называемое хелатное соединение. Другие клеи (на основе толуилендиизоцианитов) при взаимодействии с атомами кремния (стекла) образуют ковалентные связи. [c.16]
[c.16]
Энергия взаимодействия двух парамагШггных молекул оценивается в 400-4000 кДж/моль, что сравнимо с энергией ковалентной связи, поэтому именно свободные парамагнитные радикалы будут образовывать ядро ССЕ, ассоциируя вокруг себя сольватные слои, состоящие, в основном, из диамагнитных соединений нафтено-резонансного взаимодействия свободных радикалов с диамагнитными молекулами и мультипопь-мультипольного взаимодействия диамагнитных молекул между собой. [c.154]
Один из основных вкладов в Е(г) вносит первый член, соответствующий взаимодействию двух свободных радикалов, образующих ковалентную связь. Знак » -» в формуле (3.15) определяет притяжение свободных радикалов в случае отсутствия стерических затруднений. Для нейтральных молекул, в которых отсутствуют ыеспаренные электроны, первый член определяет энергию отталкивания, возникающую вследствие заполненности орбиталей атомов соседних молекул. [c.160]
Долю частично ионного характера (степень ионности или ионность) ковалентной связи можно оценить, если известны элекгроотрицательности взаимодействующих атомов А и В. Заметим, что при анализе характера связи обычно прннято рассматривать не сами электроотрицательности, а разность электроотрицательностей взаимодействующих атомов.
[c.59]
Заметим, что при анализе характера связи обычно прннято рассматривать не сами электроотрицательности, а разность электроотрицательностей взаимодействующих атомов.
[c.59]
Ковалентная связь имеет то же происхождение, что и связь в гамополярных молекулах (Нг, СЬ, Ь,.- ), она обусловлена обменным электронным взаимодействием между атомами. В молекулярных кристаллах (Нг, СЬ, Ь,—) ковалентная связь локализована между ядрами в молекуле, молекулы удерживаются вместе слабыми силами Ван-дер-Ваальса. Однако в случае алмаза или графита несколько валентных электронов являются общими для атома и ряда его соседей, и поэтому невозможно выделить какую-либо группу атомов, которую можно рассматривать как химически насыщенную (рис. 2.7). С этой точки зрения кристалл алмаза представляет собой огромную молекулу. [c.75]
Названные специфические свойства, по-существу, обусловлены наличием в металлах свободных электронов. Металлическая связь возникает при взаимодействии атомов электрополоэ/сительных элементов, внешние валентные электроны которых связаны с ядром относительно слабо. При образовании твердого состояния в результате перекрытия волновых функций металлических атомов (например, атомов Na) движение электронов, как и в случае ковалентной связи, претерпевает радикальное изменение, и электроны обобществляются. При этом каждая соседняя пара электронов предпочла бы образовать молекулу, с тем чтобы поделить себя между двумя атомами. Но у калтвердом состоянии имеется в среднем восемь соседей и только один валентный электрон,, который должен быть поделен с каждым из этих соседей. В отличие от случая ковалентной связи, когда пара электронов, в основном, курсирует между двумя соседними атомами, коллективизированному электрону в металле приходится совершать довольно сложный путь, посещая по очереди каждый атом (положительный ион) твердого тела. В описанной ситуации все ионы обладают всеми электронами вместе, а электроны могут свободно перемещаться от одного иона к- другому.
[c.82]
При образовании твердого состояния в результате перекрытия волновых функций металлических атомов (например, атомов Na) движение электронов, как и в случае ковалентной связи, претерпевает радикальное изменение, и электроны обобществляются. При этом каждая соседняя пара электронов предпочла бы образовать молекулу, с тем чтобы поделить себя между двумя атомами. Но у калтвердом состоянии имеется в среднем восемь соседей и только один валентный электрон,, который должен быть поделен с каждым из этих соседей. В отличие от случая ковалентной связи, когда пара электронов, в основном, курсирует между двумя соседними атомами, коллективизированному электрону в металле приходится совершать довольно сложный путь, посещая по очереди каждый атом (положительный ион) твердого тела. В описанной ситуации все ионы обладают всеми электронами вместе, а электроны могут свободно перемещаться от одного иона к- другому.
[c.82]
По возможности размещения междоузельных атомов структуры с ионной связью занимают промежуточное положение между плот-ноупакованными металлами и полупроводниками с ковалентной связью. Несмотря на то что геометрия решетки оставляет для них некоторое пространство, ионы часто сильно различаются по объему и в результате упаковка получается довольно-таки плотной. Поэтому вероятность появления междоузельных атомов в ионных соединениях сильно изменяется от одного веш,ества к другому.
[c.87]
Несмотря на то что геометрия решетки оставляет для них некоторое пространство, ионы часто сильно различаются по объему и в результате упаковка получается довольно-таки плотной. Поэтому вероятность появления междоузельных атомов в ионных соединениях сильно изменяется от одного веш,ества к другому.
[c.87]
Менделеева, например атомом бора. n=i Три валентных электрона атома бора образуют три ковалентные связи с соседними атомами германия, а четвертая связь otTaeT H незавершенной. — — =1 [c.239]
Клаузиуса — Мосоттн формула 294 Ковалентная связь 58, 75, 81 Ковалентные кристаллы 55 Колебания решетки 141, 158 Координационное число 31 Коэрцитивная сила 345 Коэффициент диффузии 201, 202,204 [c.383]
ковалентная связь | Определение, свойства, примеры и факты
Ковалентная связь , в химии, межатомная связь, которая возникает в результате совместного использования пары электронов между двумя атомами. Связывание возникает из-за электростатического притяжения их ядер к одним и тем же электронам. Ковалентная связь образуется, когда связанные атомы имеют более низкую общую энергию, чем у широко разделенных атомов.
Связывание возникает из-за электростатического притяжения их ядер к одним и тем же электронам. Ковалентная связь образуется, когда связанные атомы имеют более низкую общую энергию, чем у широко разделенных атомов.
В полярных ковалентных связях, например, между атомами водорода и кислорода, электроны не передаются от одного атома к другому, поскольку они находятся в ионной связи.Вместо этого некоторые внешние электроны просто проводят больше времени рядом с другим атомом. Эффект этого орбитального искажения состоит в том, чтобы вызвать региональные сетевые заряды, которые удерживают атомы вместе, например, в молекулах воды.
Британская энциклопедия, Inc.Подробнее по этой теме
кристалл: ковалентные связи
Кремний, углерод, германий и некоторые другие элементы образуют твердые тела с ковалентными связями.В этих элементах есть четыре электрона во внешнем . ..
..
Далее следует краткое рассмотрение ковалентных связей. Для полной обработки, см. Химическая связь: Ковалентные связи.
Молекулы с ковалентными связями включают неорганические вещества: водород, азот, хлор, воду и аммиак (H 2 , N 2 , Cl 2 , H 2 O, NH 3 ) вместе с все органические соединения. В структурных представлениях молекул ковалентные связи обозначены сплошными линиями, соединяющими пары атомов; e.г.,
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Одинарная линия указывает на связь между двумя атомами (, т. Е. с участием одной пары электронов), двойные линии (=) указывают на двойную связь между двумя атомами ( т. Е. с участием двух электронных пар), а тройные линии (≡) представляют собой тройную связь, обнаруженную, например, в монооксиде углерода (C≡O). Одинарные связи состоят из одной сигма (σ) связи, двойные связи имеют одну σ и одну пи (π) связь, а тройные связи имеют одну σ и две π связи.
Идея о том, что два электрона могут быть разделены между двумя атомами и служить связующим звеном между ними, была впервые представлена в 1916 году американским химиком Г. Льюис, который описал образование таких связей как результат стремления определенных атомов объединяться друг с другом, чтобы оба имели электронную структуру соответствующего атома благородного газа.
Ковалентные связи являются направленными, что означает, что атомы, связанные таким образом, предпочитают определенные ориентации относительно друг друга; это, в свою очередь, придает молекулам определенные формы, как в угловой (изогнутой) структуре молекулы H 2 O.Ковалентные связи между идентичными атомами (как в H 2 ) неполярны — , т. Е. электрически однородны — в то время как связи между разнородными атомами полярны — т. Е. , один атом заряжен слегка отрицательно, а другой — положительно. Этот частичный ионный характер ковалентных связей усиливается с разницей в электроотрицательности двух атомов. См. Также ионную связь .
См. Также ионную связь .
Ковалентные связи против ионных облигаций
- Последнее обновление
- Сохранить как PDF
- Участники и авторства
Есть два типа атомных связей — ионные связи и ковалентные связи.Они различаются по своей структуре и свойствам. Ковалентные связи состоят из пар электронов, общих для двух атомов, и связывают атомы в фиксированной ориентации. Для их расщепления требуется относительно высокая энергия (50 — 200 ккал / моль). Могут ли два атома образовывать ковалентную связь, зависит от их электроотрицательности, то есть способности атома в молекуле притягивать электроны к себе. Если два атома значительно различаются по своей электроотрицательности — как натрий и хлорид, — тогда один из атомов потеряет свой электрон в пользу другого атома. В результате образуются положительно заряженный ион (катион) и отрицательно заряженный ион (анион). Связь между этими двумя ионами называется ионной связью.
В результате образуются положительно заряженный ион (катион) и отрицательно заряженный ион (анион). Связь между этими двумя ионами называется ионной связью.
| Ковалентные облигации | Ионные связи | |
|---|---|---|
| Состояние при комнатной температуре: | Жидкость или газ | твердый |
| Полярность: | Низкий | Высокая |
| Образование: | Ковалентная связь образуется между двумя неметаллами, имеющими схожую электроотрицательность. Ни один из атомов не является «достаточно сильным», чтобы притягивать электроны друг к другу. Для стабилизации они делятся своими электронами с внешней молекулярной орбиты с другими Ни один из атомов не является «достаточно сильным», чтобы притягивать электроны друг к другу. Для стабилизации они делятся своими электронами с внешней молекулярной орбиты с другими | Ионная связь образуется между металлом и неметаллом. Неметаллы (-ve-ион) «сильнее» металла (+ ve-ион) и могут очень легко получать электроны из металла. Эти два противоположных иона притягиваются друг к другу и образуют ионную связь. |
| Форма: | Четкая форма | Нет определенной формы |
| Точка плавления: | низкий | Высокая |
| Что это такое ?: | Ковалентная связь — это форма химической связи между двумя неметаллическими атомами, которая характеризуется разделением пар электронов между атомами и другими ковалентными связями. | Ионная связь, также известная как электровалентная связь, представляет собой тип связи, образованный электростатическим притяжением между противоположно заряженными ионами в химическом соединении. Такие связи возникают в основном между металлическим и неметаллическим атомами. |
| Точка кипения: | Низкий | Высокая |
| Примеры: | Метан (CH 4 ), соляная кислота (HCl) | Хлорид натрия (NaCl), серная кислота (H 2 SO 4 ) |
| Происходит между: | Два неметалла | Один металлический и один неметаллический |
Авторы и авторство
Ковалентная связь | Определение ковалентной связи в словаре.
 com
comсуществительное Химия.
связь, образованная разделением пары электронов двумя атомами.
ВОПРОСЫ
ПРОГНОЗИРУЙТЕ СЕБЯ НА СКЛАДКИ И КРОНШТЕЙНЫ АБСОЛЮТНО!
Выделите немного времени, чтобы проверить свои знания символов скобок, и посмотрите, сможете ли вы сохранить прямые скобки, квадраты, завитки и углы!
Вопрос 1 из 7
Давайте начнем с этимологии: каково происхождение типографского слова «скобка»?
Происхождение ковалентной связи
Впервые зарегистрировано в 1960–65 гг.
Слова рядом с ковалентной связью
кузин, COV, ковалентность, ковалентность, ковалентная связь, ковалентная связь, ковариантность, ковариантность, теория ковариантов, ковариант, Словарь Covarrubias.com Несокращенный На основе Несокращенного словаря Random House, © Random House, Inc. 2021
Примеры предложений из Интернета для ковалентной связи
.expandable-content {display: none;}. Css-12x6sdt.expandable. content-extended> .expandable- content {display: block;}]]>
content-extended> .expandable- content {display: block;}]]>Но да, я представил себе, как к ней подходит типичный Джеймс Бонд.
Неспособность привязаться к своим родителям была основной причиной, по которой детей отдавали.
Без записи и без ордеров, на следующее утро судья дал ему четырехзначный залог.
Брак — это связь и обязательство; жениться на себе смешно, потому что вы уже женаты на себе.
Он был освобожден в течение часа без залога под подписку о невыезде.
Я написал ей и миссис Конингсби; и она совершенно свободна: все узы разорваны, кроме сердечных.
Узы брака казались проклятой вещью, простым рабством женщин.
Из темного крыльца, в десяти шагах по Бонд-стрит, появилась крепкая фигура, шагнувшая в нескольких ярдах позади Грея.
Давняя надежда рассеялась, когда, посмотрев направо и налево на Бонд-стрит, он не заметил пропавшую пару.

Пройдя десять шагов по Бонд-стрит, он натолкнулся на небольшую сутулую фигуру, которая оторвалась от тени двери магазина.
Изучить Dictionary.com
li {-webkit-flex-based: 49%; — ms-flex-предпочтительный-размер: 49%; flex-base : 49%;} @ экран только мультимедиа и (max-width: 769px) {.css-2jtp0r> li {-webkit-flex-base: 49%; — ms-flex-предпочтительный-размер: 49%; flex-base: 49%;}} @ media only screen and (max-width: 480px) { .css-2jtp0r> li {-webkit-flex-base: 100%; — ms-flex-предпочтительный размер: 100%; flex-base: 100%;}}]]>Определения ковалентной связи в Британском словаре
существительное
тип химической связи, включающий совместное использование электронов между атомами в молекуле, особенно разделение пары электронов двумя соседними атомами
Collins English Dictionary — Complete & Unabridged 2012 Digital Edition © William Collins Sons & Co.Ltd. 1979, 1986 © HarperCollins Publishers 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Медицинские определения ковалентной связи
n.
Химическая связь, образованная разделением одного или нескольких электронов, особенно пар электронов, между атомами.
Медицинский словарь American Heritage® Stedman’s Авторские права © 2002, 2001, 1995 компании Houghton Mifflin. Опубликовано компанией Houghton Mifflin.
Научные определения ковалентной связи
Химическая связь, образующаяся, когда электроны разделяются между двумя атомами.Обычно каждый атом вносит один электрон, чтобы сформировать пару электронов, которые являются общими для обоих атомов. Подробнее см. Координатная связь, двойная связь, полярная связь
Научный словарь американского наследия® Авторские права © 2011. Издано издательской компанией Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Культурные определения ковалентной связи
примечания для ковалентной связи
Многие молекулы в живых системах удерживаются вместе ковалентными связями.Новый словарь культурной грамотности, третье издание Авторские права © 2005 издательской компании Houghton Mifflin Harcourt.Опубликовано Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Прочие — это Readingli {-webkit-flex-base: 100%; — ms-flex-предпочтительный размер: 100%; flex-base: 100%;} @ media only screen и (max-width: 769px) {. Css -1uttx60> li {-webkit-flex-base: 100%; — ms-flex-предпочтительный-размер: 100%; flex-base: 100%;}} @ экран только мультимедиа и (max-width: 480px) {. css-1uttx60> li {-webkit-flex-base: 100%; — ms-flex-preferred-size: 100%; flex-based: 100%;}}]]>Глава 4 — Ковалентные связи и молекулярные соединения — Химия
Глава 4 — Ковалентные связи и молекулярные соединенияЭтот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
4,1 Введение в ковалентные молекулы и соединения Как распознать ковалентные облигации 4.2 Обмен электронами Одинарные ковалентные связи между одинаковыми атомами Одинарные ковалентные связи между разными атомами Множественные ковалентные связи Координатно-ковалентные связи 4.3 Электроотрицательность и полярность связи 4.4 Свойства молекулярных соединений 4.5 Обозначение бинарных молекулярных соединений 4.6 Краткое содержание главы 4,7 СсылкиГлава 4 — Ковалентные связи и молекулярные соединения
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные. В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, а лежат в спектре между этими крайностями.Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, которые редко встречаются в каких-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает объяснить, почему вещества с разными типами химических связей имеют очень разные свойства. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, которые представляют собой группы атомов, в которых одна или несколько пар электронов совместно используются связанными атомами.В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. В этой главе основное внимание будет уделено свойствам ковалентных соединений.
4,1 Введение в ковалентные молекулы и соединенияТак же, как атом — это простейшая единица, обладающая фундаментальными химическими свойствами элемента, молекула — простейшая единица, обладающая фундаментальными химическими свойствами ковалентного соединения.Таким образом, термин молекулярное соединение используется для описания элементов, которые связаны ковалентными связями, и для отличия этих соединений от ионных соединений. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («двухатомных») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , и I 2 (часть (a) на рисунке 4.1). Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые представлены как P 4 и S 8 (часть (b) на рисунке 4.1).
Рис. 4.1 Элементы, которые существуют как ковалентные молекулы. (a) Некоторые элементы естественным образом существуют в виде двухатомных молекул, в которых два атома (E) соединены одной или несколькими ковалентными связями с образованием молекулы с общей формулой E2. (б) Некоторые элементы естественным образом существуют в виде многоатомных молекул, которые содержат более двух атомов. Например, фосфор существует в виде тетраэдров P4 — правильных многогранников с четырьмя треугольными сторонами — с атомом фосфора в каждой вершине. Элементарная сера состоит из сморщенного кольца из восьми атомов серы, соединенных одинарными связями.Селен не показан из-за сложности его структуры.
Каждое ковалентное соединение представлено молекулярной формулой, которая дает атомный символ для каждого составляющего элемента в заданном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс пишется только в том случае, если количество атомов больше 1. Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как H 2 O. Точно так же диоксид углерода, который содержит один атом углерода. и два атома кислорода в каждой молекуле записываются как CO 2 .
Ковалентные соединения, которые преимущественно содержат углерод и водород, называются органическими соединениями . При представлении формул органических соединений сначала пишут углерод, затем водород, а затем любые другие элементы в алфавитном порядке (например, CH 4 O — это метиловый спирт, топливо). Соединения, состоящие в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями ; они включают как ковалентные, так и ионные соединения.Условие написания неорганических соединений включает перечисление составляющих элементов, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в той же группе, перечислены, начиная с нижнего элемента и постепенно увеличиваясь, как в ClF. Однако по соглашению, когда неорганическое соединение содержит и водород, и элемент из групп 13-15, водород обычно указывается в формуле последним. Примерами являются аммиак (NH 3 ) и силан (SiH 4 ).Такие соединения, как вода, состав которых был установлен задолго до принятия этого соглашения, всегда сначала пишется с водородом: вода всегда записывается как H 2 O, а не как OH 2 . Обычно это отличает, когда водород участвует в ковалентной связи, а не в ионном взаимодействии, как это видно во многих неорганических кислотах, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), как описано в Глава 3.
Как распознать ковалентные облигации
В главе 3 мы увидели, что ионные соединения состоят преимущественно из металла + неметалла.С другой стороны, ковалентные молекулы обычно состоят из двух неметаллов или неметалла и металлоида. Это первоначальный метод скрининга, который вы можете использовать для разделения соединений на ионную или ковалентную.
Рис. 4.2. Распознавание ионных и ковалентных соединений. Обычно соединения, которые образованы из комбинации металла с неметаллом, имеют более характерную ионную связь, тогда как соединения, образованные из двух неметаллов или металлоида и неметалла, имеют более ковалентный характер.Хотя соединения обычно находятся в спектре где-то между полностью ионным и полностью ковалентным характером, для целей наименования это руководство работает хорошо.
4.2 Обмен электронами Одинарные ковалентные связи между одинаковыми атомами
В главе 3 описывается, как электроны могут передаваться от одного атома к другому, чтобы оба атома имели энергетически стабильную внешнюю электронную оболочку в соответствии с правилом октетов .Однако есть еще один способ, которым атом может достичь полной валентной оболочки: атомы могут совместно использовать электроны, чтобы достичь состояния октета (или состояния дуэта в случае водорода).
Эту концепцию можно проиллюстрировать на примере двух атомов водорода, каждый из которых имеет по одному электрону на валентной оболочке. (Для небольших атомов, таких как атомы водорода, валентная оболочка будет первой оболочкой, содержащей только два электрона.) Мы можем представить два отдельных атома водорода следующим образом:
В этой ситуации ни один водород не может достичь предпочтительного дуэтного состояния.Напротив, когда два атома водорода сближаются достаточно близко друг к другу, чтобы поделиться своими электронами, их можно представить следующим образом:
Благодаря совместному использованию валентных электронов оба атома водорода теперь имеют по два электрона в соответствующих валентных оболочках. Поскольку каждая валентная оболочка теперь заполнена, это расположение более стабильно, чем когда два атома разделены. В этой конфигурации каждый водород имеет электронную конфигурацию, эквивалентную конфигурации благородного газа, гелия. Распределение электронов между атомами называется ковалентной связью , а два электрона, которые соединяют атомы ковалентной связью, называются связывающей парой электронов .Дискретная группа атомов, связанных ковалентными связями, называется молекулой — наименьшая часть соединения, которая сохраняет химическую идентичность этого соединения. Например, одна молекула воды будет содержать два атома водорода и один атом кислорода (H 2 O).
Химики часто используют электронные точечные диаграммы Льюиса для представления ковалентных связей в молекулярных веществах. Например, диаграммы Льюиса двух отдельных атомов водорода выглядят следующим образом:
Диаграмма Льюиса двух атомов водорода, разделяющих электроны, выглядит так:
Это изображение молекул дополнительно упрощено за счет использования тире для обозначения ковалентной связи.Молекула водорода тогда представлена следующим образом:
Помните, что прочерк, также называемый одинарной связью, представляет пару связывающих электронов.
Связь в молекуле водорода, измеренная как расстояние между двумя ядрами, составляет примерно 7,4 × 10 −11 м, или 74 пикометра (пм; 1 пм = 1 × 10 -12 м). Эта конкретная длина связи представляет собой баланс между несколькими силами: (1) притяжением между противоположно заряженными электронами и ядрами, (2) отталкиванием между двумя отрицательно заряженными электронами и (3) отталкиванием между двумя положительно заряженными ядрами.Если бы ядра были ближе друг к другу, они бы отталкивали друг друга сильнее; если бы ядра были дальше друг от друга, между положительными и отрицательными частицами было бы меньше притяжения.
Фтор — еще один элемент, атомы которого соединяются попарно, образуя двухатомные (двухатомные) молекулы. Два отдельных атома фтора имеют следующие электронные точечные диаграммы:
Каждый атом фтора вносит один валентный электрон, образуя одинарную связь и давая каждому атому полную валентную оболочку, что соответствует правилу октетов:
Кружки показывают, что вокруг каждого атома фтора восемь электронов.Как и в случае с водородом, мы можем изобразить молекулу фтора с чертой вместо связывающих электронов:
Каждый атом фтора имеет шесть электронов или три пары электронов, которые не участвуют в ковалентной связи. Считается, что они не являются общими, а принадлежат одному атому. Их называют несвязывающих пар (или неподеленных пар) электронов.
Одинарные ковалентные связи между разными атомами
Теперь, когда мы рассмотрели распределение электронов между атомами одного и того же элемента, давайте посмотрим на образование ковалентных связей между атомами разных элементов.Рассмотрим молекулу, состоящую из одного атома водорода и одного атома фтора:
Каждому атому требуется один дополнительный электрон для завершения своей валентной оболочки. Каждый вкладывая один электрон, они образуют следующую молекулу:
В этой молекуле атом водорода не имеет несвязывающих электронов, а атом фтора имеет шесть несвязывающих электронов (три неподеленные электронные пары). Кружками показано, как заполнены валентные электронные оболочки обоих атомов (напомним, что водород заполнен двумя электронами).
Более крупные молекулы построены аналогичным образом, при этом некоторые атомы участвуют в более чем одной ковалентной связи. Например, воду с двумя атомами водорода и одним атомом кислорода и метан (CH 4 ) с одним атомом углерода и четырьмя атомами водорода можно представить следующим образом:
Атомы обычно образуют характерное количество ковалентных связей в соединениях. На рис. 4.3 показаны конфигурации валентных электронов каждого семейства элементов (или столбца).
Рис 4.3 Периодическая таблица со структурами Льюиса. Каждое семейство показывает репрезентативную структуру Льюиса для этой группы элементов. Для неметаллов (семейства 4A, 5A, 6A и 7A) они могут принимать дополнительное количество общих связей для достижения состояния октета. Семейство 4A может разделять 4 ковалентные связи (4 + 4 = 8), тогда как семейства 5A, 6A и 7A могут разделять 3, 2 и 1 ковалентные связи, соответственно, для достижения состояния октета. Исключения из правила октетов существуют. Например, водород можно рассматривать как принадлежащий к Группе 1 или Группе 7A, поскольку он имеет свойства, аналогичные свойствам обеих групп.Водород может участвовать как в ионном, так и в ковалентном связывании. Участвуя в ковалентной связи, водороду нужны только два электрона, чтобы иметь полную валентную оболочку. Поскольку у него вначале один электрон, он может образовывать только одну ковалентную связь. Точно так же бор имеет 3 электрона на внешней оболочке. Этот неметалл обычно образует 3 ковалентные связи, имея максимум 6 электронов на внешней оболочке. Таким образом, бор никогда не может достичь октетного состояния. Другие атомы могут иметь расширенные орбитали и принимать дополнительные ковалентные связи.Два из них, которые важны для живых систем, — это сера и фосфор. По правилу октетов сера может образовывать 2 ковалентные связи, а фосфор — 3 ковалентные связи. Сера также может иметь расширенные орбитали, чтобы принимать 4 или 6 ковалентных связей, а фосфор может расширяться до 5 ковалентных связей.
Множественные ковалентные связи
Во многих молекулах правило октетов не выполнялось бы, если бы каждая пара связанных атомов разделяла только два электрона. Рассмотрим диоксид углерода (CO 2 ).Если у каждого атома кислорода один электрон с атомом углерода, мы получим следующее:
Это не дает атомам углерода или кислорода полный октет; Атом углерода имеет только шесть электронов в своей валентной оболочке, а каждый атом кислорода имеет только семь электронов в своей валентной оболочке. Таким образом, ни один из атомов не может достичь состояния октета в текущей конфигурации. Как написано, это будет нестабильная молекулярная конформация.
Иногда два атома должны использовать более одной пары электронов, чтобы оба атома имели октет.В диоксиде углерода второй электрон от каждого атома кислорода также делится с центральным атомом углерода, а атом углерода делит еще один электрон с каждым атомом кислорода:
В этом расположении атом углерода делит четыре электрона (две пары) с атомом кислорода слева и четыре электрона с атомом кислорода справа. Теперь вокруг каждого атома восемь электронов. Две пары электронов, общие для двух атомов, образуют двойную связь между атомами, которая обозначается двойным тире:
Некоторые молекулы содержат тройные связи, ковалентные связи, в которых три пары электронов разделяются двумя атомами.Простое соединение с тройной связью — это ацетилен (C 2 H 2 ), диаграмма Льюиса которого выглядит следующим образом:
Координатно-ковалентные связи
Координатная связь (также называемая дательной ковалентной связью) — это ковалентная связь (общая пара электронов), в которой оба электрона происходят от одного и того же атома. Ковалентная связь образована двумя атомами, разделяющими пару электронов. Атомы удерживаются вместе, потому что электронная пара притягивается обоими ядрами.При образовании простой или обычной ковалентной связи каждый атом поставляет один электрон на связь, но это не обязательно. В случае координатной ковалентной связи один атом поставляет оба электрона, а другой атом не поставляет ни один из электронов. Следующая реакция между аммиаком и соляной кислотой демонстрирует образование координированной ковалентной связи между аммиаком и ионом водорода (протоном).
Если позволить этим бесцветным газам смешаться, образуется густой белый дым твердого хлорида аммония.
Общая реакция
NH 3 (г) + HCl (г) → NH 4 Cl (т)
Ионы аммония, NH 4 + , образуются в результате переноса иона водорода (протона) от молекулы соляной кислоты к неподеленной паре электронов на молекуле аммиака. Чтобы визуализировать эту реакцию, мы можем использовать конфигурации электронных точек, чтобы наблюдать движение электронов во время реакции. Сначала вспомните состояния валентных электронов для всех атомов, участвующих в реакции:
В левой части уравнения (слева от стрелки) указаны реагенты реакции (аммиак и соляная кислота).Справа от реакции (справа от стрелки) находится продукт реакции, ионное соединение — хлорид аммония. На диаграмме ниже показано движение электронов и протонов во время реакции.
Рис. 4.4 Образование хлорида аммония. Когда образуется ион аммония, NH 4 + , четвертый водород (показан красным) присоединяется координатной ковалентной связью, потому что только ядро водорода передается от хлора к азоту.Электрон водорода остается на хлоре, образуя отрицательный ион хлорида. После образования иона аммония невозможно отличить координационные ковалентные связи от обычных ковалентных, все атомы водорода в молекуле эквивалентны, а дополнительный положительный заряд распределен по всей молекуле. Хотя электроны на схеме показаны по-разному, в действительности между ними нет никакой разницы. На простых схемах координатная связь показана изогнутой стрелкой.Стрелка указывает от атома, дающего неподеленную пару, к атому, принимающему ее.
4.3 Электроотрицательность и полярность связи
Хотя мы определили ковалентную связь как совместное использование электронов, электроны в ковалентной связи не всегда одинаково распределяются между двумя связанными атомами. Если связь не соединяет два атома одного и того же элемента, всегда будет один атом, который притягивает электроны в связи сильнее, чем другой атом, как показано на рисунке 4.5. Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначенного δ−) на одной стороне связи и некоторого положительного заряда (обозначенного δ +) на другой стороне связи. . Ковалентная связь с неравномерным распределением электронов, как в части (b) на рисунке 4.5, называется полярной ковалентной связью . Ковалентная связь с равным распределением электронов (часть (а) на рисунке 4.5) называется неполярной ковалентной связью .
Рис. 4.5 Полярные и неполярные ковалентные связи. (a) Электроны в ковалентной связи в равной степени разделяются обоими атомами водорода. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов. Это полярная ковалентная связь.
Любая ковалентная связь между атомами разных элементов является полярной связью, но степень полярности сильно различается.Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, когда электроны передаются полностью, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность , которая является относительной мерой того, насколько сильно атом притягивает электроны, когда образует ковалентную связь.
Существуют различные числовые шкалы для оценки электроотрицательности.На рис. 4.6 показана одна из самых популярных — шкала Полинга . О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях между двумя атомами, образующими связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс распределения электронов в связи.
Рисунок 4.6 Электроотрицательность различных элементов. Шкала Полинга для электроотрицательностей имеет значение для атомов фтора, равное 4.0, максимальное значение.
Хотя жестких правил не существует, общее правило состоит в том, что разница в электроотрицательности менее 0,4 указывает на то, что связь неполярна; когда разница больше 0,4, связь считается полярной. Когда разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разница электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.Примеры разницы электроотрицательностей показаны на рисунке 4.7.
Рисунок 4.7 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Когда связи молекулы полярны, молекула в целом может демонстрировать неравномерное распределение заряда в зависимости от того, как ориентированы отдельные связи. Например, ориентация двух связей O – H в молекуле воды (рис. 4.8) изогнута: один конец молекулы имеет частичный положительный заряд, а другой конец — частичный отрицательный. Короче говоря, сама молекула полярна. Полярность воды оказывает огромное влияние на ее физические и химические свойства.(Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга в молекуле и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа. (Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
Рисунок 4.8 Физические свойства и полярность. На физические свойства воды (a) и углекислого газа (b) влияет их молекулярная полярность. Обратите внимание, что стрелки на диаграмме всегда указывают в направлении, где электроны более сильно притягиваются. На этой диаграмме символ дельта (δ) используется с символом (+) или (-) для представления распределения частичного положительного и частичного отрицательного заряда в полярных ковалентных связях. Обратите внимание, что электроны, связанные с полярными ковалентными связями, будут притягиваться и проводить больше времени вокруг атома с более высоким значением электроотрицательности.Когда полярности равны и прямо противоположны, как в случае диоксида углерода (b), вся молекула не будет иметь общего заряда.
(ВЕРНУТЬСЯ В ТОП)
4.4 Свойства молекулярных соединений
Молекулярные соединения обладают многими свойствами, которые отличаются от ионных соединений. Некоторые из обобщений для этой группы включают гораздо более низкие температуры плавления и кипения по сравнению с их ионными аналогами.Например, вода (H 2 O) имеет точку плавления 4 o C и точку кипения 100 o C по сравнению с NaCl, который имеет точку плавления 801 o C и температуру кипения 1,413 o C. Это связано с тем, что полные заряды, созданные в ионных связях, имеют гораздо более сильную силу притяжения, чем сравнительно слабые частичные заряды, созданные в ковалентных молекулах. таким образом, ионные соединения имеют тенденцию к образованию очень прочных структур кристаллической решетки из-за повторяющихся зарядов катионных и анионных компонентов.С другой стороны, ковалентные соединения обычно не имеют такой хорошо структурированной трехмерной формы. Таким образом, они имеют тенденцию быть более хрупкими и легче ломаться в твердой форме, и многие из них находятся в жидкой и газовой фазах. Кроме того, из-за отсутствия заряда они, как правило, плохо проводят электричество и тепло. Многие из них также нерастворимы в воде из-за их неполярной природы (т.е. масло и вода не смешиваются).
В таблице 4.1 показаны общие различия между ковалентными и ионными соединениями.
Таблица 4.1 Сравнение ионных и ковалентных соединений
4.5 Обозначение бинарных молекулярных соединенийНапомним, что молекулярная формула показывает количество атомов каждого элемента, содержащегося в молекуле. Молекула воды содержит два атома водорода и один атом кислорода, поэтому ее формула H 2 O. Молекула октана, который является компонентом бензина, содержит 8 атомов углерода и 18 атомов водорода. Молекулярная формула октана: C 8 H 18 .При написании химической формулы элемент, который является наименее электроотрицательным (элемент, который находится левее или ниже в одной и той же группе семейства), записывается первым, а более электроотрицательный элемент записывается вторым. Вам потребуется знать, как называть простые бинарные ковалентные соединения (соединения, состоящие из двух разных элементов)
.
Рис. 4.9 Двуокись азота (NO 2 ) — это красновато-коричневый токсичный газ, который является заметным загрязнителем воздуха, вырабатываемым двигателями внутреннего сгорания.
Элементы, которые образуют бинарные молекулярные соединения, являются как атомами неметалла, так и комбинацией неметалла и металлоида. Это контрастирует с ионными соединениями, которые были образованы из иона металла и иона неметалла. Следовательно, бинарные молекулярные соединения различны, потому что ионные заряды не могут использоваться для их названия или записи их формул. Другое отличие состоит в том, что два неметаллических атома часто сочетаются друг с другом в различных соотношениях.Рассмотрим элементы азот и кислород. Они объединяются, чтобы образовать несколько соединений, включая
НЕТ, НЕТ 2 и N 2 OВсе они не назовешь оксидом азота. Как кто-то узнает, о чем вы говорите? Каждое из трех соединений имеет очень разные свойства и реакционную способность. Необходима система для различения таких соединений.
Префиксы используются в названиях бинарных молекулярных соединений для определения количества атомов каждого элемента.В таблице ниже указаны префиксы до десяти.
Таблица 4.2 Префиксы, используемые для номенклатуры бинарных ковалентных молекул
Правила использования префиксной системы номенклатуры бинарных соединений можно резюмировать следующим образом.
- Обычно менее электроотрицательный элемент указывается в формуле первым, хотя есть несколько исключений. Исключение 1 : Углерод всегда стоит на первом месте в формуле. Исключение 2: Когда водород участвует в ковалентной связи, это обычно записывается во второй позиции (например: водород стоит после азота в такой формуле, как NH 3 ) В целом, порядок обычных неметаллов в бинарных молекулярных соединения: C, P, N, H, S, I, Br, Cl, O,
- При присвоении имени первому элементу используйте полное имя элемента и соответствующий префикс, если в формуле содержится более одного атома этого элемента.Если есть только один атом для первого элемента, термин моно НЕ используется, но подразумевается. Например, CO — это монооксид углерода, а не монооксид углерода.
- Для второго элемента окончание имени элемента обычно изменяется на « -ide» , а соответствующий префикс — , всегда , используемый для второго элемента.
Примечание: a или o в конце префикса обычно удаляются из имени, когда имя элемента начинается с гласной.Например, четыре атома кислорода представляют собой тетроксид вместо тетраоксида. Некоторые примеры молекулярных соединений перечислены в таблице 4.3.
Таблица 4.3 Примеры наименования ковалентных молекул
Обратите внимание, что префикс mono- не используется с азотом в первом соединении, но используется с кислородом в обоих первых двух примерах. В стандарте S 2 Cl 2 подчеркивается, что формулы молекулярных соединений не сводятся к их наименьшим соотношениям. или моно- и и гепта- исключаются из названия в сочетании с оксидом. Например:
4.6 Резюме главы
Атомы могут иметь общие пары валентных электронов для получения октета валентной оболочки. Это разделение электронов представляет собой ковалентную связь . Частица, образованная ковалентно связанными атомами, представляет собой молекулу и представлена молекулярной формулой , которая дает количество атомов каждого типа в молекуле.Два электрона, связанных ковалентной связью, называются связывающей парой электронов . Электроны, не участвующие в ковалентных связях, называются несвязывающими парами (или неподеленными парами ) электронами . Ковалентная связь, состоящая из одной пары общих электронов, называется одинарной связью .
Ковалентные связи возникают между атомами неметаллов. При присвоении имен простым ковалентным соединениям следуют простым правилам, аналогичным правилам для ионных соединений.Однако для ковалентных соединений числовые префиксы используются по мере необходимости для указания числа атомов каждого элемента в соединении.
В некоторых случаях используется более одной пары электронов, чтобы удовлетворить правилу октетов. Две пары электронов разделяются двумя атомами, образуя двойную связь . Три пары атомов разделяются, образуя тройную связь . Одинарные, двойные и тройные ковалентные связи могут быть представлены одним, двумя или тремя штрихами, соответственно, между символами атомов.В случае координированной ковалентной связи , один атом поставляет оба электрона, а другой атом не поставляет ни один из электронов.
Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность , которая является относительной мерой того, насколько сильно атом притягивает электроны, когда образует ковалентную связь. Чем больше разница электроотрицательностей между атомами, участвующими в ковалентной связи, тем большую полярность проявляет связь.
По сравнению с ионными соединениями, ковалентные молекулы имеют более низкие температуры плавления и кипения, менее растворимы в воде и плохо проводят электричество. Эти основные различия в значительной степени обусловлены повышенной полярностью ионных связей по сравнению с ковалентными связями.
4,7 Ссылки
Материалы главы 4 были адаптированы из следующих ресурсов Creative Commons, если не указано иное:
1. Портал органической химии.WikiUniversity. Доступно по адресу: https://en.wikiversity.org/wiki/Portal:Organic_chemistry
.2. Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
3. Поульсен Т. (2010) Введение в химию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http: // opengroup.org / books / Chemistry.pdf
4. Молекулы и молекулярные соединения. (2017) Либретексты. Доступно по ссылке: https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chemistry%3A_The_Central_Science_(Brown_et_al.)/02._Atoms,_Molecules,_and_Ions/2.6%3A_Molecules
5. Кларк, Дж. (2017) «Общие принципы химической связи», опубликованные Libretexts. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Coordinate_(Dative_Covalent)_Bonding
6.OpenStax (2015) Атомы, изотопы, ионы и молекулы: строительные блоки. OpenStax CNX. Доступно по адресу: http://cnx.org/contents/be8818d0-2dba-4bf3-859a-737c25fb2c99@12.
7. Википедия, Ionic Compound. Доступно по адресу: https://en.wikipedia.org/wiki/Ionic_compound
.8. Физическая и теоретическая химия (2017) Libretexts. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Covalent_Bonds_vs_Ionic_Bonds.
Ковалентное связывание и электроотрицательность
Ковалентное связывание и электроотрицательность
Ковалентные связи образуются, когда атомы разделяют электроны. Это совместное использование позволяет каждому атому достичь своего октета электронов и большей стабильности. Метан, CH 4 , простейшее органическое соединение, содержит ковалентные связи. Углерод имеет четыре валентных электрона, а водород — один валентный электрон. Разделяя эти электроны внешней оболочки, углерод и водород завершают свои валентные оболочки и становятся более стабильными.Дуэт электронов на водороде изоэлектронен гелию и образует законченную оболочку.
Полярность облигаций. В чистой ковалентной связи общие электроны в равной степени доступны каждому из атомов. Такое расположение происходит только тогда, когда два атома одного и того же элемента связываются друг с другом. Таким образом, молекула водорода H 2 содержит хороший пример чистой ковалентной связи.
В большинстве случаев электроны в ковалентных связях не распределяются поровну.Обычно один атом притягивает связывающие электроны сильнее, чем другой. Это неравномерное притяжение приводит к тому, что эти электроны перемещаются ближе к атому с большей силой притяжения. Получающееся в результате асимметричное распределение электронов делает один конец молекулы более богатым электронами, и он приобретает частичный отрицательный заряд, в то время как конец, менее богатый электронами, приобретает частичный положительный заряд. Эта разница в электронной плотности заставляет молекулу стать полярной , то есть иметь отрицательный и положительный конец.
Способность атома притягивать электроны химической связью называется электроотрицательностью атома. Электроотрицательность атома связана с его сродством к электрону и энергией ионизации. Сродство к электрону — это энергия, выделяемая атомом газа, когда к нему присоединяется электрон. Энергия ионизации — это минимальное количество энергии, необходимое для удаления наиболее слабосвязанного электрона из газового атома.
Уровень электроотрицательности обычно измеряется по шкале, созданной Линусом Полингом.В этом масштабе наиболее электроотрицательными элементами являются галогены, кислород, азот и сера. Фтор, галоген, является наиболее электроотрицательным со значением 4,0, которое является наивысшим значением на шкале. Менее электроотрицательными элементами являются щелочные и щелочноземельные металлы. Из них цезий и франций являются наименее электроотрицательными при значениях 0,7.
Элементы с большой разницей в электроотрицательности имеют тенденцию к образованию ионных связей. Атомы элементов с подобной электроотрицательностью имеют тенденцию образовывать ковалентные связи.(Чистые ковалентные связи образуются, когда два атома имеют одну и ту же связь электроотрицательности.) Промежуточные различия в электроотрицательности между ковалентно связанными атомами приводят к полярности связи. Как правило, разница электроотрицательностей в 2 и более по шкале Полинга между атомами приводит к образованию ионной связи. Разница менее 2 между атомами приводит к образованию ковалентной связи. Чем ближе разница в электроотрицательности между атомами к нулю, тем чище становится ковалентная связь и тем меньше у нее полярности.
Углерод с электроотрицательностью 2,5 образует ковалентные связи как с низкой, так и с высокой полярностью. Значения электроотрицательности элементов, обычно встречающихся в органических молекулах, приведены в таблице.
Ковалентных облигаций против ионных облигаций — разница и сравнение
О ковалентных и ионных связях
Ковалентная связь образуется, когда два атома могут обмениваться электронами, тогда как ионная связь образуется, когда «деление» настолько неравномерно, что электрон от атома A полностью теряется для атома B, в результате чего образуется пара ионов.
Каждый атом состоит из протонов, нейтронов и электронов. В центре атома нейтроны и протоны остаются вместе. Но электроны вращаются по орбите вокруг центра. Каждая из этих молекулярных орбит может иметь определенное количество электронов для образования стабильного атома. Но кроме инертного газа этой конфигурации нет у большинства атомов. Итак, чтобы стабилизировать атом, каждый атом разделяет половину своих электронов.
Ковалентная связь — это форма химической связи между двумя неметаллическими атомами, которая характеризуется разделением пар электронов между атомами и другими ковалентными связями.Ионная связь, также известная как электровалентная связь, представляет собой тип связи, образованный электростатическим притяжением между противоположно заряженными ионами в химическом соединении. Такие связи возникают в основном между металлическим и неметаллическим атомами.
Формирование и примеры
Ковалентные связи образуются в результате совместного использования одной или нескольких пар связывающих электронов. Электроотрицательность (способность притяжения электронов) двух связанных атомов либо равны, либо разница не превышает 1.7. Пока разница электроотрицательностей не превышает 1,7, атомы могут разделять только связывающие электроны.
Модель двойных и одинарных ковалентных связей углерода в бензольном кольце.Например, давайте рассмотрим молекулу метана, то есть CH 4 . Углерод имеет 6 электронов, а его электронная конфигурация — 1s22s22p2, то есть он имеет 4 электрона на внешней орбите. Согласно правилу октатов (оно гласит, что атомы имеют тенденцию приобретать, терять или делиться электронами, так что каждый атом имеет полный внешний уровень энергии, который обычно составляет 8 электронов.), чтобы быть в стабильном состоянии, ему нужно еще 4 электрона. Таким образом, он образует ковалентную связь с водородом (1s1) и, деля электроны с водородом, образует метан или CH 4 .
Если разница электроотрицательностей больше 1,7, то более высокий электроотрицательный атом обладает способностью притягивать электроны, которая достаточно велика, чтобы вызвать перенос электронов от меньшего электроотрицательного атома. Это вызывает образование ионных связей.
Ионная связь натрия и хлора с образованием хлорида натрия.Например, в поваренной соли (NaCl) отдельными атомами являются натрий и хлор. Хлор имеет семь валентных электронов на внешней орбите, но чтобы быть в стабильном состоянии, ему необходимо восемь электронов на внешней орбите. С другой стороны, у натрия есть один валентный электрон, и ему также нужно восемь электронов. Поскольку хлор имеет высокую электроотрицательность, 3,16 по сравнению с 0,9 натрия, (поэтому разница между их электроотрицательностью более 1,7), хлор может легко притягивать один валентный электрон натрия.Таким образом, они образуют ионную связь и разделяют электроны друг друга, и у обоих будет по 8 электронов на внешней оболочке.
Примеры
Характеристики облигаций
Ковалентные связи имеют определенную и предсказуемую форму и низкие температуры плавления и кипения. Их можно легко разбить на его первичную структуру, так как атомы находятся рядом и разделяют электроны. Они в основном газообразные, и даже небольшой отрицательный или положительный заряд на противоположных концах ковалентной связи придает им молекулярную полярность.
Ионные связи обычно образуют кристаллические соединения и имеют более высокие температуры плавления и кипения по сравнению с ковалентными соединениями. Они проводят электричество в расплавленном состоянии или растворе и представляют собой чрезвычайно полярные связи. Большинство из них растворимы в воде, но не растворимы в неполярных растворителях. Им требуется гораздо больше энергии, чем ковалентная связь, чтобы разорвать связь между ними.
Причину разницы в температурах плавления и кипения для ионных и ковалентных связей можно проиллюстрировать на примере NaCl (ионная связь) и Cl 2 (ковалентная связь).Этот пример можно найти на Cartage.org.
Список литературы
Ковалентных облигаций
9.3 Ковалентные связи
Цели обучения
- Определите ковалентную связь .
- Проиллюстрируйте образование ковалентной связи с помощью электронных точечных диаграмм Льюиса.
Ионная связь обычно возникает, когда один атом легко теряет один или несколько электронов, а другой атом получает один или несколько электронов.Однако некоторые атомы не легко откажутся от электронов. Тем не менее, они по-прежнему участвуют в образовании соединений. Как?
Существует еще один механизм получения полной валентной оболочки: , разделяющая электронов. Когда электроны разделяются между двумя атомами, они образуют связь, называемую ковалентной связью. Химическая связь, образованная двумя атомами, разделяющими электроны.
Проиллюстрируем ковалентную связь с помощью атомов H, понимая, что атомам H нужно всего два электрона, чтобы заполнить подоболочку 1 s .Каждый атом H начинается с одного электрона в его валентной оболочке:
Два атома H могут делить свои электроны:
Мы можем использовать кружки, чтобы показать, что каждый атом H имеет два электрона вокруг ядра, полностью заполняя валентную оболочку каждого атома:
Поскольку каждый атом H имеет заполненную валентную оболочку, эта связь стабильна, и мы получили молекулу двухатомного водорода. (Это объясняет, почему водород является одним из двухатомных элементов.) Для простоты ковалентную связь нередко изображают тире вместо двух точек:
H – HПоскольку два атома разделяют одну пару электронов, эта ковалентная связь называется одинарной связью. Ковалентная связь, состоящая из одной пары электронов.
В качестве другого примера рассмотрим фтор. Атомы F имеют семь электронов в валентной оболочке:
Эти два атома могут делать то же самое, что и атомы H; они делятся своими неспаренными электронами, образуя ковалентную связь.
Обратите внимание, что теперь каждый атом F окружен полным октетом:
Мы также можем написать это, используя тире, чтобы обозначить общую электронную пару:
В двухатомной молекуле фтора есть два разных типа электронов. Связующая электронная пара. Пара электронов, образующая ковалентную связь. делает ковалентную связь. У каждого атома F есть еще три пары электронов, которые не участвуют в связывании; они называются неподеленными электронными парами — пара электронов, не образующая ковалентной связи.. Каждый атом F имеет одну связывающую пару и три неподеленных пары электронов.
Ковалентные связи могут быть образованы и между различными элементами. Один из примеров — HF. Каждый атом начинается с нечетного числа электронов в валентной оболочке:
.Два атома могут делиться своими неспаренными электронами, образуя ковалентную связь:
Отметим, что атом H имеет полную валентную оболочку с двумя электронами, а атом F имеет полный октет электронов.
Пример 4
Используйте электронные точечные диаграммы Льюиса, чтобы проиллюстрировать образование ковалентной связи в HBr.
Решение
HBr очень похож на HF, за исключением того, что он содержит Br вместо F. Атомы следующие:
Два атома могут иметь общий неспаренный электрон:
Проверьте себя
Используйте электронные точечные диаграммы Льюиса, чтобы проиллюстрировать образование ковалентной связи в Cl 2 .
Ответ
Более двух атомов могут участвовать в ковалентной связи, хотя любая заданная ковалентная связь будет только между двумя атомами. Рассмотрим атомы H и O:
Атомы H и O могут совместно использовать электрон, образуя ковалентную связь:
Атом H имеет полную валентную оболочку. Однако атом O имеет вокруг себя всего семь электронов, что не является полным октетом. Мы исправляем это, добавляя второй атом H, единственный электрон которого образует вторую ковалентную связь с атомом O:
(Неважно, с какой стороны расположен второй атом H.Теперь у атома O есть полный октет вокруг себя, и каждый атом H имеет два электрона, заполняющих его валентную оболочку. Так образуется молекула воды H 2 O.
Пример 5
Используйте электронную точечную диаграмму Льюиса, чтобы показать ковалентную связь в NH 3 .
Решение
Атом N имеет следующую электронную точечную диаграмму Льюиса:
Он имеет три неспаренных электрона, каждый из которых может образовывать ковалентную связь, разделяя электроны с атомом H.Электронная точечная диаграмма NH 3 выглядит следующим образом:
Проверьте себя
Используйте электронную точечную диаграмму Льюиса, чтобы показать ковалентную связь в PCl 3 .
Ответ
Существует простой набор шагов для определения электронной точечной диаграммы Льюиса простой молекулы. Во-первых, вы должны идентифицировать центральный атом и окружающие атомы. Центральный атом — атом в центре молекулы.- это атом в центре молекулы, а окружающие атомы — атом, который создает ковалентные связи с центральным атомом (ами). атомы, связывающие центральный атом. Центральный атом обычно указывается первым в формуле соединения (заметным исключением является H 2 O). После идентификации центрального и окружающих атомов выполните следующие действия:
- Подсчитайте общее количество валентных электронов. Добавьте дополнительный заряд, если у вида есть отрицательные заряды, и удалите часть за каждый положительный заряд вида.
- Напишите центральный атом и окружите его окружающими атомами.
- Поместите пару электронов между центральным атомом и каждым окружающим атомом.
- Заполните октеты вокруг окружающих атомов (кроме H).
- Поместите оставшиеся электроны, если они есть, вокруг центрального атома.
- Убедитесь, что у каждого атома есть полная валентная оболочка.
Давайте попробуем эти шаги, чтобы определить электронную точечную диаграмму для BF 4 — .Атом B является центральным атомом, а атомы F — окружающими атомами. У вида есть отрицательный знак, поэтому у нас есть дополнительный электрон, который следует учитывать.
1. Подсчитайте общее количество электронов. B имеет 3, каждый F имеет 7 и есть один дополнительный электрон: 3 + 7 + 7 + 7 + 7 + 1 = 32.
2. Запишите центральный атом, окруженный окружающими его атомами.
3. Поместите пару электронов между центральным атомом и каждым окружающим атомом. Это использует восемь электронов, поэтому у нас осталось 32-8 = 24 электрона.
4. Заполните октеты вокруг окружающих атомов (кроме H). Это использует еще 24 электрона, оставляя 24-24 = 0 электронов.
5. Поместите оставшиеся электроны, если они есть, вокруг центрального атома. Нет дополнительных электронов для добавления к центральному атому.
6. Чек. У атома B восемь электронов, как и у каждого атома F.У каждого атома есть полный октет. Это хорошая электронно-точечная диаграмма Льюиса для BF 4 — .
Однако иногда эти шаги не работают. Если бы мы следовали этим шагам для соединения формальдегида (CH 2 O), мы получили бы следующее:
Атомы H и O имеют надлежащее количество электронов, но атом C имеет только шесть электронов вокруг себя, а не восемь электронов для октета. Как это исправить?
Мы исправляем это, признавая, что два атома могут иметь более одной пары электронов.В случае CH 2 O атомы O и C разделяют две пары электронов, в результате чего получается следующая электронно-точечная диаграмма Льюиса:
Обведя электроны вокруг каждого атома, мы теперь можем видеть, что атомы O и C имеют октеты, в то время как каждый атом H имеет два электрона:
Каждая валентная оболочка заполнена, так что это приемлемая электронно-точечная диаграмма Льюиса. Если бы мы использовали линии для представления связей, мы бы использовали две линии между атомами C и O:
Связь между атомами C и O представляет собой двойную связь — ковалентную связь, состоящую из двух пар связывающих электронов.и представляет собой две связывающие пары электронов между атомами. Если использование правил рисования электронных точечных диаграмм Льюиса не работает так, как написано, может потребоваться двойная связь.
Пример 6
Какова правильная электронно-точечная диаграмма Льюиса для CO 2 ?
Решение
Центральный атом — это атом углерода, окружающий атомы кислорода. Всего у нас 4 + 6 + 6 = 16 валентных электронов. Следуя правилам электронных точечных диаграмм Льюиса для соединений, мы получаем
У атомов O есть полные октеты вокруг них, но у атома C есть только четыре электрона вокруг себя.Способ решить эту дилемму состоит в том, чтобы создать двойную связь между углеродом и каждым атомом кислорода O:
У каждого атома O по-прежнему восемь электронов, но теперь у атома C также есть полный октет. Это приемлемая электронно-точечная диаграмма Льюиса для CO 2 .
Проверьте себя
Какова правильная электронно-точечная диаграмма Льюиса для карбонилсульфида (COS)?
Ответ
Также возможна тройная связь — ковалентная связь, состоящая из трех пар связывающих электронов., в котором между двумя атомами находятся три пары электронов. Хорошими примерами этого являются элементарный азот (N 2 ) и ацетилен (C 2 H 2 ):
Ацетилен — интересный пример молекулы с двумя центральными атомами, которые оба являются атомами углерода.
Многоатомные ионы связаны ковалентными связями. Однако, поскольку они являются ионами, они участвуют в ионной связи с другими ионами. Таким образом, оба основных типа связи могут происходить одновременно.
Приложение «Еда и напитки: витамины и минералы»
Витамины — это питательные вещества, в которых наш организм нуждается в небольших количествах, но не может синтезировать; следовательно, они должны быть получены с пищей. Слово витамин происходит от «жизненно важного амина», потому что когда-то считалось, что все эти соединения содержат аминогруппу (NH 2 ). На самом деле это неправда, но название все равно прижилось.
Все витамины представляют собой ковалентно связанные молекулы. Большинство из них обычно именуются буквой, хотя все они также имеют официальные химические названия.Таким образом, витамин А также называют ретинолом, витамин С — аскорбиновой кислотой, а витамин Е — токоферолом. Нет ни одного витамина B; существует группа веществ, называемых комплексом витаминов группы B , которые все растворимы в воде и участвуют в метаболизме клеток. Если в диете не хватает витаминов, развиваются такие заболевания, как цинга или рахит. К счастью, все витамины доступны в виде добавок, поэтому любой дефицит витамина в рационе можно легко исправить.
Минерал — это любой химический элемент, кроме углерода, водорода, кислорода или азота, который необходим организму.Минералы, которые необходимы организму, включают натрий, калий, магний, кальций, фосфор, серу и хлор. Незаменимые минералы, которые необходимы организму в крошечных количествах (так называемые микроэлементов ), включают марганец, железо, кобальт, никель, медь, цинк, молибден, селен и йод. Минералы также получают из рациона. Интересно, что большинство минералов потребляются в ионной форме, а не в виде элементов или ковалентных молекул. Как и витамины, большинство минералов доступно в форме таблеток, поэтому любой дефицит можно компенсировать приемом добавок.
Каждое попадание пантотеновой кислоты — это витамин, а все, начиная от кальция и ниже, — минералы.
Основные выводы
- Ковалентные связи образуются, когда атомы разделяют электроны. Электронно-точечные диаграммы
- Льюиса могут быть нарисованы для иллюстрации образования ковалентной связи.
- Двойные или тройные связи между атомами могут быть необходимы, чтобы правильно проиллюстрировать связь в некоторых молекулах.
Упражнения
Сколько электронов будет в валентной оболочке атомов H, когда они образуют ковалентную связь?
Сколько электронов будет в валентной оболочке не-H-атомов, когда они образуют ковалентные связи?
Что такое электронная точечная диаграмма Льюиса I 2 ? Обведите электроны вокруг каждого атома, чтобы убедиться, что каждая валентная оболочка заполнена.
Что такое электронная точечная диаграмма Льюиса H 2 S? Обведите электроны вокруг каждого атома, чтобы убедиться, что каждая валентная оболочка заполнена.
Что такое электронная точечная диаграмма Льюиса NCl 3 ? Обведите электроны вокруг каждого атома, чтобы убедиться, что каждая валентная оболочка заполнена.
Что такое электронная точечная диаграмма Льюиса SiF 4 ? Обведите электроны вокруг каждого атома, чтобы убедиться, что каждая валентная оболочка заполнена.
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.
- SF 2
- BH 4 —
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.
- PI 3
- ОН —
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.
- GeH 4
- ClF
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.
- AsF 3
- NH 4 +
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества. Могут потребоваться двойные или тройные связи.
- SiO 2
- C 2 H 4 (предположим, два центральных атома)
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.Могут потребоваться двойные или тройные связи.
- CN —
- C 2 Cl 2 (предположим, что два центральных атома)
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества. Могут потребоваться двойные или тройные связи.
- КС 2
- NH 2 CONH 2 (предположим, что атомы N и C являются центральными атомами)
Нарисуйте электронную точечную диаграмму Льюиса для каждого вещества.Могут потребоваться двойные или тройные связи.
- POCl
- HCOOH (предположим, что атом C и один атом O являются центральными атомами)
 82
82 : Дрофа, 2012г.
: Дрофа, 2012г.
 А вы?
А вы?
 Их стихи пользуются неизменным успехом
Их стихи пользуются неизменным успехом