Гидросульфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 4 правки.| Гидросульфат натрия | |
|---|---|
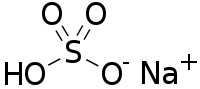 | |
| Систематическое наименование | Гидросульфат натрия |
| Традиционные названия | Кислый сернокислый натрий, бисульфат натрия |
| Хим. формула | NaHSO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 120 г/моль |
| Плотность | 2,472 г/см³ |
| Температура | |
| • плавления | 186 °C |
| Растворимость | |
| • в воде | 28,60; 50100 г/100 мл |
| Рег. номер CAS | 7681-38-1 |
| PubChem | 516919 |
| Рег. номер EINECS | 231-665-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E514(ii) |
| RTECS | VZ1860000 |
| ChemSpider | 56397 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Гидросульфа́т на́трия — кислая соль натрия и серной кислоты с формулой NaHSO4, бесцветные кристаллы. Образует кристаллогидрат NaHSO4·H2O.
- NaOH+h3SO4 → NaHSO4+h3O{\displaystyle {\mathsf {NaOH+H_{2}SO_{4}\ {\xrightarrow {\ }}\ NaHSO_{4}+H_{2}O}}}
- Na2SO4+h3SO4 → 2NaHSO4{\displaystyle {\mathsf {Na_{2}SO_{4}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ 2NaHSO_{4}}}}
- Гидросульфат натрия образует бесцветные кристаллы триклинной сингонии, пространственная группа P 1, параметры ячейки a = 0,7005 нм, b = 0,7125 нм, c = 0,6720 нм, α = 95,93°, β = 92,31°, γ = 75,52°, Z
- Кристаллогидрат гидросульфата натрия — бесцветные гигроскопические кристаллы моноклинной сингонии, пространственная группа A a, параметры ячейки a = 0,8213 нм, b = 0,7812 нм, c = 0,7805 нм, β = 120,04°, Z = 4.
- 2NaHSO4 →250oC Na2S2O7+h3O{\displaystyle {\mathsf {2NaHSO_{4}\ {\xrightarrow {250^{o}C}}\ Na_{2}S_{2}O_{7}+H_{2}O}}}
- При подщелачивании гидросульфат натрия переходит в сульфат:
- NaHSO4+NaOH → Na2SO4+h3O{\displaystyle {\mathsf {NaHSO_{4}+NaOH\ {\xrightarrow {\ }}\ Na_{2}SO_{4}+H_{2}O}}}
- При спекании гидросульфат натрия взаимодействует с солями:
- NaHSO4+NaCl →450−800oC Na2SO4+HCl↑{\displaystyle {\mathsf {NaHSO_{4}+NaCl\ {\xrightarrow {450-800^{o}C}}\ Na_{2}SO_{4}+HCl\uparrow }}}
- и оксидами:
- 2NaHSO4+CuO →450oC CuSO4+Na2SO4+h3O↑{\displaystyle {\mathsf {2NaHSO_{4}+CuO\ {\xrightarrow {450^{o}C}}\ CuSO_{4}+Na_{2}SO_{4}+H_{2}O\uparrow }}}
- Как флюс в цветной металлургии.
- Как реагент для перевода труднорастворимых окислов в растворимые сульфаты.
- Зарегистрирован в качестве пищевой добавки E514.
- в виде порошка или гранул в качестве реагента, понижающего уровень рН в бассейнах
Гипонитрит натрия — Википедия
Материал из Википедии — свободной энциклопедии
Гипонитрит натрия — неорганическое соединение, соль щелочного металла натрия и азотноватистой кислоты с формулой Na2N2O2, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты.
- Nh3OH+NaNO2+NaOH → Na2N2O2+2h3O{\displaystyle {\mathsf {NH_{2}OH+NaNO_{2}+NaOH\ {\xrightarrow {}}\ Na_{2}N_{2}O_{2}+2H_{2}O}}}
- h3N2O2+2NaOH → Na2N2O2+2h3O{\displaystyle {\mathsf {H_{2}N_{2}O_{2}+2NaOH\ {\xrightarrow {}}\ Na_{2}N_{2}O_{2}+2H_{2}O}}}
- Восстановление спиртового раствора нитрита натрия амальгамой натрия:
- 2NaNO2+4Na(Hg)+2h3O → Na2N2O2+4NaOH{\displaystyle {\mathsf {2NaNO_{2}+4Na(Hg)+2H_{2}O\ {\xrightarrow {}}\ Na_{2}N_{2}O_{2}+4NaOH}}}
Гипонитрит натрия образует бесцветные кристаллы, хорошо растворимые в холодной воде и не растворимые в этаноле.
Водный раствор из-за гидролиза по аниону имеет щелочную реакцию.
Анион имеет транс-конфигурацию.
В зависимости от условий кристаллизации образует кристаллогидраты, содержащие до 9 молекул воды.
- При нагревании разлагается:
- 4Na2N2O2 →335oC 3N2+NaNO2+NaNO3+3Na2O{\displaystyle {\mathsf {4Na_{2}N_{2}O_{2}\ {\xrightarrow {335^{o}C}}\ 3N_{2}+NaNO_{2}+NaNO_{3}+3Na_{2}O}}}
- Na2N2O2+2HCl →100oC 2NaCl+N2O↑+h3O{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+2HCl\ {\xrightarrow {100^{o}C}}\ 2NaCl+N_{2}O\uparrow +H_{2}O}}}
- При пропускании хлористого водорода через охлаждённый эфирный раствор гипонитрита натрия можно получить азотноватистую кислоту:
- Na2N2O2+2HCl →0oC h3N2O2+2NaCl{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+2HCl\ {\xrightarrow {0^{o}C}}\ H_{2}N_{2}O_{2}+2NaCl}}}
- Na2N2O2+4H(Zn,NaOH)o+2h3O → 2Nh3OH+2NaOH{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+4H_{(Zn,NaOH)}^{o}+2H_{2}O\ {\xrightarrow {}}\ 2NH_{2}OH+2NaOH}}}
- Na2N2O2+3I2+3h3O → NaNO3+NaNO2+6HI{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+3I_{2}+3H_{2}O\ {\xrightarrow {}}\ NaNO_{3}+NaNO_{2}+6HI}}}
- Вступает в обменные реакции:
- Na2N2O2+2AgNO3 → Ag2N2O2↓+2NaNO3{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+2AgNO_{3}\ {\xrightarrow {}}\ Ag_{2}N_{2}O_{2}\downarrow +2NaNO_{3}}}}
- Na2N2O2+CO2 → Na2CO3+N2O↑{\displaystyle {\mathsf {Na_{2}N_{2}O_{2}+CO_{2}\ {\xrightarrow {}}\ Na_{2}CO_{3}+N_{2}O\uparrow }}}
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 2. — 338 с.
Фторид натрия — Википедия
| Фторид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
| Систематическое наименование | Фторид натрия |
| Традиционные названия | фторид натрия; фтористый натрий, виллиомит |
| Хим. формула | NaF |
| Рац. формула | NaF |
| Состояние | бесцветный твердый порошок без запаха |
| Молярная масса | 41,988713 г/моль |
| Плотность | 2,558 г/см³ |
| Температура | |
| • плавления | 993 °C |
| • кипения | 1695 °C |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 46,9 Дж/(моль·К) |
| Энтальпия | |
| • образования | -576,6 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 4,13 г/100 мл |
| • в остальных веществах | растворим в HF, нерастворим в этаноле |
| Рег. номер CAS | 7681-49-4 |
| PubChem | 5235 |
| Рег. номер EINECS | 231-667-8 |
| SMILES | |
| InChI | |
| RTECS | WB0350000 |
| ChEBI | 28741 |
| Номер ООН | 1690 |
| ChemSpider | 5045 |
| ЛД50 | (орально: крысы, мыши, кролики) 52 мг/кг |
| Токсичность | Класс опасности 2 |
| Пиктограммы ECB |  |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Фторид натрия (фтористый натрий) — неорганическое бинарное соединение с химической формулой NaF. Белое кристаллическое вещество.
Фторид натрия — бесцветные кристаллы с кубической решеткой (a = 0,46344 нм, пространственная группа Fm3m, Z=4). Трудно растворим в воде. Хорошо растворяется в безводной плавиковой кислоте. Кристаллогидратов не образует.
В природе существует в виде относительно редкого минерала виллиомита: карминово-красные, темно-вишневые, изредка бесцветные кристаллы, содержит NaF с незначительными примесями, месторождения в Северной Америке, Африке, Кольский полуостров.
Так же NaF встречается в магматических породах, входит в состав в нефелинового сиенита.
В промышленности фторид натрия получают щелочным гидролизом гексафторсиликатов:
- Na2SiF6+4NaOH⟶6NaF+SiO2+2h3O{\displaystyle {\mathsf {Na_{2}SiF_{6}+4NaOH\longrightarrow 6NaF+SiO_{2}+2H_{2}O}}}
при избытке щелочи
- Na2SiF6+8NaOH⟶6NaF+Na4SiO4+4h3O{\displaystyle {\mathsf {Na_{2}SiF_{6}+8NaOH\longrightarrow 6NaF+Na_{4}SiO_{4}+4H_{2}O}}}
Мировое производство фторида натрия оценивается в ~10 тыс. т.
Непосредственным взаимодействием щелочи и кислоты:
- NaOH+HF⟶NaF+h3O{\displaystyle {\mathsf {NaOH+HF\longrightarrow NaF+H_{2}O}}}
Чисто теоретический интерес представляет реакция получения фторида натрия из элементов:
- 2Na+F2⟶2NaF{\displaystyle {\mathsf {2Na+F_{2}\longrightarrow 2NaF}}}
реакция протекает очень бурно.
Плавиковая кислота разрушает соли более слабых кислот:
- Na2CO3+2HF⟶2NaF+CO2↑+h3O{\displaystyle {\mathsf {Na_{2}CO_{3}+2HF\longrightarrow 2NaF+CO_{2}\uparrow +H_{2}O}}}
Также гидроксид натрия может разрушать соли летучих оснований:
- NaOH+Nh5F⟶NaF+Nh4↑+h3O{\displaystyle {\mathsf {NaOH+NH_{4}F\longrightarrow NaF+NH_{3}\uparrow +H_{2}O}}}
Разложение дифторгидрата натрия при температуре ~350 °C:
- Na(HF2)→270−400oCNaF+HF{\displaystyle {\mathsf {Na(HF_{2}){\xrightarrow {270-400^{o}C}}NaF+HF}}}
Нагрев до температуры 1100 °C гептафторониобата калия с натрием:
- K2[NbF7]+5Na→1100oCNb+2KF+5NaF{\displaystyle {\mathsf {K_{2}[NbF_{7}]+5Na{\xrightarrow {1100^{o}C}}Nb+2KF+5NaF}}}
позволяет получить чистый ниобий, фторид калия и фторид натрия.
В растворах фторид натрия подвергается гидролизу по аниону:
- NaF+4h3O→[Na(h3O)4]++F−{\displaystyle {\mathsf {NaF+4H_{2}O{\xrightarrow {}}[Na(H_{2}O)_{4}]^{+}+F^{-}}}}
- F−+h3O⇄HF+OH−{\displaystyle {\mathsf {F^{-}+H_{2}O\rightleftarrows HF+OH^{-}}}}
Степень гидролиза невелика, так как константа последней реакции pK = 10,8.
Присоединяет HF с образованием дифторгидрата натрия:
- NaF+HF→Na(HF2){\displaystyle {\mathsf {NaF+HF{\xrightarrow {}}Na(HF_{2})}}}
При избытке HF образуются высшие гидрофториды натрия:
- NaF+nHF→Na[F(HF)n]↓{\displaystyle {\mathsf {NaF+nHF{\xrightarrow {}}Na[F(HF)_{n}]\downarrow }}}
известны соединения для n = 1÷4.
Сильные нелетучие кислоты разрушают фторид натрия:
- 2NaF+h3SO4→>100oCNa2SO4+2HF↑{\displaystyle {\mathsf {2NaF+H_{2}SO_{4}{\xrightarrow {>100^{o}C}}Na_{2}SO_{4}+2HF\uparrow }}}
Насыщенный гидроксид лития благодаря плохой растворимости фторида лития разрушает фторид натрия:
- NaF+LiOH→NaOH+LiF↓{\displaystyle {\mathsf {NaF+LiOH{\xrightarrow {}}NaOH+LiF\downarrow }}}
Образовывает гексафторсиликаты и гексафторалюминаты:
- 2NaF+h3[SiF6]→Na2[SiF6]↓+2HF{\displaystyle {\mathsf {2NaF+H_{2}[SiF_{6}]{\xrightarrow {}}Na_{2}[SiF_{6}]\downarrow +2HF}}}
- 3NaF+AlF3→Na3[AlF6]↓{\displaystyle {\mathsf {3NaF+AlF_{3}{\xrightarrow {}}Na_{3}[AlF_{6}]\downarrow }}}
Расплав фторида натрия является электролитом, следовательно его можно разложить электролизом на элементы:
- 2NaF→ e−2Na↓+F2↑{\displaystyle {\mathsf {2NaF{\xrightarrow {\ e^{-}}}2Na\downarrow +F_{2}\uparrow }}}
 Таблетки, содержащие фторид натрия (натриум флуоратум)
Таблетки, содержащие фторид натрия (натриум флуоратум)Фторид натрия и образующийся из него фторапатит используются для укрепления зубной эмали, которая и сама содержит фторапатит[2][3]. Кроме добавления фтора в зубные пасты, производится фторирование питьевой воды. Зубная паста часто содержит фторид натрия, который необходим для предотвращения кариеса[4]. Кроме того, фторид натрия используется как моющее средство. Используется в различных отраслях химической промышленности — при синтезе и в металлургии. Фторид натрия является реагентом при синтезе фреонов.
Натрия фторид используется для сохранения образцов тканей в биохимии и лекарственных тестирований; ионы фтора останавливают гликолиз. Натрия фторид часто используется вместе с иодоуксусной кислотой, которая ингибирует создание фермента альдолазы.
Натрия фторид используют как компонент составов для очистки и алитирования металлов, флюсов для сварки, пайки и переплавки металлов, стекол, эмалей, керамики, огнеупоров, как компонент кислотоупорного цемента, термостойких смазок, составов для травления стекол, твердых электролитов, как консервант древесины, инсектицид, сорбент для поглощения UF6 из газовых потоков, реагент при получении фторуглеводородов, как компонент специальных сортов бумаги, как ингибитор брожения, компонент огнезащитных составов и средств пожаротушения.
Фторид натрия относится к потенциально-опасным веществам для человека и млекопитающих. Он классифицируется как токсичное вещество при ингаляции (например, через пыль) или при приеме пищи. Как было показано, при достаточно высоких дозах влияет на сердечно-сосудистую систему; смертельная доза для человека при весе 70 кг оценивается в 5—10 г. В больших дозах, когда нужно использовать фторид натрия для лечения остеопороза, может вызвать боль в ногах и перепады в артериальном давлении, когда дозы слишком высоки, то происходит раздражение желудка, иногда такое сильное, что это может вызвать язву. В микроскопических количествах фтористый натрий NaF используется для фторирования воды. При большой концентрации фтора (или при частом употреблении продуктов, жидкостей и тому подобных продуктов, содержащих фтор) может вызвать флюороз зубов, который может привести к потере зубов.
ПДК в воздухе рабочей зоны: 0,2 мг/м³.
Имеет II класс токсичности согласно ГОСТ 12.1.007-76.
- ↑ http://www.cdc.gov/niosh/npg/npgd0563.html
- ↑ Bourne, Geoffrey Howard (1986), Dietary research and guidance in health and disease, Karger, с. 153, ISBN 3-805-5434-17, <https://books.google.com/?id=OW0gAAAAMAAJ> , Snippet view from page 153
- ↑ Klein, Cornelis; Hurlbut, Cornelius Searle & Dana, James Dwight (1999), Manual of Mineralogy (21 ed.), Wiley, ISBN 0-471-31266-5
- ↑ Sodium fluoride, Molecule of the week (неопр.). American Chemical Society (19 февраля 2008). Дата обращения 1 ноября 2008.
Иодид натрия — Википедия
Материал из Википедии — свободной энциклопедии
Иоди́д на́трия, иодистый натрий, NaI — натриевая соль иодоводородной кислоты.
При нормальных условиях — белый гигроскопичный порошок или прозрачный бесцветный кристалл. Солёный на вкус. Запаха не имеет. На воздухе сыреет с разложением и выделением иода. Легко растворим в воде, в спирте, в глицерине.
Реагирует со смесью калия перманганата с гидроксидом калия:
- 2NaI+2KMnO4+2KOH ⟶ I2+2K2MnO4+2NaOH{\displaystyle {\mathsf {2NaI+2KMnO_{4}+2KOH\ \longrightarrow {}\ I_{2}+2K_{2}MnO_{4}+2NaOH}}}
Также взаимодействует со смесью дихромата калия и серной кислоты:
- 6NaI+K2Cr2O7+7h3SO4⟶ 3I2+Cr2(SO4)3+K2SO4+3Na2SO4+7h3O{\displaystyle {\mathsf {6NaI+K_{2}Cr_{2}O_{7}+7H_{2}SO_{4}\longrightarrow {}\ 3I_{2}+Cr_{2}(SO_{4})_{3}+K_{2}SO_{4}+3Na_{2}SO_{4}+7H_{2}O}}}
Химический синтез[править | править код]
Иодид натрия используется в полимеразной цепной реакции и в реакции Финкельштейна (раствор в ацетоне) для превращения хлоралкилов в иодалкилы:
- RCl+NaI→RI+NaCl{\displaystyle {\mathsf {RCl+NaI\rightarrow RI+NaCl}}}
Ядерная физика[править | править код]
Монокристаллы иодида натрия, для улучшения световыхода активированного таллием, NaI(Tl), применяются при изготовлении сцинтилляционных детекторов элементарных частиц, прежде всего в калориметрах для рентгеновской и гамма-спектрометрии в ядерной физике, ядерной медицине, геофизике и т. д. Иодид натрия гигроскопичен, поэтому такие детекторы нуждаются в герметичной упаковке, предотвращающей контакт с влагой воздуха. NaI(Tl) — один из самых распространённых сцинтилляторов, что объясняется его высоким световыходом, хорошим энергетическим разрешением, достаточно коротким временем высвечивания (около микросекунды) и высоким эффективным зарядом ядра (следовательно, высокой эффективностью поглощения гамма-квантов). Максимум спектра высвечивания лежит в районе длины волны 415 нм.
Источники света[править | править код]
Используется в наполнении металлогалогенных ламп для приближения спектра их излучения к белому цвету[1].
Иодид натрия нетоксичен, ЛД50 = 4340 мг/кг. Однако передозировка иодидов в организме небезопасна.
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
Na2O+h3O=? уравнение реакции
Реакция взаимодействия между оксидом натрия и водой (Na2O + h3O = ?) приводит к образованию сложного соединения – гидроксида натрия, формула которой имеет вид . Молекулярное уравнение реакции имеет вид:
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (; ):
Это означает, что вода находится в избытке и дальнейшие расчеты производим по оксиду натрия.
Согласно уравнению реакции , значит . Тогда масса гидроксида натрия будет равна (молярная масса – 40 g/mole):