Удельная теплоемкость вещества — формулы, определение, обозначение
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
Виу-виу-виу! Внимание!
Обнаружено новое непонятное слово — теплопередача.
Минуточку, давайте закончим с количеством теплоты.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание Q = cm(tконечная — tначальная) Охлаждение Q = cm(tначальная — tконечная) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
Теплопередача — процесс передачи теплоты (обмена энергией).Здесь все совсем несложно, видов всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?🤔
Обоими способами.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание Q = cm(tконечная — tначальная) Охлаждение Q = cm(tначальная — tконечная) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества c= Q/m(tконечная — tначальная) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества c= C/m c — удельная теплоемкость вещества [Дж/кг*˚C] C — теплоемкость вещества [Дж/˚C] m — масса [кг] |
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела Q = C(tконечная — tначальная) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Газы | C, Дж/(кг·К) |
Азот N2 | 1051 |
Аммиак Nh4 | 2244 |
Аргон Ar | 523 |
Ацетилен C2h3 | 1683 |
Водород h3 | 14270 |
Воздух | 1005 |
Гелий He | 5296 |
Кислород O2 | 913 |
Криптон Kr | 251 |
Ксенон Xe | 159 |
Метан Ch5 | 2483 |
Неон Ne | 1038 |
Оксид азота N2O | 913 |
Оксид азота NO | 976 |
Оксид серы SO2 | 625 |
Оксид углерода CO | 1043 |
Пропан C3H8 | 1863 |
Сероводород h3S | 1026 |
Углекислый газ CO2 | 837 |
Хлор Cl | 520 |
Этан C2H6 | 1729 |
Этилен C2h5 | 1528 |
Металлы и сплавы | C, Дж/(кг·К) |
Алюминий Al | 897 |
Бронза алюминиевая | 420 |
Бронза оловянистая | 380 |
Вольфрам W | 134 |
Дюралюминий | 880 |
Железо Fe | 452 |
Золото Au | 129 |
Константан | 410 |
Латунь | 378 |
Манганин | 420 |
Медь Cu | 383 |
Никель Ni | 443 |
Нихром | 460 |
Олово Sn | 228 |
Платина Pt | 133 |
Ртуть Hg | 139 |
Свинец Pb | 128 |
Серебро Ag | 235 |
Сталь стержневая арматурная | 482 |
Сталь углеродистая | 468 |
Сталь хромистая | 460 |
Титан Ti | 520 |
Уран U | 116 |
Цинк Zn | 385 |
Чугун белый | 540 |
Чугун серый | 470 |
Жидкости | Cp, Дж/(кг·К) |
Азотная кислота (100%-ная) Nh4 | 1720 |
Бензин | 2090 |
Вода | 4182 |
Вода морская | 3936 |
Водный раствор хлорида натрия (25%-ный) | 3300 |
Глицерин | 2430 |
Керосин | 2085…2220 |
Масло подсолнечное рафинированное | 1775 |
Молоко | 3906 |
Нефть | 2100 |
Парафин жидкий (при 50С) | 3000 |
Серная кислота (100%-ная) h3SO4 | 1380 |
Скипидар | 1800 |
Спирт метиловый (метанол) | 2470 |
Спирт этиловый (этанол) | 2470 |
Топливо дизельное (солярка) | 2010 |
Задача
Какое твердое вещество массой 2 кг можно нагреть на 10 ˚C, сообщив ему количество теплоты, равное 7560 Дж?
Решение:
Используем формулу для нахождения удельной теплоемкости вещества:
c= Q/m(tконечная — tначальная)
Подставим значения из условия задачи:
c= 7560/2*10 = 7560/20 = 378 Дж/кг*˚C
Смотрим в таблицу удельных теплоемкостей для металлов и находим нужное значение.
Металлы и сплавы | C, Дж/(кг·К) |
Алюминий Al | 897 |
Бронза алюминиевая | 420 |
Бронза оловянистая | 380 |
Вольфрам W | 134 |
Дюралюминий | 880 |
Железо Fe | 452 |
Золото Au | 129 |
Константан | 410 |
Латунь | 378 |
Манганин | 420 |
Медь Cu | 383 |
Никель Ni | 443 |
Нихром | 460 |
Олово Sn | 228 |
Платина Pt | 133 |
Ртуть Hg | 139 |
Свинец Pb | 128 |
Серебро Ag | 235 |
Сталь стержневая арматурная | 482 |
Сталь углеродистая | 468 |
Сталь хромистая | 460 |
Титан Ti | 520 |
Уран U | 116 |
Цинк Zn | 385 |
Чугун белый | 540 |
Чугун серый | 470 |
Ответ: латунь
Количество теплоты в физике — формулы и определение с примерами
Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
ТеплообменДругим способом изменения внутренней энергии термодинамической системы является теплообмен.
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
Количество теплоты и удельная теплоёмкостьКоличественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где — масса тела; — разность температур в конце и в начале процесса теплообмена; с — удельная теплоёмкость вещества — физическая величина, численно равная количеству теплоты, которое получает вещество массой 1 кг при увеличении его температуры на 1 К. Удельную теплоёмкость измеряют в джоулях, деленных на килограмм, кельвин
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин Теплоёмкость в отличии от удельной теплоёмкости, является тепловой характеристикой тела, а не вещества.
Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин Теплоёмкость в отличии от удельной теплоёмкости, является тепловой характеристикой тела, а не вещества.
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления Эту величину измеряют в джоулях, делённых на килограмм Для плавления тела массой предварительно нагретого до температуры плавления, ему необходимо сообщить количество теплоты При кристаллизации тела такое же количество теплоты выделяется:
Удельная теплота парообразованияФизическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм Количество теплоты, необходимое для превращения жидкости массой предварительно нагретой до температуры кипения, в пар, определяют по формуле Конденсация пара сопровождается выделением количества теплоты
Единицей измерения этой величины является джоуль, делённый на килограмм Количество теплоты, необходимое для превращения жидкости массой предварительно нагретой до температуры кипения, в пар, определяют по формуле Конденсация пара сопровождается выделением количества теплоты
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания топлива и измеряют в джоулях, делённых на килограмм Количество теплоты, выделившееся при полном сгорании некоторой массы топлива, определяют по формуле
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
Примеры решения задачПример №1
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры до температуры ему было передано количество теплоты которое можно рассчитать по формуле
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: — олово.
Пример №2
В налитую в сосуд воду, масса которой и температура добавили некоторое количество льда при температуре Определите массу льда, если после достижения теплового равновесия температура содержимого сосуда Теплоёмкостью сосуда и потерями тепла пренебречь. Удельная теплоёмкость воды льда удельная теплота плавления льда
Решение:
Пренебрегая потерями энергии в окружающую среду, учитываем только обмен энергией между входящими в систему телами. Рассмотрим тепловые процессы, происходившие в системе:
Рассмотрим тепловые процессы, происходившие в системе:
1) нагревание льда от температуры до температуры плавления
2) таяние льда:
3) нагревание воды, появившейся при таянии льда, от температуры до температуры
4) остывание тёплой воды массой от температуры до температуры Составим уравнение теплового баланса: или
Откуда масса льда:
Ответ:
Урок 23. внутренняя энергия. работа. количество теплоты — Физика — 10 класс
Работа и теплопередача как способы изменения внутренней энергии
Выражение для внутренней энергии одноатомного идеального или разреженного реального газов имеет следующий вид: $U = \frac{3}{2} \cdot \nu \cdot R \cdot T$.
Для идеального газа из молекул с двумя, тремя или большим числом атомов требуется учёт кинетической энергии вращения молекул (их уже нельзя считать материальными точками), поэтому выражение для их внутренней энергии отличается от $U = \frac{3}{2} \cdot \nu \cdot R \cdot T$, но только числовым коэффициентом.
Для двухатомного газа (например, H2, O2, CO и пр.):
$U = \frac{5}{2} \cdot \nu \cdot R \cdot T$.
Для газа с тремя атомами и более (например, CO2, CH4):
$U = 3 \cdot \nu \cdot R \cdot T$.
Чтобы изменить внутреннюю энергию вещества, нужно передать ему некоторое количество теплоты либо совершить над ним работу.
Существует три вида теплопередачи:
Теплопроводность – это процесс переноса энергии от более нагретых частей тела к менее нагретым, осуществляемый хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Простой пример – нагревание ложки в горячем чае.
Конвекция – вид теплопередачи, при котором внутренняя энергия передаётся струями или потоками жидкости, или газа. Пример: проветривание комнаты.
Излучение – процесс переноса энергии посредством электромагнитного излучения. Простой пример: солнечный свет.
Механическая работа меняет механическую энергию тела. В термодинамике то же самое. К примеру, если газ двигает поршень, расширяясь, то у нас, как и в механике, есть и сила, и перемещение. Разница только в том, что при совершении работы в термодинамике меняется не кинетическая или потенциальная энергия газа как целого тела, а кинетическая энергия его молекул, то есть внутренняя энергия газа.
Если газ расширяется, то работу газа принято считать положительной. Если же сжимается – то отрицательной.
Формула для нахождения работы газа при изобарном процессе примет следующий вид: $A = p \cdot \Delta V$.
Для изотермического процесса формула принимает следующий вид: $A = \nu \cdot R \cdot T \cdot ln \frac{V_2}{V_1}$.
Латентная (скрытая) теплота . Популярная физика. От архимедова рычага до квантовой механики
Вам могло бы показаться, что понятия температуры как меры содержания количества теплоты и теплоты будут очень сближаться, стоит только воспользоваться для расчетов атомами или молекулами вместо граммов. Это было бы так, если бы закон Дюлонга и Пети был справедлив для всех веществ и при любых условиях, но это не так. Он справедлив только для твердых элементов и только в некотором температурном диапазоне. Действительно, можно показать случаи, когда содержание количества теплоты может сильно изменяться без всякого изменения температуры вообще, и этого вполне достаточно, чтобы прекратить использование понятия температуры как меры содержания теплоты.
Это было бы так, если бы закон Дюлонга и Пети был справедлив для всех веществ и при любых условиях, но это не так. Он справедлив только для твердых элементов и только в некотором температурном диапазоне. Действительно, можно показать случаи, когда содержание количества теплоты может сильно изменяться без всякого изменения температуры вообще, и этого вполне достаточно, чтобы прекратить использование понятия температуры как меры содержания теплоты.
Предположим, что к 100 граммам жидкой воды с температурой 0 °С добавлены 100 граммов жидкой воды с температурой 100 °C. После перемешивания окончательная температура смеси будет равна 50 °С.
Затем предположим, что 100 граммов льда с температурой 0 °С добавлены к 100 граммам жидкой воды с температурой 100 °С. После таяния льда и перемешивания смеси (предполагая, что во время ожидания не произошло никакой потери теплоты в окружающую среду или увеличения теплоты из окружающей среды, — задача, которая может быть решена посредством изоляции всей системы) мы обнаружим, что температура смеси составляет всего лишь 10 °С.
Почему так получилось? Понятно, что жидкая вода с температурой 0 °C содержит большее количество теплоты, пригодной для того, чтобы внести ее в окончательную смесь, чем лед при тех же 0 °С, и все же? Ведь и жидкая вода, и лед имели одну и ту же температуру. Кажется разумным предположить, что во втором случае некоторое количество теплоты, которое содержится в горячей воде, было использовано на процесс таяния льда, и, таким образом, для подъема температуры смеси осталось гораздо меньшее его количество.
Действительно, если мы будем нагревать смесь льда и воды, то обнаружим, что независимо от того, какое количество теплоты было передано смеси, температура системы остается равной 0 C°, пока последний кусочек льда не будет расплавлен. И только после того, как лед расплавится, теплота начинает преобразовываться в кинетическую энергию, и только тогда температура воды может начать повышаться. Эксперимент показывает: для того чтобы расплавить один грамм льда, из окружающей среды поглощается примерно 80 калорий теплоты и в процессе этого расплава не происходит никакого повышения температуры смеси. Лед, находящийся при температуре 0 °С, преобразуется и воду, находящуюся при тех же 0 °C.
Лед, находящийся при температуре 0 °С, преобразуется и воду, находящуюся при тех же 0 °C.
Да, но если теплота, которую получает лед, не преобразуется в кинетическую энергию молекул, что же случается с ней? Ведь согласно закону сохранения энергии, как мы знаем, она не может просто исчезнуть.
Молекулы воды во льду связаны вместе сильными силами притяжения, которые и удерживают вещество в виде твердого тела. Чтобы преобразовать лед в воду, то есть в жидкую форму (в которой молекулы, как во всех жидкостях, являются практически свободными от взаимных связей, вплоть до способности взаимно скользить и перемещаться относительно друг друга), необходимо противостоять этим силам. Во время плавления льда тепловая энергия расходуется на противодействие этим межмолекулярным силам. При одной и той же температуре молекулы воды содержат большее количество энергии, чем молекулы льда, но не в форме более быстрого движения или вибрации, а в форме способности к сопротивлению силам притяжения, старающимся стянуть их между собой.
Согласно закону сохранения энергии, изменение энергии в процессе замораживания должно быть равно и противоположно по знаку при таянии. Если жидкой воде при температуре 0 °C предоставить возможность отдавать теплоту в окружающую внешнюю среду, то способность молекул сопротивляться силам притяжения постепенно будет потеряна. Все большее количество молекул будет крепко связано вместе, и в конце концов вода замерзнет. Отданное в окружающую внешнюю среду количество теплоты, которое теряет система в процессе этого замораживания, равно 80 калориям на каждый грамм получившегося льда.
Короче говоря, 1 грамм льда, находящийся при температуре, равной 0 °С, поглощает 80 калорий и плавится, образуя 1 грамм воды с температурой 0 °С; а 1 грамм воды, находящейся при температуре, равной 0 C°, выделяет 80 калорий, в то время как замораживается в 1 грамм льда с температурой 0 °С.
Теплота, использованная в процессе плавления льда (или любого другого твердого тела), преобразуется в своего рода потенциальную энергию молекул. Как камень, находящийся наверху горы, имеет благодаря своему расположению и с точки зрения гравитационного притяжения большее количество энергии, чем подобный же камень, но находящийся у подножия горы, так и свободно перемещающиеся молекулы в жидкостях благодаря своему положению и с точки зрения межмолекулярного притяжения обладают большим количеством энергии, чем те же или подобные молекулы в твердых телах, где они жестко связаны.
Как камень, находящийся наверху горы, имеет благодаря своему расположению и с точки зрения гравитационного притяжения большее количество энергии, чем подобный же камень, но находящийся у подножия горы, так и свободно перемещающиеся молекулы в жидкостях благодаря своему положению и с точки зрения межмолекулярного притяжения обладают большим количеством энергии, чем те же или подобные молекулы в твердых телах, где они жестко связаны.
Представление о количестве теплоты вещества дает его суммарная внутренняя энергия, представляющая собой и кинетическую и потенциальную энергию молекул. Температура дает нам отражение в изменении только кинетической энергии молекул. В процессе изменения только потенциальной энергии, как это было в приведенном примере с плавлением или замораживанием льда, полное количество теплоты, которое содержится в веществе, меняется без изменения температуры.
Первооткрывателем того факта, что теплота плавит лед без поднятия его температуры, был Джозеф Блэк — тот самый, кто первым рассчитал значение удельной теплоемкости. Он назвал теплоту, использованную в процессе плавления льда, «латентной, или скрытой, теплотой». Слово «латентная» означает нечто, что присутствует в веществе, но не явным образом. Это примерно то же самое, что и «потенциальная энергия». Таким образом, ясно просматривается связь между «латентной теплотой» и «потенциальной энергией».
Он назвал теплоту, использованную в процессе плавления льда, «латентной, или скрытой, теплотой». Слово «латентная» означает нечто, что присутствует в веществе, но не явным образом. Это примерно то же самое, что и «потенциальная энергия». Таким образом, ясно просматривается связь между «латентной теплотой» и «потенциальной энергией».
Итак, тепло, которое требуется для того, чтобы расплавить грамм льда, называется его «скрытой теплотой плавления» (слово «плавление» в случае льда является синонимом слова «таяние»). Необходимым уточнением является слово «плавление», так как существует и другой тип латентной теплоты, который возникает в процессе кипения или парообразования. При преобразовании одного грамма жидкой воды, находящейся при температуре, равной 100 °С, в один грамм пара с температурой 100 °С происходит полная нейтрализация всех межмолекулярных связей, которые еще остались после преобразования твердого вещества в жидкость. Только после этого молекулы начинают демонстрировать свойства, типичные для молекул газов, то есть свое практически независимое движение. При имевшем место ранее процессе таяния была нейтрализована только незначительная часть межмолекулярных сил притяжения, а основная часть их продолжает действовать. По этой причине «латентная, или скрытая, теплота парообразования» данного вещества в общем случае значительно выше, чем латентная теплота плавления того же самого вещества. Например, латентная теплота парообразования воды, а именно: количество теплоты, которое требуется для того, чтобы преобразовать 1 грамм воды с при температурой 100 °С в 1 грамм пара с той же температурой 100 °С, равно 539 калориям. То есть для воды латентная теплота парообразования почти в семь раз больше, чем латентная теплота плавления.
При имевшем место ранее процессе таяния была нейтрализована только незначительная часть межмолекулярных сил притяжения, а основная часть их продолжает действовать. По этой причине «латентная, или скрытая, теплота парообразования» данного вещества в общем случае значительно выше, чем латентная теплота плавления того же самого вещества. Например, латентная теплота парообразования воды, а именно: количество теплоты, которое требуется для того, чтобы преобразовать 1 грамм воды с при температурой 100 °С в 1 грамм пара с той же температурой 100 °С, равно 539 калориям. То есть для воды латентная теплота парообразования почти в семь раз больше, чем латентная теплота плавления.
Таким образом, энергосодержание пара на удивление высоко. Сотня граммов воды, находящихся при температуре, равной 100 °С, в процессе охлаждения от этой температуры до точки замерзания отдает около 10 000 калорий. Сотня же граммов пара, находящихся при температуре, равной 100 °C, однако, отдает около 53 900 калорий, просто преобразовываясь в воду. Получившаяся вода тогда отдает еще и 10 000 калорий, по мере охлаждения до точки замерзания. По этой причине паровые двигатели обладают таким высоким коэффициентом полезного действия, который никогда бы не был доступен «двигателям на горячей воде». (Не вызывает удивления тот факт, что Джеймс Ватт, изобретатель парового двигателя, был студентом у Джозефа Блэка.)
Получившаяся вода тогда отдает еще и 10 000 калорий, по мере охлаждения до точки замерзания. По этой причине паровые двигатели обладают таким высоким коэффициентом полезного действия, который никогда бы не был доступен «двигателям на горячей воде». (Не вызывает удивления тот факт, что Джеймс Ватт, изобретатель парового двигателя, был студентом у Джозефа Блэка.)
Существует способ использования латентной теплоты парообразования. Предположим, что газ типа аммиака помещен под давлением в закрытый сосуд. Если увеличивать давление, то это заставит газ сжижаться. Поскольку аммиак сжижается, он отдает некоторое количество теплоты окружающей среде. Эта теплота может поднять температуру как непосредственно окружающей среды, так и самого аммиака. Однако если сосуд с аммиаком погрузить в проточную воду, то выделенная теплота будет уноситься этой водой, а жидкий аммиак будет оставаться при температуре, которая была у него в газообразном состоянии.
Если теперь сосуд с аммиаком вынуть из воды и снизить давление так, чтобы жидкий аммиак снова закипел и стал газом, он должен поглотить количество теплоты, эквивалентное тому, которое он отдал до того. Он и поглощает эту теплоту из самых близких источников — из себя и из своего непосредственного окружения. Часть кинетической энергии его собственных молекул преобразуется в потенциальную энергию газообразного состояния, и температура аммиака резко падает вниз.
Он и поглощает эту теплоту из самых близких источников — из себя и из своего непосредственного окружения. Часть кинетической энергии его собственных молекул преобразуется в потенциальную энергию газообразного состояния, и температура аммиака резко падает вниз.
Если мы возьмем газ, подобный аммиаку, и сделаем его частью механического устройства, которое поочередно то сжимает его, то позволяет ему испаряться, в результате мы получим тепловой насос, который потребляет теплоту из аммиака и непосредственно из близлежащей окружающей среды. Далее, поместив такой насос в некую изолированную коробку, мы получим рефрижератор, то есть холодильник.
Понижение температуры по мере испарения используется и нашими собственными телами. Благодаря действию потовых желез мы покрыты тонкой влажной пленкой, которая по мере испарения забирает теплоту от нашего тела и дает нам прохладу. Вода имеет самую высокую латентную теплоту парообразования среди обычных веществ, а так как наш пот является почти чистой водой, это означает, что мы все немного испаряемся, хотя обычно так мало, что совсем и не замечаем этого. В жаркую погоду процесс ускоряется, и если внешние условия изменяются, то мы хорошо можем видеть результат этого парообразования — конденсация (пот) накапливается в больших количествах. Все мы прекрасно знаем это чувство дискомфорта — результат частичного пробоя нашей личной системы охлаждения — как говорится: «в пот бросило».
В жаркую погоду процесс ускоряется, и если внешние условия изменяются, то мы хорошо можем видеть результат этого парообразования — конденсация (пот) накапливается в больших количествах. Все мы прекрасно знаем это чувство дискомфорта — результат частичного пробоя нашей личной системы охлаждения — как говорится: «в пот бросило».
«Теплопередача. Количество теплоты». Физика – 8-й класс
Предложен урок для повторения и закрепления материала по трем способам теплопередачи, качественному и количественному описанию процессов нагревания или охлаждения вещества, горения топлива. Предлагается к использованию анимационный ролик, задание по анализу экспериментальных данных и задачи трех уровней сложности.
Цель урока: повторить материал о
трех способах теплопередачи, формировать умения
объяснять тепловые явления и количественно их
описывать.
Развиваемые навыки: мыслительные, коммуникативные.
Ученики будут анализировать и интерпретировать данные, делать аргументированные выводы, применять научную информацию для решения задач.
Описание урока.
Организационный момент (готовность к уроку, настрой)
Формулировка цели урока.
Этап 1. Повторение материала.
В качестве повторения на уроке использовался открытый для бесплатного использования ресурс в Интернете: www.bbc.co.uk/schools.
(В нашей школе ученики обучаются по
Российской программе и по программе
международного бакалавриата (www.ibo.org).
Уроки физики проводятся в основном на русском
языке, но терминология дается на русском и
английском языках. Использование материалов
англоязычных сайтов и учебников позволяет
разнообразить изучение физики и дополнительно
мотивирует школьников. )
)
С помощью компьютера с колонками и проектора смотрим на экране учебный анимационный ролик “Energy transfer and storage – Activity”
http://www.bbc.co.uk/schools/ks3bitesize/science/energy_electricity_forces/energy_transfer_storage/activity.shtml
(основной для повторения материал на английском языке можно посмотреть в приложении 1)
В конце ролика предлагается тест с выбором одного из трех вариантов ответа, выполняем его вместе всем классом.
Тест с выбором ответа.
Кроме способов теплопередачи повторяем формулы для расчета:
количества теплоты, необходимого для нагревания тела или выделяемого при его охлаждении,
количества теплоты, выделяемого при сгорании топлива.
Этап 2. Решение индивидуальных заданий
I уровня.
Решение индивидуальных заданий
I уровня.
Школьникам раздаются по карточки с тремя вопросами, на которые они письменно отвечают.
Примеры вопросов для формирования карточек приведены ниже.
На экране открываем список всех вопросов и по порядку отвечаем на них уже устно.
1. На каких способах теплопередачи основано отопление?
2. Какие способы теплопередачи отвечают за нагревание воды в кастрюле?
3. Чтобы деревья зимой не вымерзли, приствольные круги посыпают соломой, опилками, торфом. Для чего?
4. В какой цвет окрашивают наружные поверхности самолетов, искусственных спутников Земли, воздушных шаров чтобы избежать перегрева?
5. Благодаря какому способу теплопередачи можно греться у костра?
6. Почему алюминиевая кружка с чаем обжигает губы, а фарфоровая нет?
7. Почему грязный снег в солнечную
погоду тает быстрее, чем чистый?
Почему грязный снег в солнечную
погоду тает быстрее, чем чистый?
8. По каким соображениям холодильники изнутри и снаружи красят в белый цвет?
9. Удельная теплоемкость свинца равна 140 Дж/(кг°С). Что это означает?
10. Почему чаще всего вода используется в системе отопления домов, в системе охлаждения двигателей?
11. Какое вещество при сжигании выделяет больше всего энергии?
12. Что показывает удельная теплота сгорания топлива? Например, что означает q=46МДж/кг для бензина?
13. Стальную и медную заготовки нагрели до одинаковой температуры и для закалки опустили в воду. Одинаковое ли количество теплоты отдали заготовки, если массы деталей равны?
14*. Что требует больше времени: нагревание воды на плите от 10 до 20°С или от 90 до 100°С?
15*. Почему нельзя расплавить гвоздь в
пламени свечи?
Почему нельзя расплавить гвоздь в
пламени свечи?
Этап 3. Физический эксперимент.
Каждый школьник получает карточку с описанием физического эксперимента и таблицей результатов, в которой заполнена лишь одна строка с данными.
Школьники с одинаковым экспериментом объединяются в группу, обмениваются данными, заполняют всю таблицу и формулируют вывод.
Каждая группа выступает с описанием эксперимента, для наглядности используя необходимое оборудование, представляет итоговую таблицу и вывод.
В классе предварительно можно выбрать среди учеников – экспертов, например, школьников лучше всего проявивших себя в ответах на вопросы I уровня.
Эксперты сразу получают заполненную
таблицу с экспериментальными данными и, после
индивидуального обсуждения с учителем вывода,
выступают в роли экзаменаторов групп.
Примеры физических экспериментов.
Сравнение теплоемкости веществ.
Приборы и материалы: набор цилиндров одинаковой массы из стали, меди, алюминия; сосуд с горячей водой; пластинка из парафина.
Задание: опустите цилиндр в сосуд с горячей водой и подержите 3-4 мин. Затем аккуратно поставьте их на парафиновую пластинку и пронаблюдайте за плавлением парафина под каждым цилиндром. Сделайте вывод.
Материал |
Глубина погружения цилиндра в пластину из парафина, мм |
Сталь |
2 |
Алюминий |
4 |
Медь |
1 |
Вывод: Максимальная теплоемкость у
алюминия, минимальная – у меди.
(сравниваем также по таблице “Удельная теплоемкость некоторых веществ”)
Наблюдение за процессом горения веществ.
Приборы и материалы: пробирки с одинаковым объемом воды, сухой спирт, бензин в горелке, спирт в горелке, термометр.
Задание: отмерьте одинаковые массы бензина, спирта и сухого спирта. Аккуратно сжигая одинаковые количества горючего, проследите, как изменяется температура в нагреваемых пробирках. Оцените количество теплоты, полученное пробиркой с водой. Сделайте вывод.
Сжигаемое вещество |
Температура воды t, °С |
Масса воды m, кг |
Количество
теплоты, полученное пробиркой |
|
начальная |
конечная |
|||
Бензин |
20 |
30 |
0,1 |
4200 |
Спирт |
20 |
24 |
0,1 |
1680 |
Сухой спирт |
20 |
26 |
0,1 |
2520 |
Вывод:
_Самая большая удельная теплота
сгорания – у бензина, минимальная у спирта. _
_
(Сравниваем также по таблице “Удельная теплота сгорания некоторых видов топлива”, комментарий – как вычислена последняя колонка таблицы?)
Этап 4. Решение индивидуальных заданий II и III уровня.
Каждый школьник решает одну задачу из II и из III уровня сложности.
II уровень. Задачи.
Дано: = = _____________ — ? |
Решение. (формула) (вычисления) Ответ: |
1. Какую массу воды можно нагреть от 15 до 45°С, затратив для этого энергию 1260кДж?
2. На сколько градусов остынет вода
объёмом 100л, если отдаст в окружающую среду 1680 кДж
энергии?
На сколько градусов остынет вода
объёмом 100л, если отдаст в окружающую среду 1680 кДж
энергии?
3. Определите удельную теплоемкость металла массой 100г, если при нагревании от 20 до 40°С внутренняя энергия увеличилась на 280 Дж?
4. Какое количество теплоты выделится при сжигании 2 т нефти?
5. Какую массу природного газа необходимо сжечь, чтобы получить 8,8 МДж энергии?
6. При горении 200г вещества выделилось 2,8 МДж энергии. Что это за вещество?
III уровень. Задачи.
1. На сколько градусов нагреются 2 л воды, если им передать все тепло от горения 20 г сухих дров?
2. Какую массу олова можно нагреть на 100°С, если передать олову всю энергию, выделившуюся при горении 200 г спирта?
3. Сколько дров необходимо сжечь, чтобы нагреть воду массой 5 кг на 50 °С?
4. Сколько спирта необходимо сжечь,
чтобы нагреть стальную деталь массой 500г от 20 до
120°С?
Сколько спирта необходимо сжечь,
чтобы нагреть стальную деталь массой 500г от 20 до
120°С?
5*. В медной кастрюле массой 5 кг нагревают 10 л воды от 10°С до кипения. Определите расход керосина, считая, что вся теплота, выделившаяся при сгорании, пошла на нагревание воды и кастрюли.
6*. Определить КПД спиртовки, в которой при нагревании 300г воды от 20 до 100°С сгорело 12г спирта.
В случае недостаточного количества времени задача III уровня сложности остается для домашней работы.
Проверка заданий и оценивание школьников осуществляется в ходе урока, при необходимости карточки с решением задач собираются для проверки.
Подведение итогов.
Домашнее задание.
Список литературы
А.В. Пёрышкин «Физика — 8 класс”
А. В. Пёрышкин «Сборник задач по
физике. 7-9 классы”
В. Пёрышкин «Сборник задач по
физике. 7-9 классы”
Л.А. Кирик «Физика-8″ Методические материалы
А.И. Сёмке «Занимательные материалы к урокам. Физика 8 класс»
А.Е. Марон, Е.А. Марон “Опорные конспекты и дифференцированные задачи по физике. 7, 8, 9 классы”
http://www.bbc.co.uk/schools/ks3bitesize/science/energy_electricity_forces/energy_transfer_storage/activity.shtml
Физика 8 класс. Количество теплоты. Удельная теплоемкость. Топливо.
Физика 8 класс Конспект Количество теплотыКоличество теплоты. Удельная теплоемкость. Топливо.
Внутренняя энергия тела может изменяться как при совершении работы, так и путем теплопередачи (без совершения работы). Если изменение внутренней энергии происходит путем теплопередачи, то переход энергии от одних тел к другим осуществляется теплопроводностью, конвекцией или излучением.
Количество энергии, переданной от одного тела к другому в процессе теплопередачи, называют количеством теплоты.
Количество теплоты, которое необходимо для нагревания тела (или выделяемое при остывании), зависит от массы этого тела, от изменения его температуры и рода вещества.
Количество теплоты обозначают буквой Q, измеряют в джоулях (Дж) или в килоджоулях (кДж).
1 кДж = 1 000 Дж
Количество теплоты измеряют также в калориях (кал) или килокалориях (ккал)
1 ккал = 1 000 кал.
Калория – это количество теплоты, которое необходимо для нагревания 1 г воды на 1 ºС.
1 кал = 4,19 Дж
1 ккал = 4190 Дж = 4,19 кДж.
Физическая величина равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1ºС, называется удельной теплоёмкостью вещества.
Удельная теплоемкость обозначается буквой с и измеряется в Дж/кг ºС.
Пример удельной теплоемкости:
удельная теплоемкость воды 4200 Дж/кг ºС — это означает, что для нагревания воды массой 1 кг на 1 ºС необходимо количество теплоты, равное 4200 Дж.
Удельная теплоемкость вещества, находящегося в различных агрегатных состояниях, различна.
Количество теплоты. Удельная теплоемкостьЧтобы рассчитать количество теплоты, необходимое для нагревания тела или выделяемое при охлаждении, следует:
удельную теплоемкость умножить на массу тела и на разность между конечной и начальной температурами.
где с – удельная теплоемкость, m – масса, t2 – конечная температура,
t1 – начальная температура тела.
Топливо — это горючее вещество, которое используется для получения некоторого количества теплоты.
Топливо используют для кипячения воды, приготовления пищи, обогревания жилища, езды на автомобиле.
Самые распространенные виды топлива: газ, нефть, дерево, уголь, бензин.
Топливо — источник энергииПримеры топлива:
твердые виды топлива: уголь, сера, фосфор
жидкие виды топлива: нефть, бензин, керосин, эфир, спирт, ацетон
газообразные виды топлива: водород, метан, пропан, ацетилен.
Основные свойства топлива
- горючее вещество, которое при сгорании выделяет тепло
- вещество должно иметь небольшую температуру воспламенения
- топливом может быть горючее вещество, продукты сгорания которого безвредны
- топливом могут стать только широко распространенные, сравнительно лёгкие в добыче и удобные для транспортировки вещества.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой 1 кг, называется удельной теплотой сгорания топлива.
Удельная теплота сгорания топлива обозначается буквой q. Единицей удельной теплоты сгорания является 1 Дж/кг.
Общее количество теплоты Q, выделяемое при сгорании m кг топлива, вычисляется по формуле
где q — удельная теплота сгорания топлива, m — масса топлива.
Пример удельной теплоты топлива:
удельная теплота сгорания бензина 4,6 · 107 Дж/кг – это значит, что при полном сгорании бензина массой 1 кг выделяется 4,6 · 107 Дж энергии.
Конспект составлен на основании теоретического материала учебника «Физика 8 класс» А.В. Перышкин, «Физика 8 класс»А.В.Грачев.
Скачать конспект:
Похожие записи:
Количество теплоты. Уравнение теплового баланса
Количество теплоты. Уравнение теплового баланса
- Подробности
- Просмотров: 666
«Физика — 10 класс»
В каких процессах происходят агрегатные превращения вещества?
Как можно изменить агрегатное состояние вещества?
Изменить внутреннюю энергию любого тела можно, совершая работу, нагревая или, наоборот, охлаждая его.
Так, при ковке металла совершается работа, и он разогревается, в то же время металл можно разогреть над горящим пламенем.
Также если закрепить поршень (рис. 13.5), то объём газа при нагревании не меняется и работа не совершается. Но температура газа, а следовательно, и его внутренняя энергия возрастают.
Внутренняя энергия может увеличиваться и уменьшаться, поэтому количество теплоты может быть положительным и отрицательным.
Процесс передачи энергии от одного тела другому без совершения работы называют теплообменом.
Количественную меру изменения внутренней энергии при теплообмене называют количеством теплоты.
Молекулярная картина теплообмена.
При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии более нагретого тела передаётся менее нагретому телу.
Количество теплоты и теплоёмкость.
Вам уже известно, что для нагревания тела массой т от температуры t1 до температуры t2 необходимо передать ему количество теплоты:
Q = cm(t2 — t1) = cm Δt. (13.5)
При остывании тела его конечная температура t2 оказывается меньше начальной температуры t1 и количество теплоты, отдаваемой телом, отрицательно.
Коэффициент с в формуле (13.5) называют удельной теплоёмкостью вещества.
Удельная теплоёмкость — это величина, численно равная количеству теплоты, которую получает или отдаёт вещество массой 1 кг при изменении его температуры на 1 К.
Удельная теплоёмкость газов зависит от того, при каком процессе осуществляется теплопередача. Если нагревать газ при постоянном давлении, то он будет расширяться и совершать работу. Для нагревания газа на 1 °С при постоянном давлении ему нужно передать большее количество теплоты, чем для нагревания его при постоянном объёме, когда газ будет только нагреваться.
Если нагревать газ при постоянном давлении, то он будет расширяться и совершать работу. Для нагревания газа на 1 °С при постоянном давлении ему нужно передать большее количество теплоты, чем для нагревания его при постоянном объёме, когда газ будет только нагреваться.
Жидкие и твёрдые тела расширяются при нагревании незначительно. Их удельные теплоёмкости при постоянном объёме и постоянном давлении мало различаются.
Удельная теплота парообразования.
Для превращения жидкости в пар в процессе кипения необходима передача ей определённого количества теплоты. Температура жидкости при кипении не меняется. Превращение жидкости в пар при постоянной температуре не ведёт к увеличению кинетической энергии молекул, но сопровождается увеличением потенциальной энергии их взаимодействия. Ведь среднее расстояние между молекулами газа много больше, чем между молекулами жидкости.
Величину, численно равную количеству теплоты, необходимой для превращения при постоянной температуре жидкости массой 1 кг в пар, называют удельной теплотой парообразования.
Процесс испарения жидкости происходит при любой температуре, при этом жидкость покидают самые быстрые молекулы, и она при испарении охлаждается. Удельная теплота испарения равна удельной теплоте парообразования.
Эту величину обозначают буквой r и выражают в джоулях на килограмм (Дж/кг).
Очень велика удельная теплота парообразования воды: rН20 = 2,256 • 106 Дж/кг при температуре 100 °С. У других жидкостей, например у спирта, эфира, ртути, керосина, удельная теплота парообразования меньше в 3—10 раз, чем у воды.
Для превращения жидкости массой m в пар требуется количество теплоты, равное:
Qп = rm. (13.6)
При конденсации пара происходит выделение такого же количества теплоты:
Qк = -rm. (13.7)
Удельная теплота плавления.
При плавлении кристаллического тела всё подводимое к нему тепло идёт на увеличение потенциальной энергии взаимодействия молекул. Кинетическая энергия молекул не меняется, так как плавление происходит при постоянной температуре.
Кинетическая энергия молекул не меняется, так как плавление происходит при постоянной температуре.
Величину, численно равную количеству теплоты, необходимой для превращения кристаллического вещества массой 1 кг при температуре плавления в жидкость, называют удельной теплотой плавления и обозначают буквой λ.
При кристаллизации вещества массой 1 кг выделяется точно такое же количество теплоты, какое поглощается при плавлении.
Удельная теплота плавления льда довольно велика: 3,34 • 105 Дж/кг.
«Если бы лёд не обладал большой теплотой плавления, то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота непрерывно передаётся льду из воздуха. Последствия этого были бы ужасны; ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда или снега». Р. Блек, XVIII в.
Для того чтобы расплавить кристаллическое тело массой m, необходимо количество теплоты, равное:
Qпл = λm. (13.8)
(13.8)
Количество теплоты, выделяемой при кристаллизации тела, равно:
Qкр = -λm (13.9)
Уравнение теплового баланса.
Рассмотрим теплообмен внутри системы, состоящей из нескольких тел, имеющих первоначально различные температуры, например теплообмен между водой в сосуде и опущенным в воду горячим железным шариком. Согласно закону сохранения энергии количество теплоты, отданной одним телом, численно равно количеству теплоты, полученной другим.
Отданное количество теплоты считается отрицательным, полученное количество теплоты — положительным. Поэтому суммарное количество теплоты Q1 + Q2 = 0.
Если в изолированной системе происходит теплообмен между несколькими телами, то
Q1 + Q2 + Q3 + … = 0. (13.10)
Уравнение (13.10) называется уравнением теплового баланса.
Здесь Q1, Q2, Q3 — количества теплоты, полученной или отданной телами. Эти количества теплоты выражаются формулой (13.5) или формулами (13.6)—(13.9), если в процессе теплообмена происходят различные фазовые превращения вещества (плавление, кристаллизация, парообразование, конденсация).
Эти количества теплоты выражаются формулой (13.5) или формулами (13.6)—(13.9), если в процессе теплообмена происходят различные фазовые превращения вещества (плавление, кристаллизация, парообразование, конденсация).
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основы термодинамики. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Насыщенный пар —
Давление насыщенного пара —
Влажность воздуха —
Примеры решения задач по теме «Насыщенный пар. Влажность воздуха» —
Кристаллические тела —
Аморфные тела —
Внутренняя энергия —
Работа в термодинамике —
Примеры решения задач по теме «Внутренняя энергия. Работа» —
Количество теплоты. Уравнение теплового баланса —
Примеры решения задач по теме: «Количество теплоты. Уравнение теплового баланса» —
Первый закон термодинамики —
Применение первого закона термодинамики к различным процессам —
Примеры решения задач по теме: «Первый закон термодинамики» —
Второй закон термодинамики —
Статистический характер второго закона термодинамики —
Принцип действия тепловых двигателей. Коэффициент полезного действия (КПД) тепловых двигателей —
Примеры решения задач по теме: «КПД тепловых двигателей»
Коэффициент полезного действия (КПД) тепловых двигателей —
Примеры решения задач по теме: «КПД тепловых двигателей»
Учебное пособие по физике
Ранее в этом уроке было дано пять определений температуры в словарном стиле. Их было:
- Степень жара или холода тела или окружающей среды.
- Мера теплоты или холодности объекта или вещества по отношению к некоторому стандартному значению.
- Мера средней кинетической энергии частиц в образце вещества, выраженная в единицах или градусах по стандартной шкале.
- Мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.
- Любой из различных стандартных числовых показателей этой способности, таких как шкала Кельвина, Фаренгейта и Цельсия
Как уже упоминалось, первые два пункта имеют довольно очевидное значение. Третий пункт списка был темой предыдущей страницы этого урока. Пятым пунктом было определение, с которого мы начали, когда обсуждали температуру и работу термометров; это была тема второй страницы этого урока.Это оставляет нам четвертый пункт — определение температуры с точки зрения способности вещества передавать тепло другому веществу. Эта часть Урока 1 посвящена пониманию того, как относительная температура двух объектов влияет на направление передачи тепла между двумя объектами.
Пятым пунктом было определение, с которого мы начали, когда обсуждали температуру и работу термометров; это была тема второй страницы этого урока.Это оставляет нам четвертый пункт — определение температуры с точки зрения способности вещества передавать тепло другому веществу. Эта часть Урока 1 посвящена пониманию того, как относительная температура двух объектов влияет на направление передачи тепла между двумя объектами.
Представьте себе очень горячую кружку кофе на кухонном столе. В целях обсуждения мы будем говорить, что чашка кофе имеет температуру 80°C и что окружающая среда (столешница, воздух на кухне и т.) имеет температуру 26°С. Как вы думаете, что произойдет в этой ситуации? Я подозреваю, что вы знаете, что чашка кофе со временем постепенно остывает. При температуре 80°C вы не посмеете пить кофе. Даже кофейная кружка, скорее всего, будет слишком горячей, чтобы до нее можно было дотронуться. Но со временем и кофейная кружка, и кофе остынут. Скоро будет питьевая температура. И если вы не поддадитесь искушению выпить кофе, он в конечном итоге станет комнатной температуры. Кофе охлаждается с 80°C до примерно 26°C.Так что же происходит с течением времени, из-за чего кофе остывает? Ответом на этот вопрос может быть как макроскопический , так и макроскопический характер.
Скоро будет питьевая температура. И если вы не поддадитесь искушению выпить кофе, он в конечном итоге станет комнатной температуры. Кофе охлаждается с 80°C до примерно 26°C.Так что же происходит с течением времени, из-за чего кофе остывает? Ответом на этот вопрос может быть как макроскопический , так и макроскопический характер.
На макроскопическом уровне мы бы сказали, что кофе и кружка передают тепло окружающей среде. Эта передача тепла происходит от горячего кофе и горячей кружки к окружающему воздуху. Тот факт, что кофе понижает свою температуру, является признаком того, что средняя кинетическая энергия его частиц уменьшается.Кофе теряет энергию. Кружка также снижает свою температуру; средняя кинетическая энергия его частиц также уменьшается. Кружка тоже теряет энергию. Энергия, которая теряется из-за кофе и кружки, передается в более холодную среду. Эту передачу энергии от кофе и кружки к окружающему воздуху и столешнице мы называем теплом. В этом смысле тепло — это просто передача энергии от горячего объекта к более холодному.
В этом смысле тепло — это просто передача энергии от горячего объекта к более холодному.
Теперь давайте рассмотрим другой сценарий — банку холодной газировки, поставленную на ту же кухонную стойку.В целях обсуждения мы скажем, что газировка и банка, в которой она содержится, имеют температуру 5°C, а окружающая среда (столешница, воздух на кухне и т. д.) имеет температуру 26°C. Что произойдет с холодной банкой газировки с течением времени? Еще раз, я подозреваю, что вы знаете ответ. Колд поп и контейнер нагреются до комнатной температуры. Но что происходит, что заставляет эти объекты с температурой ниже комнатной повышать свою температуру? Холод уходит от шипучки и контейнера с ней? Нет! Нет такой вещи, как холод, ускользающий от или протечка .Скорее, наше объяснение очень похоже на объяснение, используемое для объяснения того, почему кофе остывает. Есть теплообмен.
Со временем поп и контейнер нагреваются. Температура повышается с 5°C до почти 26°C.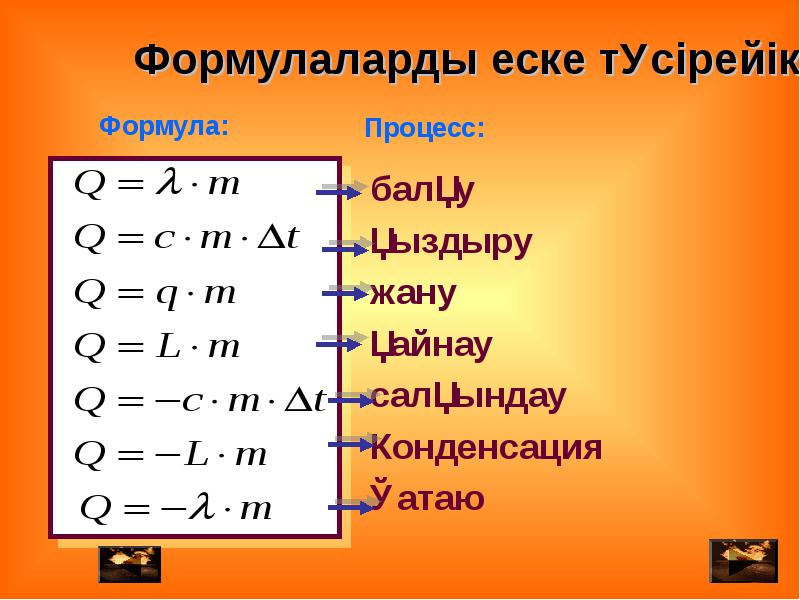 Это повышение температуры является признаком того, что средняя кинетическая энергия частиц внутри шипучки и контейнера увеличивается. Чтобы частицы внутри шипучки и контейнера увеличили свою кинетическую энергию, они должны откуда-то получать энергию.Но откуда? Энергия передается из окружающей среды (столешница, воздух на кухне и т. д.) в виде тепла. Как и в случае с охлаждающей кофейной кружкой, энергия передается от объектов с более высокой температурой к объекту с более низкой температурой. Еще раз, это известно как тепло — передача энергии от объекта с более высокой температурой к объекту с более низкой температурой.
Это повышение температуры является признаком того, что средняя кинетическая энергия частиц внутри шипучки и контейнера увеличивается. Чтобы частицы внутри шипучки и контейнера увеличили свою кинетическую энергию, они должны откуда-то получать энергию.Но откуда? Энергия передается из окружающей среды (столешница, воздух на кухне и т. д.) в виде тепла. Как и в случае с охлаждающей кофейной кружкой, энергия передается от объектов с более высокой температурой к объекту с более низкой температурой. Еще раз, это известно как тепло — передача энергии от объекта с более высокой температурой к объекту с более низкой температурой.
Оба этих сценария можно описать двумя простыми утверждениями.Объект снижает свою температуру, выделяя энергию в виде тепла в окружающую среду. И объект увеличивает свою температуру, получая энергию в виде тепла от своего окружения. И , нагревающий , и , охлаждающий объектов, работают одинаково — путем передачи тепла от объекта с более высокой температурой к объекту с более низкой температурой. Итак, теперь мы можем осмысленно переформулировать определение температуры. Температура — это мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.Чем выше температура объекта, тем больше склонность этого объекта к передаче тепла. Чем ниже температура объекта, тем больше вероятность того, что этот объект окажется на принимающей стороне теплопередачи.
Итак, теперь мы можем осмысленно переформулировать определение температуры. Температура — это мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе.Чем выше температура объекта, тем больше склонность этого объекта к передаче тепла. Чем ниже температура объекта, тем больше вероятность того, что этот объект окажется на принимающей стороне теплопередачи.
Но, возможно, вы спрашивали: что происходит с температурой окружающей среды? Повышается ли температура столешницы и воздуха на кухне, когда кружка и кофе остывают? И понижается ли температура столешницы и воздуха на кухне, когда банка и ее попка нагреваются? Ответ – твердое Да! Доказательство? Просто коснитесь столешницы — она должна стать прохладнее или теплее, чем до того, как на нее поставили кофейную кружку или банку с газировкой.А как же воздух на кухне? Теперь немного сложнее представить убедительное доказательство. Тот факт, что объем воздуха в комнате настолько велик и что энергия быстро рассеивается от поверхности кружки, означает, что изменение температуры воздуха на кухне будет аномально малым. На самом деле это будет пренебрежимо малое . Прежде чем произойдет заметное изменение температуры, должно произойти намного больше теплопередачи.
На самом деле это будет пренебрежимо малое . Прежде чем произойдет заметное изменение температуры, должно произойти намного больше теплопередачи.
При обсуждении охлаждения кофейной кружки столешница и воздух на кухне упоминались как окружение .В физических дискуссиях такого типа обычно используется ментальная структура системы и окружения . Кофейная кружка (и кофе) будет рассматриваться как система , а все остальное во вселенной будет рассматриваться как окружение . Для простоты мы часто сужаем область окружения от остальной вселенной до тех объектов, которые непосредственно окружают систему. Этот подход к анализу ситуации с точки зрения системы и окружения настолько полезен, что мы будем использовать его в оставшейся части этой главы и в следующей.
Теперь представим третью ситуацию. Предположим, что маленькая металлическая чашка с горячей водой помещена внутрь большой пенопластовой чашки с холодной водой.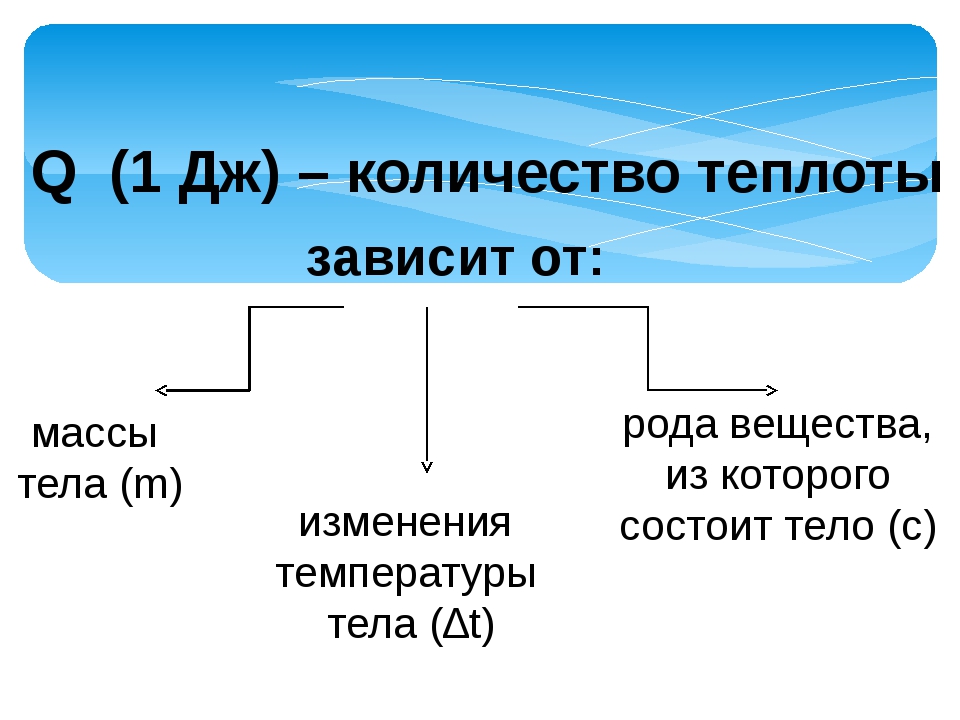 Предположим, что температура горячей воды изначально равна 70°С, а температура холодной воды во внешнем стакане изначально равна 5°С. И давайте предположим, что обе чашки снабжены термометрами (или датчиками температуры), которые измеряют температуру воды в каждой чашке с течением времени. Как вы думаете, что произойдет? Прежде чем читать дальше, подумайте над вопросом и придумайте какой-либо вариант ответа.Когда холодная вода нагревается, а горячая охлаждается, будут ли их температуры одинаковыми или разными? Будет ли холодная вода нагреваться до более низкой температуры, чем температура, до которой остывает горячая вода? Или по мере нагревания и охлаждения их температуры будут пересекаться друг с другом ?
Предположим, что температура горячей воды изначально равна 70°С, а температура холодной воды во внешнем стакане изначально равна 5°С. И давайте предположим, что обе чашки снабжены термометрами (или датчиками температуры), которые измеряют температуру воды в каждой чашке с течением времени. Как вы думаете, что произойдет? Прежде чем читать дальше, подумайте над вопросом и придумайте какой-либо вариант ответа.Когда холодная вода нагревается, а горячая охлаждается, будут ли их температуры одинаковыми или разными? Будет ли холодная вода нагреваться до более низкой температуры, чем температура, до которой остывает горячая вода? Или по мере нагревания и охлаждения их температуры будут пересекаться друг с другом ?
К счастью, этот эксперимент можно провести, и он уже неоднократно проводился. График ниже является типичным представлением результатов.
Как видно из графика, горячая вода остыла примерно до 30°C, а холодная вода нагрелась примерно до такой же температуры. Тепло передается от объекта с высокой температурой (внутренняя банка с горячей водой) к объекту с низкой температурой (внешняя банка с холодной водой). Если мы обозначим внутреннюю чашу с горячей водой как систему , то мы можем сказать, что существует поток тепла от системы к окружающей среде .Пока существует разница температур между системой и окружающей средой, между ними существует тепловой поток. Поток тепла сначала более быстрый, как показано более крутыми наклонами линий. Со временем разница температур между системой и окружающей средой уменьшается, а скорость теплообмена снижается. Это обозначено более пологим наклоном двух линий. (Подробная информация о скорости теплопередачи будет обсуждаться далее в этом уроке.) В конце концов, температура системы и окружающей среды достигает одинаковой температуры, и теплопередача прекращается.Говорят, что именно в этот момент два объекта достигли теплового равновесия.
Тепло передается от объекта с высокой температурой (внутренняя банка с горячей водой) к объекту с низкой температурой (внешняя банка с холодной водой). Если мы обозначим внутреннюю чашу с горячей водой как систему , то мы можем сказать, что существует поток тепла от системы к окружающей среде .Пока существует разница температур между системой и окружающей средой, между ними существует тепловой поток. Поток тепла сначала более быстрый, как показано более крутыми наклонами линий. Со временем разница температур между системой и окружающей средой уменьшается, а скорость теплообмена снижается. Это обозначено более пологим наклоном двух линий. (Подробная информация о скорости теплопередачи будет обсуждаться далее в этом уроке.) В конце концов, температура системы и окружающей среды достигает одинаковой температуры, и теплопередача прекращается.Говорят, что именно в этот момент два объекта достигли теплового равновесия.
В нашей главе об электрических цепях мы узнали, что разница в электрическом потенциале между двумя точками вызывает поток заряда вдоль проводящего пути между этими точками. Пока сохраняется разность электрических потенциалов, будет существовать поток заряда. Теперь в этой главе мы изучаем аналогичный принцип, связанный с потоком тепла.Разница температур между двумя точками вызовет поток тепла вдоль (теплопроводящего) пути между этими двумя точками. Пока сохраняется разница температур, будет происходить поток тепла. Этот поток тепла продолжается до тех пор, пока два объекта не достигнут одинаковой температуры. Как только их температуры становятся равными, говорят, что они находятся в тепловом равновесии, и поток тепла больше не происходит.
Пока сохраняется разность электрических потенциалов, будет существовать поток заряда. Теперь в этой главе мы изучаем аналогичный принцип, связанный с потоком тепла.Разница температур между двумя точками вызовет поток тепла вдоль (теплопроводящего) пути между этими двумя точками. Пока сохраняется разница температур, будет происходить поток тепла. Этот поток тепла продолжается до тех пор, пока два объекта не достигнут одинаковой температуры. Как только их температуры становятся равными, говорят, что они находятся в тепловом равновесии, и поток тепла больше не происходит.
Этот принцип иногда называют нулевым законом термодинамики.Этот принцип был формализован в закон после того, как были открыты первый, второй и третий законы термодинамики . Но поскольку этот закон казался более фундаментальным, чем три ранее открытых, он был назван нулевым законом . Все объекты подчиняются этому закону — стремлению к тепловому равновесию. Это ежедневный вызов для тех, кто хочет контролировать температуру своего тела, еды, напитков и дома. Мы используем лед и изоляцию, чтобы сохранить холодными наши холодные напитки, и мы используем изоляцию и непрерывные импульсы микроволновой энергии, чтобы наши горячие напитки оставались горячими.Мы оборудуем наши автомобили, наши дома и офисные здания кондиционерами и вентиляторами, чтобы в теплые летние месяцы в них не было жары. И мы оборудуем эти же автомобили и здания печами и обогревателями, чтобы согревать их в холодные зимние месяцы. Всякий раз, когда какая-либо из этих систем имеет температуру, отличную от температуры окружающей среды, и не полностью изолирована от окружающей среды (идеальная ситуация), тепло будет течь. Этот тепловой поток будет продолжаться до тех пор, пока температура системы и окружающей среды не сравняется.Поскольку эти системы имеют значительно меньший объем, чем окружающая среда, будет более заметное и существенное изменение температуры этих систем.
Мы используем лед и изоляцию, чтобы сохранить холодными наши холодные напитки, и мы используем изоляцию и непрерывные импульсы микроволновой энергии, чтобы наши горячие напитки оставались горячими.Мы оборудуем наши автомобили, наши дома и офисные здания кондиционерами и вентиляторами, чтобы в теплые летние месяцы в них не было жары. И мы оборудуем эти же автомобили и здания печами и обогревателями, чтобы согревать их в холодные зимние месяцы. Всякий раз, когда какая-либо из этих систем имеет температуру, отличную от температуры окружающей среды, и не полностью изолирована от окружающей среды (идеальная ситуация), тепло будет течь. Этот тепловой поток будет продолжаться до тех пор, пока температура системы и окружающей среды не сравняется.Поскольку эти системы имеют значительно меньший объем, чем окружающая среда, будет более заметное и существенное изменение температуры этих систем.
Калорическая теория
Ученые долго размышляли над природой тепла. Вплоть до середины 19 века наиболее общепринятым понятием тепла было то, что оно связывалось с жидкостью, известной как теплотворная среда. Известный химик Антуан Лавуазье пришел к выводу, что существует две формы теплотворной способности: та, которая находится в скрытом виде или хранится в горючих материалах, и та, которая ощущается и наблюдается при изменении температуры.Для Лавуазье и его последователей сжигание топлива приводило к высвобождению этого скрытого тепла в окружающую среду, где наблюдалось изменение температуры окружающей среды. Для Лавуазье и его последователей тепло присутствовало всегда — либо в скрытой, либо в ощутимой форме. Если горячий чайник с водой охлаждался до комнатной температуры, это объяснялось потоком калорий из горячей воды в окружающую среду.
Вплоть до середины 19 века наиболее общепринятым понятием тепла было то, что оно связывалось с жидкостью, известной как теплотворная среда. Известный химик Антуан Лавуазье пришел к выводу, что существует две формы теплотворной способности: та, которая находится в скрытом виде или хранится в горючих материалах, и та, которая ощущается и наблюдается при изменении температуры.Для Лавуазье и его последователей сжигание топлива приводило к высвобождению этого скрытого тепла в окружающую среду, где наблюдалось изменение температуры окружающей среды. Для Лавуазье и его последователей тепло присутствовало всегда — либо в скрытой, либо в ощутимой форме. Если горячий чайник с водой охлаждался до комнатной температуры, это объяснялось потоком калорий из горячей воды в окружающую среду.
Согласно теории теплоты, тепло было материальным в природе.Это была физическая субстанция. Это было материала . Как и все в мире Лавуазье, калорийность была законсервированной субстанцией. Подобно нашему современному взгляду на тепло, точка зрения калориста заключалась в том, что если калория выделяется одним объектом, то ее получает другой объект. Общее количество калорий никогда не менялось; оно просто переносилось с одного объекта на другой и трансформировалось из одного типа (латентного) в другой тип (чувственный). Но в отличие от нашего современного взгляда на тепло, теплород был реальной физической субстанцией — жидкостью, которая могла перетекать от одного объекта к другому.И в отличие от нашего современного представления, тепло всегда присутствовало в той или иной форме. Наконец, с современной точки зрения, теплота присутствует только тогда, когда есть передача энергии. Бессмысленно говорить о тепле как о существующем после того, как два объекта пришли к тепловому равновесию. Тепло не содержится в объекте; скорее это нечто, передаваемое между объектами. Тепло больше не существует, когда передача прекращается.
Подобно нашему современному взгляду на тепло, точка зрения калориста заключалась в том, что если калория выделяется одним объектом, то ее получает другой объект. Общее количество калорий никогда не менялось; оно просто переносилось с одного объекта на другой и трансформировалось из одного типа (латентного) в другой тип (чувственный). Но в отличие от нашего современного взгляда на тепло, теплород был реальной физической субстанцией — жидкостью, которая могла перетекать от одного объекта к другому.И в отличие от нашего современного представления, тепло всегда присутствовало в той или иной форме. Наконец, с современной точки зрения, теплота присутствует только тогда, когда есть передача энергии. Бессмысленно говорить о тепле как о существующем после того, как два объекта пришли к тепловому равновесию. Тепло не содержится в объекте; скорее это нечто, передаваемое между объектами. Тепло больше не существует, когда передача прекращается.
Падение теории калорийности
Хотя всегда существовали альтернативы калорийной теории, до середины 19 века она была наиболее распространенной точкой зрения. Одним из первых вызовов теории калорий выступил англо-американский ученый Бенджамин Томпсон (также известный как граф Рамфорд). Томпсон был одним из первых ученых, которым было поручено рассверливать стволы пушек для британского правительства. Томпсон был поражен высокими температурами, достигаемыми пушками, и стружкой, которая выпадала из пушек в процессе сверления. В одном эксперименте он погрузил пушку в резервуар с водой во время процесса бурения и заметил, что тепло, выделяемое в процессе бурения, способно вскипятить окружающую воду в течение нескольких часов.Томпсон продемонстрировал, что это тепловыделение происходило без каких-либо химических или физических изменений в составе пушки. Он приписывал выделение тепла трению между пушкой и буровым инструментом и утверждал, что это не могло быть результатом попадания жидкости в воду. В 1798 году Томпсон опубликовал статью, в которой оспаривал представление о том, что тепло — это сохраняющаяся жидкость. Он отстаивал механический взгляд на тепло, предполагая, что его происхождение связано с движением атомов, а не с переносом жидкости.
Одним из первых вызовов теории калорий выступил англо-американский ученый Бенджамин Томпсон (также известный как граф Рамфорд). Томпсон был одним из первых ученых, которым было поручено рассверливать стволы пушек для британского правительства. Томпсон был поражен высокими температурами, достигаемыми пушками, и стружкой, которая выпадала из пушек в процессе сверления. В одном эксперименте он погрузил пушку в резервуар с водой во время процесса бурения и заметил, что тепло, выделяемое в процессе бурения, способно вскипятить окружающую воду в течение нескольких часов.Томпсон продемонстрировал, что это тепловыделение происходило без каких-либо химических или физических изменений в составе пушки. Он приписывал выделение тепла трению между пушкой и буровым инструментом и утверждал, что это не могло быть результатом попадания жидкости в воду. В 1798 году Томпсон опубликовал статью, в которой оспаривал представление о том, что тепло — это сохраняющаяся жидкость. Он отстаивал механический взгляд на тепло, предполагая, что его происхождение связано с движением атомов, а не с переносом жидкости.
Английский физик Джеймс Прескотт Джоуль продолжил то, на чем остановился Томпсон, нанеся несколько смертельных ударов по теории калорий посредством серии экспериментов. Джоуль, в честь которого теперь названа стандартная метрическая единица энергии, проводил опыты, в которых экспериментально связывал количество механической работы с количеством теплоты, переданной от механической системы. В одном эксперименте Джоуль позволил падающим грузам вращать гребное колесо, погруженное в резервуар с водой.Рисунок аппарата изображен справа (из Викимедиа; общественное достояние). Падающие грузы воздействовали на гребное колесо, которое, в свою очередь, нагревало воду. Джоуль измерял как количество выполненной механической работы, так и количество тепла, полученного водой. Подобные эксперименты, демонстрирующие, что тепло может генерироваться электрическим током, нанесли еще один удар по представлению о том, что тепло — это жидкость, которая содержится в веществах и всегда сохраняется.
Как мы подробно узнаем из следующей главы, объекты обладают внутренней энергией. В химических реакциях часть этой энергии может выделяться в окружающую среду в виде тепла. Однако эта внутренняя энергия не является материальной субстанцией или жидкостью, содержащейся в объекте. Это просто потенциальная энергия, хранящаяся в связях, удерживающих вместе частицы внутри объекта. Тепло или тепловая энергия — это форма, которой обладает эта энергия, когда она передается между системами и окружением . В тепле нет ничего материального. Это не вещество и не жидкость, которые сохраняются.Тепло – это форма энергии, которая может передаваться от одного объекта к другому или даже создаваться за счет потери других форм энергии.
В химических реакциях часть этой энергии может выделяться в окружающую среду в виде тепла. Однако эта внутренняя энергия не является материальной субстанцией или жидкостью, содержащейся в объекте. Это просто потенциальная энергия, хранящаяся в связях, удерживающих вместе частицы внутри объекта. Тепло или тепловая энергия — это форма, которой обладает эта энергия, когда она передается между системами и окружением . В тепле нет ничего материального. Это не вещество и не жидкость, которые сохраняются.Тепло – это форма энергии, которая может передаваться от одного объекта к другому или даже создаваться за счет потери других форм энергии.
Итак, температура — это мера способности вещества или, в более общем смысле, любой физической системы передавать тепловую энергию другой физической системе. Если два объекта — или система и ее окружение — имеют разную температуру, то они обладают разной способностью передавать тепло. Со временем будет происходить поток энергии от более горячего объекта к более холодному. Этот поток энергии называется теплом. Тепловой поток заставляет более горячий объект охлаждаться, а более холодный нагреваться. Поток тепла будет продолжаться до тех пор, пока они не достигнут одинаковой температуры. В этот момент два объекта установили тепловое равновесие друг с другом.
Этот поток энергии называется теплом. Тепловой поток заставляет более горячий объект охлаждаться, а более холодный нагреваться. Поток тепла будет продолжаться до тех пор, пока они не достигнут одинаковой температуры. В этот момент два объекта установили тепловое равновесие друг с другом.
В следующей части этого урока мы рассмотрим механизм теплопередачи. Мы рассмотрим различные способы передачи тепла от объекта к объекту или даже от одного места внутри объекта к другому.Мы узнаем, что макроскопическое можно объяснить в терминах микроскопического.
Проверьте свое понимание
1. Для каждого из следующих обозначений системы и окружающей среды укажите направление теплового потока как от системы к окружающей среде или от окружающей среды к системе.
Система | Окрестности | Направление теплопередачи | |
а. | Гостиная (T=78°F) | Наружный воздух | |
б. | Гостиная | Чердак | |
в. | Чердак | Наружный воздух |
2. Учитель химии утверждает, что теплосодержание одного вещества составляет 246 кДж/моль. Учитель химии утверждает, что вещество содержит тепло? Объясните, что имелось в виду под этим утверждением.
3.Объясните, почему высококачественные термосы имеют вакуумную прокладку в качестве основного компонента их изолирующих свойств.
Этот пример взаимозаменяемости теплоты и работы как агентов добавления энергии в систему может помочь развеять некоторые неверные представления о теплоте. Для описания энергии, которой обладает высокотемпературный объект, неправильно использовать слово «тепло», чтобы сказать, что объект «обладает теплом» — лучше сказать, что он обладает внутренней энергией в результате своего молекулярного движения. Слово «тепло» лучше использовать для описания процесса передачи энергии от объекта с более высокой температурой к объекту с более низкой температурой.Конечно, вы можете взять объект с низкой внутренней энергией и поднять его до более высокой внутренней энергии, нагрев его. Но вы также можете увеличить его внутреннюю энергию, совершив над ним работу, а поскольку внутренняя энергия высокотемпературного объекта заключается в беспорядочном движении молекул, вы не можете сказать, какой механизм использовался для придания ему этой энергии. Предупреждая учителей и учеников о ловушках неправильного употребления слова «тепло», Марк Земански советует задуматься о джингле:
Земанский указывает на первый закон термодинамики как на проясняющую связь.Первый закон определяет и теплоту, и работу как методы передачи энергии, которые могут вызвать изменение внутренней энергии системы. | Индекс Концепции внутренней энергии Справочник |
Что такое тепло? — Определение и объяснение — Видео и стенограмма урока
Тепловое расширение
Тепловое расширение — это явление, происходящее в твердых телах, жидкостях и газах.Почти все вещества расширяются при повышении их температуры, если они не ограничены каким-либо образом. Примеры включают нагрев воздуха в воздушном шаре, который заставляет воздушный шар расширяться и подниматься, и ртуть в термометре, который поднимается в ответ на тепло. Металлические стержни также используются в различных областях. Например, металлические стержни или полосы, которые используются в качестве компенсаторов на концах секций моста, объясняют расширение стальных мостов в более жаркую погоду. Количество происходящего расширения и то, как мы его прогнозируем, зависит от вещества. Например, твердый металлический стержень обычно линейно расширяется и увеличивается в длину, в то время как жидкости и газы испытывают увеличение объема. Во всех трех случаях тепловое расширение происходит в ответ на повышение температуры, и полезные устройства используют эту концепцию.
Например, твердый металлический стержень обычно линейно расширяется и увеличивается в длину, в то время как жидкости и газы испытывают увеличение объема. Во всех трех случаях тепловое расширение происходит в ответ на повышение температуры, и полезные устройства используют эту концепцию.
Термодинамика
Термодинамика изучает тепло и его преобразование в механическую энергию. Существует четыре закона термодинамики, но здесь мы сосредоточимся только на двух основных законах: первом законе и втором законе.
Первый закон гласит, что изменение внутренней энергии вещества равно произведенной над ним работе плюс переданное ему тепло. Математически мы используем уравнение:
дельта U = работа + Q
Внутренняя энергия представляет собой сумму кинетической и потенциальной энергий всех атомов и молекул внутри вещества. Значение первого закона термодинамики состоит в том, что есть два способа повысить температуру вещества:
1) подвергая его воздействию другого вещества с более высокой температурой и
2) совершая определенные виды работы над вещество
Трение и сжатие газов являются двумя примерами способов повышения температуры методом работы. Поршни в двигателях внутреннего сгорания используют эту концепцию. Воздух сжимается в цилиндре поршнем, который поднимает температуру почти в двадцать семь раз по сравнению с температурой несжатого состояния.
Поршни в двигателях внутреннего сгорания используют эту концепцию. Воздух сжимается в цилиндре поршнем, который поднимает температуру почти в двадцать семь раз по сравнению с температурой несжатого состояния.
Второй закон гласит, что теплота не может передаваться от более холодного тела к более горячему без выполнения работы внешним агентом. Иными словами, невозможно построить устройство, которое будет многократно извлекать тепло из источника и передавать механическую энергию, не отдавая некоторое количество тепла в резервуар с более низкой температурой.Прекрасным примером является тепловая машина, о которой пойдет речь далее в этом уроке.
Теплопередача
Теплопередача происходит по трем механизмам: проводимость , конвекция и излучение .
- Теплопроводность — передача тепла между атомами и молекулами при прямом контакте
- Конвекция — это передача тепла за счет движения самого нагретого вещества, например, за счет течений в жидкости
- Излучение — передача тепла посредством электромагнитных волн
Примером проведения является нагрев кастрюли с водой на электрической плите. Дно кастрюли соприкасается с горячей поверхностью плиты. Тепло течет от горелки ко дну кастрюли и даже вверх по бокам и, возможно, к ручке. Проводимость также возникает между кастрюлей и водой, которые также соприкасаются друг с другом. Примером конвекции является система принудительного воздушного отопления. Теплый воздух выдувается и смешивается с более холодным воздухом, чтобы вызвать нагрев более холодного воздуха более теплым воздухом. Примером передачи тепла излучением является солнце или горячий огонь. Солнце излучает электромагнитные волны, которые нагревают землю, как и огонь, который нагревает ваши руки или тело, когда вы приближаетесь.Используются также комбинации этих механизмов. Примером может служить отопление дома, в котором используются все три принципа. Использование изоляции в доме фактически снижает передачу тепла от горячих поверхностей внутри дома к более холодным поверхностям снаружи. Приточно-вытяжная система, позволяющая солнечному свету проникать в дом, может быть использована и внутри.
Дно кастрюли соприкасается с горячей поверхностью плиты. Тепло течет от горелки ко дну кастрюли и даже вверх по бокам и, возможно, к ручке. Проводимость также возникает между кастрюлей и водой, которые также соприкасаются друг с другом. Примером конвекции является система принудительного воздушного отопления. Теплый воздух выдувается и смешивается с более холодным воздухом, чтобы вызвать нагрев более холодного воздуха более теплым воздухом. Примером передачи тепла излучением является солнце или горячий огонь. Солнце излучает электромагнитные волны, которые нагревают землю, как и огонь, который нагревает ваши руки или тело, когда вы приближаетесь.Используются также комбинации этих механизмов. Примером может служить отопление дома, в котором используются все три принципа. Использование изоляции в доме фактически снижает передачу тепла от горячих поверхностей внутри дома к более холодным поверхностям снаружи. Приточно-вытяжная система, позволяющая солнечному свету проникать в дом, может быть использована и внутри.
Удельная теплоемкость
Удельная теплоемкость или просто удельная теплоемкость — это количество тепла, необходимое для повышения температуры единицы массы (т.г., один грамм, один килограмм и др.) вещества на 1 градус Цельсия. Удельная теплоемкость чистой воды составляет 4180 Дж на килограмм-градус Цельсия, что означает, что для повышения температуры 1 кг чистой воды на 1 градус Цельсия требуется 4180 Дж энергии. Практическое использование самой удельной теплоемкости редко, поэтому ее обычно используют для расчета других величин. Одним из сравнений различных удельных теплоемкостей является то, что энергия, необходимая для нагрева пяти чашек воды до кипения, примерно равна энергии, необходимой для разгона небольшого автомобиля до 60 миль в час.
Тепловые двигатели
Тепловая машина представляет собой устройство, преобразующее тепло в механическую энергию. Он поглощает тепло от горячего источника, такого как горящее топливо, преобразует часть этой энергии в полезную механическую энергию, а оставшуюся энергию отдает в виде тепла в некий резервуар с более низкой температурой. Тепловая машина — это реализация второго закона термодинамики. Ископаемые виды топлива, такие как уголь, нефть и природный газ, обычно используются в качестве источника энергии для тепловых двигателей. Примерами тепловых двигателей являются бензиновые, дизельные и реактивные двигатели, а также электростанции, работающие на угле.Согласно второму закону, не вся энергия, подводимая к тепловому двигателю, превращается в полезную механическую работу. Другими словами, ни одно устройство не может преобразовать 100% подводимого тепла в механическую энергию. Следовательно, тепловой двигатель имеет определенный КПД, который описывает, сколько тепла он может преобразовать в полезную мощность. Математически формула выглядит следующим образом:
Тепловая машина — это реализация второго закона термодинамики. Ископаемые виды топлива, такие как уголь, нефть и природный газ, обычно используются в качестве источника энергии для тепловых двигателей. Примерами тепловых двигателей являются бензиновые, дизельные и реактивные двигатели, а также электростанции, работающие на угле.Согласно второму закону, не вся энергия, подводимая к тепловому двигателю, превращается в полезную механическую работу. Другими словами, ни одно устройство не может преобразовать 100% подводимого тепла в механическую энергию. Следовательно, тепловой двигатель имеет определенный КПД, который описывает, сколько тепла он может преобразовать в полезную мощность. Математически формула выглядит следующим образом:
эффективность = (выходная энергия / потребляемая энергия) x 100
Например, если устройство имеет КПД 50%, оно преобразует половину входной энергии в механическую энергию, а другая половина тратится впустую.Максимальный КПД тепловой машины, называемый КПД Карно в честь французского инженера Сади Карно, зависит от температуры источника тепла и резервуара с более низкой температурой.
Резюме урока
Тепло и температура часто используются взаимозаменяемо, но на самом деле это две разные вещи. Теплота – это энергия, которая передается от двух веществ при разных температурах и течет от горячего к холодному. Температура – это мера того, насколько горячим или холодным является вещество.На этом уроке также были изучены несколько практических применений тепла, в том числе тепловое расширение , первый и второй законы термодинамики , теплопередача , удельная теплоемкость и тепловые двигатели .
Словарь и определения
- Теплота : форма энергии, которая передается между двумя веществами при разных температурах
- Температура : мера теплоты или холодности материи
- Тепловое расширение : явление, происходящее в твердых телах, жидкостях и газах; он связан с расширением веществ при повышении их температуры
- Термодинамика : изучение тепла и его преобразования в механическую энергию
- Первый закон термодинамики : изменение внутренней энергии вещества равно произведенной над ним работе плюс переданное ему тепло
- Второй закон термодинамики : теплота не может передаваться от более холодного тела к более горячему без помощи внешнего агента
- Проводимость : передача тепла между атомами и молекулами при прямом контакте
- Конвекция : передача тепла путем движения самого нагретого вещества, например, течениями в жидкости
- Излучение : передача тепла посредством электромагнитных волн
- Удельная теплоемкость : количество теплоты, необходимое для повышения температуры единицы массы
- Тепловая машина : устройство, преобразующее теплоту в механическую энергию
Результаты обучения
Цель этого урока – помочь вам подготовиться к:
- Различать тепло и температуру
- Обсудить процесс теплового расширения
- Назовите два закона термодинамики
- Укажите три механизма передачи тепла
- Обратите внимание на функции удельной теплоты и тепловых двигателей
Что такое тепло? — Определение из WhatIs.
 ком От
ком ОтТеплота – это передача кинетической энергии от одной среды или объекта к другой или от источника энергии к среде или объекту. Такой перенос энергии может происходить тремя способами: излучением, проводимостью и конвекцией.
Стандартной единицей теплоты в Международной системе единиц (СИ) является калория (кал), представляющая собой количество энергии, которое необходимо передать для повышения температуры одного грамма чистой жидкой воды на один градус Цельсия при условии, что температура воды выше точки замерзания и ниже точки кипения.Иногда килокалория (ккал) указывается как единица тепла; 1 ккал = 1000 кал. (Это так называемая диетическая калория.) Реже используется британская тепловая единица (БТЕ). Это количество тепла, необходимое для повышения температуры одного фунта чистой жидкой воды на один градус по Фаренгейту.
Примером теплового излучения является воздействие инфракрасной (ИК) энергии при попадании на поверхность. ИК — это электромагнитное поле, способное передавать энергию от источника, например, камина, к месту назначения, например, к поверхностям в комнате. Излучение не требует промежуточной среды; это может происходить через вакуум. Он отвечает за нагревание Земли солнцем.
Излучение не требует промежуточной среды; это может происходить через вакуум. Он отвечает за нагревание Земли солнцем.
Теплопроводность возникает, когда две материальные среды или объекты находятся в непосредственном контакте, и температура одного из них выше, чем температура другого. Температуры имеют тенденцию к выравниванию; таким образом, теплопроводность состоит в передаче кинетической энергии от более теплой среды к более холодной. Примером может служить погружение охлажденного тела человека в горячую ванну.
Тепло за счет конвекции возникает, когда движение жидкости или газа переносит энергию из более теплой области в более холодную. Хорошим примером конвекции является стремление теплого воздуха подниматься вверх, а холодного воздуха опускаться, выравнивая температуру воздуха внутри комнаты с горячей печью. Считается, что тепловая конвекция (наряду с теплопроводностью) происходит внутри Земли, передавая кинетическую энергию от внутреннего ядра через внешнее ядро и мантию к земной коре. В этой ситуации внешнее ядро и мантия ведут себя как жидкости в течение длительных периодов времени.
В этой ситуации внешнее ядро и мантия ведут себя как жидкости в течение длительных периодов времени.
См. также Таблицу физических единиц.
Последнее обновление было в марте 2009 г.
Тепло против температуры — Энергетическое образование
Тепло и температура — тесно связанные темы, и поэтому разница между ними может немного сбивать с толку. Основное отличие состоит в том, что тепло имеет дело с тепловой энергией, тогда как температура больше связана с молекулярной кинетической энергией.
Тепло — это передача тепловой энергии, тогда как температура — это свойство объекта. [1]Какая разница?
Тепло описывает передачу тепловой энергии между молекулами в системе и измеряется в джоулях. [2] Тепло измеряет движение или течение энергии. Объект может получать тепло или терять тепло, но не может иметь тепло. Теплота есть мера изменения, а не свойство, которым обладает объект или система. Поэтому он классифицируется как переменная процесса.
Поэтому он классифицируется как переменная процесса.
Температура описывает среднюю кинетическую энергию молекул в материале или системе и измеряется в градусах Цельсия (°C), Кельвина (K), Фаренгейта (°F) или Ренкина (R). Это измеримое физическое свойство объекта, также известное как переменная состояния. Другие измеримые физические свойства включают скорость, массу и плотность, и это лишь некоторые из них. [3]
Сходства
Тепло – это передача тепловой энергии, вызванная разницей температуры между молекулами.
Примечание:
Тепловая энергия может иначе пониматься как полная микроскопическая кинетическая и потенциальная энергия системы.
Второй закон термодинамики
Второй закон термодинамики — это сложная тема, которая требует интенсивного изучения в области термодинамики, чтобы по-настоящему понять ее. Однако для целей этой статьи необходимо понять только один небольшой аспект, а именно тот факт, что тепло всегда самопроизвольно перетекает от более горячих веществ к более холодным . Это простое утверждение объясняет, почему кубик льда не образуется на улице в жаркий день или почему он тает, если его бросить в миску с теплой водой.
Это простое утверждение объясняет, почему кубик льда не образуется на улице в жаркий день или почему он тает, если его бросить в миску с теплой водой.
Мысленный эксперимент
Представьте себе, что вышеупомянутый кубик льда брошен в миску с теплой водой — лед должен получать тепло (тепловую энергию) от воды в миске (см. предыдущий абзац). Добавление тепловой энергии приводит к увеличению кинетической энергии молекулы льда и, следовательно, к повышению температуры. Это известно, потому что температура фактически является мерой средней кинетической энергии молекул.Кроме того, лед будет продолжать получать тепловую энергию, заставляя его молекулы двигаться быстрее и в конечном итоге разрывать межмолекулярные связи или таять.
В заключение, передача тепла или тепловой энергии обычно изменяет температуру вещества, , но не всегда ! Например, в тот момент, когда лед в миске превращается в воду, эти молекулы воды будут иметь точно такую же температуру, как когда они были льдом.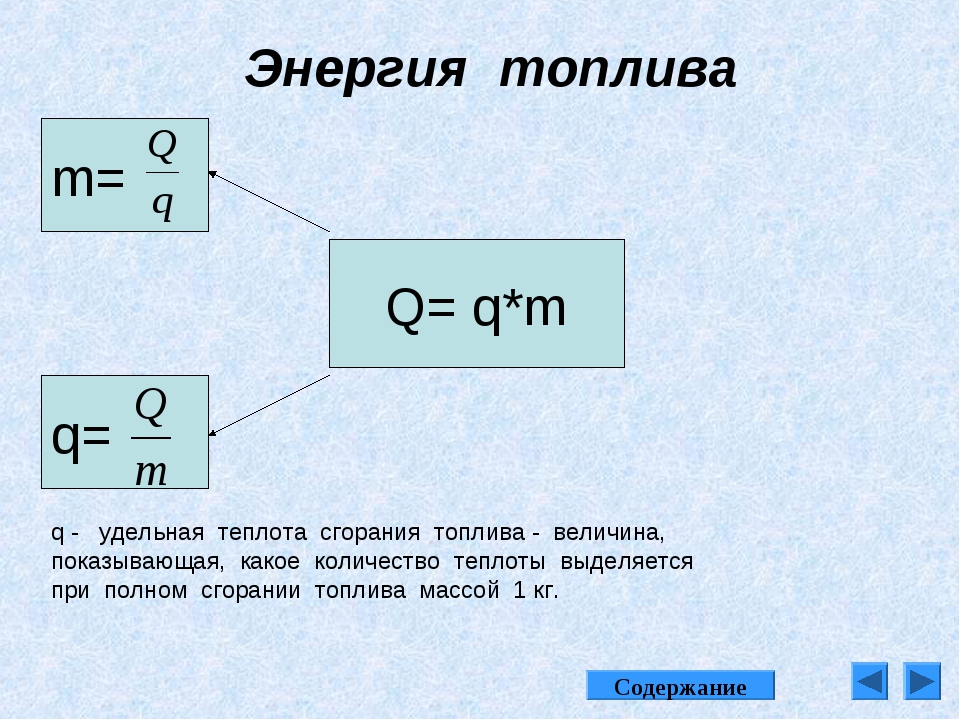 В этом случае тепловая энергия совершает работу не по увеличению кинетической энергии, а по разрыву межмолекулярных связей, вызывая изменение состояния.Однако со временем температура недавно растаявшего льда будет повышаться, пока все внутри чаши не достигнет равновесия, что означает постоянную температуру повсюду.
В этом случае тепловая энергия совершает работу не по увеличению кинетической энергии, а по разрыву межмолекулярных связей, вызывая изменение состояния.Однако со временем температура недавно растаявшего льда будет повышаться, пока все внутри чаши не достигнет равновесия, что означает постоянную температуру повсюду.
Для дальнейшего чтения
Каталожные номера
- ↑ Это было сделано внутри компании членом группы Energy Education.
- ↑ Р. Найт, Физика для ученых и инженеров, 3-е изд. Пирсон, 2013, с. 279
- ↑ Р. Найт, Физика для ученых и инженеров, 3-е изд. Пирсон, 2013, с.445
Теплота
Скрытая теплота парообразования касается фазового перехода между жидким и газообразным состояниями. Теплота парообразования воды равна 2,26·10 6 Дж/кг. Количество теплоты, необходимое для превращения 1 г воды в пар при 100°C, равно Q = мл v = (10 −3 кг) (2,26 × 10 6 Дж/кг). = 2,26 × 10 3 Дж. Продолжительное подвод тепла к пару приведет к перегреву пара и достижению температуры выше 100°C.
= 2,26 × 10 3 Дж. Продолжительное подвод тепла к пару приведет к перегреву пара и достижению температуры выше 100°C.
Обратите внимание на график на рисунке, что стакан со смесью льда и воды остается при температуре 0°C. Только после того, как весь лед растает, дальнейшее нагревание повысит температуру раствора. Аналогичный эффект возникает, когда вода и водяной пар существуют при одной и той же температуре 100°C до тех пор, пока вся вода не выкипит.
Тепловая энергия может передаваться из одного места в другое одним из трех способов: проводимостью, конвекцией и излучением.
Металлическая ручка железной сковороды, поставленной на нагретую конфорку, нагревается за счет теплопроводности. Теплопроводность возникает, когда тепло проходит через нагретое твердое тело. Скорость передачи (H) представляет собой отношение количества теплоты за время, переданное из одного места в объекте в другое H = Q /Δ t , где H выражается в ваттах. или Дж/с, когда Q в джоулях, а Δ t в секундах. Для осуществления проводимости температура между двумя частями проводящей среды — дном кастрюли и ручкой — должна быть разной.Формула для теплопроводности с одной стороны на другую плиты толщиной L и площадью поперечного сечения A определяется как
или Дж/с, когда Q в джоулях, а Δ t в секундах. Для осуществления проводимости температура между двумя частями проводящей среды — дном кастрюли и ручкой — должна быть разной.Формула для теплопроводности с одной стороны на другую плиты толщиной L и площадью поперечного сечения A определяется как
, где тепло перетекает от T 2 к T 1 и T 2 > T 1 , как показано на рис.
Рисунок 3
Тепло перетекает из областей с более высокой температурой в области с более низкой.
Константа (k) , называемая теплопроводностью , находится в таблицах, в которых перечислены свойства материалов.Тот факт, что разные материалы имеют разные значения k , объясняет, почему металлическая полка холодильника кажется более холодной, чем продукты на ней, даже если они находятся в тепловом равновесии. Константа проводимости для металлов относительно велика, и металл кажется более холодным, потому что металл быстрее отводит тепло от руки, чем другие материалы.
Константа проводимости для металлов относительно велика, и металл кажется более холодным, потому что металл быстрее отводит тепло от руки, чем другие материалы.
Тепло, переносимое движением нагретого вещества, является результатом конвекции . Наиболее распространенным примером конвекции является нагретая масса воздуха, поднимающаяся от обогревателя или костра.
Третий механизм передачи тепла излучение в виде электромагнитных волн. Лучистая энергия солнца согревает землю. Скорость, с которой объект излучает лучистую энергию, пропорциональна четвертой степени его абсолютной температуры. Закон Стефана-Больцмана , описывающий взаимосвязь, записывается как P = σ AeT 4 , где P — излучаемая мощность в ваттах, σ — постоянная, равная 5,6696 −10 с Вт/м 2 K 4 , A – площадь поверхности объекта в м 2 , T – абсолютная температура, а , 290 e – постоянная теплопроводности. изменяется от 0 до 1 в зависимости от свойств поверхности.
изменяется от 0 до 1 в зависимости от свойств поверхности.
Термос или сосуд Дьюара — это предмет, который сводит к минимуму передачу тепла за счет теплопроводности, конвекции и излучения. Колба изготовлена из стекла Pyrex с двойными стенками и посеребренными внутренними стенками. Пространство между стенками вакуумируется, чтобы уменьшить теплопередачу путем теплопроводности и конвекции. Посеребренные стены отражают большую часть лучистого тепла, чтобы сократить передачу тепла излучением. Контейнер эффективно используется для хранения холодных или горячих жидкостей в течение длительного периода времени.
Жара — Физика средней школы
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже. Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
.


 Я нашел эту идею в небольшой статье Марка Земанского, озаглавленной «Использование и неправильное употребление слова «тепло» в преподавании физики».Одна ключевая идея из этого примера заключается в том, что если вам представят высокотемпературный газ, вы не сможете сказать, достиг ли он такой высокой температуры в результате нагревания, совершения над ним работы или комбинации того и другого.
Я нашел эту идею в небольшой статье Марка Земанского, озаглавленной «Использование и неправильное употребление слова «тепло» в преподавании физики».Одна ключевая идея из этого примера заключается в том, что если вам представят высокотемпературный газ, вы не сможете сказать, достиг ли он такой высокой температуры в результате нагревания, совершения над ним работы или комбинации того и другого.
 После этого ни слова работа, ни теплота не годятся для описания конечного состояния системы — мы можем говорить только о внутренней энергии системы.
После этого ни слова работа, ни теплота не годятся для описания конечного состояния системы — мы можем говорить только о внутренней энергии системы.