Оксид серы (VI) — это… Что такое Оксид серы (VI)?
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
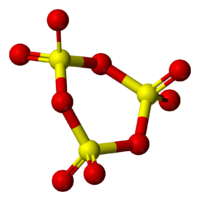
пространственная модель молекулыγ-SO3
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO
Получение
Получают, окисляя оксид серы(IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или Na2VO3):
- 2SO2 + O2 → 2SO3 + Q.
Можно получить термическим разложением сульфатов:
- Fe2(SO4)3 → Fe2O3 + 3SO3,
или взаимодействием SO2 с озоном:
- SO2 + O3 → SO3 + O2.
Для окисления SO2 используют также оксид азота(IV) NO2:
- SO2 + NO2 → SO3 + NO.
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика.
При взаимодействии с водой образует серную кислоту:
- SO3 + H2O → H2SO4.
Взаимодействует с основаниями:
- 2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
- CaO + SO3 → CaSO4,
c амфотерными оксидами:
- 3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
- H2SO4 (100 %) + SO3 → H2S2O7.
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до SO 2:
- 5SO3+ 2P→ P2O5 + 5SO2
- 3SO3 + H2S → 4SO 2+ H2O
- 2SO3 + 2KI → SO2 + I2 + K2SO4.
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота HSO3Cl:
- SO3 + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
- SO3 + Cl2 + 2 SCl2 → 3SOCl2
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Особенности работы
Поскольку при взаимодействии SO3 и воды образуется едкая серная кислота, при работах с ним следует соблюдать особенную осторожность.Поэтому следует вливать тоненькой струйкой КИСЛОТУ В ВОДУ, непрерывно перемешивая раствор.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид серы(VI) — это… Что такое Оксид серы(VI)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
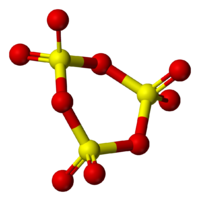 Пространственная модель молекулы γ-SO3
Пространственная модель молекулы γ-SO3Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3):
Можно получить термическим разложением сульфатов:
или взаимодействием SO2 с озоном:
Для окисления SO2
используют также NO2:Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
и оксидами:
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
dic.academic.ru
SO2 — это… Что такое SO2?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO 2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
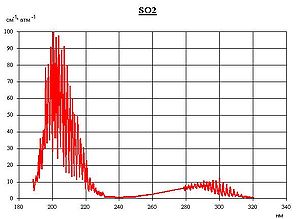
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие

SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.
dic.academic.ru
Оксид серы(IV) — это… Что такое Оксид серы(IV)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (IV) (диокси́д се́ры, се́рнистый газ, се́рнистый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой се́рнистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазонеОтносится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
Последняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также в слабоалкогольных напитках (вина средней ценовой категории) в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и как следствие присутствия воды H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре[1]. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Физиологическое действие

SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
- ПДК(предельно допустимая концентрация):
- в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
- в помещении (рабочая зона) — 10 мг/м³
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное[источник не указан 62 дня]. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
Примечания
- ↑ Гордон А., Форд Р. Спутник химика / Пер. на русск. Е. Л. Розенберга, С. И. Коппель. — М.: «Мир», 1976. — 544 с.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
dic.academic.ru
Триоксид серы (серный ангидрид) so3
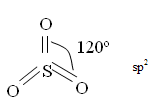
SO3 – ангидрид H2SO4. Бесцветная жидкость при
160С < t <42ºC, затвердевает при t < 160С, в газовой фазе при t > 42ºC, tкип = +45ºС, ядовит, молекула имеет sp2 гибридизацию, форму плоского треугольника, угол между связями — 120º.
В технике SO3 получают окислением SO2 в присутствии катализатора (Pt, оксиды ванадия)
Pt
2SO2 + O2 = 2SO3 – ангидрид серной кислоты
SO3 + H2O = H2SO4
В водных растворах H2SO4 – сильная двухосновная кислота. Гидратация H2SO4 сопровождается выделением большого количества теплоты за счёт образования гидратов:
H2SO4 ∙ H2O
H2SO4 ∙ 2H2O
H2SO4 ∙ 4H2O
Поэтому смешивать H2SO4 c водой следует очень осторожно.
В виде SO3 только в газовой фазе, хорошо полимеризуется в жидком состоянии циклический триммер, в кристаллические – зигзагообразные цепи. Термически нестоек при t>700º разлагается:
>7000С
2SO3 ↔ 2SO2 + O2
SO3 –типичный кислотный оксид, бурно реагирует с водой (Н2О)
SO3(кр) + H2Oж → H2SO4 ж
SO3 + Ba(OH)2 → BaSO4↓ + H2O
SO3 + CaO → CaSO4
SO3 + NaOHP → NaHSO4
SO3 + 2NaOHK → Na2SO4 + H2O
S+6 (высшая) – поэтому сильнейший окислитель
5SO3 + 2P → P2O5 + 5SO2↑
3SO3 + H2S → 4SO2↑ + H2O
SO3 растворяется в безводной H2SO4 образуя олеум. Вливают серную кислоту тонкой струйкой в воду, а не наоборот.
Концентрированная H2SO4 поглощает пары воды, поэтому её применяют в качестве осушителя; она отнимает воду и от органических веществ обугливая их. Полиамиды (капрон, нейлон), шёлк быстро разрушаются ею, шерсть более устойчива к её действию.
Получение h3so4
1) константный способ. катализатор – Pt, кислота получается любой концентрации. SO2 поглощается H2SO4 получается олеум. Конценрацию (98%) получают смешиванием олеума с разбавленной H2SO4.
Схема получения:
O2 O2 H2O
FeS2 → SO2 → SO3 → H2SO4
Катализ
2) нитрозный способ: катализатор – оксиды азота. Конечный продукт содержит 78% H2SO4
2NO + O2 → 2NO2
SO2 + NO2 + H2O → H2SO4 + NO
Химические свойства h3so4
Концентрированная H2SO4 (ω=93 – 98%) более сильный окислитель (особенно при нагревании), окисляет даже металлы после Н2; не окисляет Fe(только при нагревании), Au, Pt- новые металлы.
В зависимости от концентрации:
t
(Ag, Cu) Zn + H2SO4 K → ZnSO4 + SO2↑ + H2O
3Zn + 4H2SO4 → 3ZnSO4 + S↓ + 4H2O
ω=50%
4Zn + 5H2SO4 → 4ZnSO4 + H2S↑ + 4H2O
Конц. H2SO4 окисляет неметаллы:
t
2P + H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
t
S + 2H2SO4 → 3SO2↑ + 2H2O
При комнатной t HI, HBr, H2S
8HI +H2SO4 → 4I2 + H2S↑ + 4H2O
H2S + H2SO4 → S + SO2↑ + 2H2O
Разбавленная обладает всеми типичными свойствами кислот:
Изменяет окраску индикаторов.
2) Реакции с:
Oсновными оксидами CaO + H2SO4 = CaSO4 + H2O
Амфотерными оксидами ZnO + H2SO4 = ZnSO4 + H2O
Щёлочами KOH + H2SO4 = K2SO4 + H2O
Нерастворимыми основаниями
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Солями K2СO3 + H2SO4 = K2SO4 +СО2 + H2O
K2SiO3 + H2SO4 = K2SO4 + H2SiO3↓
С аммиаком 2NH3 + H2SO4 = (NH4)2SO4
И его водными растворами NH3∙Н2О + H2SO4 = NH4НSO4 + Н2О
При взаимодействии с Ме в РСЭП до Н2 разб. H2SO4 обладает окислительными свойствами за счёт ионов Н+
Fe + H2SO4 p → FeSO4 + H2
(у металлов реализуется низшая степень окисления).
Важное свойство её нелетучесть, поэтому используют для получения летучих кислот путём вытеснения из сухих (крист).
KClкр. + H2SO4 K → KHSO4 + HCl↑
Безводная H2SO4 – вязкая маслянистая жидкость, требует осторожного обращения во избежание разбрызгивания вливать надо H2SO4 в воду, а не наоборот.
Тиосоединения. При замене в сульфат-ионе одного атома кислорода на атом серы образуются тиосульфат –ионы S2O32-.
В лаборатории тиосульфаты получают при кипячении раствора сульфита с порошком серы.
Na2S+4O3 + S0 = Na2S2+6/ -2O3
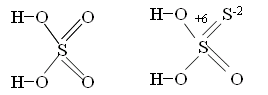
Тиосерная кислота неустойчива из-за протекания внутримолекулярного окислительно-восстановительного процесса. Поэтому при подкислении тиосульфатов они начинают выделять свободную серу и SO2.
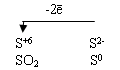
Сильные кислоты вытесняют из тиосульфатов тиосерную кислоту:
Na2S2O3 + 2HCl = H2S2O3 + 2NaCl =H2O + SO2↑+ S↓
Na2S2O3 + 2HCl → 2NaCl + SO2↑ + S↓ +H2O
Наличие в тиосульфатах S-2 придаёт им восстановительные свойства.
В фотографии кристаллогидрат Na2S2O3∙5H2O (под названием гипосульфит) является основным компонентом для приготовления закрепляющих растворов, т.к. образует с ионами Ag+ прочные комплексы [Ag+(S2O3)2]3-, удаляет из фотоэмульсии неизрасходованные галогениды серебра.
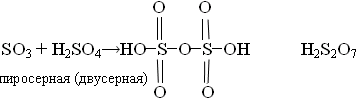
Пиросульфаты – соли пиросерной кислоты (двусерной), H2S+62O7.
Это смесь SO3 и H2SO4, так называемый олеум (смесь полисерных кислот), состав можно представить H2SO4∙xSO3.
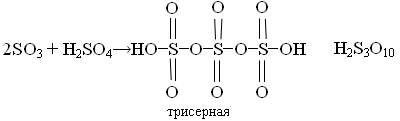
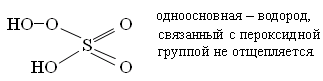
Пероксосульфаты H+2SO-25 (пероксомоносерная)
(мононадсерная)
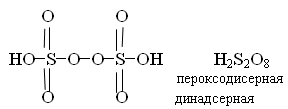
studfile.net
Оксид серы(VI), серная кислота, сульфаты — урок. Химия, 8–9 класс.
Оксид серы(\(VI\))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+h3O=h3SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы(\(VI\)) дымит на воздухе.
Особенностью оксида серы(\(VI\)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы(\(VI\)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+h3O,
SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — \(+6\). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота
Серная кислота h3SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
h3SO4+CuO=CuSO4+h3O,
h3SO4+Zn(OH)2=ZnSO4+2h3O;
- с солями, если образуется газ или нерастворимое вещество:
h3SO4+CaCO3=CaSO4+h3O+CO2↑,
h3SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
h3+1SO4+Zn0=Zn+2SO4+h3↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2h3S+6O4+Cu0=Cu+2SO4+S+4O2+2h3O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
h3SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):

Соли серной кислоты
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5h3O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2h3O применяется в строительстве, сульфат бария BaSO4 — в медицине.
www.yaklass.ru
Разница между SO2 и SO3
Главное отличие — ТАК2 против SO3
ТАК2 так что3 неорганические химические соединения, образованные комбинацией атомов серы и атомов кислорода. ТАК2 обозначает диоксид серы, так что3 обозначает триоксид серы, Это газообразные соединения. Они имеют разные химические и физические свойства. Эти соединения называются оксидами серы, так как они образуются в результате реакции между серой и О2 молекулы. Основное отличие СО2 так что3 в том, что ТАК2 имеет два атома кислорода, связанных с атомом серы, тогда как SO3 имеет три атома кислорода, связанных с атомом серы.
Ключевые области покрыты
1. Что такое SO2
— Определение, химическая структура и свойства, степень окисления
2. Что такое SO3
— Определение, химическая структура и свойства, производство серной кислоты
3. В чем разница между SO2 и SO3
— Сравнение основных различий
Ключевые термины: кислотный дождь, одиночная электронная пара, кислород, состояние окисления, сера, диоксид серы, серная кислота, триоксид серы
Что ТАК2
ТАК2 обозначает диоксид серы, Диоксид серы — газообразное соединение, состоящее из атомов серы и кислорода. Химическая формула диоксида серы — SO2, Следовательно, он состоит из атома серы, связанного с двумя атомами кислорода через ковалентные связи. Один атом кислорода может образовывать двойную связь с атомом серы. Следовательно, атом серы является центральным атомом соединения. Поскольку элемент серы имеет 6 электронов на своей внешней орбите после образования двух двойных связей с атомами кислорода, осталось еще 2 электрона; они могут действовать как одинокая электронная пара. Это определяет геометрию SO2 молекула как угловая геометрия. ТАК2 является полярным из-за своей геометрии (угловой) и наличия неподеленной электронной пары.
Рисунок 1: Химическая структура SO2
Диоксид серы считается токсичным газом. Следовательно, если есть ТАК2 в атмосфере это будет признаком загрязнения воздуха. Этот газ имеет очень раздражающий запах. Молекулярная масса диоксида серы составляет 64 г / моль. Это бесцветный газ при комнатной температуре. Температура плавления составляет около -71оС, тогда как температура кипения составляет -10оC.
Степень окисления серы в диоксиде серы составляет +4. Следовательно, диоксид серы также можно получить восстановлением соединений, состоящих из атомов серы, которые находятся в более высокой степени окисления. Одним из таких примеров является реакция между медью и серной кислотой. Здесь сера в серной кислоте находится в степени окисления +6. Следовательно, его можно снизить до +4 степени окисления диоксида серы.
Диоксид серы может быть использован при производстве серной кислоты, которая имеет ряд применений в промышленных масштабах и лабораторных масштабах. Диоксид серы также является хорошим восстановителем. Поскольку степень окисления серы в диоксиде серы составляет +4, ее можно легко окислить до степени окисления +6, что позволяет восстановить другое соединение.
Что ТАК3
ТАК3 обозначает триоксид серы. Триоксид серы представляет собой твердое соединение, состоящее из одного атома серы, связанного с тремя атомами кислорода. Химическая формула диоксида серы — SO3, Каждый кислород образовал двойную связь с атомом серы. Атом серы находится в центре молекулы. Поскольку сера имеет 6 электронов на самой внешней орбите, после образования трех двойных связей с атомами кислорода на атоме серы больше не осталось электронов. Это определяет геометрию SO3 молекула как тригональная плоская геометрия. ТАК3 является неполярным из-за своей геометрии (тригональной плоскости) и отсутствия одинокой электронной пары.
Рисунок 2: Химическая структура SO3
Молекулярная масса триоксида серы составляет 80,057 г / моль. Температура плавления СО3 составляет около 16,9 ° С, тогда как температура кипения составляет 45оПри комнатной температуре и давлении триоксид серы представляет собой белое кристаллическое твердое соединение, которое будет испаряться в воздухе. Обладает резким запахом. Степень окисления серы в триоксиде серы составляет +6.
В газообразной форме триоксид серы является загрязнителем воздуха и основным компонентом кислотных дождей. Однако триоксид серы очень важен в производстве серной кислоты в промышленных масштабах. Это потому, что триоксид серы является ангидридной формой серной кислоты.
ТАК3 (л) + H2О(Л) → H2ТАК4 (л)
Вышеуказанная реакция очень быстрая и экзотермическая. Поэтому при использовании триоксида серы для промышленного производства серной кислоты следует применять методы контроля. Кроме того, триоксид серы является важным реагентом в процессе сульфирования.
Разница между SO2 так что3
Определение
ТАК2: ТАК2 обозначает диоксид серы.
ТАК3: ТАК3 обозначает триоксид серы.
Природа
ТАК2: ТАК2 представляет собой газообразное соединение, состоящее из атомов серы и кислорода.
ТАК3: ТАК3 представляет собой твердое соединение, состоящее из одного атома серы, связанного с тремя атомами кислорода.
Молярная масса
ТАК2: Молярная масса СО2 составляет 64 г / моль.
ТАК3: Молярная масса СО3 80,057 г / моль.
Точка плавления и точка кипения
ТАК2: Температура плавления СО2 составляет около -71 ° С, тогда как температура к
ru.strephonsays.com