Агрегатное состояние жидкое — Справочник химика 21
РА (агрегатное состояние — жидкое) [c.82]Полимеры могут находиться в двух агрегатных состояниях (жидком и твердом), двух фазовых состояниях (аморфном и кристаллическом) и трех релаксационных (или деформационных) физических состояниях (стеклообразном, высокоэластическом и вязкотекучем). Границы между этими физическими состояниями обычно характеризуют значениями температур стеклования с и текучести Гт. [c.34]
Агрегатное состояние Жидкое Твердое [c.72]
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе, образуют одно агрегатное состояние — жидкое или газообразное, чаще жидкое. Гомогенный катализ за последние годы стал одним из наиболее быстро развивающихся разделов химии, приобрел применение в важнейших промышленных процессах и многочисленных селективных лабораторных СИН- [c.179]
Гомогенный катализ — процессы, в которых катализатор и реагирующие вещества находятся в одном агрегатном состоянии, жидком или газообразном. Для гомогенного катализа характерно проявление активности отдельным ионом или молекулой катализатора. Поэтому, как правило, увеличение скорости реакции прямо пропорционально концентрации введенного катализатора. Процесс в гомогенном катализе развивается через образование лабильных [c.4]
В отличие от низкомолекулярных веществ для полимеров характерны только конденсированные агрегатные состояния жидкое и твердое. В газообразном состоянии они не могут существовать, так как при нагревании разлагаются или сгорают задолго до достижения температуры кипения. [c.394]
Итак, изотерма реального газа характеризует два агрегатных состояния жидкое и газообразное, а так же взаимный их переход. [c.38]
Выделение продуктов реакции определяется их агрегатным состоянием жидкие вещества экстрагируют из реакционной массы подходящим растворителем, твердые выделяют фильтрованием.
Смесь газов в газовом баллоне находится в двух агрегатных состояниях — жидком и газообразном. Паровая фаза составляет примерно 10% общего объема баллона при его максимально допустимом заполнении. Обязательное наличие паровой подушки необходимо из-за большого объемного расширения сжиженного газа с повышением его температуры. [c.193]
Твердое агрегатное состояние Жидкое агрегатное состояние [c.150]
Мезоморфные состояния, и мезофазы, известны давно п до- статочно часто встречаются в низкомолекулярных системах. Обычно эти состояния связывают с жидкими кристаллами, которые являются предметом интенсивного изучения в современной молекулярной физике и интенсивных и непрерывно расширяющихся технических исследований [243]. Жидкокристаллическое состояние называется мезоморфным, а жидкие кристаллы — мезофазой, потому что в них сдвинуты границы, определяющие то, что мы выше назвали фазово-агрегатными состояниями. Агрегатное состояние жидких кристаллов — бесспорно жидкое. Но элементы порядка в нем не имеют ничего общего с привычным ближним порядком в жидкостях, достижимым в результате постепенного увеличения дефектности (свободного объема) реальных кристаллов, которая возрастает с плавле- нием.
Отметим, что рефракция определяется показателем преломления п, плотностью р и молекулярной массой М, а в том случае, когда п измеряют при определенной длине световой волны, не зависит от температуры, давления и агрегатного состояния (жидкого, газообразного и т. п.). [c.121]
Аморфное фазовое состояние полимеров. Полимерам, находящимся в аморфном фазовом состоянии, могут соответствовать два агрегатных состояния — жидкое и твердое. [c.72]
Все Оф и Вф, находящиеся в водном растворе, считаются гидратированными. Нейтральные частицы в растворе отмечены нижним индексом (р)—водный раствор при формуле агрегатное состояние жидких (ж) и газообразных (г) веществ указано, а для твердых веществ опущено.
Пока мол. масса относительно мала все физич. и химич. свойства молекулы быстро изменяются с увеличением М. Однако по достижении нек-рого предела дальнейшее возрастание М перестает существенным образом отражаться на этих свойствах. Этот предел быстрее всего достигается для агрегатных состояний (жидкие олигомеры становятся воскоподобными уже при п порядка 20—30), несколько медленнее — для химич. свойств (исчезает влияние концевых групп) и еще медленнее — для механич. и релаксационных свойств (см. также Олигомеры). [c.50]
Реакция присоединения водорода протекает в гетерогенной среде, где реагирующие вещества находятся в трех агрегатных состояниях (жидкое — масло, твердое — катализатор и газообразное— водород). Насыщение идет в местах одновременного столкновения этих трех веществ. Реакция может идти в обратную сторону, если в местах контакта жира и катализатора не будет водорода. При таких условиях возникает дегидрогенизация.
В природе вода имеет очень большое распространение и играет очень важную роль как в минеральных процессах, так и в биологических. Она, покрывает почти Vs земной поверхности и встречается во всех трех агрегатных состояниях. Жидкая вода образует океаны, моря, реки, озера, парообразная — входит в состав атмосферного воздуха, твердая-—образует снег и лед. Природная вода всегда содержит различные растворенные примеси или же в виде тонкой взвеси, делающей воду мутной. Самая чистая природная вода — это вода, образовавшаяся в результате конденсации в атмосфере паров (дождевая вода, снег, град). Все прочие виды воды в зависимости от их нахождения в природе всегда содержат большее или меньшее количество указанных выше примесей и взвесей. Остановимся сначала на растворенных в воде веществах — солях различных кислот. [c.85]
Необходимо различать структурное и термодинамическое понятия фазы. В термодинамике фазой называют часть системы, отделенную от другой части поверхностью раздела и отличающуюся от нее термодинамическими свойствами. Например, вода, в которой плавает лед, представляет собой систему из двух фаз, причем каждая фаза находится в своем агрегатном состоянии (жидкая вода и твердый лед). Структурное понятие фазы означает определенный порядок во взаимном расположении молекул. У низкомолекулярных веществ оба понятия фазы совпадают, а у ВМС они часто не совпадают. Две фазы не всегда могут иметь поверхность раздела. [c.30]
Например, вода, в которой плавает лед, представляет собой систему из двух фаз, причем каждая фаза находится в своем агрегатном состоянии (жидкая вода и твердый лед). Структурное понятие фазы означает определенный порядок во взаимном расположении молекул. У низкомолекулярных веществ оба понятия фазы совпадают, а у ВМС они часто не совпадают. Две фазы не всегда могут иметь поверхность раздела. [c.30]
Термин флюид в литературе иногда применяется в качестве обобщенного названия двух агрегатных состояний (жидкого и газообразного), обладающих высокой текучестью.
Установив единство газов и паров, Менделеев идет дальше на основании открытой им температуры абсолютного кипения он устанавливает единство обоих агрегатных состояний — жидкого и газообразного, причем пар играет роль связующего звена между ними. Парообразное состояние в виде насыщенного пара, — пишет Менделеев, — представляет как бы переход от жидкого к газообразному, как коллоидальное, мягкое и порошкообразное состояния представляют переход от твердого состояния к жидкому. В этом отношении особенно поучительно то, что при известной температуре всякая летучая жидкость, несмотря на малый объем пространства, переходит вполне и вдруг в пар [c.178]
Итак, изотерма реального газа характеризует два агрегатных состояния (жидкое и газообразное), а также взаимный их переход. Переход от газообразного к жидкому состоянию изучался на двуокиси углерода. Этот газ довольно легко сжижается. [c.61]
К и 0,006 атм (4,58 мм рт. ст.) соответствуют единственным условиям сосуществования воды во всех трех агрегатных состояниях — жидком, твердом и парообразном. Температура 273,16 К — температура плавления льда при давлении насыщенного пара воды. Эта точка выше нуля Цельсия. За нуль же температуры принимается по шкале Цельсия, как известно, точка плавления при давлении 1 атм. Заканчивается рассматриваемая кривая при давлении около 2100 атм и температуре около—20°С, что является наиболее низкой температурой плавления обычного льда. При давлениях выше 2100 атм обычный лед (лед I) начинает переходить в иную кристаллическую модификацию воды — так называемый лед III. Подробнее об этом несколько позже (см. рис. 51). Кривая ОВ выражает зависимость давления насыщенного пара жидкой воды от температуры. Она начинается в тройной и заканчивается в критической точке (374°С и 220 атм). Однако при осторожном охлаждении чистой воды ее можно получить в переохлажденном состоянии. Прерывистая кривая 0D отвечает давлению пара над такой переохлажденной метастабильной водой, т. е. водой, находящейся в неустойчивом состоянии. Эта кривая расположена выше кривой АО, выражающей зависимость давления пара над льдом. В этой области (т. е. левее точки О) жидкая вода должна самопроизвольно переходить в твердое состояние и переход будет связан с убылью энергии Г иббса. Кривую Л О не удается продлить в неустойчивую область правее точки О, т. е. перегреть твердое вещество выше точки плавления нельзя. Таким образом, кривая А О заканчивается в тройной точке. Начинается же она, как можно считать, при абсолютном нуле.
При давлениях выше 2100 атм обычный лед (лед I) начинает переходить в иную кристаллическую модификацию воды — так называемый лед III. Подробнее об этом несколько позже (см. рис. 51). Кривая ОВ выражает зависимость давления насыщенного пара жидкой воды от температуры. Она начинается в тройной и заканчивается в критической точке (374°С и 220 атм). Однако при осторожном охлаждении чистой воды ее можно получить в переохлажденном состоянии. Прерывистая кривая 0D отвечает давлению пара над такой переохлажденной метастабильной водой, т. е. водой, находящейся в неустойчивом состоянии. Эта кривая расположена выше кривой АО, выражающей зависимость давления пара над льдом. В этой области (т. е. левее точки О) жидкая вода должна самопроизвольно переходить в твердое состояние и переход будет связан с убылью энергии Г иббса. Кривую Л О не удается продлить в неустойчивую область правее точки О, т. е. перегреть твердое вещество выше точки плавления нельзя. Таким образом, кривая А О заканчивается в тройной точке. Начинается же она, как можно считать, при абсолютном нуле.
Вода может быть в трех агрегатных состояниях жидком, твердом (лед) и газообразном (пар). Вода из одного агрегатного состояния в любое другое может при определенном давлении и температуре переходить непосредственно. Так, жидкая вода может превратиться и в лед, и в пар лед может таять, а также испаряться. [c.137]
Таким образом, качество смазочных материалов определяет состояние машин и двигателей, их надежность и долговечность и, следовательно, срок службы. Хотя смазочные материалы эксплуатируются в разнообразных условиях и применяются часто для разных целей, некоторые требования к ним имеют общий характер. Другие требования (см. соответствующие ГОСТы) носят более частный характер и имеют значение для той или иной группы смазочных материалов. Существует несколько классификаций, по которым смазочные материалы подразделяются 1) по происхождению животно-растительные, минеральные (в основном нефтяные) и синтетические 2) по агрегатному состоянию (жидкие, мазеобразные и твердые) и 3) по основным областям применения. Последний класс очень сложен. Так, жидкие масла по применению условно подразделяют на следующие семь групп
Последний класс очень сложен. Так, жидкие масла по применению условно подразделяют на следующие семь групп
В нормальных алканах отрыв атома водорода от вторичного углеродного атома в 3—4 раза более вероятен, чем от первичного. Вероятность разрыва связи —СНа—СНз— не зависит от ее положения в молекуле, а вероятность разрыва связи —СНз—СНд приблизительно в 5 раз меньше, чем связи —СНа— На—. Детальная расшифровка состава димерного] продукта радиолиза н.гексана позволила вычислить отношение концентраций первичных радикалов к сумме вторичных. Установлено, что это отношение не зависит от агрегатного состояния (жидкое и твердое) и с ростом дозы распад исходного веш ества сопровождается повышением содержания непредельных углеводородов (главным образом диенов и полиенов) среди тяжелого остатка, накопление которых происходит в линейной зависимости от дозы. [c.359]
Физическое состояние, при котором есть дальний порядок во взаимной ориентации и расположении молекул, но агрегатное состояние жидкое, называется жидкокристаллическим состоянием. [c.24]
В системе Г—Т зернистый (сыпучий) взвешенный слой твердого материала по внешнему виду напоминает кипящую жидкость. Как и в кипящей жидкости в нем возникают, а затем возрастают, сливаются (иногда разбиваются) пузыри газа на верхней границе возникают фонтанчики (своды) вся система Г — Т находится в постоянном неупорядоченном движении. Поэтому в советской литературе и, в особенности, в производственной практике, взвешенный слой в системе Г—Т чаще всего называют кипящим. Часть исследователей называет кипящим взвешенный слой при сравнительно небольших скоростях газа от начала взвешивания зерен до 3—5 w , так как именно в области сравнительно небольших скоростей газа, которые и применяются на практике, взвешенный слой наиболее похож на кипящую жидкость. В ряде случаев производственного применения взвешенного слоя особенно важным оказалось то, что твердый зернистый материал приобретает текучесть, подобную жидкости, поэтому взвешенный слой называют ожиженным (fluid bed, fluidised bed) или псевдоожижепным. При этом проводят аналогию между изменением агрегатных состояний жидкой и твердой фаз во взвешенном слое. Иногда даже пренебрегают наличием двух фаз во взвешенном слое. [c.12]
При этом проводят аналогию между изменением агрегатных состояний жидкой и твердой фаз во взвешенном слое. Иногда даже пренебрегают наличием двух фаз во взвешенном слое. [c.12]
Если катализируемая система и сам катализатор находятся в одинаковом агрегатном состоянии (жидком, паро- или газообразном), катализ называют гомогенным. Примерами последнего могут служить хлорирование метана в присутствии паров хлористого сульфу-рила, образование сложных эфиров из спиртов и карбоновых кислот под действием небольших количеств серной или соляной кислот, реакции кислотного гидролиза и т. д. Если же катализируемая система и катализатор находятся в разных агрегатных состояниях, катализ называют гетерогенным. Примерами гетерогенных каталитических реакций являются синтез метанола или высших спиртов из смесей окиси углерода с водородом над твердыми катализаторами, различные гидро- или дегидрирования, процессы дегидроциклизации, каталитический крекинг, окисление бензола в малеиновый ангидрид или нафталина во фталевый ангидрид и т. д. Гетерогенные каталитические реакции бэлее распространены и имеют большее практическое значение, чем гомогенные. [c.22]
Смеси идеальных газов представляют собой растворы с наиболее простыми свойствами. Некоторые свойства идеальных газовых растворов представляют исключнтольпый интерес для термодинамики, так как они оказались обп1,имн для растворов в любых агрегатных состояниях (жидком и твердом) и послужили основой для создания термодинамической теории идеальных растворов — предельного тИпа растворов для веществ с одинаковыми межмо-лекулярными взаимодействиями при любом виде уравнения состояния системы. [c.83]
Углекислота как легкосжижаемый газ, так же как и закись азота, находится в баллоне в двух агрегатных состояниях жидком и газообразном. Постоянное давление около 70 ати держится в углекислотном баллоне, пока в нем не останется только газообразная углекислота. После того как в баллоне останется только газообразная углекислота, давление с расходом газа начинает падать и легко контролируется манометром, что дает возможность заранее знать, что необходимо произвести замену баллона.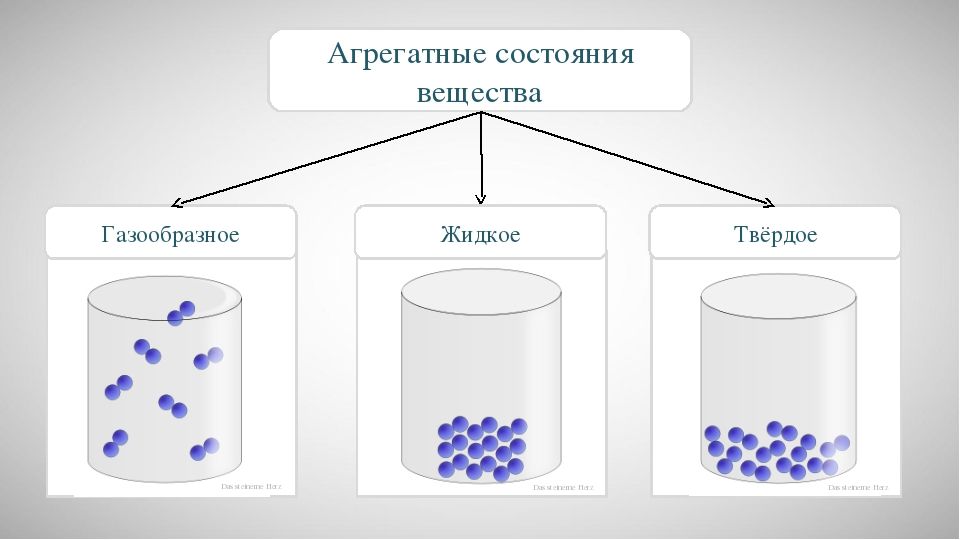 [c.127]
[c.127]
ЖИДКОСТИ — тела, находящиеся в агрегатном состоянии (жидком состоянии), промежуточном между твердым и газовым состояниями. По своей высокой плотности и малой сжимаемости, по наличию сильного межмолекулярного взаимодействия Ж., будучи конденсированными системами, близки к твердым телам и существенно отличаются от газов. Наряду с этим, изотропность, текучесть (т. е. способность легко изменять внешнюю форму под действием малых нагрузок) приближают их к газам. Вследствие текучести под действием внешних сил легко изменяется собственная форма Ж. (форма шара, соответствующая наименьшей поверхности при данном объеме). Форму шара Ж. принимают под действием молекулярных сил, проявляющихся в поверхностном натяжении. Текучесть Ж., вызывая релаксацию касательных напряжений в них, позволяет обнаруживать упругость формы Ж. только при очень малой продолжительности действия сдвигающей силы. Вследствие высокой плотностн, вязкость Ж., в отличие от газов, резко падает с повышением темп-ры (у газов она при этом возрастает). Область существования Ж. ограничена со стороны низких темп-р переходом в твердое или стеклообразное состояние. Для каждого вещества характерна критич. темп-ра, выше к-рой Ж. пе может существовать в равновесии с собственным наром (см. Критическое состояние). [c.30]
Г омогенным (однородным) называют катализ, при котором катализируемая система и сам катализатор находятся в одинаковом агрегатном состоянии (жидком или газообразном). Примером гомогенного катализа может служить реакция полимеризации в растворе (см. гл. XIV). [c.82]
Основная единица продукции, по которой ведется расчет, должна иметь детальную техническую характеристику. Например, при установлении нормы удельного расхода тецлоты на сжатие воздуха в компрессоре необходимо указать конечное давление, температуру, тип компрессора. Устанавливая норму на 1 т стали, необходимо указать ее качество, химический состав, агрегатное состояние (жидкая, твердая). [c.188]
[c.188]
у воды два жидких состояния
Команда ученых экспериментально подтвердила гипотезу 30-летней давности. Ученые показали, что вода может существовать в виде двух жидкостей разной плотности, которые при определенных условиях не смешиваются друг с другом.
Международная команда ученых экспериментально подтвердила гипотезу 30-летней давности. Ученые показали, что вода может существовать в виде двух жидкостей разной плотности, которые при определенных условиях не смешиваются друг с другом. Результаты эксперимента описаны в журнале Science. Новость появилась на портале EurekAlert!.
Всем нам известно, что у воды три агрегатных состояния: твердое, жидкое и газообразное. Однако в последние годы ученые начали получать доказательства того, что некоторые состояния существуют не в одной форме. Так, физик Перси Бриджмен открыл несколько кристаллических форм водяного льда – и некоторые из них (так называемый «суперионный» лед) ученым даже удалось получить в лаборатории. Конечно, такие формы могут получиться только при определенных условиях, и в естественном состоянии лед образуется на Земле только в одном виде.
Около 30 лет назад компьютерное моделирование показало, что и у жидкого состояния воды есть несколько состояний. «Эта противоречащая интуиции гипотеза была одним из самых важных вопросов в химии и физике воды. С самого начала она выглядела как противоречивый сценарий. Это связано с тем, что эксперименты, которые могут получить доступ к двум жидким состояниям воды, были очень сложными из-за очевидно неизбежного образования льда в условиях, в которых должны существовать две жидкости», – отметил Николас Джовамбаттиста, профессор Центра выпускников Университета Нью-Йорка и заведующий кафедрой физики Бруклинского колледжа, один из авторов данного исследования.
«Обычное» жидкое состояние воды, с которым мы все знакомы,
соответствует жидкой воде при нормальной температуре (примерно 25
градусов по Цельсию). «Аномальная» же вода образуется при низких
температурах (примерно -63 градуса по Цельсию) и существует в
двух различных жидких состояниях: жидкость с низкой плотностью
при низком давлении и жидкость с высокой плотностью при высоком
давлении. Эти две жидкости имеют заметно разные свойства и
отличаются по плотности на 20%. При соответствующих условиях эти
две формы воды не должны смешиваться. Между ними должна быть
тонкая граница раздела, как между обычной водой и нефтью,
например.
«Аномальная» же вода образуется при низких
температурах (примерно -63 градуса по Цельсию) и существует в
двух различных жидких состояниях: жидкость с низкой плотностью
при низком давлении и жидкость с высокой плотностью при высоком
давлении. Эти две жидкости имеют заметно разные свойства и
отличаются по плотности на 20%. При соответствующих условиях эти
две формы воды не должны смешиваться. Между ними должна быть
тонкая граница раздела, как между обычной водой и нефтью,
например.
Такое состояние воды практически неуловимо: ведь при -63 градусах вода неизбежно превращается в лед. Однако авторы исследования смогли его «поймать». Они использовали два фемтосекундных лазера: инфракрасный и ренгеновский. С помощью первого ученые быстро нагрели лед, чтобы превратить его в живую воду. В процессе нагрева создавалась жидкая вода высокой плотности при повышенном давлении. За этим состоянии ученые наблюдали с помощью второго лазера. Они заметили, что образуются пузырьки жидкости, содержащие «аномальную» воду. Пузырьки появились всего на миг, который длился от 20 наносекунд до трех микросекунд.
Для чего нужно знать о других жидких состояниях воды? Поскольку вода является одним из важнейших веществ на Земле, ее фазовое поведение играет фундаментальную роль в различных областях, включая биохимию, климатологию, криоконсервацию, криобиологию, материаловедение и многие другие области промышленности. Во многих процессах вода действует как растворитель, продукт, реагент или примесь. Отсюда следует, что необычные характеристики фазового поведения воды, такие как наличие двух жидких состояний, могут повлиять на многочисленные научные и инженерные приложения.
[Иллюстрация: JERKER LOKRANTZ AND ANDERS NILSSON]
Предмет: Химия Раздел долгосрочного плана: 7.1В Изменения состояния веществ | Школа: Калиновская средняя школа |
| ||||||||||||||
Дата: | ФИО учителя: составитель Панченко П. |
| ||||||||||||||
Класс: 7 | Количество
| отсутствующих: присутствующих: | ||||||||||||||
Тема урока | Агрегатные состояния веществ |
| ||||||||||||||
Цели обучения | 7.1.1.4 – знать различные агрегатные состояния веществ и уметь объяснять структуру твердых, жидких и газообразных веществ согласно кинетической теории частиц
|
| ||||||||||||||
Цели урока | – Знать различные виды агрегатных состояний вещества; – Описывать все виды агрегатного состояния вещества; – Объяснять агрегатное состояние вещества с точки зрения теории частиц;
|
| ||||||||||||||
Критерии оценки | Все учащиеся: – Приводят примеры твердых, жидких, газообразных веществ; – Знают расположение частиц в разных агрегатных состояниях; Большинство учащиеся: – Объясняют агрегатное состояние вещества с точки зрения теории частиц; – Сравнивать вещества в различных агрегатных состояниях Некоторые учащиеся: – Могут объяснить особенности перехода из одного агрегатного состояния вещества в другое; |
| ||||||||||||||
Языковые цели
| Учащиеся могут: Объяснить изменение агрегатных состояний веществ; Использовать термины для объяснения различных агрегатных состояний веществ; Обсудить переход из одного агрегатного состояния в другое; Терминология: Агрегатное состояние вещества, твердое, газообразное, жидкое, плавление, охлаждение, кипение, испарение, сублимация, десублимация, конденсация, Полезные слова и словосочетания для диалога: Существуют три вида агрегатных состояний, это……… Строение вещества определяется………. Я классифицировал вещества следующим образом……… Наша группа думает, что…….. Мы считаем, что…….. На изменение агрегатного состояния влияют……
|
| ||||||||||||||
Привитие ценностей
| « Мәңгілік ел»: проявить уважение к одноклассникам, при работе в группах, в парных работах; Толерантность; Образовательные ценности: творческое и критическое мышление, коммуникативные способности
|
| ||||||||||||||
Межпредметная связь | Физика, Естествознание, Познание мира; |
| ||||||||||||||
Предшествующие знания по теме
| Знают физические и химические явления, введение в химию |
| ||||||||||||||
Ход урока |
| |||||||||||||||
Запланированные этапы урока | Запланированная деятельность на уроке
| Ресурсы |
| |||||||||||||
Начало урока 10 мин
3 мин
3мин
4мин
. | 1.Организационный момент 3 мин 1.Тренинг «Подарок»- эмоциональный настрой учащихся на урок. Создание коллаборативной среды. Учитель здоровается с учениками и предлагает им встать в круг, взявшись за руки. «Давайте подумаем, что мы могли бы подарить Вашему классу, чтобы взаимодействие стало еще эффективней – а отношение более сплоченным? Я дарю Вам «Оптимизм и взаимное доверие». Каждый из учащихся высказывается, что он хотел бы подарить группе. «И наградим себя аплодисментами!». Актуализация знаний. Выход на тему урока. Прием « Иллюстрации» Перед вами представлены картинки. Внимательно рассмотрите их. Что их объединяет? Чем отличаются картинки между собой? Как вы думаете, о чем мы сегодня будем говорить? Итак, тема нашего урока « Агрегатные состояния веществ» Определить цели урока. Прием «Прогноз» Раздать учащимся листы, на котором показана цель урока и предлагаю сделать прогноз на конец урока, предположить как они будут себя чувствовать, что они будут знать или не знать, что будут уметь или не уметь делать. |
Презентация Power Point
Приложение 1 |
| |||||||||||||
Середина урока 11-40
3мин
22 мин
10мин
5 мин
| 2. Деление на группы – прием «Изображения» В корзине находятся картинки с различными видами агрегатных состояний. Ученики вытягивают картинку и ищут одинаковые, тем самым объединяются в группы. Работа с текстом учебника. Каждая группа работает по своей теме: 1группа – «Жидкое состояние вещества» 2 группа – « Газообразное состояние вещества» 3 группа – « Твердое состояние вещества» 4 группа – « Изменение агрегатного состояния веществ» Метод « Своя игра» На доске представлены вопросы по уровням Уровень А – сложный Уровень В – средний Уровень С – низкий Выходят представители групп выбирают вопросы, отвечают на вопросы. Формативное оценивание: Метод «большого пальца» Большой палец вверх – согласны Большой палец в сторону – не совсем согласны Большой палец вниз – не согласны
Индивидуальная работа Задание. 1. Определите агрегатное состояние веществ, изображенных на картинках. 2. Установите соответствие между агрегатным состоянием и его структурой. 3. объясни особенности строения данного агрегатного состояния.
Комментарий учителя. Обратная связь.
| (4 вида картинок по 4 штук каждого вида) Приложение 2
Учебник Химия 7 класс Авторы: М. К. Оспанова Т. Г. Белоусова К. С. Аухадиева Приложение3
Картинки с изображением агрегатных состояний веществ Приложение 4
|
| |||||||||||||
Конец урока 41-45 4 мин
| В конце урока учащиеся делают рефлексию Прием « Облако тегов» Раздаются листы на которых варианты, необходимо дополнить: Сегодня я узнал………. Было трудно……… Я понял, что………….. Я научился…………….. Я смог……………….. было интересно узнать, что………. Меня удивило……………. | Приложение Мультимедиа, Power Point |
| |||||||||||||
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? | Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? | Здоровье и соблюдение техники безопасности |
| |||||||||||||
Дифференциация на уроке осуществляется при , групповой и индивидуальной работе на основе предлагаемых видов заданий, при выполнении заданий на основе оказываемой поддержки учителя.
Все учащиеся: – Приводят примеры твердых, жидких, газообразных веществ; – Знают расположение частиц в разных агрегатных состояниях; Большинство учащиеся: – Объясняют агрегатное состояние вещества с точки зрения теории частиц; – Сравнивать вещества в различных агрегатных состояниях Некоторые учащиеся: – Могут объяснить особенности перехода из одного агрегатного состояния вещества в другое; | Оценивание по заданиям: 1. Взаимооценивание 2. Метод « Прогноз» 3.. Оценивание прием «Поднятый вверх палец» 3.Комментарий учителя,словесная оценка 4. Рефлексия Метод «Облако тегов» На уроке оценивается умение учащегося определять виды агрегатных состояний веществ, объяснять особенности строения данных агрегатных состояний веществ, переход вещества из одного агрегатного состояния вещества в другое; | Смена видов деятельности, являются элементами применения здоровьесберегающей технологии |
| |||||||||||||
Газ азот (N2) является одним из важных элементов всего живого на планете Земля. Азот представляет собой бесцветный газ, который не обладает запахом и трудно взаимодействует с другими веществами. При помощи специальных установок можно получить жидкий азот, который внешне напоминает воду и при взаимодействии с воздухом начинается реакция поглощения кислорода. При температуре минус 200 °C жидкий азот переходит в твердое агрегатное состояние в виде белых кристаллов. На воздухе твердый азот начинает взаимодействовать с кислородом, поглощая его, и переходит в состояние жидкого азота с долей кислорода. При нагревании и испарении жидкого азота получается в сотни раз больше азота в газообразном состоянии. Поэтому жидкий азот следует тщательно хранить в специальных криогенных цистернах и оберегать от взаимодействия с воздухом. Жидкий азот широко применяют в криогенике, для охлаждения различного оборудования, глубокой заморозки и в пожаротушении. Применение жидкого азота (N2) в промышленностиВ промышленных масштабах свободный азот получают путем его выделения из воздуха. Чаще всего для этих целей используют метод фракционной перегонки, при которой сжиженный воздух медленно нагревается. В результате нагревания испаряются благородные газы, потом испаряется азот и в итоге остается жидкий кислород. Чтобы достичь чистоты азота следует повторить процесс фракционной перегонки несколько раз. При помощи данного метода ежегодно производят миллионы тонн азота. В своем большинстве азот идет для производства аммиака, который является важным элементом в большинстве областей нашей промышленности. полная информация ГазообразныйЖидкий |
Жидкое агрегатное состояние — Большая Энциклопедия Нефти и Газа, статья, страница 1
Жидкое агрегатное состояние
Cтраница 1
Жидкое агрегатное состояние танимает промежуточное положение между газообразным и твердым состояниями. Жидкости по Харантеру движения молекул приближаются к газам, а по плотности упаковки — к твердым телам.
[1]
Жидкости по Харантеру движения молекул приближаются к газам, а по плотности упаковки — к твердым телам.
[1]
Жидкое агрегатное состояние является промежуточным между кристаллическим и газообразным. При высоких температурах свойства жидкости приближаются к свойствам неидеального газа, при низких — — к свойствам кристаллического вещества. [3]
Жидкое агрегатное состояние занимает промежуточное положение между газообразным и твердым состояниями. [4]
Жидкое агрегатное состояние занимает промежуточное положение между газообразным и твердым. Жидкости по характеру движения молекул приближаются к газам, а по плотности упаковки — к твердым телам. Обладая значительной подвижностью, молекулы жидкости легко перемещаются, их центры равновесия непрерывно изменяют положение. Поэтому жидкость легко меняет форму: течет под влиянием небольших напряжений. [5]
Жидкое агрегатное состояние является промежуточным между кристаллическим и газообразным. При высоких температурах свойства жидкости приближаются к свойствам неидеального газа, при низких — к свойствам кристаллического вещества. [7]
Жидкое агрегатное состояние занимает промежуточное положение между газообразным и твердым состояниями. Жидкости по характеру движения молекул приближаются к газам, а по плотности упаковки-к твердым телам. Обладая значительной подвижностью, молекулы жидкости легко перемещаются, их центры равновесия легко изменяют положение. Поэтому жидкость легко меняет форму — течет под влиянием небольших напряжений. [8]
Жидкое агрегатное состояние занимает промежуточное положение. В этом состоянии ЭМВ сравнима с ЭТД. По подвижности молекул жидкости находятся ближе к газам ( из-за флуктуации энергии возможна подвижность молекул в целом — их вращательные и поступательные движения), а по расстояниям между молекулами и характеру взаимодействия — ближе к твердым телам. Жидкость форму не сохраняет ( принимает форму сосуда, в который ее помещают), но сохраняет собственный объем. При внешнем воздействии жидкость изменяет форму — течет с той или иной скоростью в зависимости от вязкости.
[9]
По подвижности молекул жидкости находятся ближе к газам ( из-за флуктуации энергии возможна подвижность молекул в целом — их вращательные и поступательные движения), а по расстояниям между молекулами и характеру взаимодействия — ближе к твердым телам. Жидкость форму не сохраняет ( принимает форму сосуда, в который ее помещают), но сохраняет собственный объем. При внешнем воздействии жидкость изменяет форму — течет с той или иной скоростью в зависимости от вязкости.
[9]
Жидкое агрегатное состояние является промежуточным между кристаллическим и газообразным. При высоких температурах свойства жидкости приближаются к свойствам неидеального газа, при низких — к свойствам кристаллического вещества. [11]
Жидкое агрегатное состояние вещества по своему строению является промежуточным между газообразным, в котором частицы распределены в пространстве случайным образом, и твердым кристаллическим, в котором расположение частиц строго упорядочено. В расположении частиц жидкости наблюдается сложное сочетание элементов порядка и беспорядка. Однако в отличие от кристаллов, в которых частицы совершают колебания около строго фиксированных положений, частицы жидкости способны к перемещению. [12]
Жидкое агрегатное состояние таниыает промежуточное полож — яие между газообразным и твердым состояниями, Жидкости по характеру движения молекул приближаются к газам, а по плотности упаковки — к твердым телам. [13]
Жидкое агрегатное состояние вещества по своему строению является промежуточным между газообразным, в котором частицы распределены в пространстве случайным образом, и твердым кристаллическим, в котором расположение частиц строго упорядочено. В расположении частиц жидкости наблюдается сложное сочетание элементов порядка и беспорядка. Однако в отличие от кристаллов, в которых частицы совершают колебания около строго фиксированных положений, частицы жидкости способны к перемещению.
[14]
Однако в отличие от кристаллов, в которых частицы совершают колебания около строго фиксированных положений, частицы жидкости способны к перемещению.
[14]
Страницы: 1 2 3 4
Агрегатное состояние вещества
Для того чтобы понять, что такое агрегатное состояние вещества, вспомните или представьте себя летом возле речки с мороженным в руках. Замечательная картинка, правда?
Так вот, в этой идиллии кроме получения удовольствия можно еще осуществить физическое наблюдение. Обратите внимание на воду. В реке она жидкая, в составе мороженного в виде льда – твердая, а в небе в виде облаков – газообразная. То есть она находится одновременно в трех различных состояниях. В физике это называется агрегатным состоянием вещества. Различают три агрегатных состояния – твердое, жидкое и газообразное.
Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества мы можем наблюдать воочию в природе. Вода с поверхности водоемов испаряется, и образуются облака. Так жидкость переходит в газ. Зимой вода в водоемах замерзает, переходя в твердое состояние, а весной вновь тает, переходя в обратно в жидкость. Что происходит с молекулами вещества при переходе его из одного состояния в другое? Меняются ли они? Отличаются ли, например, молекулы льда от молекул пара? Ответ однозначный: нет. Молекулы остаются абсолютно теми же. Меняется их кинетическая энергия, а соответственно и свойства вещества. Энергия молекул пара достаточно велика, чтобы разлетаться в разные стороны, а при охлаждении пар конденсируется в жидкость, и энергии у молекул все еще достаточно для почти свободного перемещения, но уже недостаточно, чтобы оторваться от притяжения других молекул и улететь. При дальнейшем охлаждении вода замерзает, становясь твердым телом, и энергии молекул уже недостаточно даже для свободного перемещения внутри тела. Они колеблются около одного места, удерживаемые силами притяжения других молекул.
Они колеблются около одного места, удерживаемые силами притяжения других молекул.
Характер движения и состояния молекул в различных агрегатных состояниях вещества можно отразить на следующей таблице:
|
Агрегатное состояние вещества |
Свойства вещества |
Расстояние между частицами |
Взаимодействие частиц |
Характер движения |
Порядок расположения |
|
Газ |
Не сохраняет форму и объем |
Гораздо больше размеров самих частиц |
Слабое |
Хаотическое (беспорядочное) непрерывное. Свободно летают, иногда сталкиваясь. |
Беспорядочное |
| Жидкость |
Не сохраняет форму, сохраняет объем
|
Сравнимо с размерами самих частиц |
Сильное |
Колеблются около положения равновесия, постоянно перескакивая с одного места на другое. |
<p >Беспорядочное |
|
Твердое тело |
<p >Сохраняет форму и объем |
Мало по сравнению с размерами самих частиц |
Очень сильное |
Непрерывно колеблются около положения равновесия |
В определенном порядке |
Процессов, в которых происходит изменение агрегатных состояний веществ, всего шесть.
Переход вещества из твердого состояния в жидкое называется плавлением, обратный процесс – кристаллизацией. Когда вещество переходит из жидкости в газ, это называется парообразованием, из газа в жидкость – конденсацией. Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией, обратный процесс – десублимацией.
- 1. Плавление
- 2. Кристаллизация
- 3. Парообразование
- 4. Конденсация
- 5. Сублимация
- 6. Десублимация
Примеры всех этих переходов мы с вами не раз наблюдали в жизни. Лед плавится, образуя воду, вода испаряется, образуя пар. В обратную сторону пар, конденсируясь, переходит снова в воду, а вода, замерзая, становится льдом. А если вы думаете, что вы не знаете процессов сублимации и десублимации, то не спешите с выводами. Запах любого твердого тела – это и есть не что иное, как сублимация. Часть молекул вырывается из тела, образуя газ, который мы и можем унюхать. А пример обратного процесса – это узоры на стеклах зимой, когда пар в воздухе, замерзая, оседает на стекле и образует причудливые узоры.
Нужна помощь в учебе?
Предыдущая тема: Студент или преподаватель? Кого выбрать? — Nado5.ru
Следующая тема:   График плавления: разбираем график на примере льда
1 Агрегатные состояния вешества — Котельные установки
Известны четыре состояния, в которых может находиться в природе любое вещество.
Такими агрегатными состояниями вещества являются твердое, жидкое, газообразное и
плазменное. Все материальные тела состоят из микрочастиц размером порядка 10-10 м — атомов, молекул, связанных между собой силами взаимного притяжения и
находящихся в состоянии непрерывного хаотического теплового движения. Атом (от
греч. atomos
— неделимый) — это наименьшая частица вещества (химического элемента),
которая еще является носителем его химических свойств. Атомы могут существовать
как в свободном состоянии (в газе, плазме), так и в виде химических соединений —
молекул. Молекулы простых веществ состоят из одинаковых атомов, а молекулы
сложных веществ — из разных атомов. Атомы разных элементов имеют неодинаковые
размеры и разные массы. Так как атомы имеют форму шара, их размеры
характеризуются диаметром или радиусом. Самая маленькая из известных
микрочастиц — это атом водорода. Его диаметр приблизительно равен 10-8 см, или 10-10 м. Диаметр атома, например, хлора приблизительно равен
1,8- 10-8 см и т.д. Для выражения таких малых величин используют
единицы длины, которые называются ангстремами (А) и
нанометрами (нм): 1 А = 0,1 нм = 10-9м.
Атомы могут существовать
как в свободном состоянии (в газе, плазме), так и в виде химических соединений —
молекул. Молекулы простых веществ состоят из одинаковых атомов, а молекулы
сложных веществ — из разных атомов. Атомы разных элементов имеют неодинаковые
размеры и разные массы. Так как атомы имеют форму шара, их размеры
характеризуются диаметром или радиусом. Самая маленькая из известных
микрочастиц — это атом водорода. Его диаметр приблизительно равен 10-8 см, или 10-10 м. Диаметр атома, например, хлора приблизительно равен
1,8- 10-8 см и т.д. Для выражения таких малых величин используют
единицы длины, которые называются ангстремами (А) и
нанометрами (нм): 1 А = 0,1 нм = 10-9м.
В этих единицах диаметр атома водорода приблизительно равен 1 А или 0,1 нм. Микрочастицы часто называют наночастицами.
Различают простые и сложные вещества. Вещества, состоящие из атомов одного вида, называют простыми, как, например, газообразные кислород 02, водород Н2, азот N2 или твердые углерод С, железо Fe. Вещества, молекулы которых состоят из атомов разного вида, называют сложны м и. Примерами сложных веществ могут быть газы — диоксид углерода С02 (углекислый газ), метан СН4, жидкость — вода Н20 и т.д.
На уровне современных знаний атомы, в свою очередь, представляют собой
сложнейшие системы элементарных частиц. Каждый атом состоит из положительно
заряженного ядра и отрицательно заряженных частиц — электронов, которые
движутся вокруг него. Ядро включает в себя положительно заряженные частицы —
протоны, частицы, которые не имеют заряда, — нейтроны и множество (около 300)
элементарных частиц и античастиц. Многие элементарные частицы также имеют
сложную структуру и также состоят из еще более мелких частиц — кварков. Мир
элементарных частиц бесконечен и до конца непознаваем. Их превращения на
макроскопическом уровне проявляются и в изменении агрегатного состояния тел
(физические превращения), и в изменении состава вещества (химические
превращения).
Таким образом, материальные тела могут претерпевать разные изменения как физические, так и химические. Явления, при которых изменяется только агрегатное состояние вещества и не происходит образования новых веществ, называются физическими. Например, при нагревании воды до температуры кипения образуется пар, т.е. ее агрегатное состояние изменяется от жидкого до газообразного. При охлаждении пара снова образуется вода. В данном примере изменяется только физическое состояние воды, новые вещества не образуются. То же наблюдается и при таянии льда. Если же процесс связан с изменением состава и строения вещества, то его называют химическим превращением или химической реакцией. Примером химической реакции является процесс сжигания угля с образованием газообразных продуктов горения. Химические явления происходят и в процессе коррозии металлов, и в реакциях получения металлов из руд и т.д.
Состояние физических тел зависит от межатомного расстояния и сил межатомного притяжения, а также от степени тепловых колебаний частиц около их равновесных положений.
Агрегатное состояние тела определяется в результате этого как твердое (большая сила связи частиц, стабильная упругая форма тела, большая плотность, малая сжимаемость тела), газообразное (частицы не связаны или слабо связаны между собой молекулярными силами притяжения, хаотически движутся, заполняя весь объем, т.е. высокая текучесть) и жидкое (большая плотность и малая сжимаемость, как и у твердого тела, отсутствие упругости и стабильности формы, а также текучесть, как и у газа).
Чтобы сжать твердое тело или разделить его на части, необходимо приложить
определенную силу. По сравнению с твердыми веществами в жидкостях сила
межчастичного притяжения значительно меньше («ближний порядок»), а расстояние
между частицами по порядку величины соответствует размеру самих частиц (около
0,1 нм). В результате жидкость практически не сжимается и в свободном состоянии
не имеет определенной формы, объем ее измеряется размером сосуда, в котором она
находится.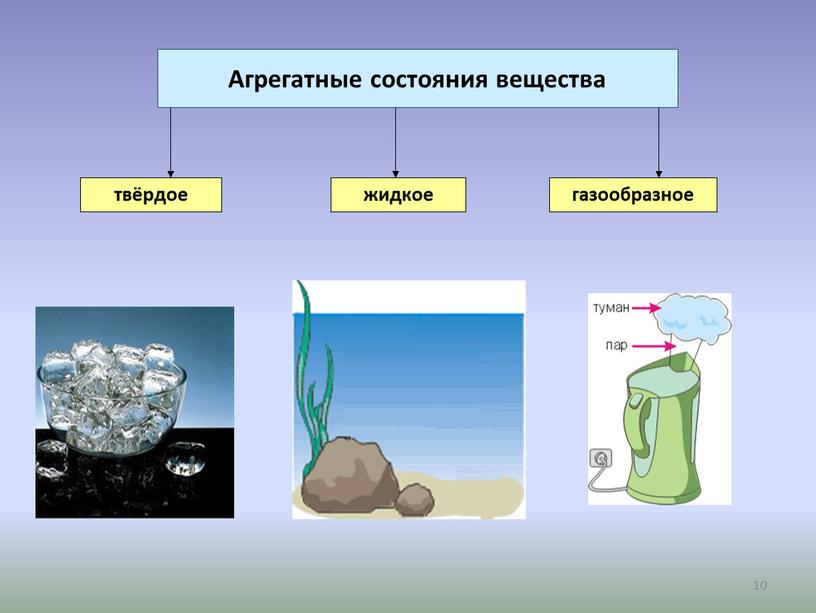
В газообразных веществах, примером которых служат воздух, пар, горючие и дымовые газы, сила межмолекулярного притяжения очень мала, и напротив, межмолекулярное пространство и подвижность молекул очень велики. Газообразные тела имеют большую текучесть и не имеют определенного объема. Как и жидкости, они принимают форму сосуда, в котором находятся. По сравнению с твердыми телами и жидкостями газы легко сжимаются.
Состояния (фазы) материи (агрегация) — x-engineer.org
Все окружающие нас объекты состоят из материи . Вселенная также содержит материю, но в другом масштабе. Материя может существовать в нескольких состояниях (также называемых фазами). Наиболее распространенными фундаментальными состояниями материи являются:
Существует также четвертое состояние, тоже довольно распространенное, но менее интуитивно понятное:
Состояние, в котором находится объект, зависит от двух физических атрибутов: давления и температуры .Возьмем для примера воду. На Земле наиболее распространенным состоянием воды является жидкое состояние. Это связано с тем, что глобальная средняя годовая температура составляет 15 ° C , а атмосферное давление составляет 1 бар . В этих условиях вода будет в жидком состоянии.
Чем выше температура (теплота, энтальпия) вещества, тем выше кинетическая энергия молекул. Это заставит молекулы колебаться с более высокими амплитудами и частотами, что нарушит межмолекулярные силы и отделит молекулы друг от друга.Поэтому, как правило, чем выше температура, тем ниже плотность.
В зависимости от температуры (при постоянном давлении) вещество может находиться в твердом, жидком или газообразном состоянии.
Изображение: Наиболее распространенные фазы материи
ТВЕРДЫЕ
Материя в твердом состоянии имеет самую высокую плотность, а молекулы плотно упакованы вместе. По сравнению с другими состояниями кинетическая энергия в твердом теле мала. Твердые тела имеют определенную форму и объем, если их поместить в контейнер, они не соответствуют геометрии контейнера.Имея определенный объем, даже если сжатие при высоком давлении не сжимает их в меньшем объеме, твердые вещества не сжимаются.
По сравнению с другими состояниями кинетическая энергия в твердом теле мала. Твердые тела имеют определенную форму и объем, если их поместить в контейнер, они не соответствуют геометрии контейнера.Имея определенный объем, даже если сжатие при высоком давлении не сжимает их в меньшем объеме, твердые вещества не сжимаются.
Твердое тело может стать жидкостью, процесс называется плавлением или плавлением. Например, лед (твердый) при температуре выше 0 ° C тает и превращается в жидкую воду. Тот же процесс применяется и к железу, которое становится жидким при температуре выше 1500 ºC.
Твердые тела могут также напрямую переходить в газы, этот процесс называется сублимацией .Нафталин, основной ингредиент традиционных нафталиновых шариков, представляет собой органическое соединение с формулой C 10 H 8 . Это твердое вещество, которое возгоняется при стандартной температуре воздуха и низких температурах.
ЖИДКОСТИ
Жидкости имеют меньшую плотность, чем твердые тела (кроме воды), но более высокую кинетическую энергию. У них также есть определенный объем, поэтому их нельзя сжать. Молекулы воды более рыхлые, по сравнению с твердыми телами, и они могут перемещаться относительно друг друга.Жидкость не имеет определенной формы и, будучи помещенной в емкость, принимает ее форму.
Жидкость может переходить в твердое состояние посредством процесса, называемого затвердеванием (или кристаллизацией). Вода, если ее охладить ниже 0 ° C, становится твердой (лед).
Процесс превращения жидкости в газ называется испарение . В случае с водой, если нагреться до 100 ° C, она закипает и превращается в пар.
Изображение: Фазы воды в зависимости от температуры (тепла)
ГАЗЫ
По сравнению с другими состояниями вещества, газов имеют самую низкую плотность и самую высокую кинетическую энергию. Молекулы в газе имеют много места между собой и, если их не удерживать, будут распространяться бесконечно. Если поместить в емкость, газ занимает весь объем. Под давлением пространство между молекулами станет меньше, а объем газа уменьшится. Газ сжимаемый.
Молекулы в газе имеют много места между собой и, если их не удерживать, будут распространяться бесконечно. Если поместить в емкость, газ занимает весь объем. Под давлением пространство между молекулами станет меньше, а объем газа уменьшится. Газ сжимаемый.
Газ может быть преобразован в жидкость с помощью процесса, называемого конденсация . Если газ достаточно охладиться, кинетическая энергия молекулы больше не сможет преодолевать межмолекулярные силы.Это приведет к скоплению молекул, которые образуют жидкость. Например, водяные пары (пар) при охлаждении ниже 100 ° C начнут конденсироваться в жидкую воду.
Превращение газа непосредственно в твердое тело называется осаждением . Если поместить газ непосредственно в очень холодную среду, он превратится в крошечные твердые частицы. Например, пары воды превращаются в кристаллы льда при температуре ниже 0 ° C.
Изображение: Физика перехода между состояниями материи
ПЛАЗМА
Плазма — наиболее распространенное состояние материи во Вселенной, но не очень распространенное на Земле.При очень большом количестве тепла газ может превратиться в плазму. В плазменном состоянии атомы ионизированы, , что отделяет электроны (отрицательный заряд) от ионов (положительный заряд).
Примеры плазмы в природе: молния, неоновый свет и электрические искры. Плазма также может быть произведена искусственно, наиболее распространенной технологией является приложение электрического тока через диэлектрический газ или жидкость.
Изображение: плазменная струя
Плазма может быть получена только из газов, а обратный процесс — только из плазмы в газ посредством деионизации .
ФАЗОВЫЕ ДИАГРАММЫ
Превращение вещества лучше всего описывается на фазовых диаграммах . Эти диаграммы показывают равновесные фазы в зависимости от температуры и давления или состава вещества.
Простые фазовые диаграммы (2-D), которые легко понять, представляют собой диаграммы давление – температура одного простого вещества, например воды . Вертикальная ось соответствует давлению, а горизонтальная — температуре.Фазовая диаграмма показывает в пространстве давление – температура линии равновесия или межфазных границ между тремя фазами: твердым телом, жидкостью и газом.
Изображение: диаграмма фазовых границ материи (2-D)
Тройная точка представлена значением температуры ( T tp ) и давления ( p tp ), при которых все три фазы (газ, жидкость и твердое тело) этого вещества сосуществуют в термодинамическом равновесии. Для воды координаты тройной точки: 0.01 ° C и 0,0061166 бар. На этом этапе, при небольших изменениях давления и температуры, можно превратить все вещество в лед, воду или пар.
Изображение: Фазовая диаграмма воды
Критическая точка определяет конец границы жидкости и пара. Он определяется критической температурой ( T cr ) и критическим давлением ( p cr ). В критической точке фазовая граница исчезает, жидкость и ее пар могут сосуществовать в одном и том же состоянии.Критическая точка для воды находится при 374 ° C и 220,888 бар. Вблизи критической точки вода становится сжимаемой, расширяемой, с плохой диэлектрической проницаемостью и плохим растворителем для электролитов. Выше критической точки вода становится сверхкритической жидкостью . Вещество в этом состоянии сочетает в себе свойства как жидкости, так и газа, и с помощью точной настройки температуры и давления можно управлять поведением, чтобы оно было более жидким или газообразным.
Вода (H 2 O) и диоксид углерода (CO 2 ) являются наиболее часто используемыми сверхкритическими жидкостями.
Изображение: Фазовая диаграмма давление-температура углекислого газа
Особым состоянием вещества являются конденсаты Бозе-Эйнштейна (БЭК) . При охлаждении вещества при чрезвычайно низких температурах (близких к абсолютному нулю, 0 K = -273,15 ° C) молекулярная вибрация почти полностью прекращается. Все атомы вещества собираются вместе, потому что нет кинетической энергии, чтобы разделить их, создав «суператом». Вещества BEC в основном используются для моделирования условий, которые могут возникнуть в черных дырах.
При охлаждении вещества при чрезвычайно низких температурах (близких к абсолютному нулю, 0 K = -273,15 ° C) молекулярная вибрация почти полностью прекращается. Все атомы вещества собираются вместе, потому что нет кинетической энергии, чтобы разделить их, создав «суператом». Вещества BEC в основном используются для моделирования условий, которые могут возникнуть в черных дырах.
Для любых вопросов или замечаний относительно этого руководства, пожалуйста, используйте форму комментариев ниже.
Не забывайте ставить лайки, делиться и подписываться!
Теория химических расчетов | Агрегированные состояния вещества | Упражнения по химии
Вещество присутствует в природе в трех различных агрегатных состояниях вещества: твердом, жидком и газообразном. Твердые тела имеют фиксированную форму и объем. Жидкости имеют фиксированный объем, но их форма соответствует форме их контейнера.Газы не имеют выхода или определенного объема, регулируя в обоих случаях их емкость. Эти два свойства, форма и объем, которые служат для различения трех агрегатных состояний, зависят от сил притяжения между составляющими частицами вещества и относительного упорядочения указанных частиц.
ЗАКОНЫ О ГАЗАХ
Объем V любого вещества (твердого, жидкого или газообразного) является функцией количества вещества, которое может быть выражено через число молей n давления p и температуры T.
Закон Бойля-Мариотта
«При постоянной температуре и фиксированной массе газа занимаемый объем обратно пропорционален давлению».
Bioprofe | Теория агрегации состояний вещества | 01
Это более известно по выражению:
Bioprofe | Теория агрегации состояний вещества | 02
Где V — объем, занимаемый при давлении P, а V´ — объем, занимаемый при давлении P ’.
Закон Шарля-Гэя Люссака
«При постоянном давлении и фиксированной массе газа занимаемый объем прямо пропорционален температуре».
Bioprofe | Теория агрегации состояний вещества | 03
«При постоянном объеме и фиксированной массе газа давление прямо пропорционально температуре».
Bioprofe | Теория агрегации состояний вещества | 04
Уравнение состояния идеальных газов.
Законы Бойля-Мариотта и Шарля-Гей-Люссака можно объединить в одно выражение, получив таким образом соотношение между объемом данной массы газа, давлением и температурой.
Bioprofe | Теория агрегации состояний вещества | 05
Применение закона Авогадро:
Bioprofe | Теория агрегации состояний вещества | 06
Bioprofe | Теория агрегации состояний вещества | 07
Закон Далтона.
«Общее давление p, оказываемое смесью газов, равно сумме парциальных давлений p I , которые оказывал бы каждый газ, если бы он был только компонентом в том же контейнере».
Bioprofe | Теория агрегации состояний вещества | 08
(p = общее давление смеси; p i = парциальное давление каждого газа x i = мольная доля каждого газа).
Кажущаяся молекулярная масса газовой смеси, М:
Bioprofe | Теория агрегации состояний вещества | 09
(M i = молекулярная масса каждого газа; n i = количество молей каждого газа; V i = объем для каждого газа; V = объем смеси).
Кинетическая энергия 1 моля идеального газа:
Bioprofe | Теория агрегации состояний вещества | 10
СКОРОСТНЫЕ МОЛЕКУЛЫ
Среднеквадратичная скорость газа:
Bioprofe | Теория агрегации состояний вещества | 11
Средняя скорость газа:
Bioprofe | Теория агрегации состояний вещества | 12
Наиболее вероятная скорость газа:
Bioprofe | Теория агрегации состояний вещества | 13
Взаимосвязь между различными скоростями:
Bioprofe | Теория агрегации состояний вещества | 14
ТРАНСЛЯЦИЯ ГАЗА
Закон Грэма:
«Скорость диффузии или истечения газов, v, обратно пропорциональна квадратным корням из их плотностей или молекулярных масс».
Bioprofe | Теория агрегации состояний вещества | 15
РЕАЛЬНЫЕ ГАЗЫ
Уравнение Ван-дер-Ваальса для 1 моля газа:
Bioprofe | Теория агрегации состояний вещества | 17
(a / V 2 = внутреннее давление газа; b = covolume).
Связь между a, b и R и постоянная критика:
Bioprofe | Теория агрегации состояний вещества | 16
ФАЗЫ ГИББСА ПРАВИЛО:
F + L = C + 2
(F = количество фаз; L = количество степеней свободы; C = количество компонентов).
Материя: определение и пять состояний материи
Материя — это «вещество», из которого состоит Вселенная; все, что занимает пространство и имеет массу, является материей.
Вся материя состоит из атомов , которые, в свою очередь, состоят из протонов, нейтронов и электронов.
По данным Вашингтонского государственного университета , атомы объединяются в молекулы, которые являются строительными блоками для всех типов материи.И атомы, и молекулы удерживаются вместе с помощью формы потенциальной энергии, называемой химической энергией. В отличие от кинетической энергии , которая представляет собой энергию движущегося объекта, потенциальная энергия представляет собой энергию, запасенную в объекте.
Пять фаз материи
Существует четыре естественных состояния материи: твердые тела, жидкости, газы и плазма. Пятое состояние — это искусственные конденсаты Бозе-Эйнштейна.
Твердые тела
В твердом теле частицы плотно упакованы вместе, поэтому они мало двигаются.Электроны каждого атома постоянно находятся в движении, поэтому атомы имеют небольшую вибрацию, но они фиксируются в своем положении. Из-за этого частицы в твердом теле имеют очень низкую кинетическую энергию.
Твердые тела имеют определенную форму, а также массу и объем и не соответствуют форме контейнера, в который они помещены. Твердые вещества также имеют высокую плотность, что означает, что частицы плотно упакованы вместе.
Жидкости
В жидкости частицы плотнее упакованы, чем в твердом теле, и могут обтекать друг друга, придавая жидкости неопределенную форму.Таким образом, жидкость будет соответствовать форме емкости.
Как и твердые тела, жидкости (большинство из которых имеет более низкую плотность, чем твердые тела) невероятно трудно сжимать.
Газы
В газе частицы имеют большое пространство между собой и обладают высокой кинетической энергией. У газа нет определенной формы или объема. Если не ограничен, частицы газа будут распространяться бесконечно; если он ограничен, газ расширится, чтобы заполнить свой контейнер.Когда газ подвергается давлению за счет уменьшения объема контейнера, пространство между частицами уменьшается, и газ сжимается.
Плазма
Плазма не является обычным состоянием материи здесь, на Земле, но, по данным лаборатории Джефферсона , это может быть наиболее распространенное состояние материи во Вселенной. Звезды — это, по сути, перегретые шары плазмы.
Плазма состоит из сильно заряженных частиц с чрезвычайно высокой кинетической энергией.Благородные газы (гелий, неон, аргон, криптон, ксенон и радон) часто используются для создания светящихся знаков с помощью электричества для ионизации их до состояния плазмы.
Конденсат Бозе-Эйнштейна
Конденсат Бозе-Эйнштейна (BEC) был создан учеными в 1995 году. Используя комбинацию лазеров и магнитов, Эрик Корнелл и Карл Вейман, ученые Объединенного института лабораторной астрофизики ( JILA) в Боулдере, штат Колорадо, охладил образец рубидия с точностью до нескольких градусов от абсолютного нуля.При такой чрезвычайно низкой температуре движение молекул почти прекращается. Поскольку кинетическая энергия почти не передается от одного атома к другому, атомы начинают слипаться. Больше нет тысяч отдельных атомов, есть только один «суператом».
BEC используется для изучения квантовой механики на макроскопическом уровне. Похоже, что свет замедляется при прохождении через BEC, что позволяет ученым изучать парадокс частицы / волны. БЭК также обладает многими свойствами сверхтекучей жидкости или жидкости, которая течет без трения.BEC также используются для моделирования условий, которые могут существовать в черных дырах.
Прохождение фазы
Добавление или удаление энергии из материи вызывает физические изменения, когда материя перемещается из одного состояния в другое. Например, добавление тепловой энергии (тепла) к жидкой воде превращает ее в пар или пар (газ). А удаление энергии из жидкой воды превращает ее в лед (твердое тело). Физические изменения также могут быть вызваны движением и давлением.
Плавление и замораживание
Когда твердое тело нагревается, его частицы начинают вибрировать быстрее и отдаляться друг от друга.Когда вещество достигает определенной комбинации температуры и давления, его точка плавления , твердое вещество начинает плавиться и превращаться в жидкость.
Когда два состояния вещества, например твердое и жидкое, находятся при равновесной температуре и давлении, дополнительное тепло, добавленное в систему, не приведет к увеличению общей температуры вещества до тех пор, пока весь образец не достигнет одинакового физического состояния. Например, если вы положите лед в стакан с водой и оставите его при комнатной температуре, лед и вода в конечном итоге достигнут одинаковой температуры.Поскольку лед тает от тепла, исходящего от воды, он будет оставаться при нуле градусов по Цельсию, пока весь кубик льда не растает, а затем продолжит нагреваться.
Когда тепло отводится от жидкости, ее частицы замедляются и начинают оседать в одном месте внутри вещества. Когда вещество достигает достаточно прохладной температуры при определенном давлении, точке замерзания, жидкость становится твердой.
Большинство жидкостей сжимаются при замерзании. Однако вода расширяется, когда замерзает в лед, заставляя молекулы раздвигаться дальше и уменьшать плотность, поэтому льда плавает поверх воды .
Добавление дополнительных веществ, таких как соль в воду, может изменить как температуру плавления, так и температуру замерзания. Например, добавление соли в снег снизит температуру замерзания воды на дорогах, что сделает его более безопасным для водителей.
Существует также точка, известная как тройная точка , где твердые тела, жидкости и газы существуют одновременно. Например, вода существует во всех трех состояниях при температуре 273,16 Кельвина и давлении 611,2 Па.
Большинство жидкостей сжимаются при замерзании, но вода расширяется, делая ее менее плотной, когда она становится льдом.Эта уникальная характеристика позволяет льду плавать в воде, как этот массивный айсберг в Антарктиде. (Изображение предоставлено NASA / Operation Icebridge)Сублимация
Когда твердое вещество превращается непосредственно в газ, минуя жидкую фазу, этот процесс известен как сублимация. Это может происходить либо при быстром повышении температуры образца выше точки кипения (мгновенное испарение), либо при «лиофилизации» вещества путем его охлаждения в условиях вакуума, так что вода в веществе подвергается сублимации и удаляется из него. пример.Некоторые летучие вещества подвергаются сублимации при комнатной температуре и давлении , например замороженный диоксид углерода или сухой лед.
Испарение
Испарение — это превращение жидкости в газ, которое может происходить либо при испарении, либо при кипении.
Поскольку частицы жидкости находятся в постоянном движении, они часто сталкиваются друг с другом. Каждое столкновение также вызывает передачу энергии, и когда достаточно энергии передается частицам у поверхности, они могут быть полностью выбиты от образца в виде свободных частиц газа.По мере испарения жидкости охлаждаются, потому что энергия, передаваемая поверхностным молекулам, вызывающая их утечку, уносится вместе с ними.
Жидкость закипает, когда к жидкости добавляется достаточно тепла, чтобы вызвать образование пузырьков пара под поверхностью. Эта точка кипения — это температура и давление, при которых жидкость становится газом.
Конденсация и осаждение
Конденсация происходит, когда газ теряет энергию и объединяется с образованием жидкости.Например, водяной пар конденсируется в жидкую воду .
Осаждение происходит, когда газ превращается непосредственно в твердое тело, минуя жидкую фазу. Водяной пар становится льдом или инеем, когда воздух, соприкасающийся с твердым телом, например травинкой, холоднее, чем остальной воздух.
Дополнительные ресурсы:
Эта статья была обновлена 21 августа 2019 г. участником Live Science Рэйчел Росс.
Плазма, четвертое агрегатное состояние материала — напыление — полупроводниковые технологии от А до Я
Во многих процессах производства полупроводников используется плазма, например.грамм. при напылении, осаждении или в процессах сухого травления. Важным моментом здесь является то, что плазма не нагревается. Поэтому пластины, которые уже были металлизированы, можно обрабатывать в плазменных процессах.
Плазма также называется четвертым состоянием вещества или четвертым агрегатным состоянием. Агрегатное состояние — это качественное состояние материалов, которое зависит от температуры и давления. Три состояния — твердое, жидкое и газообразное — встречаются в повседневной жизни. Если температура низкая, каждый атом твердого тела зафиксирован в одной точке.Силы притяжения мешают им двигаться. При абсолютном нуле (-273,15 ° C) вещества не вступают в реакцию. С повышением температуры частицы начинают колебаться, и связи атомов становятся нестабильными. При достижении точки плавления вещество переходит из первого агрегатного состояния во второе: лед (твердый) превращается в воду (жидкость).
Гравитационные силы в жидкостях все еще присутствуют, но частицы могут двигаться и не имеют фиксированных мест, как в твердом состоянии, частицы приспосабливаются, например, к заданной форме.При дальнейшем повышении температуры связи полностью разрываются, частицы движутся независимо друг от друга. При температуре кипения вещество переходит из второго состояния в третье: вода (жидкость) превращается в водяной пар (газообразный).
В то время как объем твердых и жидких веществ постоянен, газообразные вещества полностью занимают существующее пространство, а частицы распределяются по всему помещению равномерно.
Каждое вещество имеет определенную температуру плавления и кипения. Кремний плавится при 1414 ° C и переходит в газообразное состояние примерно при 2900 ° C.Если ввести в вещество еще больше энергии, столкновения между частицами вышибут электроны из внешних электронных оболочек. Теперь есть свободные электроны и положительно заряженные ионы: состояние плазмы достигнуто.
СОСТОЯНИЯ АГРЕГАЦИИ И КРИСТАЛЛИЧЕСКИХ СТРУКТУР. Любой материал может находиться в любом из следующих состояний. Газовое состояние Газовое состояние Жидкое состояние Жидкое состояние Твердое состояние.
Презентация на тему: «СОСТОЯНИЯ АГРЕГАЦИИ И КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ. Любой материал может находиться в любом из следующих состояний. Газовое состояние Газовое состояние Жидкое состояние Жидкое состояние Твердое тело »- стенограмма презентации:
ins [data-ad-slot = «4502451947»] {display: none! important;}} @media (max-width: 1000 пикселей) {# place_14> ins: not ([data-ad-slot = «4502451947»]) {display: none! important;}} @media (max-width: 1000 пикселей) {# place_14 {width: 250px;}} @media (max-width: 500 пикселей) {# place_14 {width: 120px;}} ]]>1 СОСТОЯНИЯ АГРЕГАЦИИ И КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ
2 Любой материал может находиться в любом из следующих состояний.Газовое состояние Газовое состояние Жидкое состояние Жидкое состояние Твердое состояние Твердое состояние Состояние материала регулируется: Состояние материала определяется: Типом связи Типом связи Энергия связи Энергия связи Стабильность связи Стабильность связи Размеры атомы Размеры атомов Температура Температура Давление Давление
3 СОСТОЯНИЕ ГАЗА Каждая отдельная молекула газа имеет порядок. Однако в общей структуре нет порядка. Межмолекулярная связь в газах создается за счет связи Ван-дер-Ваальса, которая является слабой связью. Атомы находятся в непрерывном движении с высокой скоростью, что не позволяет им иметь фиксированную форму. Случайное движение атомов заставит газ заполнить любой контейнер, в который он вводится.
4 ЖИДКОЕ СОСТОЯНИЕ Жидкости имеют более упорядоченную структуру, чем газы. Однако этот порядок короткодействующий. Связь ч / б частиц слабая и ограниченная.Таким образом, жидкости могут легко принимать форму емкости. Тепловое расширение жидкостей меньше, чем у газов.
5 1. Жидкости, полученные из кристаллических твердых тел: они состоят из небольшой группы атомов, все еще расположенных в кристаллической структуре. Однако связи недостаточно прочны, чтобы образовать твердую массу. 2. Жидкости, полученные из аморфных твердых тел: они состоят из больших молекул, которые являются гибкими и подвижными.Основное различие между двумя типами жидкостей — их температура плавления. Первый имеет определенную температуру плавления, потому что все связи в X-таллиновой структуре имеют одинаковую прочность и разрушаются при одной и той же температуре.
6 ТВЕРДОЕ СОСТОЯНИЕ Твердые материалы классифицируются в соответствии с регулярностью расположения атомов или ионов относительно друг друга. Кристаллические твердые тела Аморфные твердые тела В кристаллических материалах атомы расположены в повторяющемся или периодическом массиве на больших атомных расстояниях.(дальний порядок) В аморфных материалах дальний порядок не существует
7 После затвердевания жидкости атомы будут располагаться в повторяющейся трехмерной структуре, в которой каждый атом связан со своими ближайшими атомами. Следовательно, скорость затвердевания имеет большое влияние на тип твердого тела. Затвердевание происходит постепенно → кристаллическое затвердевание происходит внезапно → аморфное
8 Тип связи также влияет на тип твердых ионных и металлических связей → Кристаллические ионные и металлические связи → Кристаллические ковалентные связи → Аморфные ковалентные связи → Аморфный При переходе от жидкого состояния к твердому состоянию нет определенной разделительной линии.(Между ними находятся гели) Гели образованы очень мелкими частицами твердых частиц, которые удерживают молекулы жидкости внутри себя. В зависимости от типа, прочности и количества связей гели могут быть более жидкими или более твердыми.
9 КРИСТАЛЛИЧЕСКИЕ ТВЕРДЫЕ В кристаллическом твердом теле частицы, которые могут быть (атомы, молекулы или ионы), окружены подобными соседями в соответствии с определенной геометрической повторяющейся структурой. При описании кристаллических структур атомы или ионы рассматриваются как твердые сферы с четко определенным диаметром.
10 Примером модели твердых сфер является расположение атомов некоторых распространенных элементарных металлов, показанное на рисунке. В этом примере: все атомы идентичны. Все атомы идентичны. Иногда термин «решетка» используется в контексте кристаллических структур. Иногда термин «решетка» используется в контексте кристаллических структур. Пространство-Решетка: трехмерные массивы точек в пространстве, совпадающих с положениями атомов.Пространство-Решетка: трехмерные массивы точек в пространстве, совпадающих с положениями атомов.
11 Элементарная ячейка: это наименьшая единица пространственной решетки, которая повторяется, образуя решетку. Другими словами, пространственная решетка образована упаковкой элементарных ячеек лицом к лицу.
12 Конфигурации элементарных ячеек 1. Простая элементарная ячейка: точки решетки находятся в каждом углу ячейки.2. Базовая центрированная элементарная ячейка: дополнительные точки решетки в центре двух параллельных граней. 3. Единичная ячейка, центрированная по телу: дополнительная решетка в интерьере. 4. Элементарная ячейка с центрированной гранью: дополнительные точки решетки в центре каждой грани.
13 КРИСТАЛЛИЧЕСКИЕ СИСТЕМЫ На основе конфигураций элементарных ячеек и расположения атомов
14 Гранецентрированная кубическая структура (ГЦК) Два представления элементарной ячейки
15 Фактор атомной упаковки Фактор атомной упаковки показывает нам, насколько плотна элементарная ячейка: APF = 1……… Элементарная ячейка заполнена атомами APF = 0 ……… Элементарная ячейка пуста
16 Атомный коэффициент упаковки FCC A D a a B G H E C r r 2r F Помните !!! Атомы представляют собой твердые сферы, и они касаются друг друга по диагонали куба для структуры FCC. Число атомов в элементарной ячейке: Атомы на гранях — 6 x 1/2 = 3 Угловые атомы — 8×1 / 8 = 1 Общее количество атомов в элементарной ячейке = 4 Объем элементарной ячейки, V c
17 Атомный коэффициент упаковки FCC A D a a B G H E C r r 2r F
18
19 Телоцентрированная кубическая (ОЦК) структура B D E H G C A F a r 2r ra2 Сколько атомов в структуре ОЦК? НПФ БЦК?
20 ВЫЧИСЛЕНИЕ ПЛОТНОСТИ Поскольку весь кристалл может быть создан путем повторения элементарной ячейки, плотность кристаллического материала может быть рассчитана на основе плотности элементарной ячейки.: Плотность элементарной ячейки n: Число атомов в элементарной ячейке M: Масса атома V c: Объем ячейки Масса атома указана в периодической таблице в единицах атомной массы (а.е.м.) или г / моль. . Чтобы преобразовать (аму) в (гр), используйте число авагадро.
21 год ВЫЧИСЛЕНИЕ ПЛОТНОСТИ Число Авагадро, N A = 6,023×10 23 атома / моль Следовательно, : плотность элементарной ячейки n: число атомов в элементарной ячейке A: атомная масса V c: объем ячейки N A: число Авагадро
22 ПОЛИКРИСТАЛЛИЧЕСКИЕ МАТЕРИАЛЫ Большинство кристаллических твердых веществ состоит из множества мелких кристаллов или зерен, называемых поликристаллическими.Большинство кристаллических твердых веществ состоит из множества мелких кристаллов или зерен, называемых поликристаллическими. Во время затвердевания поликристаллического твердого вещества кристаллизация может начинаться с различных зародышей со случайной кристаллографической ориентацией. Во время затвердевания поликристаллического твердого вещества кристаллизация может начинаться с различных зародышей со случайной кристаллографической ориентацией. При застывании могут образовываться зерна неправильной формы. При застывании могут образоваться зерна неправильной формы.Структура будет иметь границы зерен, которые можно будет увидеть под микроскопом. Структура будет иметь границы зерен, которые можно будет увидеть под микроскопом.
23 Этап 1 Этап 2 Этап 3 Этап 4
24 ПОЛИМОРФНОЕ ПРЕОБРАЗОВАНИЕ Материалы с одинаковым химическим составом могут иметь более одной кристаллической структуры.Их называют аллотропными или полиморфными материалами. Материалы, имеющие одинаковый химический состав, могут иметь более одной кристаллической структуры. Их называют аллотропными или полиморфными материалами. Аллотропия чистых элементов. Аллотропия чистых элементов. Полиморфизм соединений. Полиморфизм соединений. Эти преобразования приводят к изменению свойств материалов и составляют основу термической обработки сталей и сплавов. Эти преобразования приводят к изменению свойств материалов и составляют основу термической обработки сталей и сплавов.
25 Углерод может существовать в двух формах: Углерод может существовать в двух формах: ПОЛИМОРФИЗМ Графит (2D-слои) Алмаз (3D-структура)
26 ПОЛИМОРФИЗМ Железо (Fe) может также существовать в нескольких формах: ОЦК при комнатной температуре → α-железо ГЦК при 910 ° C → γ-железо ОЦК при температуре выше 1400 ° C → β-железо Выше 1539 ° C → жидкость При нагревании железа от комнатной температуры до температуры выше 910 ° C его кристаллическая структура изменяется от BCC до FCC, что сопровождается сжатием (уменьшением объема).
Физическое состояние — zxc.wiki
Состояния агрегации — это различные состояния вещества, которые могут быть преобразованы друг в друга посредством простых изменений температуры или давления. Есть три классических состояния агрегации , твердого, , жидкого, и газообразного, , а также других неклассических состояний в физике, таких как B. плазма.
Фаза, используемая в термодинамике, имеет более узкое определение, в частности, она подразделяет твердое состояние в соответствии с его внутренней структурой.
Какое агрегатное состояние или какая фаза является стабильной в зависимости от давления и температуры, показано на фазовой диаграмме.
Три классических агрегатных состояния
Частота агрегатных состояний элементов в зависимости от температуры (синий: твердое тело, красный: жидкость, зеленый: газообразное состояние)Существует три классических агрегатных состояния:
- твердый ( f или s ): В этом состоянии вещество обычно сохраняет как форму, так и объем; см. твердых тел .
- жидкость ( fl альтернативно l ): здесь сохраняется объем, но форма нестабильна и адаптируется к окружающему пространству; см. жидкость .
- газообразный ( г ): Здесь тоже нет стабильности объема, газ полностью заполняет доступное пространство; см. газ .
Для твердых и жидких веществ существует собирательный термин «конденсированное вещество».
В случае твердых тел различие проводится также по другим характеристикам:
Частичная модель состояний
Классические агрегатные состояния можно объяснить с помощью модели частиц, которая сводит мельчайшие частицы вещества (атомы, молекулы, ионы) к маленьким сферам.
Средняя кинетическая энергия всех частиц является мерой температуры во всех состояниях. Тип движения в трех агрегатных состояниях совершенно разный. В газе частицы движутся по прямой, как бильярдные шары, пока не столкнутся с другим или со стенкой сосуда. В жидкости частицы должны протискиваться через промежутки между своими соседями (диффузия, броуновское движение молекул). В твердом теле частицы колеблются только вокруг своего положения покоя.
Крепко
Модель кристаллического твердого телаMove
Мельчайшие частицы твердого тела движутся незначительно. Они вращаются вокруг фиксированного положения, своего положения на сетке, и в основном вращаются вокруг своих осей. Чем выше температура, тем сильнее они вибрируют или вращаются, и расстояние между частицами (обычно) увеличивается. Исключение: аномалия плотности.
- Форма твердого тела не изменилась.
- Вещества в твердом агрегатном состоянии трудно разделить.
- Они трудно деформируются (плохая деформируемость, хрупкость).
Примечание. Если посмотреть на частицы с помощью принципов квантовой механики, то в силу принципа неопределенности Гейзенберга частицы никогда не должны стоять на месте. У них есть небольшие колебания, которые также известны как колебания нулевой точки. Это соответствует основному состоянию гармонического осциллятора.
аттракцион
Между мельчайшими частицами действуют различные силы, а именно силы Ван-дер-Ваальса, электростатическая сила между ионами, водородными связями или ковалентными связями.Тип силы определяется атомной структурой частиц (ионы, молекулы, диполи …). Притяжение особенно сильно к материалам, твердым даже при высоких температурах.
расположение
Из-за слабого движения и прочного сцепления частицы располагаются равномерно.
- Таким образом, большинство твердых веществ имеют правильную структуру (кристалл), лишь некоторые из них являются аморфными.
- Расположение частиц в аморфном твердом теле неупорядочено так же, как и в жидкости, но оно стабильно по размерам, поскольку движения частиц друг относительно друга в значительной степени заморожены.
расстояние
Из-за сильного притяжения частицы расположены близко друг к другу (высокая плотность упаковки)
Жидкость
Модель частиц жидкости или аморфного твердого телаMove
Частицы не неподвижны, как в случае с твердыми телами, но могут перемещаться друг с другом. Когда температура повышается, частицы движутся все быстрее и быстрее.
аттракцион
Из-за нагрева движение частиц настолько велико, что сил взаимодействия уже недостаточно, чтобы удерживать частицы на своем месте.Теперь частицы могут двигаться свободно.
- Жидкое вещество распространяется само по себе, если оно не находится в контейнере.
- Краситель распределяется в жидкости (диффузия).
расстояние
Хотя более быстрое движение увеличивает расстояние между частицами (большинство твердых тел при плавлении занимают большее пространство), частицы остаются прикрепленными друг к другу. То же самое относится к уменьшению объема жидкости за счет сжатия, как и в случае твердого тела, в результате чего задействуется соответствующий модуль сжатия жидкости.При понижении температуры объем также становится меньше, но в случае воды только до температуры 4 ° C (аномалия воды), а ниже объем снова увеличивается до 0 ° C.
расположение
Хотя частицы постоянно перестраиваются и дрожат / вращаются, их расположение можно определить. Этот ближний порядок аналогичен таковому в аморфном твердом теле, но его вязкость намного ниже, т.е. частицы H более подвижны.
Газообразный
Move
В случае веществ в газообразном состоянии частицы перемещаются быстро.Газ или газообразное вещество быстро распространяется по комнате. В замкнутом пространстве удары мельчайших частиц о стенки приводят к давлению газа.
аттракцион
В газообразном состоянии кинетическая энергия мельчайших частиц настолько высока, что они не слипаются. Мельчайшие частицы газообразного вещества равномерно распределяются по всему доступному пространству.
расстояние
Быстрое движение частиц в газе означает, что они далеко друг от друга.Они только время от времени сталкиваются друг с другом, но остаются на большом расстоянии по сравнению с жидкой фазой. Газообразное вещество можно сжимать, т.е. Х. громкость можно уменьшить.
расположение
Из-за движения частицы неупорядочены.
В физической химии проводится различие между паром и газом. С физической точки зрения оба являются не чем иным, как газообразным агрегатным состоянием; термины также не имеют прямого отношения к реальному газу и идеальному газу.То, что в просторечии именуется как «пар», с физической точки зрения представляет собой смесь жидких и газообразных компонентов, которая в случае воды называется влажным паром.
Пар в более узком смысле слова — это состояние равновесия между жидкой и газовой фазами. Его можно сжижать без необходимости выполнять какую-либо работу, то есть при его сжижении давление не увеличивается. В технике этот тип пара называется влажным паром, в отличие от так называемого перегретого пара или перегретого пара, который на самом деле представляет собой настоящий газ, состоящий из молекул воды, и температура которого выше температуры конденсации жидкой фазы при соответствующем давлении. .
Избранные основные вещества в качестве примеров
Чистые вещества называются твердыми, жидкими или газообразными в зависимости от их физического состояния при температуре 20 ° C (см. Комнатная температура) и давлении 1013,25 гПа (нормальное давление). Пример: бром находится в жидком состоянии при комнатной температуре и нормальном давлении (см. Таблицу), поэтому бром считается жидкостью.
Эти обозначения (твердое тело, жидкость, газ) также используются, когда вещества принимают другое физическое состояние при изменившихся условиях.Однако в более узком смысле классификация относится к стандартным условиям, упомянутым выше; тогда каждое вещество относится к одной из категорий.
| материал | Температура плавления 1 | Точка кипения 1 | Физическое состояние в морозильной камере (−10 ° C) 1 | Физическое состояние при комнатной температуре (25 ° C) 1 | Физическое состояние в духовке (150 ° C) 1 |
|---|---|---|---|---|---|
| утюг | 1535 ° С | 2750 ° С | твердо | твердо | твердо |
| медь | 1084 ° С | 2567 ° С | твердо | твердо | твердо |
| Цезий | 28 ° С | 671 ° С | твердо | твердо | жидкость |
| кислород | −219 ° С | −183 ° С | газообразный | газообразный | газообразный |
| гелий | −272 ° С | −269 ° С | газообразный | газообразный | газообразный |
| бром | −7 ° С | 59 ° С | твердо | жидкость | газообразный |
| хлор | −101 ° С | −35 ° С | газообразный | газообразный | газообразный |
| вода | 0 ° С | 100 ° С | твердо | жидкость | газообразный |
1 при нормальном давлении
Физические состояния в смесях
При смешивании веществ образуются характерные смеси, например туман или пена, в зависимости от физического состояния компонентов и их количественного соотношения.
Изменение физического состояния
Переходы между различными агрегатными состояниями имеют специальные названия (eoc, omc, eon) и особые условия перехода, которые в случае чистых веществ состоят из давления и температуры. Эти условия перехода соответствуют точкам на линиях фазовых границ фазовых диаграмм. Определенное количество тепла требуется для каждого фазового перехода или выделяется в процессе.
Сублимация и испарение также происходят ниже точки сублимации или кипения.Здесь говорят об испарении.
Примеры на каждый день
Сроки изменения агрегатного состояния водыВсе переходы можно наблюдать на примере воды в повседневной жизни (см. Рисунок):
Расплав
Снег или лед начинают становиться жидкими весной, как только температура поднимается выше температуры таяния.
Заморозить
Если вода в озерах охлаждается ниже точки замерзания, образуются кристаллы льда, которые со временем становятся все больше и больше, пока поверхность не покроется слоем льда.
Испарение
Если вода в кастрюле нагревается выше точки кипения, вода становится газообразной. «Пузырьки» в кастрюле возникают из-за того, что вода на горячем дне кастрюли сначала достигает температуры кипения — поднимающиеся пузырьки — это водяной пар, который (как и большинство газообразных веществ) невидим. Испарение , переход из жидкой в газообразную форму без достижения точки кипения, можно легко наблюдать при потоотделении на коже.
Конденсированный
Четко видимый туман над кипящей водой, который обычно в просторечии называют «паром», представляет собой водяной пар, сконденсированный в крошечные капли воды. Роса и облака также создаются за счет конденсации водяного пара.
сублимация
Замерзшие лужи могут постепенно «высыхать» в результате сублимации зимой даже при температурах значительно ниже точки замерзания, пока лед полностью не сублимируется и лужа не исчезнет.
Повторная сублимация
Изморозь или ледяные цветы, образующиеся зимой, вызваны водяным паром, который повторно сублимируется из окружающего воздуха.
Частичная модель фазовых переходов
Расплав
При повышении температуры (добавлении тепловой энергии) мельчайшие частицы перемещаются все более и более сильно, и их расстояние друг от друга (обычно) увеличивается. Силы Ван-дер-Ваальса по-прежнему удерживают их на своих местах, в своих решетках. Только из-за так называемой температуры плавления амплитуда колебаний частиц становится настолько большой, что структура решетки частично разрушается. Создаются группы частиц, которые могут свободно перемещаться.В них существует ближний порядок, в отличие от дальнего порядка частиц внутри кристаллической решетки твердых веществ.
Заморозить
При понижении температуры движение частиц уменьшается, и их расстояние друг от друга становится все меньше и меньше. Энергия вращения также уменьшается. При так называемой температуре затвердевания расстояние становится настолько малым, что частицы блокируют друг друга и взаимодействуют друг с другом более привлекательным образом — они занимают фиксированное положение в трехмерной решетке.
Есть жидкости, которые расширяются при понижении температуры, например вода. Такое поведение известно как аномалия плотности.
Испарение и сублимация
Скорость мельчайших частиц не одинакова. Часть быстрее, часть медленнее, чем в среднем. Частицы постоянно меняют свою текущую скорость из-за столкновений.
На границе твердого тела или жидкости, при переходе фазы в газообразную, может случиться так, что частица получит такой сильный импульс от своих соседей, что она вырвется из зоны влияния когезионной сила .Затем эта частица переходит в газообразное состояние и забирает с собой некоторую тепловую энергию в виде кинетической энергии, то есть твердая или жидкая фаза немного остывает.
Если в систему подводится тепловая энергия и температура достигает температуры сублимации или кипения, этот процесс происходит непрерывно, пока все мельчайшие частицы не перейдут в газовую фазу. В этом случае температура в испаряющейся фазе обычно остается неизменной до тех пор, пока все частицы с более высокой температурой не исчезнут из системы.Таким образом, подача тепла преобразуется в увеличение энтропии.
Если силы сцепления очень велики, или если это на самом деле гораздо более прочная металлическая или ионная связь, то испарения нет.
Сильное увеличение объема вещества из-за испарения может привести к физическому взрыву, если внезапно приложить много тепла.
Конденсация и повторная сублимация
Обратный процесс — это конденсация или повторная сублимация. Крошечная частица сталкивается с твердым или жидким веществом, передает свой импульс и удерживается на месте силами сцепления.В результате тело нагревается энергией, которую мельчайшая частица несет больше, чем среднее значение мельчайших частиц в твердой или жидкой фазе.
Однако, если частица исходит из газообразного вещества при этой температуре, силы сцепления слишком слабы, чтобы удерживать ее на месте. Даже если он потерял так много энергии, что был связан, следующее столкновение с соседними крошечными частицами отбросит его обратно в газовую фазу. Понижая температуру, можно отбирать энергию у мельчайших частиц.В результате, когда температура опускается ниже температуры сублимации или затвердевания, силы взаимодействия с другими частицами заставляют их слипаться вместе и снова образовывать твердое тело или жидкость.
Фазовые диаграммы
Фазовая диаграмма pT вещества описывает, в зависимости от давления и температуры, в скольких фазах присутствует вещество и в каком агрегатном состоянии они находятся. Линии показывают давление и температуру, при которых вещества меняют свое физическое состояние.В определенной степени переход между агрегатными состояниями происходит по линиям, поэтому их также называют линиями границы раздела фаз. Соответствующие агрегатные состояния присутствуют на них в виде динамического равновесия рядом друг с другом в разных фазах.
- При определенном давлении и температуре, так называемой тройной точке, все три физических состояния могут существовать одновременно. Это точка в «середине» фазовой диаграммы, в которой встречаются все три линии границы раздела фаз.Таким образом, тройная точка подходит в качестве отправной точки для этих линий и для определения многих температурных шкал.
- Выше определенного давления и определенной температуры, так называемая критическая точка, газ и жидкость больше не могут быть различимы из-за их одинаковой плотности. Следовательно, в этом пространстве состояний нельзя установить границу раздела фаз.
- Для давлений ниже давления тройной точки вещество может стать твердым только при понижении температуры или только газообразным при повышении температуры.Разделительная линия между двумя областями называется кривой сублимации . На нем могут сосуществовать твердая и газовая фазы. Теоретически кривая сублимации начинается с абсолютного нуля и заканчивается в тройной точке.
- Для давлений выше давления тройной точки вещество является твердым при температурах ниже точки плавления, жидкостью между точкой плавления и точкой кипения и газообразным веществом выше точки кипения. Разделительная линия между твердой и жидкой фазами, то есть кривая точек плавления, называется кривой плавления , разделительная линия между жидкостью и газом называется кривой точки кипения .Обе кривые также начинаются в тройной точке, причем кривая плавления теоретически продолжается до бесконечности, а кривая точки кипения заканчивается в критической точке.
- Степени свободы на фазовой диаграмме зависят от рассматриваемой плоскости. В тройной точке и в критической точке нет степени свободы, поскольку и давление, и температура имеют фиксированные значения, которые зависят только от вещества. Либо давление, либо температура могут быть свободно выбраны на линиях границы раздела фаз и являются взаимозависимыми, следовательно, существует определенная степень свободы.В пространстве чистых состояний, т.е. в областях фазовой диаграммы, можно свободно выбирать давление и температуру, что соответствует двум степеням свободы.
Неклассические физические состояния
В дополнение к трем классическим агрегатным состояниям существуют и другие состояния вещества, некоторые из которых возникают только в экстремальных условиях (отсортированных по температуре, от более высоких к более низким).
- Состояние плазмы: встречается, например, в электрических дугах, в звездах и в термоядерных реакторах.При очень высоких температурах атомы распадаются на ядро и оболочку; создаются свободные электроны.
- Атомарный газ: в нем больше нет молекул, поскольку постоянные столкновения разрушают связи, но электроны все еще прочно связаны.
- Сверхкритическое состояние возникает при превышении критической точки и представляет собой смешанное состояние между жидкостью и газом.
- Мезоморфное состояние: оно занимает промежуточное положение между агрегатными состояниями, жидким и твердым, и встречается в различных формах, например, в жидких кристаллах или пластичных кристаллах.
- Конденсат Бозе-Эйнштейна: это набор чрезвычайно холодных атомов, которые имеют одинаковое квантово-механическое состояние, что делает их неразличимыми и, следовательно, ведет себя совершенно согласованно.
- Фермионный конденсат: сверххолодное состояние фермионов, которые отличаются от бозонов (целочисленный спин) своим полуцелым спином.
- Сверхтекучая жидкость: жидкость без внутреннего трения.
- Супрасолид: состояние, которое достигается с помощью сверххолодного гелия-4.Материя одновременно проявляет свойства твердых и сверхтекучих тел.
литература
- Питер Курцвейл, Пауль Шайперс: Химия: основы, дополнительные знания, приложения и эксперименты . Springer, 2010, ISBN 978-3-8348-0341-2 (ограниченный предварительный просмотр в поиске книг Google).
- Гвидо Кикельбик: Химия для инженеров . Pearson Germany, 2008, ISBN 978-3-8273-7267-3 (ограниченный предварительный просмотр в поиске книг Google).
- Б.Энгельс, К. Шмук, Т. Ширмейстер, Р. Финк: Химия для медицинских работников . Pearson Germany, 2008, ISBN 978-3-8273-7286-4 (ограниченный предварительный просмотр в поиске книг Google).
- Compact Silver Line: Физика: базовые знания формул и законов . Compact Verlag, 2010, ISBN 978-3-8174-7891-0 (ограниченный предварительный просмотр в поиске книг Google).
- Дитер Мешеде, Кристиан Гертсен: Физика Гертсена . Springer, 2003, ISBN 978-3-540-02622-8 (ограниченный предварительный просмотр в поиске книг Google — о плазме как «четвертом агрегатном состоянии»).
Интернет-ссылки
Свойства полимеров
Полимеры — это особые виды соединений, которые ведут себя не так, как маленькие молекулы. И они этого не делают из-за их огромных молекулярных размер. И именно такой размер дает три уникальные свойства, присущие только таким гигантским молекулам.
Какие свойства, спросите вы? Наверняка вы видели их раньше во многих материалах, которые вы используете каждый день. Эти свойства зависят от молекулярных различий, и приложения зависят от этих свойств.Точнее, сочетание свойств, которыми обладает каждый полимер, зависит от его состава и того, как он превращается (или обрабатывается) во что-то полезное.
Хорошо, но что это за молекулярные свойства? Если вы еще не посетили страницу, на которой они объясняются, мы можем резюмируйте их еще раз вместе с тем, как полимеры упаковываются в твердом состоянии:
Все эти свойства определяют различные состояния макромолекулярной агрегации, которые проявляют полимеры. И эти состояния вы ощущаете, когда обращаетесь или используете что-то из полимеров.
Например, вы можете представить полимер в газообразном состоянии? Ну не волнуйся. Нет газообразных полимеров. Такие большие молекулы обладают такими сильными межмолекулярными силами и сцеплением, удерживающими их вместе, что вам нужно будет нагреть их не менее чем до 500 ° C, чтобы добиться испарения. Но при таких высоких температурах у вас больше не будет полимеров, а будет большая масса разложившихся или карбонизированных остатков после того, как уйдут все продукты разложения.
Твердые полимеры обычно существуют в виде аморфных стекол.Однако при наличии определенного порядка в их цепной структуре некоторые полимеры могут кристаллизоваться, например волокна, поликетоны. или синдиотактический полистирол, чтобы назвать несколько.
Жидкое состояние в полимерах наблюдается редко. В большинстве случаев, когда температура полимерного компаунда постепенно повышается, он проявляет резиноподобные свойства или становится более жидким с вязкой или липкой консистенцией.
В то время как твердые полимеры демонстрируют высокое агрегатное состояние, растворы макромолекул, особенно разбавленные, отличаются по другим причинам.Обычно растворы полимеров очень вязкие, их трудно перемешивать и медленно наливать. Но если увеличить концентрации полимера, они становятся настолько вязкими, что в определенный момент межмолекулярные силы снова вступают в игру, и жидкий характер исчезает. Речь идет сейчас о «геле», а не о растворе. Вы видели гели на своих кухнях в виде желе, мармеладов и джемов и даже молочных продуктов, таких как сливочный сыр и мороженое. Интересно, а?
Хотите узнать больше? Затем давайте рассмотрим каждое агрегатное состояние отдельно.Перейдите на указанные ниже страницы, чтобы узнать о различных отличиях полимеров от других материалов в реальном мире.
. В.
В.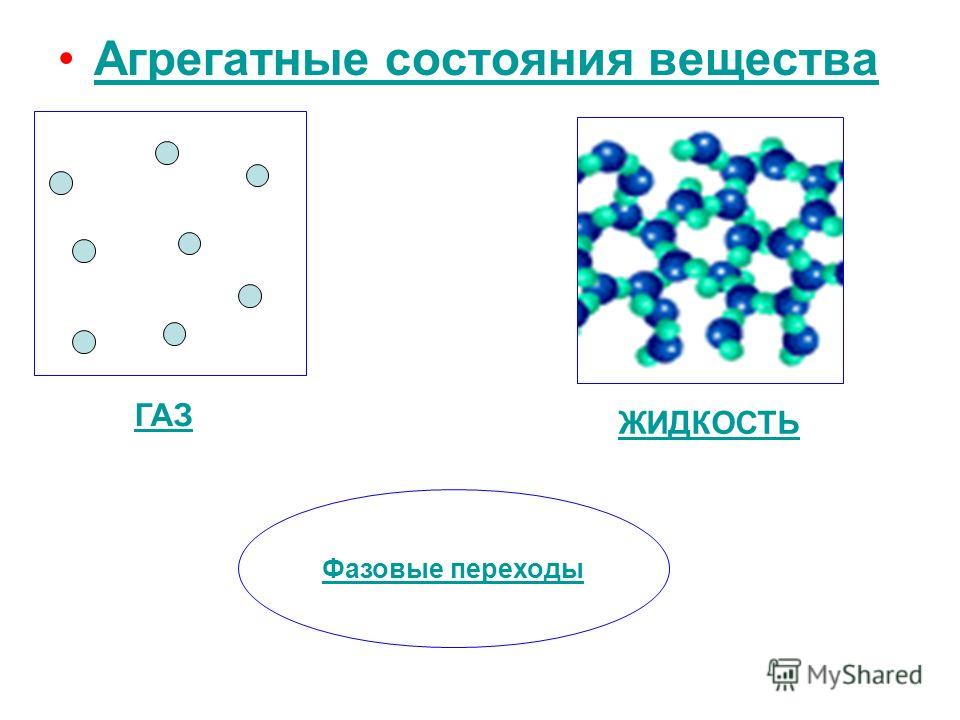

 Если есть дополнения ,дополняет группа.
Если есть дополнения ,дополняет группа. .
. Самое большое количество свободного газа азот встречается в воздухе, так как это одна из главных составляющих нашей атмосферы. Различные соединения азота можно встретить как в органических веществах, так и в неорганических. Даже растительный и животный мир не может обходиться без газа азота.
Самое большое количество свободного газа азот встречается в воздухе, так как это одна из главных составляющих нашей атмосферы. Различные соединения азота можно встретить как в органических веществах, так и в неорганических. Даже растительный и животный мир не может обходиться без газа азота.