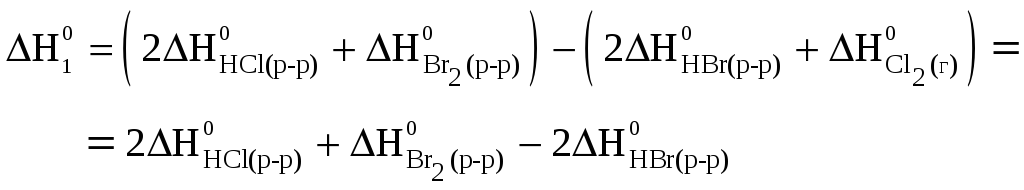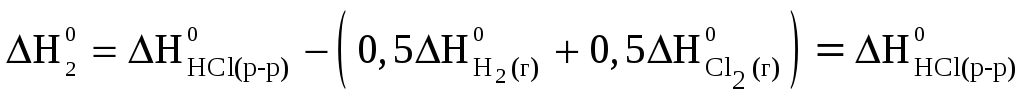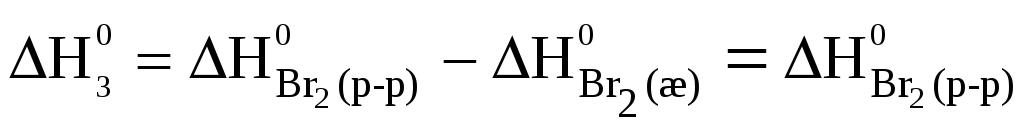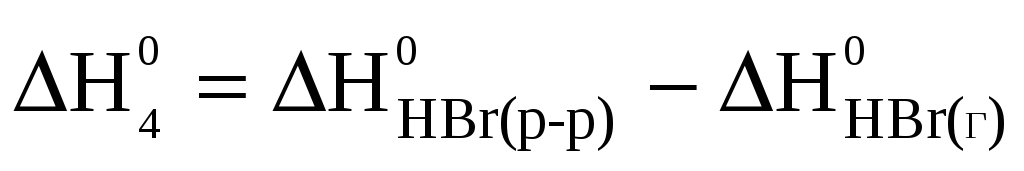Cr2(SO4)3, степень окисления хрома и др элементов
Общие сведения о сульфате хрома (III) и степени окисления в Cr2(SO4)3
Брутто-формула — Cr2(SO4)3. Молярная масса равна – 392,16 г/моль.
Рис. 1. Сульфат хрома (III). Внешний вид.
Растворяется в воде (гидролизуется по катиону). Образует кристаллогидраты составов Cr2(SO4)3×18H2O иCr2(SO4)3×6H2O. Проявляет слабые окислительно-восстановительные свойства.
Cr2(SO4)3, степени окисления элементов в нем
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Сульфат-ион – это кислотный остаток серной кислоты, формула которой H2SO4. В её составе имеется два атома водорода, следовательно, степень окисления сульфат-ионе равна (-2). Степень окисления кислорода в составе кислот, а, следовательно, и их остатков равна (-2). Для нахождения степени окисления серы в составе сульфат-иона примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4× (-2) = -2;
x — 8 = -2;
x = +6.
Степень окисления хрома найдем аналогичным образом:
2×у + 3× (+6) + 12× (-2) = 0;
2у + 18 – 24 = 0;
2у — 6 = 0;
2у = + 6;
y= +3.
Степень окисления хрома в сульфате хрома (III) равна (+3): Cr+32(SO4)3.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Химия_1_Ani
7
Задание 1.
Написать формулы гидроксидов, соответствующим оксидам K2O; Nd2O3; CrO; Cr2O3; CrO3; Fe2O3; N2O5. Какими свойствами (основными, кислотными, амфотерными) обладают оксиды и соответствующие им гидроксиды? Назвать и построить их графические формулы. Определить эквивалентную массу для соединений: Cr2
Оксид | Гидроксид | Свойства | Название | Графическая формула |
K2O | KOH | основные | гидроксид калия |
|
Nd2 O3 | Nd(OH)3 | основные | Гидроксид неодима |
|
CrO | Cr(OH)2 | основные | Гидроксид хрома (II) |
|
Cr2O3 | Cr(OH)3 | амфотерные | Гидроксид хрома (III) |
|
CrO3 | H2CrO4 | кислотные | Хромовая кислота |
|
Fe2O3 | Fe(OH)3 | амфотерные | Гидроксид железа (III) |
|
N2O5 | HNO3 | кислотные | Азотная кислота |
|
Расчёт эквивалентных масс:
ЭCr2O3= 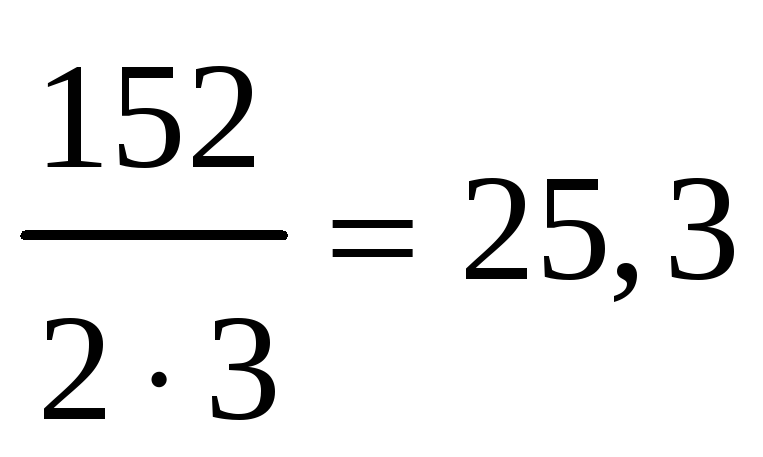 г/моль
г/моль
ЭCr(OH)3 = 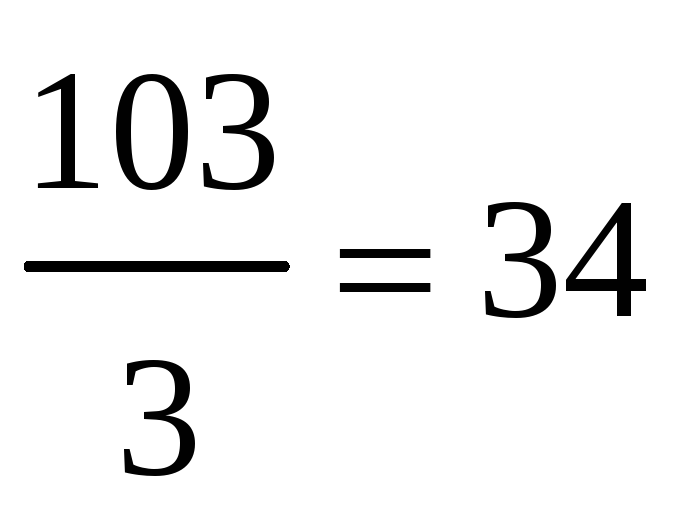 г/моль
г/моль
ЭCr2(SO4)3 = 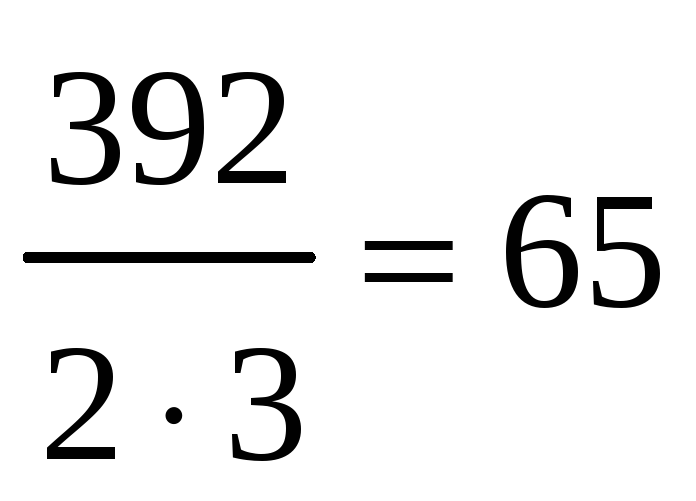 г/моль
г/моль
ЭH2CrO4 = 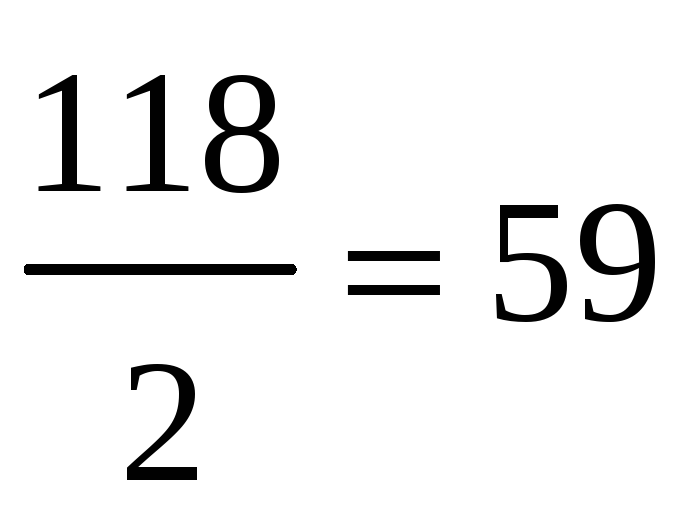 г/моль
г/моль
Задание 2.
Закончить уравнения:
P2O5 + 3Ca(OH)2 = Ca3(PO4)2 + 3H2O
Zn +2NaOH = Na2ZnO2 +H2
SnO + 2NaOH = Na2SnO2 +H2O
2Sn + O2 = 2SnO
CdO + 2HNO3 = Cd(NO3)2 + H2O
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
P + Ga = GaP
SiH4 + 2O2 = SiO2 + 2H2O
GaCl3 + PH3 = GaP + РCl3
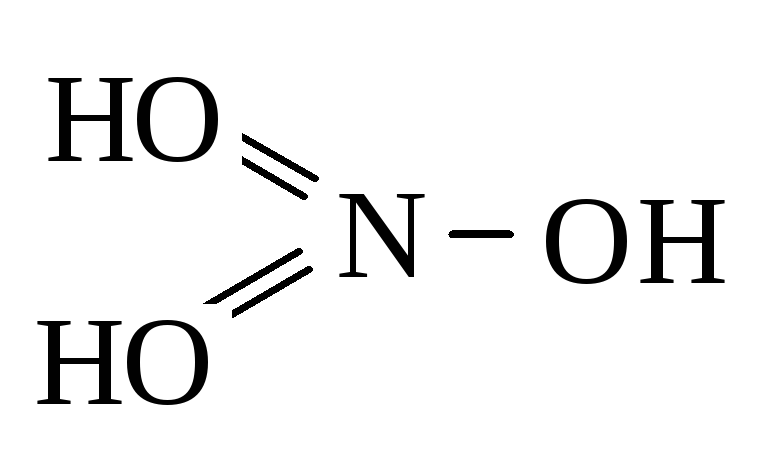
SiH4
 Si
+ 2H 2
Si
+ 2H 2
Задание 3.
Вычислите стандартную энтальпию образования газообразного HBr на основании следующих данных (298 K):
2HBr(р-р) + Cl2(г) = 2HCl(р-р) + Br2(р-р) ΔH01 = — 92,9 кДж;
½H2(г) + ½Cl2(г) = HCl(р-р) ΔH02 = — 166,8 кДж*;
Br2(ж) = Br2(р-р) ΔH03 = — 0,8 кДж;
HBr
*В «Пособии» величина ΔH02 почему-то приведена со знаком «+», хотя эта реакция экзотермическая.
Применив закон Гесса к каждому уравнению, и учитывая, что стандартные энтальпии образования простых веществ (H2, Cl2, Br2) равны нулю, получим:
Подставив соответствующие стандартные
энтальпии образования из уравнений
(2-1) ‑ (4-1) в уравнение (1-1) получим: 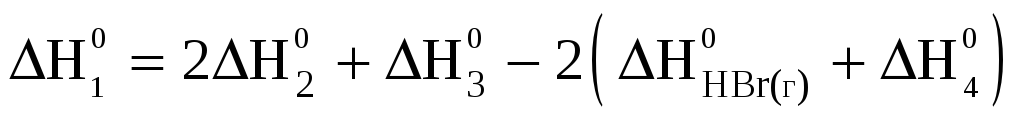 .
.
Отсюда можно получить искомую величину:
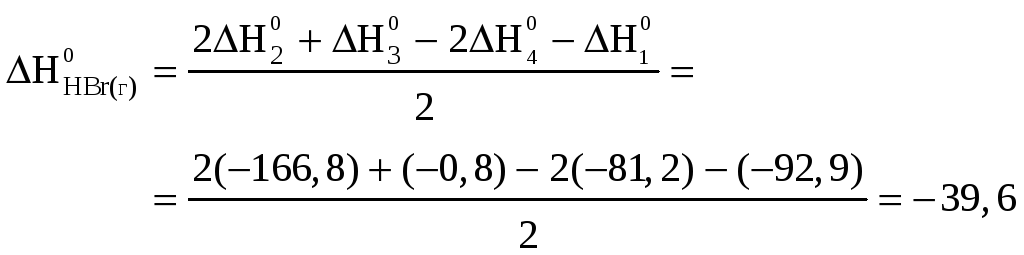 кДж
кДж
Задание 4.
Исходя из реакций:
KClO3 = KCl + 3/2O2 ΔH01 = — 49,4 кДж;
KClO4 = KCl + 2O2 ΔH02 = 33,0 кДж
вычислить
4KClO3 = 3KClO4 + KCl.
Применив закон Гесса к каждому уравнению, и учитывая, что стандартные энтальпии образования простых веществ (O2) равны нулю, получим:
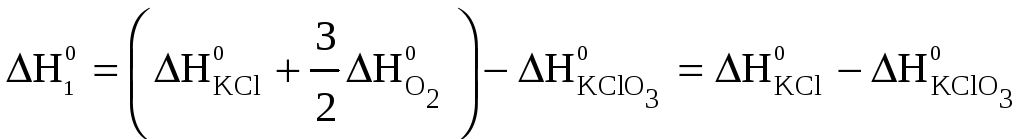
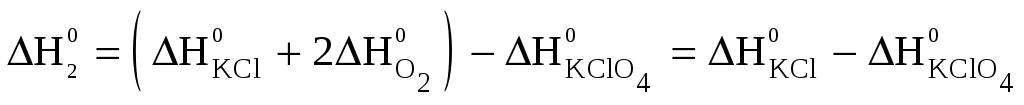
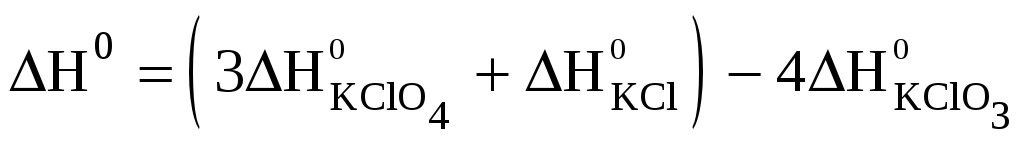
Решив эту систему уравнений относительно ΔH0 и подставив в полученное уравнение известные величины ΔH01 и ΔH02, получим искомую величину:
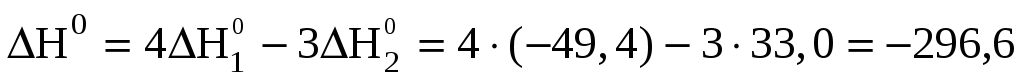 кДж
кДж
Задание 5.
Реакция CO + Cl2 = COCl2 протекает в замкнутом сосуде при постоянной температуре: исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остаётся 50% начального количества CO. Определите давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм рт. ст.).
Можно выразить количественный состав
газовой смеси в парциальных давлениях
компонентов смеси. В первоначальный
момент в сосуде парциальные давления
компонентов 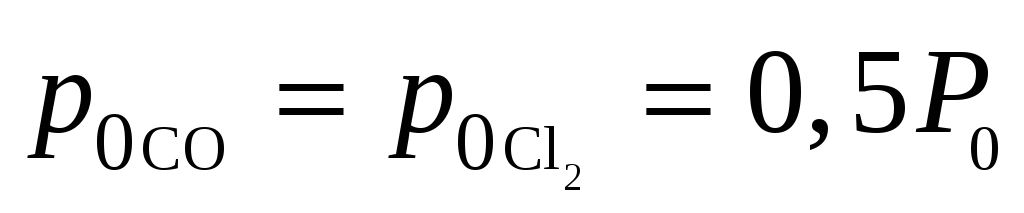 (P0 = 100 кПа –
первоначальное давление). К моменту
наступления равновесия в сосуде
парциальные давления CO
и Cl2 уменьшились в
два раза и стали
(P0 = 100 кПа –
первоначальное давление). К моменту
наступления равновесия в сосуде
парциальные давления CO
и Cl2 уменьшились в
два раза и стали 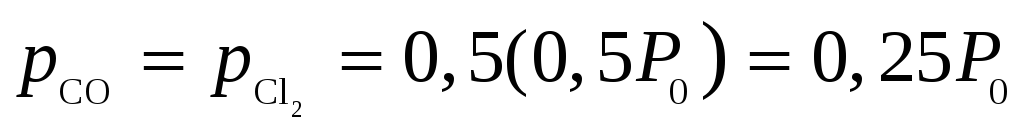 .
В результате реакции образовался COCl2 и его парциальное давление также
.
В результате реакции образовался COCl2 и его парциальное давление также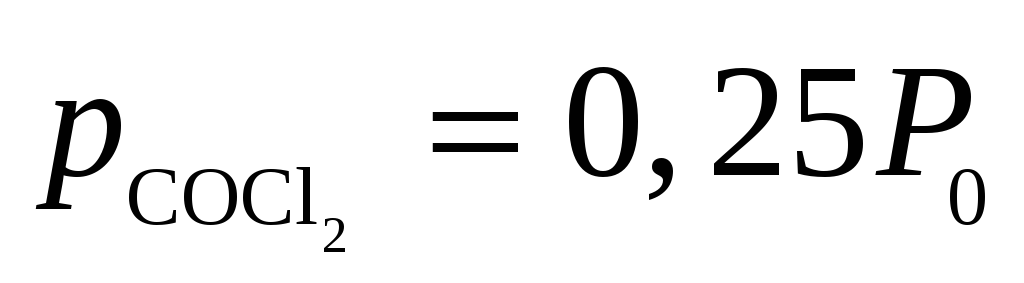 .
По закону Дальтона давление в сосуде в
момент наступления равновесия
.
По закону Дальтона давление в сосуде в
момент наступления равновесия 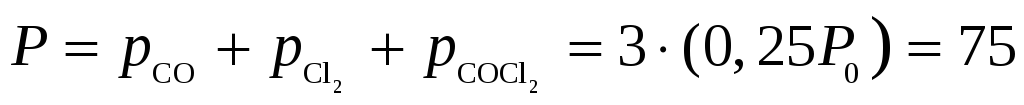 кПа
(562,5 мм рт. ст.)
кПа
(562,5 мм рт. ст.)
Задание 6.
Каталитическое окисление аммиака
выражается общим уравнением
4NH3 + 5O2  4NO + 6H2O.
Через некоторое время после начала
реакции концентрации стали:
[NH3] = 0,01 моль/л;
[O2] = 0,02 моль/л;
[NO] = 0,03 моль/л.
Вычислите исходные концентрации аммиака
и кислорода, и константы равновесия Кс и Кр, если реакция протекала
при 750°С.
4NO + 6H2O.
Через некоторое время после начала
реакции концентрации стали:
[NH3] = 0,01 моль/л;
[O2] = 0,02 моль/л;
[NO] = 0,03 моль/л.
Вычислите исходные концентрации аммиака
и кислорода, и константы равновесия Кс и Кр, если реакция протекала
при 750°С.
Исходные концентрации аммиака и кислорода
найдем на основе уравнения реакции,
согласно которому из четырех молекул
NH3 и пяти молекул
O2 образуется четыре
молекулы NO и шесть молекул
H2O.
Отсюда следует, что на образование 0,03
молей NO расходуется 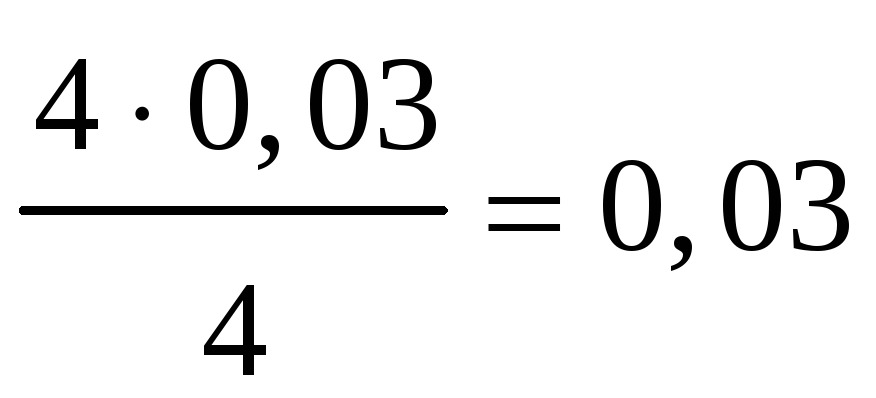 моля NH3 и
моля NH3 и 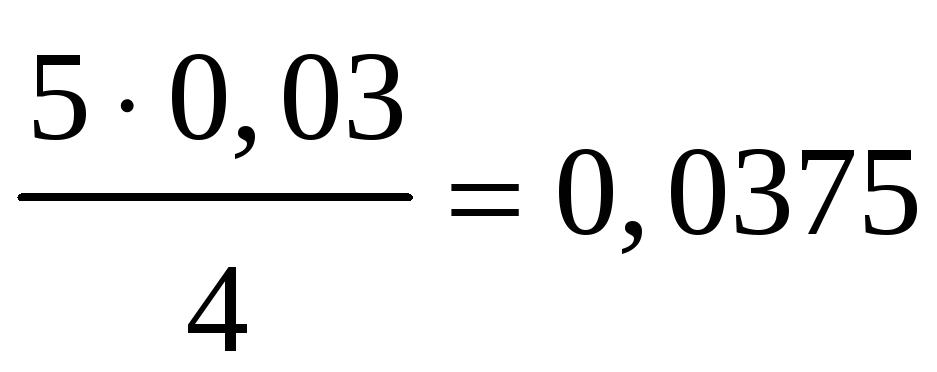 моля O2. Таким образом,
исходные концентрации аммиака и кислорода
равны:
моля O2. Таким образом,
исходные концентрации аммиака и кислорода
равны:
[NH3]исх = 0,01 + 0,03 = 0,04 моль/л;
[O2]исх = 0,02 + 0,0375 = 0,0575 моль/л.
Определим из уравнения реакции неизвестную
величину равновесной концентрации
воды: 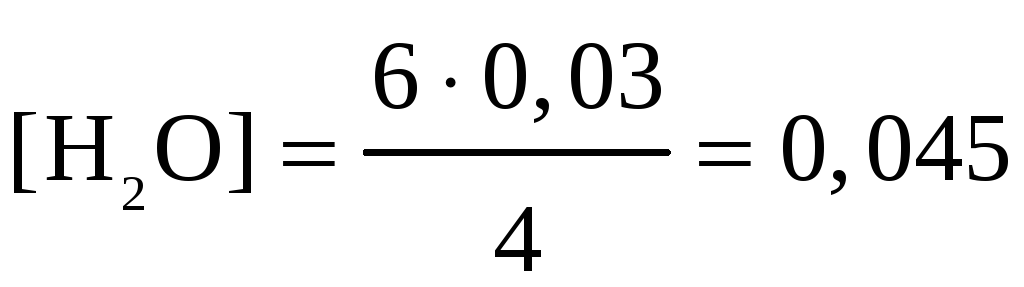 моль/л.
моль/л.
Константа равновесия, выраженная через равновесные концентрации
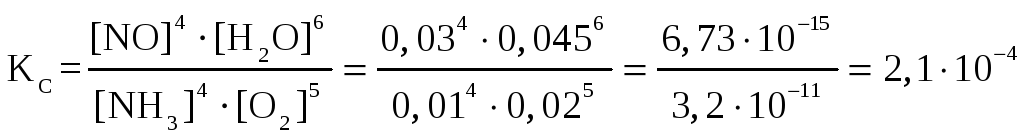
Константа равновесия, выраженная через равновесные парциальные давления
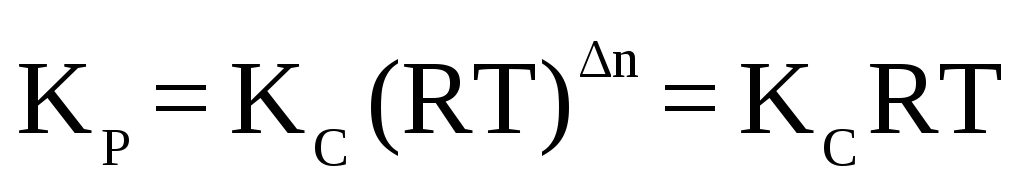 ,
,
где Δn = (4 + 6) – (4 + 5) = 1 – изменение числа молей в реакции;
R = 8,31 Дж/(К∙моль) – универсальная газовая постоянная;
T = 750 + 273,15 = 1023,14 K – температура (в кельвинах), при которой
протекает реакция.
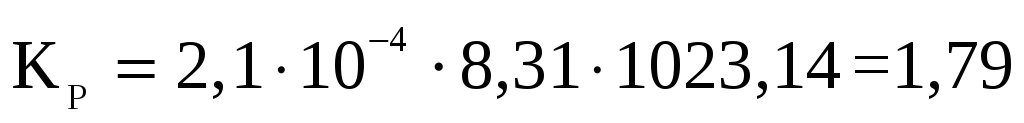
Задание 7.
По приведённым кривым охлаждения построить диаграмму состояния системы висмут-сурьма.
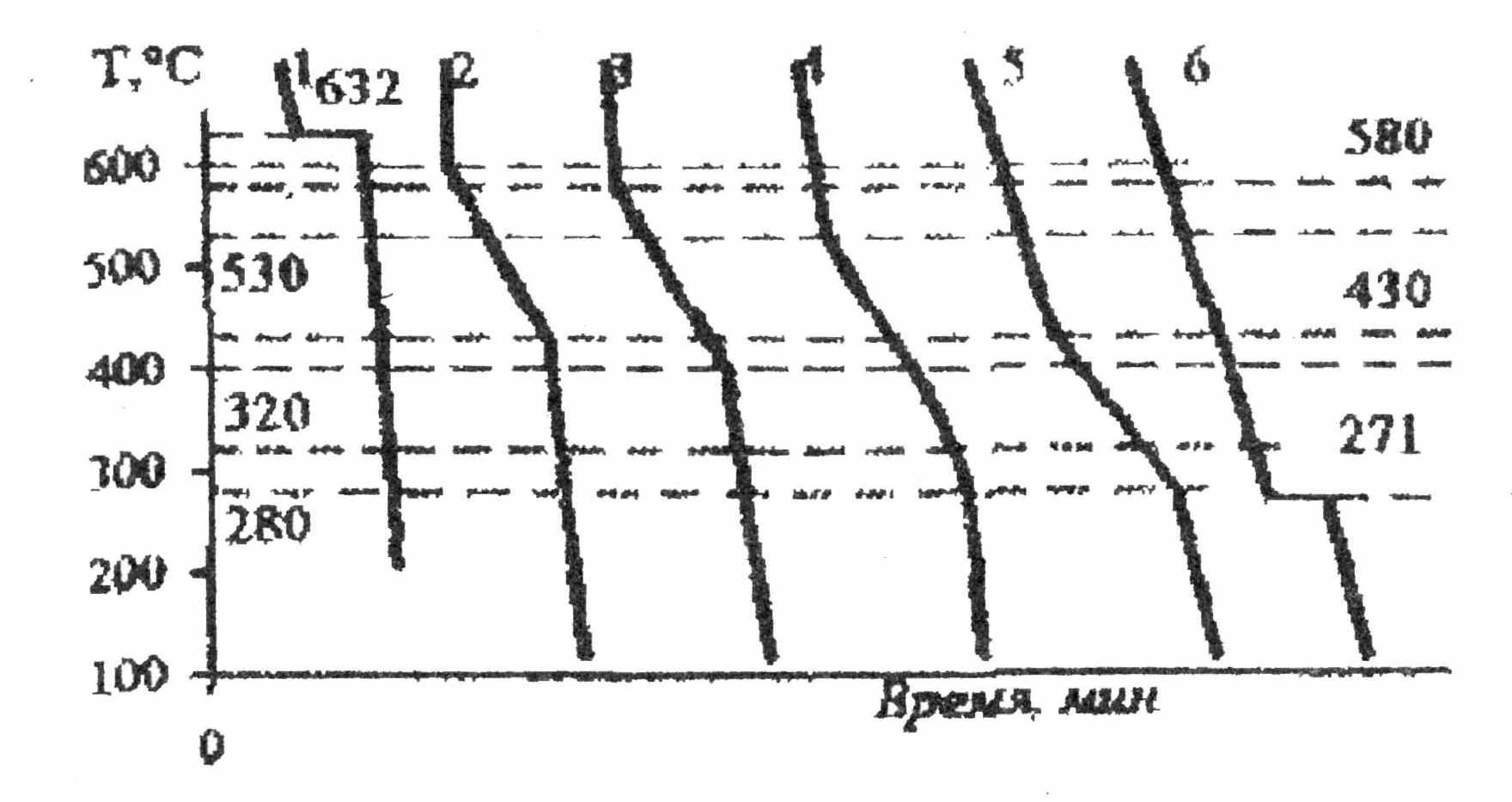
№ кривой
1
2
3
4
5
6
Sb, %
100
80
70
50
30
0
По диаграмме определить:
а) тип диаграммы и её особенности;
б) каков исходный состав сплава, если при 500°С половина его затвердела;
в) 70%-ный твёрдый раствор находится в равновесии с жидким. Каков состав жидкого раствора;
г) 50 г сплава, содержащего 60% сурьмы, нагреты до 450°С. Сколько сурьмы осталось в твёрдом растворе? Сколько висмута перешло в жидкий раствор?
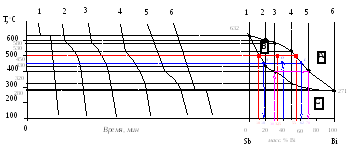
а) Вид построенной диаграммы
характерен для систем с неограниченной
растворимостью в твёрдом и жидком
состояниях. Особенностью диаграммы
является отсутствие эвтектики. Верхняя
кривая – линия ликвидуса – выражает
зависимость температуры начала
кристаллизации расплава от его состава.
Выше линии ликвидуса – поле  – при любой температуре и концентрации
система представляет собой ненасыщенный
расплав. Нижняя кривая – линия солидуса
– выражает зависимость температуры
конца кристаллизации расплава от состава
системы. Ниже линии солидуса (поле
– при любой температуре и концентрации
система представляет собой ненасыщенный
расплав. Нижняя кривая – линия солидуса
– выражает зависимость температуры
конца кристаллизации расплава от состава
системы. Ниже линии солидуса (поле  )
– твёрдый раствор обоих компонентов.
Кривые солидуса и ликвидуса сходятся
в точках, соответствующих температурам
кристаллизации чистых компонентов. В
пределах поля
)
– твёрдый раствор обоих компонентов.
Кривые солидуса и ликвидуса сходятся
в точках, соответствующих температурам
кристаллизации чистых компонентов. В
пределах поля  в системе сосуществуют твёрдый и жидкий
растворы.
в системе сосуществуют твёрдый и жидкий
растворы.
б) Найдём исходный состав сплава,
воспользовавшись «правилом рычага».
Так как при 500°С соотношение жидкой и
твердой фаз  %,
то точка, соответствующая исходному
составу лежит на середине отрезка,
отсекаемого линиями солидуса (10% Bi)
и ликвидуса (55% Bi) от
изотермы.
%,
то точка, соответствующая исходному
составу лежит на середине отрезка,
отсекаемого линиями солидуса (10% Bi)
и ликвидуса (55% Bi) от
изотермы.
Получаем: 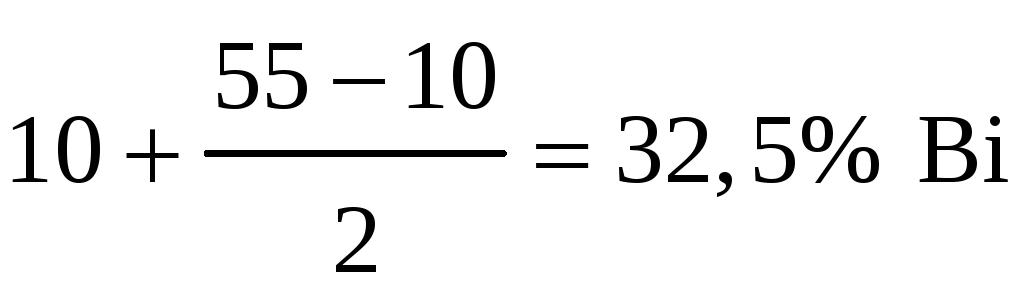 .
.
В исходном сплаве содержится 32,5% висмута и 67,5% сурьмы.
P.S. Графическое решение – линии и точки (квадраты) красного цвета.
в) Точки, соответствующие равновесным твердому и жидкому растворам лежат на одной изотерме. Для твёрдого раствора она проходит через точку на линии солидуса, соответствующую твердому раствору, в котором содержится 70% сурьмы. Пересечение этой изотермы с линией ликвидуса даёт точку, соответствующую равновесному жидкому раствору содержащему 30% сурьмы.
P.S. Графическое решение – линии со стрелками розового цвета.
г) Точки L и S, соответствующие составам жидкой и твёрдой фаз лежат на изотерме 450°С в местах ее пересечения с линиями ликвидуса и солидуса:
твёрдая фаза – 82% Sb, 18%Bi
жидкая фаза – 38% Sb, 62% Bi
Массы жидкой и твёрдой фаз можно найти по «правилу рычага»:
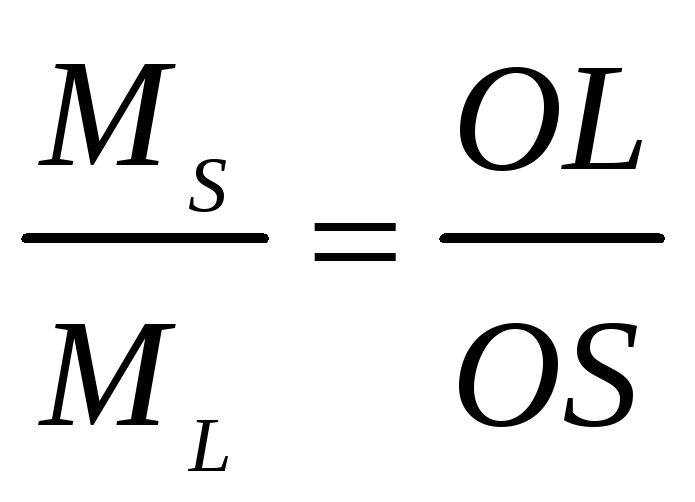 ,
,
где MS и ML – масса, соответственно твердой и жидкой фаз;
OL и OS – длина соответствующих отрезков на изотерме (точка O отвечает
составу исходного сплава)
Приняв за M массу исходного сплава, имеем:
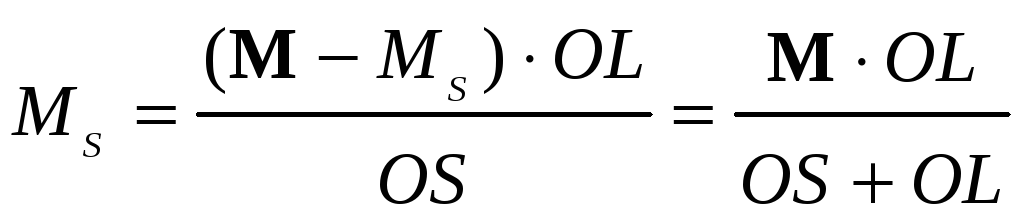
Подставив данные в это уравнение, получим, что
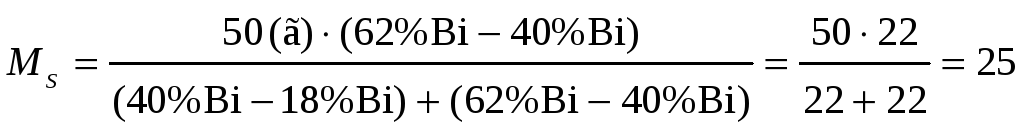 (г),
(г),
и соответственно ML = 50 – 25 = 25 (г)
Таким образом, из расчёта видно, что при 450°С в системе имеется равное количество жидкой и твердой фаз.
В твёрдой фазе (твердом растворе) осталось 25 (г) ∙ 0,82 = 20,5 (г) Sb.
В жидкую фазу (жидкий раствор) из исходного сплава перешло 25 (г) ∙ 0,62 = 15,5 (г.) Bi.
P.S. Графическое решение – линии со стрелками синего цвета.
Задание 8.
В керамическом производстве при разных температурах протекают реакции:
MgCO3(т) = MgO(т) + CO2(г)
2CaSO4(т) = 2CaO(т) + 2SO2(г) + O2(г)
Примените правило фаз к каждой реакции.
Правило фаз Гиббса: С = К – Ф + n,
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз;
n – число факторов равновесия.
Для обеих реакций число факторов равновесия n равно 1, т.к. на систему оказывает влияние только температура (давление постоянно).
Для первого уравнения:
Ф = 3 (две твёрдые фазы ‑ MgCO3(т) и MgO(т) и одна газообразная ‑ CO2(г)),
К = R – g = 3 – 1 = 2 (R – число веществ в системе, g – число независимых уравнений реакций).
В итоге имеем С = 2 – 3 + 1 = 0, т.е. система инвариантна.
Для второго уравнения:
Ф = 3 (две твёрдые фазы ‑ CaSO4(т) и CaO(т) и одна газообразная – смесь SO2(г) и O2(г)).
К = 4 – 1 =3.
С = 3 – 3 + 1 = 2, т.е. система моновариантна.
studfile.net
Графические изображения формул неорганических соединений
При графическом изображении формул веществ указывается последовательность расположения атомов в молекуле с помощью, так называемых валентных штрихов (термин «валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил сцепления атомов), иначе называемых валентной чертой (каждая валентная черта, или валентный штрих, эквивалентны одной паре электронов в ковалентных соединениях или одному электрону, участвующему в образовании ионной связи). Часто неправильно принимают графическое изображение формул за структурные формулы, приемлемые только для соединений с ковалентной связью и показывающие взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе). В узлах кристаллической решетки NаСI находятся ионы, причем каждый Nа+ окружен шестью хлорид-ионами. Это графическое изображение формулы вещества, показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не соединяются между собой и хлорид-ионы, они соединены с ионами натрия.Покажем это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько столбцов и выполняем действия согласно алгоритмам по графическому изображению формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое изображение формул оксидов (например, Аl2O3)
III II
1. Определяем валентность атомов элементов в Аl2O3
2. Записываем химические знаки атомов металлов на первое место (первый столбец). Если атомов металлов больше одного, то записываем и в один столбец и обозначаем валентность (число связей между атомами) валентными штрихами
З. Второе место (столбец), тоже в один столбец, занимают химические знаки атомов кислорода, причем к каждому атому кислорода должно подходить по два валентных штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1. Определяем валентность атомов элементов Fе(ОН)3
2. На первом месте (первый столбец) пишем химические знаки атомов металла, обозначаем их валентность Fе
З. Второе место (столбец) занимают химические знаки атомов кислорода, которые присоединяются одной связью к атому металла, вторая связь пока «свободна»
4. Третье место (столбец) занимают химические знаки атомов водорода, присоединяющихся на «свободную» валентность атомов кислорода
Графическое изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем валентность атомов элементов Н2SO4.
2. На первом месте (первый столбец) пишем химические знаки атомов водорода в один столбец с обозначением валентности
Н—
Н—
З. Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной связью к атому водорода, при этом вторая валентность каждого атома кислорода пока «свободна»
Н— О —
Н— О —
4. Третье место (столбец) занимают химические знаки атомов кислотообразователя с обозначением валентности
5. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Графическое изображение формул солей
Средние соли (например, Fe2SO4)3) В средних солях все атомы водорода кислоты замещены на атомы металла, поэтому при графическом изображении их формул первое место (первый столбец) занимают химические знаки атомов металла с обозначением валентности, а далее — как в кислотах, то есть второе место (столбец) занимают химические знаки атомов кислорода, третье место (столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Кислые соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать как продукты частичного замещения атомов водорода в кислоте атомами металла, поэтому при составлении графических формул кислых солей на первое место (первый столбец) записывают химические знаки атомов металла и водорода с обозначением валентности
Н—
Н—
Ва =
Н—
Н—
Второе место (столбец) занимают химические знаки атомов кислорода
Третье место (столбец) — химические знаки атомов кислотообразователя, на «свободные» валентности кислотообразователя присоединяются атомы кислорода согласно правилу валентности
Основные соли (например, А1ОНSO4) Основные соли определяем, чем как продукт частичного замещения группы ОН основания на кислотный остаток. При составлении графических формул основных солей первое место (столбец) занимают химические знаки атомов металлов с обозначением валентности, второе (столбец) — химические знаки атомов металлов кислорода, третье — химические знаки атомов водорода и кислотообразователя с обозначением соответствующей валентности. На «свободные» валентности атома кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По графическому изображению формул веществ можно судить об их свойствах, определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1 или в органических соединениях
Структурная формула Фосфата кальция Ca3(PO4)2 Ca+23(P+5O-24)2
blogg-latofa.blogspot.com
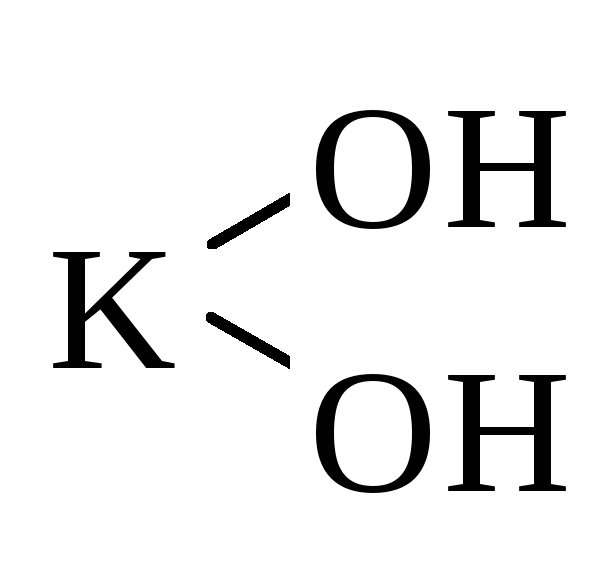
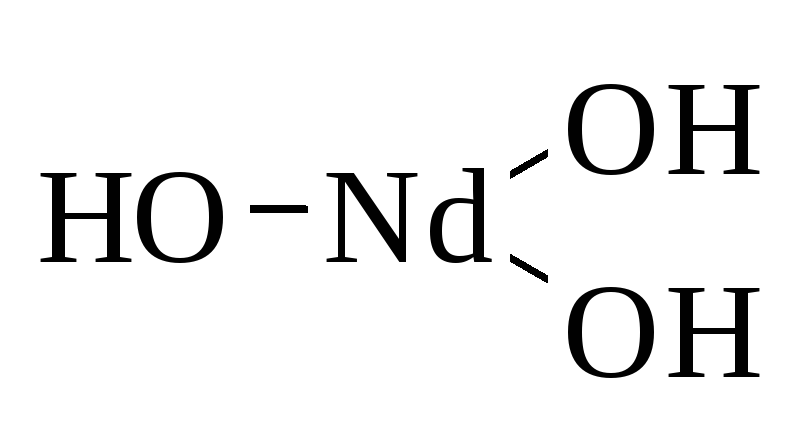
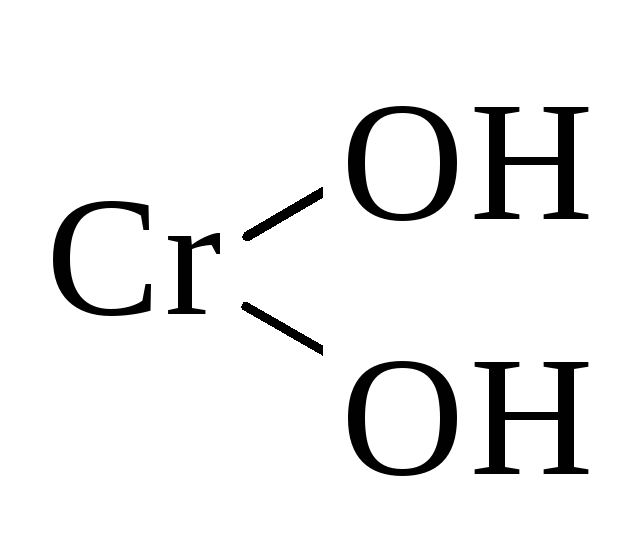
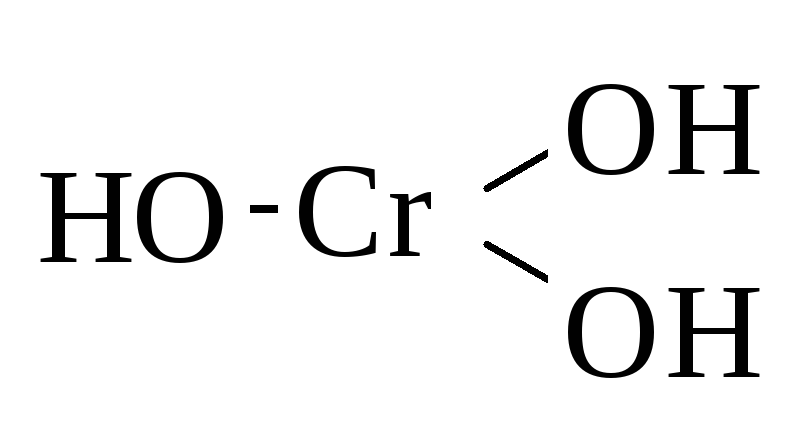
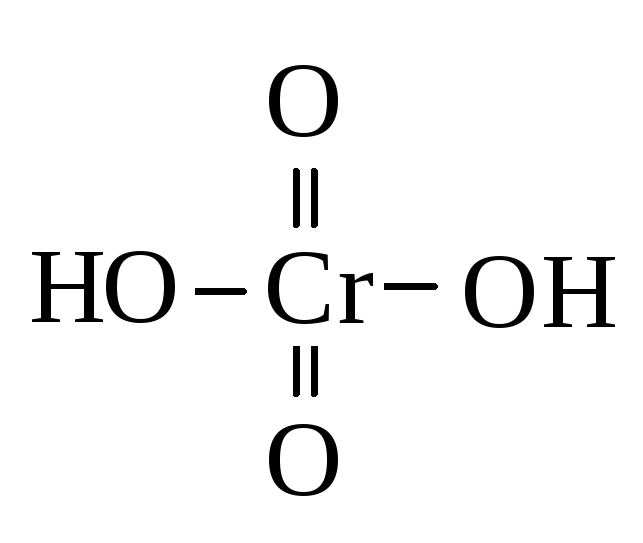
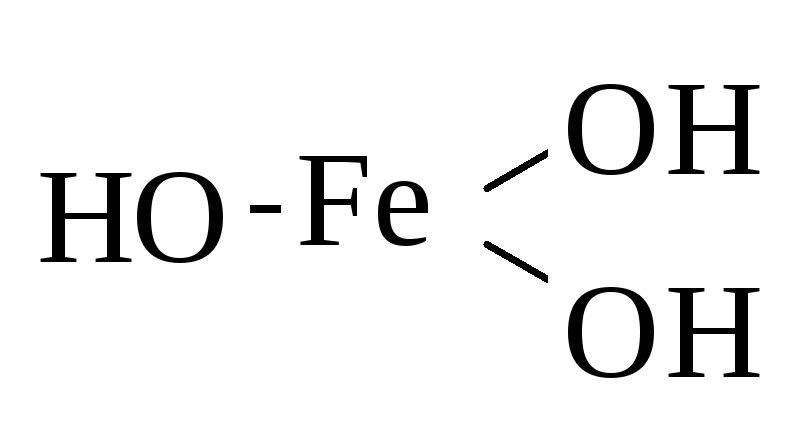
 Si
+ 2H 2
Si
+ 2H 2