Реферат
по химии на тему
«Скорость химических реакций».
Содержание.
Скорость химической реакции. Определение.
Влияние концентрации веществ на скорость химической реакции.
Влияние давления на скорость химической реакции.
Влияние давления на скорость химической реакции. (Дополнительный материал).
Влияние поверхности соприкосновения реагентов на скорость химической реакции.
Влияние поверхности соприкосновения реагентов на скорость химической реакции. (Дополнительный материал).
Влияние природы реагентов на скорость химической реакции.
Влияние природы реагентов на скорость химической реакции. (Дополнительный материал).
Влияние температуры на скорость химической реакции.
Влияние температуры на скорость химической реакции. (Дополнительный материал).
Катализ и ингибирование.
Катализ и ингибирование. (Дополнительный материал).
Скорость химической реакции. Определение.
Химические реакции протекают с разными скоростями. Из известных на сегодняшний день реакций самая быстрая протекает в 1040 раз быстрее, чем самая медленная. Превращение графита в алмаз в недрах Земли — очень медленная реакция. А взрыв смеси кислорода с водородом происходит практически мгновенно.
Как сравнить скорости реакций количественно?
Скорость — это изменение некоторой величины во времени.
Рассмотрим реакцию:
H2 + I2 = 2HI
Попробуем определить скорость этой реакции по расходованию реагентов в единицу времени. Например, так:
v(H2) = m(H2)/Dt, v(I2) = m(I2)/Dt
где v — скорость реакции, m — убыль массы соответствующего реагента, Dt — отрезок времени.
Но v(H2) не равно v(I2). Ведь массы водорода и иода, прореагировавших в единицу времени, не равны.
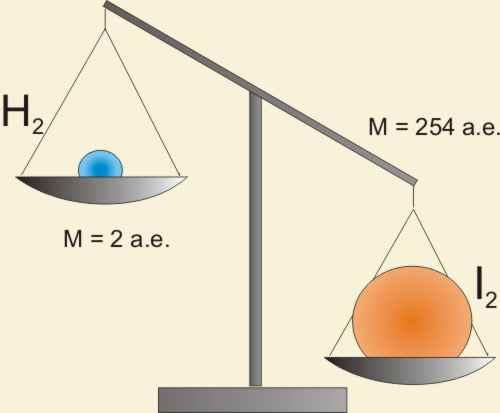
Реакция идет в мольном соотношении 1:1, а не в массовом! Попробуем по-другому:
взяв вместо масс количества веществ.
v(H2) = v(I2)
Но если в первом случае мы возьмем убыль числа молей в единицу времени в 1 мл смеси, а во втором — в 1 л смеси, то скорости снова не будут равны! Они зависят от объема. Если проводить одну и ту же реакцию в маленькой пробирке и в большой бочке, то в пробирке прореагирует меньшее количество вещества — просто потому, что там меньше реагента.
А если привести эти выражения к единице объема?
v(H2) = n(H2)/VDt = Dc(H2)/Dt, v(I
2) = n(I2)/VDt=Dc(I2)/D tгде Dc изменения молярных концентраций соответствующих веществ.Тогда vh3 = vI2 = v данной реакции!
Таким образом, конечное определение будет:
Скорость химической реакции — это изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени: v = Dc/Dt [моль/литр*сек] |
В принятом определении есть два нюанса!
Нюанс 1:
Это выражение
v = Dc/Dt
позволяет
определить лишь среднюю скорость реакции
за выбранный отрезок времени. Ученых
же, как правило, интересует скорость в
выбранный
v = dc/dt

Если мы определяем скорость реакции по одному из реагентов, то знак производной c(t) отрицателен, т.к. концентрации реагентов убывают. Но по физическому смыслу скорость не может быть отрицательной величиной. Поэтому при использовании концентраций реагентов:
v = -dc/dt
Нюанс 2:
Определим скорость этой же реакции
H2 + I2 = 2HI
не по уменьшению концентрации реагента, а по увеличению концентрации продукта:
v(HI) = dc(HI)/dt
У нас получилось, что v(H2) = v(I2), но не равно v(HI)! Ведь при уменьшении концентраций водорода и иода, например, в 3 раза концентрация иодоводорода возрастает в 9 раз (это видно по коэффициентам в уравнении реакции). Чтобы скорости стали равными (и можно было говорить о единой скорости реакции), изменение концентрации HI в единицу времени следует поделить на стехиометрический коэффициент при HI:
v(HI) = dc(HI)/2dt
В общем случае для реакции
aA + bB = eE + fF
значение скорости определяется как:
v = -dc(A)/adt = -dc(B)/bdt = dc(E)/edt = dc(F)/fdt
Краткие теоретические сведения Скорость химических реакций
При рассмотрении вопроса о скорости химических реакций необходимо различать реакции, протекающие в гомогенной или гетерогенной системах.
Системой в химии называют рассматриваемое вещество или совокупность веществ. Система отделена от внешней среды.
Гомогенной называют систему, состоящую из одной фазы. Она может быть в газообразном (воздух), жидком (морская вода) или твердом состояниях.
Гетерогенной называют систему, состоящую из нескольких фаз, например вода со льдом.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства меняются скачкообразно.
Реакции, протекающие в гомогенной системе, называются гомогенными, а в гетерогенной системе – гетерогенными.
Примером гомогенной реакции может быть любая реакция, протекающая в растворе:
 ,
,  .
.
Гомогенные реакции протекают во всем объеме системы.
Гетерогенные реакции идут только на поверхности раздела фаз, образующих эту систему, например:
 .
.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства.
В гомогенной системе реакционным пространством является объем.
Отношение количества вещества к единице объема называется концентрацией С.
Если в момент
времени 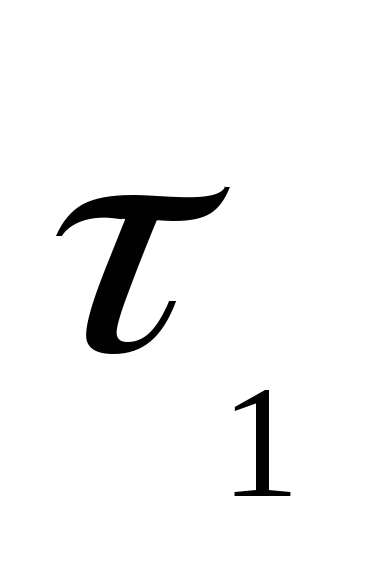 концентрация реагирующего вещества
была
концентрация реагирующего вещества
была (моль/дм3),
а в последующий момент времени
(моль/дм3),
а в последующий момент времени  оказалась равной
оказалась равной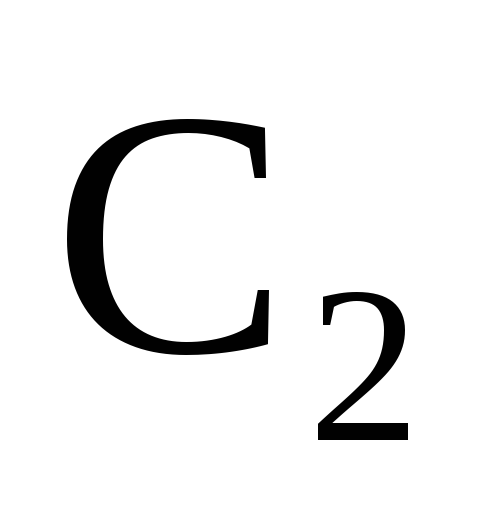 (моль/дм3),
то средняя скорость реакции будет
выражаться отношением:
(моль/дм3),
то средняя скорость реакции будет
выражаться отношением:
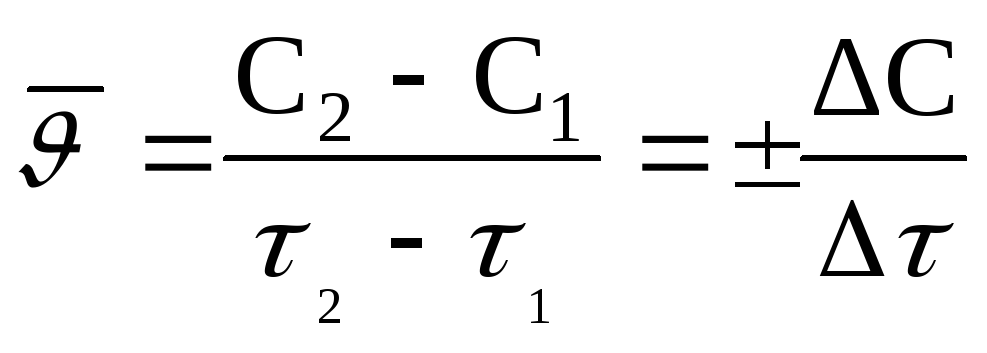 ;
;  – тау.
– тау.
Если 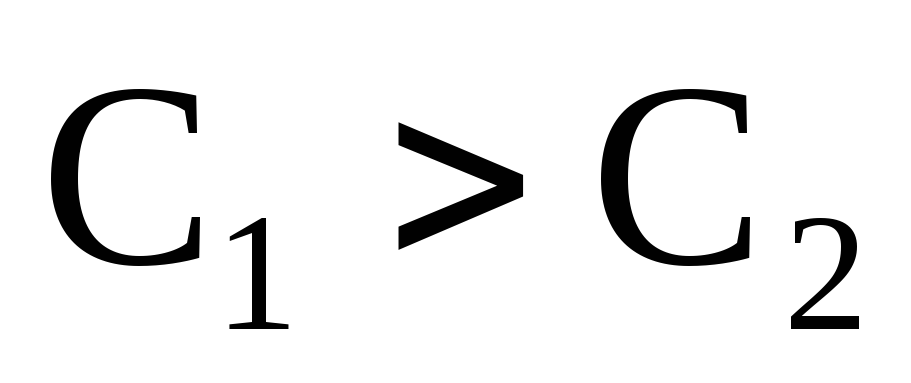
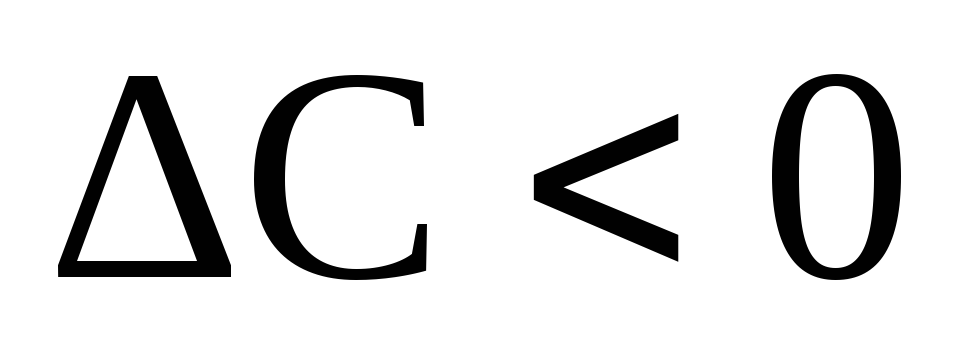 – правая часть уравнения будет
отрицательной.
– правая часть уравнения будет
отрицательной. Если 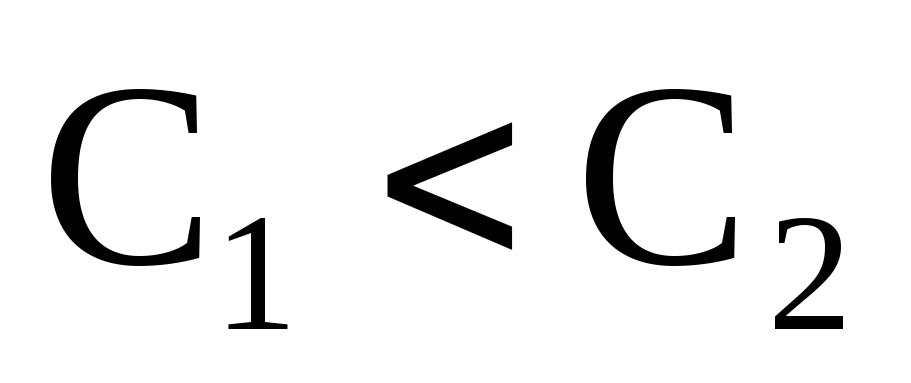 ,
то
,
то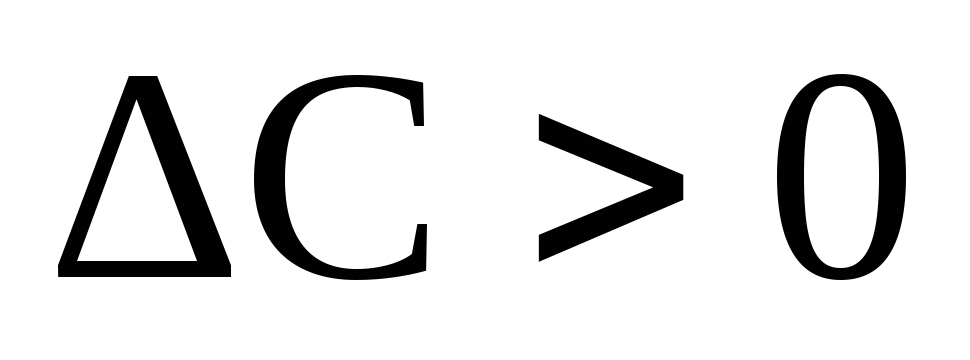 – правая часть уравнения будет
положительной.
– правая часть уравнения будет
положительной.
Истинная скорость
реакции  в данный момент времени определяется
как первая производная от концентрации
по времени:
в данный момент времени определяется
как первая производная от концентрации
по времени:
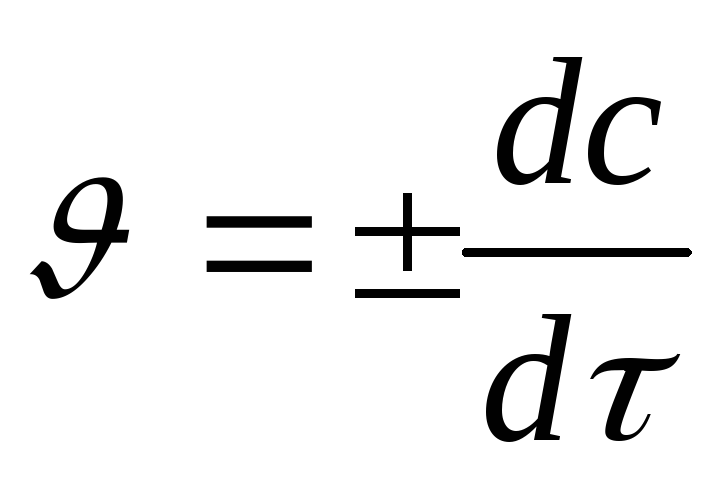 ,
моль/дм3·с.
,
моль/дм3·с.
Реакционным пространством в гетерогенной реакции является поверхность раздела фаз, поэтому скоростью гетерогенной реакции называется изменение количества вещества в единицу времени на единице площади поверхности раздела фаз:
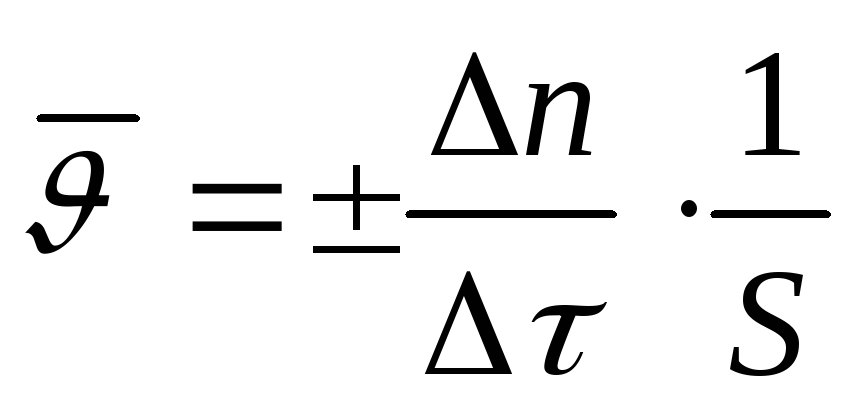 ,
моль/с·м2,
,
моль/с·м2,
или через производную:
 ,
,
где  – площадь поверхности раздела фаз;
– площадь поверхности раздела фаз;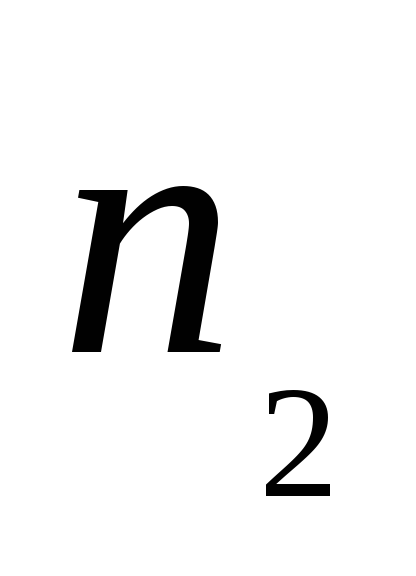 и
и – количество реагирующего вещества в
момент времени
– количество реагирующего вещества в
момент времени и
и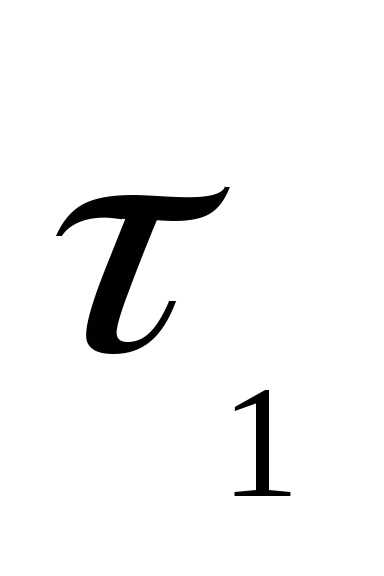 соответственно;
соответственно;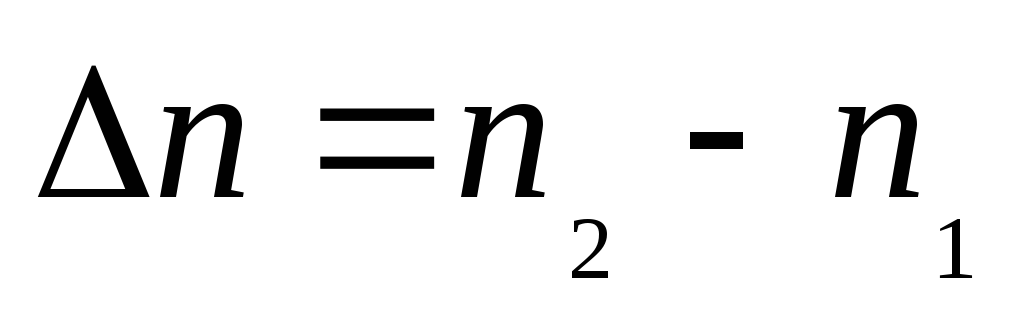 – изменение количества реагирующего
вещества за промежуток времени
– изменение количества реагирующего
вещества за промежуток времени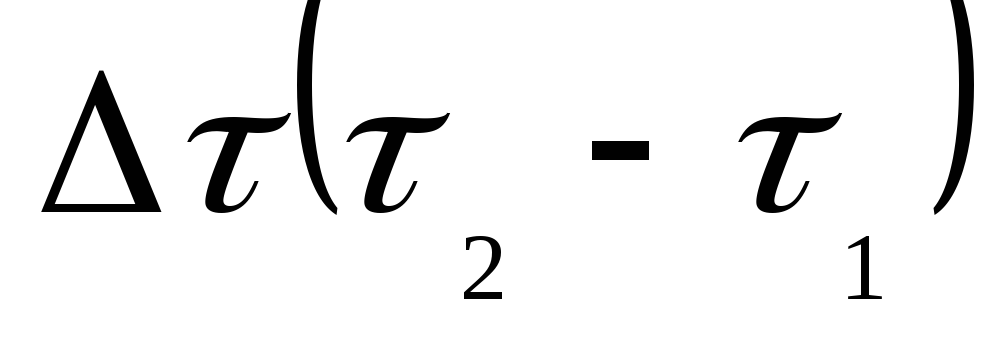 .
.
Скорость химической реакции определяется следующими основными факторами:
природой реагирующих веществ;
концентрацией реагирующих веществ;
температурой протекания реакции;
наличием катализаторов, механизмом реакции и т.д.
Зависимость скорости химической реакции от концентрации выражается законом действующих масс, основным законом химической кинетики: при постоянной температуре скорость гомогенной химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов.
Для химических
реакций в общем виде 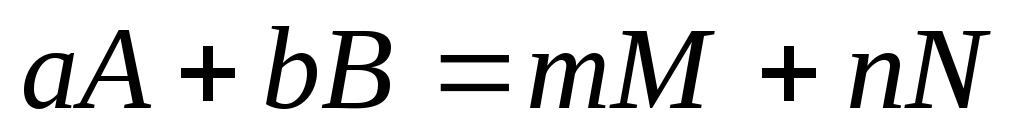 кинетическое уравнение химической
реакции будет иметь вид:
кинетическое уравнение химической
реакции будет иметь вид:
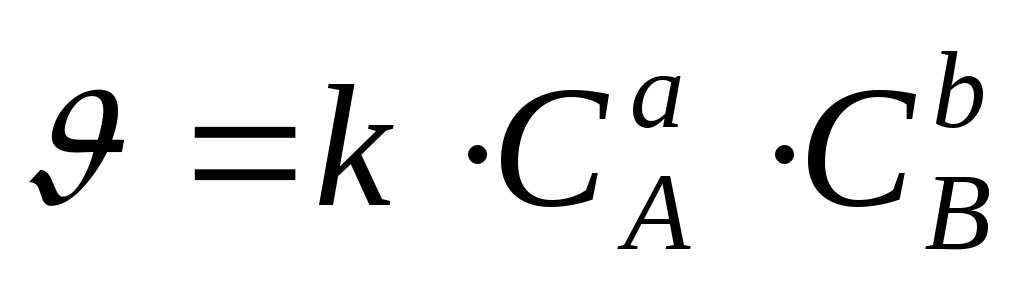 ,
,
где 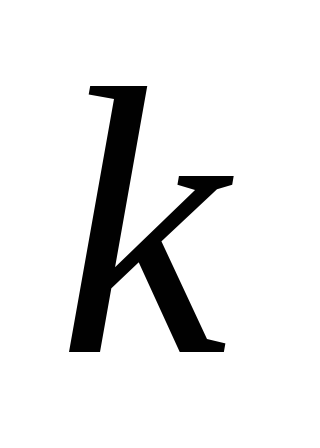 – коэффициент пропорциональности,
называемый константой скорости химической
реакции, дм3/моль·с.
– коэффициент пропорциональности,
называемый константой скорости химической
реакции, дм3/моль·с.
Этот коэффициент зависит от природы реагирующих веществ, температуры и наличия катализаторов. Величина этого коэффициента не зависит от концентрации веществ, участвующих в реакции.
Для гетерогенных
химических реакций в уравнение закона
действующих масс входят концентрации
только тех веществ, которые находятся
в газовой фазе или в растворе, а также
площадь поверхности раздела фаз.
Концентрация вещества, находящегося в
твердой фазе, обычно постоянна и входит
в константу скорости. Например, для
реакции горения угля 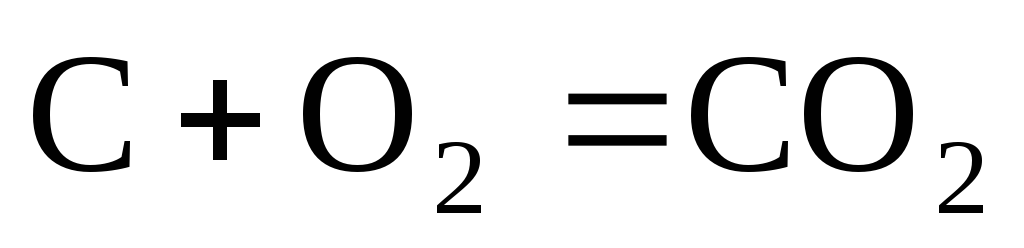 закон действующих масс имеет вид:
закон действующих масс имеет вид:
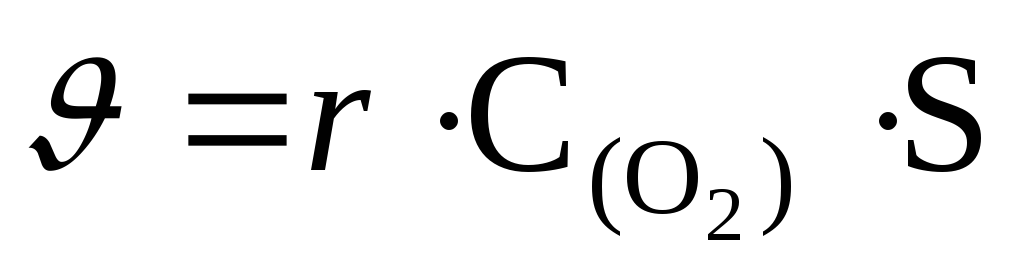 .
.
Зависимость скорости химической реакции от температуры определяется приближенным правилом Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается в 2-4 раза:
 ,
,
где 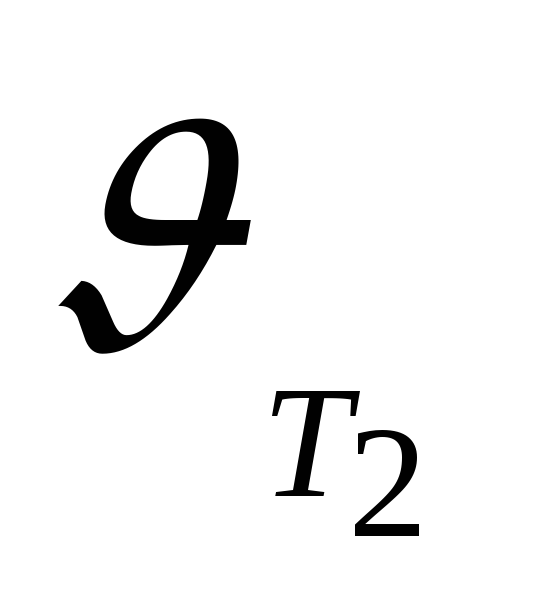 и
и – скорости реакции при температурах
– скорости реакции при температурах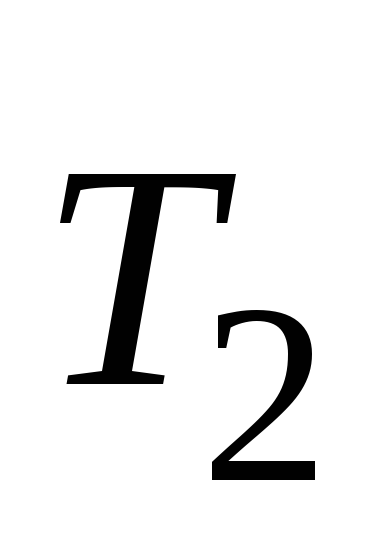 и
и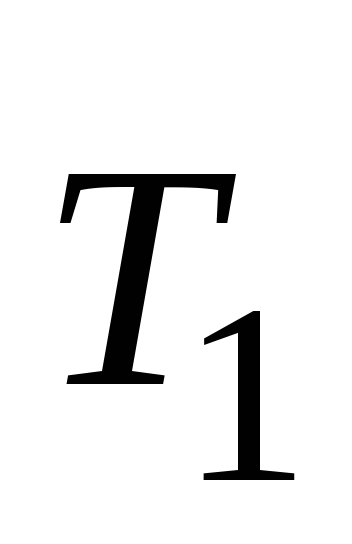 соответственно;
соответственно;
 –температурный
коэффициент скорости реакции.
–температурный
коэффициент скорости реакции.
Величина  показывает, во сколько раз увеличивается
скорость реакции при повышении температуры
на 10º.
показывает, во сколько раз увеличивается
скорость реакции при повышении температуры
на 10º.
При концентрации
реагирующих веществ 1 моль/дм3 скорость реакции численно равна константе
скорости  (из уравнения закона действующих масс).
(из уравнения закона действующих масс).
Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
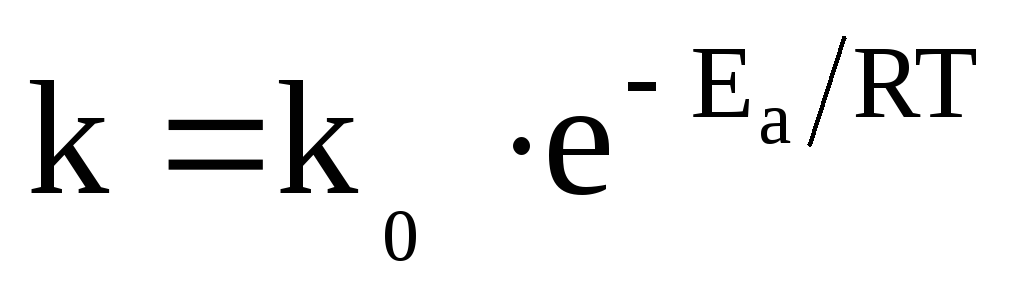 ,
,
где 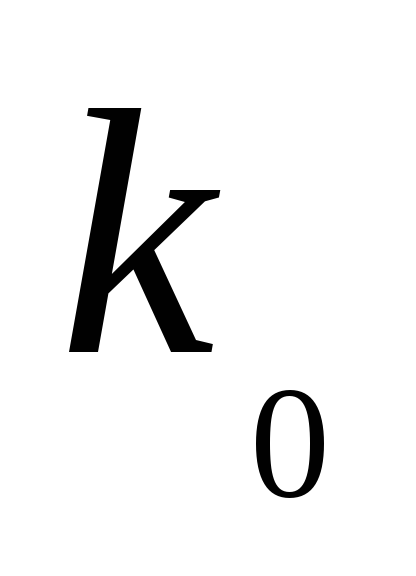 – предэкспоненциальный множитель,
который определяется числом столкновений
и ориентацией реагирующих веществ;
– предэкспоненциальный множитель,
который определяется числом столкновений
и ориентацией реагирующих веществ;
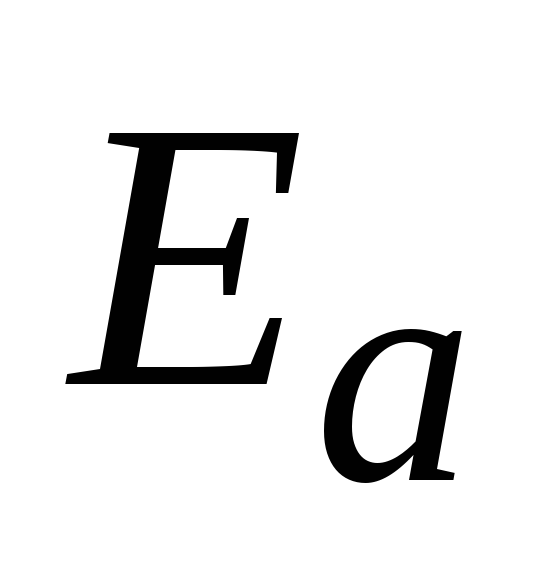 –энергия активации,
кДж/моль;
–энергия активации,
кДж/моль;
 –абсолютная
температура, К;
–абсолютная
температура, К;
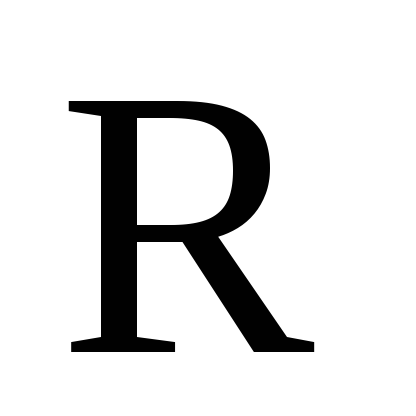 –8,314 Дж/моль·К –
универсальная газовая постоянная;
–8,314 Дж/моль·К –
универсальная газовая постоянная;
 –основание
натурального логарифма (2,718…).
–основание
натурального логарифма (2,718…).
Энергия активации – это энергия, необходимая для перевода молекул из неактивного состояния в активное, столкновения которых приводят к химическим взаимодействиям.
Энергия активации зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
Энергия активации необходима для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами при сближении молекул и атомов взаимодействующих веществ. Другими словами, для образования неустойчивого активированного комплекса, который распадается с образованием продуктов реакции.
Химические реакции сопровождаются тепловыми эффектами. Если тепловой эффект реакции ΔН < 0, то реакция идет с выделением энергии в окружающую среду, т.е. экзотермическая.
Если реакция идет
с поглощением энергии из окружающей
среды 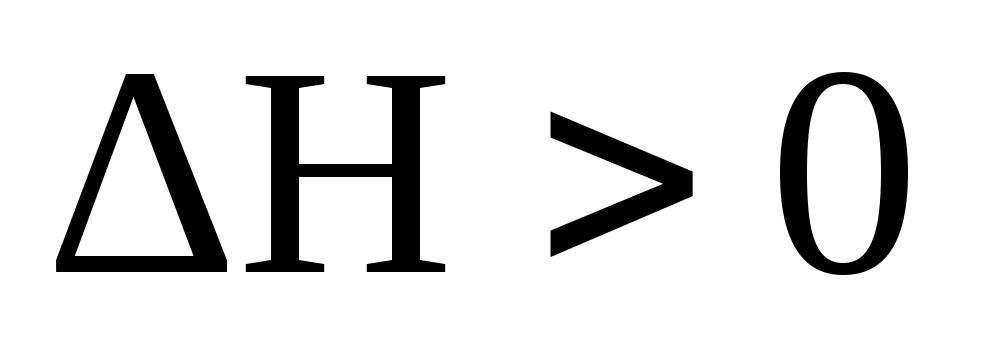 ,
то реакция называется эндотермической.
,
то реакция называется эндотермической.
Катализаторы – это вещества, которые ускоряют химические реакции, но не испытывают химических превращений в их результате, т.е. восстанавливают свой состав.
Явление изменения скорости химической реакции под воздействием катализаторов называется катализом. Катализаторы снижают энергию активации за счет изменения механизма химических реакций.
Реферат: Скорость химических реакций
ИНСТИТУТ ЭКОНОМИКИ, УПРАВЛЕНИЯ И ПРАВА (г. КАЗАНЬ)
Нижнекамский филиал
КОНТРОЛЬНАЯ РАБОТА
по неорганической химии .
за 2 . семестр 2007/2008 уч. года
преподаватель: Давыдов Е.М. .
вариант .
Ткаченко .
фамилия
Семен .
имя
Ильич .
отчество
1 курса заочного отделения
1371з гр.
Содержание
Введение 3
1. Кинетическое уравнение химических реакций 4
2.Молекулярность реакций 13
Введение
Скорость любой химической реакции зависит от условий, в которых она протекает: от концентрации реагентов (или их давления, если это газы), температуры, наличия катализатора или излучения и т.д. Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма. Это относительно молодая наука, и в ней имеется много нерешенных проблем. Во всех кинетических исследованиях фигурируют время и промежуточные продукты (вещества, образующиеся на промежуточных стадиях реакции). Этим они отличаются от исследований систем в условиях химического равновесия, когда рассматриваются только начальное и конечное состояния реагентов.
Кинетическое уравнение химических реакций
В одном кинетическом эксперименте нередко участвуют одновременно две или несколько реакций, при этом их скорости могут зависеть от наличия загрязнений и следов катализаторов. В результате получаемые данные бывают плохо воспроизводимыми, что затрудняет их интерпретацию. Если с термодинамической точки зрения из одних и тех же исходных веществ возможно образование разных продуктов, следует подбором концентрации реагентов, температуры и специфического катализатора добиться, чтобы протекала именно та реакция, которая интересует исследователя. Скорость реакций обычно определяют при постоянной температуре, лучше при двух и более ее значениях, используя один или несколько высокоточных термостатов.
Измерение скоростей реакций. Скорости реакций измеряют разными способами. Можно отбирать пробы из термостатируемого реактора через строго определенные интервалы времени либо замедлять или полностью останавливать реакцию (быстрым охлаждением реактора или каким-либо иным способом) и анализировать пробы титрованием или другими аналитическими методами. Иногда одновременно запускают несколько идентичных реакций, а затем последовательно останавливают их быстрым охлаждением и анализируют продукты.
Если один из реагентов или продуктов реакции обладает оптической активностью, то следят за его концентрацией с помощью поляриметра. Аналогично, если изменение концентрации реагента или продукта реакции либо их обоих сопровождается изменением электропроводности, для кинетических измерений используют электрические методы. Иногда концентрацию одного из реагирующих веществ определяют, измеряя оптическую плотность раствора при определенной длине волны и используя закон Ламберта – Бера.
Скорость реакции можно рассчитать исходя из данных об изменении давления или объема в газофазной системе либо объема газа, выделяющегося в ходе реакции. В случае газофазных реакций, протекающих в потоке, в реактор иногда вводят катализатор или повышают температуру, чтобы ускорить процесс. Входные и выходные трубки в таких системах делают достаточно малыми, чтобы газы поступали в реактор и выходили из него как можно быстрее и в области с неконтролируемым градиентом температуры находились непродолжительное время. Время нахождения газов в реакторе (время протекания реакции) определяют исходя из объема газов, проходящих через реактор в 1 с, отнесенного к объему реактора. Если общее число молекул в ходе реакции изменяется, то оценить время становится довольно трудно. В проточных системах используются большие количества реагентов и получаются большие количества продуктов, что облегчает моделирование соответствующих химических процессов в промышленных масштабах.
Скорость реакции можно определить по уменьшению концентрации исходных веществ или по увеличению концентрации продуктов. Скорость уменьшения концентрации исходного вещества равна –dC/dt, а скорость увеличения концентрации продукта равна dC/dt, где С – концентрация, t – время. Концентрацию обычно измеряют в единицах молярности (моль/л), время – в секундах.
Порядок реакции. Порядок реакции – это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции
aA + bB ® mM + nN
скорость уменьшения концентрации С реагента А можно представить в виде
где СА и СВ – концентрации исходных веществ А и В соответственно. Порядок реакции в этом случае равен а + b. Коэффициент пропорциональности k, входящий в уравнение, называется константой скорости. Он равен скорости реакции при единичной концентрации реагентов.
Реакции первого порядка. Если скорость реакции зависит от концентрации только одного реагента в первой степени, то выражение для скорости принимает вид
О такой реакции говорят, что она является реакцией первого порядка.
Чтобы найти зависимость концентрации от времени, нужно проинтегрировать уравнение (1). Разделив переменные и проинтегрировав, получим
–ln C = kt + const
где ln – натуральный логарифм. Или, перейдя к десятичным логарифмам:
График зависимости lg C от t является прямой с тангенсом угла наклона –s, равным –k/2,303. Отсюда
k = 2,303Чs
Зная k и концентрацию С при данном t, можно найти константу интегрирования (const) и рассчитать концентрацию для любого момента времени. Константу интегрирования можно также определить из координат точки пересечения прямой с осью lg C при t = 0 (рис. 1).
Уравнение (1) можно проинтегрировать в пределах от С1 до С2 , равных концентрациям реагента в моменты времени t1 и t2 :
Отсюда
Размерность k равна размерности t –1 .
Если в начальный момент времени (t1 = 0) C1 = C0 , то концентрация C в любой момент времени t в соответствии с уравнением (2) будет равна
Уравнение (1) можно записать в другом виде, приняв, что а – это начальное количество реагента, x – его количество, прореагировавшее за время t. Тогда (а – x) равно количеству реагента, оставшемуся через время t, и уравнение реакции примет вид
Разделив переменные и проинтегрировав, получим
–ln(a – x) = kt + const
отсюда при t = 0, x = 0 и const = –ln a
Часто представляет интерес характеристическая величина t1/2 – время полупревращения реакции, т.е. время, за которое концентрация исходного вещества уменьшается вдвое. При x = (1/2)a и t = t1/2 из уравнения (3) получим
Это соотношение иллюстрирует важную особенность реакций первого порядка: время, за которое количество вещества уменьшается вдвое, не зависит от его количества в момент начала реакции и в любой данный момент реакции.
Если известна константа скорости k, можно рассчитать количество вещества, прореагировавшего к данному моменту времени, или определить, за какое время прореагирует данное количество вещества.
Уравнению первого порядка следуют многие химические реакции. Например, пентаоксид азота, растворенный в тетрахлориде углерода, разлагается при температуре 45° С в строгом соответствии с уравнением реакции первого порядка:
Реакции второго порядка. Когда скорость реакции пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени, мы имеем дело с реакцией второго порядка. В дифференциальной форме выражения для скорости такой реакции имеют вид
и
Пусть a – начальная молярная концентрация реагента А, x – число его молей в 1 л, прореагировавшее за время t; тогда скорость реакции будет равна
dx/dt = k(a – x)2
или
dx/(a – x)2 = kdt
Проинтегрировав, получим
1/(a – x) = kt + C
Поскольку x = 0 при t = 0, константа С = 1/а. Отсюда
и
Если а и b – начальные молярные концентрации реагентов А и В соответственно и если за время t прореагировало x молей этих реагентов в 1 л, то, проинтегрировав соответствующее уравнение для скорости реакции, можно найти выражение для константы скорости:
Размерность k – л/(мольЧс). Численное значение k можно найти, подставив концентрации и время в уравнение (4) либо построив графики зависимости или от времени. Умножение наклона полученной таким образом прямой на 2,303/(a – b) дает k .
Реакции третьего порядка. Скорость реакции третьего порядка может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени. Так,
или
dx/dt = k(a – x)3
Разделение переменных и интегрирование дают
или
Здесь размерность k – л2 /(моль2 Чс).
Реакции нулевого порядка. Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях). Уравнение для скорости такой реакции в дифференциальной форме имеет вид
–dC/dt = k
или, выраженное через концентрацию x продукта,
dx/dt = k
Проинтегрировав, получим
x = kt + C
Значению x = 0 соответствует t = 0, откуда константа С = 0 и
x = kt
В величину k могут входить различные константы, например интенсивность света, концентрация насыщенного раствора или пара. Размерность k – моль/(лЧс).
Реакции п-го порядка. В общем случае для реакции порядка п при п > 1 связь между концентрацией и временем для конечного времени наблюдения описывается уравнением
где С – концентрация реагента в момент времени t, C0 – начальная концентрация. График зависимости 1/(Сn – 1 ) от t представляет собой прямую с наклоном (n–1) k. Размерность k – (моль/л)1 – n /c.
Реакции не всегда имеют целочисленный порядок. Показатели степени при концентрациях в выражении для скорости часто являются дробными. Однако и в этом случае порядок реакции равен сумме показателей степеней. Например, для реакции, скорость которой равна
порядок п = 0,7 + 1,8 = 2,5.
Часто порядок реакции, определяемый экспериментально, не соответствует порядку, который следует из стехиометрического уравнения. Большинство химических реакций включает две или несколько стадий, протекающих одновременно, что приводит к более сложным выражениям для скорости.
Определение порядка реакции. Подстановка в формулы. Если k остается постоянной при подстановке значений концентрации и времени в уравнение скорости реакции, значит, порядок реакции, задаваемый уравнением, верен. Если же расчеты не согласуются с экспериментальными данными, то реакция сложнее, чем предполагалось, и, вероятно, протекает в две или несколько стадий.
Графический метод. Для определения порядка реакции можно прибегнуть к графическому представлению функций, описывающих зависимость концентрации от времени. Если при построении зависимости С от t получается прямая, это означает, что реакция – нулевого порядка. Если линейна зависимость lg C от t, имеет место реакция первого порядка. При условии что начальная концентрация всех реагентов одинакова, реакция имеет второй порядок, если линейным является график зависимости 1/С от t, и третий – в случае линейности зависимости 1/С 2 от t.
Определение времени полупревращения. Для реакции первого порядка время, за которое прореагирует определенная часть реагента (например, половина), не зависит от начальной концентрации (см. выше),
Для реакции второго порядка при равенстве начальных концентраций обоих реагентов, а = b, время, за которое прореагирует половина вещества, обратно пропорционально начальной концентрации. Из приведенного выше выражения для константы скорости реакции второго порядка получаем
или
t1/2 = 1/ka
Изменение соотношения между реагентами. Если выражение для скорости представить как
где СА , СВ , СС … – концентрации участвующих в реакции веществ А, В и С …, а а, b, с … – соответствующие показатели степени в уравнении для скорости, то порядок реакции п можно определить, увеличив вдвое значение СА без изменения СВ и СС и экспериментально определив величину Dx/Dt для СА и 2СА . Так, если – скорость при концентрации 2СА , а – скорость при концентрации СА , то, взяв отношение этих двух величин, получим
Предположим, что наблюдаемое отношение
равно 4; тогда а = 2 и реакция является реакцией второго порядка относительно реагента А. Если это отношение равно 2, то а = 1 и имеет место реакция первого порядка относительно того же реагента. Аналогичным образом определяют b, с и т.д.
Добавление избытка реагентов. Добавив в реакционную смесь в большом избытке все реагирующие вещества, кроме одного, можно определить порядок реакции по этому реагенту, т.е. показатель степени, с которым концентрация данного реагента входит в уравнение скорости. Таким же образом определяют порядок реакции по каждому реагенту.
Показатель степени для концентрации реагента А, не находящегося в избытке, устанавливают по графику зависимости dCA /dt от ln CA согласно уравнению
Наклон полученной прямой равен а. Константа kў является произведением константы скорости на концентрации реагентов, находящихся в избытке, взятые в соответствующих степенях.
Молекулярность реакции
Молекулярность реакции определяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Порядок реакции и ее молекулярность не всегда можно предсказать исходя из стехиометрии реакции; для этого нужно провести кинетические измерения. В некоторых случаях порядок и молекулярность реакции, определенные исходя из ее стехиометрии, совпадают.
Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например распад ее на составляющие (диссоциация молекул иода I2 ® 2I) или превращение в другую молекулу в результате внутримолекулярной перестройки:
Бимолекулярная реакция – это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, H2 + I2 ® 2HI). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной. Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Скорость химической реакции. Изучение основных закономерностей протекания химических реакций
Похожие главы из других работ:
Влияние управляющих параметров на равновесие и скорость реакции синтеза метанола
3. Влияние параметров управления на скорость химической реакции
Все системы взаимодействующих веществ и соответствующие им технологические процессы делятся на однородные, или гомогенные, и неоднородные, или гетерогенные. Гомогенными называются такие процессы…
Изучение основных закономерностей протекания химических реакций
Скорость химической реакции
Все химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни, также известны реакции, требующие для своего протекания несколько лет…
Изучение основных закономерностей протекания химических реакций
Скорость гетерогенной и гомогенной реакции
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. Скоростью гетерогенной реакции называется количество вещества…
Кинетика химических реакций
9.3 Константа скорости химической реакции, ее зависимость от температуры
Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается…
Классификация химических реакций
1. Общее понятие о химической реакции
Химическая реакция — это превращение одних веществ в другие. Однако, такое определение нуждается в существенном дополнении. Так, например, в ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие…
Межмолекулярное взаимодействие. Адсорбция. Пищевые пены
3. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того…
Определение термодинамической возможности протекания химических процессов в реакции h3+Cl2=2HCl
2.2 Расчет изменения энтропии химической реакции
Степень беспорядка, или неупорядоченности, в системе характеризуется физическим свойством, называемым энтропией…
Проектирование ректификационной колонны для разделения смеси метанол-вода
4. Диаметр колонны и скорость пара
…
Проектирование ректификационной установки непрерывного действия для разделения смеси ацетон — уксусная кислота
3.2 Скорость пара и диаметр колонны
Скорость пара в интервале устойчивой работы провальных тарелок может быть определена с помощью уравнения [1, 204]: где(18) Средние температуры пара и жидкости определяем по диаграмме t — x, y Для пара: а) при б) при Для жидкости: а) при уср.в = 0…
Расчет абсорбционной установки для улавливания фторгазов в производстве экстракционной фосфорной кислоты (ЭФК)
8.3.1 Диаметр абсорбера и скорость газа
Для нормальной работы абсорберов этого типа необходимо, чтобы газ двигался в центральной полой части со скоростью от 10 до 20 м/с. Пусть в рассчитываемом абсорбере газ движется со скоростью 12 м/с…
Расчет ректификационной установки для разделения бинарной смеси этиловый спирт-вода
4.2 Скорость пара в колонне
Скорость пара в верхней части колонны: , (35) где С = 0,059 (при расстоянии между тарелками 400 мм) — коэффициент, зависящий от конструкции тарелок, расстояния между тарелками, рабочего давления в колонне, нагрузке колонны по жидкости (рис 7). wпв = 0…
Термодинамические расчеты соединений
4. Расчет ДGтє химической реакции образования соединения CuFe2O4
4.1 Расчет ДG400є 4.1.1 Расчет ДG400є реакции по уравнению Гиббса (первый метод) 4.1.2 Расчет G0400 по уравнению Гиббса-Гельмгольца(второй метод) 4.2 Расчет ДG500є 4.2.1 Расчет ДG500є реакции по уравнению Гиббса (первый метод) 4.2…
Термодинамические расчеты соединений
3. РАСЧЕТ ДGТє ХИМИЧЕСКОЙ РЕАКЦИИ ОБРАЗОВАНИЯ СОЕДИНЕНИЯ CuFeO2
3.1 РАСЧЕТ ДG400є 3.1.1 Расчет ДG400є реакции по уравнению Гиббса (первый метод) 1) Определяем энтальпию реакции при 298 К. H0298 = H0298(CuFeO2) — H0298(CuO) — H0298(FeO) = -592,6 +157,03 + +266,65= -168,92 кДж*моль-1…
Химическая кинетика
2. Порядок химической реакции
…
Химическая термодинамика. Скорость химических процессов
3. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того…