Металлы — Википедия
О соответствующем направлении рок-музыки см. Метал.Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на 2019 год, к металлам часто относят (единого общепринятого определения нет, например, полуметаллы и полупроводники не всегда относят к металлам):
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra; к щёлочноземельным также иногда относят Mg, и Be;
38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
— Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po;
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам могут относится более 90 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))[4].
Некоторые группы/семейства металлов[править | править код]


- Щелочные:
- Щёлочноземельные:
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Переходные:
- Постпереходные:
- Тугоплавкие
- Металлы платиновой группы
- Цветные
- Благородные
- Монетные
Аморфные металлы[править | править код]
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова[5].
 | Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые металлы; которое разнство в том состоит, что высоких одним огнём без помощи других материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел обращаются. За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть.М. В. Ломоносов |  |
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).[6]
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[7]. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Подготовка руды
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространённые металлы, такие как железо, медь, олово, плавят с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[8][9]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Твёрдость[править | править код]
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Температура плавления[править | править код]
Плотность[править | править код]
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность[править | править код]
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность[править | править код]
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность[править | править код]
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет[править | править код]
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Взаимодействие с простыми веществами[править | править код]
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны).Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
- 4Li+O2=2Li2O{\displaystyle {\mathsf {4Li+O_{2}=2Li_{2}O}}} оксид лития
- 2Na+O2=Na2O2{\displaystyle {\mathsf {2Na+O_{2}=Na_{2}O_{2}}}} пероксид натрия
- K+O2=KO2{\displaystyle {\mathsf {K+O_{2}=KO_{2}}}} надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
- Na2O2+2Na=2Na2O{\displaystyle {\mathsf {Na_{2}O_{2}+2Na=2Na_{2}O}}}
Со средними и малоактивными металлами реакция происходит при нагревании:
- 3Fe+2O2=Fe3O4{\displaystyle {\mathsf {3Fe+2O_{2}=Fe_{3}O_{4}}}}
- 2Hg+O2=2HgO{\displaystyle {\mathsf {2Hg+O_{2}=2HgO}}}
- 2Cu+O2=2CuO{\displaystyle {\mathsf {2Cu+O_{2}=2CuO}}}
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- 6Li+N2=2Li3N{\displaystyle {\mathsf {6Li+N_{2}=2Li_{3}N}}}
При нагревании:
- 2Al+N2=2AlN{\displaystyle {\mathsf {2Al+N_{2}=2AlN}}}
- 3Ca+N2=Ca3N2{\displaystyle {\mathsf {3Ca+N_{2}=Ca_{3}N_{2}}}}
- С серой реагируют все металлы, кроме золота и платины.
Железо взаимодействует с серой при нагревании, образуя сульфид:
- Fe+S=FeS{\displaystyle {\mathsf {Fe+S=FeS}}}
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- 2Na+h3=2NaH{\displaystyle {\mathsf {2Na+H_{2}=2NaH}}}
- Mg+h3=Mgh3{\displaystyle {\mathsf {Mg+H_{2}=MgH_{2}}}}
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- 2Na+2C=Na2C2{\displaystyle {\mathsf {2Na+2C=Na_{2}C_{2}}}}
- Na2C2+2h3O=2NaOH+C2h3{\displaystyle {\mathsf {Na_{2}C_{2}+2H_{2}O=2NaOH+C_{2}H_{2}}}}
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода[править | править код]
Происходит реакция замещения, которая также является окислительно-восстановительной:
- Mg+2HCl=MgCl2+h3↑{\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}}
- 2Al+2h4PO4=2AlPO4+3h3↑{\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}
Взаимодействие концентрированной серной кислоты H2SO4 с металлами[править | править код]
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
- Cu+2h3SO4=CuSO4+SO2↑+2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
Сильно разбавленная кислота реагирует с металлом по классической схеме:
- Mg+h3SO4=MgSO4+h3↑{\displaystyle {\mathsf {Mg+H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow }}}
При увеличении концентрации кислоты образуются различные продукты:
- Mg+2h3SO4=MgSO4+SO2↑+2h3O{\displaystyle {\mathsf {Mg+2H_{2}SO_{4}=MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
- 3Mg+4h3SO4=3MgSO4+S↓+4h3O{\displaystyle {\mathsf {3Mg+4H_{2}SO_{4}=3MgSO_{4}+S\downarrow +4H_{2}O}}}
- 4Mg+5h3SO4=4MgSO4+h3S↑+4h3O{\displaystyle {\mathsf {4Mg+5H_{2}SO_{4}=4MgSO_{4}+H_{2}S\uparrow +4H_{2}O}}}
Реакции для азотной кислоты (HNO3)[править | править код]
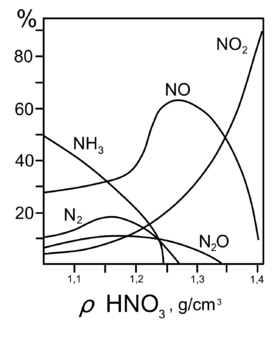 Продукты взаимодействия железа с HNO3 разной концентрации
Продукты взаимодействия железа с HNO3 разной концентрации- Cu+4HNO3(60%)=Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Cu+8HNO3(30%)=3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
При взаимодействии с активными металлами вариантов реакций ещё больше:
- Zn+4HNO3(60%)=Zn(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)=Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Zn+8HNO3(30%)=3Zn(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)=3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
- 4Zn+10HNO3(20%)=4Zn(NO3)2+N2O↑+5h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)=4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}}
- 5Zn+12HNO3(10%)=5Zn(NO3)2+N2↑+6h3O{\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)=5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}}
- 4Zn
ru.wikipedia.org
Физические свойства металлов
Особенностями строения металлов определяются их характерные физические свойства.
Пластичность. При деформации (изменении формы куска металла) ионы лишь смещаются относительно друг друга, но разрыва не происходит, так как связывающие их электроны, соответственно переместившись, продолжают осуществлять связь между сместившимися ионами. На практике пластичность проявляется в том, что под ударами молота металлы не дробятся на куски, а расплющиваются – они ковки. Самый пластичный металл – золото: его можно вытягивать в тонкие золотые нити, невидимые человеческому глазу или раскатывать в тончайшие полупрозрачные листы.
 Электрическая проводимость объясняется способностью электронов легко перемещаться по всему куску металла.
Электрическая проводимость объясняется способностью электронов легко перемещаться по всему куску металла.
Высокая теплопроводность также обусловлена движением электронов, так как именно они передают теплоту в разные участки куска металла, благодаря электронам металлы обладают характерными оптическими свойствами непрозрачности и металлического блеска. Металлы блестят потому, что отражают от своей поверхности световые лучи, а не пропускают их, как стекло, и не поглощают их как сажа.
Различные свойства проявляются в металлах в неодинаковой степени. Самой лучшей проводимостью обладает серебро, второе место по электронной проводимости занимает медь, далее следует алюминий. С помощью этих металлов можно передавать электрическую энергию на большие расстояния . Но в электротехнике в качестве материала для проводки используются алюминий и медь, так они значительно дешевле серебра.
В таком же порядке металлы располагаются и по теплопроводности: серебро, медь, алюминий.
Из более важных свойств металла стоит обратить внимание на плотность, твёрдость, прочность и температуру плавления. Плотность металла тем больше, чем больше его относительная атомная масса и чем меньше радиус атома и наоборот. Например, у лития – 534 кг/м3, а у осмия – 22500 кг/м3. Металлы с плотностью ниже 5000 кг/м3 называют лёгкими: магний, алюминий, титан. Металлы с большой плотностью: свинец, осмий.
 Такие свойства металлов, как прочность, твёрдость и температура плавления зависят от прочности металлической связи. Особенно сильна эта связь у тяжёлых металлов с достраивающимся предпоследним электронным слоем атома: тантала, вольфрама и др. Эти металлы и отличаются высокой твёрдостью и низкой плавкостью.
Такие свойства металлов, как прочность, твёрдость и температура плавления зависят от прочности металлической связи. Особенно сильна эта связь у тяжёлых металлов с достраивающимся предпоследним электронным слоем атома: тантала, вольфрама и др. Эти металлы и отличаются высокой твёрдостью и низкой плавкостью.
Температура плавления металлов изменяется от 39˚ С (ртуть) до 3410˚ С (вольфрам). Ртуть является единственным жидким металлом.
Твёрдость металлов изменяется в широких пределах: щелочные металлы достаточны мягкие, а саамы твёрдые металлы не поддаются обработке напильником.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
2 .Физические свойства металлов.
Строение металлов
Исследование структуры металла проводят путем изучения макроструктуры с увеличением до 10 раз и без увеличения; микроструктуры с увеличением от 10 до 2000 раз на оптических микроскопах и до 100 000 раз на электронных микроскопах, атомной структуры – рентгенографическим анализом. Металлы представляют собой кристаллические тела с закономерным расположением атомов в узлах пространственной решетки. Решетки состоят из ряда кристаллических плоскостей, расположенных друг от друга на расстоянии нескольких нанометров (1 нм = 10-9 м). Для железа эти расстояния 28,4 нм (α=Fe) и 36,3 нм (γ = Fe). Большинство металлов имеет пространственные решетки в виде простых геометрических фигур. Отдельные участки кристаллической решетки прочно связаны между собой в комплексы – зерна. Взаимное расположение зерен отдельных элементов и сплавов определяет структуру металлов и их свойства. Атомы металлов характеризуются малым количеством электронов (1…2) на наружной оболочке, легко отдают их, что подтверждается высокой электропроводностью. Черные металлы имеют простые кубические ячейки решеток двух видов: а) центрированный или объемно-центрированный куб (9 атомов в ячейке), объем шаров занимает 68 %; б) гранецентрированный или куб с центрированными гранями (14 атомов), объем шаров занимает 74 %. Некоторые цветные металлы и их сплавы имеют гексагональную (шестигранную) решетку. Железо, олово, титан и другие металлы обладают свойствами аллотропии, т.е. способностью одного и того же химического элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Железо имеет четыре аллотропические формы: α-Fe; β-Fe, γ-Fe, δ-Fe. Практическое значение имеют α -Fe и γ -Fe, так как p-Fe и б-Fe отличаются от a-Fe только величиной межатомного расстояния, а для β-Fe характерно отсутствие магнитных свойств. Температура, при которой происходит переход металла из одного аллотропического вида в другой, называется критической. Величины этих температур видны на диаграмме охлаждения и нагревания чистого железа в виде участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты при нагревании.
Все металлы находятся в твердом состоянии до определенной температуры. При нагреве металла амплитуда колебания атомов достигает некоторой критической величины, при которой происходят разрушение кристаллической решетки и переход металлов из твердого в жидкое состояние. Процесс кристаллизации заключается в росте кристаллов путем отложения новых кристаллических групп вокруг возникших зародышей. Рост кристаллических образований происходит в определенных направлениях. Вначале образуются главные оси кристалла путем роста в трех взаимно перпендикулярных направлениях, а затем от каждой из этих осей образуются новые и возникает не полностью завершенный кристалл, называемый дендритом. В дальнейшем все промежутки между осями дендрита заполняются упорядоченно расположенными атомами. В условиях несвободной кристаллизации образующиеся кристаллы получают неправильные очертания и форму и называются кристаллитами или зернами. Величина зерен оказывает существенное влияние на механические свойства металлов: чем мельче зерна, тем прочнее металл. Технические металлы и сплавы представляют собой поликристаллические тела, состоящие из большого числа различно ориентированных кристаллических зерен (поперечные размеры зерен – 0,001…0,1 мм). Поэтому в целом металлы и сплавы можно считать условно изотропными телами.
Группы металлов.
В настоящее время известно 105 химических элементов, большинство из
них — металлы. Последние весьма распространены в природе и встречаются в
виде различных соединений в недрах земли, водах рек, озер, морей, океанов,
составе тел животных, растений и даже в атмосфере.
По своим свойствам металлы резко отличаются от неметаллов. Впервые
это различие металлов и неметаллов определил М. В. Ломоносов. «Металлы, —
писал он, — тела твердые, ковкие блестящие».
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду
наличие у него определенного комплекса свойств:
1. Плотная кристаллическая структура.
2. Характерный металлический блеск.
3. Высокая теплопроводность и электрическая проводимость.
4. Уменьшение электрической проводимости с ростом температуры.
5. Низкие значения потенциала ионизации, т.е. способность легко
отдавать электроны.
6. Ковкость и тягучесть.
7. Способность к образованию сплавов.
Все металлы и сплавы, применяемые в настоящее время в технике, можно
разделить на две основные группы. К первой из них относят черные металлы —
железо и все его сплавы, в которых оно составляет основную часть. Этими
сплавами являются чугуны и стали. В технике часто используют так называемые
легированные стали. К ним относятся стали, содержащие хром, никель,
вольфрам, молибден, ванадий, кобальт, титан и другие металлы. Иногда в
легированные стали входят 5-6 различных металлов. Методом легирования
получают различные ценные стали, обладающие в одних случаях повышенной
прочностью, в других — высокой сопротивляемостью к истиранию, в третьих —
коррозионной устойчивостью, т.е. способностью не разрушаться под действием
внешней среды.
Ко второй группе относят цветные металлы и их сплавы. Они получили
такое название потому, что имеют различную окраску. Например, медь светло-
красная, никель, олово, серебро — белые, свинец — голубовато-белый, золото
-желтое. Из сплавов в практике нашли большое применение: бронза — сплав
меди с оловом и другими металлами, латунь — сплав меди с цинком, баббит —
сплав олова с сурьмой и медью и др.
Это деление на черные
С внешней стороны металлы, как известно, характеризуются прежде всего
особым «металлическим» блеском, который обусловливается их способностью
сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно
только в том случае, когда металл образует сплошную компактную массу.
Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в
порошок, но большинство металлов в мелкораздробленном виде имеет черный
или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и
электропроводностью, причем по способности проводить тепло и ток
располагаются в одном и том же порядке: лучшие проводники — серебро и медь,
худшие — свинец и ртуть. С повышением температуры электропроводность
падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая
механическая деформируемость. Металлы пластичны, они хорошо куются,
вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с
особенностями их внутренней структуры. Согласно современным воззрениям,
кристаллы металлов состоят из положительно заряженных ионов и свободных
электронов, отщепившихся от соответствующих атомов. Весь кристалл можно
себе представить в виде пространственной решетки, узлы которой заняты
ионами, а в промежутках между ионами находятся легкоподвижные электроны.
Эти электроны постоянно переходят от одних атомов к другим и вращаются
вокруг ядра то одного, то другого атома. Так как электроны не связаны с
определенными ионами, то уже под влиянием небольшой разности потенциалов
они начинают перемещаться в определенном направлении, т.е. возникает
электрический ток.
Наличием свободных электронов обусловливается и высокая
теплопроводность металлов. Находясь в непрерывном движении, электроны
постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому
колебания ионов, усилившиеся в данной части металла вследствие нагревания,
сейчас же передаются соседним ионам, от них — следующим и т.д., и тепловое
состояние металла быстро выравнивается; вся масса металла принимает
одинаковую температуру.
По плотности металлы условно подразделяются на две большие группы:
легкие металлы, плотность которых не больше 5 г/см3, и тяжелые металлы —
все остальные. Плотность, а также температуры плавления некоторых металлов
приведены в таблице №1.
Таблица №1
Плотность и температура плавления некоторых металлов.
|Название |Атомный вес |Плотность, |Температура |
| | |г/см3 |плавления, C | и8.
|Легкие металлы.| | | |
|Литий |6,939 |0,534 |179 |
|Калий |39,102 |0,86 |63,6 |
|Натрий |22,9898 |0,97 |97,8 |
|Кальций |40,08 |1,55 |850 |
|Магний |24,305 |1,74 |651 |
|Цезий |132,905 |1,90 |28,5 |
|Алюминий |26,9815 |2,702 |660,1 |
|Барий |137,34 |3,5 |710 |
|Тяжелые металлы| | | |
|Цинк |65,37 |7,14 |419 |
|Хром |51,996 |7,16 |1875 |
|Марганец |54,9380 |7,44 |1244 |
|Олово |118,69 |7,28 |231,9 |
|Железо |55,847 |7,86 |1539 |
|Кадмий |112,40 |8,65 |321 |
|Никель |58,71 |8,90 |1453 |
|Медь |63,546 |8,92 |1083 |
|Висмут |208,980 |9,80 |271,3 |
|Серебро |107,868 |10,5 |960,8 |
|Свинец |207,19 |11,344 |327,3 |
|Ртуть |200,59 |13,546 |-38,87 |
|Вольфрам |183,85 |19,3 |3380 |
|Золото |196,967 |19,3 |1063 |
|Платина |195,09 |21,45 |1769 |
|Осмий |190,2 |22,5 |2700 |
Частицы металлов, находящихся в твердом и жидком состоянии, связаны
особым типом химической связи — так называемой металлической связью. Она
определяется одновременным наличием обычных ковалентных связей между
нейтральными атомами и кулоновским притяжением между ионами и свободными
электронами. Таким образом, металлическая связь является свойством не
отдельных частиц, а их агрегатов.
Химические свойства металлов.
Основным химическим свойством металлов является способность их атомов
легко отдавать свои валентные электроны и переходить в положительно
заряженные ионы. Типичные металлы никогда не присоединяют электронов; их
ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны,
типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов
далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем
он активнее, тем энергичнее вступает во взаимодействие с другими
веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк
начинает растворяться, а из раствора выделяется свинец. Реакция выражается
уравнением:
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией
окисления-восстановления. Сущность ее сводится к тому, что атомы цинка
отдают свои валентные электроны ионам двухвалентного свинца, тем самым
превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в
виде металлического свинца. Если поступить наоборот, то есть погрузить
кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет.
Это показывает, что цинк более активен, чем свинец, что его атомы легче
отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Вытеснение одних металлов из их соединений другими металлами впервые
было подробно изучено русским ученым Бекетовым, расположившим металлы по их
убывающей химической активности в так называемый «вытеснительный ряд». В
настоящее время вытеснительный ряд Бекетова носит название ряда напряжений.
В таблице №2 представлены значения стандартных электродных
потенциалов некоторых металлов. Символом Me+/Me обозначен металл Me,
погруженный в раствор его соли. Стандартные потенциалы электродов,
выступающих как восстановители по отношению к водороду, имеют знак «-», а
знаком «+» отмечены стандартные потенциалы электродов, являющихся
окислителями.
Таблица №2
Стандартные электродные потенциалы металлов.
|Электрод |Е0,В |Электрод |Е0,В |
|Li+/Li |-3,02 |Co2+/Co |-0,28 |
|Rb+/Rb |-2,99 |Ni2+/Ni |-0,25 |
|K+/K |-2,92 |Sn2+/Sn |-0,14 |
|Ba2+/Ba |-2,90 |Pb2+/Pb |-0,13 |
|Sr2+ /Sr |-2,89 |H+/1/2h3 |0,00 |
|Ca2+/Ca |-2,87 |Sb3+/Sb |+0,20 |
|Na+/Na |-2,71 |Bi3+/Bi |+0,23 |
|La3+/La |-2,37 |Cu2+/Cu |+0,34 |
|Mg2+/Mg |-2,34 |Cu+/Cu |+0,52 |
|Al3+/Al |-1,67 |Ag+/Ag |+0,80 |
|Mn2+/Mn |-1,05 |Pd2+/Pd |+0,83 |
|Zn2+/Zn |-0,76 |Hg2+/Hg |+0,86 |
|Cr3+/Cr |-0,71 |Pt2+/Pt |+1,20 |
|Fe2+/Fe |-0,44 |Au3+/Au |+1,42 |
|Cd2+/Cd |-0,40 | | |
Металлы, расположенные в порядке возрастания их стандартных
электродных потенциалов, и образуют электрохимический ряд напряжений
металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni,
Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньше электродный потенциал металла, тем больше его
восстановительная способность.
2. Каждый металл способен вытеснять(восстанавливать) из растворов солей
те металлы, которые стоят в ряду напряжений после него.
3. Все металлы, имеющие отрицательный стандартный электродный
потенциал, то есть находящиеся в ряду напряжений левее водорода,
способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение
металлов и их солей только в водных растворах и при комнатной температуре.
Кроме того, нужно иметь ввиду, что высокая электрохимическая активность
металлов не всегда означает его высокую химическую активность. Например,
ряд напряжений начинается литием, тогда как более активные в химическом
отношении рубидий и калий находятся правее лития. Это связано с
исключительно высокой энергией процесса гидратации ионов лития по сравнению
с ионами других щелочных металлов.
studfile.net
Какие физические свойства характерны для всех металлов? Чем это обусловлено?
Физические свойства металлов. С внешней стороны металлы, как известно, характеризуются прежде всего особым металлическим блеском, который обусловливается их способностью сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно только в том случае, когда металл образует сплошную компактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в порошок, но большинство металлов в мелкораздробленном виде имеет черный или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и электропроводностью, причем по способности проводить тепло и ток располагаются в одном и том же порядке лучшие проводники — серебро и медь, худшие — свинец и ртуть. С повышением температуры электропроводность падает, при понижении температуры, наоборот, увеличивается. Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т. п. Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры. Согласно современным воззрениям, кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отщепившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т. е. возникает электрический ток. Наличием свободных электронов обусловливается и высокая теплопроводность металлов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них — следующим и т. д и тепловое состояние металла быстро выравнивается вся масса металла принимает одинаковую температуру. По плотности металлы условно подразделяются на две большие группы легкие металлы, плотность которых не больше 5 гсм3, и тяжелые металлы — все остальные. Понятно ли? Учебник по химии не пытались открыть?
Тяжёлые, холодные на ощупь. Обусловлено высокой плотностью и теплопроводностью соответственно.
википедию открыть какбэ не сложно
электропроводность
Высокая теплопроводност и электропроводность. Объясняется наличием большого количества свободных электронов.
touch.otvet.mail.ru
1.2. Основные свойства металлов и сплавов
Металлы и сплавы характеризуются комплексом физических, механических, химических и технологических свойств.
Физические свойства металлов и сплавов – блеск, плотность, температура плавления, теплопроводность, теплоемкость, электропроводность, магнитные свойства, расширяемость при нагревании и фазовых превращениях.
Механические свойства металлов и сплавов – твердость, упругость, прочность, хрупкость, пластичность, вязкость, износостойкость, сопротивление усталости, ползучесть.
Химические свойства металлов и сплавов определяют их способность сопротивляться воздействию окружающей среды. При контакте с окружающей средой металлы и сплавы подвергаются коррозии, растворяются окисляются и снижают свою жаропрочность.
Технологические свойства металлов и сплавов – ковкость, свариваемость, прокаливаемость, склонность к обезуглероживанию, обрабатываемость резанием, жидкотекучесть, закаливаемость. Они характеризуют способность металлов и сплавов обрабатываться различными методами. Кроме того, они позволяют определить, насколько экономически эффективно можно изготовить изделие.
Ковкость – способность металла и сплава обрабатываться путем пластического деформирования.
Свариваемость – способность металла и сплава образовывать неразъемное соединение, свойства которого близки к свойствам основного металла (сплава).
Прокаливаемость – способность металла и сплава закаливаться на определенную глубину.
Склонность к обезуглероживанию металла и сплава – возможность выгорания углерода в поверхностных слоях изделий из сплавов и сталей при нагреве в среде, содержащей кислород и водород.
Обрабатываемость резанием – поведение металла и сплава под воздействием режущего инструмента.
Жидкотекучесть – способность расплавленного металла и сплава заполнять литейную форму.
Закаливаемость – способность металла и сплава к повышению твердости при закалке (нагрев и быстрое охлаждение).
Физические свойства металлов и сплавов важны для самолетостроения, автомобилестроения, медицины, строительства, изготовления космических аппаратов и часто являются основными характеристиками, по которым определяют возможность использования того или иного металла или сплава.
Блеск – способность поверхности металла и сплава направленно отражать световой поток.
Плотность – масса единицы объема металла или сплава. Величину, обратную плотности, называют удельным объемом.
Температура плавления – это температура, при которой металл или сплав целиком переходит в жидкое состояние.
Теплопроводность – количество теплоты, проходящее в секунду через сечение в 1см2, когда на расстоянии в 1см изменение температуры составляет в 10С.
Теплоемкость – количество теплоты, необходимой для повышения температуры тела на 10С.
Электрическая проводимость – величина, обратная электрическому сопротивлению. Под удельным электрическим сопротивлением понимают электрическое сопротивление проводника длиной 1 м и площадью поперечного сечения в 10-6м2 при пропускании по нему электрического тока.
К магнитным свойствам металлов и сплавов относятся: начальная магнитная проницаемость, максимальная магнитная проницаемость, коэрцитивная сила, намагниченность насыщения, индукция насыщения, остаточная магнитная индукция, точка Кюри, петля гистерезиса.
При помещении стального образца в магнитное поле возникающая в нем магнитная индукция (b) является функцией напряженности магнитного поля (Нm).
Намагниченность (М)
пропорциональна напряженности магнитного
поля. Эти величины связаны между собой
коэффициентом 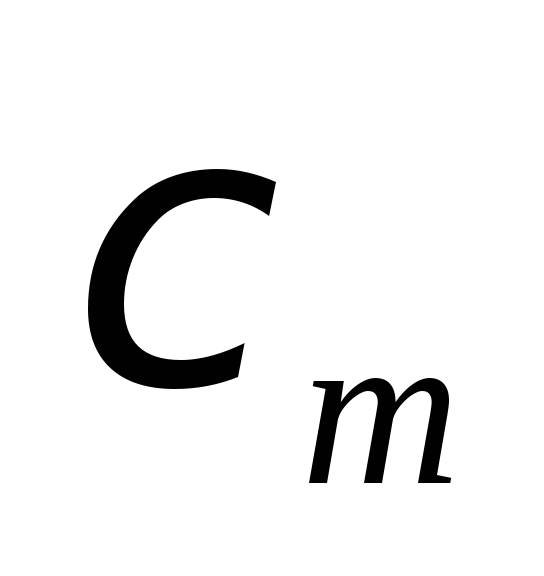 ,
который называется магнитной
восприимчивостью стали или сплава.
,
который называется магнитной
восприимчивостью стали или сплава.
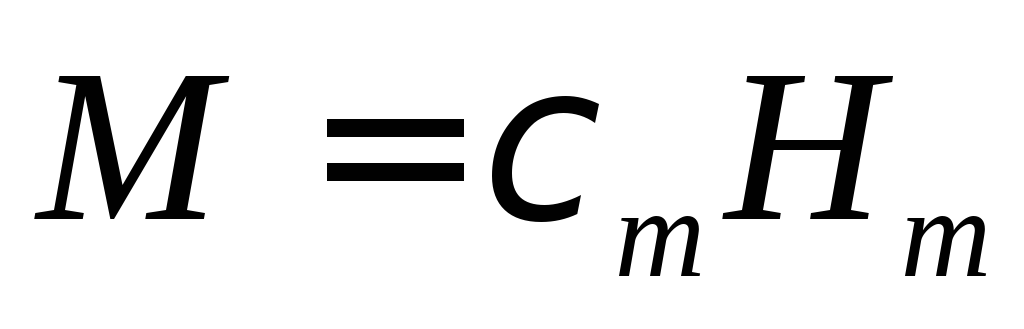 (1)
(1)
Между магнитной индукцией и напряженностью магнитного поля существует аналитическая связь
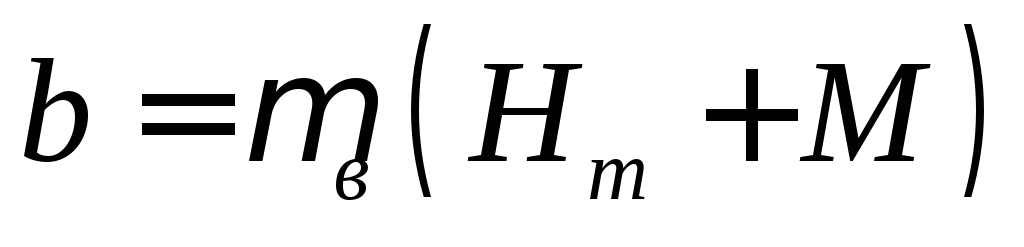 (2)
(2)
где 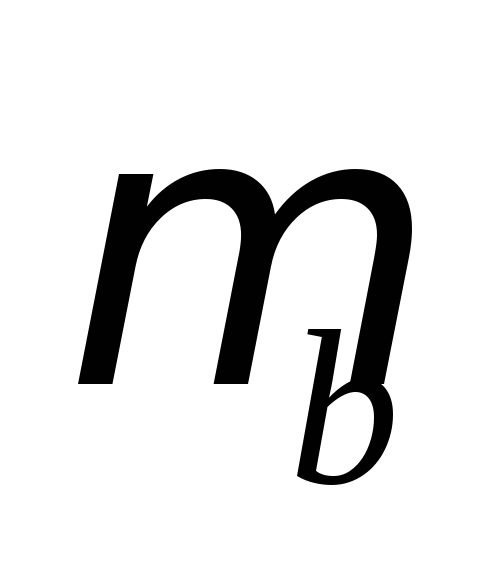 — магнитная проницаемость вакуума.
— магнитная проницаемость вакуума.
Для
ферромагнетиков (сплавов, способных
намагничиваться до насыщения в малых
магнитных полях) 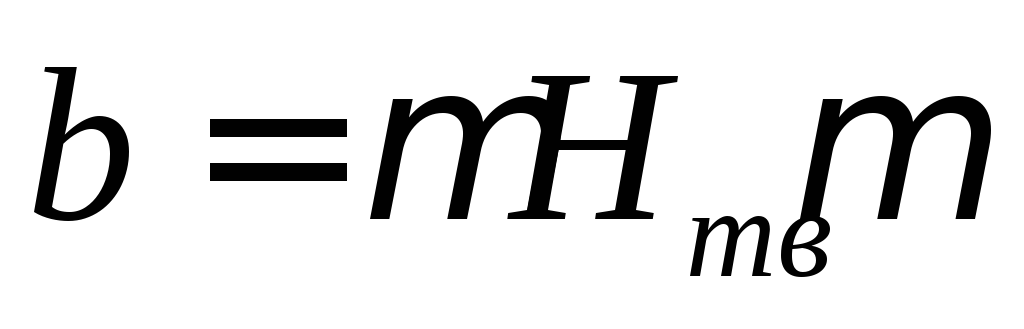 ,
где
,
где — коэффициент магнитной проницаемости.
— коэффициент магнитной проницаемости.
При намагничивании ферромагнитных материалов (стали, полученные соединением ферромагнетиков с парамагнетиками) намагниченность сначала плавно возрастает, потом резко повышается и постепенно достигает насыщения. При уменьшении напряженности магнитного поля Нm после намагничивания и реверсирования (изменение направления поля) его кривая изменения индукции образует замкнутую петлю. Эта петля называется петлей гистерезиса.
Основными
параметрами начальной кривой и петли
гистерезиса являются остаточная
индукция br, коэрцитивная
сила Нс, напряженность
насыщающего поля Нн и намагниченность
насыщения Мs.
По начальной кривой определяется кривая
магнитной проницаемости, в которой
основными точками являются начальная
магнитная проницаемость 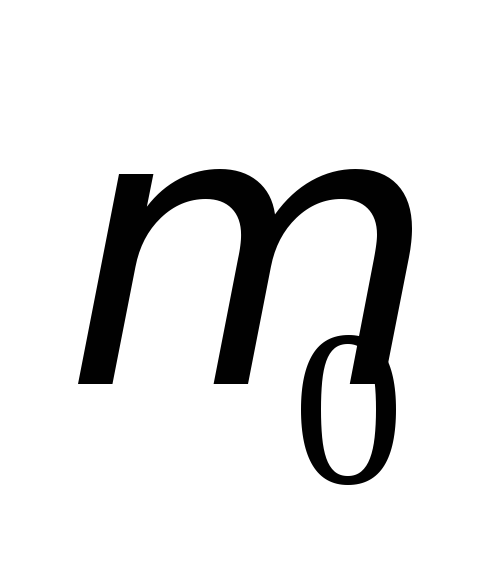 и максимальная магнитная проницаемость
и максимальная магнитная проницаемость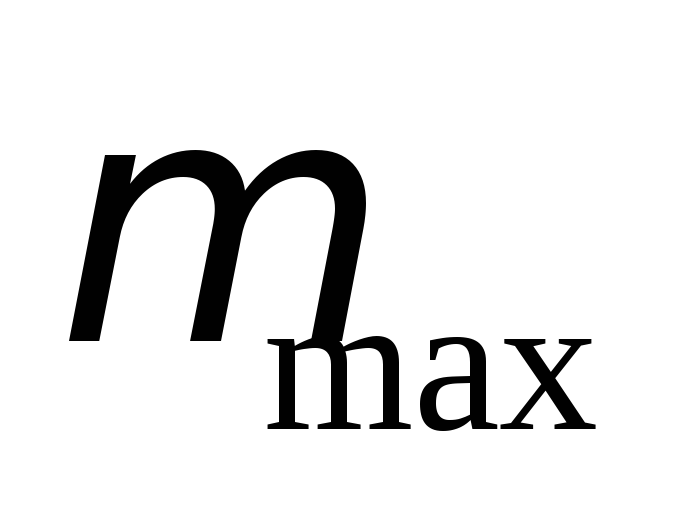 .
.
Наибольшее
значение индукции на петле гистерезиса
называется индукцией
насыщения  .
.
Ферромагнетики при нагреве до определенной температуры переходят в парамагнитное состояние (в состояние с малой магнитной восприимчивостью). Эта температура называется точкой Кюри. Точка Кюри определяется в основном химическим составом сплава или стали и не зависит от давлений, напряжений и других факторов.
Все характеристики ферромагнитных материалов можно разделить на структурно нечувствительные и структурно чувствительные. К структурно нечувствительным характеристикам относятся точка Кюри, намагниченность насыщения, зависящие от произвольной намагниченности, к структурно чувствительным – магнитная проницаемость, остаточная индукция и коэрцитивная сила.
Структурно нечувствительные характеристики ферромагнитных материалов зависят в основном от химического состава и числа фаз и практически не зависят от кристаллической структуры, размера частиц зерна металла. Следовательно, измерение точки Кюри, намагниченности насыщения и т.д. необходимо для качественного фазового анализа стали и сплава.
Измерение структурно чувствительных характеристик необходимо при изучении структурных изменений в сплавах и сталях при термической или механической обработке.
Магнитная проницаемость, коэрцитивная сила и остаточная индукция изменяются при обработке сплавов и сталей. Расширение при нагревании изделий из сталей и сплавов – изменение размеров и формы зерен, характеризуется температурными коэффициентами объемного расширения и линейного расширения. Расширение при нагревании в интервале температур фазовых превращений сталей и сплавов характеризуется коэффициентом линейного расширения отдельных фаз. Внутренние (фазовые и структурные) превращения в металлах и сплавах характеризуются изменением объема, линейных размеров и коэффициента расширения. При фазовых превращениях в металлах и сплавах происходит выделение или поглощение скрытой теплоты превращения, изменяется теплоемкость изделия. Поэтому при изменении структуры металла или сплава, нагреваемого или охлаждаемого с постоянной скоростью, могут появиться отклонения от нормальной кривизны на кривых изменения температуры по времени. По этим кривым, называемым термическими кривыми, определяют температуру (температурный интервал) превращения.
studfile.net
Основные свойства металлов
Металлы обладают механическими, технологическими, физическими и химическими свойствами.
К физическим свойствам относятся: цвет, плотность, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании и фазовых превращениях;
к химическим — окисляемость, растворимость, коррозионная стойкость, жароупорность;
к механическим — прочность, твердость, упругость, вязкость, пластичность, хрупкость;
к технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прочность — способность металла сопротивляться действию внешних сил, не разрушаясь.
Удельная прочность— отношение предела прочности к плотности.
Твердостью— называется способность тела противостоять проникновению в него другого тела.
Упругость— свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызывающих изменение формы (деформацию).
Вязкость— способность металла оказывать сопротивление ударным внешним силам. Вязкость — свойство обратное хрупкости.
Пластичность— свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил.
Современными методами испытания металлов являются механические испытания, химический, спектральный, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах.
Механические свойства. Первое требование, предъявляемое ко всякому изделию, — это достаточная прочность. Многие изделия, кроме общей прочности, должны обладать еще особыми свойствами, характерными для данного изделия. Например, режущие инструменты должны обладать высокой твердостью. Для изготовления режущих и других инструментов применяют инструментальные стали и сплавы, а для рессор и пружин — специальные стали, обладающие высокой упругостью.
Вязкие металлы применяют в тех случаях, когда детали при работе подвергаются ударной нагрузке.
Пластичность металлов дает возможность обрабатывать их давлением (ковать, прокатывать, штамповать).
Физические свойства. В авиа-, авто-, приборо-, и вагоностроении вес деталей часто является важнейшей характеристикой, поэтому сплавы алюминия и магния являются здесь особенно полезными.
Плавкостьиспользуется для получения отливок путем заливки расплавленного металла в формы. Легкоплавкие металлы (свинец) применяют в качестве закалочной среды для стали. Некоторые сложные сплавы имеют столь низкую температуру плавления, что расплавляются в горячей воде. Такие сплавы применяются для отливки топографических матриц, предохранителей в приборах пожарной безопасности.
Металлы с высокой электропроводностью(медь, алюминий) используют в электромашиностроении, в линиях электропередач, а сплавы с высоким электросопротивлением — для ламп накаливания, электронагревательных приборов.
Магнитные свойстваметаллов используются в электромашиностроении при производстве электродвигателей, трансформаторов в приборостроении (телефонные и телеграфные аппараты).
Теплопроводностьметаллов дает возможность равномерно нагревать их для обработки давлением, термической обработки, кроме того, она обеспечивает возможность пайки и сварки металлов.
Некоторые металлы имеют коэффициент линейного расширения, близкий к нулю; такие металлы применяют для изготовления точных приборов при сооружении мостов, путепроводов и др.
Химические свойства. Коррозионная стойкость особенно важна для изделий, работающих в химически активных средах (детали машин в химической промышленности). Для таких изделий используют сплавы с высокой коррозионной стойкостью — нержавеющие, кислотостойкие и жароупорные стали.
studfile.net
Свойства металлов и сплавов: химические, физические, механические, технологические
Металлические изделия и детали используются в разных сферах промышленности. Существует множество видов металлов и каждый из них обладает сильными и слабыми сторонами. При изготовлении деталей для машин, самолётов или промышленного оборудования мастера обращают внимание на характеристики материала. Поэтому требуется знать свойства металлов и сплавов.


Свойства металлов и сплавов
Признаки металлов
У металлов есть признаки, которые их характеризуют:
- Высокие показатели теплопроводности. Металлические материалы хорошо проводят электричество.
- Блеск на изломе.
- Ковкость.
- Кристаллическая структура.
Не все материалы прочные и обладают высокими показателя износоустойчивости. Это же касается плавления при высоких температурах.
Классификация металлов
Металлы разделяются на две большие группы — черные и цветные. Представители обоих видов различаются не только характеристиками, но и внешним видом.
Черные
Представители этой группы считаются самыми распространёнными и недорогими. В большинстве своем имеют серый или тёмный цвет. Плавятся при высокой температуре, обладают высокой твердостью и большой плотностью. Главный представитель этой группы — железо. Эта группа разделяется на подгруппы:
- Железные — к представителям этой подгруппы относится железо, никель и кобальт.
- Тугоплавкие — сюда входят металлы температура плавления которых начинается с 1600 градусов. Их применяют при создании основ для сплавов.
- Редкоземельные — к ним относятся церий, празеодим и неодим. Обладают низкой прочностью.
Существуют урановые и щелочноземельные металлы, однако они менее популярны.
Цветные
Представители этой группы отличаются яркой окраской, меньшей прочностью, твердостью и температурой плавления (не для всех). Разделяется эта группа на следующие подгруппы:
- Лёгкие — подгруппа, включающая в себя металлы с плотностью до 5000 кг/м3. Это такие материалы, как литий, натрий, калий, магний и другие.
- Тяжёлые — сюда относится серебро, медь, свинец и другие. Плотность превышает 5000 кг/м3.
- Благородные — представили этой подгруппы имеют высокую стоимость и устойчивость к коррозийным процессам. К ним относятся золото, палладий, иридий, платина, серебро и другие.
Выделяются тугоплавкие и легкоплавкие металлы. К тугоплавким относится вольфрам, молибден и ниобий, а к легкоплавким все остальные.
Основные виды сплавов
Человечество знакомо с различными металлическими сплавами. Самыми многочисленными из них являются соединения на основе железа. К ним относятся ферриты, стали и чугун. Ферриты имеют магнитные свойства, в чугуне содержится более 2,4% углерода, а сталь — это материал с высокой прочность и твердостью.
Отдельное внимания требуют металлические сплавы из цветных металлов.


Производство стали
Цинковые сплавы
Соединения металлов, которые плавятся при низких температурах. Смеси на основе цинка устойчивы к воздействию коррозийных процессов. Легко обрабатываются.
Алюминиевые сплавы
Популярность алюминий и сплавы на его основе получили во второй половине 20 века. Этот материал обладает такими преимуществами:
- Устойчивость к низким температурам.
- Электропроводность.
- Малый вес заготовок в сравнении с другими металлами.
- Износоустойчивость.
Однако нельзя забывать про то, что алюминий плавится при низких температурах. При температуре около 200 градусов характеристики ухудшаются.
Алюминий применяется при изготовлении комплектующих к машинам, производстве деталей для самолётов, составляющих промышленного оборудования, посуды, инструментов. Не многие знают, что алюминий популярен в сфере производства оружия. Связано это с тем, что детали из алюминия не искрят при сильном трении.
Чтобы увеличить прочность детали, алюминий смешивают с медью. Чтобы заготовка выдерживала давление — с марганцем. Кремний добавляют, чтобы получить обычную отливку.
Алюминий. Сплавы алюминия. Алюминиевые рамы для велосипеда.
Watch this video on YouTube
Медные сплавы
Сплавы на основе меди — марки латуни. Из этого материала изготавливаются детали высокой точности, так как латунь легко обрабатывать. В составе сплава может содержаться до 45% цинка.
Свойства сплавов
Чтобы изготавливать детали и конструкции, нужно знать основные свойства металлов и сплавов. При неправильной обработке готовая деталь может быстро выйти из строя и разрушить оборудование.


Двигатель внутреннего сгорания
Физические свойства
Сюда относятся визуальные параметры и характеристики материала, изменяющиеся при обработке:
- Теплопроводность. От этого зависит насколько поверхность будет передавать тепло при нагревании.
- Плотность. По этому параметру определяется количество материла, которое содержится в единице объёма.
- Электропроводность. Возможность металла проводить электрический ток. Этот параметр называется электрическое сопротивление.
- Цвет. Этот визуальный показатель меняется под воздействием температур.
- Прочность. Возможность материала сохранять структуру при обработке. Сюда же относится твердость. Эти показатели относятся и к механическим свойствам.
- Восприимчивость к действию магнитов. Это возможность материала проводить через себя магнитные лучи.
Физические основы позволяют определить в какой сфере будет использоваться материал.
Химические свойства
Сюда относятся возможности материала противостоять воздействию химических веществ:
- Устойчивость к коррозийным процессам. Этот показатель определяет на сколько материал защищён от воздействия воды.
- Растворимость. Устойчивость металла к воздействию растворителей — кислотам или щелочным составам.
- Окисляемость. Параметр указывает на выделение оксидов металлом при его взаимодействии с кислородом.
Обуславливаются эти характеристики химическим составом материала.
Механические свойства
Механические свойства металлов и сплавов отвечают за целостность структуры материала:
- прочность;
- твердость;
- пластичность;
- вязкость;
- хрупкость;
- устойчивость к механическим нагрузкам.
Технологические свойства
Технологические свойства определяют способность металла или сплава изменяться при обработке:
- Ковкость. Обработка заготовки давлением. Материал не разрушается. Структура изменяется.
- Свариваемость. Восприимчивость детали к работе сварочным оборудованием.
- Усадка. Происходит этот процесс при охлаждении заготовки после её разогрева.
- Обработка режущим инструментом.
- Ликвация (затвердевание жидкого металла при понижении температуры).
Основной способ обработки металлических деталей — нагревание.
Свойства металлов и сплавов отвечают за то, как себя будет вести готовое изделие при эксплуатации. При обработке материалов также важно знать его характеристики.
Химия 48. Свойства металлов и сплавов. Катализаторы горения — Академия занимательных наук
Watch this video on YouTube
metalloy.ru