Формулы солей: принципы составления | Студенческая жизнь
 Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой h4PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
 Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
 Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
 Валентность остатка HPO4 равна двум, так как в кислоте h4PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Валентность остатка HPO4 равна двум, так как в кислоте h4PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
 Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (h3SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.

Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(Nh4)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
life-students.ru
|
|
| |||||||||
nscience.ru
Средние, кислые и основные соли
⇐ ПредыдущаяСтр 11 из 11Все рассмотренные выше соли являются нормальными или средними солями. Молекулы их содержат катион металла (или аммония NH4+) и кислотный остаток, не содержащий водорода. Кроме средних солей, различают кислые соли и основные соли.
Кислые соли– это продукты неполного замещения водорода кислоты на металл – результат и подтверждение ступенчатого характера диссоциации многоосновных кислот.
Первая ступень диссоциации Примеры кислых солей
серной кислоты: серной кислоты:
H2SO4 ↔ H+ + HSO4— NaHSO4, Ca(HSO4)2, Al(HSO4)3.
Примеры кислых солей ортофосфорной кислоты:
Na2+HPO42- –– гидрофосфат натрия,
Na+H2PO4— –– дигидрофосфат натрия,
Ca2+(H2PO4)2— –– дигидрофосфат кальция.
Основные соли – продукты неполного замещения гидроксильных групп основания на кислотный остаток – результат и подтверждение ступенчатого характера диссоциации многоатомных оснований.
Ступенчатая диссоциация: Примеры основных солей:
1. Fe(OH)3 ↔ Fe(OH)2+ + OH— Fe(OH)2Cl, Fe(OH)2NO3, [Fe(OH)2]2SO4.
.
2. Fe(OH)2+ ↔ FeOH2+ + OH— FeOHCl2, FeOH(NO3)2, FeOHSO4.
Названия солейобобщены в табл.1 приложения 2 и в ремарке после таблицы.
Графические формулы
Графическая формула показывает, в каком порядке и каким количеством валентных связей атомы связаны друг с другом. При составлении графической формулы:
– каждый атом обозначается символом своего элемента, так что химических знаков элемента в графическом изображении столько, сколько соответствующих атомов,
– каждая валентная связь между атомами обозначается черточкой,
— как правило, соединяют положительно заряженный атом с отрицательно заряженным.
Посмотрим на графические формулы оксида натрия Na2O:

 правильно неправильно
правильно неправильно
 Na Na Na Na
Na Na Na Na
O O
 |
Na –– O –– Na Na –– Na –– O



 Представим графически формулу СО2. Перед построением графической формулы целесообразно определить степени окисления атомов, входящих в состав молекулы. Так в молекуле CO2 атом углерода четырехвалентен, имеет степень окисления 4+; кислород двухвалентен, 2-. От символа «С» должно исходить 4 черточки:
Представим графически формулу СО2. Перед построением графической формулы целесообразно определить степени окисления атомов, входящих в состав молекулы. Так в молекуле CO2 атом углерода четырехвалентен, имеет степень окисления 4+; кислород двухвалентен, 2-. От символа «С» должно исходить 4 черточки:
==С==
 В электронейтральной молекуле все валентные связи должны быть «замкнуты». Значит, два атома О «замкнут» по две черточки каждый:
В электронейтральной молекуле все валентные связи должны быть «замкнуты». Значит, два атома О «замкнут» по две черточки каждый:
O == C == O.
 |

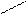 Для некоторых оксидов возможно несколько равноценных вариантов построения графических формул: О
Для некоторых оксидов возможно несколько равноценных вариантов построения графических формул: О
O == Al –– O –– Al == O; Al –– O –– Al
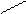
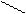 O
O
При написании графических формул кислородных кислот необходимо определить степень окисления центрального атома по известным степеням окисления кислорода (2-) и водорода (1+). Число валентных черточек около каждого атома должно отвечать степени его окисления. Следует помнить, что водород соединяется с центральным атомом только через кислород, т.е. в кислородных кислотах присутствуют группы OH. Именно с этих групп, связанных с элементом, образующим кислоту, и удобно начинать составление графической формулы кислоты.
Пример: Изобразить графически формулу серной кислоты H2SO4.
В молекуле серной кислоты 2 атома водорода, значит в ней присутствуют 2 гидроксильные группы HO—. Соединим их с атомом серы «S»
H¾O
\
S
/
H¾ O
Для завершения графического изображения добавим к атому серы оставшиеся атомы кислорода (их два), используя двойные связи
H¾O O
\ //
S
/ \\
H¾O O
Формула завершена. Ниже приводятся графические формулы некоторых кислот
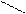
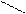


 Н –– О Н –– О Н –– О
Н –– О Н –– О Н –– О
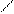

 Н –– О ––– Р = О С = О; Si = О
Н –– О ––– Р = О С = О; Si = О
Н –– О Н –– О Н –– О
ортофосфорная H3PO4 угольная Н2CO3 кремниевая H2SiO4
Изображение графических формул солей удобнее начинать с построения кислотного остатка. Например для силиката бария BaSiO3 кислотный остаток получаем, учитывая, что это остаток кремниевой кислоты, он имеет вид

O ––
½
O == Si
½
O ––
В отличие от электронейтральной молекулы кислоты, он потерял два атома водорода. Этот кислотный остаток обеими своими свободными связями в молекуле BaSiO3 связан с атомом бария, который имеет степень окисления 2+
O
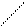 |  |

 O == Si Ba
O == Si Ba
O
Построение графической формулы кислоты – наиболее сложная задача, равноценная детской игре с пазлами. Предлагается следующая последовательность действий. Надо использовать все атомы, входящие в формулу; надо обеспечить их соединение в единое целое, но так, чтобы положительно заряженные атомы «рукопожимались» только с отрицательно заряженными. При этом количество валентных черточек, исходящих из каждого атома, должно соответствовать его степени окисления (заряду).
Упражнение 1. Постройте графические формулы высших оксидов Si, V, W, B.
Упражнение 2. Постройте графические формулы Mg(NO3)2, MgSO4, AlPO4, Ca3(PO4)2, NaBO2
Приложение 2
Справочные таблицы
Таблица 1
infopedia.su