Качественный и количественный состав органических веществ. Простейшая и молекулярная формулы
Состав веществ отражают химические формулы.
Химические формулы показывают, какие атомы и в каких соотношениях входят в данное вещество. Для большинства неорганических веществ формула обычно отражает не только состав, но и ряд свойств, например, NaCl, HCl, MgCl2.
В отличие от неорганических, в совершенно разных органических соединениях могут содержаться одни и те же элементы в одинаковых соотношениях.
Известно очень много соединений, которые соответствуют составу CH2. Это, например, газы этилен С2Н4 и циклопропан С3Н6, жидкости циклогексан С6Н12 и гексен С6Н12, твердый полиэтилен (-C2H4-)n и многие другие вещества.
Формулу CH2 для всех перечисленных веществ называют простейшей. Она показывает, что в составе молекул этих веществ на один атом углерода приходится два атома водорода.
Формулу, отражающую соотношение атомов в молекуле вещества, называют простейшей формулой.
Молекулы органических веществ с одинаковой простейшей формулой могут содержать разное число атомов при их одинаковом соотношении.
Поэтому простейшей формулы недостаточно для описания органического соединения.
Общее число атомов каждого элемента в молекуле описывается молекулярной формулой.
Одной простейшей формуле могут соответствовать много молекулярных формул.
Формула, которая показывает порядок соединения атомов в молекуле, называется структурной формулой.
Гексен и циклогексан имеют одинаковые молекулярные формулы С6Н12, но это два разных вещества с разными физическими и химическими свойствами. См. табл. 1.
|
Вещество C6H12 |
Физическое свойство |
Химическое свойство |
|
Гексен (гексен-1) |
Кипит при 63,40С |
Реагирует с бромом в темноте при 200С |
|
Циклогексан |
Кипит при 88,70С |
НЕ реагирует с бромом в темноте при 200С |
Табл. 1. Различие свойств гексена и циклогексана
Для характеристики органического вещества необходимо знать не только состав молекулы, но и порядок расположения атомов в молекуле – строение молекулы.
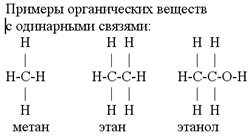
Строение веществ отражают структурные (графические) формулы, в которых ковалентные связи между атомами обозначают черточками – валентными штрихами.
В органических соединениях углерод образует четыре связи, водород – одну, кислород – две, а азот – три.
Валентность.Число ковалентных неполярных или полярных связей, которые может образовывать элемент, называют валентностью
Связь, которая образована одной парой электронов, называется простой или одинарной связью.
Связь, которая образована двумя парами электронов, называется двойной связью, ее обозначают двумя черточками, как знак «равно». Три электронных пары образуют тройную связь, которую обозначают тремя черточками. См. табл. 2.
|
|
|
|
Табл. 2. Примеры органических веществ с разными связями
На практике обычно применяют сокращенные структурные формулы, в которых не обозначены связи углерода, кислорода и других атомов с водородом:

Рис. 1. Объёмная модель молекулы этанола
Структурные формулы передают порядок, в котором атомы соединены друг с другом, но не передают расположение атомов в пространстве. Структурные формулы – это двумерный рисунок, а молекулы трехмерны, т.е. объемны, это показано на примере этанола на рис. 1.
На уроке освещался вопрос о качественных и количественных составах органических веществ, о том, что представляет собой простейшая, молекулярная, структурная формула.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 6-7 (с.11) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. –М.: Просвещение, 2012.
2. Почему органические вещества, состав которых отражается одной и той же молекулярной формулой, имеют разные и химические и физические свойства?
3. Что показывает простейшая формула?
interneturok.ru
Структурные формулы органических веществ
| этан | Алканы | этан |
| пропан | Алканы | пропан |
| 2-метилпропан | Алканы | 2-метилпропан |
| н-бутан | н-бутан | |
| 2,2-диметилпропан | Алканы | 2,2-диметилпропан |
| 2-метилбутан | Алканы | 2-метилбутан |
| н-пентан | Алканы | н-пентан |
| 2,2-диметилбутан | Алканы | 2,2-диметилбутан |
| 2,3-диметилбутан | Алканы | 2,3-диметилбутан |
| 2-метилпентан | Алканы | 2-метилпентан |
| 3-метилпентан | Алканы | 3-метилпентан |
| н-гексан | Алканы | н-гексан |
| 2,2,3-триметилбутан | Алканы | 2,2,3-триметилбутан |
| 2,2-диметилпентан | Алканы | 2,2-диметилпентан |
| 2,3-диметилпентан | Алканы | 2,3-диметилпентан |
| 2,4-диметилпентан | Алканы | 2,4-диметилпентан |
| 2-метилгексан | Алканы | 2-метилгексан |
| 3,3-диметилпентан | Алканы | 3,3-диметилпентан |
| 3-метилгексан | Алканы | 3-метилгексан |
| 3-этилпентан | Алканы | 3-этилпентан |
| н-гептан | Алканы | н-гептан |
| 2,2,3,3-тетраметилбутан | Алканы | 2,2,3,3-тетраметилбутан |
| 2,2,3-триметилпентан | Алканы | 2,2,3-триметилпентан |
| 2,2,4-триметилпентан | Алканы | 2,2,4-триметилпентан |
| 2,2-диметилгексан | Алканы | 2,2-диметилгексан |
| 2,3,3-триметилпентан | Алканы | 2,3,3-триметилпентан |
| 2,3,4-триметилпентан | Алканы | 2,3,4-триметилпентан |
| 2,3-диметилгексан | Алканы | 2,3-диметилгексан |
| 2,4-диметилгексан | Алканы | 2,4-диметилгексан |
| 2,5-диметилгексан | Алканы | 2,5-диметилгексан |
| 2-метил-3-этилпентан | Алканы | 2-метил-3-этилпентан |
| 2-метилгептан | Алканы | 2-метилгептан |
| 3,3-диметилгексан | Алканы | 3,3-диметилгексан |
| 3,4-диметилгексан | Алканы | 3,4-диметилгексан |
| 3-метил-3-этилпентан | Алканы | 3-метил-3-этилпентан |
| 3-метилгептан | Алканы | 3-метилгептан |
| 3-этилгексан | Алканы | 3-этилгексан |
| 4-метилгептан | Алканы | 4-метилгептан |
| н-октан | Алканы | н-октан |
| 2,2,3,3-тетраметилпентан | Алканы | 2,2,3,3-тетраметилпентан |
| 2,2,3,4-тетраметилпентан | Алканы | 2,2,3,4-тетраметилпентан |
| 2,2,3-триметилгексан | Алканы | 2,2,3-триметилгексан |
| 2,2,4,4-тетраметилпентан | Алканы | 2,2,4,4-тетраметилпентан |
| 2,2,4-триметилгексан | Алканы | 2,2,4-триметилгексан |
| 2,2,5-триметилгексан | 2,2,5-триметилгексан | |
| 2,2-диметил-3-этилпентан | Алканы | 2,2-диметил-3-этилпентан |
| 2,2-диметилгептан | Алканы | 2,2-диметилгептан |
| 2,3,3,4-тетраметилпентан | Алканы | 2,3,3,4-тетраметилпентан |
| 2,3,3-триметилгексан | Алканы | 2,3,3-триметилгексан |
| 2,3,4-триметилгексан | Алканы | 2,3,4-триметилгексан |
| 2,3,5-триметилгексан | Алканы | 2,3,5-триметилгексан |
| 2,3-диметил-3-этилпентан | Алканы | 2,3-диметил-3-этилпентан |
| 2,3-диметилгептан | Алканы | 2,3-диметилгептан |
| 2,4,4-триметилгексан | Алканы | 2,4,4-триметилгексан |
| 2,4-диметил-3-этилпентан | Алканы | 2,4-диметил-3-этилпентан |
| 2,4-диметилгептан | Алканы | 2,4-диметилгептан |
| 2,5-диметилгептан | Алканы | 2,5-диметилгептан |
| 2,6-диметилгептан | Алканы | 2,6-диметилгептан |
| 2-метил-3-этилгексан | Алканы | 2-метил-3-этилгексан |
| 2-метил-4-этилгексан | Алканы | 2-метил-4-этилгексан |
| 2-метилоктан | Алканы | 2-метилоктан |
| 3,3,4-триметилгексан | Алканы | 3,3,4-триметилгексан |
| 3,3-диметилгептан | Алканы | 3,3-диметилгептан |
| 3,3-диэтилпентан | Алканы | 3,3-диэтилпентан |
| 3,4-диметилгептан | Алканы | 3,4-диметилгептан |
| 3,5-диметилгептан | Алканы | 3,5-диметилгептан |
| 3-метил-3-этилгексан | Алканы | 3-метил-3-этилгексан |
| 3-метил-4-этилгексан | Алканы | 3-метил-4-этилгексан |
| 3-метилоктан | Алканы | 3-метилоктан |
| 3-этилгептан | Алканы | 3-этилгептан |
| 4,4-диметилгептан | Алканы | 4,4-диметилгептан |
| 4-метилоктан | Алканы | 4-метилоктан |
| 4-этилгептан | Алканы | 4-этилгептан |
| н-нонан | Алканы | н-нонан |
| 2,2,3,3,4-пентаметилпентан | Алканы | 2,2,3,3,4-пентаметилпентан |
| 2,2,3,3-тетраметилгексан | Алканы | 2,2,3,3-тетраметилгексан |
| 2,2,3,4,4-пентаметилпентан | Алканы | 2,2,3,4,4-пентаметилпентан |
| 2,2,3,4-тетраметилгексан | Алканы | 2,2,3,4-тетраметилгексан |
| 2,2,3,5-тетраметилгексан | Алканы | 2,2,3,5-тетраметилгексан |
| 2,2,3-триметил-3-этилпентан | Алканы | 2,2,3-триметил-3-этилпентан |
| 2,2,3-триметилгептан | Алканы | 2,2,3-триметилгептан |
| 2,2,4,4-тетраметилгексан | Алканы | 2,2,4,4-тетраметилгексан |
| 2,2,4,5-тетраметилгексан | Алканы | 2,2,4,5-тетраметилгексан |
| 2,2,4-триметил-3-этилпентан | Алканы | 2,2,4-триметил-3-этилпентан |
| 2,2,4-триметилгептан | Алканы | 2,2,4-триметилгептан |
| 2,2,5,5-тетраметилгексан | Алканы | 2,2,5,5-тетраметилгексан |
| 2,2,5-триметилгептан | Алканы | 2,2,5-триметилгептан |
| 2,2,6-триметилгептан | Алканы | 2,2,6-триметилгептан |
| 2,2-диметил-3-этилгексан | Алканы | 2,2-диметил-3-этилгексан |
| 2,2-диметил-4-этилгексан | Алканы | 2,2-диметил-4-этилгексан |
| 2,2-диметилоктан | Алканы | 2,2-диметилоктан |
| 2,3,3,4-тетраметилгексан | Алканы | 2,3,3,4-тетраметилгексан |
| 2,3,3,5-тетраметилгексан | Алканы | 2,3,3,5-тетраметилгексан |
| 2,3,3-триметилгептан | Алканы | 2,3,3-триметилгептан |
| 2,3,4,4-тетраметилгексан | Алканы | 2,3,4,4-тетраметилгексан |
| 2,3,4,5-тетраметилгексан | Алканы | 2,3,4,5-тетраметилгексан |
| 2,3,4-триметил-3-этилпентан | Алканы | 2,3,4-триметил-3-этилпентан |
| 2,3,4-триметилгептан | Алканы | 2,3,4-триметилгептан |
| 2,3,5-триметилгептан | Алканы | 2,3,5-триметилгептан |
| 2,3,6-триметилгептан | Алканы | 2,3,6-триметилгептан |
| 2,3-диметил-3-этилгексан | Алканы | 2,3-диметил-3-этилгексан |
| 2,3-диметил-4-этилгексан | Алканы | 2,3-диметил-4-этилгексан |
| 2,3-диметилоктан | Алканы | 2,3-диметилоктан |
| 2,4,4-триметилгептан | Алканы | 2,4,4-триметилгептан |
| 2,4,5-триметилгептан | Алканы | 2,4,5-триметилгептан |
| 2,4,6-триметилгептан | Алканы | 2,4,6-триметилгептан |
| 2,4-диметил-3-этилгексан | Алканы | 2,4-диметил-3-этилгексан |
| 2,4-диметил-4-этилгексан | Алканы | 2,4-диметил-4-этилгексан |
| 2,4-диметилоктан | Алканы | 2,4-диметилоктан |
| 2,5,5-триметилгептан | Алканы | 2,5,5-триметилгептан |
| 2,5-диметил-3-этилгексан | Алканы | 2,5-диметил-3-этилгексан |
| 2,5-диметилоктан | Алканы | 2,5-диметилоктан |
| 2,6-диметилоктан | Алканы | 2,6-диметилоктан |
| 2,7-диметилоктан | Алканы | 2,7-диметилоктан |
| 2-метил-3,3-диэтилпентан | Алканы | 2-метил-3,3-диэтилпентан |
| 2-метил-3-этилгептан | Алканы | 2-метил-3-этилгептан |
| 2-метил-4-этилгептан | Алканы | 2-метил-4-этилгептан |
| 2-метил-5-этилгептан | Алканы | 2-метил-5-этилгептан |
| 2-метилнонан | Алканы | 2-метилнонан |
| 3,3,4,4-тетраметилгексан | Алканы | 3,3,4,4-тетраметилгексан |
| 3,3,4-триметилгептан | Алканы | 3,3,4-триметилгептан |
| 3,3,5-триметилгептан | Алканы | 3,3,5-триметилгептан |
| 3,3-диметил-4-этилгексан | Алканы | 3,3-диметил-4-этилгексан |
| 3,3-диметилоктан | Алканы | 3,3-диметилоктан |
| 3,3-диэтилгексан | Алканы | 3,3-диэтилгексан |
| 3,4,4-триметилгептан | Алканы | 3,4,4-триметилгептан |
| 3,4,5-триметилгептан | Алканы | 3,4,5-триметилгептан |
| 3,4-диметил-3-этилгексан | Алканы | 3,4-диметил-3-этилгексан |
| 3,4-диметилоктан | Алканы | 3,4-диметилоктан |
| 3,4-диэтилгексан | Алканы | 3,4-диэтилгексан |
| 3,5-диметилоктан | Алканы |
gomolog.ru
Строение органических веществ — урок. Химия, 8–9 класс.
Атомы углерода отличаются от атомов других элементов тем, что способны образовывать устойчивые химические связи друг с другом. Они могут связываться в цепи разной длины. Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Между атомами углерода могут образовываться одинарные, двойные и тройные связи.
Молекулы органических веществ состоят обычно из атомов неметаллов, поэтому в них присутствуют ковалентные связи. Число ковалентных связей, которые образует атом, определяет его валентность.
В основе органической химии лежит теория химического строения органических веществ А. М. Бутлерова. Её основные положения:
Атомы в молекулах органических веществ соединены в определённом порядке в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен, кислород — двухвалентен, а водород и галогены — одновалентны.
В молекуле метилового спирта атом углерода соединён ковалентными связями с четырьмя другими атомами, атом кислорода — с двумя, а каждый атом водорода образует одну ковалентную связь.
Свойства веществ зависят не только от состава молекул, но и от порядка соединения атомов в них,
т. е. от химического строения.
Рассмотрим второе положение на примере вещества, имеющего состав: C2h5Cl2.
Состав веществ одинаковый, а порядок соединения атомов в них разный. В молекуле первого вещества атомы хлора соединены с разными атомами углерода, а в молекуле второго — с одним. Свойства веществ отличаются. Так, температура кипения первого вещества — \(–96,7\) °С, а второго — \(–42,0\) °С.
При составлении структурных формул органических веществ сначала записывают символы углерода, связывая их между собой; затем с учётом четырёхвалентности атома углерода записывают символы других элементов.
Структурная формула углеводорода, состоящего из трёх атомов углерода и восьми атомов водорода, строится следующим образом:
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 193 с.
www.yaklass.ru
Выполнение упражнений на составление структурных формул и названий для алканов. Решение задач на нахождение молекулярной формулы органических веществ
департамент образования, науки и молодежной политики
Воронежской области
государственное бюджетное ПРОФЕССИОНАЛЬНОЕ
образовательное учреждение Воронежской области
«воронежский государственный ПРОМЫШЛЕННО-гуманитарный колледж»
( ГБПОУ ВО «ВГПГК»)
Методическая разработкапрактической работы
Выполнение упражнений на составление структурных формул
и названий для алканов. Решение задач на нахождение
молекулярной формулы органических веществ
Дисциплина: Химия
для специальностей 1 курса
Разработал: преподаватель химии Плотникова О.В.
г. Воронеж, 2016
Тема: Выполнение упражнений на составление структурных формул и названий алканов. Решение задач по уравнению реакций.
Цель работы:
1.научиться называть алканы по систематической номенклатуре;
2.составлять молекулярные и структурные формулы углеводов и их галогенопроизводных;
3.продолжить формировать навыки решения задач.
Правила выполнения практического занятия:
1.ознакомиться с теоретическим обоснованием практического занятия;
2.в соответствии с одним из вариантов произвести расчеты по формулам и уравнениям;
3.оформить отчет;
4.ответить на контрольные вопросы;
5.сдать зачет по практическому занятию.
Теоретическая часть
Алканы являются простейшими углеводородами. Все атомы углерода в них связаны друг с другом простыми одинарными связями. Алканы называют также парафинами, предельными, или насыщенными, углеводородами.
Простейшим алканом является метан СН4
Вещества состав которых отличается от состава метана на целое число групп СН2 (СН2 — гомологическая разность), являются гомологами метана. Совокупность гомологов называется гомологическим рядом.
Первые десять членов гомологического ряда метана:
- метан
CH4
этан
C2H6
пропан
C3H8
бутан
C4H10
пентан
C5H12
гексан
C6H14
гептан
C7H16
октан
C8H18
нонан
C9H20
декан
C10H22
Состав молекул всех алканов отвечает общей формуле
СхН2х+2 где х = 1, 2, 3,4…
При отщеплении одного или нескольких атомов водорода от молекулы алкана образуется углеводородный радикал, который являемся структурным элементом многих алканов, например: метил – СН3— ;этил — С2Н5-; пропил — C3Н7 (н-пропил или изопропил)
Изомерия. Первые три члена гомологического ряда метана не имеют изомеров. Бутан имеет два изомера:
СН3 – СН2 – СН2 – СН3 СН3 – СН2 – СН3
нормальный бутан
СН3
изобутан
Последующие члены ряда метана имеют большее число изомеров. Изомерия алканов обусловлена разветвленностью углеродного скелета.
Номенклатура. Наиболее удобной является заместительная номенклатура, которая рекомендована ИЮПАК. Ее также называют Женевской. Название углеводорода дается в определенной последовательности.
1. Выбираем наиболее длинную цепь атомов углерода в молекуле, например:
2.Нумеруем эту углеродную цепь, начиная с того конца, к которому ближе расположены разветвления. В нашем, примере имеем:
если заместители находятся на равных расстояниях от конца цепи, то нумерацию начинают с более разветвленного конца, например:
Если и разветвленность главной цепи одинакова, то нумерацию начинают с того конца ближе к которому находится радикал, название которого стоит раньше в алфавитном порядке
3. Основу (корень) названия определяет углеводород, содержащий столько же атомов, сколько их содержится в пронумерованной цепи, например: 4 атома – бутан, 9 атомов – нонан и т.д. Перед корнем ставят цифру, показывающую номер атома углерода в главной цепи, у которого имеется разветвленность и название углеводородного радикала, стоящего в боковой цепи. Если боковые радикалы одинаковы, то перечисляют цифры, указывающие их положение, а число этих радикалов указывают приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д. Радикалы, если они различны, перечисляют в алфавитном порядке. Например:
Рациональная номенклатура для предельных углеводородов рассматривает их как производные метана, в котором один или несколько атомов водорода замещены на углеводородные радикалы. При этом за метан принимается тот углеродный атом, у которого больше всего заместителей (радикалов). Радикалы перечисляются в порядке усложнения, а если имеется несколько одинаковых заместителей, то перед их названием ставят греческие числительные (ди – два, три – три, тетра – четыре, пента – пять и т.д.).
Теоретическая часть
Химическая формула — условная запись состава вещества посредством химических знаков и индексов. Она отображает качественный и количественный состав условной (для веществ немолекулярного строения) или реальной молекулы вещества.
Массовая доля элемента в веществе (ω) показывает, какую часть относительной молекулярной массы вещества составляет относительная атомная масса элемента, умноженная на индекс (n) при знаке элемента в формуле. Массовая доля — величина безразмерная. Выражается в долях от единицы или в процентах
п • Аr(элемента)
ω( С) =
Мr(вещества)
Пример 1. Вычислите массовые доли элементов в соединении С4Н10.
Решение Мг(С4Н10) = 58, тогда массовая доля углерода
массовая доля водорода
п * Ar (H)
ѡ (Н) =———————= 10*1/58=17,24%
Мr (C4H10)
Молярный объем (Vm) — это отношение объема газообразного вещества к количеству вещества в этом объеме при любых условиях
При нормальных условиях (н.у.) объем 1 моль любого газа равен 22,4 л. Постоянная Vm, равная 22,4 л/моль, называется молярным объемом газа при нормальных условиях.
Относительная плотность газов (D) – это отношение масс равных объемов различных газов при одинаковых условиях (р, Т одинаковы для обоих газов)
при V1 =V2
При этих условиях, согласно закону Авогадро, в данных газах содержится одинаковое число молекул. Но массы взятых газов окажутся неодинаковыми, следовательно, они будут относиться друг к другу как их молярные массы
и М1 = М2D
если плотность измерена по водороду (DH2):Mr2 = 2, то Mr1 = 2DH2
Если плотность измерена по воздуху (Deoзд):
Mr2= 29, то Mr1 = 29Dвозд, где 29 – средняя молекулярная масса воздуха.
Пример 2
При сгорании 1,3 г вещества образуется 4,4 г оксида углерода (IV) и 0,9 г воды. Плотность паров этого вещества по водороду равна 39. Определите молекулярную формулу данного вещества.
Мг(в-ва) = 39*2 *78.
Определяем массу углерода по оксиду углерода (IV).
М(С02) = 44 г/моль, m(С02) = 44 г.
В 44 г (СО2 содержится 12 г (С),
а в 4,4 г (СО2 — х г (С)
х = 1,2 г (С)
Определяем массу водорода по воде.
М(Н20)= 18 г/моль m(Н20) = 18 г.
В 18 г (Н20) – 2 г (Н),
а в 0,9 г (Н20) – х г (Н)
х = 0,1 г (Н)
Определяем, есть ли в веществе кислород
m(C) + m (Н) = 1,2 + 0,1 = 1,3 (г). Значит, кислорода нет.
Определяем отношение атомов.
Пусть х — число атомов углерода, у — число атомов водорода,
Простейшая формула СН, но т.к. Mr (вещества) = 78, то составляем уравнение:
* 1n + 1n= 78
n = 78
n = 6
Тогда истинная формула вещества C6H6
Практическая часть 1
2.Напишите структурные формулы следующих веществ:
а)2,3-диметилпентан; З-метил-З-этилпентан; 2,4-диметил-3,3- диэтилпентан;
б) 3-метилгептан; 2,2-диметилгептан; 2,4-диметилгексан;
в) 2,2-диметилгептан; 2,2,3,3-тетраметилбутан; 2-метил гексан;
г)2-метилпропан; 3,3-диметилгексщг; 2,3,5-триметилгексан;
д) 2,5,6-триметилоктан; 2-метилгексан; 3-этилгексан;
е) 2,3-диметилбутан; 2,3,4-триметилпентан; 2,2-диметил-З-этилоктан. 2.Назовите по систематической номенклатуре вещества, формулы которых приведены ниже:
СН3
|
а) СН3-СН-СН3 в) СН3-С-СН2-СН3
| |
СН3 СН3
б) СН3-СН-СН-СН3 г) СН2-СН-СН2-СН2-СН3
| | |
СН3 СН3 СН3-СН3
2.Какие из указанных веществ являются изомерами?
г) СН3-СН2-СН2-СН2-СН3 б) СН3-СН-СН2-СН3
|
СН3
в) СН3
| г) СН3-СН2-СН2-СН2-СН2-СН2-СН2
СН3-С-СН3 |
|
СН3 СН3
3.Определите, сколько алканов изображено при помощи следующих формул?
4.Составьте для нижеуказанных веществ по 2 формулы изомеров и гомологов. Назовите получившиеся вещества по международной номенклатуре:
а) пентан; б) гептан; в) гексан.
5.Составьте уравнения реакций, с помощью которых можно осуществить превращения:
а) СН4 → СН3С1 → С2Н6 → С2Н5С1 → С3Н8
б) С →СН4 → СН3С1 → С3Н8 →С3Н7Вr
в) С → СН4 → СН3Вr → C2H6 → Н20
Практическая часть 2
1.Вычислите плотность этана по:
а) воздуху
б) водороду
в) кислороду
2.Относительная плотность углеводорода по водороду равна 22. Найдите молекулярную формулу углеводорода.
3.Найдите молекулярную формулу углеводорода, если его относительная плотность по азоту равна 1,57.
4.При сжигании углеводорода массой 3,2 г образовалось 9,9 г оксида углерода (IV) и 4,5 г воды. Относительная плотность паров этого вещества по водороду равна 64. Найдите молекулярную формулу.
5.При сжигании углеводорода массой 29 г образовалось 88 г оксида углерода и 45 г воды. Относительная плотность вещества по воздуху равна 2. Найдите молекулярную формулу углеводорода.
6.Найдите молекулярную формулу органического вещества, если известно, что массовая доля углерода в нем составляет 51,89 %, водорода — 9,73 %, хлора — 38,38 %. Относительная плотность паров этого вещества по воздуху 3,19. .
7.В углеводороде массовая доля углерода равна 84 %. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
8.Выведите молекулярную формулу вещества, содержащего углерод массовой долей 85,7 %. водород 14,3 %. Плотность паров по воздуху 21.
9.Определите молекулярную формулу вещества, содержащего углерод (массовая доля) 83,72 %, водород 16,28 %, если молекулярная масса вещества равна 86.
10.При сжигании газообразного углеводорода образовался оксид углерода (IV) массой 3,3 г и вода массой 2,02 г. Плотность его по воздуху составляет 1,04. Найдите формулу.
Контрольные вопросы
1.Что такое массовая доля элемента в химическом соединении?
2.Как вычисляется плотность одного газа по другому?
3.Назовите общую формулу алканов.
4.Что такое эмпирическая формула?
5.Чем отличаются структурные формулы от эмпирических?
Список использованных источников
1.Габриелян О.С. Химия: учеб, для студ. проф. учеб, заведений / О.С. Габриелян, И.Г. Остроумов. — М: 2009.
2.Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб, пособие для студ. сред. проф. учеб, заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. — М.: 2009.
3.Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб, для общеобразоват. учреждений. -М.: 2009.
4.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб, для общеобразоват. учреждений. — М.: 2009.
5.Габриелян О.С. Общая химия: учеб, для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев — М.: 2009
infourok.ru
Формулы — урок. Химия, 8–9 класс.
Состав и строение органических веществ можно выражать разными формулами.
1. Молекулярные формулы показывают, сколько и каких атомов содержится в молекуле вещества. Молекулярные формулы этана и этанола записываются следующим образом:
Формулы показывают, что в молекуле этана два атома углерода и шесть атомов водорода, а в молекуле этанола содержится ещё и атом кислорода.
2. Структурные формулы отражают порядок соединения атомов в молекуле. Каждая ковалентная связь в структурной формуле обозначается черточкой, направленной от одного атома к другому, а атомы обозначаются символами.
Чёрточка, соединяющая два атома, обозначает валентность. Четыре чёрточки у символов углерода в молекулах этана и этанола обозначают его четырёхвалентность и показывают число химических связей с другими атомами. Две чёрточки у символа кислорода показывают его двухвалентность, а одна чёрточка возле символа водорода говорит о том, что этот элемент одновалентен.
3. Сокращённые структурные формулы тоже показывают порядок соединения атомов, но в них изображаются только связи между атомами углерода, а связи между атомами углерода и водорода не обозначаются. При составлении сокращённых формул учитывают, что углерод в органических соединениях четырёхвалентен.
Ch4—Ch4,Ch4—Ch3OH.
Сокращённые структурные формулы могут записываться и без обозначения связей:
Ch4Ch4,Ch4Ch3OH.
4. Электронные формулы используют для демонстрации электронного строения молекул. В таких формулах каждый электрон обозначается точкой, а ковалентная связь — парой точек:
Источники:
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2011. — 193 с.
www.yaklass.ru
Как написать общую молекулярную формулу органических веществ?
В данной статье я вам покажу, как написать общую молекулярную формулу органических веществ любого класса, отталкиваясь от структурной формулы любого из его представителей.
Поехали.
Что вам нужно помнить железно, так это общую формулу алканов, она имеет вид CnH2n+2.
Далее, если вас просят, написать общую формулу, например предельных альдегидов:
1) вам следует записать формулу любого из них. Например:

2) Написать молекулярную формулу выбранного выше соединения, посчитав все атомы, входящие в состав его молекулы. В формуле выбранного в п.1. соединения мы обнаруживаем 3 атома углерода, 6 атомов водорода и 1 атом кислорода. Таким образом, оно имеет молекулярную формулу С3Н6O
3) Записать формулу алкана с таким же числом атомов углерода в молекуле. В нашем случае, с тремя атомами. Подставляя значение n=3 в формулу CnH2n+2 получаем С3Н8
4) Посмотреть, чем отличаются друг от друга молекулярные формулы полученного алкана и исходного вещества. В исходном веществе на два атома водорода меньше, и на один атом кислорода больше.
5) Внести изменения в общую формулу алканов, т.е. CnH2n+2 в соответствии с установленной разницей, т.е. уменьшить число атомов водорода на два и добавить один атом О в формулу. Т.е.
CnH2n+2-2O
или
CnH2nO
Для того чтобы были очевидны преимущества данного метода, давайте попробуем записать общую формулу гомологического ряда ароматических сложных эфиров. Ароматический значит в его структурной формуле есть бензольное кольцо, а сложные эфиры это вещества со сложноэфирной группой –С(O)-O-. Запишем формулу любого такого вещества, например:
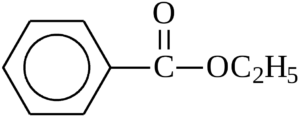
Для удобства ведения подсчетов атомов дорисуем не отображенные на структурной формуле выше атомы водорода, получим:
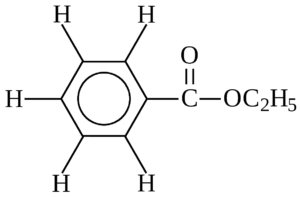
1) молекула выше состоит из 9 атомов С, 10 атомов Н, двух атомов O. Т.е. молекулярная формула данного вещества С9Н10O2
2) алкан с тем же числом атомов углерода имеет формулу C9H20. Сравнивая эту формулу с формулой изначального вещества С9Н10O2 мы видим, что в ней на 10 атомов H меньше и на два атома О больше, чем в соответствующем алкане.
3) Разница составов молекул исходного вещества и алкана с таким же числом атомов углерода будет той же самой и для общих формул гомологических рядов. Т.е.
CnH2n+2-10O2
или
CnH2n-8O2
scienceforyou.ru
Презентация к уроку по химии (10 класс) на тему: Определение формул органических веществ. Определение формул веществ по химическим свойствам.
Слайд 1
Определение формул органических веществ Определение формул веществ по химическим свойствам. Задачи С 5 Подготовка к ЕГЭ Лекция №4Слайд 2
Пример 9 Определить формулу алкадиена , если г его могут обесцветить 80 г 2%-го раствора брома.
Слайд 3
1.Общая формула алкадиенов — С n H 2n−2 . Запишем уравнение реакции присоединения брома к алкадиену , не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома: С n H 2n−2 + 2Br 2 → С n H 2n−2 Br 4
Слайд 4
2.Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома: m (Br 2 ) = m раствора • ω = 80 • 0,02 = 1,6 г ν (Br 2 ) = m / M = 1,6 / 160 = 0,01 моль.
Слайд 5
3.Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена , можно найти количество диена и (так как известна его масса) его молярную массу: 0,005 0,01 С n H 2n − 2 + 2Br 2 → С n H 2n −2 Br 4
Слайд 6
4.М диена = m / ν = 3,4 / 0,05 = 68 г/моль. 5.Находим формулу алкадиена по его общей формул, выражая молярную массу через n: 14n − 2 = 68 n = 5. Это пентадиен С 5 Н 8 . Ответ: C 5 H 8
Слайд 7
Пример 10 При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Слайд 8
Решение примера 10 1.Формула предельного одноатомного спирта — C n H 2n+1 OH . Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
Слайд 9
2.Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции): 2C n H 2n+1 OH + 2Na → 2C n H 2n+1 ONa + H 2 C 3 H 6 + H 2 → C 3 H 8
Слайд 10
3. Можно найти количество пропена , а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта: ν (C 3 H 6 ) = V / V m = 0,112 / 22,4 = 0,005 моль => ν (H 2 ) = 0,005 моль, ν спирта = 0,005 • 2 = 0,01 моль.
Слайд 11
4. Находим молярную массу спирта и n: M спирта = m / ν = 0,74 / 0,01 = 74 г/моль, 14n + 18 = 74 14n = 56 n = 4. Спирт — бутанол С 4 Н 7 ОН. Ответ: C 4 H 7 OH.
Слайд 12
Пример 11 Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Слайд 13
Решение примера 11 1.Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде: C n H 2n+1 COOC m H 2m+1 Соответственно, спирт будет иметь формулу C m H 2m+1 OH, а кислота C n H 2n+1 COOH. Уравнение гидролиза сложного эфира: C n H 2n+1 COOC m H 2m+1 + H 2 O → C m H 2m+1 OH + C n H 2n+1 COOH
Слайд 14
2. Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны. Поэтому из данных задачи можно найти массу воды: m h3O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г ν h3O = m / M = 0,54 / 18 = 0,03 моль
Слайд 15
3. Соответственно, количества веществ кислоты и спирта тоже равны моль. Можно найти их молярные массы: М кислоты = m / ν = 1,8 / 0,03 = 60 г/моль, М спирта = 1,38 / 0,03 = 46 г/моль.
Слайд 16
4.Получим два уравнения, из которых найдём m и n: M Cnh3n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота M Cmh3m+1OH = 14m + 18 = 46, m = 2 — этанол. Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат. Ответ: CH 3 COOC 2 H 5 .
Слайд 17
Пример 12 Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Слайд 18
Решение примера 12. Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной): NH 2 –CH(R)–COOH. Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
Слайд 19
Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия: NH 2 –CH(R)–COOH + NaOH → NH 2 –CH(R)– COONa + H 2 O Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции.
Слайд 20
Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их: M(аминокислоты NH 2 –CH(R)–COOH) = 74 + М R M(соли NH 2 –CH(R)– COONa ) = 96 + М R ν аминокислоты = 8,9 / (74 + М R ), ν соли = 11,1 / (96 + М R ) 8,9 / (74 + М R ) = 11,1 / (96 + М R ) М R = 15 Легко увидеть, что R = CH 3 .
Слайд 21
Можно это сделать математически, если принять, что R — C n H 2n+1 . 14n + 1 = 15, n = 1. Это аланин — аминопропановая кислота. Ответ: NH 2 –CH(CH 3 )–COOH.
Слайд 22
Источники http://ege-study.ru/materialy-ege/ximiya-chast-s-zadacha-s5-opredelenie-formul-organicheskix-veshhestv/
Слайд 23
Автор: Калитина Тамара Михайловна Место работы: МБОУ СОШ №2 с.Александров-Гай Саратовской области Должность: учитель химии Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna Дополнительные сведения: сайт http://kalitina.okis.ru/
nsportal.ru