Химические формулы и уравнения химических реакций
При написании уравнений химических реакций часто указывают физическое состояние каждого компонента, помещая справа от формулы в скобках символы г — газообразное ж — жидкое, т — твердое, водн. — растворенное состояние. Например [c.21]Уравнением химической реакции называется изображение химической реакции при помощи химических формул, соединенных знаком плюс и знаком равенства. Химическое уравнение выражает не только качественную, но и количественную [c.18]
Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и хгшические формулы. Уравнения химических реакций. [c.122]
В уравнениях химических реакций белый фосфор обычно записывают формулой Р4, которая соответствует составу его молекул. Красная и черная модификации фосфора обычно записываются символом Р.
Предложить два различных метода определения МпОг в пиролюзите. Записать уравнения химических реакций, расчетные формулы. [c.124]
Осторожно нагрейте пробирку на газовой горелке наблюдайте изменение цвета и характера осадка за счет восстановления дигид-роксида меди Си(ОН)з до металлической меди. Какое соединение получилось в результате окисления формальдегида Напишите структурные формулы формальдегида и полученной в опыте муравьиной кислоты. Составьте уравнение химической реакции окисления муравьиного альдегида дигидроксидом меди. [c.242]
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, молуравнению реакции найти соотношение между массами веществ, вступающих в реакцию н образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения.
Вот это утверждение уже представляет собой уравнение химической реакции меди с кислородом, приводящей к получению оксида меди(1). Числа, 2 и 4, помещенные перед символами или формулами, называются стехиомет-рическими коэффициентами. Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
В обеих частях (левой и правой) уравнения химической реакции должно находиться одинаковое число символов каждого элемента (закон сохранения элементов). Для этого перед формулами исходных и конечных веществ ставятся соответствующие числовые коэффициенты (определяющие число молей вступающих в реакцию и получающихся в результате реакции веществ), например [c.364]
Химические уравнения используют для выполнения различных расчетов, связанных с реакциями. Напомним, что каждая формула в уравнении химической реакции изображает один моль соответствующего вещества. Поэтому, зная молярные массы веществ — участников реакции и коэффициенты в уравнении, можно найти количественные соотношения между веществами, вступающими в реакцию и образующимися в результате ее протекания. Например, уравнение [c.36]
Например, уравнение [c.36]
При осуществлении химических диктантов, которые используют при написании формул и символов элементов, уравнений химических реакций. Запись текста на магнитофон может быть осуществлена в двух вариантах (женский и мужской голос). Учитель наблюдает за работой учащихся. Такая форма звукозаписей имеет значение для контроля знаний учащихся. [c.101]
Любую химическую реакцию можно представить в виде химического уравнения, которое состоит из двух частей, соединенных знаком равенства. В левой части уравнения записываются формулы веществ, вступающих в реакцию, а в правой— веществ, полученных в результате реакции. [c.18]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги.
Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги.
При изучении химии мы постоянно пользуемся уравнениями химических реакций, которые представляют собой запись происшедших при реакции превращений веществ. Таким образом, при составлении уравнения реакции мы должны знать, что образовалось в результате взаимодействия, и записать это при помощи химических формул. Например, водород реагирует с кислородом, давая воду [c.167]
Таким образом, при составлении уравнения реакции мы должны знать, что образовалось в результате взаимодействия, и записать это при помощи химических формул. Например, водород реагирует с кислородом, давая воду [c.167]
Составляется химическая формула или уравнение реакции, на основе которых будет решаться данная задача (если о них говорится в условии задачи). [c.231]
Научной основой курса химии средней школы является учение о периодичности свойств и строении атомов элементов. На первоначальном этапе обучения в средней школе и ПТУ, техникумах и на подготовительных курсах много внимания уделяется атомно-молекулярной теории и основным законам химии. Поэтому указанный материал намеренно не рассматривается в пособии отдельно. Его можно повторить, используя школьный учебник и тренируясь в решении задач и упражнений (нахождение формул соединений, расчеты по уравнению химической реакции и т. п.). [c.3]
Системы понятий о составе и строении связаны друг с другом.
Уравнение химической реакции — это принятый в науке способ выражения количественной и качественной стороны химических реакций. Как и химическая формула, уравнение химической реакции соответствует тому научному языку, который был выработан в ходе научного познания. Химические формулы и уравнения описывают сос- [c.52]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании и выясняются ее трудные места. При повторном изучении темы легче понять сущность вопроса, теоретические положения, их применение, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивают прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом помогает пониманию прочитанного и является средством самоконтроля.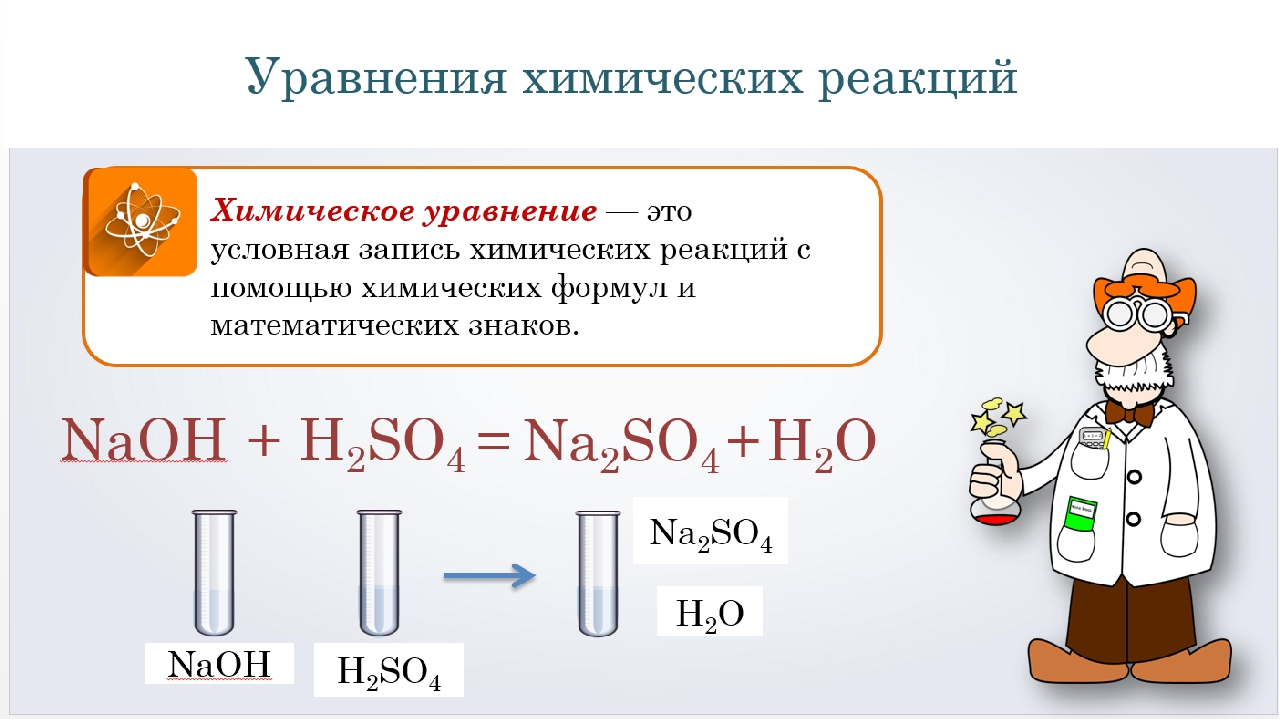
Уравнение химической реакции дает возможность производить различные связанные с ней расчеты. При этом нужно иметь в виду, что СИМВОЛ каждого химического элемента имеет одновременно два смысловых значения атомное и весовое. С одной стороны, символ, например О, обозначает один атом кислорода. С другой — тот же символ обозначает весовое количество, соответствующее атомному весу, т. е. 16 весовых единиц кислорода. При составлении формул по валентности оперируют с первым значением, при химических расчетах — со вторым. Какими именно весовыми единицами (граммами, килограммами и т.
Кроме того, необходимо уметь читать и записывать формулы веществ, составлять уравнения химических реакций и делать по ним расчеты, выполнять простые химические операции (взвешивание, определение объемов газов и жидкостей, приготовление растворов, титрование и т. п.), а также быть подготовленным к изучению последующей химической дисциплины — органической химии. [c.321]
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов в правой. Это означает, что это уравнение удовлетворяет закону сохранения массы веществ (см. 1.9), следовательно, написано правильно . Коэффициенты перед формулами веществ в уравнениях химических реакций называют стехиометриче-скими коэффициентами. [c.16]
Уравнение химических реакций дает возможность производить различные связанные с ней расчеты. При этом нужно иметь в виду, что символ каждого химического элемента имеет одновременно два смысловых значения атомное и массовое. С одной стороны, символ, например О, обозначает один атом кислорода. С другой — тот же символ обозначает моль атомов кислорода, масса которого составляет 16 г. При составлении формул по валентности оперируют с первым значением, при химических расчетах — со вторым. [c.29]
При этом нужно иметь в виду, что символ каждого химического элемента имеет одновременно два смысловых значения атомное и массовое. С одной стороны, символ, например О, обозначает один атом кислорода. С другой — тот же символ обозначает моль атомов кислорода, масса которого составляет 16 г. При составлении формул по валентности оперируют с первым значением, при химических расчетах — со вторым. [c.29]
Как правило, в уравнениях химических реакций оксид азота (IV) записывают одной формулой, обычно N02, так как оба оксида имеют одинаковые химические свойства. Газообразный N02 имеет бурую окраску, поэтому, его называют бурым газом. Ои ядовит, раздражает слизистые оболочки глаз и дыхательных путей. Оксид азота (IV) является вредным отходом химических производств.
Расчеты таких количественных соотношений между элементами в соединениях или между веществами в уравнениях химических реакций, вывод формул называются стехиометрическими расчетами. Их теоретической основой являются фундаментальные законы химии, часто называемые стехиометрическими законами. [c.9]
Их теоретической основой являются фундаментальные законы химии, часто называемые стехиометрическими законами. [c.9]
Язык химии — формулы вещества и уравнения химических реакций. В формуле вещества закодирована информация о составе, структуре, реакционной способности этого вещества. Из уравнения реакции можно получить информацию о химическом процессе и его параметрах. Научиться расшифровывать эту информацию — важная задача изучения курса общей и неорганической химии. [c.4]
В формуле (16) неравенство имеет место для реальных процессов, а равенство — для равновесных. Уравнение химической реакции запишем в виде [c.446]
Химическая символика- это своеобразный алфавит, с помощью которого записывают слова — формулы соединений и фразы -уравнения химических реакций, в той или иной мере отражающие реально происходящие процессы. [c.13]
Нужно, чтобы задания по теме требовали от учащихся в пределах возможного разнообразной деятельности а) ответов на вопросы б) составления формул веществ и уравнений химических реакций в) заполнения таблиц г) записи выводов из содержания таблиц д) составления схем применения веществ е) установления по приведенным характеристикам объектов, что эти объекты собой представляют ж) выбора заданного из ряда перечисленного. [c.130]
[c.130]
На основе уравнения химической реакции (или химической формулы) производится решение задач на выход продукта. [c.24]
Термохимические расчеты основаны на применении термохимических уравнений, которые представляют собой обычные уравнения химических реакций, когда в них, наряду с формулами веществ, участвующих в реакции, указываются и тепловые эффекты процесса. С термохимическими уравнениями можно производить те же алгебраические действия, что и с алгебраическими уравнениями. Расчеты производит следующим путем определяют, какие алгебраические действия нужно произвести, чтобы из приведенных для решения задачи уравнений получить искомое уравнение совершая аналогичные операции с соответствующими данным реакциям тепловыми эффектами, получают искомую величину. При расчетах различных тепловых эс ектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов теплоты образования для неорганических соединений и теплоты горения для органических соединений. [c.86]
[c.86]
Определение теплового эффекта сводится к написанию уравнения химической реакции и уравниванию коэффициентов нахождению теплот образования всех исходных соединений и конечных продуктов реакции, расчету теплоты реакции по формуле Гесса (с учетом стехиометрических коэффициентов). [c.345]
Можно проверить задание на слух, например, написание отдельных формул один читает, а другие слушают. Однако при составлении уравнений химических реакций и тем более решении задач такой метод не годится. Проверять задание в старших классах на слух вообще нельзя. [c.120]
Уравнение химической реакции. Уравнением химической реакции называется выражение химической реакции с помощью химических формул. Уравнение реакции — это способ описания про- цесса, который дает представление о происщедших качественных и количественных изменениях, например [c.30]
Особенностью сольватов как химических соединений является то, что коэффициенты пит меняются с изменением концентрации, температуры и других параметров раствора. Поэтому приведенные формуЛЬ сольватов не отражают их истинного стехиометрического состава, и в уравнениях химических реакций сольватированные ионы обычно записывают или Hз OO aq и H» aq, или СН3СОО» и Н [c.153]
Поэтому приведенные формуЛЬ сольватов не отражают их истинного стехиометрического состава, и в уравнениях химических реакций сольватированные ионы обычно записывают или Hз OO aq и H» aq, или СН3СОО» и Н [c.153]
С. Канниццаро убедительно показал, что только установление еднной системы атомных масс дает возможность правильно выражать состав соединений и широко использовать уравнения химических реакций. Закон Авогадро помогает в определении правильных формул химических соедипепий. Он прочно утверждает в пауке ионятио о молекуле как об основной структурной единице между миром атомов и миром макроскопических тел. [c.186]
Огромным достижением конца прошлого столетия было установление того положения, что каждому веществу можно приписать некоторое количество энергии, называемой энергией Гиббса (или гиббсовой энергией), причем реакция в системе при постоянной температуре может протекать в том случае, если сопровождается уменьшением энергии Гиббса, т. е. если энергия Гиббса исходных реагирующих веществ больше энергии Гиббса продуктов реакции. Энергия Гиббса вещества является свойством, выражающим одновременно как энтальпию данного вещества, так и присущую ему вероятность (энтропию). Если химические вещества, формулы которых записаны в левой части уравнения химического равновесия, и вещества, формулы которых записаны в правой части этого уравнения, имеют одинаковую энтропию (вероятность), реакция будет идти в том направлении, при котором происходит выделение теплоты, т. е. в направлении протекания экзотермической реакции. Если вещества в левой и правой части уравнения имеют одну и ту же энтальпию, реакция будет протекать в направлении от веществ с меньшей вероятностью (энтропией) в направлении веществ с большей вероятностью (энтропией). При равновесии, когда реакция не обнаруживает преимущественной тенденции протекания ни в прямом, ни в обратном направлении, энергия Гиббса веществ левой части уравнения точно равна энергии Гиббса веществ правой части уравнения.
е. если энергия Гиббса исходных реагирующих веществ больше энергии Гиббса продуктов реакции. Энергия Гиббса вещества является свойством, выражающим одновременно как энтальпию данного вещества, так и присущую ему вероятность (энтропию). Если химические вещества, формулы которых записаны в левой части уравнения химического равновесия, и вещества, формулы которых записаны в правой части этого уравнения, имеют одинаковую энтропию (вероятность), реакция будет идти в том направлении, при котором происходит выделение теплоты, т. е. в направлении протекания экзотермической реакции. Если вещества в левой и правой части уравнения имеют одну и ту же энтальпию, реакция будет протекать в направлении от веществ с меньшей вероятностью (энтропией) в направлении веществ с большей вероятностью (энтропией). При равновесии, когда реакция не обнаруживает преимущественной тенденции протекания ни в прямом, ни в обратном направлении, энергия Гиббса веществ левой части уравнения точно равна энергии Гиббса веществ правой части уравнения. При равновесии движущая сила изменения энтальпии, сопровождающего реакцию, полностью уравновешивается движущей силой изменения вероятности (изменения энтропии). [c.300]
При равновесии движущая сила изменения энтальпии, сопровождающего реакцию, полностью уравновешивается движущей силой изменения вероятности (изменения энтропии). [c.300]
Согласно законам химической кинетики скорость химической реакции, протекающей по уравнению тА + — -пВ=АтВп, может быть выражена формулой [c.9]
Химическая реакция. Химическое уравнение
Химическими реакциями называют явления, при которых одни вещества превращаются в другие.
Химическим уравнением называют условную запись химической реакции с помощью формул веществ и коэффициентов.
Признаками химических реакций являются:
- выделение газа
- выпадение или исчезновение осадка
- изменение цвета
- изменение запаха
- выделение тепла и света
Давайте порассуждаем вместе
1. Сумма коэффициентов в уравнении реакции между оксидом магния и оксидом азота (V) равна
1) 5
2) 2
3) 3
4) 4
Ответ: Составим уравнение реакции MgO + N2O5 = Mg(NO3)2 Сумма коэффициентов в уравнении равна 1 + 1 + 1 = 3
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
1) 3
2) 4
3) 5
4) 6
Ответ: 3Na2O + P2O5 = 2Na3PO4сумма коэффициентов равна 3+1+2 = 6
3. Сумма коэффициентов в уравнении реакции между магнием и оксидом углерода (IV)
1) 4
2) 5
3) 6
4) 2
Ответ: 2Mg + CO2 = 2MgO + C сумма коэффициентов равна 2 + 1 + 2 + 1 = 6
4. Сумма коэффициентов в левой части уравнения реакции между оксидом железа (II) и алюминием
1) 5
2) 4
3) 3
4) 2
Ответ: 3FeO + 2Al = Al2O3 + 3Fe сумма коэффициентов в левой части равна 3 + 2 = 5
5. Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
1) 5
2) 2
3) 3
4) 4
Ответ: 2KMnO4 = K2MnO4 + MnO2 + O2сумма коэффициентов в правой части равна 1+ 1 + 1 = 3
6. Сумма коэффициентов в правой части уравнения реакции между оксидом железа (III) и водородом
1) 8
2) 3
3) 6
4) 5
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O сумма коэффициентов в правой части равна 2 + 3 = 5
7. К физическим явлениям относится процесс
1) горение свечи
2) плавление свинца
3) скисание молока
4) разложение малахита
Ответ: к физическим явлениям относится процесс плавления свинца, т.
к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
Самостоятельная работа по химии «Дописать уравнения реакции»
Просмотр
содержимого документа
Дописать уравнения реакции и указать тип химической реакции.
- CuO + HCl =
- SO3 + MgO =
- CO2 + Na2O =
- Ba + HCl =
- P2O5 + CaO =
- Na2O + HBr =
- SO2 + SrO =
- Ba(OH)2 + SO3 =
- Ca(OH)2 + Cl2O7 =
- NaOH + V2O5 =
- LiOH + N2O3 =
- Ni + HBr =
- Ca(OH)2 + HNO3 =
- Al + h3SO4 =
- Zn + HCl =
- BaCl2 + h3SO4 =
- K2SiO3 + HNO3 =
- CuSO4 + KOH =
- ZnCl2 + Ca(OH)2=
- BaCl2 + Na2SO4 =
- CuSO4 + Ba(NO3)2 =
- HNO3 + Be(OH)2 =
- HNO3 + Cr(OH)3 =
- K + h3S =
- Cl2O7 + BaO =
- NaOH + Cl2O5 =
- KOH + CO2 =
- HCl + Al(OH)3 =
- CaO + h4PO4 =
- KOH + h3SO4 =
- FeCl3 + NaOH =
- Na2CO3 + HCl =
- h3SO4 + Sn(OH)2 =
- N2O5 + K2O =
Реакция горения
Реакция горения.

Горение топлива есть одна из форм окисления, т.е. соединения вещества с кислородом. Окисление может протекать различно. Медленное соединение вещества с кислородом называется собственно окислением. Примером процесса более быстрого окисления является реакция горения или горение. Наконец в случае мгновенного соединения горючих с кислородом может произойти взрыв.
Окисление сопровождается выделением определенного количества тепла. При медленном окислении это тепло постепенно рассеивается, не создавая заметного повышения температуры. При взрыве теплота реакции горения выделятся практически мгновенно, что приводит к бстрому расширению газов.
Горение углеводородных газов СmHn в кислороде может быть выражено в общем виде уравнением
СmHn + (m+n/4)O2 = mCO2 + (n/2) h3O.
Как известно, чаще всего сжигание газов происходит не в чистом кислороде, а в кислороде воздуха. В воздухе на 21 объем кислорода приходится 79 объемов азота ( если пренебречь незначительным количеством СО2 и редких газов), или на 23,3 массовых частей кислорода приходится 79 : 21 = 3,76 м³ азота, или 1 м³ кислорода содержится в 100 : 21 = 4,76 м³ воздуха.
В воздухе на 21 объем кислорода приходится 79 объемов азота ( если пренебречь незначительным количеством СО2 и редких газов), или на 23,3 массовых частей кислорода приходится 79 : 21 = 3,76 м³ азота, или 1 м³ кислорода содержится в 100 : 21 = 4,76 м³ воздуха.
В связи с указанным приведенное уравнение реакции горения углеводородных газов в атмосфере воздуха можно написать в виде
СmHn + (m+n/4)O2 + 3,76N2) = mCO2 + (n/2) h3O + (m +n/4) 3.76 N2.
Начально и конечное состояние реакций реакций горения распространенных газов представлены уравнениями, приведенными в табл. 1 и табл.2
Таблица 1
Реакция горения горючих газов в кислороде.
|
Газ |
Реакция горения |
|
Метан |
СН4 + 2О2→ СО2 + Н2О |
|
Этилен |
С2Н4 + 3О2 → 2СО2 + 2Н2О |
|
Этан |
С2Н6 + 3,5О2 → 2СО2 + 3Н2О |
|
Пропилен |
С3Н6 + 4,5О2 → 3СО2 + 3Н2О |
|
Пропан |
С3Н8 + 5О2 → 3СО2 + 4Н2О |
|
н-Бутилен и изобутилен |
С4Н8 + 6О2 → 4СО2 + 4Н2О |
|
н-Бутан и изобутан |
С4Н10 + 6,5О2 → 4СО2 + 5Н2О |
|
н-Пентан |
С5Н12 + 8О2 → 5СО2 + 6Н2О |
Таблица 2
Реакция гоения горючих газов в воздухе.
|
Газ |
Реакция горения |
|
Метан |
СН4 + 2О2 + 7,52N2 → СО2 + 2Н2О + 7,52N2 |
|
Этилен |
С2Н4 + 3О2 + 11,28N2 → 2СО2 + 2Н2О + 11,28N2 |
|
Этан |
С2Н6 + 3,5О2 + 13,16N2 → 2СО2 + 3Н2О + 13,16N2 |
|
Пропилен |
С3Н6 + 4,5О2 + 16,92N2 → 3СО2 + 3Н2О + 16,92N2 |
|
Пропан |
С3Н8 + 5О2 + 18,8N2 → 3СО2 + 4Н2О + 18,8N2 |
|
н-Бутилен и изобутилен |
С4Н8 + 6О2 + 22,56N2 → 4СО2 + 4Н2О + 22,56N2 |
|
н-Бутан и изобутан |
С4Н10 + 6,5О2 + 24,44N2 → 4СО2 + 5Н2О + 24,44N2 |
|
н-Пентан |
С5Н12 + 8О2 + 30,08N2 → 5СО2 + 6Н2О + 30,08N2 |
Уравнения реакций по химии.
 Химические уравнения
Химические уравненияПоговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений — важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.
Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий — металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород — это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na 2 O.
Записываем готовую формулу Na 2 O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O 2 =MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O 2 =2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl 2 +H 2 .
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl 2 +H 2 .
Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Поговорим о том, как составить уравнение химической реакции. Именно этот вопрос в основном вызывает серьезные затруднения у школьников. Одни не могут понять алгоритм составления формул продуктов, другие неправильно расставляют коэффициенты в уравнении. Учитывая, что все количественные вычисления осуществляются именно по уравнениям, важно понять алгоритм действий. Попробуем выяснить, как составлять уравнения химических реакций.
Попробуем выяснить, как составлять уравнения химических реакций.
Составление формул по валентности
Для того чтобы правильно записывать процессы, происходящие между различными веществами, нужно научиться записывать формулы. Бинарные соединения составляют с учетом валентностей каждого элемента. Например, у металлов главных подгрупп она соответствует номеру группы. При составлении конечной формулы между этими показателями определяется наименьшее кратное, затем расставляются индексы.
Что такое уравнение
Под ним понимают символьную запись, которая отображает взаимодействующие химические элементы, их количественные соотношения, а также те вещества, которые получаются в результате процесса. Одно из заданий, предлагаемых ученикам девятого класса на итоговой аттестации по химии, имеет следующую формулировку: «Составьте уравнения реакций, характеризующих химические свойства предложенного класса веществ». Для того чтобы справиться с поставленной задачей, ученики должны владеть алгоритмом действий.
Алгоритм действий
Например, нужно написать процесс горения кальция, пользуясь символами, коэффициентами, индексами. Поговорим о том, как составить уравнение химической реакции, воспользовавшись порядком действий. В левой части уравнения через «+» записываем знаками вещества, которые участвуют в данном взаимодействии. Так как горение происходит с участием кислорода воздуха, который относится к двухатомным молекулам, его формулу пишем О2.
За знаком равенства формируем состав продукта реакции, используя правила расстановки валентности:
2Ca + O2 = 2CaO.
Продолжая разговор о том, как составить уравнение химической реакции, отметим необходимость использования закона постоянства состава, а также сохранения состава веществ. Они позволяют проводить процесс уравнивания, расставлять в уравнении недостающие коэффициенты. Данный процесс является одним из простейших примеров взаимодействий, происходящих в неорганической химии.
Важные аспекты
Для того чтобы понять, как составить уравнение химической реакции, отметим некоторые теоретические вопросы, касающиеся этой темы. Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
Закон сохранения массы веществ, сформулированный М. В. Ломоносовым, объясняет возможность расстановки коэффициентов. Так как количество атомов каждого элемента до и после взаимодействия остается неизменным, можно проводить математические расчеты.
При уравнивании левой и правой частей уравнения используют наименьшее общее кратное, аналогично тому, как составляется формула соединения с учетом валентностей каждого элемента.
Окислительно-восстановительные взаимодействия
После того как у школьников будет отработан алгоритм действий, они смогут составить уравнение реакций, характеризующих химические свойства простых веществ. Теперь можно переходить к разбору более сложных взаимодействий, например протекающих с изменением степеней окисления у элементов:
Fe + CuSO4 = FeSO4 + Cu.
Существуют определенные правила, согласно которым расставляют степени окисления в простых и сложных веществах. Например, у двухатомных молекул этот показатель равен нулю, в сложных соединениях сумма всех степеней окисления также должна быть равна нулю. При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
При составлении электронного баланса определяют атомы или ионы, которые отдают электроны (восстановитель), принимают их (окислитель).
Между этими показателями определяется наименьшее кратное, а также коэффициенты. Завершающим этапом разбора окислительно-восстановительного взаимодействия является расстановка коэффициентов в схеме.
Ионные уравнения
Одним из важных вопросов, который рассматривается в курсе школьной химии, является взаимодействие между растворами. Например, дано задание следующего содержания: «Составьте уравнение химической реакции ионного обмена между хлоридом бария и сульфатом натрия». Оно предполагает написание молекулярного, полного, сокращенного ионного уравнения. Для рассмотрения взаимодействия на ионном уровне необходимо по таблице растворимости указать ее для каждого исходного вещества, продукта реакции. Например:
BaCl2 + Na2SO4 = 2NaCl + BaSO4
Вещества, которые не растворяются на ионы, записывают в молекулярном виде. Реакция обмена ионами протекает полностью в трех случаях:
- образование осадка;
- выделение газа;
- получение малодиссоциируемого вещества, например воды.

При наличии у вещества стереохимического коэффициента он учитывается при написании полного ионного уравнения. После того как будет написано полное ионное уравнение, проводят сокращение тех ионов, которые не были связаны в растворе. Конечным итогом любого задания, предполагающего рассмотрение процесса, протекающего между растворами сложных веществ, будет запись сокращенной ионной реакции.
Заключение
Химические уравнения позволяют объяснять с помощью символов, индексов, коэффициентов те процессы, которые наблюдаются между веществами. В зависимости от того, какой именно протекает процесс, существуют определенные тонкости записи уравнения. Общий алгоритм составления реакций, рассмотренный выше, основывается на валентности, законе сохранения массы веществ, постоянстве состава.
Имеет валентность равную двум, но в некоторых соединениях может проявлять высшую валентность. Если будет написана неправильно, то может не уравняться.
После правильного написания получившихся формул расставляем коэффициенты. Они для уравнения элементов. Суть уравнивания заключается в том, чтобы число элементов до реакции равнялось числу элементов после реакции. Начинать уравнивание стоит всегда с . Расставляем коэффициенты согласно индексам в формулах. Если с одной стороны реакции имеет индекс два, а с другой не имеет (принимает значение единицы), то во втором случае перед формулой ставим двойку.
Они для уравнения элементов. Суть уравнивания заключается в том, чтобы число элементов до реакции равнялось числу элементов после реакции. Начинать уравнивание стоит всегда с . Расставляем коэффициенты согласно индексам в формулах. Если с одной стороны реакции имеет индекс два, а с другой не имеет (принимает значение единицы), то во втором случае перед формулой ставим двойку.
Как только перед веществом поставлен коэффициент, значения всех элементов в этом увеличиваются в значение коэффициента. Если элемент обладает индексом, то сумма получившихся будет равняться произведению индекса и коэффициента.
После уравнивания металлов переходим к неметаллам. Затем переходим к кислотным остаткам и гидроксильным группам. Далее уравниваем водород. В самом конце проверяем реакцию по уравненному кислороду.
Химические реакции – это взаимодействие веществ, сопровождаемое изменением их состава. Иными словами, вещества, вступающие в , не соответствуют веществам, получающимся в результате реакции. С подобными взаимодействиями человек сталкивается ежечасно, ежеминутно. Ведь процессы, протекающие в его организме (дыхание, синтез белков, пищеварение и т.д.) – это тоже химические реакции.
С подобными взаимодействиями человек сталкивается ежечасно, ежеминутно. Ведь процессы, протекающие в его организме (дыхание, синтез белков, пищеварение и т.д.) – это тоже химические реакции.
Инструкция
Итак, запишите в левой части реакции исходные вещества: СН4 + О2.
В правой, соответственно, будут продукты реакции: СО2 + Н2О.
Предварительная запись этой химической реакции будет следующей: СН4 + О2 = СО2 + Н2О.
Уравняйте вышенаписанную реакцию, то есть добейтесь выполнения основного правила: количество атомов каждого элемента в левой и правой частях химической реакции должно быть одинаковым.
Вы видите, что количество атомов углерода совпадает, а количество атомов кислорода и водорода разное. В левой части 4 атома водорода, а в правой — только 2. Поэтому поставьте перед формулой воды коэффициент 2. Получите: СН4 + О2 = СО2 + 2Н2О.
Атомы углерода и водорода уравнены, теперь осталось сделать то же самое с кислородом. В левой части атомов кислорода 2, а в правой – 4. Поставив перед молекулой кислорода коэффициент 2, получите итоговую запись реакции окисления метана: СН4 + 2О2 = СО2 + 2Н2О.
Поставив перед молекулой кислорода коэффициент 2, получите итоговую запись реакции окисления метана: СН4 + 2О2 = СО2 + 2Н2О.
Как неудивительна природа для человека: зимой она окутывает землю снежным пуховым одеялом, весной — раскрывает, словно хлопья поп корна, все живое, летом — бушует буйством красок, осенью поджигает рыжим огнем растения… И только если вдуматься и присмотреться, можно увидеть, что стоят за всеми этими столь привычными изменениями сложные физические процессы и ХИМИЧЕСКИЕ РЕАКЦИИ. А чтобы исследовать все живое, необходимо уметь решать химические уравнения. Основным требованием при уравнивании химических уравнений — знание закона сохранения количества вещества: 1)количество вещества до реакции равно количеству вещества после реакции; 2)общее количество вещества до реакции равно общему количеству вещества после реакции.
Инструкция
Чтобы уравнять «пример» необходимо выполнить несколько шагов.
Записать уравнение реакции в общем виде. Для этого неизвестные коэффициенты перед обозначить буквами латинского (х, y, z, t и тд). Пусть требуется уравнять реакцию соединения водорода и , в результате которой получится вода. Перед молекулами водорода, кислорода и воды поставить латинские
Для этого неизвестные коэффициенты перед обозначить буквами латинского (х, y, z, t и тд). Пусть требуется уравнять реакцию соединения водорода и , в результате которой получится вода. Перед молекулами водорода, кислорода и воды поставить латинские
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.
Разберем все нюансы, связанные с подобной процедурой.
Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.
Если коэффициенты расставлены правильно, их число должно быть одинаковым.
Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде — О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
Возьмем еще один пример, который предполагает постановку коэффициентов:
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить .
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой – 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
С правой стороны нет индексов, то есть одна частица кислорода, а с левой – 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты – это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.

Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой – нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли .
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5 . Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример .
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее – всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
3.1: Химические уравнения — Chemistry LibreTexts
Цели обучения
- Для описания химической реакции.
- Для расчета количества соединений, образующихся или потребляемых в химической реакции
Что происходит с материей, когда она претерпевает химические изменения? Закон сохранения массы гласит, что « Атомы не создаются и не разрушаются во время какой-либо химической реакции ». Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, происходящие во время реакции, включают только перегруппировку атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Химические уравнения
Как показано на рисунке \ (\ PageIndex {1} \), приложение небольшого количества тепла к груде оранжевого порошка дихромата аммония приводит к бурной реакции, известной как вулкан дихромата аммония. Тепло, свет и газ образуются в виде большой кучи пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Тепло, свет и газ образуются в виде большой кучи пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Химические реакции представлены на бумаге химическими уравнениями . Например, газообразный водород (H 2 ) может реагировать (гореть) с газообразным кислородом (O 2 ) с образованием воды (H 2 O).Химическое уравнение для этой реакции записывается как:
Например, газообразный водород (H 2 ) может реагировать (гореть) с газообразным кислородом (O 2 ) с образованием воды (H 2 O).Химическое уравнение для этой реакции записывается как:
\ [\ ce {2H_2 + O_2 \ rightarrow 2H_2O} \]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются справа. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана из дихромата аммония на рисунке \ (\ PageIndex {1} \) составляет
\ [\ underbrace {\ ce {(NH_4) _2Cr_2O_7}} _ {реагент} \ rightarrow \ underbrace {\ ce {Cr_2O_3 + N_2 + 4H_2O}} _ {продукты} \ label {3.1.1} \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение \ (\ ref {3.1.1} \) указывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его так:
Уравнение этой реакции еще более информативно, если записать его так:
\ [\ ce {(Nh5) 2Cr2O7 (s) \ rightarrow Cr2O3 (s) + N2 (g) + 4h3O (g)} \ label {3.1.2} \]
Уравнение \ (\ ref {3.1.2} \) идентично уравнению \ (\ ref {3.1.1} \), за исключением добавления сокращений в скобках для обозначения физического состояния каждого вида.Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы, номера каждого типа атомов одинаковы по обе стороны от уравнений \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \). На каждой стороне реакции есть два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении номера каждого типа атомов и общий заряд одинаковы с обеих сторон.Уравнения \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \) являются сбалансированными химическими уравнениями. С каждой стороны уравнения различается то, как атомы расположены, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, то уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, то уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Химическая реакция изменяет только распределение атомов, но не их количество.
Введение в уравнения химических реакций: https://youtu.be/5mjawuf7K2Q
Уравновешивание простых химических уравнений
Когда химик сталкивается с новой реакцией, на ней обычно нет этикетки, которая показывает сбалансированное химическое уравнение. Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в форме химического уравнения, которое может быть сбалансировано, а может и не быть сбалансировано, как было написано вначале. Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
\ [\ ce {C_7H_ {16} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.3} \]
При полном сгорании любого углеводорода при достаточном количестве кислорода всегда образуется диоксид углерода и вода.
Рисунок \ (\ PageIndex {2} \): Пример реакции горения. Воск в свече представляет собой высокомолекулярный углеводород, который в реакции горения выделяет газообразный диоксид углерода и водяной пар (Уравнение \ (\ ref {3.1.3} \)). Уравнение \ (\ ref {3.1.3} \) не сбалансировано: номера каждого типа атомов на стороне реагента уравнения (7 атомов углерода, 16 атомов водорода и 2 атома кислорода) не совпадают с номера каждого типа атомов на стороне продукта (1 атом углерода, 2 атома водорода и 3 атома кислорода). Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы, чтобы получить одинаковое количество атомов каждого типа по обеим сторонам уравнения. Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).
Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).
Балансировка реакций горения: https://youtu.be/yE3bHIEslJc
Самый простой и наиболее полезный метод уравновешивания химических уравнений — это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент, который присутствует только в одном реагенте и одном продукте, если это возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон.
- Уравновешивает многоатомные ионы (если есть) как единое целое.
- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Проверьте свою работу, подсчитав количество атомов каждого сорта в обеих частях уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1A} \): сжигание гептана
Чтобы продемонстрировать этот подход, давайте воспользуемся сгоранием н-гептана (Уравнение \ (\ ref {3. 1.3} \)) в качестве примера.
1.3} \)) в качестве примера.
- Определить наиболее сложное вещество . Самая сложная субстанция — это вещество с наибольшим числом различных атомов, то есть \ (\ ce {C_7H_ {16}} \). Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.
- Настройте коэффициенты . Попробуйте отрегулировать коэффициенты молекул на другой стороне уравнения, чтобы получить одинаковое количество атомов с обеих сторон.Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, с правой стороны:
\ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + H_2O} \ label {3.1.4} \]
- Баланс многоатомных ионов как единое целое . В этой реакции не рассматриваются многоатомные ионы.
- Уравновесить остальные атомы .
 Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \] - Проверь свою работу . Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода.Всегда проверяйте, сбалансировано ли химическое уравнение. Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.

Пример \ (\ PageIndex {1B} \): сжигание изооктана
Рассмотрим, например, аналогичную реакцию, горение изооктана (\ (\ ce {C8h28} \)). Поскольку при сгорании любого углеводорода с кислородом образуется диоксид углерода и вода, несбалансированное химическое уравнение выглядит следующим образом:
\ [\ ce {C_8H_ {18} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3.1.7} \]
- Определить наиболее сложное вещество . Начните процесс балансировки, предположив, что окончательное сбалансированное химическое уравнение содержит одну молекулу изооктана.
- Настройте коэффициенты . Первый элемент, который появляется в реагентах только один раз, — это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + H_2O} \ label {3.1.8} \]
- Баланс многоатомных ионов как единое целое .
 Этот шаг не применяется к этому уравнению.
Этот шаг не применяется к этому уравнению. - Уравновесить остальные атомы . Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.9} \] Углерод и атомы водорода теперь уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \ [\ ce {C_8H_ {18} + 25/2 O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.10} \] Уравнение \ (\ ref {3.1.10} \) теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами. Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2: \ [\ ce {2C_8H_ {18} (l) + 25O_2 (g) \ rightarrow 16CO_2 (g) + 18H_2O (g)} \ этикетка {3.
 11} \]
11} \] - Проверь свою работу . Сбалансированное химическое уравнение имеет 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка сложных химических уравнений: https: // youtu.be / 7Jzb9XAHOJw
Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Пример \ (\ PageIndex {1C} \): Гидроксиапатит
Реакция минерального гидроксиапатита (\ (\ ce {Ca5 (PO4) 3 (OH)} \)) с фосфорной кислотой и водой дает \ (\ ce {Ca (h3PO4) 2 • h3O} \) (дигидрофосфат кальция моногидрат).Напишите и сбалансируйте уравнение этой реакции.
Гидроксиапатит (\ (\ ce (Ca5 (PO4) 3 (OH)} \)) кристаллДано : реагенты и продукт
На вопрос : вычисленное химическое уравнение
Стратегия :
- Определите продукт и реагенты, а затем напишите несбалансированное химическое уравнение.

- Следуйте инструкциям по уравновешиванию химического уравнения.
Решение :
A Сначала мы должны идентифицировать продукт и реагенты и написать уравнение реакции.В задаче приведены формулы для гидроксиапатита и моногидрата дигидрофосфата кальция (напомним, что фосфорная кислота — это H 3 PO 4 ). Исходное (несбалансированное) уравнение выглядит следующим образом:
\ [\ ce {Ca5 (PO4) 3 (OH) (s) + H_3PO4 (вод.) + H_2O _ {(l)} \ rightarrow Ca (H_2PO_4) _2 \ cdot H_2O _ {(s)}} \]
1. B Определите наиболее сложное вещество . Мы начнем с предположения, что только одна молекула или формульная единица наиболее сложного вещества, \ (\ ce {Ca5 (PO4) 3 (OH)} \), появляется в сбалансированном химическом уравнении.
2. Настройте коэффициенты . Поскольку кальций присутствует только в одном реагенте и одном продукте, мы начнем с него. Одна формульная единица \ (\ ce {Ca5 (PO4) 3 (OH)} \) содержит 5 атомов кальция, поэтому нам нужно 5 Ca (H 2 PO 4 ) 2 • H 2 O на правая сторона:
\ [\ ce {Ca5 (PO4) 3 (OH) + h4PO4 + h3O \ rightarrow 5Ca (h3PO4) 2 \ cdot h3O} \]
3. Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный фосфат-ион (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона. Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода.На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон.В этом уравнении многоатомный фосфат-ион (PO 4 3 — ) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона. Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода.На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
\ [\ ce {Ca_5 (PO_4) _3 (OH) + 7H_3PO_4 + H_2O \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O} \]
Хотя OH — также является многоатомным ионом, он не появляется с обеих сторон уравнения. Таким образом, кислород и водород необходимо уравновешивать отдельно.
Таким образом, кислород и водород необходимо уравновешивать отдельно.
4. Уравновесить оставшиеся атомы .Теперь у нас 30 атомов водорода справа и только 24 слева. Мы можем уравновесить атомы водорода, используя наименее сложное вещество, H 2 O, поместив коэффициент 4 перед H 2 O с левой стороны, что в сумме даст 4 H 2 O молекул:
\ [\ ce {Ca_5 (PO_4) _3 (OH) (s) + 7H_3PO_4 (aq) + 4H_2O (l) \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O (s)} \]
Теперь уравнение сбалансировано. Несмотря на то, что мы явно не сбалансировали атомы кислорода, на каждой стороне находится 41 атом кислорода.
5. Проверь свою работу . Обе части уравнения содержат 5 атомов кальция, 10 атомов фосфора, 30 атомов водорода и 41 атом кислорода.
Упражнение \ (\ PageIndex {1} \): Ферментация
Ферментация — это биохимический процесс, который позволяет дрожжевым клеткам жить в отсутствие кислорода. Люди веками использовали его для производства вина и пива, а также для выращивания хлеба. При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \).Напишите сбалансированную химическую реакцию ферментации глюкозы.
Люди веками использовали его для производства вина и пива, а также для выращивания хлеба. При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \).Напишите сбалансированную химическую реакцию ферментации глюкозы.
Коммерческое использование ферментации . (а) Чаны для пивоварен используются для приготовления пива. (б) Ферментация глюкозы дрожжевыми клетками — это реакция, которая делает возможным производство пива.
- Ответ
\ [C_6H_ {12} O_6 (s) \ rightarrow 2C_2H_5OH (l) + 2CO_2 (g) \ nonumber \]
Уравновешивающие реакции, содержащие многоатомные частицы: https: // youtu.be / i0ORKYt90Z0
Интерпретация химических уравнений
Помимо предоставления качественной информации об идентичности и физическом состоянии реагентов и продуктов, сбалансированное химическое уравнение предоставляет количественную информацию. В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например,g., 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например,g., 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \)). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
- Два иона NH 4 + и один Cr 2 O 7 2 — Выход иона 1 формульная единица Cr 2 O 3 , 1 молекула N 2 и 4 H 2 молекул O.
- Один моль (NH 4 ) 2 Cr 2 O 7 дает 1 моль Cr 2 O 3 , 1 моль N 2 и 4 моль H 2 О.

- Масса 252 г (NH 4 ) 2 Cr 2 O 7 дает 152 г Cr 2 O 3 , 28 г N 2 и 72 г H 2 О.
- Всего 6,022 × 10 23 формульных единиц (NH 4 ) 2 Cr 2 O 7 дает 6.022 × 10 23 формульных единиц Cr 2 O 3 , 6.022 × 10 23 молекул N 2 и 24.09 × 10 23 молекул H 2 O.
Все это химически эквивалентные способы выражения информации, содержащейся в сбалансированном химическом уравнении, с использованием понятий моля, молярной или формульной массы и числа Авогадро.Отношение количества молей одного вещества к количеству молей другого называется мольным соотношением. Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
\ [252 \; г \; \ текст {из} \; \ ce {(NH_4) _2Cr_2O_7} \]
выход
\ [152 + 28 + 72 = 252 \; г \; \ text {продуктов.} \]
Химическое уравнение, однако, не показывает скорость реакции (быстро, медленно или совсем) или выделяется ли энергия в виде тепла или света. Эти вопросы более подробно рассматриваются в следующих главах.
Важная химическая реакция была проанализирована Антуаном Лавуазье, французским химиком 18 века, который интересовался химией живых организмов, а также простыми химическими системами. В классической серии экспериментов он измерил углекислый газ и тепло, выделяемое морской свинкой во время дыхания, в котором органические соединения используются в качестве топлива для производства энергии, углекислого газа и воды. Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «Дыхание — это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле.Одним из важнейших видов топлива в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Лавуазье обнаружил, что отношение выделяемого тепла к выдыхаемому углекислому газу было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием углекислого газа — процесс, который химики называют горением. Основываясь на этих экспериментах, он предположил, что «Дыхание — это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле.Одним из важнейших видов топлива в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Пример \ (\ PageIndex {2} \): Горение глюкозы
Сбалансированное химическое уравнение горения глюкозы в лаборатории (или в мозге) выглядит следующим образом:
\ [\ ce {C_6H_ {12} O6 (s) + 6O2 (g) \ rightarrow 6CO2 (g) + 6h3O (l)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в этом уравнении в терминах
- одиночная молекула глюкозы.

- моль реактивов и продуктов.
- грамм реагентов и продуктов представлены 1 моль глюкозы.
- чисел молекул реагентов и продуктов, представленных 1 моль глюкозы.
Дано : вычисленное химическое уравнение
Запрошено : отношения молекул, молей и масс
Стратегия :
- Используйте коэффициенты из сбалансированного химического уравнения, чтобы определить как молекулярные, так и мольные отношения.
- Используйте молярные массы реагентов и продуктов для перевода из молей в граммы.
- Используйте число Авогадро, чтобы преобразовать моль в количество молекул.
Решение :
Это уравнение сбалансировано, как написано: каждая сторона имеет 6 атомов углерода, 18 атомов кислорода и 12 атомов водорода. Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
- Одна молекула глюкозы реагирует с 6 молекулами O 2 с образованием 6 молекул CO 2 и 6 молекул H 2 O.
- Один моль глюкозы реагирует с 6 моль O 2 с образованием 6 моль CO 2 и 6 моль H 2 O.
- Чтобы интерпретировать уравнение в терминах масс реагентов и продуктов, нам нужны их молярные массы и мольные отношения из части b. Молярные массы в граммах на моль следующие: глюкоза 180,16; О 2 , 31,9988; CO 2 , 44,010; и H 2 O, 18.015.
\ [\ begin {align *} \ text {масса реагентов} & = \ text {масса продуктов} \\ [4pt] g \, глюкоза + g \, O_2 & = g \, CO_2 + g \, H_2O \ end {align *} \]
\ [1 \, моль \, глюкоза \ влево ({180.16 \, g \ over 1 \, mol \, глюкоза} \ right) + 6 \, mol \, O_2 \ left ({31.9988 \, g \ over 1 \, mol \, O_2} \ right) \]
\ [= 6 \, моль \, CO_2 \ влево ({44. 010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, моль \, H_2O} \ справа) \]
010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, моль \, H_2O} \ справа) \]
\ [372,15 \, г = 372,15 \, г \]
C Один моль глюкозы содержит число Авогадро (6,022 × 10 23 ) молекул глюкозы. Таким образом, 6,022 × 10 23 молекул глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3,613 × 10 24 молекул кислорода для получения (6 × 6,022 × 10 23 ) = 3,613 × 10 24 молекул каждая из CO 2 и H 2 O.
В табличной форме:
| \ (C_6H_ {12} O_ {6 \; (s)} \) | + | \ (6O_ {2 \; (g)} \) | → | \ (6CO_ {2 \; (g)} \) | \ (6H_2O _ {(l)} \) | ||
|---|---|---|---|---|---|---|---|
а. | 1 молекула | 6 молекул | 6 молекул | 6 молекул | |||
| б. | 1 моль | 6 моль | 6 моль | 6 моль | |||
| с. | 180,16 г | 191,9928 г | 264,06 г | 108,09 г | |||
г. | 6.022 × 10 23 молекул | 3,613 × 10 24 молекул | 3,613 × 10 24 молекул | 3.613 × 10 24 молекула |
Упражнение \ (\ PageIndex {2} \): взрыв нитрата аммония
Аммиачная селитра — обычное удобрение, но при неправильных условиях может быть опасным. В 1947 году корабль, загруженный нитратом аммония, загорелся во время разгрузки и взорвался, разрушив город Техас-Сити, штат Техас.
Нитрат аммония может быть опасным. На этом аэрофотоснимке Техас-Сити, штат Техас, показаны разрушения, вызванные взрывом корабля с нитратом аммония 16 апреля 1947 года.Для просмотра видео щелкните здесь.
Взрыв возник в результате следующей реакции:
\ [2NH_4NO_ {3 \; (s)} \ rightarrow 2N_ {2 \; (g)} + 4H_2O _ {(g)} + O_ {2 \; (g)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в уравнении в терминах
- отдельных молекул и ионов.
- моль реактивов и продуктов.
- граммов реагентов и продуктов с учетом 2 моль нитрата аммония.
- чисел молекул или формульных единиц реагентов и продуктов на 2 моль нитрата аммония.
Ответ :
| \ (2NH_4NO_ {3 \; (s)} \) | → | \ (2N_ {2 \; (g)} \) | + | \ (4H_2O _ {(g)} \) | + | \ (O_ {2 \; (g)} \) | |
|---|---|---|---|---|---|---|---|
а. | 2NH 4 + ионов и 2NO 3 — ионов | 2 молекулы | 4 молекулы | 1 молекула | |||
| б. | 2 моль | 2 моль | 4 моль | 1 моль | |||
| с. | 160,0864 г | 56,0268 г | 72,0608 г | 31,9988 г | |||
г. | 1,204 × 10 24 формульных единиц | 1.204 × 10 24 молекул | 2.409 × 10 24 молекул | 6.022 × 10 23 молекул |
Определение молей и масс реагентов и продуктов с использованием стехиометрических факторов (мольных соотношений): https://youtu.be/74mHV0CZcjw
Сводка
Химическая реакция описывается химическим уравнением, которое определяет идентичность и количество реагентов и продуктов.В химической реакции одно или несколько веществ превращаются в новые вещества. Химическая реакция описывается химическим уравнением , выражением, которое определяет идентичность и количество веществ, участвующих в реакции. Химическое уравнение показывает исходное (ые) соединение (я) — реагенты — слева и конечное соединение (я) — продукты — справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении — это коэффициент для этого вида. Мольное отношение двух веществ в химической реакции — это отношение их коэффициентов в сбалансированном химическом уравнении.
Химическое уравнение показывает исходное (ые) соединение (я) — реагенты — слева и конечное соединение (я) — продукты — справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении — это коэффициент для этого вида. Мольное отношение двух веществ в химической реакции — это отношение их коэффициентов в сбалансированном химическом уравнении.
скорость реакции | Факты и формула
скорость реакции , в химии, скорость, с которой протекает химическая реакция. Он часто выражается либо через концентрацию (количество на единицу объема) продукта, которая образуется за единицу времени, либо через концентрацию реагента, которая потребляется за единицу времени.Альтернативно, это может быть определено в терминах количества потребляемых реагентов или продуктов, образованных за единицу времени. Например, предположим, что вычисленное химическое уравнение реакции имеет вид A + 3B → 2Z.
Например, предположим, что вычисленное химическое уравнение реакции имеет вид A + 3B → 2Z.
Ставка может быть выражена следующими альтернативными способами: d [Z] / d t , — d [A] / d t , — d [B] / d t , d z / d t , — d a / d t , — d b / d t , где t — время, [A], [B] и [Z] — концентрации веществ, а a, b и z — их количества.Обратите внимание, что все эти шесть выражений отличаются друг от друга, но просто связаны.
Британская викторина
Основы химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Химические реакции протекают с совершенно разными скоростями в зависимости от природы реагирующих веществ, типа химического превращения, температуры и других факторов. В общем, реакции, в которых объединяются атомы или ионы (электрически заряженные частицы), происходят очень быстро, в то время как реакции, в которых ковалентные связи (связи, в которых атомы разделяют электроны) разрываются, протекают намного медленнее. Для данной реакции скорость реакции будет варьироваться в зависимости от температуры, давления и количества присутствующих реагентов.Реакции обычно замедляются со временем из-за истощения реагентов. В некоторых случаях добавление вещества, которое само по себе не является реагентом, называемого катализатором, ускоряет реакцию. Константа скорости или конкретная константа скорости — это константа пропорциональности в уравнении, которое выражает взаимосвязь между скоростью химической реакции и концентрациями реагирующих веществ. Измерение и интерпретация реакций составляют раздел химии, известный как химическая кинетика.
Химические реакции — Общая информация
Химические реакции — Общая информация Химические реакции — Общая информация |
Химические уравнения — это сокращенный метод представления химических реакций. В химической реакции реагенты (то, с чего вы начинаете) превращаются в продукты (то, чем вы заканчиваете). Реагенты, которые показаны в левой части уравнения, и продукты, которые показаны справа, разделены стрелкой.Уравнение ниже представляет реакцию углерода с газообразным кислородом с образованием диоксида углерода.
C + O 2 CO 2Эту реакцию можно также изобразить графически:
Обратите внимание, что количество атомов углерода одинаково по обе стороны стрелки. Есть один атом углерода на стороне реагента и один атом углерода на стороне продукта. То же самое верно и для кислорода, за исключением того, что есть два атома кислорода с каждой стороны (помните, что нижний индекс два в молекуле кислорода означает, что есть два атома кислорода, связанных вместе). Когда количество атомов на каждой стороне уравнения равно, уравнение считается сбалансированным. Сбалансированное уравнение согласуется с Законом Сохранения Материи, который гласит, что материя не создается и не разрушается во время химической реакции.
Когда количество атомов на каждой стороне уравнения равно, уравнение считается сбалансированным. Сбалансированное уравнение согласуется с Законом Сохранения Материи, который гласит, что материя не создается и не разрушается во время химической реакции.
Когда метан (CH 4 ) реагирует с кислородом, он образует диоксид углерода и воду.
CH 4 + O 2 H 2 O + CO 2Здесь мы замечаем, что реакция не сбалансирована, так как количество атомов водорода различно с каждой стороны.То же самое и с числом атомов кислорода. Чтобы сбалансировать это уравнение, мы должны добавить коэффициенты перед кислородом и водой. Коэффициенты используются, когда мы хотим представить более одного конкретного атома или молекулы.
CH 4 + 2 O 2 2 H 2 O + CO 2 С добавлением коэффициентов реакция уравновешивается. Одна молекула метана реагирует с двумя молекулами кислорода с образованием одной молекулы диоксида углерода и двух молекул воды. Графически это может быть представлено:
Графически это может быть представлено:
Ряд других символов иногда используется при написании химических уравнений.
Продолжайте читать о том, как классифицировать реакции.
12.3 Законы о тарифах — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Объяснять форму и функцию закона о нормах
- Используйте законы скорости для расчета скорости реакции
- Используйте данные скорости и концентрации для определения порядка реакции и получения законов скорости
Как описано в предыдущем модуле, на скорость реакции часто влияют концентрации реагентов. Скоростные законы (иногда называемые законами дифференциальной скорости ) или скоростные уравнения — это математические выражения, которые описывают взаимосвязь между скоростью химической реакции и концентрацией ее реагентов. В качестве примера рассмотрим реакцию, описываемую химическим уравнением
Скоростные законы (иногда называемые законами дифференциальной скорости ) или скоростные уравнения — это математические выражения, которые описывают взаимосвязь между скоростью химической реакции и концентрацией ее реагентов. В качестве примера рассмотрим реакцию, описываемую химическим уравнением
, где a и b — стехиометрические коэффициенты. Закон скорости этой реакции записывается как:
скорость = k [A] m [B] nrate = k [A] m [B] n, в котором [ A ] и [ B ] представляют собой молярные концентрации реагентов, а k — константа скорости, которая характерна для конкретной реакции при определенной температуре.Показатели степени m и n представляют собой порядки реакции и обычно представляют собой положительные целые числа, хотя они могут быть дробными, отрицательными или нулевыми. Константа скорости k и порядки реакции m и n должны быть определены экспериментально, наблюдая, как скорость реакции изменяется при изменении концентраций реагентов. Константа скорости k не зависит от концентраций реагентов, но зависит от температуры.
Константа скорости k и порядки реакции m и n должны быть определены экспериментально, наблюдая, как скорость реакции изменяется при изменении концентраций реагентов. Константа скорости k не зависит от концентраций реагентов, но зависит от температуры.
Порядки реакций в законе скорости описывают математическую зависимость скорости от концентраций реагентов. Ссылаясь на общий закон скорости выше, реакция составляет m порядка относительно A и n порядка относительно B . Например, если m = 1 и n = 2, реакция будет первого порядка для A и второго порядка для B . Общий порядок реакции — это просто сумма порядков для каждого реагента. Для приведенного в качестве примера закона скорости реакция является общим третьим порядком (1 + 2 = 3). Ниже показано несколько конкретных примеров, чтобы проиллюстрировать эту концепцию.
Для приведенного в качестве примера закона скорости реакция является общим третьим порядком (1 + 2 = 3). Ниже показано несколько конкретных примеров, чтобы проиллюстрировать эту концепцию.
Тарифный закон:
описывает реакцию первого порядка по перекиси водорода и первого порядка в целом. Тарифный закон:
скорость = k [C4H6] 2rate = k [C4H6] 2описывает реакцию второго порядка по C 4 H 6 и второго порядка в целом. Тарифный закон:
скорость = k [H +] [OH−] скорость = k [H +] [OH−]описывает реакцию первого порядка по H + , первого порядка по OH — и второго порядка в целом.
Пример 12,3
Написание тарифных законов из приказов о реакции
Эксперимент показывает, что реакция диоксида азота с оксидом углерода: NO2 (г) + CO (г) ⟶NO (г) + CO2 (г) NO2 (г) + CO (г) ⟶NO (г) + CO2 (г) является вторым порядком по NO 2 и нулевым порядком по CO при 100 ° C. Каков закон скорости реакции?
Каков закон скорости реакции?
Решение
Реакция будет иметь вид: скорость = k [NO2] m [CO] nrate = k [NO2] m [CO] nРеакция второго порядка по NO 2 ; таким образом, м = 2.Реакция нулевого порядка по СО; таким образом, n = 0. Закон скорости:
rate = k [NO2] 2 [CO] 0 = k [NO2] 2rate = k [NO2] 2 [CO] 0 = k [NO2] 2Помните, что число, возведенное в нулевую степень, равно 1, таким образом [ CO] 0 = 1, поэтому член концентрации CO может быть исключен из закона скорости: скорость реакции зависит исключительно от концентрации NO 2 . В следующем разделе главы о механизмах реакции будет объяснено, как концентрация реагента может не влиять на скорость реакции, несмотря на то, что он участвует в реакции.
Проверьте свои знания
Закон скорости реакции: h3 (г) + 2NO (г) ⟶N2O (г) + h3O (г) h3 (г) + 2NO (г) ⟶N2O (г) + h3O (г) было определено как скорость = k [NO] 2 [H 2 ]. Каков порядок по каждому реагенту и каков общий порядок реакции?
Каков порядок по каждому реагенту и каков общий порядок реакции?
Отвечать:
Заказв NO = 2; заказ в H 2 = 1; общий заказ = 3
Проверьте свои знания
В реакции переэтерификации триглицерид реагирует со спиртом с образованием сложного эфира и глицерина.Многие студенты узнают о реакции между метанолом (CH 3 OH) и этилацетатом (CH 3 CH 2 OCOCH 3 ) в качестве образца реакции, прежде чем изучать химические реакции, приводящие к образованию биодизеля: Ch4OH + Ch4Ch3OCOCh4⟶Ch4OCOCh4 + Ch4Ch3OHCh4OH + Ch4Ch3OCOCh4⟶Ch4OCOCh4 + Ch4Ch3OHЗакон скорости реакции между метанолом и этилацетатом при определенных условиях определен как:
скорость = k [Ch4OH] скорость = k [Ch4OH]Каков порядок реакции по отношению к метанолу и этилацетату и каков общий порядок реакции?
Отвечать:
заказ в CH 3 OH = 1; заказать в CH 3 CH 2 OCOCH 3 = 0; общий заказ = 1
Обычным экспериментальным подходом к определению законов скорости является метод начальных ставок. Этот метод включает измерение скорости реакции для нескольких экспериментальных испытаний, проводимых с использованием различных исходных концентраций реагентов. Сравнение измеренных скоростей для этих испытаний позволяет определить порядки реакции и, впоследствии, константу скорости, которые вместе используются для формулирования закона скорости. Этот подход проиллюстрирован в следующих двух примерах упражнений.
Этот метод включает измерение скорости реакции для нескольких экспериментальных испытаний, проводимых с использованием различных исходных концентраций реагентов. Сравнение измеренных скоростей для этих испытаний позволяет определить порядки реакции и, впоследствии, константу скорости, которые вместе используются для формулирования закона скорости. Этот подход проиллюстрирован в следующих двух примерах упражнений.
Пример 12,4
Определение закона о ставке по начальным ставкам
Озон в верхних слоях атмосферы истощается, когда он вступает в реакцию с оксидами азота.Скорость реакций оксидов азота с озоном является важным фактором при принятии решения о том, насколько важны эти реакции в формировании озоновой дыры над Антарктидой (рис. 12.8). Одной из таких реакций является сочетание оксида азота NO с озоном O 3 : Фигура
12,8
Контурная карта, показывающая концентрацию стратосферного озона и «озоновую дыру», которая возникает над Антарктидой в весенние месяцы. (кредит: модификация работы НАСА)
(кредит: модификация работы НАСА)
Эта реакция была изучена в лаборатории, и следующие данные скорости были определены при 25 ° C.
| Пробная | [NO] (моль / л) | [O 3 ] (моль / л) | Δ [NO2] Δt (моль · л-1 · с-1) Δ [NO2] Δt (моль · л-1 · с-1) |
|---|---|---|---|
| 1 | 1,00 × × 10 −6 | 3,00 × × 10 −6 | 6.60 × × 10 −5 |
| 2 | 1,00 × × 10 −6 | 6,00 × × 10 −6 | 1,32 × × 10 −4 |
| 3 | 1. 00 × × 10 −6 00 × × 10 −6 | 9,00 × × 10 −6 | 1,98 × × 10 −4 |
| 4 | 2,00 × × 10 −6 | 9,00 × × 10 −6 | 3,96 × × 10 −4 |
| 5 | 3,00 × × 10 −6 | 9,00 × × 10 −6 | 5,94 × × 10 −4 |
Определите закон скорости и константу скорости реакции при 25 ° C.
Решение
Нормативный закон будет иметь вид: скорость = k [NO] m [O3] nrate = k [NO] m [O3] nОпределите значения m , n и k из экспериментальных данных, используя следующий трехэтапный процесс:
- Шаг 1.

Определите значение m из данных, в которых [NO] изменяется, а [O 3 ] является постоянным. В последних трех экспериментах [NO] изменяется, в то время как [O 3 ] остается постоянным. Когда [НЕТ] удваивается с пробной 3 до 4, ставка удваивается, а когда [НЕТ] утроится от пробной 3 до 5, ставка также утроится.Таким образом, скорость также прямо пропорциональна [NO], и m в законе ставок равна 1.
- Шаг 2.
Определите значение n из данных, в которых [O 3 ] изменяется, а [NO] является постоянным. В первых трех экспериментах [NO] постоянно, а [O 3 ] меняется. Скорость реакции изменяется прямо пропорционально изменению [O 3 ]. Когда [O 3 ] удваивается с испытания 1 на 2, ставка удваивается; когда [O 3 ] утраивается от опыта 1 до 3, ставка увеличивается также втрое.
скорость = k [NO] 1 [O3] 1 = k [NO] [O3] скорость = k [NO] 1 [O3] 1 = k [NO] [O3] Таким образом, ставка прямо пропорциональна [O 3 ], а n равно 1. Закон скорости таков:
Таким образом, ставка прямо пропорциональна [O 3 ], а n равно 1. Закон скорости таков: - Шаг 3.
Определите значение k из одного набора концентраций и соответствующего коэффициента . Ниже использованы данные испытания 1:
k = скорость [NO] [O3] = 6,60 × 10–5 моль л – 1 с – 1 (1,00 × 10–6 моль л – 1) (3,00 × 10–6 моль – 1) = 2,20 × 107 лмоль – 1 с – 1 k = скорость [NO] [O3] = 6,60 × 10-5 моль л-1с-1 (1.00 × 10-6 моль л — 1) (3,00 × 10-6 моль — 1) = 2,20 × 107 лмоль — 1 с — 1
Проверьте свои знания
Ацетальдегид разлагается при нагревании с образованием метана и окиси углерода в соответствии с уравнением: Ch4CHO (г) ⟶Ch5 (г) + CO (г) Ch4CHO (г) ⟶Ch5 (г) + CO (г)Определите закон скорости и константу скорости реакции по следующим экспериментальным данным:
| Пробная | [CH 3 CHO] (моль / л) | −Δ [Ch4CHO] Δt (моль · л − 1 · с − 1) −Δ [Ch4CHO] Δt (моль · л − 1 · с-1) |
|---|---|---|
| 1 | 1. 75 × × 10 −3 75 × × 10 −3 | 2,06 × × 10 −11 |
| 2 | 3,50 × × 10 −3 | 8,24 × × 10 −11 |
| 3 | 7,00 × × 10 −3 | 3.30 × × 10 −10 |
Отвечать:
скорость = k [Ch4CHO] 2rate = k [Ch4CHO] 2 с k = 6,73 × × 10 −6 л / моль / с
Пример 12,5
Определение тарифных законов по начальным ставкам
Используя метод начальных скоростей и экспериментальные данные, определите закон скорости и значение константы скорости этой реакции: 2NO (г) + Cl2 (г) ⟶2NOCl (г) 2NO (г) + Cl2 (г) ⟶2NOCl (г)| Пробная | [NO] (моль / л) | [Cl 2 ] (моль / л) | −Δ [NO] Δt (моль · л − 1 · с − 1) −Δ [NO] Δt (моль · л − 1 · с − 1) |
|---|---|---|---|
| 1 | 0. 10 10 | 0,10 | 0,00300 |
| 2 | 0,10 | 0,15 | 0,00450 |
| 3 | 0,15 | 0,10 | 0,00675 |
Решение
Закон скорости этой реакции будет иметь вид: скорость = k [NO] m [Cl2] nrate = k [NO] m [Cl2] nКак и в примере 12.4, подойдите к этой проблеме поэтапно, определив значения m и n из экспериментальных данных, а затем используя эти значения, чтобы определить значение k .В этом примере, однако, явный алгебраический подход (по сравнению с неявным подходом в предыдущем примере) будет использоваться для определения значений m и n :
- Шаг 1.

Определите значение m из данных, в которых [NO] изменяется, а [Cl 2 ] является постоянным . Запишите отношения с индексами x и y , чтобы указать данные из двух разных испытаний:
ratexratey = k [NO] xm [Cl2] xnk [NO] ym [Cl2] ynratexratey = k [NO] xm [Cl2] xnk [NO] ym [Cl2] ynИспользование третьего испытания и первого испытания, в которых [Cl 2 ] не меняется, дает:
скорость 3 скорость 1 = 0.006750.00300 = k (0.15) m (0.10) nk (0.10) m (0.10) nrate 3rate 1 = 0.006750.00300 = k (0.15) m (0.10) nk (0.10) m (0.10) nОтмена эквивалентных членов в числителе и знаменателе оставляет:
0,006750,00300 = (0,15) м (0,10) м 0,0067 50,00 300 = (0,15) м (0,10) м, что упрощается до:
Используйте логарифмы для определения показателя степени м :
ln (2,25) = млн (1,5) ln (2,25) ln (1,5) = m2 = млн (2,25) = млн (1,5) ln (2,25) ln (1,5) = m2 = mПодтвердите результат
- Шаг 2.

Определите значение n из данных, в которых [Cl 2 ] изменяется, а [NO] является постоянным.
скорость 2 скорость 1 = 0,004500,00300 = k (0,10) m (0,15) nk (0,10) m (0,10) nrate 2rate 1 = 0,004500.00300 = k (0,10) m (0,15) nk (0,10) m (0,10) nОтмена дает:
0,00450,0030 = (0,15) n (0,10) n0,00450,0030 = (0,15) n (0,10) n, что упрощается до:
Таким образом, n должно быть равно 1, а закон ставок имеет следующий вид:
скорость = k [NO] m [Cl2] n = k [NO] 2 [Cl2] скорость = k [NO] m [Cl2] n = k [NO] 2 [Cl2] - Шаг 3.
Определите числовое значение константы скорости k с соответствующими единицами измерения. Единицы измерения скорости реакции — моль / л / с. Единицы для k являются любыми необходимыми, так что замена в выражение закона скорости дает соответствующие единицы для ставки.
 В этом примере единицы концентрации: моль 3 / л 3 . Единицами для k должны быть моль −2 л 2 / с, так что скорость выражается в моль / л / с.
В этом примере единицы концентрации: моль 3 / л 3 . Единицами для k должны быть моль −2 л 2 / с, так что скорость выражается в моль / л / с.Чтобы определить значение k после того, как выражение закона скорости было решено, просто вставьте значения из первого экспериментального испытания и решите для k :
0,00300 моль – 1 с – 1 = k (0,10 моль – 1) 2 (0,10 моль – 1) 1k = 3,0 моль – 2 л 2 с – 10,00 300 моль – 1 с – 1 = k (0,10 моль – 1) 2 (0,10 моль – 1) 1к = 3,0 моль − 2L2с − 1
Проверьте свои знания
Используйте предоставленные начальные данные о скорости, чтобы вывести закон скорости реакции, уравнение которой имеет следующий вид: OCl− (aq) + I− (aq) ⟶OI− (aq) + Cl− (aq) OCl− (aq) + I− (aq) ⟶OI− (aq) + Cl− (aq)| Пробная | [OCl —] (моль / л) | [I —] (моль / л) | Начальная скорость (моль / л / с) |
|---|---|---|---|
| 1 | 0. 0040 0040 | 0,0020 | 0,00184 |
| 2 | 0,0020 | 0,0040 | 0,00092 |
| 3 | 0,0020 | 0,0020 | 0,00046 |
Определите выражение для закона скорости и значение константы скорости k с соответствующими единицами измерения для этой реакции.
Отвечать:
, скорость 2, скорость 3 = 0,000920,00046 = k (0,0020) x (0,0040) yk (0,0020) x (0,0020) yrate 2rate 3 = 0.000920,00046 = k (0,0020) x (0,0040) yk (0,0020) x (0,0020) y
2,00 = 2,00 y
y = 1
скорость 1 скорость 2 = 0,001840,00092 = k (0,0040) x (0,0020) yk (0,0020) x (0,0040) yrate 1rate 2 = 0,001840,00092 = k (0,0040) x (0,0020) yk (0,0020) x (0,0040) y
2. 00 = 2x2y2.00 = 2×214.00 = 2xx = 22.00 = 2x2y2.00 = 2×214.00 = 2xx = 2
00 = 2x2y2.00 = 2×214.00 = 2xx = 22.00 = 2x2y2.00 = 2×214.00 = 2xx = 2
Подставляя данные о концентрации из испытания 1 и решая для k , получаем:
скорость = k [OCl−] 2 [I-] 10,00184 = k (0,0040) 2 (0,0020) 1k = 5,75 × 104 моль − 2L2s − 1rate = k [OCl−] 2 [I−] 10.00184 = k (0,0040) 2 (0,0020) 1k = 5,75 × 104 моль − 2L2s − 1
Единицы порядка реакции и константы скорости
В некоторых из наших примеров порядки реакции в законе скорости совпадают с коэффициентами в химическом уравнении реакции. Это просто совпадение, а зачастую и не так.
Законы скорости могут демонстрировать дробные порядки для некоторых реагентов, а отрицательные порядки реакции иногда наблюдаются, когда увеличение концентрации одного реагента вызывает снижение скорости реакции.Предлагается несколько примеров, иллюстрирующих эти моменты:
NO2 + CO⟶NO + CO2rate = k [NO2] 2Ch4CHO⟶Ch5 + COrate = k [Ch4CHO] 22N2O5⟶NO2 + O2rate = k [N2O5] 2NO2 + F2⟶2NO2Frate = k [NO2] [F2] 2NO2Cl⟶2NO2 + Cl2rate = k [NO2Cl] NO2 + CO⟶NO + CO2rate = k [NO2] 2Ch4CHO⟶Ch5 + COrate = k [Ch4CHO] 22N2O5⟶NO2 + O2rate = k [N2O5] 2NO2 + F2⟶2NO2Frate = k [NO2] [F2] 2NO2Cl⟶2NO2 + Cl2rate = k [NO2Cl] Важно отметить, что законов скорости определяются только экспериментально и не могут быть надежно предсказаны стехиометрией реакции.
Единицы для константы скорости будут изменяться в зависимости от общего порядка реакции.Единица измерения константы скорости реакции второго порядка, описанной в примере 12.4, была определена как Лмоль-1с-1Лмоль-1с-1. Для реакции третьего порядка, описанной в Примере 12.5, единица для k была получена как L2 моль-2 с-1. L2 моль-2 с-1. Для анализа размеров требуется, чтобы единица константы скорости для реакции, общий порядок которой составляет x , была Lx − 1 моль1 − xs − 1.Lx − 1 моль1 − xs − 1. В таблице 12.1 приведены единицы константы скорости для общих порядков реакции.
Единицы константы скорости для общих приказов на реакцию
| Общий порядок реакции ( x ) | Единица константы скорости (L x -1 моль 1- x с -1 ) |
|---|---|
| 0 (ноль) | моль л −1 с −1 |
| 1 (первая) | с −1 |
| 2 (второй) | л моль −1 с −1 |
| 3 (третий) | L 2 моль −2 с −1 |
Таблица
12. 1
1
Обратите внимание, что единицы в этой таблице были получены с использованием конкретных единиц для концентрации (моль / л) и времени (с), хотя могут использоваться любые допустимые единицы для этих двух свойств.
Реакция синтеза: определение, формула и примеры — видео и стенограмма урока
Что такое реакция синтеза?
Кронут и мошенник, два очень веселых названия еды, они, несомненно, покорили мир во время своего грандиозного дебюта. Знаете ли вы, что это прекрасные примеры продуктов, полученных в результате реакции синтеза? Смешивать термин «еда» с научным термином может показаться странным, но это определенно правда.Прежде чем обсуждать, как это происходит, давайте рассмотрим, что такое реакция синтеза.
Реакция синтеза представляет собой соединение двух реагентов или соединений с образованием сложного продукта, также называемого соединением. Иногда реакции синтеза могут приводить к образованию более чем одного продукта, как мы вскоре увидим в процессе фотосинтеза.
Будь то один сложный продукт или несколько продуктов, отличный способ запомнить, что такое реакция синтеза, — это подумать о слове «комбинация».«По сути, вы комбинируете реагенты, чтобы получить желаемый продукт. Формула реакции синтеза, включающей образование сложного продукта, показана здесь, на диаграмме 1. Как вы можете видеть, вещество D соединяется с веществом R с образованием более сложного соединения, обозначенного DR.
Как вы можете понять из уравнения, показанного на диаграмме 1, реакция синтеза не является многостадийным процессом.То есть нет необходимости беспокоиться об изучении нескольких шагов для этой реакции. Фактически, реакция синтеза, пожалуй, одна из наиболее широко используемых реакций; не только в химии, но и в нестандартных местах, например, на наших кухнях.
Прежде чем приступить к рассмотрению нескольких примеров, следует помнить о двух концепциях реакций синтеза.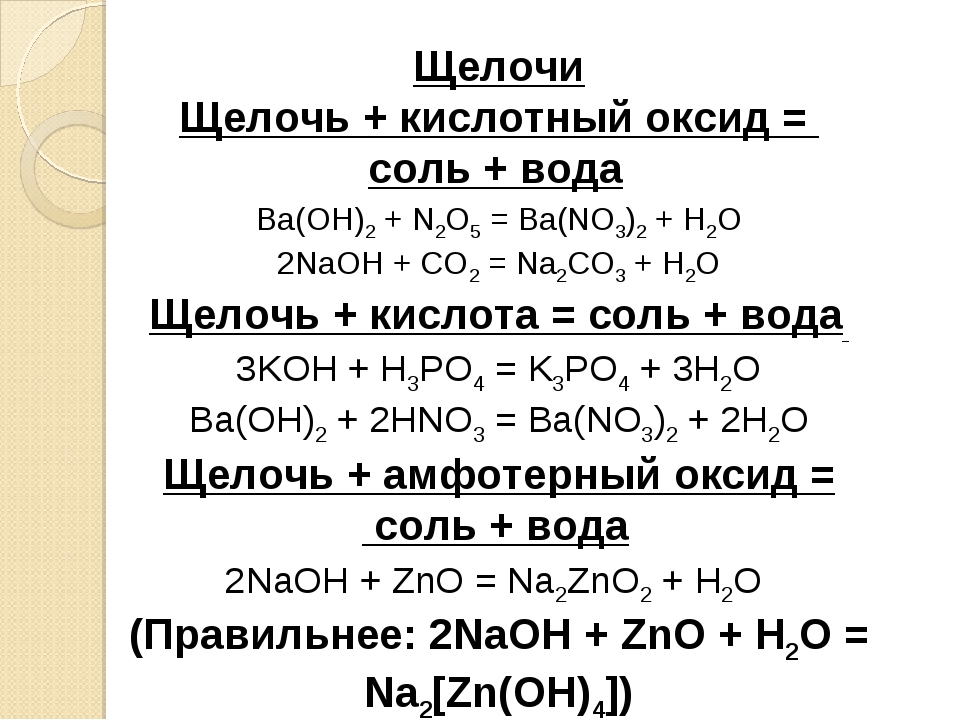 Во-первых, бинарные соединения могут быть получены в результате реакции синтеза. Бинарное соединение — это соединение, которое содержит только два разных элемента.Например, комбинация двух реагентов, железа и кислорода, приведет к образованию бинарного соединения оксида железа, широко известного как ржавчина.
Во-первых, бинарные соединения могут быть получены в результате реакции синтеза. Бинарное соединение — это соединение, которое содержит только два разных элемента.Например, комбинация двух реагентов, железа и кислорода, приведет к образованию бинарного соединения оксида железа, широко известного как ржавчина.
Во-вторых, всегда помните, работая с реакциями синтеза, чтобы сбалансировать ваше уравнение. Как вы вскоре увидите, иногда требуются коэффициенты, например числа, чтобы гарантировать, что то, что присутствует на левой стороне реакции, равно количеству того, что присутствует на правой стороне реакции. Теперь, когда мы рассмотрели эти две фундаментальные концепции, давайте применим полученные знания к нескольким примерам.
Поиск реакции
Доступна следующая информация о поиске реакции:
Пожалуйста, следуйте инструкциям ниже, чтобы провести поиск:
Помощь по поиску реакции
Правила для рецептов / продуктов (шаг 1)
(Вернуться к поиску)- Для каждого вида, который вы хотите сопоставить, введите один
из следующих:
- Химическое наименование
- Химическая формула
- Регистрационный номер CAS
- Подстановочные знаки звездочка ( * ) и вопросительный знак (? )
могут использоваться следующие символы элементов в химических формулах.
 Звездочка
соответствует нулю или более вхождений элемента. Знак вопроса совпадает
одно или несколько вхождений элемента.
Звездочка
соответствует нулю или более вхождений элемента. Знак вопроса совпадает
одно или несколько вхождений элемента.
Параметры поиска (шаг 2)
(Вернуться к поиску)- Соответствие обратных реакций
- Сопоставьте реакции, соответствующие указанным спецификациям, за исключением Дело в том, что реагенты и продукты меняются местами.
- Разрешить реагенты в дополнение к указанным
- Сопоставьте реакции, в которых участвуют дополнительные реагенты, с теми, которые указано.Этот вариант особенно полезен, когда только один реагент указан.
- Разрешить продукты помимо указанных
- Сопоставьте реакции, которые производят дополнительные продукты, с теми, которые указано.
- Исключить реакции, содержащие ионы
- Этот вариант исключает реакции, в которых в качестве реагентов или продуктов используются ионы.

Справка по типу реакции (шаг 3)
(Вернуться к поиску)Поиск может быть ограничен путем выбора желаемого типа реакции.Есть три варианта типа реакции:
- Любая реакция
- Никаких ограничений по типу реакции нет.
- Ионная кластеризация
- Поиски ограничиваются реакциями кластеризации ионов.
- Отключение
- Поиски ограничиваются реакциями диссоциации.
Информация о поисках ионных кластеров
Следующие подходы рекомендуются для поиска кластерные ионные реакции:
Поиск по коровому иону
- Введите имя, формулу или номер реестра CAS главного сервера.
ион в качестве реагента.Обратите внимание, что если вы войдете в нейтральный
формула для основного иона, вы получите реакции для всех
ионы с данной формулой. Например, поиск по запросу « Mg »
найдет реакции с Mg + и Mg +2 .

- Если интересующий лиганд известен, введите его имя, формулу или регистрационный номер CAS в качестве другого реагента.
- Выберите тип реакции «Ионная кластеризация».
- Нажмите кнопку «Поиск».
Поиск по лиганду
- Введите имя, формулу или регистрационный номер CAS лиганда. в качестве реагента.
- Выберите тип реакции «Ионная кластеризация».
- Нажмите кнопку «Поиск».
Поиск по ионному кластеру
Эта форма в настоящее время не поддерживает поиск на основе ion кластерная формула. Мы надеемся устранить этот недостаток в будущем. обновление на сайте.
Вернуться к форме поиска.
Как определить химическую формулу продукта?
1) Реакции горения. На мой взгляд, с ними проще всего разобраться в продуктах, потому что продукты всегда одни и те же! Любая реакция горения приведет к образованию # CO_2 # и # H_2O #.Примером может служить сжигание пропана:
# C_3H_8 (г) + 5O_2 (г) → 3O_2 (г) + 4H_2O (г) #
2) Реакции синтеза / композиции: в этой реакции 2 простых вещества объединяются, чтобы сформировать более сложное. Как правило, вы хотите посмотреть на заряды ионов двух реагентов и использовать их для определения полученного соединения. Прекрасным примером является образование воды из водорода и кислорода:
Как правило, вы хотите посмотреть на заряды ионов двух реагентов и использовать их для определения полученного соединения. Прекрасным примером является образование воды из водорода и кислорода:
# 2H_2 (г) + O_2 (г) → 2H_2O (л) #
3) Реакции разложения: В этой реакции 1 сложное соединение распадается на 2 более простых вещества.Реакции разложения имеют 6 подкатегорий, которые могут помочь вам предсказать продукты. Я не буду вдаваться в эти категории, так как мой собственный курс химии не рассматривал их, и я, вероятно, не смог бы их хорошо объяснить, но я оставлю эту ссылку, которая проходит по ним: http://eppe.tripod.com /reaction.htm
4) Реакции одиночного смещения: Эта реакция происходит, когда один элемент обменивается местами с другим элементом в соединении. Пример этого: #Zn (s) + 2HCl (aq) → ZnCl_2 (aq) + H_2 (g) # С их помощью убедитесь, что переключаемый элемент переключается с элементом с таким же зарядом.Как и в примере, Zn переключается с водородом, потому что оба являются катионами.
 к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.

 Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, справа: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
 Этот шаг не применяется к этому уравнению.
Этот шаг не применяется к этому уравнению. 11} \]
11} \]



 Таким образом, ставка прямо пропорциональна [O 3 ], а n равно 1. Закон скорости таков:
Таким образом, ставка прямо пропорциональна [O 3 ], а n равно 1. Закон скорости таков: 

 В этом примере единицы концентрации: моль 3 / л 3 . Единицами для k должны быть моль −2 л 2 / с, так что скорость выражается в моль / л / с.
В этом примере единицы концентрации: моль 3 / л 3 . Единицами для k должны быть моль −2 л 2 / с, так что скорость выражается в моль / л / с. Звездочка
соответствует нулю или более вхождений элемента. Знак вопроса совпадает
одно или несколько вхождений элемента.
Звездочка
соответствует нулю или более вхождений элемента. Знак вопроса совпадает
одно или несколько вхождений элемента.
