63. Хром
Хром (Cr) – d-элемент расположенный в 4-м периоде, в VI группе побочной подгруппы. Высшая степень окисления – +6. В соединениях может проявлять степень окисления от + до +6, но наиболее характерными для хрома является степень окисления +3 и +6. В остальных степенях окисления соединения хрома неустойчивы.
Физические свойства: хром – серовато-белый металл с характерным металлическим блеском. Природный хром состоит из смеси 5 изотопов: 50, 52, 53, 54, 56. Это самый твердый из всех известных металлов, его плотность 7,2 г/см3. Температура плавления – 1855 °C, температура кипения – 2642 °C. При обычной температуре хром устойчив к воздействию воды и воздуха.
Химические свойства: электронная конфигурация: 1s22s22p23s23p63d54s1. В образовании химических связей хрома участвуют не только электроны внешнего 4 уровня, но и электроны предпоследнего уровня – 3d-подуровня.
При высокой температуре хром горит в кислороде: 4Cr + 3О2 = 2Cr2О3.
Раскаленный хром реагирует с парами воды, вытесняя из нее кислород: 2Cr + 3Н2О = Cr2О3 + 3Н2?.
При нагревании реагирует с галогеноводородами, S, N2, P4, C, Si, B:
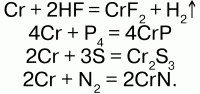
С галогенами реагирует не одинаково:
а) со фтором взаимодействует даже на холоде: Cr + 3F2 = CrF6;
б) с хлором реагирует при нагревании: 2Cr + 3Cl2 = 2CrCl3.
Разбавленная соляная и серная кислоты растворяют хром с выделением водорода, а в холодной азотной он пассивируется. Хром образует три оксида: CrО, Cr2О3 и CrО3.
Получение: В чистом виде хром получают двумя способами:
1) металлотермический – восстановление металла из его оксида с помощью другого металла;
2) электролитический – электролиз водного раствора хромовых кислот. При этом одновременно с хромом на катоде выделяется водород. Поэтому получаемый хром содержит включения водорода. Для получения чистого хрома его переплавляют в вакууме.
Металлический хром получают алюмотерми-ческим способом (способ Бекетова) из оксида Cr2О3: Cr2О3 + 2Al = Al2О3 + 2Cr.
Нахождение в природе: в природе хром встречается только в виде соединений, важнейшим из которых является хромистый железняк FeCrO4 или Fe(CrO)2, из которого путем восстановления углеродом в электропечах получают сплав – феррохром. Используется хром в инструментальной и автомобильной промышленности: хромирование – покрытие хромом других металлов; в металлургии – при производстве легированной стали.
64. Оксиды и гидроксиды хрома
Хром образует три оксида: CrО, Cr2О3 и CrО3. Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте: CrО + 2НСl = CrСl2 + Н2О.
При нагревании на воздухе выше 100 °C CrО превращается в Cr2О3: 4CrО + О2 = 2Cr2О3.
Оксид хрома III (Cr2О3) – тугоплавкий порошок зеленого цвета (температура плавления – 2265 °C). Твердость кристаллов близка к корунду, поэтому его вводят в состав полирующих средств. Получают из хромистого железняка (FeCr2O4). При окислительно-щелочном сплавлении последнего с содой образуются хромат натрия NaCrO4: 2Fe(CrO2)2 + 4Na2CO3 + 1/2O2 = 4Na2CrO4 + Fe2O3 + 4CO2.
Затем Na2CrO4 переводят в Na2Cr2O7 – дихромат: Na2CrO4 + Н2SO4 = Na2Cr2O7 + Н2О + Na2SO4.
Далее дихромат восстанавливают углем и получают Cr2О3: Na2Cr2O7 + 2С = Na2CO3 + Cr2О3 + СО?.
В лаборатории Cr2О3 получают термическим разложением дихромата аммония: (Nh5)2Cr2O7?Cr2О3 + N2 + 4Н2О.Cr2О3 – амфотерный оксид: реагирует с основаниями и кислотами при сплавлении его со щелочами образует хромиты: Cr2О3 + NaОН = 2NaCrO2 + Н2О.
Оксид хрома VI (CrО3) – темно-красные кристаллы, хорошо растворимые в воде. CrО3 – кислотный оксид, с избытком воды образует хромовую кислоту: CrO3 + h3O?h3CrO4.
CrO3 – ангидрид хромовой кислоты. При большой концентрации CrO3 образуются дихромовая кислота: 2CrO3 + h3O?h3CrO7.
CrO3 при нагревании до 250 °C разлагается: 4CrO3?2Cr2О3 + 3О2?.
Получение: взаимодействием дихромата калия с концентрированной h3S04: К2CrO7 + Н2SO4 = CrO3? + К2SO4 + h3O. CrO3 – сильный окислитель – окисляет йод, серу, уголь, фосфор, превращаясь при этом в Cr2О3.
Гидроксид хрома II Сг(ОН)2
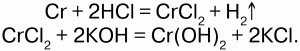
Соединения Cr II неустойчивы и легко окисляются кислородом воздуха:
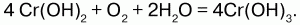
Гидроксид хрома III (Cr(OH)3)n – это сложный полимер зеленого цвета, не растворимый в воде, обладает амфотерными свойствами – растворяется в кислотах и в щелочах; реагирует с кислотами с образованием солей хрома (III):
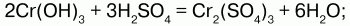
со щелочами – с образованием сине-фиолетовых растворов – гидроксохромитов:
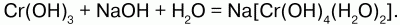
При сплавлении Cr(ОН)3 со щелочами получают хромиты, а с избытком – метахромиты:
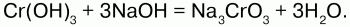
studfile.net
Гидроксид хрома Википедия
Гидроксид хрома (III) — сложное неорганическое вещество с химической формулой Cr(OH)3.
Описание
Гидроксид хрома (III) — амфотерный гидроксид. Серо-зелёного цвета, разлагается при нагревании, теряя воду и образуя зелёный метагидроксид CrO(OH). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зелёного гидрата. При стоянии под раствором теряет реакционную способность («стареет»). Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома(III).
Молярная электропроводность при бесконечном разведении при 25 °C равна 795,9 см2/моль. Получают в виде студнеобразного зелёного осадка при обработке солей хрома (III) щелочами, при гидролизе солей хрома (III) с карбонатами щелочных металлов или сульфидом аммония.
Химические свойства
- Образуется при действии щелочей или водного раствора аммиака на растворы солей хрома:
- CrCl3+3Nh4+3h3O → Cr(OH)3+3Nh5Cl{\displaystyle {\mathsf {CrCl_{3}+3NH_{3}+3H_{2}O\ {\xrightarrow {}}\ Cr(OH)_{3}+3NH_{4}Cl}}}
- Na3[Cr(OH)6]+3CO2 → Cr(OH)3+3NaHCO3{\displaystyle {\mathsf {Na_{3}[Cr(OH)_{6}]+3CO_{2}\ {\xrightarrow {}}\ Cr(OH)_{3}+3NaHCO_{3}}}}
- При нагревании до ~100^oC на воздухе разлагается с образованием метагидроксида хрома CrO(OH) зелёного цвета. При более высоких температурах трёхвалентный гидроксид хрома разлагается с образованием оксида хрома(III) и выделением паров воды:
- Cr(OH)3 →100oC CrO(OH)+h3O{\displaystyle {\mathsf {Cr(OH)_{3}\ {\xrightarrow {100^{o}C}}\ CrO(OH)+H_{2}O}}}
- 2Cr(OH)3 →430−1000oC Cr2O3+3h3O{\displaystyle {\mathsf {2Cr(OH)_{3}\ {\xrightarrow {430-1000^{o}C}}\ Cr_{2}O_{3}+3H_{2}O}}}
- Гидроксид хрома (III) обладает амфотерными свойствами, благодаря чему легко растворяется в кислотах с образованием солей хрома (III):
- С разбавленными кислотами:
- Cr(OH)3+3HCl → CrCl3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HCl\ {\xrightarrow {}}\ CrCl_{3}+3h3O}}}
- 2Cr(OH)3+3h3SO4 → Cr2(SO4)3+6h3O{\displaystyle {\mathsf {2Cr(OH)_{3}+3H_{2}SO_{4}\ {\xrightarrow {}}\ Cr_{2}(SO_{4})_{3}+6h3O}}}
- Cr(OH)3+3HNO3 → Cr(NO3)3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HNO_{3}\ {\xrightarrow {}}\ Cr(NO_{3})_{3}+3H_{2}O}}}
- С концентрированными веществами:
- Cr(OH)3+3HF → CrF3↓+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HF\ {\xrightarrow {}}\ CrF_{3}{\downarrow }+3H_{2}O}}}
- Cr(OH)3+3Ch4COOH → Cr(Ch4COO)3+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3CH_{3}COOH\ {\xrightarrow {}}\ Cr(CH_{3}COO)_{3}+3H_{2}O}}}
- Cr(OH)3+3HCN+3KCN → K3[Cr(CN)6]+3h3O{\displaystyle {\mathsf {Cr(OH)_{3}+3HCN+3KCN\ {\xrightarrow {}}\ K_{3}[Cr(CN)_{6}]+3H_{2}O}}}
- Также благодаря амфотерным свойствам легко происходят реакции и с щелочами:
- Cr(OH)3+3NaOH → Na3[Cr(OH)6]{\displaystyle {\mathsf {Cr(OH)_{3}+3NaOH\ {\xrightarrow {}}\ Na_{3}[Cr(OH)_{6}]}}}
- 2Cr(OH)3+4NaOH+3h3O2 → 2Na2CrO4+8h3O{\displaystyle {\mathsf {2}}{Cr(OH)_{3}+4NaOH+3H_{2}O_{2}\ {\xrightarrow {}}\ 2Na_{2}CrO_{4}+8H_{2}O}}
- При взаимодействии с гидроксидами натрия или лития возможно получение хромитов данных металлов (M = Li, Na):
- Cr(OH)3+MOH →300−400oC MCrO2+2h3O{\displaystyle {\mathsf {Cr(OH)_{3}+MOH\ {\xrightarrow {300-400^{o}C}}\ MCrO_{2}+2H_{2}O}}}
Литература
- Неорганическая химия в реакциях / Р.А.Лидин, В.А.Молочко, Л.Л.Андреева. — Москва: «Дрофа», 2007. — Т. 3. — 640 с. — ISBN 978-5-358-01303-2.
wikiredia.ru
Свойства хрома. Задача 1084
Задача 1084.
Охарактеризовать свойства хрома, указав: а) его положение в периодической системе и строение атома; б) отношение металлического хрома к воздуху, воде и кислотам; в) состав и характер оксидов и гидроксидов хрома.
Решение:
Строение и свойства металлического хрома
а) Хром (элемент №24) — металл находящейся в шестой группе побочной подгруппы, период 4, ряд 4. Электронное строение атома хрома можно представить формулой +24Cr [Ar] 3d54s1. Для хрома наблюдается проскок (или провал) электрона на d-уровень (второй s-электрон покидает 4s-подуровень и проскакивает на 3d-подуровень):
Cr – 3d54s1. Это объясняется близостью энергий ns— и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней. У хрома d-уровень заполнен наполовину, что и объясняет стабильность атома +24Cr [Ar] 3d54s1 по сравнению с атомом +24Cr [Ar] 3d44s2. Массовая доля хрома в земной коре – 0,02%. Для его соединений характерны степени окисления +2, +3, +6, а степени окисления +1,+4,+5 могут проявляются теоретически. Этот металл имеет амфотерные свойства за счёт незавершённой электронной оболочки. Поэтому он реагирует с щелочами и с кислотами.
б) Хром устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
Химически хром довольно инертен вследствие образования на его поверхности прочной тонкой пленки оксида. Он не окисляется на воздухе даже в присутствии влаги, а при нагревании окисление проходит только на поверхности. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами:
4Cr + 3O2 Na2Cr2O7 + 2Cr2O3
Хром пассивируется разбавленной и концентрированной азотной кислотой, царской водкой, и даже при кипячении металла с этими реагентами растворяется лишь незначительно. Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
Cr + 2HCl = CrCl2 + H2↑
Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется.
Амфотерные оксиды хрома
в) Оксид хрома II (CrО) – основный оксид – черный порошок. Сильный восстановитель. CrО растворяется в разбавленной соляной кислоте:
CrО + 2НСl = CrСl2 + Н2О.
Гидроксид хрома(II) — неорганическое соединение, гидроокись металла хрома с формулой Сr(OH)2, коричневое (гидрат — жёлтое) аморфное вещество, не растворимое в воде образует кристаллогидрат. Гидроксид хрома (II) имеет основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Оксид хрома(III) Cr2O3, представляет собой зеленые микрокристаллы с плотностью 5220 кг/м3 и высокой температурой плавления (2437° С). Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен и его трудно растворить в водных кислотах и щелочах. При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
Cr2O3 + 4KOH + KClO3 = 2K2CrO4 + KCl + 2H2O.
Cr2O3 — амфотерное соединение.
Гидроксид хрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3↓+ 3Na2SO4
Гидроксид хрома (III) обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH → K[Cr(OH)4]
Хромовый ангидрид и хромовые кислоты
Оксид хрома(VI) (хромовый ангидрид) CrO3, расплывающиеся на воздухе красные кристаллы, легко растворимые в воде (до 68,2%). Тпл. =197° С (с частичным разложением). Хромовый ангидрид – сильный окислитель.
При растворении в воде, в зависимости от концентрации, образует гидроксиды хрома(VI) — хромовые кислоты различного состава:
CrO3 + H2O = H2CrO4 (желтый р-р) – хромовая кислота;
2CrO3 + H2O = H2Cr2O7 (оранжевый р-р) — двухромовая кислота;
3CrO3 + H2O = H2Cr3O10 (красный р-р) = трихромовая кислота.
Хромовая кислота — электролит средней силы. Изополихромовые кислоты — сильные окислители.
buzani.ru
Формула гидроксида соответствующего оксиду хрома (6):
Естественные науки Гарик Ситроян 2 (6) Формула гидроксида соответствующего оксиду хрома (6): 10 лет В лидерыОтветы
Ответы Mail.Ru Наука, Техника, Языки Естественные науки Все вопросы КатегорииИзбранные
КАТЕГОРИИ
Авто, Мото Автострахование Выбор автомобиля, мотоцикла Оформление авто-мото сделок ГИБДД, Обучение, Права Сервис, Обслуживание, Тюнинг ПДД, Вождение Прочие Авто-темы Автоспорт Бизнес, Финансы Макроэкономика Производственные предприятия Собственный бизнес Страхование Банки и Кредиты Недвижимость, Ипотека Бухгалтерия, Аудит, Налоги Остальные сферы бизнеса Долги, Коллекторы Знакомства, Любовь, Отношения Любовь Знакомства Отношения Расставания Дружба Прочие взаимоотношения Компьютеры, Связь Интернет Железо Программное обеспечение Прочее компьютерное Мобильные устройства Офисная техника Мобильная связь Образование Детские сады Школы ВУЗы, Колледжи Дополнительное образование Образование за рубежом Прочее образование Философия, Непознанное Мистика, Эзотерика Психология Религия, Вера Прочее непознанное Философия Путешествия, Туризм Самостоятельный отдых Документы Отдых в России Отдых за рубежом Прочее туристическое Семья, Дом, Дети Строительство и Ремонт Беременность, Роды Воспитание детей Мебель, Интерьер Домашняя бухгалтерия Домоводство Загородная жизнь Свадьба, Венчание, Брак Организация быта Прочие дела домашние Спорт Футбол Хоккей Экстрим Другие виды спорта Занятия спортом События, результаты Спортсмены Зимние виды спорта Стиль, Мода, Звезды Мода Светская жизнь и Шоубизнес Прочие тенденции стиля жизни Стиль, Имидж Темы для взрослых Другое О проектах Mail.ru Ответы Mail.ru Почта Mail.ru Прочие проекты Новости Mail.ru Агент Mail.ru Мой Мир Mail.ru ICQ Облако Mail.ru Красота и Здоровье Коррекция веса Здоровый образ жизни Врачи, Клиники, Страхование Болезни, Лекарства Косметика, Парфюмерия Баня, Массаж, Фитнес Уход за волосами Маникюр, Педикюр Детское здоровье Салоны красоты и СПА Прочее о здоровье и красоте Животные, Растения Домашние животные Комнатные растения Сад-Огород Дикая природа Прочая живность Города и Страны Вокруг света Карты, Транспорт, GPS Климат, Погода, Часовые пояса Коды, Индексы, Адреса ПМЖ, Недвижимость Прочее о городах и странах Общество, Политика, СМИ Общество Политика Прочие социальные темы Средства массовой информации Еда, Кулинария Закуски и Салаты Первые блюда Вторые блюда Напитки Десерты, Сладости, Выпечка Консервирование Торжество, Праздник Готовим детям Готовим в … Покупка и выбор продуктов На скорую руку Прочее кулинарное Фотография, Видеосъемка Обработка и печать фото Обработка видеозаписей Выбор, покупка аппаратуры Уход за аппаратурой Техника, темы, жанры съемки Прочее фото-видео Товары и Услуги Идеи для подарков Техника для дома Прочие промтовары Сервис, уход и ремонт Прочие услуги Досуг, Развлечения Хобби Концерты, Выставки, Спектакли Охота и Рыбалка Клубы, Дискотеки Рестораны, Кафе, Бары Советы, Идеи Игры без компьютера Прочие развлечения Новый Год День Святого Валентина Восьмое марта Наука, Техника, Языки Гуманитарные науки Естественные науки Лингвистика Техника Работа, Карьера Написание резюме Подработка, временная работа Кадровые агентства Отдел кадров, HR Профессиональный рост Смена и поиск места работы Обстановка на работе Трудоустройство за рубежом Прочие карьерные вопросы Гороскопы, Магия, Гадания Гороскопы Гадания Сны Прочие предсказания Магия Юридическая консультация Административное право Гражданское право Конституционное право Семейное право Трудовое право Уголовное право Финансовое право Жилищное право Право социального обеспечения Военная служба Паспортный режим, регистрация Прочие юридические вопросы Юмор Золотой фонд Искусство и Культура Музыка Литература Кино, Театр Живопись, Графика Архитектура, Скульптура Прочие искусства Компьютерные и Видео игры Прочие Браузерные Клиентские Консольные Мобильные Программирование Другие языки и технологии Java JavaScript jQuery MySQL Perl PHP Python Веб-дизайн Верстка, CSS, HTML, SVG Системное администрирование Домашние задания Другие предметы Литература Математика Алгебра Геометрия Иностранные языки Химия Физика Биология История География Информатика Экономика Русский язык Обществознание Плесский колледж бизнеса и туризма GS Logistica SpezServis© Mail.Ru, 2018
touch.otvet.mail.ru