Свойства и функции Периодической системы химических элементов — Мегаобучалка
Билет № 20 Открытие периодического закона и периодической системы химических элементов. Элементы свидетели торжества периодического закона (галлий, скандий). Границы периодической системы элементов
Основной закон химии — Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно. Периодический закон – один из основных законов природы и важнейший закон химии. С открытия этого закона начинается современный этап развития химической науки. Хотя физический смысл периодического закона стал понятен только после создания теории строения атома, сама эта теория развивалась на основе периодического закона и системы химических элементов. Закон помогает ученым создавать новые химические элементы и новые соединения элементов, получать вещества с нужными свойствами. Сам Менделеев предсказал существование 12 элементов, которые в то время еще не были открыты, и определил их положение в периодической системе. Свойства трех из этих элементов он подробно описал, и при жизни ученого эти элементы были открыты («экабор» – галлий, «экаалюминий» – скандий, «экасилиций» – германий). Современная периодическая система содержит 110 открытых на сегодняшний день химических элементов, каждый из которых занимает определенное место, имеет свой порядковый номер и название.
Функции периодического закона
Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной.
Интегративная роль периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. [3]
Прогностическая (предсказательная) функция периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21 (скандий), 31 (галлий) и 32 (германий). Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Всего же им были предсказаны двенадцать элементов. Свою предсказательную функцию периодический закон сохраняет и до наших дней.
Свойства и функции Периодической системы химических элементов.
Рис.1 Закономерности для элементов Периодической таблицы (кроме инертных газов).
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
Рис.2 Полуметаллы
При перемещении СПРАВА НАЛЕВО вдоль периода М ЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении — возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Но некоторые элементы относят к полуметаллам (рис. 2). Они занимают места на границе между металлами и неметаллами, так как валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками, роль которых в электронной технике чрезвычайно важна.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
3. Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ — ВОССТАНОВИТЕЛЬНЫЕ свойства элементов. Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы.
4. По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
5. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
6. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке не приводит к увеличению размеров атома.
7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
8. Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
9. s-Элементы имеют валентности, совпадающие с номером их группы.
10. p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
11. Не только элементы, но и многие их соединения — оксиды, гидриды, соединения с галогенами — обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически «повторяются» (то есть могут быть записаны в виде обобщенной формулы). Например:
12. d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов.
megaobuchalka.ru
Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона
На уроке вы сможете изучить тему «Структура Периодической системы химических элементов. Объяснительная и предсказательная функции Периодического закона». Вы узнаете о значении Периодической таблицы Менделеева, ее функциях и возможностях. Периодическая система Д.И.Менделеева является графическим отображением Периодического закона химических элементов. Этот закон Д.И. Менделеев вывел в 1869 году. Таблицу он создавал с 1865 по 1871 год.
Тема: Периодический закон и Периодическая система химических элементов Д.И. Менделеева.
Урок: Структура Периодической системы химических элементов. Объяснительная и предсказательная функции периодического закона
В начале XX века было открыто строение атома и стало ясно, что свойства химических элементов находятся в периодической зависимости не от атомных масс, а от заряда ядра атома, т. е. числа протонов в ядре.

Рис. 1. «Длинная» форма таблицы
Дальнейшее развитие Периодической системы заключалось в том, что ученые заполняли пустые клетки в таблице Менделеева: открыли семейство благородных газов. Открывались естественно и искусственно полученные радиоактивные элементы. В 2010 году был открыт последний 117 химический элемент, 7 периода Периодической системы.
Таким образом, перед учеными встал вопрос о нижней границе Периодической системы, который остается открытым до сих пор.
Чаще всего можно увидеть три формы выражения Периодической системы: короткая или короткопериодная, длинная или длиннопериодная или сверхдлинная.
В короткой форме таблица изображена на Рис. 2.
1-3 периоды занимают по 1 строке, 4-ый и последующие периоды занимают по 2 строчки. Символы элементов главных и побочных подгрупп выравниваются относительно разных краев клеток. Лантаноиды и актиноиды вынесены из общей таблицы.
В длинном варианте лантаноиды и актиноиды вынесены из общей таблицы, соответственно, так же как и в короткой, делая её более компактной. Нет главных и побочных подгрупп. Каждый период занимает ровно одну строчку. Рис. 1.
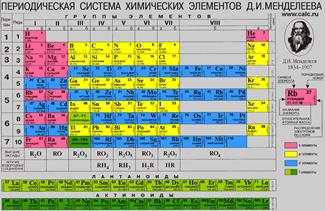
Рис. 2. «Короткая форма»

Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного х
r3test.interneturok.ru
Персональный сайт — Каталог статей

Рис. 2. «Короткая форма»

Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента. Рис. 3.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
1-ый, 2-ой , 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Совокупность переходных металлов в каждом периоде называется вставной декадой, потому что этих металлов в каждом периоде 10.

Рис. 4. Вторая группа
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы. Рис. 4.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.
himi4ok.ucoz.ru
Значение и развитие периодического закона — урок. Химия, 8–9 класс.
Значение периодического закона
Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное значение для развития науки.
Периодический закон:
- систематизировал и обобщил все сведения о химических элементах и их соединениях, объединил их в единое целое;
- объяснил разные виды периодичности в изменении свойств элементов и образованных ими простых и сложных веществ;
- позволил предсказывать существование неоткрытых химических элементов и прогнозировать их свойства;
- послужил базой для изучения строения ядра атома и электронных оболочек.
Сам Дмитрий Иванович Менделеев, предвидя развитие науки, писал: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются».
Развитие периодического закона
Во времена Д. И. Менделеева основным свойством атомов химических элементов считалась атомная масса. Периодический закон в формулировке Д. И Менделеева звучит так:
Свойства элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величин их атомных масс.
Позже было изучено строение атома, и стало ясно, что основной характеристикой атома химического элемента является не величина его атомной массы, а величина положительного заряда ядра. Периодический закон стали формулировать иначе. Современная формулировка выглядит следующим образом:Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Заряды ядер атомов элементов, расположенных в ряд, возрастают непрерывно. Объяснить причины периодичности учёные смогли тогда, когда изучили строение электронных оболочек атомов.Причиной периодического изменения свойств химических элементов и образуемых ими веществ является периодически повторяющееся строение наружных энергетических уровней электронных оболочек атомов.
www.yaklass.ru
Периодический закон Википедия
После открытия периодического закона Д. И. Менделеев два года совершенствовал его формулировку и окончательно оформил её в следующем виде (1871):
 | Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса[1]. |  |
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1913), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.). В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку:
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании». Графическим (табличным) выражением закона является разработанная Менделеевым периодическая система химических элементов. Всего предложено несколько сотен[2] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.).
Поиски основы естественной классификации и систематизации химических элементов начались задолго до открытия Периодического закона. Трудности, с которыми сталкивались естествоиспытатели, которые первыми работали в этой области, были вызваны недостаточностью экспериментальных данных: в начале XIX века число известных химических элементов было мало, а принятые значения атомных масс многих элементов неверны.
Триады Дёберейнера и первые системы элементов
В 1829 году немецкий химик Иоганн Вольфганг Дёберейнер предпринял первую значимую попытку систематизации элементов[3]. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами:
ruwikiorg.ru
Значение периодического закона и периодической системы элементов Д И. Менделеева
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая зависимость между свойствами химических элементов и массой их атомов, периодический закон явился блестящим подтверждением одного из всеобщих законов развития природы — закона перехода количества в качество. [c.54]Несмотря на большое значение ранних работ различных ученых, главная заслуга в развитии периодической системы принадлежит русскому ученому Дмитрию Ивановичу Менделееву и немецкому ученому Юлиусу Лотару Мейеру. Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
По поводу приоритета Д. И. Менделеева в открытии периодического закона А. Смит (А. Смит, Введение в неорганическую химию. Перевод под редакцией A.B. Раковского, Москва 1928) писал Лотар Мейер почти одновременно и независимо от Менделеева открыл периодическое изменение удельных объемов простых веществ с изменением атомного веса и далее хотя знание удельных объемов простых веществ имеет большое значение для изучения физико-химических особенностей элементов, однако ясно, что эти удельные объемы не пригодны для составления системы элементов и что ими во многих случаях нельзя руководствоваться для определения места элемента в системе. Вот почему Л. Мейер, открывший периодичность удельных объемов простых веществ, не мог создать периодической системы элементов, Что сделал Д. И. Менделеев, изучивший периодичность не только физических, но и химических свойств .— Прим. ред. [c.26]
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая [c.55]
Более того, можно доказать, что все современное учение о химических элементах базируется на идеях Менделеева, в особенности полно высказанных в упомянутой статье Периодическая законность [для] химических элементов . Исключительно большое значение приобретает в связи с этим научное определение понятия химический элемент , составляющее фундамент всех современных представлений об атомах и элементах. Во втором разделе своей статьи (см. фотокопию VI) Менделеев пишет Положение элемента Я в системе определяется тем рядом и тою группою, к которым он относится, или около него стоящими элементами и У из того же ряда, элементами Н с меньшим и / » с большим атомным весом из той же грунты. Свойства У и его соединений определяются, зная свойства X, У, Я и Я» [18, стр. 39]. [c.15]
Сравнительно правильный ход нарастания разности атомных весов, представленный числами 16, 22 и 28, давал резкий скачок при переходе от 2г к Т1 сразу на 40. Между тем Менделеев уже в самый момент открытия периодического закона ясно видел, что переход от одного элемента к другому, качественно от него отличному, обусловлен правильным количественным изменением в атомных весах элементов, а, следовательно, и в их разностях. Это и означало фактическое признание, что количественные изменения атомного веса переходят , или превращаются, в качественные изменения химической индивидуальности элементов (т. е. вызывают и обусловливают их качественные изменения). В ряду элементов С, 51, Т1, 8п скачок от одного элемента к другому обусловливается количественной разностью в атомных весах в пределах около 20. Иными словами, для того, чтобы вызвать качественное изменение элемента для данного ряда, значение атомного веса должно возрасти примерно на 20 атомных единиц. А это означает, что если разность между атомными весами двух элементов, находящихся в одном и том же ряду, достигает 40 единиц, то оба эти элемента не являются соседними в общей системе. Между ними должен существовать какой-то неизвестный элемент х с промежуточным атомным весом (в данном случае около 70). Если допустить это, то закон превращения количественных изменений в качественные в данном его конкретном выражении будет полностью соблюден по всему ряду С, 51, Т1, х, 2г, 5п правильное изменение атомного веса примерно на 20 единиц будет каждый раз обусловливать качественное изменение у химических элементов. [c.8]
Большое прогностическое значение имеет периодический закон Д. И.Менделеева На оснопе периодической системы Д. И. Менделеев исправил атомные массы у 20 элементов, предсказал существование ряда неоткрытых элементов и дал точное описание их свойств. [c.70]
О взаимосвязи закона с системой автор открытия писал Было бы правильнее мою систему назвать периодической , потому что она вытекает из периодического закона… В сопоставлении несходных элементов заключается важнейший принцип, которым моя система отличается от систем моих предшественников (Д. И, Менделеев. Периодический закон. Классики науки . М., Изд-во АН СССР, 1958. С. 388), и далее …важнейшее качество элемента познается не по низшей, а по высшим степеням окисления. По этим причинам важнейшее значение для характеристики элемента имеют высшие формы образуемых им соеднненнй,,. (Менделеев Д. И. Периодический закон. Дополнительные материалы, М,, Изд-во АН СССР, 1960, С, 343). [c.62]
В сентябре 1876 г. Лекок де Буабодран повторил опыты очистил металл и нашел плотность его равной 5,94 (по современным, 5,91), а атомную массу 69,9 (современное значение 69,72). Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— пис
www.chem21.info