Алкены — Википедия
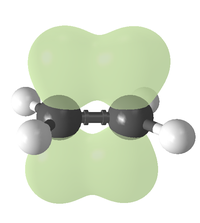 Пространственная структура этилена.
Пространственная структура этилена.Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов, имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил».
Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая. Например, единственным изомером пропилена является циклопропан (C
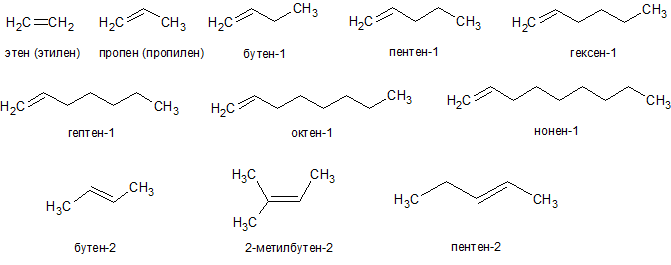
Алкены могут существовать в виде пространственных или геометрических изомеров.
Различают:
- цис- изомеры: заместители расположены по одну сторону от двойной связи;
- транс- изомеры: заместители расположены по разные стороны от двойной связи.
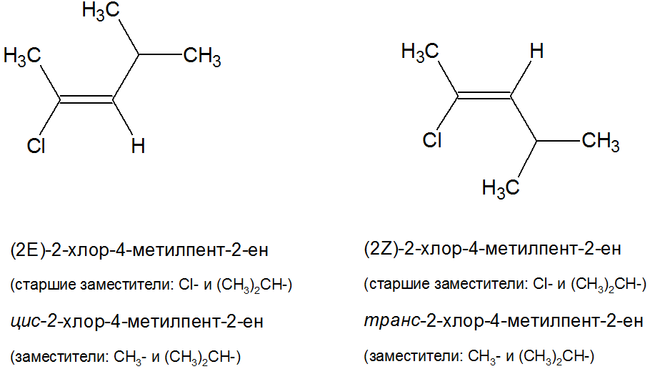
IUPAC рекомендует называть геометрические изомеры по следующей номенклатуре:
- Z- изомеры: старшие заместители у углеродных атомов двойной связи находятся по одну сторону относительно двойной связи;
- E- изомеры: старшие заместители у углеродных атомов двойной связи находятся по разные стороны относительно двойной связи.
В соответствии с теорией гибридизации двойная связь образуется за счёт перекрывания вдоль линии связи С-С sp²-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания углеродных p-орбиталей (π-связь).
 Схема образования связей в молекуле этилена
Схема образования связей в молекуле этиленаВ состоянии sp² гибридизации электронное состояние атома углерода можно представить следующим образом:
C∗↑↓1s↑sp2↑sp2↑sp2↑p{\displaystyle C^{*}\quad {\frac {\uparrow \downarrow }{1s}}\;{\frac {\uparrow \,}{sp^{2}}}\;{\frac {\uparrow \,}{sp^{2}}}{\frac {\uparrow \,}{sp^{2}}}{\frac {\uparrow \,}{p}}}
Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120 °. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С.
Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p-орбиталей углерода формирует две молекулярные π-орбитали этилена[1]:
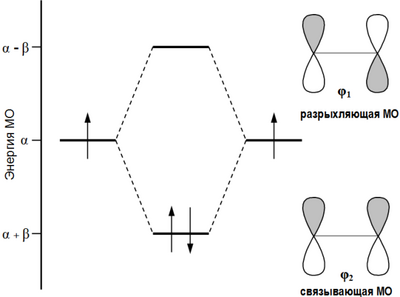 Формирование π-орбиталей этилена
Формирование π-орбиталей этиленаПервый потенциал ионизации этилена составляет 10,51 эВ[2], что позволяет электрону относительно легко уходить (электрофильное взаимодействие) с высшей занятой молекулярной орбитали (ВЗМО). В то же время, низшая связывающая молекулярная орбиталь (НСМО) этилена имеет достаточно низкую энергию: −1,6-1,8 эВ, что объясняет относительную лёгкость присоединения электрона с образованием аниона[2] (нуклеофильное взаимодействие).
Добавление метильного заместителя снижает потенциал ионизации π— электронов примерно на 0,6-0,8 эВ и повышает энергию НСМО на 0,2 эВ, а ВЗМО на 0,7 эВ[2].
Впервые этилен был получен в 1669 году немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт. Учёный установил, что его «воздух» более химически активен, чем метан, однако идентифицировать полученный газ он не смог и названия ему не присвоил[3].
Вторично и тем же способом «воздух Бехера» был получен и описан голландскими химиками Дейманом, Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795 году. Они назвали его «маслородным газом» так как при взаимодействии с хлором, он образовывал маслянистую жидкость — дихлорэтан (об этом стало известно позднее). По-французски «маслородный» — oléfiant. Французский химик Антуан Фуркруа ввёл этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало общим для всего класса олефинов (или, по современной номенклатуре, алкенов)[4].
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из «маслородного» газа и воды. Этот же газ он обнаружил и в хлористом этиле[5]. В 1828 году Ж. Дюма и П. Буллей предположили, что этилен представляет собой основание, способное давать соли подобно аммиаку. Якоб Берцелиус принял эту идею, назвав соединение «этерином» и обозначив буквой E[6].
Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его настоящую формулу. В 1848 году Кольбе писал формулу этилена как С4Н4, этого же мнения придерживался и Либих. Ж. Дюма правильно определил состав вещества, но его структура по-прежнему была описана неверно: С2НН3[5].
В 1862 году немецкий химик-органик Э.Эрленмейер предположил наличие в молекуле этилена двойной связи, а в 1870 году известный российский учёный А. М. Бутлеров признал эту точку зрения правильной, подтвердив её природу экспериментально[7].
Нахождение в природе и физиологическая роль алкенов[править | править код]
В природе ациклические алкены практически не встречаются[8]. Простейший представитель этого класса органических соединений — этилен (C2H4) — является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов — мускалур (цис— трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).

Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей[9].
Отдельные представители:
- Этилен — вызывает наркоз, обладает раздражающим и мутагенным действием.
- Пропилен — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
- Бутен-2 — вызывает наркоз, обладает раздражающим действием[9].
- Температуры плавления и кипения алкенов (упрощённо) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гептадецена C17H34 включительно — жидкости, а начиная с октадецена C 18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
| Физические свойства алкенов[10] | |||||
|---|---|---|---|---|---|
| № | Название | Формула | Т плавления, ° C | Т кипения, ° C | Плотность, d20 4 |
| 1 | Этилен | С2H4 | −169,1 | −103,7 | 0,5700* |
| 2 | Пропилен | C3H6 | −187,6 | −47,7 | 0,5193* |
| 3 | Бутен-1 | C4H8 | −185,3 | −6,3 | 0,5951* |
| 4 | цис-Бутен-2 | CH3-CH=CH-CH3 | −138,9 | 3,7 | 0,6213 |
| 5 | транс-Бутен-2 | CH | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Метилпропен-1 | CH3-C(CH3)=CH2 | −140,4 | −7,0 | 0,5942* |
| 7 | Пентен-1 | С5H10 | −165,2 | 30,1 | 0,6405 |
| 8 | Гексен-1 | С6H12 | −139,8 | 63,5 | 0,6730 |
| 9 | Гептен-1 | С7H14 | −119,0 | 93,6 | 0,6970 |
| 10 | Октен-1 | С8H16 | −101,7 | 121,3 | 0,7140 |
| … | Гептадецен[11] | С17H34 | 4,1 | 284,4 | 0,7811 |
* Значения измерены при температуре кипения.
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
В лабораторной практике обычно применяют метод дегидратации спиртов в присутствии сильных минеральных кислот[1], дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных; синтезы Гофмана, Чугаева, Виттига и Коупа[12].
Подробнее — см. соответствующие разделы ниже.
Дегидрирование алканов[править | править код]
Это один из промышленных способов получения алкенов[13][14]. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы[15]. Для получения транс-алкенов используют MOH/EtOH, для цис-производных NaNH2/NH3
Ch4−Ch4→Ch3=Ch3+h3{\displaystyle {\mathsf {CH_{3}\!\!-\!\!CH_{3}}}\rightarrow {\mathsf {CH_{2}\!\!=\!\!CH_{2}+H_{2}}}}
(Ch4)2CH−Ch4→(Ch4)2C=Ch3+h3{\displaystyle {\mathsf {(CH_{3})_{2}CH\!\!-\!CH_{3}}}\rightarrow {\mathsf {(CH_{3})_{2}C\!\!=\!\!CH_{2}+H_{2}}}}
Дегидрогалогенирование и дегалогенирование алканов[править | править код]
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка[16]:
R−CHCl−Ch3Cl+Zn→R−CH=Ch3+ZnCl2{\displaystyle {\mathsf {R\!\!-\!\!CHCl\!\!-\!\!CH_{2}Cl+Zn}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+ZnCl_{2}}}}
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей[17]:
R−CHBr−Ch4+C2H5ONa→R−CH=Ch3+NaBr+C2H5OH{\displaystyle {\mathsf {R\!\!-\!\!CHBr\!\!-\!\!CH_{3}+C_{2}H_{5}ONa}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+NaBr+C_{2}H_{5}OH}}}
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
Дегидратация спиртов[править | править код]
Дегидратацию спиртов ведут при повышенной температуре бани в присутствии сильных минеральных кислот [16]:
Ch4−CH(OH)−Ch4+h3SO4→Ch4−CH(OSO3H)−Ch4+h3O{\displaystyle {\mathsf {CH_{3}\!\!-\!\!CH(OH)\!\!-\!\!CH_{3}+H_{2}SO_{4}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH(OSO_{3}H)\!\!-\!\!CH_{3}+H_{2}O}}}
Ch4−CH(OSO3H)−Ch4→Ch4−CH=Ch3+h3SO4{\displaystyle {\mathsf {CH_{3}\!\!-\!\!CH(OSO_{3}H)\!\!-\!\!CH_{3}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH_{2}+H_{2}SO_{4}}}}
В современной практике алкены из вторичных и третичных спиртов также получают с использованием дегидратирующего реагента — реагента Бёрджесса[18]:
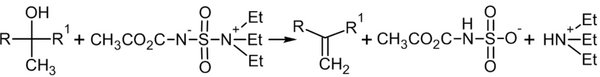
Гидрирование алкинов[править | править код]
Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара)[16]:
Ch4−C≡C−Ch4+h3 →Pd/Pb(Ch4COO)2 Ch4−CH=CH−Ch4{\displaystyle {\mathsf {CH_{3}\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {C\!\!-\!\!CH_{3}+H_{2}}}\ {\xrightarrow {Pd/Pb(CH_{3}COO)_{2}}}\ {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_{3}}}}
Ch4−C≡C−Ch4+2Na+2Nh4→Ch4−CH=CH−Ch4{\displaystyle {\mathsf {CH_{3}\!\!-\!\!C}}\!\!\equiv \!\!{\mathsf {C\!\!-\!\!CH_{3}+2Na+2NH_{3}}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!CH\!\!=\!\!CH\!\!-\!\!CH_{3}}}} (транс-изомер) +2NaNh3{\displaystyle {\mathsf {+2NaNH_{2}}}}
Реакция Виттига[править | править код]
Реакция Виттига — стереоселективный синтез алкенов взаимодействием карбонильных соединений и алкилиденфосфоранов (илидов фосфониевых солей)[19]:
(C6H5)3P+Ch4Br→[(C6H5)3P−Ch4]Br{\displaystyle {\mathsf {(C_{6}H_{5})_{3}P+CH_{3}Br}}\rightarrow {\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br}}}
[(C6H5)3P−Ch4]Br+C6H5Li→(C6H5)3P−Ch3:+C6H6+LiBr{\displaystyle {\mathsf {[(C_{6}H_{5})_{3}P\!\!-\!\!CH_{3}]Br+C_{6}H_{5}Li}}\rightarrow {\mathsf {(C_{6}H_{5})_{3}P\!\!-\!\!CH_{2}\!\!:+}}{\mathsf {C_{6}H_{6}+LiBr}}}
Ch4−CO−Ch4+(C6H5)3P−Ch3:→Ch4−C(Ch4)=Ch3+(C6H5)3P=O{\displaystyle {\mathsf {CH_{3}\!\!-\!\!CO\!\!-\!\!CH_{3}+(C_{6}H_{5})_{3}P\!\!-\!\!CH_{2}\!\!:}}\rightarrow {\mathsf {CH_{3}\!\!-\!\!C(CH_{3})\!\!=\!\!CH_{2}+(C_{6}H_{5})_{3}P\!\!=\!\!O}}}
Для превращения солей фосфония в илиды используются бутиллитий, гидрид, амид или алкоголят натрия, а также некоторые другие сильные основания.
В реакцию могут вступать самые различные карбонильные соединения, среди которых ароматические и алифатические альдегиды и кетоны, в том числе содержащие двойные и тройные связи и различные функциональные группы.
В лабораторной практике часто используют более современную модификацию (1959 год) реакции Виттига — реакцию Хорнера-Уодсворта-Эммонса[20]:
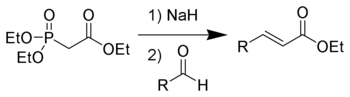
Преимущество использования фосфонатов заключается в том, что образующиеся в ходе реакции фосфаты легко отмываются водой. Кроме того, реакция позволяет избирать оптическое направление элиминирования, получая на выходе транс— (термодинамический контроль) или цис-изомеры (кинетический контроль)[18].
Реакция Кнёвенагеля[править | править код]
Реакция Кнёвенагеля — конденсация альдегидов или кетонов с соединениями, содержащими активную CH2-группу[18]:
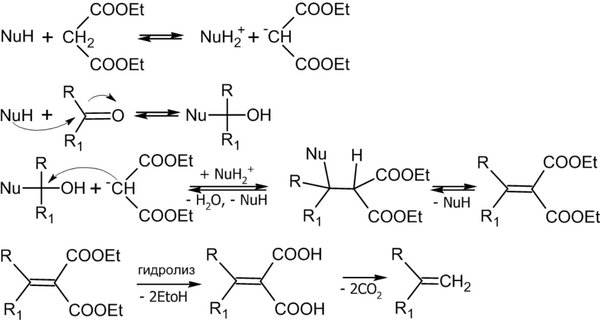
Реакция имеет очень широкий диапазон применения, при этом помимо эфиров малоновой кислоты, в реакцию могут вступать и другие соединения, например: CH3CN, CH3NO2, LiCH2COOC2H5 и пр.[21].
Реакция Чугаева[править | править код]
Реакция Чугаева — взаимодействие спиртов с CS2 и NaOH с последующим метилированием и дальнейшим пиролизом образовавшихся S-метилксантогенатов[22]:
R−Ch3−Ch3OH+CS2+NaOH→R−Ch3−Ch3OC(S)−SNa+h3O{\displaystyle {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OH+CS_{2}+NaOH}}\rightarrow {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OC(S)\!\!-\!\!SNa+H_{2}O}}}
R−Ch3−Ch3OC(S)−SNa→R−CH=Ch3+COS+NaHS{\displaystyle {\mathsf {R\!\!-\!\!CH_{2}\!\!-\!\!CH_{2}OC(S)\!\!-\!\!SNa}}\rightarrow {\mathsf {R\!\!-\!\!CH\!\!=\!\!CH_{2}+COS+NaHS}}}
Реакция Гофмана[править | править код]
Исчерпывающее метилирование по Гофману — разложение четвертичных аммониевых оснований на алкен, третичный амин и воду[23]:
(C2H5)4N+OH−→Ch3=Ch3+(C2H5)3N+h3O{\displaystyle {\mathsf {(C_{2}H_{5})_{4}N^{+}OH^{-}}}\rightarrow {\mathsf {CH_{2}\!\!=\!\!CH_{2}+(C_{2}H_{5})_{3}N+H_{2}O}}}
На первой стадии реакции действием метилиодида амин превращают в четвертичный аммонийиодид, который далее переводят в гидроксид действием оксида серебра, наконец, последний этап — разложение — ведут при 100-200 °C, часто при пониженном давлении[24].
Элиминирование по Гофману приводит к образованию наименее замещенных алкенов (против правила Зайцева).
Метод используется, в основном, для получения некоторых циклических алкенов и в химии алкалоидов[24].
Реакция Коупа[править | править код]
Реакция Коупа — разложение N-окисей третичных аминов[24]:
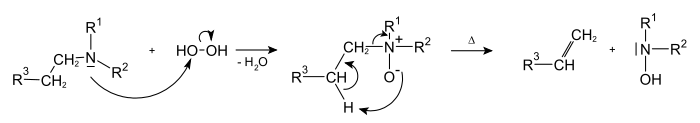
Прочие методы синтеза[править | править код]
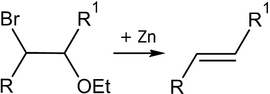
Реакция Бурда[править | править код]
Реакция Бурда — элиминирование брома и этоксигруппы из бромалкилэтиловых эфиров под действием цинковой пыли[25]:
Синтез из тозилгидразонов[править | править код]
Алкены можно получить разложением тозилгидразонов под действием оснований (Реакция Бэмфорда-Стивенса и Реакция Шапиро)[26]:
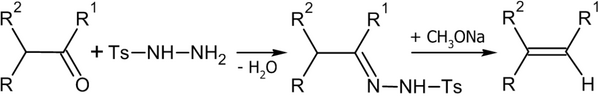
Реакция Бэмфорда-Стивенса и Реакция Шапиро протекают по одинаковому механизму. В первом случае используются натрий, метилат натрия, гидриды лития или натрия, амид натрия и т. п. Во втором: аллкиллитий и реактивы Гриньяра. В реакция Бэмфорда-Стивенса образуются более замещенные, а в реакция Шапиро — наименее замещенные алкены[27].
Реакция Перкина[править | править код]
Реакция Перкина — взаимодействие ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.)[28]:
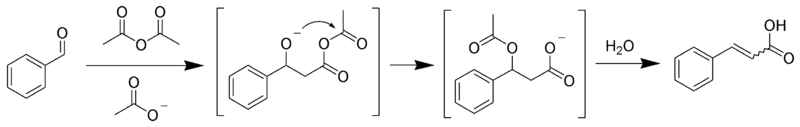
Последующим декарбоксилированием образующейся кислоты можно получить соответствующий алкен.
Синтез Кори-Винтера[править | править код]
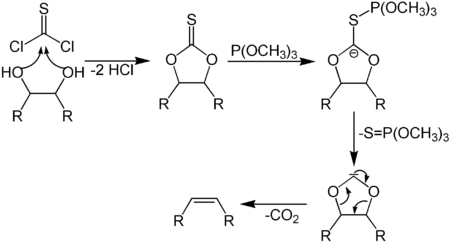
Олефинирование Жюлиа-Лижо[править | править код]
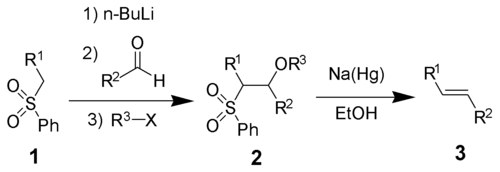
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются с сильными восстановителями или водородом под действием катализаторов , а также способны к радикальному замещению.
Реакции электрофильного присоединения[править | править код]
В данных реакциях атакующей частицей является эл
Алкины — Википедия
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.

Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обусловливает кислотные свойства алкинов в реакциях замещения.
Впервые ацетилен был получен в 1836 году Эдмундом Дэви, двоюродным братом знаменитого английского химика Гемфри Дэви, нагреванием уксуснокислого калия с древесным углем и последующей реакцией с водой образовавшегося карбида калия [1]. Дэви назвал свой газ «двууглеродистым водородом».
В 1862 году немецкий химик и врач Ф. Вёлер вновь открыл ацетилен, действуя водой на карбид кальция.
В 1863 году французский химик М. Бертло получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами[2]. Именно он дал газу имя ацетилен (от латинских слов acetum — уксус и греческого иле — дерево). Русское название «ацетилен» впервые было применено Д. И. Менделеевым[3].
Большую роль в изучении химии ацетилена и его производных в конце XIX века сыграл А. Е. Фаворский.
В 1895 году Ле Шателье обнаружил, что ацетилен, сгорая в кислороде, даёт очень горячее пламя, что впоследствии легло в основу ацетиленовой технологии сварки и резки тугоплавких металлов[4].
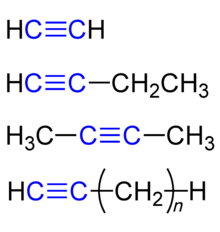
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Ниже представлены некоторые представители алкинов и их названия:

Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин).
Гомологический ряд алкинов:
- В противном случае, разница в положении тройной связи в двух разных молекулах алкинов (например, бутин-1 и пентин-2) будет сигнализировать о том, что эти вещества будут являтся структурными изомерами по положению связи.
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.

На представленной выше диаграмме приведены молекулярные орбитали этилена и ацетилена.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
| Физические свойства некоторых алкинов[6][7] | |||||
|---|---|---|---|---|---|
| № | Название | Формула | Т плавления,°С | Т кипения,°С | Плотность, d204 |
| 1 | Этин | С2H2 | −81,8 | −75 | 0,565* |
| 2 | Пропин | C3H4 | −101,5 | −23 | 0,670* |
| 3 | Бут-1-ин | HC≡C−CH2CH3 | −125,9 | 8,1 | 0,678* |
| 4 | Бут-2-ин | CH3−C≡C−CH3 | −32,3 | 27,0 | 0,694 |
| 5 | Пент-1-ин | HC≡C−C3H7 | −90,0 | 39,3 | 0,695 |
| 6 | Пент-2-ин | CH3−C≡C−C2H5 | −101,0 | 55,0 | 0,714 |
| 7 | 3-Метилбут-1-ин | HC≡C−CH(CH3)CH3 | н/д | 28,0 | 0,665 |
| 8 | Гекс-1-ин | HC≡C−C4H9 | −132,4 | 71,4 | 0,719 |
* Значения измерены при температуре кипения.
Нахождение в природе и физиологическая роль алкинов[править | править код]
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения, содержащие полиацетиленовые структуры[8].
Ацетилен обнаружен в атмосфере Урана[9], Юпитера[10] и Сатурна[11].
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги[12].
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)[править | править код]
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
CaO+3C→CaC2+CO{\displaystyle {\mbox{CaO}}+3{\mbox{C}}\rightarrow {\mbox{CaC}}_{2}+{\mbox{CO}}}
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
CaC2+2h3O→C2h3+Ca(OH)2{\displaystyle {\mbox{CaC}}_{2}+2{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+{\mbox{Ca(OH)}}_{2}}
Пиролиз углеводородов (промышленный способ)[править | править код]
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который, сгорая, поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана[13]:
2Ch5→C2h3+3h3{\displaystyle 2{\mbox{CH}}_{4}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+3{\mbox{H}}_{2}}
Крекинг природного газа (промышленный способ)[править | править код]
Электрокрекинг[править | править код]
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением[14].
Термоокислительный крекинг[править | править код]
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании[14]:
6Ch5+4O2→C2h3+8h3+3CO+CO2+3h3O{\displaystyle 6{\mbox{CH}}_{4}+4{\mbox{O}}_{2}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+8{\mbox{H}}_{2}+3{\mbox{CO}}+{\mbox{CO}}_{2}+3{\mbox{H}}_{2}{\mbox{O}}}
Метод прямого синтеза[править | править код]
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
2C+h3→C2h3{\displaystyle 2{\mbox{C}}+{\mbox{H}}_{2}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}}
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот[править | править код]
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия[15]:
NaOOCCH=CHCOONa+2h3O→C2h3+2CO2+2NaOH+h3{\displaystyle {\mbox{NaOOCCH}}\!\!=\!\!{\mbox{CHCOONa}}+2{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+2{\mbox{CO}}_{2}+2{\mbox{NaOH}}+{\mbox{H}}_{2}}
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
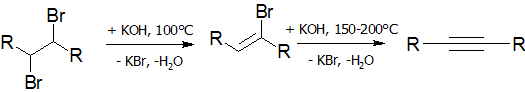
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)[править | править код]
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке [16]:
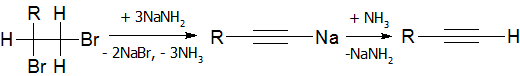
Алкилирование алкинов (лабораторный способ)[править | править код]
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:
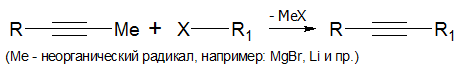
Подробнее смотри подраздел: Реакции нуклеофильного замещения алкинидов.
Прочие лабораторные способы получения алкинов[править | править код]
На первой стадии идёт образование дибромалкена:
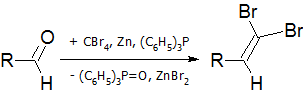
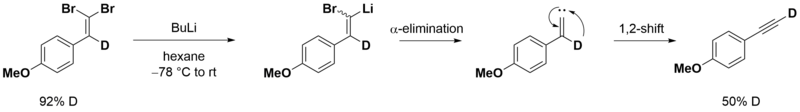
На второй стадии происходит обмен брома на литий и альфа-элиминирование с последующим превращением винилидена в алкин в результате перегруппировки Фрича-Буттенбергера-Вихеля:
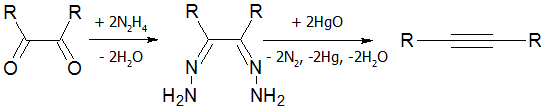
- Разложение дигидразонов[18]:
- Перегруппировка Фрича-Буттенберга-Вихелля — превращение 1,1-диарил-2-дигалогенэтиленов в производные ацетилена под действием сильных оснований[19]:
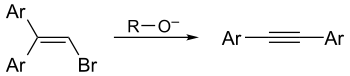
Кислотные свойства алкинов и реакции нуклеофильного замещения[править | править код]
Образование алкинидов[править | править код]
Алкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены, но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли — алкиниды[6]:
HC≡CH+2NaNh3→NaC≡CNa+2Nh4{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+2{\mbox{NaNH}}_{2}\rightarrow {\mbox{NaC}}\!\!\equiv \!\!{\mbox{CNa}}+2{\mbox{NH}}_{3}} (ацетиленид динатрия)
HC≡CH+2K→KC≡CK+h3{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+2{\mbox{K}}\rightarrow {\mbox{KC}}\!\!\equiv \!\!{\mbox{CK}}+{\mbox{H}}_{2}} (ацетиленид дикалия)
Ch4−C≡CH+C2H5MgBr→Ch4−C≡CMgBr+C2H6{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}+{\mbox{C}}_{2}{\mbox{H}}_{5}{\mbox{MgBr}}\rightarrow {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CMgBr}}+{\mbox{C}}_{2}{\mbox{H}}_{6}} (пропинилмагнийбромид)
Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связи[6]:
Ch4−C≡CH+Ag(Nh4)2OH→Ch4−C≡C−Ag↓+ 2Nh4+h3O{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}+{\mbox{Ag(NH}}_{3})_{2}{\mbox{OH}}\rightarrow {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{Ag}}\!\downarrow +\ 2{\mbox{NH}}_{3}+{\mbox{H}}_{2}{\mbox{O}}}
Ch4−C≡CH+Cu(Nh4)2OH→Ch4−C≡C−Cu↓+ 2Nh4+h3O{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}+{\mbox{Cu(NH}}_{3})_{2}{\mbox{OH}}\rightarrow {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{Cu}}\!\downarrow +\ 2{\mbox{NH}}_{3}+{\mbox{H}}_{2}{\mbox{O}}}
HC≡CH+2Cu(Nh4)2OH→Cu−C≡C−Cu↓+ 4Nh4+2h3O{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+2{\mbox{Cu(NH}}_{3})_{2}{\mbox{OH}}\rightarrow {\mbox{Cu}}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{Cu}}\!\downarrow +\ 4{\mbox{NH}}_{3}+2{\mbox{H}}_{2}{\mbox{O}}}
Пропинид серебра представляет собой осадок белого цвета, пропинид меди — осадок жёлтого цвета, наконец, диацетиленид меди — осадок красного цвета.
Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина[8]:
Ch4−C≡C−Ag+2NaCN+h3O→Ch4−C≡CH↑+Na[Ag(CN)2]+NaOH{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{Ag}}+2{\mbox{NaCN}}+{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}\!\uparrow +{\mbox{Na}}[{\mbox{Ag(CN)}}_{2}]+{\mbox{NaOH}}}
См. также статью: Ацетилениды.
Реакции нуклеофильного замещения алкинидов[править | править код]
Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения:
NaC≡CNa+2h3O→HC≡CH+2
Алкены, подготовка к ЕГЭ по химии
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
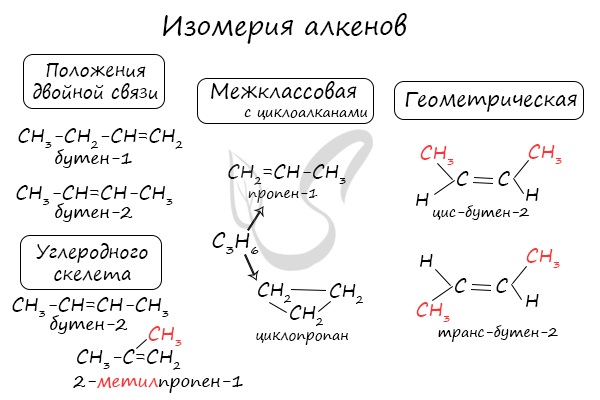
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
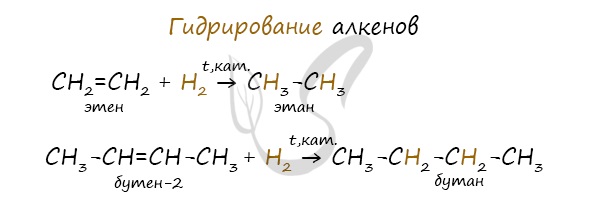
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
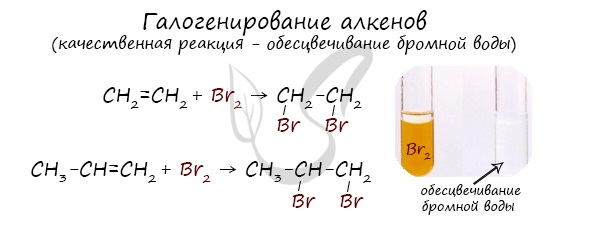
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обеспечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
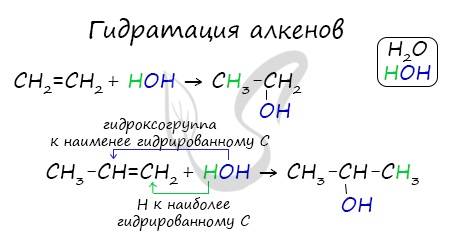
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.

Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Строение, изомерия и гомологический ряд алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n+2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С. Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
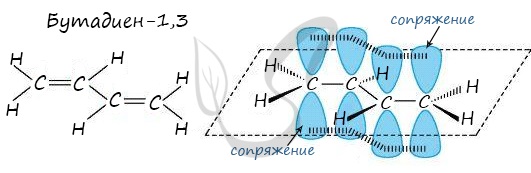
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
| Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей. |
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
| Например. Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4 |
| Гексадиен-1,3 | Гексадиен-2,4 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
| Например. Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен |
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен) |
| Пентадиен-1,3 | 2-Метилбутадиен-1,3 |
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен | транс-Алкадиен |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
| Например. Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |
CH2=CH–CH=CH2
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
| Например, алкадиен имеет название бутадиен-1,3. |
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкадиена |
| Дивинил | |
| Изопрен |
Поделиться ссылкой:
Учебно-методический материал по химии (10 класс) на тему: открытый урок по теме: «Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов»
Тема:«Алкены. Строение. Гомологический ряд этилена. Номенклатура.
Изомерия алкенов»
Цель урока:
- выработка умений самостоятельно применять знания об алканах, применять их в новых условия.
- изучить строение алкенов; выявить их существенные отличия от алканов; рассмотреть виды изомерии алкенов; основываясь на особенностях строения, спрогнозировать химические свойства алкенов.
Задачи урока:
- Образовательные:
- формирование знаний школьников о непредельных углеводородах и об алкенах как самостоятельном классе этих веществ, а также об особенностях их электронного строения, изомерии, номенклатуры, физических свойств;
- показать место и значение алкенов среди углеводородов и в жизни человека;
Развивающие:
- развивать умение учащихся на основе теоретических знаний сравнивать, анализировать, обобщать, логически рассуждать, устанавливать взаимосвязь строения и свойств веществ.
- развивать внимание, познавательный интерес учащихся к предмету путем формирования мотивов деятельности и использования разнообразных форм работы (коллективная, индивидуальная, парная).
Воспитательные:
- воспитывать желание учиться активно, с интересом, прививать сознательную дисциплинированность, четкость и организованность в работе.
Форма проведения: урок-игра.
Тип урока: урок формирования новых знаний.
Оборудование:
1. Комплект для построения шаростержневых моделей молекул.
2. Раздаточный материал:«судовой журнал»
3. Презентация: «Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов» .
Ход урока
(слайд №1)
Любой человек, невзирая на возраст любит путешествовать. Вот и я Вас приглашаю совершить вместе со мной путешествие на прекрасном лайнере. Я – «капитан», Вы – пассажиры. Нам нужен штурман, который будет моим помощником. Его мы можем выбрать по количеству жетонов за отгаданный кроссворд.
Сегодня вместо тетрадей вы будете работать с «судовым журналом», который у Вас на столах.
Итак, начинаем. Чтобы определить- кто поведёт карабль? Небоходимо ответить на вопросы кроссворда:(слайд №2-10)
- Процесс выравнивания S и P электронных облаков
- Гомолог метана, формула которого C4h20.
- Основной компонент болотного газа
- Вещества относящиеся к одному классу, но отличающиеся друг от друга на одну или несколько групп -Ch3
- Вещество получаемое в процессе дегидратации этилового спирта
- Частица несущая один не спаренный электрон
- Вещества имеющие одинаковое число атомов, одну и ту же молекулярную массу, но различное химическое строение
- Ученый, который получил этан из галогеннопроизводных предельных углеводород с металлическим натрием:
По итогам назначается Штурман.____________
Учитель: Итак карабль готов к выходу в плаванье. Отдать швартовый !
Учитель ставит перед штурманом задачу: на протяжении всего нашего плаванья следить за курсом, за правильные ответы учащимся выдавать жетоны.
Учитель: (слайд №11)
Штурман, что у нас по курсу?
Штурман:
1. Форватор основных понятий.
Как нам его преодалеть?
Учитель: Чтобы выйти из бухты необходимо ответить на вопросы в «судовом журнале»
Работа учащихся на местах:
1. Вопрос в «судовом журнале» (слайд №12) Ответ (слайд №13)
— Из перечисленных веществ, выпишите формулы предельных УВ и дайте им названия:
C4H8, Ch5, C5h22, C2h5, C3H6, C7h26, C8h28, C8h26, C5h20 .
!!!! Один учащийся тем временем решает задачу у доски на вывод химической формулы:
Задача. Выведите молекулярную формулу УВ, если известно, что массовая доля углерода в данном веществе составляет 87,5%, массовая доля водорода – 14,3%. Плотность данного вещества по водороду равна 14. (Ответ: C2h5)
Все вещества которые вы выписали относят к классу алканов. Давайте дадим характеристику класса, ответив на вопрос 2.
2. Вопрос в «судовом журнале»
Заполните таблицу отвечая на вопросы:
- Какова общая формула алканов?
- Какой тип гибридизации характерен для атомов углерода у алканов?
- Чему равен валентный угол?
- Форма молекул алканов?
- Виды связи?
- Длина связи С – С ?
- Виды изомерии?
Ответ (слайд №14)
Признаки | Предельные УВ (насыщенные, алканы) |
1. Общая формула | Cnh3n+2 |
2. Тип гибридизации | sp3 |
3. Валентный угол | 109о28 |
4. Форма молекулы | тетраидрическая |
5. Виды связей | σ — связь |
6. Длина связи | 0,154 нм |
7. Виды изомерии | Структурная: изомерия углеводородного скелета |
Учитель: Штурман, что у нас дальше по курсу?
Ответ (слайд №15)
2. Море классов органических соединений
Учитель:
1. Будет ли УВ, формулу которого была выведена в задаче относится к предельным УВ? Почему? — Не отвечает общей формуле алканов
2. Является ли данный УВ насыщенным? — Данный УВ не является насыщенным
Данный УВ используют широко для обработки фруктов и овощей, чтобы ускорить их созревание. Сегодня его широко применяют для получения многих видов пластмасс. Это этилен.
Учитель: Как вы думаете, какую тему урока мысегодня будем изучать? Ответ (слайд №16)
Записать тему в «судовой журнал»
Тема: «Алкены. Строение. Гомологический ряд этилена. Номенклатура. Изомерия алкенов»
???? Постановка целей урока
Сообщение учащегося об истории открытия и истории названия этилена.
Ответ (слайд №17)
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635–1682)… случайно! В одном из опытов он вместо добавления к нагретому купоросному маслу (концентрированной серной кислоте) еще одной его порции в рассеянности прилил винный спирт (этанол), который находился рядом в стакане. Бехер увидел сильное вспенивание раствора с выделением неизвестного газа, похожего на метан СН4. В отличие от метана новый газ горел коптящим пламенем и обладал слабочесночным запахом. Бехер установил, что его “воздух” более химически активен, чем метан. Так был открыт этилен С2Н4, образующийся по реакции:
Современники не смогли по достоинству оценить открытие учёного. Ведь Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор в процессе реакции. До этого в научной практике применялись только биологические катализаторы природного происхождения – ферменты. Этилен более 100 лет после его открытия не имел собственного названия.
В конце ХVIII века выяснилось, что при взаимодействии с хлором “газ Бехера” превращается в маслянистую жидкость; после чего его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, которые имели подобное этилену строение. И только в середине XIX в. “газ Бехера” получил название “этилен”, которое дал ему А.М. Бутлеров. Это название и осталось в химии до наших дней.
Работа учащихся на местах: Вопрос в «судовом журнале»
1. Выразить строение этилена структурной формулой, если согласно теории А.М.Бутлерова углерод в органических соединениях четырёхвалентен.
Ответ (слайд №18)
2. Лабораторный опыт № 1: Собрать шаростержневую модель молекулы этилена, ответить на ряд вопросов, заполнив таблицу:
- Сколько сигма-связей в молекуле этена? Ответ (слайд №19)
- В состоянии какого типа гибридизации находятся атомы углерода в этом соединении?
- Сколько гибридных и негибридных орбиталей в атоме углерода в sp2- гибридном состоянии?
- Как расположены гибридные орбитали в пространстве?
- Каков будет угол связи?
- Какая из связей более прочная: сигма- или пи-связь? Ответ (слайд №20)
3. Характеристика двойной связи. Ответ (слайд №21)
Сделать вывод о характере двойной связи:
а) двойная связь является сочетанием сигма- и пи-связей, различающихся своей прочностью.
б) наличие пи-связи (более слабой) объясняет высокую химическую активность алкенов.
Учитель:
Ответив на вопросы, мы двигаемся дальше по курсу. Штурман, что у нас дальше по курсу?
Ответ (слайд №22)
3. Рифы химических формул
Задание классу: в «судавом журнале»
Гомологический ряд алкенов.
1. Составить молекулярные формулы первых семи представителей ряда этена Ответ (слайд № 23). Существует ли алкен с одним атомом углерода?
Номенклатура алкенов.
2. Назовите непредельный углеводород. (слайд №24,25)
СН2
||
СН3 – СН2 – СН2 – С– СН2 – СН3 (2- этилпентен-1)
Запомни!!! (слайд №26)
Названия одновалентных радикалов алкенов: -СН=СН2 (винил) –СН2–СН=СН2 ( аллил )
Изомерия. (Предложить учащимся ответить на вопросы)
1. Какие виды изомерии характерны для алкенов?
— изомерия углеродного скелета. Ответ (слайд № 27)
— изомерия положения двойной связи. Ответ (слайд № 28)
— межклассовая изомерия. Ответ (слайд № 29)
Лабораторный опыт № 2: (слайд № 30)
а) заменить в шаростержневой модели молекулы этилена два атома водорода на 2 атомыа хлора по вариантам.
б) возможно свободного вращения атомов углерода при двойной связи?
в) сравнить полученные вещества и ответить на вопрос:Может ли молекула одной конфигурации свободно превратиться в молекулу другой конфигурации ?
- Это два разных вещества, изомерных друг другу. (слайд № 31)
- Данный вид изомерии обусловлен не разным порядком соединения атомов в молекулах, а различным расположением атомов в пространстве.
Это один из видов пространственной изомерии – геометрическая изомерия.
Если замещающие группы в изомере находятся по одну сторону плоскости двойной связи, то будет цис-изомер (цис- от лат.- по эту сторону), если они находятся по разные стороны – транс-изомер (транс- от лат. – через, по разные стороны).
Эти изомеры отличаются физическими и химическими свойствами.
Вывод:
- для алкенов характерна пространственная (цис-, транс) изомерия.
- цис-транс-изомерия возникает только в том случае, если каждый из атомов углерода, связанных двойной связью, соединён с разными атомами или группами атомов.
Учитель: Давайте заполним таблицу в «судовом журнале»
Тип изомерии | Виды изомерии |
l Структурная изомерия | 1 углеродного скелета |
2 положения двойной связи | |
3 межклассовая | |
ll Пространственная изомерия | 1 цис-изомерия |
2 транс-изомерия |
Физические свойства алкенов. Ответ (слайд № 32)
Изменение физических свойств происходит вслед за возрастанием Mr веществ.
По физическим свойствам алкены близки к алканам, т.к. их молекулы также практически неполярны. С воздухом этилен образует взрывоопасные смеси. Жидкие алкены имеют неприятный специфический запах.
Распространение в природе. В отличие от предельных УВ алкены в природе, как правило, не встречаются, что объясняется их высокой химической активностью. Этилен может входить в состав природного и попутного газов, правда содержание его невелико (0,5- 4%). Газообразные алкены выделяют из газов нефтепереработки, а также из газов коксообразования угля.
Учитель: Штурман, что у нас дальше по курсу? Ответ (слайд №33)
4. Залив знаний
Чтобы преодалеть это испатание нам необходимо ответить на ряд вопросов.
1. Какое вещество является лишним? Почему?(слайд №34)
А) 3-метилпентен-1 Г) 2-метил-4-этилгексен-2 Ж) циклогексан
Б) 2,2-диметил-3-этилгептен-3 Д) 3-метилпентен-2 З) цис-изомер-гексен-2
В) 2-метилоктен-2 Е) 3-метилгексен-2 И) гексан
Ответ (слайд №35) Какое вещество является лишним? Почему? — И) гексан
2. Какие вещества являются изомерами? Почему? (слайд №36)
Ответ (слайд №37) Какие вещества являются изомерами? Почему? — 1) А и Д; 2) В и Г.
- 3. Вставьте в текст соответствующие слова и символы из скобок (слайд №38)
Алкенами называются УВ, содержащие в молекуле одну…. (одинарную, двойную, тройную) связь и имеющие общую формулу …. (СnН2n+2, СnН2n, СnН2n-2). Длина углерод-углеродной связи в этилене ….(больше, меньше), чем в этане, и равна ….(0,154 нм, 0,120 нм, 0,134 нм)
Ответ (слайд №39)
Алкенами называются УВ, содержащие в молекуле одну…. (одинарную, двойную, тройную) связь и имеющие общую формулу …. (СnН2n+2 СnН2n СnН2n-2 ). Длина углерод-углеродной связи в этилене ….(больше, меньше), чем в этане, и равна ….(0,154 нм, 0,120 нм, 0,134 нм)
5. Порт
Учитель: (слайд №40)
Итак, мы подошли в конечный пункт нашего путешествия – порт.
Давайте подведём итог нашему путешествию, ответив вопросы в «судовам журнале»:
(слайд №41)
- Что мы узнали в ходе путешествия?
- Где встретились затруднения на нашем пути?
- С каким настроением Вы вернулись в Порт?(поднимите смайлик)
Учащиеся отвечают на вопросы, учитель считает количество жетонов и выставляет оценки за урок.
(слайд №42) Домашнее задание
Учитель: Домашнее задание у вас находится в «судовом журнале»
1. §7
2. Напишите структурные формулы веществ:
а) 3-метилпентен-1 б) 2,2-диметил-3-этилгептен-3 в) 2-метилоктен-2
г) 2-метил-4-этилгексен-2 д) 3-метилпентен-2 е) 3-метилгексен-2
ж) циклогексан з) цис-изомер-гексен-2
(слайд №43) Спасибо за внимание!
Физические и химические свойства алкенов
Общая формула гомологического ряда алкенов (табл. 2) – CnH2n
Таблица 2. Гомологический ряд алкенов.
| Название химического соединения | Структурная формула |
|---|---|
|
Этен (этилен) |
C2H4 (СH2 = CH2) |
|
Пропен (пропилен) |
C3H6 (СH2 = CH-CH3) |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
|
Гептен |
C7H14 |
|
Октен |
C8H16 |
|
Нонен |
C9H18 |
|
Декен |
C10H20 |
Углеводородные радикалы, образованные от алкенов: -CH = CH2 – винил и –СН2-СН = СН2 – аллил.
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
CH2 = CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
CH2 = CH-CH2-CH3 (бутен-1)
CH3-C = CH-CH3 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Атомы углерода в молекулах алкенов находятся в sp2-гибридизациии: 3σ-связи располагаются в одной плоскости под углом 120 друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Химические свойства алкенов
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
CH3-CH = CH2 + HCl = CH3-CHCl-CH3
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
CH3-C(CH3) = CH2 + H2O = CH3-C(CH3)OH-CH3
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
CH2 = CH2 + Br2 = BrCH2-CH2Br
При нагревании смеси алкена с галогеном до 500С возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH = CH2 + Cl2 = Cl-CH2-CH = CH2 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоны, карбоновых кислот или углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n—
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение алкенов
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-CHBr-CH3 + KOH = CH3-CH = CH-CH3 + KBr + H2O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH = CH-CH3
— дегидратация спиртов при их нагревании с серной кислотой (t >150 C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 = CH3-CH = CH2 + H2O
— дегидрирование алканов при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 = CH3-CH = CH2 + H2
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Примеры решения задач
Алкадиены, подготовка к ЕГЭ по химии
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
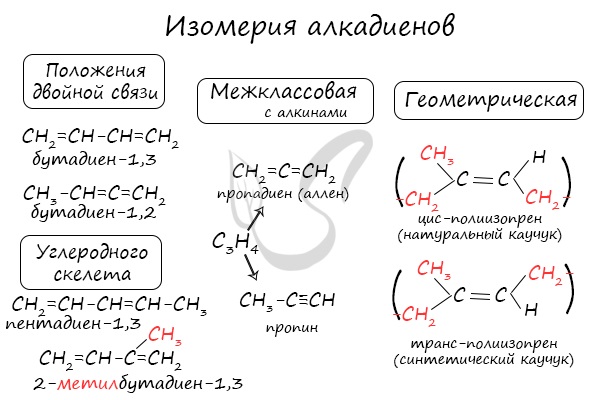
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена все атомы углерода находятся в состоянии sp2гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
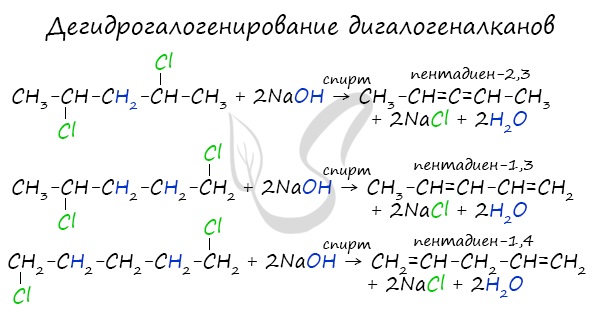
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, использующуюся повсеместно.
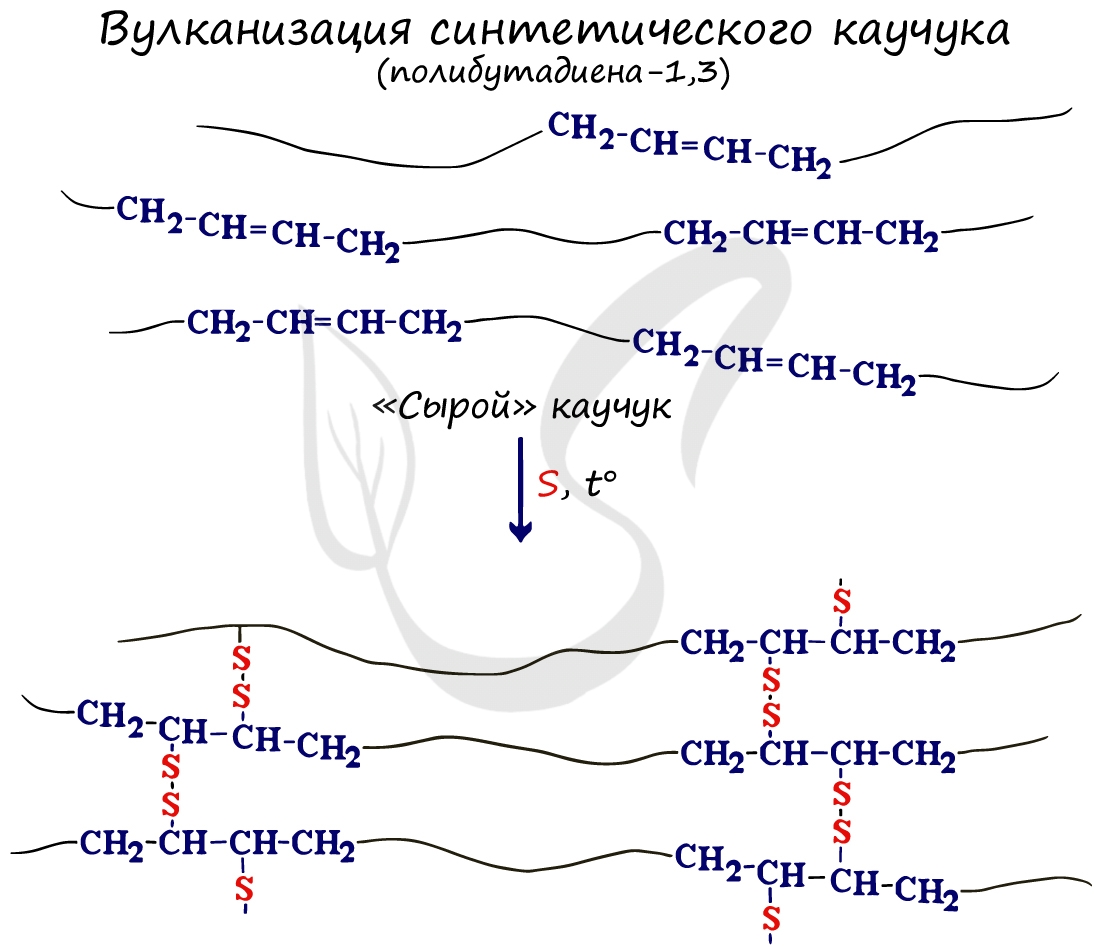
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
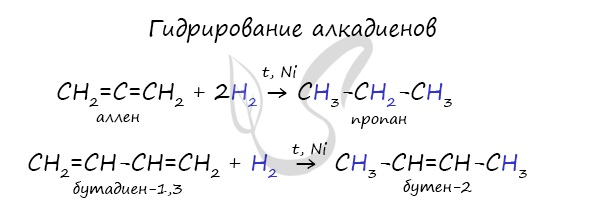
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обеспечивается, что указывает на присоединение его по кратным связям к органическому веществу.
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.
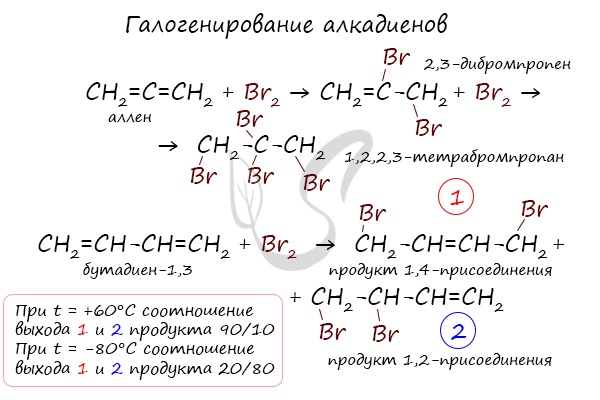
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.

При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.