Хлорид натрію — Вікіпедія
| Хлорид натрію | |
|---|---|
 | |
 | |
| Назва за IUPAC | Натрій хлорид |
| Інші назви | звичайна сіль, кухонна сіль, столова сіль, харчова сіль, кам’яна сіль, галіт[1] |
| Ідентифікатори | |
| Номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Номер EINECS | 231-598-3 |
| DrugBank | 09153 |
| KEGG | C13563 і D02056 |
| ChEBI | 26710 |
| RTECS | VZ4725000 |
| Код ATC | B05CB01, B05XA03 і A12CA01 |
| SMILES | [Na+].[Cl-][2] |
| InChI | 1S/ClH.Na/h2H;/q;+1/p-1 |
| Номер Бельштейна | 3534976 |
| Номер Гмеліна | 13673 |
| Властивості | |
| Молекулярна формула | NaCl |
| Молярна маса | 58,443 г/моль |
| Зовнішній вигляд | безбарвна/біла кристалічна тверда речовина |
| Запах | без запаху |
| Густина | 2,165 г/см³ |
| Тпл | 801 |
| Ткип | 1413 |
| Розчинність (вода) | 356 г/л (0 °C) 359 г/л (25 °C) 391 г/л (100 °C) |
| Розчинність (метанол) | 14,9 г/л |
| Розчинність (аміак) | 21,5 г/л |
| Розчинність | розчинний у гліцерині, етиленгліколі, мурашиній кислоті нерозчинний у HCl |
| Показник заломлення (nD) | 1,5442 (589 нм) |
| Структура | |
| Кристалічна структура | гранецентрована кубічна (див. текст), cF8 |
| Координаційна геометрія | Октаедральна (Na+) Октаедральна (Cl–) |
| Небезпеки | |
| ЛД50 | 3000–8000 мг/кг (орально: щури, миші, кролі)[3] |
| Індекс ЄС | не зазначений |
| NFPA 704 |  0 0 |
| Температура спалаху | незаймистий |
| Пов’язані речовини | |
| Інші аніони | флуорид натрію бромід натрію йодид натрію |
| Інші катіони | хлорид літію хлорид калію хлорид рубідію хлорид цезію |
| Якщо не зазначено інше, дані приведені для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Хлори́д на́трію (NaCl, у побуті — «сіль») — тверда, прозора (у чистому вигляді) хімічна сполука з іонною кристалічною ґраткою, солона на смак. При розчиненні у воді повністю дисоціює на катіони натрію та хлорид-аніони.
 Кристал хлориду натрію
Кристал хлориду натріюЗустрічається в природі в розчиненому стані в солоних водоймах: у морях, океанах, озерах. У кристалічному стані входить до мінералу галіт, з якого практично повністю складається видобувна кам’яна сіль, морська сіль тощо.
Залежно від походження природного хлориду натрію, має різну ступінь чистоти та різний кількісний та якісний склад домішок, які зумовлюють його смак та колір. Хлорид натрію, який застосовується в побуті, часто звуть кухонною, харчовою чи столовою сіллю; у назві іноді вказується на джерело її походження (кам’яна, морська, озерна, виварна) та — ґатунок: чим вищий, тим менше домішок містить хлорид натрію. У воді хлорид натрію розчиняється, але в чистому виді, на відміну від кухонної солі, не гігроскопічний, — не сиріє.
Хлорид натрію використовується дуже широко: окрім застосування в кулінарії (як приправа до їжі і при консервуванні риби, м’яса та інших харчових продуктів), є також важливою сировиною хімічної промисловості для одержання гідроксиду натрію, соди, хлору тощо. Щорічний світовий видобуток хлориду натрію становить сотні мільйонів тонн, з яких майже 30 % використовується в харчовій промисловості.
У природі хлорид натрію зустрічається у вигляді мінералу галіту, який утворює поклади кам’яної солі серед осадових гірських порід, прошарки і лінзи на берегах солоних озер і лиманів, соляні кірки в солончаках та на стінках кратерів вулканів і в сольфатарах. Величезна кількість хлориду натрію розчинена у морській воді. Світовий океан містить 4×1015 тонн NaCl, тобто з кожної тисячі тонн морської води можна отримати в середньому 1,3 тонни хлориду натрію. Сліди NaCl постійно містяться в атмосфері внаслідок випаровування бризок морської води. У хмарах на висоті півтора кілометра 30% крапель, більших 10 мкм за розміром, складаються з NaCl. Також його знайдено у кристалах снігу [4].
Найімовірніше, що перше знайомство людини із сіллю відбулося в лагунах теплих морів або на соляних озерах, де на мілководді солона вода інтенсивно випарювалась під дією високої температури і вітру, а в осаді накопичувалась сіль. За образним виразом:
| « | Сіль була народжена найшляхетнішими батьками: сонцем і морем | » |
— Піфагор, [5] | ||
Галіт[ред. | ред. код]
У природі хлорид натрію найчастіше зустрічається у вигляді мінералу галіту. Він має гранецентровану кубічну ґратку і містить 39,34 % Na, 60,66 % Cl. Іншими хімічними елементами, що входять до складу домішок, є: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Густина 2,1—2,2 г/см³, а твердість за шкалою Мооса — 2. Безбарвний, прозорий мінерал, зі скляним блиском. Поширений мінерал соленосних товщ. Утворюється при осадженні у замкнених водоймах, а також як продукт згону на стінках кратерів вулканів. Складає пласти в осадових породах лагунних та морських фацій, штокоподібні тіла в соляних куполах тощо
Кам’яна сіль[ред. | ред. код]
Кам’яною сіллю називають осадову гірську породу з групи евапоритів, складену більше ніж на 90% з галіту. Галіт також часто називають кам’яною сіллю. Ця осадова гірська порода може бути безбарвною або сніжно-білою, але частіше її забарвлено домішками глин, тальку (сірий колір), оксидами та гідроксидами заліза (жовтий, помаранчевий, рожевий, червоний), бітумами (бурий). Кам’яна сіль містить хлориди і сульфати натрію, калію, магнію і кальцію, броміди, йодиди, борати, гіпс, домішки карбонатно-глинистого матеріалу, доломіту, анкериту, магнезиту, бітумів тощо[6].
За умовами формування родовищ кам’яну сіль поділяють на такі види[6]:
- ропа сучасних соляних басейнів
- соляні підземні води
- поклади мінеральних солей сучасних соляних басейнів
- викопні поклади (найважливіші для промисловості).
Морська сіль[ред. | ред. код]
Морська сіль є сумішшю солей (хлориди, карбонати, сульфати тощо), що утворюється за повного випаровування морської води. Середній вміст солей в морській воді становить:
| Сполука | Мас. частка, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| інші солі | 0,2 |
 Очищена кристалічна морська сіль
Очищена кристалічна морська сільПід час випаровування морської води за температури 20 — 35 °C в осаді спочатку кристалізуються найменш розчинні солі — карбонати кальцію та магнію і сульфат кальцію. Потім випадають більш розчинні сульфати натрію і магнію, хлориди натрію, калію і магнію, і після них — сульфати калію і магнію. Послідовність кристалізації солей і склад осаду може дещо змінюватись залежно від температури, швидкості випаровування та інших умов. У промисловості морську сіль отримують з морської води, здебільшого методом звичайного випарювання. Вона відрізняється від кам’яної солі значно більшим вмістом інших хімічних солей, мінералів та різних мікроелементів, в першу чергу йоду, калію, магнію та мангану. Відповідно вона відрізняється від хлориду натрію за смаком — гірко-солоний присмак їй надають солі магнію. Вона використовується в медицині: при лікуванні шкірних захворювань, таких як псоріаз. Як лікувальна речовина в аптечній та звичайній торговельній мережі поширеним продуктом є сіль з Мертвого моря. В очищеному вигляді цей вид солі також пропонується у продуктовій торговельній мережі — як натуральна та багата на йод харчова
Поклади[ред. | ред. код]
Поклади кам’яної солі відомі у всіх геологічних системах. Найважливіші з них зосереджено у кембрійських, девонських, пермських і третинних відкладах. Кам’яна сіль складає потужні пластові поклади і ядра склепінчастих структур (соляних куполів і штоків), утворює прошарки, лінзи, гнізда і вкраплення в інших породах[6]. Україна має великі та унікальні за якістю поклади солі, де у потужних пластах на незначних глибинах залягають ресурси дуже високої якості [8]. За хімічною чистотою їх можна вважати найкращими у світі. Також родовища кам’яної солі є у Придніпровській низовини, Прикарпатті, Закарпатті, Переддобруджі а також у Криму[9]:
Крім кам’яної солі є родовища у вигляді ропи соляних озер (Сиваське та Сасик-Сиваське), а також підземні розсоли. Запаси кам’яної солі та природних розсолів в Україні досить значні і за сучасного рівня видобутку практично невичерпні (їх запаси становлять понад 9 млрд т за категоріями А + В + С
Історія[ред. | ред. код]
Деякі дослідники вважають, що сіль була першим мінералом, який люди видобували в шахтах. Так, є дані, що свідчать про видобування неглибоко залягаючих пластах солі колодязним методом ще в бронзову добу поблизу Зальцбургу[10]. У 3—4 тисячолітті до н.е. племена, які мешкали в долинах рік Хуанхе і Янцзи та на рівнині біля Печилейської затоки виварювали сіль. В епоху династії Чжоу (1125—1255 до н. е.) були особливі чиновники, які завідували соляним промислом у Піднебесній. Вони зараховувались до придворної служби і називалися «янь-жень» — «соляні люди». Страбон описує родовища солі, а Діоскорід згадує видобуток солі з морської води. В середньовіччі першими містами Центральної Європи, які тісно пов’язані з сіллю, були Люнебург (956), Райхенхаль (1163) і Халлейн (1177).
У IX столітті у Венеції були свої солеварні, що залишились ще з римських часів. Але сіль в них отримували тільки дрібну — крупнокристалічну доводилося імпортувати. А в XIII столітті низка повеней знищила половину венеціанських солеварен і імпорт солі зріс ще більше. Тоді венеціанці зробили важливе відкриття — спекуляція сіллю давала більше прибутку, ніж її виробництво. Уряд давав субсидії купцям за доставку солі до Венеції. У результаті це стало настільки вигідною справою, що ті ж самі купці, збагатившись, зайнялися ввезенням і інших потрібних товарів. Дорогі індійські прянощі, шовку, зерно — все йшло до Європи через Венецію. Але завжди від 30 до 50 відсотків усіх перевезень венеціанців становила сіль. Поступово Венеція прибрала до рук всі європейські ринки солі. Купці просувалися все далі і далі по Середземномор’ю, купуючи сіль, а якщо вийде — то і самі солеварні, в Єгипті, Алжирі, Криму. Саме на регулюванні солі Венеція змогла звести розкішні громадські будівлі і побудувати складну гідравлічну систему для захисту від затоплення. Величний і чарівний вигляд міста, його статуї, собори і розписи були профінансовані «соляними» грошима.
У давнину технологія видобування солі полягала в тому, що соляну ропу витягали кінським приводом із шахт, що звалися «криниці» або «вікна», і були досить глибокими — 60—90 м. Витягнуту суровицю виливали до особливого резервуару — творила, звідки вона через отвори стікала до нижнього резервуару — кадіба, а з останнього системою ринв подавалася до дерев’яних веж. Там її розливали у великі чани і черіні[a 1], на яких сіль виварювалася[11].
На Русі помори виварювали сіль на узбережжі Білого моря і називали її морянкою. 1137 року новгородський князь Святослав Ольгович визначив податок на соляні варниці[12]:
| « | на морі од чрена і од салги по пузу[a 2] | » |
Біломорською сіллю торгували у всій Російській імперії аж до початку 20 ст., коли її було витіснено дешевшою поволзькою сіллю.
Сучасний видобуток хлориду натрію механізовано та автоматизовано. Сіль масово добувається випарюванням морської води (тоді її називають морською сіллю) чи ропи з інших ресурсів, таких як соляні джерела та соляні озера, а також розробкою соляних шахт та видобуванням кам’яної солі.
Для видобування хлориду натрію з морської води необхідні умови жаркого клімату з низькою вологістю повітря, наявність значних низинних територій, що лежать нижче рівня моря або затоплюються припливом, слабка водопроникність ґрунту випарювальних басейнів, мала кількість опадів протягом сезону активного випаровування, відсутність впливу прісних річкових вод та наявність розвинутої транспортної інфраструктури.
Сучасне виробництво[ред. | ред. код]
Карта світового виробництва хлориду натрію у 2005 році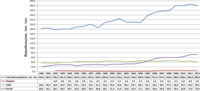 Світове виробництво хлориду натрію (1990-2012)[13]
Світове виробництво хлориду натрію (1990-2012)[13]Світове виробництво солі 2012 року оцінюється в 280 мільйонів тон[14]. Найбільшими світовими виробниками є Китай (60,0 млн тон), США (45,0 млн тон), Німеччина (16,5 млн тон), Індія (15,8 млн тон) та Канада (14 млн тон)[15]. Лідером виробництва хлориду натрію у США є «Akzo Nobel Salt Inc.» (входить до холдингової корпорації «Akzo Nobel»), потужності виробництв якої становлять понад 10 млн тон/рік. На ринку солевидобування США помітне місце мають такі компанії, як «Morton International» (6,3 млн тон/рік), «Cargill Inc.» (3,9 млн тон/рік), «Carey Salt» (1,7 млн тон/рік). З 2003 року помітно виразне нарощування виробничих потужностей соляної промисловості Китаю і поступове повільне зменшення видобутку солі в США та Європі. За видобутком солі Україна (5,5 млн тон) посідає 11-е місце у світі та 3-є — в Європі (після Німеччини та Франції, остання — 6,0 млн тон)[16].
Видобування солі в країнах Європи належить в основному державам Центральної та Південної Європи. Лідери європейського ринку — Німеччина, Франція, Велика Британія, Польща, Іспанія, Італія, Нідерланди, Румунія. Норвегія, Швеція та Фінляндія майже не мають солевидобувних виробництв і імпортують хлорид натрію з інших країн ЄС.
В Росії найбільшими виробниками хлориду натрію є: ВАТ «Бассоль», ВАТ «Тиретський солерудник», ВАТ «Сільвініт», ВАТ «Ілецьксоль» та ТзОВ Комбінат «Сибсоль». В Україні лідером солевидобувної промисловості є ДП «Артемсіль» з потужностями понад 7 млн тон/рік[17].
- ↑ черінь — сковорода, площею від 5 до 30—40 м²
- ↑ Чрен — залізна квадратна сковорода, салга — казан, в якому випарювали морську воду. Пузом у біломорських солеварнях називали мішок солі в два четверики, тобто приблизно 52 літри.
 Вантаження солі на корабель, соляний термінал порту Арейа Бранка, Бразилія
Вантаження солі на корабель, соляний термінал порту Арейа Бранка, БразиліяХлорид натрію є важливою речовиною, що забезпечує життєдіяльність людини, тваринного і рослинного світу, а також товаром, який має надзвичайно широкий спектр промислового застосування. Він є основою для виробництва багатьох хімічних продуктів, в першу чергу хлору і гідроокису натрію, без яких неможливо виробництво багатьох пластмас, алюмінію, паперу, мила, скла тощо. За підрахунками спеціалістів, хлорид натрію в умовах сучасної світової глобалізованої економіки прямо чи посередньо має більше 14 тисяч областей застосування[18].
У харчовій промисловості та кулінарії[ред. | ред. код]
 Сіль кухонна виварна «Екстра»
Сіль кухонна виварна «Екстра»У харчовій промисловості та кулінарії використовують хлорид натрію, чистота якого має бути не менше 97%. Його застосовують як смакову добавку і для консервування харчових продуктів. Такий хлорид натрію має товарну назву кухонна сіль, часом також вживаються назви харчова, столова, а також уточнення назви залежно від її походження — кам’яна, морська, та за складом добавок — йодована, фторована тощо. Така сіль є кристалічним сипким продуктом з солоним смаком без присмаку, без запаху (за винятком йодованої солі), в якому не припускаються сторонні домішки, що не пов’язані з методом добуванні солі. Окрім хлориду натрію, кухонна сіль містить невелику кількість солей кальцію, магнію, калію, які надають їй гігроскопічності і жорсткості. Чим менше цих домішок у солі, тим вища її якість[19].
Виділяють ґатунки: екстра, вищий, перший і другий. Масова частка хлористого натрію у ґатунках, %:
- екстра — не менш ніж 99,5;
- вищий — 98,2;
- перший — 97,5;
- другий — 97,0.
Масова частка вологи у виварній солі сорту «екстра» 0,1 %, у вищому сорті 0,7 %. Припускаються добавки йодиду калію (йодистого калію), йодату калію (йоднуватокислого калію), флуориду калію та флуориду натрію (фторидів калію та натрію). Масова частка йоду має складати (40,0 ± 15,0)×10−4 %, флуору (25,0 ± 5,0)×10−3 %[19]. Іноді в кухонну сіль додають інші допоміжні речовини, наприклад ферроціанід калію (E536 — неотруйну комплексну сіль Сmax10 мг/кг) як агента, що запобігає злипанню[20] Колір екстра та вищого ґатунків — білий, однак для першого та другого припускається сірий, жовтуватий, рожевий та голубуватий відтінки залежно від походження солі. Харчову кухонну сіль виробляють меленою і сіяною. За розміром зерен мелену сіль поділяють на номери: 0, 1, 2, 3. Що більший номер, то більші зерна солі[19].
У кулінарії хлорид натрію споживають як найважливішу приправу. Сіль має добре знайомий кожній людині характерний смак, без якого їжа здається прісною. Така особливість солі обумовлена фізіологією людини. Проте досить часто люди споживають солі більше, ніж потрібно для фізіологічних процесів.
У США продаються різні харчові продукти, що рекламуються як «сіль з пониженим вмістом натрію» англ. low sodium salt. Зменшення вмісту натрію досягається за рахунок зниження кількості хлориду натрію на одиницю об’єму. Один з варіантів виробництва — часткове заміщення хлориду натрію іншими хімічними сполуками, такими як хлорид калію або магнію. Інший варіант — зміна габітусів кристалів солі («сніжинки» замість характерних призм), в результаті чого її об’ємна щільність зменшується (0,76 г/см³ проти 1,24 г/см³ у «звичайної» солі), і одна столова ложка продукту містить на третину менше натрію[21].
Хлорид натрію має слабкі антисептичні властивості — 10–15 % вміст солі запобігає розмноженню гнилісних бактерій. Цей факт обумовлює її широке застосування як консерванту.
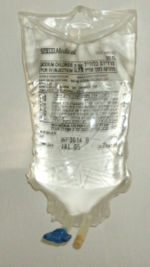 Пакет стерильного ізотонічного розчину для ін’єкцій
Пакет стерильного ізотонічного розчину для ін’єкційВ медицині[ред. | ред. код]
Ізотонічний розчин хлориду натрію у воді (0,9%) застосовується як дезінтоксикаційний засіб, для корекції стану систем організму у разі зневоднення, як розчинник інших лікарських препаратів. При падінні концентрації хлориду натрію у плазмі крові, вода переходить із судинного русла до міжтканинного простору і відбувається загущення крові. При значному дефіциті — спостерігаються судоми гладенької мускулатури і судомні скорочення скелетної, порушуються функції нервової та серцево-судинної систем. Гіпертонічні розчини застосовують у разі легеневих, шлункових і кишкових кровотеч; як допоміжний осмотичний діуретик для забезпечення форсованого діуреза; у станах, що характеризуються дефіцитом іонів натрію і хлору; у разі отруєння нітратом срібла; для обробки гнійних ран (місцево). В офтальмології як місцевий засіб розчин хлориду натрію має протинабрякову дію[22].
В оптиці[ред. | ред. код]
Кристали хлориду натрію прозорі для інфрачервоного спектра (довжини хвиль між 0,21 и 25 мкм)[23] і з них виготовляють лінзи, призми і вікна для інфрачервоних оптичних приладів. Наприклад, потужні імпульсні СО2-лазери, мають в своїй конструкції кілька лінз з високочистих кристалів хлориду натрію.
У комунальному господарстві. Технічна сіль[ред. | ред. код]
Взимку хлорид натрію, забруднений домішками інших солей або піску чи глини — так звана технічна сіль — застосовується як антифриз проти ожеледиці. Нею посипають тротуари, хоча це негативно впливає на рослинність, спричиняє корозію споруд та автомобілів, пошкоджує шкіряне взуття.
Регенерація Na-катіонітових фільтрів[ред. | ред. код]
Na-катіонітові фільтри широко застосовуються в котельних установках всіх потужностей для пом’якшення води при водопідготовці. Як катіонітовий матеріал на сучасних водопідготовчих установках використовують в основному глауконіт, сульфоноване вугілля і синтетичні смоли. Найпоширеніше сульфовугілля.
Регенерацію Na-катіонітових фільтрів здійснюють 6-8%-ним розчином кухонної солі, в результаті дія сульфовугілля відновлюється. Реакції йдуть за рівняннями:
- CaR2 + 2NaCl = 2NaR + CaCl2.
- MgR2 + 2NaCl = 2NaR + MgCl2.
Хімічна промисловість[ред. | ред. код]
Поряд із кам’яним вугіллям, вапняками і сіркою, сіль входить до так званої «великої четвірки» мінеральних сировин, які є найважливішими для хімічної промисловості[24]. З неї отримують соду, хлор, соляну кислоту, гідроксид натрію, сульфат натрію і металевий натрій. Окрім цього сіль використовується також для промислового отримання легкорозчинного у воді хлорату натрію, що є засобом для знищення бур’янів[25]. Сумарне рівняння реакції електролізу гарячого розчину хлориду натрію[26]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Отримання хлору та гідроксиду натрію[ред. | ред. код]
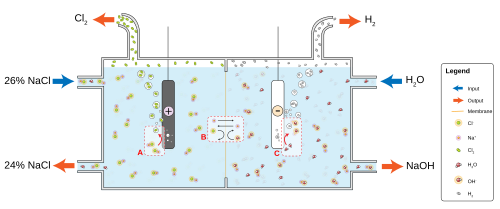 Схема типової електролізної комірки соляної ропи
Схема типової електролізної комірки соляної ропиУ промисловості шляхом електролізу концентрованого розчину хлориду натрію отримують хлор. Процеси, що відбуваються на електродах[27][28]:
- на катоді як побічний продукт виділяється водень внаслідок відновлення іонів H+, утворених електролітичною дисоціацією води:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- оскільки (внаслідок практично повної електролітичної дисоціації NaCl), хлор у розчині перебуває у вигляді хлорид-іонів, вони окислюються на аноді до вільного хлору у вигляді газу:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- сумарна реакція:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Як видно з рівняння сумарної реакції ще одним продуктом є гідроксид натрію. Витрати електроенергії на 1 т хлору складають приблизно 2700 кВт×год. Отриманий хлор зріджується на жовту рідину вже за звичайної температури[29].
Якщо між анодом та катодом нема діафрагми, то розчинений у воді хлор починає реагувати з гідроксидом натрію, утворюючи хлорид та гіпохлорит натрію NaClO[28]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Для уникнення цієї реакції при отриманні гідроксиду натрію з хлориду натрію застосовують діафрагму, а відповідний метод отримання NaOH називають діафрагмовим. Як діафрагму застосовують азбестовий картон. У процесі електролізу розчин хлориду натрію безперервно подається до анодного простору, а з катодного простору безперервно витікає розчин хлориду та гідроксиду натрію. Під час випарювання останнього хлорид кристалізується, оскільки його розчинність у 50% розчині NaOH мізерно мала (0,9%). Отриманий розчин NaOH випарюють у залізних чанах, після чого сухий залишок переплавляють.
Для отримання чистого гідроксиду натрію (без домішок хлориду натрію) застосовують ртутний метод, де використовують графітовий анод та ртутний катод. Внаслідок того, що перенапруга виділення водню на ртуті дуже велика, на ній відновлюються іони натрію і утворюється амальгама натрію[28][30]:
- Na+ + e− → Na(Hg)
Амальгаму пізніше розкладають гарячою водою з утворенням гідроксиду натрію та водню, а ртуть перекачують насосом назад до електролізера:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Сумарна реакція процесу така ж, як і у разі діафрагмового методу.
Отримання металевого натрію[ред. | ред. код]
Металевий натрій отримують електролізом розплаву хлориду натрію. Відбуваються такі процеси:
- на катоді виділяється натрій:
- 2 Na+ + 2 e− → 2 Na
- на аноді виділяється хлор (як побічний продукт):
- 2 Cl− − 2 e− → Cl2
- сумарна реакція:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Вана електролізеру складається зі сталевого кожуха з футеровкою, графітового аноду та кільцевого залізного катоду. Між катодом та анодом розташовано сітчасту діафрагму. Для зниження температури плавлення NaCl (800 °C), електролітом є не чистий хлорид натрію, а його суміш із хлоридом кальцію CaCl2 (40:60) із температурою плавлення 580 °C. Металевий натрій, що збирається у верхній частині катодного простору, містить до 5% домішку кальцію, але останній згодом майже повністю відділяється, оскільки його розчинність у рідкому натрії за температури його плавлення (371 °C) становить лише 0,01 %. Із витрачанням NaCl його постійно додають до ванни. Витрати електроенергії складають приблизно 15 кВт×год на 1 кг натрію[31].
Отримання соляної кислоти та сульфату натрію[ред. | ред. код]
Серед багатьох промислових методів отримання соляної кислоти, тобто розчину хлороводню (HCl) у воді, застосовується реакція обміну між хлоридом натрію та сірчаною кислотою:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Перша реакція відбувається значною мірою вже за звичайних умов, а за слабкого нагрівання йде майже до кінця. Друга відбувається лише за високих температур. Процес здійснюється в спеціальних механізованих печах великої потужності. Хлороводень, що виділяється, знепилюють, охолоджують та поглинають водою з утворенням соляної кислоти. Як побічний продукт утворюється сульфат натрію Na2SO4[32][33].
Цей метод застосовується також для отримання хлороводню в лабораторних умовах.
Фізичні та фізико-хімічні властивості[ред. | ред. код]
ГДЗ. Відповіді (сторінка 15) до робочого зошита «Хімія 7 клас» М.М.Савчин » Допомога учням
ГДЗ. Відповіді (сторінка 15) до робочого зошита «Хімія 7 клас» М.М.Савчин » Допомога учнямЗавантаження. Зачекайте, будь-ласка…
Лабораторні досліди. Ознайомлення з фізичними властивостями речовин
Виконайте запропоновані вам завдання, дотримуючись правил безпеки під час роботи у хімічному кабінеті.
Завдання 1. Розгляньте видані вам речовини з написами: I варіант — кухонна сіль, порошок сірки, мідні ошурки;
II варіант — порошок заліза, розтерта крейда, цукор-пісок. Впишіть у таблицю агрегатний стан і фізичні властивості кожної з них.
І варіант
| Фізичні властивості | Кухонна сіль | Сірка | Мідь |
| 1. Агрегатний стан | твердий | твердий | твердий |
| 2. Колір | білий | жовтий | червонуватий |
| 3. Блиск |
скляний |
відсутній | металічний |
| 4. Смак | солона | відсутній | відсутній |
|
5. Густина (більша чи менша за 1 г/см3) |
більша | більша | більша |
| б. Розчинність у воді | розчиняється | не розчиняється | не розчиняється |
| 7. Теплопровідність | ні | ні | так |
| 8. Електропровідність | ні | ні | так |
II варіант
| Фізичні властивості | Залізо | Крейда | Цукор |
| 1. Агрегатний стан | твердий | твердий | твердий |
| 2. Колір | сріблясто-сірий | білий | білий |
| 3. Блиск | металічний | відсутній |
скляний |
| 4. Смак | відсутній | відсутній | солодкий |
|
5. Густина (більша чи менша за 1 г/см3) |
більша | більша | більша |
| б. Розчинність у воді | не розчиняється | не розчиняється | розчиняється |
| 7. Теплопровідність | так | ні | ні |
| 8. Електропровідність | так | ні | ні |
Завдання 2. Порівняйте, чим подібні між собою: I варіант — сірка, крейда; II варіант — кухонна сіль, цукор. Дані запишіть у таблицю.
І варіант
| Назви речовин | Подібні фізичні властивості |
| Сірка і крейда | 1. Тверді |
| 2. Не розчиняються у воді. | |
| 3. Відсутній блиск. | |
| 4. Нетеплопровідні. | |
| 5. Неелектропровідні. |
II варіант
| Назви речовин | Подібні фізичні властивості |
| Кухонна сіль і цукор | 1. Білого кольору. |
| 2. Розчиняються у воді. | |
| 3. Мають кристалічну будову. | |
| 4. Нетеплопровідні. | |
| 5. Неелектропровідні. | |
| 6. Тверді. |
Завдання 3. Виявіть властивості, за якими відрізняються: І варіант — вода і олія; II варіант — порошки заліза і сірки. Дані запишіть у таблицю.
І варіант
| Назви речовин | Відмінні фізичні властивості |
| Вода і олія |
1. Колір. |
| 2. Смак. | |
| 3. Запах. | |
|
4. Олія не розчиняється у воді, вода — розчинник. |
|
| 5. Густина. |
II варіант
| Назви речовин | Відмінні фізичні властивості |
| Порошок заліза і сірки | 1. Колір. |
|
2. Густина. |
|
|
3. Залізо притягується магнітом, а сірка — ні. |
|
|
4. Теплопровідність: залізо — теплопровідне, а сірка — нетеплопровідна. |
|
|
5. Електропровідність: залізо — електропровідне, а сірка — неелектропровідна. |
Завдання 4. Напишіть характерні ознаки, за якими можна розпізнати: І варіант — оцет; II варіант — олію.
І варіант ІІ варіант
За запахом. За кольором, за запахом.
§ 27. Густина речовини » Народна Освіта
У першій половині XX ст. навчилися видобувати порівняно дешевий алюміній. Його назвали крилатим металом. За однакових об’ємів зі сталлю алюміній та його сплави мають майже втричі меншу масу. Відповідно конструкції, виготовлені з алюмінієвих сплавів, наприклад крила літака та обшивка фюзеляжу, значно легші. Якщо маси двох катерів — сталевого та з алюмінієвих сплавів однакові, то у другого буде більший об’єм. На його борту може розміщуватися більше пасажирів і вантажів. Нині в літакобудуванні, космічній техніці та суднобудуванні широко використовують вуглепластикові матеріали. У вуглепластика велика міцність, проте він легший за алюміній (за умови їх однакових об’ємів).
Тіла однакового об’єму, виготовлені з різних речовин, зображено на мал. 3.18, а, а тіла, виготовлені з тих самих речовин, але однакової маси, — на мал. 3.18, б.
Очевидно, що тіла, виготовлені з однієї й тієї ж речовини, об’єми яких розрізняються у два, три, чотири рази, у стільки
само разів розрізнятимуться за масою. Це означає, що відношення маси однорідної речовини до її об’єму — величина стала для будь-яких об’ємів і мас цієї речовини.
Фізичну величина, що чисельно дорівнює відношенню маси однорідної речовини до її об’єму, називають густиною цієї речовини.
У фізиці густину позначають грецькою літерою р (ро). Оскільки масу позначають літерою т, а об’єм — літерою V, то
можна записати:
Густина речовини чисельно дорівнює масі речовини в одиниці об’єму.
У СІ одиницею маси є 1 кг, об’єму — 1 м3, відповідно, одиницею густини є кілограм на кубічний метр —
На практиці часто користуються й іншими одиницями гус
тини, зокрема
Тоді
Задача 1. Визначити густину бензину марки А-95, що міститься в цистерні, якщо відомо, що його маса 36 т, а об’єм 50 м3.
Пригадайте: тіла складаються з молекул, маси яких дуже малі. Тому маса тіла визначається сумою мас усіх молекул, з яких воно складається.
Густина тіла чисельно дорівнює масі одиниці об’єму тіла, отже, дорівнює сумі мас молекул, які містяться в одиниці об’єму його речовини.
Густина різних речовин неоднакова. Знаючи густину тіла, можна з’ясувати, з якої речовини його було виготовлено. Значення густин різних речовин визначають дослідним шляхом, крім того, їх можна знайти в довідниках. Нижче у табл. 3.1 — 3.3 наведено приклади густини деяких речовин, що перебувають у твердому, рідкому та газоподібному станах.
Таблиця 3.1. Густини деяких речовин у твердому стані
Таблиця 3.2. Густини деяких речовин у рідкому стані
Таблиця 3.3. Густини газів за температури 0 °С і тиску 760 мм рт. ст.
Знаючи об’єм і густину речовини тіла, можна легко визначити його масу.
Задача 2. З граніту виготовили колону об’ємом 6 м3. Яка маса цієї колони?
В умові задачі є лише значення об’єму колони і вказівка на те, що її виготовлено з граніту. Згідно з відповідною таблицею
густина граніту становить
Те, що
Кухонна сіль — Вікіпедія
Харчова́ кухо́нна сіль — це речовина у вигляді кристаликів, яка містить 93-99 % хлористого натрію і домішки солей кальцію, магнію, калію, які надають їй гігроскопічності, жорсткості і гіркуватого присмаку.[1][2] Чим менше в солі цих домішок, тим вища її якість.
Сіль є кристалічним сипким продуктом без запаху (окрім випадку йодованої солі) з солоним смаком без присмаку, в якому не допускається присутність сторонніх домішок, що не пов’язані з методом добуванні солі. Колір екстра та вищого ґатунків — білий, однак для першого та другого допускаються сірий, жовтуватий, рожевий та голубуватий відтінки в залежності від походження солі.[2]
Як сировина для одержання кухонної солі (хлористого натрію) використовується кам’яна сіль (67,9%), озерна осадова сіль (31,8%) і в невеликих об’ємах натуральні розсоли. За призначенням і споживанням розрізняють харчову (50%) загального виробництва, технічну (40%) і кормову (10%) сіль.
= Види кухонної солі = За місцем розташування покладів і способом видобутку розрізняють сіль самосадну (озерну), садну (з морської води), кам’яну (з надр землі) і виварну (з підземних розчинів).[1][2] Харчову кухонну сіль кам’яну, самосадну і садну випускають меленою і сіяною. Для профілактики захворювань щитоподібної залози сіль випускають з додаванням йодату калію або йодиду калію (йодована сіль).
 Сіль кухонна виварна «Екстра»
Сіль кухонна виварна «Екстра»Сорти[ред. | ред. код]
За якістю сіль поділяють на ґатунки: екстра, вищий, І і II. Масова частка хлористого натрію у ґатунках, %: екстра — не менш ніж 99,7; вищий — 98,4; І — 97,7; II — 97,0.[3] Масова частка вологи у виварній солі сорту екстра — 0,1 %, у вищому сорті — 0,7 %.[3] Допускаються добавки йодиду калію (йодистого калію), йодату калію (йоднуватокислиго калій), флуориду калію та флуориду натрію (фторидів калію та натрію). При цьому масова частка йоду має становити (40,0 ± 15,0)·10−4 %, флуору (25,0 ± 5,0)·10−3 %.

Харчову кухонну сіль кам’яну, самосадну і садну випускають меленою і сіяною.
За розміром зерен мелену сіль поділяють на номери: 0, 1,2, 3. Чим більший номер, тим більші зерна солі.
Йодована сіль[ред. | ред. код]
Для профілактики дефіциту йоду, який відчуває близько 70 % населення України, сіль випускають з додаванням йодату калію або, рідше, йодиду калію. Таку сіль називають йодованою. За старим стандартом йодована сіль повинна містити 25 г йодиду калію на 1 т солі[1] і зберігатися не більше 6 міс.[1] За новим українським нормативом (40±15 мкг/г йодату калію) йодована сіль не повинна мати жодного запаху, не втрачати властивостей при кип’ятінні і повинна бути здатною запобігти проблемам, пов’язаним з йододефіцитом (особливо розумовій відсталості у дітей).
Добова фізіологічно обґрунтована норма споживання солі для людини 4-6 грамів, однак традиційно в багатьох країнах вона значно вища — близько 10-20 грамів. Оскільки в Україні солиться більшість таких продуктів, як ковбаса, сир, хліб тощо, фактично для того, щоб залишитися в межах норми споживання, взагалі не можна солити їжу.
Значення в харчуванні[ред. | ред. код]
Сіль використовують як речовину для консервування харчових продуктів.[2] Але надмірне вживання солі сприяє підвищенню кров’яного тиску, хворобам нирок та серця.
Історія. Первинні технології виробництва солі[ред. | ред. код]
Найімовірніше, що перше знайомство людини з сіллю відбулося на узбережжі теплих морів, де на мілководді морська вода інтенсивно випарювалась під дією високих температур і вітру, а в осаді накопичувалась сіль. За образним виразом Піфагора, «сіль була народжена найшляхетнішими батьками — сонцем і морем».
В Російській імперії ще в XVII ст. більшість пряностей, таких як оцет і сіль, в народі почали вживати не в процесі приготування їжі, а ставити на стіл і використовувати вже під час прийому їжі через їх дороговизну[4].
Технологія виробництва солі полягала в тому, що соляну ропу витягали кінським приводом із шахт, що звалися «криниці» або «вікна» і були досить глибокими — 60—90 м. Витягнуту суровицю виливали в спеціальний резервуар — творило, звідки вона через отвори стікала в нижній резервуар — кадіб, а з останнього по системі ринв подавалася у дерев’яні вежі. Тут її розливали по великих нанвах і черінях — сковородах з площею від 5 до 30—40 м, на яких вона виварювалася.
Українське слово «сіль» походить від латинської назви солі «sal». Прикметно, що латинське слово «salarium» — соляна норма, яку видавали в Стародавньому Римі, перейшла у «salar» — заробітна плата, що свідчить про використання солі як торговельного еквівалента.
Запаси, видобування і виробництво солі в Україні[ред. | ред. код]
Квітка з кам′яної солі. Виконана на стінці виробки у соляній шахті. м. Соледар Кристали кам′яної солі з соляної копальні «Величка»
Кристали кам′яної солі з соляної копальні «Величка»Україна має великі та унікальні за якістю поклади сировини для кухонної солі. За хімічною чистотою їх можна вважати найкращими у світі. Основні запаси розташовані на території Донбасу, Придніпровської низовини, Прикарпаття та Закарпаття, а також у Криму.
Крім кам’яної солі є родовища, представлені ропою озер, а також пов’язані із зосередженням підземних розсолів. Запаси кам’яної солі та природних розсолів в Україні досить значні і при сучасному рівні видобутку практично невичерпні (їх запаси становлять понад 9 млрд т по категорії А + В + С). Найбільші запаси кам’яної солі зосереджені на Донбасі, де у потужних пластах на незначних глибинах (Слов’янськ, Соледар, Бахмут) залягають ресурси дуже високої якості.
Загальна потужність шару солі в Донбасі коливається від 100 до 200 м. Тут видобувається найбільша кількість кам’яної солі в Європі. В обмежених обсягах виварну сіль видобувають у Дрогобичі, Калуші, Долині (Прикарпаття).
Родовища кам’яної солі виявлено також на Лівобережжі — в межах Дніпровсько-Донецької западини (біля Лубнів, на горі Золотусі біля Ромен).
Цінні продукти одержують із вод Сакського озера та Перекопської групи соляних озер. Значні запаси солі мають інші розташовані на півдні України озера і лимани.
Високоякісні кам’яні солі є важливою статтею експорту України.
Найбільшими в СРСР соляними озерами, на дні яких лежать величезні запаси солі і на яких проводився видобуток солі, були Ельтон і Баскунчак, які розташовані на північ від Каспійського моря.[5]
- Існує відома крилата фраза «Пуд солі з’їсти» (спілкуватися, прожити з людиною пліч-о-пліч тривалий час). За оцінками фізіологів, сучасна людина споживає в рік близько п’яти кілограмів солі, отже пуд солі удвох можна з’їсти за півтора-два роки. Раніше цей час через дорожнечу продукту був значно більший.
- Звичайна харчова сіль в великих кількостях є отрутою — летальна доза в 100 разів перевищує добову норму споживання і становить 3 грами на 1 кілограм маси тіла, тобто для людини вагою 80 кг смертельною є доза в 240 грамів солі.
- Навесні 1648 року в Москві стався Соляний бунт, викликаний, серед іншого, непомірно високим податком на сіль. Тисячоліття тому сіль була настільки дорогою, що через неї влаштовували війни. Зараз сіль є найдешевшою з усіх відомих харчових добавок, якщо не брати до уваги воду.
- Продавана в магазинах сіль складається з NaCl приблизно на 97 %, інша частка припадає на різні добавки. Найчастіше додають йодиди і карбонати, в останні роки все частіше додають фториди. Додавання фторидів практикують для профілактики зубних захворювань. З 1950-х років додавати фторид до солі стали в Швейцарії, і завдяки позитивним результатам в боротьбі з карієсом в 1980-х роках фторид стали додавати в сіль у Франції і в Німеччині. До 60 % продаваної солі в Німеччині і до 80 % у Швейцарії містять фториди.
- Іноді в кухонну сіль додають інші допоміжні речовини, наприклад ферроціанід калію (E536 в європейській системі кодування харчових добавок; неотруйна комплексна сіль) як агент, що запобігає злипанню.
- У США продаються різні продукти, що рекламуються як «сіль з пониженим вмістом натрію» (англ. low sodium salt). Зменшення вмісту натрію досягається за рахунок зниження кількості кухонної солі на одиницю об’єму. Один з варіантів виробництва — часткове заміщення хлориду натрію іншими хімічними сполуками, такими як хлорид калію або магнію. Інший варіант — зміна вихідної кристалічної структури солі («сніжинки» замість характерних призм), в результаті чого її об’ємна щільність зменшується (0,76 г/см³ проти 1,24 г/см³ у «звичайній» солі), і одна ложка продукту містить на третину менше натрію (та й солі як такої).
- Відомо, що ідучи з тайгового притулку, мисливці неодмінно залишають сірники і сіль для випадкових мандрівників.
- На Русі здавна було прийнято в Страсного четверга готувати так звану «четвергову сіль» — кам’яну сіль змішували з квасною гущею або м’якушкою житнього хліба і пересмажували на сковороді, після чого товкли в ступі. Четвергову сіль вживали з крашанками та деякими іншими стравами.
- Ворожіння за допомогою солі іменується аломантією.
- ↑ а б в г Страви, закуски, напої, десерти барів і буфетів: Підручник / В. С. Доцяк, Л. О. Стременко, І. В. Стременко. — К.: Вища шк., 1998. — 519с. ISBN 5-11-004724-3 (с.: 213—214)
- ↑ а б в г Згідно з ДСТУ 3583-97, що чинний з 1 липня 1998 року на території України
- ↑ а б Зайцева Г. Т., Горпинко Т. М. Технологія виготовлення борошняних кондитерських виробів: Підруч. для проф.-техн. навч. закладів. — К.: Вікторія, 2002. — 400 с. ISBN 966-95870-6-9(с.: 72-73)
- ↑ Похлебкин В. В. Национальные кухни наших народов (Основные кулинарные направления, их история и особености. Рецептура).—М.: Пищевая пром-сть, 1980. — 304 с.
- ↑ М. М. Скаткін // Природознавство: підручник для 4 класу. — К.: «Радянська школа», 1967. с.256 (сторінка:60)
фізичні властивості, поширеність та застосування » Народна Освіта
Пригадайте, як за формулою відрізнити кислоти (за § 28) та властивості твердих речовин з йонними кристалічними ґратками (за § 23).
Фізичні властивості солей
У солях, завдяки їхньому складу, існує йонний зв’язок, а всі солі мають йонні кристалічні ґратки. І саме тому всі солі за звичайних умов є твердими кристалічними речовинами з високими температурами плавлення (Додаток 1). Солі відрізняються за розчинністю: одні солі добре розчинні у воді, інші — майже не розчиняються. Щоб дізнатися про розчинність тієї чи іншої солі, можна скористатися таблицею розчинності речовин у воді (див. форзац).
Залежно від складу солі можуть бути різного кольору. Багато солей безбарвні, але деякі мають характерне забарвлення. Наприклад, сполуки Феруму(ІІ) забарвлені в кольори зелених відтінків (мал. 37.1а), Феруму(ПІ) — жовтих або червоних (мал. 37.16), a XpoMy(VI) — жовтих або жовтогарячих (мал. 37.їв).
У солей — йонні кристалічні ґратки, тому вони не мають запаху. Але деякі солі завдяки певним хімічним реакціям іноді пахнуть. Так, алюміній сульфід має запах сірководню (гідроген сульфіду), а розчини солей сульфітної кислоти мають характерний запах сірчистого газу. 5
ПОШИРЕНІСТЬ У ПРИРОДІ ТА ЗАСТОСУВАННЯ СОЛЕЙ
Натрій хлорид NaCl (кухонна сіль) трапляється у вигляді мінералу галіту, а також міститься у природних солоних водах. Є сировиною для добування хлору, хлоридної кислоти, натрій гідроксиду та питної соди. Незамінний при готуванні їжі. Україна має величезні поклади натрій хлорид»’, які вважаються невичерпними.
Натрій карбонат Na0CO3 (кальцинована сода) добувають з природного мінералу Na2CO3 · IOH0O (кристалічної соди). Сода є ефективним засобом для чищення посуду. Натрій карбонат використовують для виготовлення скла, мила, пральних порошків, емалей тощо.
Калій карбонат K0CO3 (поташ) використовують для добування мінеральних добрив, виготовлення кришталю та оптичного скла, протиоже-ледних сумішей для обробки злітно-посадкових смуг.
Натрій сульфат Na0SO4 · IOH0O (глауберова сіль, мірабіліт) — цінний реактив для лабораторної практики, використовується для виготовлення скла. Має проносну дію, що є характерною для всіх розчинних солей сульфатної кислоти.
Широко застосовуються солі нітратної кислоти — нітрати (селітри). Нітрати Калію KNOij, Натрію NaNO3 та Кальцію Ca(NO3)0 є складовими пороху, використовуються для добування кисню в лабораторії. У сільському господарстві застосовуються як азотні добрива.
Ферум(ІІ) сульфід FeS у природі трапляється у вигляді мінералу марказиту. В Україні в значних кількостях трапляється в Криворізькому залізорудному басейні. Є цінною сировиною для добування заліза й сульфатної гсислоти.
Арсен(ІІІ) сульфід As2S3 (аурипігмент) — цінний мінерал для виготовлення золотої та жовтої фарб, які особливо поширені в іконописі. Надзвичайно отруйний. Є сировиною для добування арсену.
Цинк сульфід ZnS (цинкова обманка) є сировиною для добування цинку. Із сфалериту виготовляють цинкові білила, а також фарби, що світяться в темряві.
Калій перманганат KMnO4 (марганцівка) використовується як дезінфекційний засіб та як засіб для промивання шлунка при отруєннях. Калій перманганат є також цінним реактивом у лабораторній практиці.
Аргентум(І) нітрат AgNO3 (ляпіс) здавна використовували для виготовлення дзеркал. Солі Аргентуму іноді використовують розганяння хмар, або, навпаки, для викликання дощу. Якщо з літака розпилити пил аргентум йодиду або аргентум броміду, то він конденсує водяну пару, що випадає у вигляді дощу.
Поширеними в природі є солі Кальцію, вони є складовою багатьох порід і мінералів. Кальцій сульфат у вигляді мінералу гіпсу використовують у будівництві для виготовлення різних сумішей та в медицині для фіксації зламаних кінцівок.
Найпоширеніша сіль Кальцію — це карбонат CaCO3. Він утворює вапняк, крейду, а також мінерали кальцит
§ 29. Солі. Їхні фізичні й хімічні властивості » Народна Освіта
— А ти знаєш, звідки походить слово «сіль»?
— Ні. Я знаю, що сіль у нас стоїть завжди на столі.
— Саме ця звичайна кухонна сіль NaCl і дала назву всім солям. Вважають, що слово «сіль* походить від слова «сонце», під яким випарювали морську сіль для одержання дорогоцінного NaCl.
— Так яка ж вона дорогоцінна! У будь-якому магазині купити можна, і коштує недорого.
— Це зараз. В історії людства були й «соляні» бунти, і «соляні» війни — все тому, що жити без солі ми, люди, не можемо. Вона нам необхідна.
Тому ще у ХУІП столітті вважали багатою людиною того, у кого була сіль.
— Та?:… Тепер зрозуміло, чому чумаки сіль возили.
СКЛАД І НАЗВИ СОЛЕЙ
Як ми вже знаємо, солями називають складні речовини, в яких йони металу пов’язані з кислотними залишками. Такі солі називають середніми.
Якщо ви забули, як складати формули солей і називати їх, поверніться до §20.
Будь-яку сіль можна представити як продукт заміщення йонів Гідрогену в кислоті на йони металу.
Винятком є солі амонію, в яких із кислотними залишками пов’язані не йони металу, а йони амонію NH4. Ці солі ми будемо вивчати в 10 класі.
Крім хімічних назв у солей збереглися й традиційні, історично сформовані назви. їх іще називають тривіальними. У таблиці 15 наведено назви деяких солей згідно з прийнятою сучасною номенклатурою та традиційні (тривіальні) назви солей.
Таблиця 15
Сучасні н традиційні назви деяких солей
|
Сіль |
Сучасна назва |
Традиційна назва |
|
Na2CO3 |
Натрій карбонат |
Кальцинована сода |
|
NaHCO3 |
Натрій гідрогенкарбонат |
Питна сода |
|
K2CO3 |
Калій карбонат |
Поташ |
|
Na2SO1 |
Натрій сульфат |
Глауберова сіль |
|
MgSO4 |
Магній сульфат |
Англійська сіль, гірка сіль |
|
KClO3 |
Калій хлорат |
Бертолетова сіль |
|
KNO3 |
Калій нітрат |
Калійна селітра |
|
NaNO3 |
Натрій нітрат |
Натрієва селітра |
|
CaCO3 |
Кальцій карбонат |
Крейда, мармур, вапняк |
|
CaSO4 |
Кальцій сульфат |
Гіпс, алебастр |
Є кілька речовин, до назви яких входить слово «сода». У жодному разі не можна плутати кальциновану’ соду Na2CO3 і питну соду NaHCO3. Якщо ненавмисно використати в їжу
кальциновану соду замість питної соди, можна одержати важкий хімічний опік. А каустична сода — зовсім не сіль, це технічна назва натрій гідроксиду NaOH. Якщо звичайною содою можна почистити раковину або посуд, то каустичну соду ні за яких умов брати в руки або використовувати в побуті не можна! Ці прості знання можуть знадобитися у житті — ніколи не знаєш, які речовини нам трапляться.
ПРАВИЛА РОБОТИ ІЗ СОЛЯМИ
Сухі солі для дослідів треба брати в невеликих кількостях, насипати спеціальною ложкою або шпателем. У жодному разі не пробувати солі на смак! Серед них багато отруйних. Є й вибухонебезпечні солі. Тому працювати з ними потрібно обережно.
|
CuSO4— токсична, фізіологічно небезпечна речовина |
|
|
BaCl2 токсична, фізіологічно небезпечна речовина |
|
|
KMnO1 токсична, фізіологічно небезпечна речовина |
|
Вогненебезпечно! |
|
|
Вибухонебезпечно! |
|
|
Обережно, отруйна речовина! |
ФІЗИЧНІ ВЛАСТИВОСТІ СОЛЕЙ
Всі солі — тверді речовини, в основному йонної будови, але фізичні властивості (температури кипіння, плавлення, густини, твердість) у них різні. Як правило, це
Густина речовини
Навчальна. Формування поняття густини, як величини, що характеризує речовину; одиниць її вимірювання; формування вміння порівнювати густини різних речовин; формування навичок розрахунку густини, маси й об’єму тіла.
Розвивальна. Розвивати логічне мислення учнів; удосконалити вміння самостійно робити висновки із спостережуваних дослідів; показати учням практичну значущість набутих знань та розуміння важливості знань про густину для вирішення практичних задач.
Виховна. Виховувати культуру оформлення розрахункових задач.
Тип уроку: урок вивчення нового матеріалу.
Обладнання: навчальна презентація, комп’ютер. Терези, тіла рівної маси та об’єму, тіла різної маси та об’єму, два яйця (свіже і несвіже), дві посудини з водою, склянка з солоною водою, ареометр.
«Людина не має крил і за відношенням ваги свого тіла до ваги м’язів вона у 72 рази слабша за птаха; людина майже у 800 разів важча за повітря… Але я думаю, що людина полетить, спираючись не на силу своїх мускулів, а на силу свого розуму».
(Микола Жуковський, видатний науковець, творець аеродинаміки)
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
Вітаю всіх! Кожен урок для нас – це нові знання, несподіванки, відкриття. Сьогодні ми знову розширимо коло наших знань, які обов’язково стануть нам у пригоді, знадобляться у нашому повсякденному житті чи в майбутній професії.
ЕПІГРАФ – обговорення змісту та ідеї епіграфа уроку. СЛАЙД 1
СЛАЙД 2. Три шляхи ведуть до знань:
II. ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
СЛАЙД 3. 1. Наведіть приклади, які свідчать про те, що для зміни швидкості руху тіла потрібен час.
2. Що таке інерція?
3. Приблизно половина дорожньо-транспортних пригод відбувається з вини пішоходів. Які міркування ви навели б своїм товаришам, щоб переконати їх завжди дотримуватися правил дорожнього руху?
СЛАЙД 4. 4. Дайте визначення інертності.
5. Маса: означення, позначення, одиниці вимірювання, прилад для вимірювання.
6. Як пов’язані відношення мас двох тіл, що взаємодіють з відношенням змін швидкостей їх рухів?
СЛАЙД 5. 7. Згадайте про чищення килимів: вибиванням пилу та витрушуванням різкими змахами. На якій властивості тіл базуються ці два способи? Чим вони різняться з точки зору фізики?
8. Що більше: кілограм заліза чи кілограм вати?
9. Як можна виміряти масу тіла?
СЛАЙД 6. Перевіримо роботу учнів: Вправа «Хто уважніший?» (завдання на картках – два учні виконують біля дошки, а потім із слайдів перевіряє клас)
(кожен термін — 1 бал, якщо дасть визначення терміну або обґрунтування — + ще 1 бал)
Представлення і захист виконання експериментального завдання «Терези власноруч».
III. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ ТА ВМІНЬ
3. У чому полягає відмінність між речовиною і фізичним тілом?
5. Яку властивість тіла характеризує маса?
6. Як можна виміряти масу тіла?
а) 5,3 т=5300кг; б) 0,25т=250кг; в) 4700 г=4,7кг; г) 150 г=0,15кг.
а) 5 кг 230 г=5230г; б) 270 г 840 мг=270,84г; в) 56 г 91 мг=56,091г.
IV. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ. ОГОЛОШЕННЯ ТЕМИ, МЕТИ УРОКУ СЛАЙД 7. Створення проблемної ситуації.
Так як жодний із запропонованих способів для визначення величезних мас не підходить, спробуємо розв’язати задачу іншим способом. СЛАЙД 8.
Доречі мало хто з вас знає, що повітря, яке знаходиться навколо нас має велику масу. Скажімо повітря в супермаркеті який наповнений людьми має масу до 5000 кг. А ось свинцевий тягарець для вудки може мати масу в 10-15 г.
Тому такі твердження є неправильними. З’ясуємо в чому тут річ.
V. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Здійснимо деякі вимірювання та виконаємо розрахунки (робота з рис.16.1 на стор.112) – робота в групах
Наше завдання — знайти відношення маси кожного бруска до його об’єму, тобто визначити масу свинцю об’ємом 1 см3. (Учні виконують вимірювання та розрахунки.)
V1=2х2х1=4 (см3) | = |
m1=45,2 г | |
V2=2х2,5х2=10 (см3) | |
m1= 113 г | |
Це характеристика речовини. |
СЛАЙД 14. Густина речовини — це фізична величина, яка характеризує речовину і дорівнює відношенню маси суцільного тіла, виготовленого з цієї речовини, до об’єму цього тіла.
Одиниця густини в СІ — кілограм на метр кубічний:
СЛАЙД 15.
СЛАЙД 16. Що означає: густина речовини дорівнює ? (Це означає, що 1 м3 даної речовини має масу 700 кг.)
Проводиться робота з таблицею густини: учні визначають речовини з найменшою та найбільшою густиною.
Робота з підручником
Розгляньте таблицю на ст..249.
Знайдіть у таблиці густину бетону. Що означає це число? 2200кг/м3=2,2г/см3
Котра з твердих речовин має найбільшу густину? (Осмій – 22500кг/м3)Найменшу? (корок – 240кг/м3)
СЛАЙД 17. Порівняйте густину води і льоду. Що це означає? (1000кг/м3 і 900кг/м3)
Таблиця густин дає змогу визначити речовину, з якої тіло виготовлено, без проведення хімічного аналізу. Достатньо виміряти масу й об’єм тіла та обчислити густину.
А тепер і ви авіаконструктори. Для будівництва літаків потрібен метал досить міцний, легкий, який не піддається корозії, порівняно дешевий. Визначте за допомогою таблиці густин речовину, яку треба використати для будівництва літаків.
(Учні визначають, що це алюміній.)
ЦІКАВА СТОРІНКА (учні читають ланцюжком) СЛАЙД 18
У першій половині XX ст. навчилися видобувати порівняно дешевий алюміній — дюралюміній. Він краще всього задовольняє всі умови металоконструкцій для літаків. Це сплав алюмінію (83 частини алюмінію), 5 частин міді , 1 частина марганцю і 1 частина магнію. Його назвали крилатим металом.
За однакових об’ємів зі сталлю алюміній та його сплави мають майже втричі меншу масу. Відповідно конструкції, виготовлені з алюмінієвих сплавів, наприклад крила літака та обшивка фюзеляжу, значно легші. Якщо маси двох катерів — сталевого та з алюмінієвих сплавів однакові, то у другого буде більший об’єм. На його борту може розміщуватися більше пасажирів і вантажів.
Нині в літакобудуванні, космічній техніці та суднобудуванні широко використовують вуглепластикові матеріали. У вуглепластика велика міцність, проте він легший за алюміній (за умови їх однакових об’ємів).
СЛАЙД 19. Український державний авіабудівний концерн «Антонов» презентував новий вантажний літак АН-132D. При урочистому викочуванні з ангару був присутній і президент Петро Порошенко.
Цей літак зможе підіймати в небо 9,2 тонни вантажу. Літак має розмах крил 29,2 м при довжині 24,5 метра й висоті 8,8 метра.
«Ми впевнені, що у цього літака велике майбутнє. І я дякую за це свято і за цю перемогу всім авіабудівникам, всім нашим партнерам», – сказав Порошенко. Крім України у створенні вантажного АН-132D брали участь Канада, США, Велика Британія, Німеччина, Франція і Саудівська Аравія.
СЛАЙД 20-фізкультхвилинка; СЛАЙД 21. Чи залежить густина речовини від температури та агрегатного стану речовини?
Зі збільшенням температури збільшується і швидкість хаотичного руху частинок речовини. У результаті збільшується середня відстань між частинками, відповідно, збільшується й об’єм тіла. Тому густина речовини зменшується.
І навпаки, чим нижчою є температура речовини, тим менші міжмолекулярні проміжки, тобто меншим є об’єм речовини і більшою є її густина.
Зверніть увагу!
Густина речовин може бути дуже різною. Густина речовини залежить від температури, при підвищенні температури зазвичай густина знижується. Це пов’язано з термічним розширенням, коли при незмінній масі збільшується об’єм. СЛАЙД 22
Виведемо формули: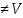

Необхідність врахування густини речовини при будівництві, створенні нових матеріалів, техніці.
Густину речовини враховують практично в усіх сферах науки, техніки й будівництва, під час створення нових матеріалів. Так, наприклад, матеріали для космічної техніки мають володіти такими характеристиками, як висока міцність і невелика густина.
СЛАЙД 23. Найгустіша речовина не знаходиться на Землі. Наприклад, в космосі щільність білого карлика Сіріуса В (зірка) настільки велика, що маса сірникової коробки з цієї речовини була б рівна 127 тоннам.
Звертаємо увагу учнів на те, що поняття «маса» стосується тіла, а поняття «густина» — речовини, з якої виготовлене тіло.
Це цікаво! СЛАЙД 24
Густина — один з головних показників, що визначає якість продукту і входить до показників нормованих нормативно-технічною документацією.
«Чому плаває чи тоне яйце?» (демонструється вказане явище). СЛАЙД 25
Свіжість курячих яєць можна перевірити по їх густині. При довгому збереженні частина рідини випаровується через пори в яєчній шкаралупі і замінюється повітрям. При тому ж об’ємі його густина зменшується і воно стає легшим. Свіже яйце тоне у воді, а не свіже спливає.
Демонстрація. Яйце у солоній воді спливає. Чому? Порівняйте густину чистої і солоної води. Використання цієї особливості у кораблебудуванні (річкові і морські судна).
СЛАЙД 26. Вимірювання густини твердих тіл є частіше за все непрямими: вимірюють масу та об’єм, а потім розраховують густину речовини.
Його опустиш в рідину,
будеш знати густину. (Ареометр)
Ареометр – це прилад у вигляді скляного поплавка із шкалою і вантажем (внизу), призначення якого виміряти густину рідин та сипучих тіл.
V. ЗАКРІПЛЕННЯ НОВИХ ЗНАНЬ ТА ВМІНЬ
Розв’язування задач СЛАЙД 27
Уявіть, що ви геологи і під час експедиції побачили якусь невідому вам речовину. Зовнішній вигляд не дає можливості здогадатися що це за речовина. Як бути? (Учні здогадуються, що необхідно експериментально визначити густину речовини і за таблицею густин визначити речовину. Наголошую на тому, що це грубий, орієнтовний спосіб визначення речовини).
1. Об’єм уламка металу 50 см3, а його маса 365 г. Знайдіть густину цієї речовини. Яка це речовина?
Дано: | Розв’язання Відповідь: — олово |
СЛАЙД 28. У Миколаєві на Чорноморському суднобудівному заводі триває будівництво нового корабля, на якому красуватиметься назва «Вінниця». Будівництво судна було розпочато у 2011 році. На даний момент корпус корабля готовий на 80%, технічна готовність всього судна – менше 20%. До 2018 року корабель має бути готовий. Проект створений миколаївським КП «Дослідно-проектний центр кораблебудування».
Як утримуються на воді військові крейсери, виготовлені зі сталі?
Якою повинна бути середня густина судна, щоб воно могло плавати на воді?
СЛАЙД 29. Айсберг в перекладі з німецької означає «льодяна гора». Айсберги – величезні льодяні брили, які відкололися від шельфового льоду і вільно плавають в океані. Відомо, що значно більша його частина знаходиться під водою (іноді майже 90% всього об’єму). 
Враховуючи величезні розміри айсбергів, можна тільки здогадуватися про його масу. Проте, знаючи параметри айсберга, можна її визначити.
Особливо важливо знати масу айсберга, коли постає питання про його транспортування (адже айсберг — це величезний запас прісної води). Транспортуванню підлягають айсберги масою 4-5 т, до 7 т. Зустрічаються айсберги значно більші.
Найбільший із зафіксованих спостерігачами айсберг мав площу поверхні 10000 км2 і висоту близько 50 м – це був так званий плоский айсберг. Визначте його масу, якщо густина айсберга становить 920кг/м3.
Дано: | m=1=46 | |
S=10000 км2=1 | ||
h=50м | m= | |
V=Sh | ||
m-? | m= | Відповідь: m= |
Це цікаво! СЛАЙД 30
Однією із ознак готовності варення є рівномірне розташування ягід у сиропі. Як це пояснити? (густина ягід і сиропу стає однаковою)
Задача СЛАЙД 31
Автомобіль БелАЗ–540, за місяць може перевезти 54 000м3 породи. Яка маса такого вантажу, якщо густина породи приблизно дорівнює 2,5103кг/м3 ? (Серійний випуск білоруського великовантажного самоскида БелАЗ-540 було розпочато в кінці 1965 року).
Дано: | m=54000=135 | |
V=54 000м3 | ||
2,5103кг/м3 | m= | |
m-? | Відповідь: m= |
Це цікаво! СЛАЙД 32
Для організму людини крохмаль поряд з сахарозою служить основним постачальником вуглеводів — одного з найважливіших компонентів їжі.
Картопля належить до найважливіших сільськогосподарських культур. Вона має різнобічне використання. Це винятково важливий продукт харчування. Недарма її називають другим хлібом. Цінність картоплі визначається високими смаковими якостями та сприятливим для здоров’я людини хімічним складом.
Бульби в середньому містять 75-80% води і до 25% сухих речовин. Вміст крохмалю коливається від 14 до 25%. Чим вищий вміст крохмалю, тим кращий смак картоплі.
Щоб визначити процентний вміст крохмалю в картоплі, треба знати її густину.
Визначте кількість крохмалю в картоплі, користуючись даними таблиці.

Вправа «Я розумний?» СЛАЙД 33-41
Прилад доставили із Землі на Місяць. Як змінилася його маса?
Чи є правильним твердження: пластикова пляшка ємністю 1 л уміщує 1 кг рідини?
Чи правильно? Густина 1 м³ ртуті — 13600 кг/м³ , а густина 2 м³ ртуті — 27200 кг/м³?
Якщо від кавуна відкусити шматочок, то чи зміниться його густина?
Шматок пластиліну скачали в кульку. Які з фізичних величин, що характеризують кульку, змінилися – m, V, ?
Коли ми, збираючись у відпустку, набиваємо все новими й новими речами й без того вже повну валізу, які з фізичних величин ми змінюємо – m, V, ?
Чому густина людського тіла мало відрізняється від густини води?
Що має більшу густину: одна зернина чи жменя зерна?
Чи змогли б ви підняти корковий куб, довжина сторони якого дорівнює 1 м?
РОДИННА ЦІННІСТЬ
На столі перед геніальним сищиком лежало намисто. «Це родинна цінність, — з гордістю сказала господиня Шерлоку Холмсу, — їх я успадкувала від своєї матері, моїй мамі їх подарувала бабуся. А зробив їх хороший майстер так, що до цього часу залишається загадкою, яка із бурштинових (янтарних) намистинок зроблена з поліефірної смоли».
— Дрібниці, це визначити нескладно, — посміхаючись сказав Шерлок Холмс.
Як геніальний сищик хотів знайти пластмасову намистинку-підробку?
Відповідь. Треба порівняти густини цих бусинок.. Поліефірна (пластмасова) бусинка має більшу густину – 1,7-1,8 г/см3, а у янтаря 1,05-1,2 г/см3. Крім того, янтарь легше і швидше електризується, ніж пластмас.
Бесіда за питаннями
1. Чи всі тіла однакової маси мають однаковий об’єм?
2. Чи всі тіла однакового об’єму мають однакову масу?
3. Дайте визначення густини речовини.
4. Які вимірювання необхідно здійснити, щоб визначити густину речовини?
5. Які одиниці густини ви знаєте?
6. Чи залежить густина речовини від температури та агрегатного стану речовини? Якщо залежить, то як? Відповідь поясніть.
7. Як обчислити масу тіла за його густиною та об’ємом?
8. Як визначити об’єм тіла, знаючи його густину та масу?
VІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
вправа «Кошик» ЯКІ ЗНАННЯ ВИ ВЗЯЛИ З УРОКУ СЬОГОДНІ?
VIІ. Домашнє завдання СЛАЙД 42
Вивчити § 16, Вправа № 16 (3-6)-усно
За бажанням:
Світ тварин є надзвичайно різноманітним. Виберіть групу тварин (наприклад, птахи, риби, комахи, ссавці тощо) і, скориставшись додатковими джерелами інформації, підготуйте повідомлення про «рекордсменів» за масою серед вибраних груп.
СЛАЙД 43. 7 класу:
Здавалося, все просто у цім світі.
І все давно відкрито на Землі.
Але законів невідкритих таємниці
Ми кожен раз чекаємо нові.
І кожен раз те, що було так просто
Показує таємну свою суть
І може ще колись в далекий космос
Думки, надії, мрії понесуть.
Вам, молодим нові закони відкривати
І не обмежує хай думку Інтернет
Ви можете усе відкрити, все пізнати
І вам відкритий цілий світ.
КАРТКИ
Випишіть знайдені вами фізичні терміни:
(кожен термін — 1 бал, якщо дасть визначення терміну або обґрунтування — + ще 1 бал)
Прсмитоінерціяморттметрстбтшра Прмттрваттпомасалтлонмцявполеримавпа мсфкрепрнполюсрманітсінертністьядноррмрпавр иьплакілограмвленняиелиошвидкістьуляричкипрограпао боиоптикалтрнульватідтерезит |
Випишіть знайдені вами фізичні терміни: (кожен термін — 1 бал, якщо дасть визначення терміну або обґрунтування — + ще 1 бал) |
Кролеупромкитрддометрпаратвольтол рнаотермаиграмтдалоштуинавашпарлит нарасилавкхвилинапатпрнугаениенатомбо лазпунбукнориречовинакотілондаціяромпаравтзерка лотеплопечакедриоб’ємнпрстра |
Подайте в основних одиницях маси такі маси тіл:
а) 5,3 т б) 0,25т в) 4700 г г) 150 г
Подайте в грамах такі маси тіл:
а) 5 кг 230 г б) 270 г 840 мг в) 56 г 91 мг