Пероксид водорода — Википедия
Перокси́д водоро́да (пе́рекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Молекула пероксида водорода имеет следующее строение:
Структура молекулы пероксида водородаВследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать в роли как окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:
- Na2SO3+h3O2→Na2SO4+h3O;{\displaystyle {\mathsf {Na_{2}SO_{3}+H_{2}O_{2}\rightarrow Na_{2}SO_{4}+H_{2}O}};}
- Mn(OH)2+h3O2→MnO(OH)2+h3O.{\displaystyle {\mathsf {Mn(OH)_{2}+H_{2}O_{2}\rightarrow MnO(OH)_{2}+H_{2}O}}.}
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода:
- 2AgNO3+h3O2→2Ag+2O+2HNO3.{\displaystyle {\mathsf {2AgNO_{3}+H_{2}O_{2}\rightarrow 2Ag+2O+2HNO_{3}}}.}
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H
2O и O2. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:- 2h3O2→2h3O+O2.{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}}}.}
В присутствии катализаторов разложения в среде кислорода может появляться озон:
- h3O2+O2→h3O+O3↑.{\displaystyle {\mathsf {H_{2}O_{2}+O_{2}\rightarrow H_{2}O+O_{3}\uparrow }}.}
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
- h3O2⇄H++HO2−; HO2−⇄H++O22−.{\displaystyle {\mathsf {H_{2}O_{2}\rightleftarrows H^{+}+HO_{2}^{-};~~~~~~HO_{2}^{-}\rightleftarrows H^{+}+O_{2}^{2-}}}.}
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
- h3O2+2NaOH→Na2O2+2h3O;{\displaystyle {\mathsf {H_{2}O_{2}+2NaOH\rightarrow Na_{2}O_{2}+2H_{2}O}};}
- h3O2+Ba(OH)2→BaO2↓+2h3O.{\displaystyle {\mathsf {H_{2}O_{2}+Ba(OH)_{2}\rightarrow BaO_{2}\downarrow +2H_{2}O}}.}
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
- h3O−12+Ag2O⟶2Ag+O02+h3O.{\displaystyle {\mathsf {H_{2}{\stackrel {-1}{O}}_{2}+Ag_{2}O\longrightarrow 2Ag+{\stackrel {0}{O}}_{2}+H_{2}O}}.}
В реакции с нитритом калия соединение служит окислителем:
- KNO2+h3O−12⟶KNO−23+h3O.{\displaystyle {\mathsf {KNO_{2}+H_{2}{\stackrel {-1}{O}}_{2}\longrightarrow KN{\stackrel {-2}{O}}_{3}+H_{2}O}}.}
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства[править | править код]
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
- h3O2+2KI+h3SO4→I2+K2SO4+2h3O.{\displaystyle {\mathsf {H_{2}O_{2}+2KI+H_{2}SO_{4}\rightarrow I_{2}+K_{2}SO_{4}+2H_{2}O}}.}
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
- O22−→O2+2e−,{\displaystyle {\mathsf {O_{2}^{2-}\rightarrow O_{2}+2e^{-}}},}
например:
- 3h3O2+2KMnO4→2MnO2+2KOH+3O2↑+2h3O.{\displaystyle {\mathsf {3H_{2}O_{2}+2KMnO_{4}\rightarrow 2MnO_{2}+2KOH+3O_{2}\uparrow +2H_{2}O}}.}
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
- 5h3O2+2KMnO4+3h3SO4→5O2+2MnSO4+K2SO4+8h3O.{\displaystyle {\mathsf {5H_{2}O_{2}+2KMnO_{4}+3H_{2}SO_{4}\rightarrow 5O_{2}+2MnSO_{4}+K_{2}SO_{4}+8H_{2}O}}.}
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
- h3S2O8+2h3O→h3O2+2h3SO4.{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+2H_{2}O\rightarrow H_{2}O_{2}+2H_{2}SO_{4}}}.}
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[2]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
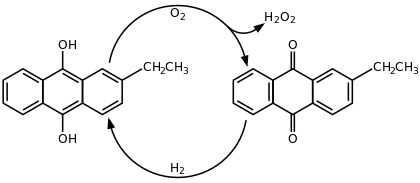
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[3].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта [4]:
- (Ch4)2CHOH+O2→(Ch4)2CO+h3O2,{\displaystyle {\mathsf {(CH_{3})_{2}CHOH+O_{2}\rightarrow (CH_{3})_{2}CO+H_{2}O_{2}}},}
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию:
- BaO2+h3SO4→BaSO4↓+h3O2.{\displaystyle {\mathsf {BaO_{2}+H_{2}SO_{4}\rightarrow BaSO_{4}\downarrow +H_{2}O_{2}}}.}
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H[5].
 3 % раствор перекиси водорода
3 % раствор перекиси водородаБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[6] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
Пероксид водорода применяется также для обесцвечивания волос[11] и отбеливания зубов[12], однако эффект в обоих случаях основан на окислении, а следовательно — разрушении тканей. Во время отбеливания зубов, однако, не происходит разрушения тканей. Пигментированные белки дентина начинают раскручиваться до первичной структуры (как если бы белок яйца из варёного стал более сырым), при этом связи не разрушаются, то есть этот процесс обратим. Эмаль сама по себе прозрачна, и эффект отбеливания достигается за счет разницы в отражении света дентином.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме[13].
С 90-х годов ХХ века 3%-ный раствор пероксида водорода продвигался целителем И. П. Неумывакиным для приёма внутрь как универсальное средство лечения и оздоровления человека. Научного подтверждения допустимости и эффективности данный метод не имеет.
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[14].
Выпускается в виде водных растворов, стандартная концентрация 1—6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 146 дней]. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
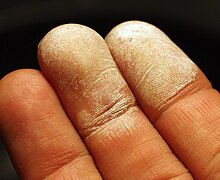 Кожа после попадания на неё концентрированного раствора перекиси водорода.
Кожа после попадания на неё концентрированного раствора перекиси водорода.Несмотря на то, что пероксид водорода нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962—6984. — DOI:10.1002/anie.200503779. — PMID 17039551.
- ↑ Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society (англ.)русск. : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884—1893. — ISSN 0368-1769. — DOI:10.1039/JR9610001884.
- ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds, New York Times (19 июня 2007). Дата обращения 13 июля 2011.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don’t die easily, CNN (12 июля 2011). Дата обращения 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513—519. — DOI:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос
- ↑ Способы отбеливания зубов
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant’s Toothpaste (неопр.). University of Utah Chemistry Demonstrations. University of Utah. Дата обращения 21 марта 2014.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник?]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Сероводород — Википедия
| Сероводород | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | сульфид водорода | ||
| Традиционные названия | сероводород, сернистый водород | ||
| Хим. формула | H2S | ||
| Рац. формула | H2S | ||
| Состояние | газ | ||
| Молярная масса | 34.082 г/моль | ||
| Плотность | 1.5206 (н.у.)г/литр | ||
| Энергия ионизации | 10,46 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −82.30 °C | ||
| • кипения | −60.28 °C | ||
| Пределы взрываемости | 4 ± 1 об.%[1] | ||
| Давление пара | 17,6 ± 0,1 атм[1] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 6.89, 19±2 | ||
| Растворимость | |||
| • в воде | 0.025 (40 °C) | ||
| Рег. номер CAS | 7783-06-4 | ||
| PubChem | 402 | ||
| Рег. номер EINECS | 231-977-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | MX1225000 | ||
| ChEBI | 16136 | ||
| Номер ООН | 1053 | ||
| ChemSpider | 391 | ||
| ЛД50 | 713 ppm (крыса, 1 час) | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да, дигидросульфи́д) — бесцветный газ со сладковатым вкусом, обеспечивающий характерный неприятный тяжёлый запах тухлых яиц (тухлого мяса). Бинарное химическое соединение водорода и серы. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. В больших концентрациях ядовит. Огнеопасен. Концентрационные пределы воспламенения в смеси с воздухом составляют 4,5—45 % сероводорода. Используется в химической промышленности для синтеза некоторых соединений, получения элементарной серы, серной кислоты, сульфидов. Сероводород также используют в лечебных целях, например в сероводородных ваннах[2].
В природе встречается редко в составе попутных нефтяных газов, природного газа, вулканических газах, в растворённом виде в природных водах (например, в Чёрном море слои воды, расположенные глубже 150—200 м, содержат растворённый сероводород). Образуется при гниении белков, которые содержат в составе серосодержащие аминокислоты метионин и/или цистеин. Небольшое количество сероводорода содержится в кишечных газах человека и животных.
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет изогнутую форму, поэтому она полярна (μ = 0,34⋅10−29 Кл·м). В отличие от воды, в сероводороде не образуются водородные связи, поэтому сероводород в обычных условиях не сжижается. Раствор сероводорода в воде — очень слабая сероводородная кислота. Является сверхпроводником при температуре 203 К (−70 °C) и давлении 150 ГПа[3].
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
- h3S→HS−+H+{\displaystyle {\mathsf {H_{2}S\rightarrow HS^{-}+H^{+}}}} Ka = 6,9⋅10−7 ; pKa = 6,89.
Реагирует со щелочами:
- h3S+2NaOH→Na2S+2h3O{\displaystyle {\mathsf {H_{2}S+2NaOH\rightarrow Na_{2}S+2H_{2}O}}} (средняя соль, при избытке NaOH)
- h3S+NaOH→NaHS+h3O{\displaystyle {\mathsf {H_{2}S+NaOH\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
- S+2e−→S2−(Eh=−0.444B){\displaystyle {\mathsf {S+2e^{-}\rightarrow S^{2-}(Eh=-0.444B)}}}
- S+2H++2e−→h3S(Eh=0.144B){\displaystyle {\mathsf {S+2H^{+}+2e^{-}\rightarrow H_{2}S(Eh=0.144B)}}}
В воздухе горит синим пламенем:
- 2h3S+3O2→2h3O+2SO2{\displaystyle {\mathsf {2H_{2}S+3O_{2}\rightarrow 2H_{2}O+2SO_{2}}}}
при недостатке кислорода:
- 2h3S+O2→2S+2h3O{\displaystyle {\mathsf {2H_{2}S+O_{2}\rightarrow 2S+2H_{2}O}}} (на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42−, например:
- 3h3S+4HClO3→3h3SO4+4HCl{\displaystyle {\mathsf {3H_{2}S+4HClO_{3}\rightarrow 3H_{2}SO_{4}+4HCl}}}
- 2h3S+SO2→2h3O+3S{\displaystyle {\mathsf {2H_{2}S+SO_{2}\rightarrow 2H_{2}O+3S}}}
Качественной реакцией на сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца, например[4]:
- h3S+Pb(NO3)2→PbS↓+2HNO3{\displaystyle {\mathsf {H_{2}S+Pb(NO_{3})_{2}\rightarrow PbS{\downarrow }+2HNO_{3}}}}
При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается и железо, входящее в его состав и придающее крови красный цвет, вступает в реакцию с сероводородом и образует чёрный сульфид железа[4].
Сульфиды[править | править код]
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов и растворимой соли сероводородной кислоты, например сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са2+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.), часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
Сульфиды применяются в технике, например полупроводники и люминофоры (сульфид кадмия, сульфид цинка), смазочные материалы (дисульфид молибдена) и др.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
Пример окисления сульфида перекисью водорода:
- PbS+4h3O2=PbSO4+4h3O{\displaystyle {\mathsf {PbS+4H_{2}O_{2}=PbSO_{4}+4H_{2}O}}}
- Взаимодействием разбавленных кислот с сульфидами:
FeS+2 HCl⟶ FeCl2+ h3S↑{\displaystyle {\mathsf {FeS+2\ HCl\longrightarrow \ FeCl_{2}+\ H_{2}S\uparrow }}}
Al2S3+6 h3O⟶2 Al(OH)3↓+3 h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6\ H_{2}O\longrightarrow 2\ Al(OH)_{3}\downarrow +3\ H_{2}S\uparrow }}}
- Сплавлением парафина с серой.
Соединения, генетически связанные с сероводородом[править | править код]
Является первым членом в ряде полисероводородов (сульфанов) — H2Sn (выделены полисероводороды с n=1÷8)[5].
Сероводород из-за своей токсичности находит ограниченное применение.
В норме[править | править код]
Эндогенный сероводород производится в небольших количествах клетками млекопитающих и выполняет ряд важных биологических функций, в том числе сигнальную. Это третий из открытых «газотрансмиттеров» (после окиси азота и угарного газа).
Эндогенный сероводород образуется в организме из цистеина при помощи ферментов цистатионин-β-синтетазы и цистатионин-γ-лиазы. Он является спазмолитиком (расслабляет гладкие мышцы) и вазодилататором, подобно окиси азота и угарному газу[6]. Он также проявляет активность в ЦНС, где он повышает NMDA-опосредованную нейротрансмиссию и способствует долговременному запоминанию информации[7].
В дальнейшем сероводород окисляется до сульфит-иона в митохондриях при помощи фермента тиосульфат-редуктазы. Сульфит-ион в дальнейшем окисляется до тиосульфат-иона и затем в сульфат-ион ферментом сульфит-оксидазой. Сульфаты, как конечный продукт метаболизма, экскретируются с мочой[8].
Благодаря свойствам, сходным со свойствами окиси азота (но без её способности образовывать пероксиды, реагируя с супероксидом), эндогенный сероводород считается сейчас одним из важных факторов, защищающих организм от сердечно-сосудистых заболеваний[6]. Известные кардиопротективные свойства чеснока связаны с катаболизмом полисульфидных групп аллицина в сероводород, причём эта реакция катализируется восстановительными свойствами глютатиона[9].
Хотя и оксид азота(II) NO, и сероводород способны расслаблять мышцы и вызывать вазодилатацию, их механизмы действия, судя по всему, различны. В то время как оксид азота активирует фермент гуанилатциклазу, сероводород активирует АТФ-чувствительные калиевые каналы в гладкомышечных клетках. Исследователям до настоящего времени неясно, как распределяются физиологические роли в регулировании тонуса сосудов между окисью азота, угарным газом и сероводородом. Однако существуют некоторые данные, позволяющие предположить, что окись азота в физиологических условиях в основном расширяет крупные сосуды, в то время как сероводород ответствен за аналогичное расширение мелких кровеносных сосудов[10].
Последние исследования заставляют предполагать значительное внутриклеточное кросс-общение между сигнальными путями оксида азота(II) и сигнальными путями сероводорода[11], демонстрирующие, что вазодилатирующие, спазмолитические, противовоспалительные и цитопротективные свойства этих газов взаимозависимы и взаимодополняющи. Кроме того, показано, что сероводород способен реагировать с внутриклеточными S-нитрозотиолами, в результате чего образуется наименьший возможный S-нитрозотиол — HSNO. Это заставляет предполагать, что сероводород играет роль в контроле за уровнем внутриклеточного содержания S-нитрозотиолов[12].
Подобно окиси азота, сероводород играет роль в расширении сосудов полового члена, необходимом для осуществления эрекции, что создаёт новые возможности для терапии эректильной дисфункции при помощи тех или иных средств, повышающих продукцию эндогенного сероводорода[13][14].
При патологических состояниях[править | править код]
При инфаркте миокарда обнаруживается выраженный дефицит эндогенного сероводорода, что может иметь неблагоприятные последствия для сосудов.[15] Инфаркт миокарда приводит к некрозу сердечной мышцы в зоне инфаркта через два различных механизма: один — это повышенный оксидативный стресс и повышенное образование свободных радикалов, и другой — это сниженная биодоступность эндогенных вазодилататоров и «защитников» тканей от свободнорадикального повреждения — окиси азота и сероводорода.[16] Повышенное образование свободных радикалов происходит вследствие повышенного несвязанного электронного транспорта в активном сайте фермента эндотелиальной синтазы оксида азота — фермента, ответственного за превращение L-аргинина в окись азота.[15][16] Во время инфаркта, окислительная деградация тетрагидробиоптерина, кофактора в процессе производства окиси азота, ограничивает доступность тетрагидробиоптерина и соответственно ограничивает способность синтазы оксида азота к производству NO.[16] В результате синтаза оксида азота реагирует с кислородом, другим косубстратом, необходимым для производства окиси азота. Результатом этого является образование супероксидов, повышенное образование свободных радикалов и внутриклеточный оксидативный стресс.[15] Дефицит сероводорода ещё более ухудшает эту ситуацию, нарушая активность синтазы оксида азота за счёт ограничения активности Akt и угнетения фосфорилирования Akt синтазы оксида азота в сайте eNOSS1177, необходимом для её активации.[15][17] Вместо этого при дефиците сероводорода активность Akt изменяется таким образом, что Akt фосфорилирует ингибирующий сайт синтазы оксида азота — eNOST495 — что приводит к ещё большему угнетению биосинтеза окиси азота.[15][17]
«Сероводородная терапия» использует донор или прекурсор сероводорода, такой как диаллил-трисульфид, для того, чтобы повысить содержание сероводорода в крови и тканях пациента с инфарктом миокарда. Доноры или прекурсоры сероводорода уменьшают повреждение миокарда после ишемии и реперфузии и риск осложнений инфаркта миокарда.[15] Повышенные уровни сероводорода в тканях и крови реагируют с кислородом, содержащимся в крови и тканях, в результате чего образуется сульфан-сера, промежуточный продукт, в составе которого сероводород «запасается», хранится и транспортируется в клетки.[15] Пулы сероводорода в тканях реагируют с кислородом, повышение содержания сероводорода в тканях активирует синтазу оксида азота и тем самым повышает продукцию окиси азота.[15] Вследствие повышения использования кислорода для производства окиси азота, меньше кислорода остаётся для реагирования с эндотелиальной синтазой оксида азота и производства супероксидов, повышенного при инфаркте, что в итоге приводит к уменьшению образования свободных радикалов.[15] Кроме того, меньшее образование свободных радикалов понижает оксидативный стресс в гладкомышечных клетках сосудов, понижая тем самым окислительную деградацию тетрагидробиоптерина.[16] Повышение доступности кофактора синтазы оксида азота — тетрагидробиоптерина — также способствует увеличению продукции окиси азота в организме.[16] Кроме того, более высокие концентрации сероводорода непосредственно повышают активность синтазы оксида азота через активацию Akt, что приводит к повышению фосфорилирования активирующего сайта eNOSS1177 и снижению фосфорилирования ингибирующего сайта eNOST495.[15][17] Это фосфорилирование приводит к повышению каталитической активности синтазы оксида азота, что приводит к более эффективному и более быстрому превращению L-аргинина в окись азота и повышению концентрации окиси азота.[15][17] Повышение концентрации окиси азота повышает активность растворимой гуанилатциклазы, что, в свою очередь, приводит к повышению образования циклического гуанозинмонофосфата цГМФ из ГТФ.[18] Повышение уровня циклического ГМФ приводит к повышению активности протеинкиназы G (PKG).[19] А протеинкиназа G приводит к снижению уровня внутриклеточного кальция в гладких мышцах стенок сосудов, что приводит к их расслаблению и усилению кровотока в сосудах.[19] Кроме того, протеинкиназа G также ограничивает пролиферацию гладкомышечных клеток стенок сосудов, уменьшая тем самым утолщение интимы сосудов. В конечном итоге «сероводородная терапия» приводит к уменьшению размеров зоны инфаркта.[15][18]
При болезни Альцгеймера уровень сероводорода в мозгу резко понижен.[20] В модели на крысах болезни Паркинсона концентрация сероводорода в мозгу крыс также оказалась пониженной, причём введение крысам доноров или прекурсоров сероводорода улучшало состояние животных вплоть до полного исчезновения симптомов.[21] При трисомии 21 (синдроме Дауна) организм, напротив, вырабатывает избыточное количество сероводорода.[8] Эндогенный сероводород также вовлечён в патогенез сахарного диабета 1-го типа. Бета-клетки поджелудочной железы больных сахарным диабетом 1-го типа вырабатывают чрезмерно повышенные количества сероводорода, что приводит к гибели этих клеток и к понижению секреции инсулина соседними, пока ещё живыми, клетками.[10]
Использование для гибернации и анабиоза[править | править код]
В 2005 году было показано, что мышь можно погрузить в состояние почти анабиоза: искусственной гипотермии, подвергнув её воздействию низких концентраций сероводорода (81 ppm) во вдыхаемом воздухе. Дыхание животных замедлилось со 120 до 10 дыхательных движений в минуту, а их температура тела упала с 37 градусов Цельсия до уровня, всего на 2 градуса Цельсия превышающего температуру окружающей среды (то есть эффект был таков, как будто теплокровное животное внезапно стало холоднокровным). Мыши пережили эту процедуру в течение 6 часов, причём после этого у них не наблюдалось никаких негативных последствий для здоровья, нарушений поведения или каких-либо повреждений внутренних органов[22] В 2006 году было показано, что артериальное давление у мыши, подвергнутой подобным образом воздействию сероводорода, существенно не снижается[23].
Сходный процесс, известный как гибернация или «зимняя спячка», наблюдается в природе у многих видов млекопитающих, а также у жаб, но не у мыши (хотя мышь может впадать в ступор при долгом отсутствии еды). Было показано, что во время «зимней спячки» продукция эндогенного сероводорода у тех животных, которые впадают в зимнюю спячку, значительно повышается. Теоретически, если бы удалось заставить вызываемую сероводородом гибернацию столь же эффективно работать у людей, это могло бы быть очень полезным в клинической практике для спасения жизни тяжело травмированных или перенёсших тяжёлую гипоксию, инфаркты, инсульты больных, а также для консервации донорских органов. В 2008 году было показано, что гипотермия, вызванная сероводородом в течение 48 часов, у крыс способна уменьшать степень повреждения головного мозга, вызываемого экспериментальным инсультом или травмой мозга[24].
Сероводород связывается с цитохромоксидазой C и тем самым предотвращает связывание с нею кислорода, что приводит к резкому замедлению метаболизма, но в больших количествах «парализует» клеточное дыхание и приводит к «удушью» на уровне клетки — к клеточной гипоксии. И у человека, и у животных все клетки организма в норме производят некоторое количество сероводорода. Ряд исследователей предположили, что, помимо других физиологических ролей, сероводород также используется организмом для естественной саморегуляции скорости метаболизма (метаболической активности), температуры тела и потребления кислорода, что может объяснить вышеописанное наступление гибернации у мышей и крыс при повышенных концентрациях сероводорода, а также повышение его концентрации при физиологической спячке у животных[25].
Однако два последних исследования вызывают сомнения в том, что этого эффекта гибернации и индукции гипометаболизма при помощи сероводорода возможно достичь у более крупных животных. Так, исследование 2008 года не смогло воспроизвести этот же эффект на свиньях, что привело исследователей к заключению, что эффект, наблюдаемый у мышей, не наблюдается у более крупных животных[26]. Аналогично другая статья отмечает, что эффекта индукции гипометаболизма и гибернации при помощи сероводорода, легко достижимого у мышей и крыс, не удаётся достичь у овец[27].
В феврале 2010 года учёный Марк Рот заявил на конференции, что вызванная сероводородом гипотермия у человека прошла I фазу клинических испытаний[28]. Однако решение о проведении дальнейших клинических испытаний на больных с инфарктом было отозвано основанной им компанией Ikaria в августе 2011 года ещё до начала набора участников испытаний без объяснения причин со ссылкой на «решение компании»[29][30].
Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При вдыхании воздуха с небольшими концентрациями у человека довольно быстро возникает адаптация к неприятному запаху «тухлых яиц» и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус[31].
При вдыхании воздуха с большой концентрацией из-за паралича обонятельного нерва запах сероводорода почти сразу перестаёт ощущаться.
Порог запаха сероводорода (концентрации, при которых начинает ощущаться запах) по данным Всемирной Организации Здравоохранения («Рекомендации по качеству воздуха для Европы») составляет 0,007 мг/м3.
В Российской Федерации предельно-допустимая максимально-разовая концентрация сероводорода в атмосферном воздухе (ПДКм.р.) установлена на уровне порога запаха и составляет 0,008 мг/м3
Концентрации сероводорода в воздухе, при которых начинаются обратимые реакции у чувствительных групп населения, значительно выше порога запаха.
В рекомендациях Всемирной Организации Здравоохранения по качеству атмосферного воздуха для Европы рекомендуемое значение, при котором могут возникнуть первые обратимые от воздействия сероводорода (раздражение глаз), составляет 0,15 мг/м3 — в 18,75 раз больше, чем порог запаха. Согласно отдельному докладу Всемирной Организации Здравоохранения, посвященному исследованиям воздействия сероводорода на здоровье населения, обратимая реакция у чувствительных групп населения (астматиков и аллергиков) начинается с концентрации 2,8 мг/м3, что в 350 раз выше порога запаха.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0337.html
- ↑ Польза сероводородных ванн
- ↑ A. P. Drozdov, M. I. Eremets, I. A. Troyan, V. Ksenofontov, S. I. Shylin. Conventional superconductivity at 203 kelvin at high pressures in the sulfur hydride system (англ.) // Nature. — Vol. 525, iss. 7567. — P. 73—76. — DOI:10.1038/nature14964.
- ↑ 1 2 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 88. Сероводород // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 206—207. — 240 с. — 1 630 000 экз.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- ↑ 1 2 Lefer, David J. A new gaseous signaling molecule emerges: Cardioprotective role of hydrogen sulfide (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — November (vol. 104, no. 46). — P. 17907—17908. — DOI:10.1073/pnas.0709010104. — Bibcode: 2007PNAS..10417907L. — PMID 17991773.
- ↑ Kimura, Hideo. Hydrogen sulfide as a neuromodulator (неопр.) // Molecular Neurobiology. — 2002. — Т. 26, № 1. — С. 13—19. — DOI:10.1385/MN:26:1:013. — PMID 12392053.
- ↑ 1 2 Kamoun, Pierre. H2S, a new neuromodulator (неопр.) // Médecine/Sciences. — 2004. — July (т. 20, № 6—7). — С. 697—700. — DOI:10.1051/medsci/2004206-7697. — PMID 15329822.
- ↑ Benavides, Gloria A; Squadrito, Giuseppe L; Mills, Robert W; Patel, Hetal D; Isbell, T Scott; Patel, Rakesh P; Darley-Usmar, Victor M; Doeller, Jeannette E; Kraus, David W. Hydrogen sulfide mediates the vasoactivity of garlic (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — 13 November (vol. 104, no. 46). — P. 17977—17982. — DOI:10.1073/pnas.0705710104. — Bibcode: 2007PNAS..10417977B. — PMID 17951430.
- ↑ 1 2 «Toxic Gas, Lifesaver», Scientific American, March 2010
- ↑ Coletta C., Papapetropoulos A., Erdelyi K., Olah G., Módis K., Panopoulos P., Asimakopoulou A., Gerö D., Sharina I., Martin E., Szabo C. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2012. — Vol. 109, no. 23. — P. 9161—9166. — DOI:10.1073/pnas.1202916109. — PMID 22570497. [исправить]
- ↑ Filipovic M. R., Miljkovic J. Lj, Nauser T., Royzen M., Klos K., Shubina T., Koppenol W. H., Lippard S. J., Ivanović-Burmazović I. Chemical characterization of the smallest S-nitrosothiol, HSNO; cellular cross-talk of h3S and S-nitrosothiols. (англ.) // Journal of the American Chemical Society. — 2012. — Vol. 134, no. 29. — P. 12016—12027. — DOI:10.1021/ja3009693. — PMID 22741609. [исправить]
- ↑ Roberta d’Emmanuele di Villa Biancaa, Raffaella Sorrentinoa, Pasquale Maffiaa, Vincenzo Mironeb, Ciro Imbimbob, Ferdinando Fuscob, Raffaele De Palmad, Louis J. Ignarroe und Giuseppe Cirino. Hydrogen sulfide as a mediator of human corpus cavernosum smooth-muscle relaxation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2009. — Vol. 106, no. 11. — P. 4513—4518. — DOI:10.1073/pnas.0807974105. — Bibcode: 2009PNAS..106.4513D. — PMID 19255435.
- ↑ Hydrogen Sulfide: Potential Help for ED (неопр.). WebMD (2 марта 2009).
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 King, Adrienne; Polhemus, Bhushan, Otsuka, Kondo, Nicholson, Bradley, Islam, Calvert, Tao, Dugas, Kelley, Elrod, Huang, Wang, Lefer; Bhushan, S.; Otsuka, H.; Kondo, K.; Nicholson, C. K.; Bradley, J. M.; Islam, K. N.; Calvert, J. W.; Tao, Y.-X.; Dugas, T. R.; Kelley, E. E.; Elrod, J. W.; Huang, P. L.; Wang, R.; Lefer, D. J. Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2014. — January (vol. 111, no. Early Edition). — P. 1—6. — DOI:10.1073/pnas.1321871111. — Bibcode: 2014PNAS..111.3182K.
- ↑ 1 2 3 4 5 Alp, Nicholas; Channon. Regulation of endothelial nitric oxide synthase by tetrahydrobiopterin in vascular disease (англ.) // Journal of the American Heart Association (англ.)русск. : journal. — 2003. — Vol. 24. — P. 413—420. — DOI:10.1161/01.ATV0000110785.96039.f6.
- ↑ 1 2 3 4 Coletta, Ciro; Papapetropoulos, Erdelyi, Olah, Modis, Panopoulos, Asimakopoulou, Gero, Sharina, Martin, Szabo; Erdelyi, K.; Olah, G.; Modis, K.; Panopoulos, P.; Asimakopoulou, A.; Gero, D.; Sharina, I.; Martin, E.; Szabo, C. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2012. — April (vol. 109, no. 23). — P. 9161—9166. — DOI:10.1073/pnas.1202916109. — Bibcode: 2012PNAS..109.9161C. — PMID 22570497.
- ↑ 1 2 Boerth, N. J.; Dey, Cornwell, Lincoln. Cyclic GMP-dependent protein kinase regulates vascular smooth muscle cell phenotype (англ.) // Journal of Vascular Research : journal. — 1997. — Vol. 34, no. 4. — P. 245—259. — DOI:10.1159/000159231. — PMID 9256084.
- ↑ 1 2 Lincoln, T. M.; Cornwell, Taylor. cGMP-dependent protein kinase mediates the reduction of Ca2+ by cAMP in vascular smooth muscle cells (англ.) // American Physiological Society (англ.)русск. : journal. — 1990. — March (vol. 258, no. 3). — P. C399—C407. — PMID 2156436.
- ↑ Eto, Ko; Takashi Asada; Kunimasa Arima; Takao Makifuchi; Hideo Kimura. Brain hydrogen sulfide is severely decreased in Alzheimer’s disease (англ.) // Biochemical and Biophysical Research Communications (англ.)русск. : journal. — 2002. — 24 May (vol. 293, no. 5). — P. 1485—1488. — DOI:10.1016/S0006-291X(02)00422-9. — PMID 12054683.
- ↑ Hu L. F., Lu M., Tiong C. X., Dawe G. S., Hu G., Bian J. S. Neuroprotective effects of hydrogen sulfide on Parkinson’s disease rat models. (англ.) // Aging cell. — 2010. — Vol. 9, no. 2. — P. 135—146. — DOI:10.1111/j.1474-9726.2009.00543.x. — PMID 20041858. [исправить]
- ↑ Mice put in ‘suspended animation’, BBC News, 21 April 2005
- ↑ Gas induces ‘suspended animation’, BBC News, 9 October 2006
- ↑ Florian B., Vintilescu R., Balseanu A. T., Buga A-M, Grisk O., Walker L. C., Kessler C., Popa-Wagner A; Vintilescu; Balseanu; Buga; Grisk; Walker; Kessler; Popa-Wagner. Long-term hypothermia reduces infarct volume in aged rats after focal ischemia (англ.) // Neuroscience Letters (англ.)русск. : journal. — 2008. — Vol. 438, no. 2. — P. 180—185. — DOI:10.1016/j.neulet.2008.04.020. — PMID 18456407.
- ↑ Mark B. Roth and Todd Nystul. Buying Time in Suspended Animation. Scientific American, 1 June 2005
- ↑ Li, Jia; Zhang, Gencheng; Cai, Sally; Redington, Andrew N. Effect of inhaled hydrogen sulfide on metabolic responses in anesthetized, paralyzed, and mechanically ventilated piglet
Гидропероксильный радикал — Википедия
Материал из Википедии — свободной энциклопедии
Гидропероксильный радикал или пероксильный радикал — это протонированная форма супероксида с формулой HO2•.
Гидропероксильный радикал образуется в результате переноса атома водорода на молекулу кислорода, путём взаимодействия атома кислорода с гидроксильным радикалом (HO•) или протона с супероксид анионом[2].
В водном растворе супероксид анинон O2− и гидропероксильный радикал находятся в равновесии:
- O2− + H2O
 HO2 + OH−
HO2 + OH−
Константа равновесия этого процесса pKa = 4.88[3], из чего можно сделать вывод, что 0,3 % супероксида в цитозоле находится в протонированной форме.
В отличие от O2−, который является сильным восстановителем, HO2• в ходе многих биологически важных реакций может вести себя как окислитель, отбирая атомы водорода от токоферола и полиненасышенных жирных кислот липидной мембраны. По этой причине он является одним из основных инициаторов перекисного окисления липидов.
Поскольку диэлектрическая постоянная сильно влияет на pKa, а диэлектрическая проницаемость воздуха весьма мала, образующийся (фотохимически) в атмосфере супероксид практически полностью существует в форме HO2•. Поскольку HO2• весьма реакционноспособен, он действует как атмосферное «моющее средство», разлагая некоторые органические загрязнители. По этой причине химия HO2 имеет геохимическое значение.
Гидропероксильный радикал разрушает озоновый слой стратосферы; он образуется в результате окисления углеводородов в тропосфере[2].
Тяжёлая вода — Википедия
| Тяжёлая вода | |||
|---|---|---|---|
| |||
| Систематическое наименование | оксид дейтерия | ||
| Традиционные названия | тяжёлая вода | ||
| Хим. формула | D2O | ||
| Состояние | жидкость | ||
| Молярная масса | 20,04 г/моль | ||
| Плотность | 1,1042 г/см³ | ||
| Динамическая вязкость | 0,00125 Па·с | ||
| Температура | |||
| • плавления | 3,81 °C | ||
| • кипения | 101,43 °C | ||
| Критическая точка | |||
| • давление | 21,86 МПа | ||
| Мол. теплоёмк. | 84,3 Дж/(моль·К) | ||
| Уд. теплоёмк. | 4,105 Дж/(кг·К) | ||
| Энтальпия | |||
| • образования | −294,6 кДж/моль | ||
| • плавления | 5,301 кДж/моль | ||
| • кипения | 45,4 кДж/моль | ||
| Давление пара | 10 мм рт. ст. при 13,1 °C 100 мм рт. ст. при 54 °C | ||
| Растворимость | |||
| • в воде | неограниченная | ||
| • в эфире | малорастворима | ||
| • в этаноле | неограниченная | ||
| Показатель преломления | 1,32844 (при 20 °C) | ||
| Рег. номер CAS | 7789-20-0 | ||
| PubChem | 24602 | ||
| Рег. номер EINECS | 232-148-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0230000 | ||
| ChEBI | 41981 | ||
| ChemSpider | 23004 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжёловодородной воды, известной также как оксид дейтерия. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха[1]. Формула тяжёловодородной воды обычно записывается как D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная жидкость без вкуса и запаха. Не радиоактивна.
Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что учёный был удостоен Нобелевской премии по химии в 1934 году. А уже в 1933 году Гилберт Льюис выделил чистую тяжёловодородную воду. При электролизе обычной воды, содержащей наряду с обычными молекулами воды незначительное количество молекул тяжёлой (D2O) и полутяжёлой (НDО) воды, образованных тяжёлым изотопом водорода, остаток постепенно обогащается молекулами этих соединений. Из такого остатка после многократного повторения электролиза Льюису в 1933 г. впервые удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул соединения кислорода с дейтерием и получившей название тяжёлой. Этот способ производства тяжёлой воды остаётся основным и сейчас, хотя используется в основном на окончательной стадии обогащения от 5—10 % до >99 % (см. ниже).
После открытия в конце 1938 года деления ядер и осознания возможности использования цепных ядерных реакций деления, индуцированных нейтронами, возникла необходимость в замедлителе нейтронов — веществе, позволяющем эффективно замедлять нейтроны, не теряя их в реакциях захвата. Наиболее эффективно нейтроны замедляются лёгкими ядрами, и самым эффективным замедлителем должны были бы быть ядра обычного водорода (протия), однако они обладают высоким сечением захвата нейтронов. Напротив, тяжёлый водород захватывает очень мало нейтронов (сечение захвата тепловых нейтронов у протия в более чем 100 тысяч раз выше, чем у дейтерия). Технически наиболее удобным соединением дейтерия является тяжёлая вода, причём она способна также служить теплоносителем, отводя выделяющееся тепло от области, где происходит цепная реакция деления. С самых ранних времён ядерной энергетики тяжёлая вода стала важным компонентом в некоторых реакторах, как энергетических, так и предназначенных для наработки изотопов плутония для ядерного оружия. Эти так называемые тяжеловодные реакторы имеют то преимущество, что могут работать на природном (необогащённом) уране без использования графитовых замедлителей, которые на этапе вывода из эксплуатации могут представлять опасность взрыва пыли и содержат наведённую радиоактивность (углерод-14 и ряд других радионуклидов)[2]. Однако в большинстве современных реакторов используется обогащённый уран с нормальной «лёгкой водой» в качестве замедлителя, несмотря на частичную потерю замедленных нейтронов.
Производство тяжёлой воды в СССР[править | править код]
 | Эта статья или раздел описывает ситуацию применительно лишь к одному региону (СССР), возможно, нарушая при этом правило о взвешенности изложения. Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
Промышленное производство и применение тяжёлой воды началось с развитием атомной энергетики. В СССР при организации Лаборатории № 3 АН СССР (современный ИТЭФ) перед руководителем проекта А. И. Алихановым была поставлена задача создания реактора на тяжёлой воде. Это обусловило потребность в тяжёлой воде, и техническим советом Специального комитета при СНК СССР был разработан проект Постановления СНК СССР «О строительстве полупромышленных установок по производству продукта 180», работы по созданию производительных установок тяжёлой воды в кратчайшие сроки были поручены руководителю атомного проекта Б. Л. Ванникову, народному комиссару химической промышленности М. Г. Первухину, представителю Госплана Н. А. Борисову, народному комиссару по делам строительства СССР С. З. Гинзбургу, народному комиссару машиностроения и приборостроения СССР П. И. Паршину и народному комиссару нефтяной промышленности СССР Н. К. Байбакову[3]. Главным консультантом в вопросах тяжёлой воды стал Начальник сектора Лаборатории № 2 АН СССР М. И. Корнфельд.
| Параметр | D2O | HDO | H2O |
|---|---|---|---|
| Температура плавления, °C | 3,82 | 2,04 | 0,00 |
| Температура кипения, °C | 101,4 | 100,7 | 100,0 |
| Плотность при 20 °C, г/см³ | 1,1056 | 1,054 | 0,9982 |
| Температура максимальной плотности, °C | 11,6 | 4,0 | |
| Вязкость при 20 °C, сантипуаз | 1,2467 | 1,1248 | 1,0016 |
| Поверхностное натяжение при 25 °C, дин·см | 71,87 | 71,93 | 71,98 |
| Молярное уменьшение объёма при плавлении, см³/моль | 1,567 | 1,634 | |
| Молярная теплота плавления, ккал/моль | 1,515 | 1,436 | |
| Молярная теплота парообразования, ккал/моль | 10,864 | 10,757 | 10,515 |
| pH при 25 °C | 7,41 | 7,266 | 7,00 |
В природных водах один атом дейтерия приходится на 6400—7600[5] атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO, одна такая молекула приходится на 3200—3800 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двух атомов дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5⋅10−7). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие[править | править код]
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки)[6] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой[7][8]. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90 % дейтерировании воды в теле[9]. Простейшие способны адаптироваться к 70 % раствору тяжёлой воды, а водоросли и бактерии способны жить даже в чистой тяжёлой воде[6][10][11][12][13]. Человек может без видимого вреда для здоровья выпить несколько стаканов тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. Так, в одном из экспериментов по изучению связи вестибулярного аппарата и непроизвольных движений глаз (нистагма) добровольцам предлагалось выпить от 100 до 200 граммов тяжёлой воды; в результате поглощения более плотной тяжёлой воды купулой (желатинообразной структурой в полукружных каналах) её нейтральная плавучесть в эндолимфе каналов нарушается, и возникают лёгкие нарушения пространственной ориентации, в частности нистагм. Этот эффект аналогичен возникающему при приёме алкоголя (однако в последнем случае плотность купулы уменьшается, поскольку плотность этилового спирта меньше плотности воды)[14].
Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах от 10 до 675 г D2O в день[15].
В человеческом организме содержится в качестве естественной примеси столько же дейтерия, сколько в 5 граммах тяжёлой воды; этот дейтерий в основном входит в молекулы полутяжёлой воды HDO, а также во все прочие биологические соединения, в которых есть водород.[источник не указан 567 дней]
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока. В 1935 году, сразу после открытия тяжёлой воды, её цена составляла ориентировочно 19 долларов за грамм[16]. В настоящее время тяжёлая вода с содержанием дейтерия 99 % ат., продаваемая поставщиками химических реактивов, при покупке 1 кг сто́ит около 1 евро за грамм[17], однако эта цена относится к продукту с контролируемым и гарантированным качеством химического реактива; при снижении требований к качеству цена может быть на порядок ниже.
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье, из-за публикации предположения В. В. Похлёбкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[18]. В действительности повышение концентрации тяжёлой воды при кипячении ничтожно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация дейтерия равна 0,15 %, то есть всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1⋅1030 тонн воды, что в 300 млн раз превышает массу Земли[19]. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей, переход в раствор веществ из стенок посуды и термическое разложение органических примесей.
Стоимость производства тяжёлой воды определяется затратами энергии. Поэтому при обогащении тяжёлой воды применяют последовательно разные технологии — вначале пользуются более дешёвыми технологиями, с бо́льшими потерями тяжёлой воды, а в конце — более энергозатратными, но с меньшими потерями тяжёлой воды.
С 1933 по 1946 годы единственным применявшимся методом обогащения был электролиз. В последующем появились технологии ректификации жидкого водорода и изотопного обмена в системах: водород — жидкий аммиак, водород — вода, сероводород — вода. Современное массовое производство во входном потоке использует воду, дистиллированную из электролита цехов получения электролитического водорода, с содержанием 0,1—0,2 % тяжёлой воды.
На первой стадии концентрирования применяется двухтемпературная противоточная сероводородная технология изотопного обмена, выходная концентрация тяжёлой воды 5—10 %. На второй — каскадный электролиз раствора щёлочи при температуре около 0 °C, выходная концентрация тяжёлой воды 99,75—99,995 %.
Крупнейшим в мире производителем тяжёлой воды является Канада, что связано с применением в её энергетике тяжеловодных ядерных реакторов CANDU.
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для замедления нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии, агрохимии и др. (в том числе в опытах с живыми организмами и при диагностических исследованиях человека). В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Дейтерий — ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетических реакторах такого типа предполагается осуществить реакцию D + T → 4He + n + 17,6 МэВ[20].
В некоторых странах (например, в Австралии) коммерческий оборот тяжёлой воды поставлен под государственные ограничения, что связано с теоретической возможностью её использования для создания «несанкционированных» реакторов на природном уране, пригодных для наработки оружейного плутония.
Полутяжёлая вода[править | править код]
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещён дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и H2O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода[править | править код]
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) ещё заметнее отличается от обычной: кипит при 104 °C, замерзает при +9 °C и имеет плотность 1,21 г/см³.[21] Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода (16O, 17O и 18O). Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжёлокислородные изотопные модификации воды[править | править код]
Термин тяжёлая вода применяют также по отношению к тяжёлокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжёлокислородных модификаций. Их физические свойства также несколько отличаются от свойств обычной воды; так, температура замерзания 1H218O составляет +0,28 °C[4].
Тяжёлокислородная вода, в частности, 1H218O, используется в диагностике онкологических заболеваний (из неё на циклотроне получают изотоп фтор-18, который используют для синтеза препаратов для диагностики онкозаболеваний, в частности 18-фдг).
Общее число изотопных модификаций воды[править | править код]
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжёлокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18:
- T216O — сверхтяжёлая вода
- T217O
- T218O
- DT16O
- DT17O
- DT18O
- HT16O
- HT17O
- HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 радиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1H215O).
- ↑ Петрянов И. В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ http://www-pub.iaea.org/MTCD/publications/PDF/ngwm-cd/PDF-Files/paper%2017%20%28Holt%29.pdf
- ↑
 документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке - ↑ 1 2 Water properties
- ↑ Дейтерий / В кн.: Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ 1 2 D. J. Kushner, Alison Baker, and T. G. Dunstall. Pharmacological uses and perspectives of heavy water and deuterated compounds (англ.) // Can. J. Physiol. Pharmacol. (англ.)русск. : journal. — 1999. — Vol. 77, no. 2. — P. 79—88. — DOI:10.1139/cjpp-77-2-79. — PMID 10535697.
- ↑ Лобышев В. Н., Калиниченко Л. П. Изотопные эффекты D2O в биологических системах. — М.: Наука, 1978. — 215 с.
- ↑ Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution. — Dordrecht: Kluwer Acad. Publ., 2004. — 112 p.
- ↑ Trotsenko, Y. A., Khmelenina, V. N., Beschastny, A. P. (1995) The Ribulose Monophosphate (Quayle) Cycle: News and Views. Microbial Growth on C1 Compounds, in: Proceedings of the 8th International Symposium on Microbial Growth on C1 Compounds (Lindstrom M. E., Tabita F. R., eds.). San Diego (USA), Boston: Kluwer Academic Publishers, pp. 23-26
- ↑ Мосин О. В., Швец В. И., Складнев Д. А., Игнатов И. Микробный синтез дейтерий-меченного L-фенилаланина факультативной метилотрофной бактерией Brevibacterium Methylicum на средах с различными концентрациями тяжелой воды // Биофармацевтический журнал. — 2012. — Т. 4, вып. 1. — С. 11—22.
- ↑ Мосин О. В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и микроводорослей при росте на тяжелой воде (D2O) // Вода: химия и экология. — 2012. — Вып. 3. — С. 83—94.
- ↑ Crespi H. L. Fully deuterated microorganisms: tools in magnetic resonance and neutron scattering. Synthesis and Applications of Isotopically Labeled Compounds / in: Proceedings of an International Symposium. Baillie T, Jones J.R eds. Amsterdam: Elsevier. 1989. pp. 329—332.
- ↑ Mosin O. V., Ignatov I. Microbiological Synthesis of 2H-Labeled Phenylalanine, Alanine, Valine, and Leucine/Isoleucine with Different Degrees of Deuterium Enrichment by the Gram-Positive Facultative Methylotrophic Bacterium Вrevibacterium Methylicum (англ.) // International Journal of BioMedicine. — 2013. — Vol. 3, iss. 2. — P. 132—138.
- ↑ Money K. E., Myles W. S. Heavy water nystagmus and effects of alcohol (англ.) // Nature. — 1974. — Vol. 247, no. 5440. — P. 404—405. — DOI:10.1038/247404a0. — Bibcode: 1974Natur.247..404M. — PMID 4544739.
- ↑ Патент США № 5 223 269 от 29 июня 1993. Method and composition for the treatment of hypertension. Описание патента на сайте Ведомства по патентам и товарным знакам США.
- ↑ Pharmacologist drinks heavy water in experiment (англ.). Science News Staff (9 February 1935). Дата обращения 7 сентября 2013.
- ↑ Deuterium oxide, 99 atom % D | D2O | Sigma-Aldrich
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ Илья Леенсон. Тяжелая вода (неопр.). Энциклопедия Кругосвет. Дата обращения 7 сентября 2013.
- ↑ Андреев Б. М., Зельвенский Я. Д., Катальников С. Г., Тяжелые изотопы водорода в ядерной технике, М., 1987.
- ↑ Тритий // Химическая энциклопедия Т.5 — Москва — Научное издательство «Большая Российская энциклопедия» — 1998
Иодоводород — Википедия
Материал из Википедии — свободной энциклопедии
Иодоводород HI — бесцветный удушливый газ (при нормальных условиях), сильно дымит на воздухе. Хорошо растворим в воде, образует азеотропную смесь с Ткип 127 °C и концентрацией HI 57 %. Неустойчив, разлагается при 300 °C.
В промышленности HI получают по реакции иода с гидразином:
- 2I2+N2h5→4HI+N2{\displaystyle {\mathsf {2I_{2}+N_{2}H_{4}\rightarrow 4HI+N_{2}}}}
В лаборатории HI можно получать с помощью окислительно-восстановительных реакций:
- h3S+I2→S+2HI{\displaystyle {\mathsf {H_{2}S+I_{2}\rightarrow S+2HI}}}
и реакций обмена:
- PI3+3h3O→h4PO3+3HI{\displaystyle {\mathsf {PI_{3}+3H_{2}O\rightarrow H_{3}PO_{3}+3HI}}}
Иодоводород также получается при взаимодействии простых веществ. Эта реакция идет только при нагревании и протекает не до конца, так как в системе устанавливается равновесие:
- h3+I2⇄2HI{\displaystyle {\mathsf {H_{2}+I_{2}\rightleftarrows 2HI}}}
Водный раствор HI называется иодоводородной кислотой (бесцветная жидкость с резким запахом). Иодоводородная кислота является сильной кислотой (pKа = −11)[1]. Соли иодоводородной кислоты называются иодидами. В 100 г воды при нормальном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г. 45%-ная йодоводородная кислота имеет плотность 1,4765 г/см3.
Иодоводород является сильным восстановителем. На воздухе водный раствор HI окрашивается в бурый цвет вследствие постепенного окисления его кислородом воздуха и выделения молекулярного иода:
- 4HI+O2→2h3O+2I2{\displaystyle {\mathsf {4HI+O_{2}\rightarrow 2H_{2}O+2I_{2}}}}
HI способен восстанавливать концентрированную серную кислоту до сероводорода:
- 8HI+h3SO4→4I2+h3S+4h3O{\displaystyle {\mathsf {8HI+H_{2}SO_{4}\rightarrow 4I_{2}+H_{2}S+4H_{2}O}}}
Подобно другим галогенводородам, HI присоединяется к кратным связям (реакция электрофильного присоединения):
- HI+Ch3=Ch3→Ch4−Ch3I{\displaystyle {\mathsf {HI+CH_{2}{\text{=}}CH_{2}\rightarrow CH_{3}-CH_{2}I}}}
Иодиды присоединяют элементарный иод с образованием полииодидов:
- RI+I2→R(I3)x{\displaystyle {\mathsf {RI+I_{2}\rightarrow R(I_{3})_{x}}}}
Под действием света щелочные соли разлагаются, выделяя I2, придающий им жёлтую окраску. Иодиды получают взаимодействием иода со щелочами в присутствии восстановителей, не образующих твердых побочных продуктов: муравьиная кислота, формальдегид, гидразин:
- 2K2CO3+2I2+HCHO→4KI+3CO2↑+h3O{\displaystyle {\mathsf {2K_{2}CO_{3}+2I_{2}+HCHO\rightarrow 4KI+3CO_{2}\uparrow +H_{2}O}}}
Можно использовать также сульфиты, но они загрязняют продукт сульфатами. Без добавок восстановителей при получении щелочных солей наряду с иодидом образуется иодат MIO3 (1 часть на 5 частей иодида).
Ионы Cu2+ при взаимодействии c иодидами легко дают малорастворимые соли одновалентной меди CuI:
- 2NaI+2CuSO4+Na2SO3+h3O→2CuI↓+2Na2SO4+h3SO4{\displaystyle {\mathsf {2NaI+2CuSO_{4}+Na_{2}SO_{3}+H_{2}O\rightarrow 2CuI\downarrow +2Na_{2}SO_{4}+H_{2}SO_{4}}}}[2]
Замещает элементы в кислородных кислотах по реакциям
- 12HNO3+2I2→4HIO3+N2↑+10NO2↑+4h3O{\displaystyle {\mathsf {12HNO_{3}+2I_{2}\rightarrow 4HIO_{3}+N_{2}\uparrow +10NO_{2}\uparrow +4H_{2}O}}}
- h3SO4+I2→HIO4+HI+S↓{\displaystyle {\mathsf {H_{2}SO_{4}+I_{2}\rightarrow HIO_{4}+HI+S\downarrow }}}
- 2h4PO4+8I2→2HIO4+4HI+2PI5{\displaystyle {\mathsf {2H_{3}PO_{4}+8I_{2}\rightarrow 2HIO_{4}+4HI+2PI_{5}}}}
Образующийся пентайодид фосфора гидролизуется водой.
Иодоводород используют в лабораториях как восстановитель во многих органических синтезах, а также для приготовления различных иодсодержащих соединений.
Спирты, галогениды и кислоты восстанавливаются HI, давая алканы[3].
- C4H9Cl+2HI→C4h20+HCl+I2{\displaystyle {\mathsf {C_{4}H_{9}Cl+2HI\rightarrow C_{4}H_{10}+HCl+I_{2}}}}
При действии HI на пентозы он все их превращает во вторичный иодистый амил: CH3CH22CH2CHICH3, а гексозы — во вторичный иодистый н-гексил[4]. Легче всего восстанавливаются иодпроизводные, некоторые хлорпроизводные не восстанавливаются вовсе. Третичные спирты восстанавливаются легче всего. Многоатомные спирты также реагируют в мягких условиях, часто давая вторичные иодалкилы[5].
HI при нагреве диссоциирует на водород и I2, что позволяет получать водород с низкими энергетическими затратами.
Физиологическое воздействие и токсикология[править | править код]
- Иодоводород — едкое, токсичное вещество. Обладает удушающим действием.
- При попадании на кожу иодоводородная кислота может вызвать ожоги.
- Предельно допустимая концентрация иодоводорода в воздухе рабочей зоны составляет 2 мг/м³.
- Согласно ГОСТ 12.1.007-76 йодистоводородная кислота относится к III классу опасности (умеренно-опасное химическое вещество).
- Ахметов Н. С. «Общая и неорганическая химия» М.:Высшая школа, 2001
- ↑ Рабинович В. А., Хавин З.Я Краткий химический справочник: Справ.изд.3 изд.- Л.:Химия, 1991. — 432с.
- ↑ Ксензенко В. И., Стасиневич Д. С. «Химия и технология брома, иода и их соедине-ний» М., Химия, 1995, −432с.
- ↑ Несмеянов А. Н., Несмеянов Н. А. «Начала органической химии т. 1» М., 1969 стр. 68
- ↑ Несмеянов А. Н., Несмеянов Н. А. «Начала органической химии т. 1» М., 1969 стр. 440
- ↑ «Препаративная органическая химия» М., Гос. н.т. изд-во хим. лит-ры, 1959 стр. 499 и В. В. Марковников Ann. 138, 364 (1866)
Водород — это… Что такое Водород?
| Внешний вид простого вещества | |
|---|---|
| Газ без цвета, запаха и вкуса | |
| Свойства атома | |
| Имя, символ, номер | Водород / Hydrogenium (H), 1 |
| Атомная масса (молярная масса) | 1,00794 а. е. м. (г/моль) |
| Электронная конфигурация | 1s1 |
| Радиус атома | 53 пм |
| Химические свойства | |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность | 2,20[1] (шкала Полинга) |
| Степени окисления | 1,0, −1 |
| Энергия ионизации (первый электрон) | 1311,3 (13,595) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ |
| Температура плавления | 14,01 K |
| Температура кипения | 20,28 K |
| Теплота плавления | 0,117 кДж/моль |
| Теплота испарения | 0,904 кДж/моль |
| Молярная теплоёмкость | 14,235[2] Дж/(K·моль) |
| Молярный объём | 14,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,780 c=6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Название представляет собой кальку с латинского: лат. Hydrogenium (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «порождающий воду». Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен[2]. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине.
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова .
Распространённость
Во Вселенной
Водород — самый распространённый элемент во Вселенной[3]. На его долю приходится около 92 % всех атомов (около 8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
В промышленности
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
В лаборатории
Физические свойства
 Спектр излучения водорода
Спектр излучения водорода 
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и параводорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Равновесная мольная концентрация пара-водородаРазделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Изотопы
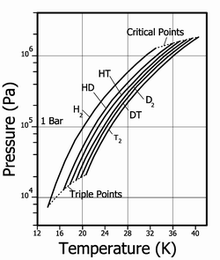 Давление пара для различных изотопов водорода
Давление пара для различных изотопов водородаВодород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[4]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет[4]. Тритий содержится в природе в очень малых количествах.
В литературе[4] также приводятся данные об изотопах водорода с массовыми числами 4—7 и периодами полураспада 10−22—10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[5].
| Температура плавления, K | Температура кипения, K | Тройная точка, K / kPa | Критическая точка, K / kPa | Плотность жидкий / газ, кг/м³ | |
|---|---|---|---|---|---|
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,6 / 12,8 | 35,91 / 1,48 | 114,0 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,23 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице[4][6].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)·10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1·10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)·10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)·10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Доля диссоциировавших молекул водородаМолекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
Он может «отнимать» кислород от некоторых оксидов, например:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
- , реакция протекает со взрывом в темноте и при любой температуре,
- , реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением[7]. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Меры предосторожности

Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объему. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако, следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг[8]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
Пищевая промышленность
- При производстве маргарина из жидких растительных масел.
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»). Входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.[источник не указан 658 дней]
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающую среду и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Интересные факты
- Хорватское название водорода — Vodik, ввёл в употребление филолог Богослав Шулек.
См. также
Примечания
- ↑ Hydrogen: electronegativities (англ.). Webelements. Проверено 15 июля 2010.
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 400—402. — 623 с. — 100 000 экз.
- ↑ Книга рекордов Гиннесса для химических веществ
- ↑ 1 2 3 4 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
- ↑ G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ Правилов А. М. Фотопроцессы в молекулярных газах. М.: Энергоатомиздат, 1992.
- ↑ Аркадий Шварц Снова о водороде Вестник online № 19(356) 15 сентября 2004
Литература
- Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. — М.: Издательство «Экзамен»,2005.
- Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
- Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006 ISBN 5-02-025114-3
Ссылки
Бромоводород — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2019; проверки требует 1 правка.| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм[1], 20,003 бар[2], 26,5 бар[2] и 40,7 бар[2] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Бро́моводоро́д (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
- h3+Br2→200−400oC,Pt2HBr{\displaystyle {\mathsf {H_{2}+Br_{2}{\xrightarrow {200-400^{o}C,Pt}}2HBr}}}
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
- PBr3+3h3O⟶h4PO3+3HBr{\displaystyle {\mathsf {PBr_{3}+3H_{2}O\longrightarrow H_{3}PO_{3}+3HBr}}}
- PBr5+4h3O⟶h4PO4+5HBr{\displaystyle {\mathsf {PBr_{5}+4H_{2}O\longrightarrow H_{3}PO_{4}+5HBr}}}
Восстановление брома несколькими способами:
- 3Br2+S+4h3O→100−150oCh3SO4+6HBr{\displaystyle {\mathsf {3Br_{2}+S+4H_{2}O{\xrightarrow {100-150^{o}C}}H_{2}SO_{4}+6HBr}}}
- Br2+KNO2+h3O→ KNO3+2HBr{\displaystyle {\mathsf {Br_{2}+KNO_{2}+H_{2}O{\xrightarrow {\ }}KNO_{3}+2HBr}}}
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
- KBr+h3SO4→h3OKHSO4+HBr↑{\displaystyle {\mathsf {KBr+H_{2}SO_{4}{\xrightarrow {H_{2}O}}KHSO_{4}+HBr\uparrow }}}
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
- HBr+h3O⇄Br−+h4O+ pK=−9{\displaystyle {\mathsf {HBr+H_{2}O\rightleftarrows Br^{-}+H_{3}O^{+}\ \ p{\mathit {K}}=-9}}}
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
- 2HBr⇄h3+Br2{\displaystyle {\mathsf {2HBr\rightleftarrows H_{2}+Br_{2}}}}
Как кислота реагирует с металлами, их оксидами, основаниями:
- 2HBr+Mg→ MgBr2+h3↑{\displaystyle {\mathsf {2HBr+Mg{\xrightarrow {\ }}MgBr_{2}+H_{2}\uparrow }}}
- 2HBr+CaO→ CaBr2+h3O{\displaystyle {\mathsf {2HBr+CaO{\xrightarrow {\ }}CaBr_{2}+H_{2}O}}}
- 2HBr+Ba(OH)2→ BaBr2+2h3O{\displaystyle {\mathsf {2HBr+Ba(OH)_{2}{\xrightarrow {\ }}BaBr_{2}+2H_{2}O}}}
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
- 4HBr+O2→τoC2Br2+2h3O{\displaystyle {\mathsf {4HBr+O_{2}{\xrightarrow {\tau ^{o}C}}2Br_{2}+2H_{2}O}}}
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.

Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
- ГОСТ 2062-77 Кислота бромистоводородная
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1966. — Т. 1. — 1072 с.
- Гринвуд Н., Эрншо А. Химия элементов. — Бином. Лаборатория знаний, 2008. — Т. 2. — 666 с.
- Неорганическая химия. В 3 т. / Под ред. Ю. Д. Третьякова. — М.: Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
- Ахметов Н. С. Общая и неорганическая химия: Учеб. для химико-технол. вузов. — 2-е изд., перераб. и доп. — М: Высш. шк., 1988. — 640 с., ил.

 (
( HO2 + OH−
HO2 + OH−
 (
( документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
 (
(