химия из нашей жизни / Хабр
Химия, изучаемая в школе, мне больше напоминала математику: вычисление валентности, массовой доли вещества, бесконечное составление формул химических реакций, и т.д. и т.п. Нет, эти знания полезны, но согласитесь, если ваша профессия не связана с химией, использовать их вы не будете, и они вскоре вовсе забудутся. Физику я любил потому, что явления, изученные на ней можно проследить и увидеть в реальной жизни: мы каждый день сталкиваемся со светом, звуком, агрегатными состояниями веществ, электричеством и тепловыми явлениями. Чем химия хуже? Ведь она тоже окружает нас ежедневно и постоянно используется в быту. Поэтому сегодня мы с точки зрения химии будем разбирать вещества, используемые всеми людьми, изучим их свойства и происхождение, поехали!
В статье: соль поваренная, сода пищевая, кислота лимонная, а также спирт этиловый и его действие на организм.
Соль
У всех людей есть химическая лаборатория, и имя ей кухня. Зайдем сюда. Здесь много интересных веществ, но первое, сразу бросающееся в глаза — конечно же поваренная соль, или говоря научным языком хлорид натрия (хим. формула NaCl) Разберем вещества, из которых она состоит:
формула NaCl) Разберем вещества, из которых она состоит:
Свой путь NaCl начинает с газа хлороводорода (HCl). Это очень токсичное вещество, вызывающее воспаление носоглотки и дыхательных путей, отек легких при попадании внутрь, ожоги на коже. 19 грамм хлороводорода убьёт среднестатистического человека. Однако HCl хорошо растворим в воде (500 объемов на 1 объем воды), в результате растворения получается соляная кислота (хим. формула та же). Не имеет цвета, прозрачна. Переходит в твердое состояние уже при -30°, кипит при 48°. Вещество все еще токсичное, вызывающее ожоги при попадании на кожу. Не смотря на это, содержится в желудке человека в концентрации 0,05%. HCl в желудке необходима для работы фермента пепсина, переваривающего белки, в свою очередь, для того чтобы соляная кислота не разъедала стенки желудка, в желудочном соке растворены гидрокарбонаты (соли угольной кислоты). HCl активное вещество — реагирует со всеми металлами, стоящими в ряду активности после водорода. Продукты реакции мы все прекрасно знаем — соли, получившие названия хлоридов.
Прежде чем рассмотреть сам хлорид натрия, познакомимся с еще одним элементом, его составляющим — натрием (Na). Натрий — светлосеребристый метал, отличающийся сильной пластичностью и мягкостью. В природе в чистом виде не существует, но содержится в соединениях некоторых минералов (как пример полевой шпат), и конечно же в хлориде натрия, в большом количестве растворенном в водах морей и океанов. Натрий легко окисляется до оксида натрия на воздухе, поэтому для хранения помещается в керосин. В организме человека содержится в межклеточной жидкости, совместно с калием используется для образования мышечных сокрашений, и некоторых других функций.
Давайте же теперь рассмотрим продукт реакции соляной кислоты и натрия — хлорид натрия.
NaCl представляет из себя твердое вещество, образующее прозрачные кристаллы. C° плавления — 800°, кипения — 1465°, плотность — 2,165 г/см куб. Как уже было упомянуто, в огромных количествах растворен в морской воде. Кроме того, составляет минерал галит, содержащийся в осадочных горных породах, по берегам соленых озер, а также на стенках кратеров вулканов. Галит входит в состав каменной соли — горной породы, впрочем на 90% состоящей из него. Вещество прозрачно, или имеет белый цвет, но часто окрашено глинами и оксидами железа. Помимо хлорида натрия содержит соли калия, кальция и магния. Хлорид натрия конечно же содержится и в морской соли, образующейся при выпаривании морской воды. Состоявляет однако только 77% от вещества, и помимо NaCl, в соли содержится хлорид магния MgCl2 и сульфат магния MgSO4, а также другие вещества. Каменная и морская соль, использующиеся в быту, носят название поваренной соли. Концентрация хлорида натрия в ней достигает от 97 до практически 100%, поэтому поваренная соль почти полностью чистое вещество — NaCl. Суточная доза соли, необходимая человеку в умеренном климате — в среднем 5 грамм, однако в более жарких условиях возрастает в несколько раз. Среднестатистический человек в день употребляет 13 грамм соли, поэтому у нас, живущих в достаточно прохладном климате, недостаток данного вещества в организме редкость.
Галит входит в состав каменной соли — горной породы, впрочем на 90% состоящей из него. Вещество прозрачно, или имеет белый цвет, но часто окрашено глинами и оксидами железа. Помимо хлорида натрия содержит соли калия, кальция и магния. Хлорид натрия конечно же содержится и в морской соли, образующейся при выпаривании морской воды. Состоявляет однако только 77% от вещества, и помимо NaCl, в соли содержится хлорид магния MgCl2 и сульфат магния MgSO4, а также другие вещества. Каменная и морская соль, использующиеся в быту, носят название поваренной соли. Концентрация хлорида натрия в ней достигает от 97 до практически 100%, поэтому поваренная соль почти полностью чистое вещество — NaCl. Суточная доза соли, необходимая человеку в умеренном климате — в среднем 5 грамм, однако в более жарких условиях возрастает в несколько раз. Среднестатистический человек в день употребляет 13 грамм соли, поэтому у нас, живущих в достаточно прохладном климате, недостаток данного вещества в организме редкость. NaCl необходима для водного обмена, поддержания концентрации соляной кислоты в желудке, для формирования костной и мышечной ткани.
NaCl необходима для водного обмена, поддержания концентрации соляной кислоты в желудке, для формирования костной и мышечной ткани.
Сода
Нет человека, не видевшего эту упаковкуЧто еще интересного есть на нашей кухне? Очевидно — сода. Это кстати тоже соль натрия, но только не хлорид, а гидрокарбонат, или кислая соль угольной кислоты (NaHCO3). Напомню, что кислые соли это вещества, в которых атомы водорода заменились на атомы метала в ходе хим. реакции лишь частично. Так, мы можем заметить наличие одного атома водорода в формуле соды.
Перед рассмотрением самого вещества, давайте ознакомимся с одним из его компонентов — угольной кислотой. Данная кислота образуется при растворении углекислого газа в воде. Формула — h3CO3. Достаточно неустойчивое соединение, однако образуемые кислотой соли вполне устойчивы. Выглядит как бесцветная жидкость, не отличающаяся от воды. В повседневной жизни встречается как газированная вода. Концентрация углекислого газа в газировке составляет от 0,2 до 0,4%. Теперь о самой соде. Гидрокарбонат натрия, повсеместно используемый в кулинарии представляет из себя кристаллический порошок белого цвета. Плотность — 2,165 г/см куб. В природе встречается как минерал нахколит в содовых озёрах. Одно из содовых озер — Селитряное расположилось в Забайкальском крае, недалеко от Читы. Бессточно, в озеро впадает лишь одна пересыхающая речка. Глубина 6,5 метра. Имеет очень большую минерализацию, главным образом представленную карбонатом, гидрокарбонатом и хлоридом натрия. До середины 20 века использовалось для добычи вышеупомянутых веществ, а сейчас является памятником природы. Сода реагрует со многими кислотами, в ходе реакции образуется соответствующая натриевая соль (например при реакции с соляной кислотой — знакомый нам хлорид натрия), а также угольная кислота, распадающаяся на угл. газ и воду.
Теперь о самой соде. Гидрокарбонат натрия, повсеместно используемый в кулинарии представляет из себя кристаллический порошок белого цвета. Плотность — 2,165 г/см куб. В природе встречается как минерал нахколит в содовых озёрах. Одно из содовых озер — Селитряное расположилось в Забайкальском крае, недалеко от Читы. Бессточно, в озеро впадает лишь одна пересыхающая речка. Глубина 6,5 метра. Имеет очень большую минерализацию, главным образом представленную карбонатом, гидрокарбонатом и хлоридом натрия. До середины 20 века использовалось для добычи вышеупомянутых веществ, а сейчас является памятником природы. Сода реагрует со многими кислотами, в ходе реакции образуется соответствующая натриевая соль (например при реакции с соляной кислотой — знакомый нам хлорид натрия), а также угольная кислота, распадающаяся на угл. газ и воду.
Лимонная кислота
Заглянем в холодильник. Что здесь есть интересного? Ну, например лимоны, а точнее их кислота — лимонная. Как и положено всем органическим соединениям, имеет вот такой «скромный» набор атомов в молекуле: C6H8O7. Может показаться, что лимонная кислота это жидкость, однако на самом деле это твердое вещество, в чистом виде представляющее кристаллы белого цвета.
Может показаться, что лимонная кислота это жидкость, однако на самом деле это твердое вещество, в чистом виде представляющее кристаллы белого цвета.
Плавится она лишь при температуре 153°. Поэтому в лимонах заключен раствор этой кислоты, ее растворимость очень высока: 133 грамма на 100 грамм воды! Как и любая другая кислота, лимонная образует соли — цитраты. Цитраты натрия, калия и кальция, образующие белые и прозрачные кристаллы, используются, как и сама лимонная кислота, в качестве пищевых добавок в промышленной кулинарии.
Этиловый спирт
Выйдем с кухни и достанем аптечку. Конечно, это еще целая химическая лаборатория с большим количеством интересных веществ, но нам интересно именно вещество под названием этиловый спирт (C2H5OH).
Бесцветная жидкость, с плотностью 0,78 т.е. чуть легче воды, плавится уже при -114° (поэтому с внутренним употреблением даже в самые сильные морозы где нибудь на Таймыре суровым полярником, проблем не возникает), закипает при 78°. Спирт горюч, продукты реакции горения — углекислый газ и вода. Конечно, часто находит употребление как растворитель и антисептик, но не менее широко известен как незаменимый компонент горячительных напитков, и именно из за него происходит процесс опьянения, давайте рассмотрим почему:
Спирт горюч, продукты реакции горения — углекислый газ и вода. Конечно, часто находит употребление как растворитель и антисептик, но не менее широко известен как незаменимый компонент горячительных напитков, и именно из за него происходит процесс опьянения, давайте рассмотрим почему:
Этиловый спирт или этанол всасывается в кровь в желудке и кишечнике. Он разрушительно действует на оболочки клеток эритроцитов, в результате они склеиваются, образуя тромбы, в том числе и в головном мозге, из за чего начинается легкое кислородное голодание. Помимо этого, этанол действует на нейроны в мозгу, заставляя вырабатывать дофамин, делающий человека веселым и активным. При увеличении дозы спиртного в мозге активируется гаммо-аминомасляная кислота, обладающая успокаивающим действием. Самые слабые могут уже заснуть на этой стадии. Последующее, и уже явно не желательное добавление дозы этанола просто «взрывает» нейроны, делая поведение человека или агрессивным, или удрученным, склонным к странным идеям и мыслям. К слову, количество принятого не всегда совпадает с количеством попавшего в кровь — еда, одновременно употребляемая со спиртным, препятствует его всасыванию в кровь, поэтому с виду благородное и безобидное шампанское в красивой упаковке без закуски в сравнительно небольшой дозе опьянит даже бывалого и крепкого мужчину на казалось бы культурном корпоративе, а гораздо большее количество водки, скажем с жирной курочкой (жир очень сильно препятствует всасыванию этанола в кровь, обволакивая стенки кишечника), может произвести совсем небольшой эффект. Поэтому мужики после работы спокойно посидели до вечера, попили водки и поели курицы, придя домой во вполне разумительном состоянии, а на корпоративе все начали буянить и попали в СИЗО (просто юмор, автор не склоняет к употреблению ни того, ни другого).
К слову, количество принятого не всегда совпадает с количеством попавшего в кровь — еда, одновременно употребляемая со спиртным, препятствует его всасыванию в кровь, поэтому с виду благородное и безобидное шампанское в красивой упаковке без закуски в сравнительно небольшой дозе опьянит даже бывалого и крепкого мужчину на казалось бы культурном корпоративе, а гораздо большее количество водки, скажем с жирной курочкой (жир очень сильно препятствует всасыванию этанола в кровь, обволакивая стенки кишечника), может произвести совсем небольшой эффект. Поэтому мужики после работы спокойно посидели до вечера, попили водки и поели курицы, придя домой во вполне разумительном состоянии, а на корпоративе все начали буянить и попали в СИЗО (просто юмор, автор не склоняет к употреблению ни того, ни другого).
Соляная кислота и ее соли
Урок в 8 классе по теме: Соляная кислота и её соли.
Цель: изучить химические свойства соляной кислоты, и рассмотреть области применения данной кислоты.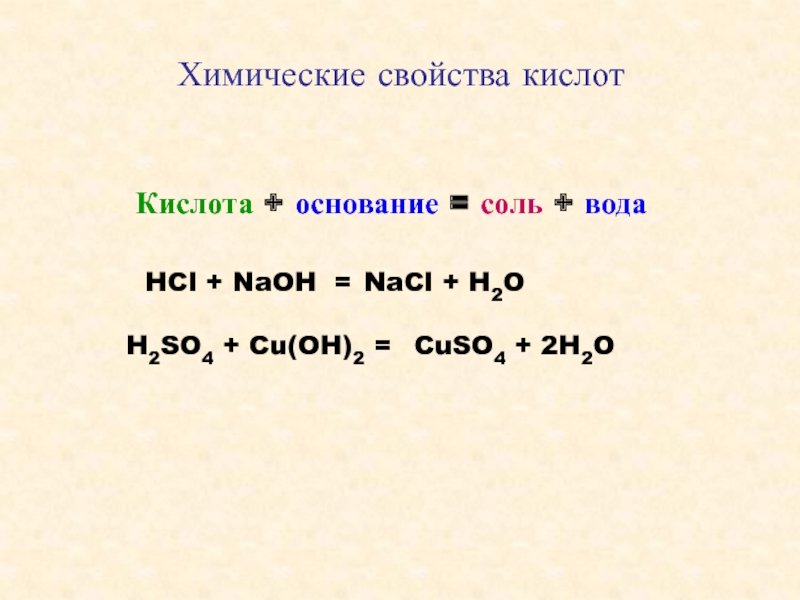
Задачи:
Образовательная — в процессе исследования изучить химические свойства соляной кислоты и познакомиться с качественной реакцией на хлорид ион.
Развивающая — развивать дальнейшие умения составлять уравнения химических реакций; учить сравнивать, обобщать, анализировать и делать выводы.
Воспитательная — развивать познавательную деятельность через эксперимент.
Тип урока: урок усвоения новых знаний.
Метод обучения: объяснительно-иллюстративный, проблемно-поисковый, практическая работа, использование ИКТ.
Организационные формы: беседа, практическая работа, сообщения учащихся.
Оборудование и реактивы: периодическая система химических элементов, таблица растворимости, штатив с пробирками, соляная кислота, гидроксид натрия, нитрат серебра, медь, магний, алюминий, синий лакмус, метилоранж, фенолфталеин.
Приёмы активизации мыслительной деятельности учащихся:
Анализ учебной информации.
Раскрытие межпредметных связей между химией, физикой, биологией.
Выдвижение гипотез.
Анализ и составление обобщающих выводов.
Ход урока.
Вступительное слово учителя:
Тема нашего урока «Соляная кислота и её свойства». (слайд 1)Девизом нашего урока будут слова Гёте:
« Просто знать — ещё не всё, знания нужно уметь использовать». (сл.2)
Вы должны будете показать, как умеете использовать свои знания в различных ситуациях. Сначала вспомним, что мы знаем о кислотах. Итак, первый вопрос:
Что такое кислота? (сложное вещество, состоящее из атомов водорода и кислотного остатка).
Сколько атомов водорода может быть в кислотах? Как их классифицируют по данному признаку? (одно-, двух-, трёхосновные). Приведите примеры.
Чем можно заместить водород? Что при этом получается? (металлами; соли).
Дайте определение солей. (Сложные вещества, состоящие из атомов металла и кислотного остатка).
Концентрированная соляная кислота (массовая доля хлороводорода составляет 37%) – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом вследствие выделения хлороводорода. (слайд.3 видео опыта «Свойства дымящей соляной кислоты»)
Получение соляной кислоты:
1.В промышленности получают сжиганием водорода в хлоре и растворением продукта реакции в воде.
2.В лаборатории H2SO4 +2NaCl →2HCl ↑ + Na2SO4
Этот газ легко растворяется в воде: до 450 объемов хлороводорода — в одном объеме воды. В пробирке образуется соляная кислота – раствор хлороводорода в воде.
В пробирке образуется соляная кислота – раствор хлороводорода в воде.
Химические свойства:
1) Изменение окраски индикатора (лакмус- красный)
2) Взаимодействует с металлами (если металл находится в ряду, составленном Н.Н.Бекетовым, до водорода, то выделяется водород и образуется соль.
Исключение HNO3 (выделяются другие газы)
Mg + 2HCl → MgCl2 + H2 2Al + 6HCl → 2AlCl3 + 3H2 Cu + HCl →
Практическая работа
3) Взаимодействует с основными и амфотерными оксидами:
MgO + 2HCl → MgCl2 + H2O ZnO + 2 HCl→ ZnCl2 + H2O
4) Взаимодействует с основаниями:
HCl + KOH → KCl + H2O 3HCl + Al(OH)3 → AlCl3 + 3H2O
5) Взаимодействует с солями (в соответствии с рядом кислот, каждая предыдущая кислота может вытеснить из соли последующую), образуется другая кислота и другая соль.
HNO3
H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3
────────────────────────►
H3PO4
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
6) Взаимодействует с нитратом серебра, выпадает осадок белого цвета, который не растворяется ни в воде, ни в кислотах.
HCl + AgNO3 → AgCl↓ + HNO3
Нитрат серебра является реактивом на соляную кислоту и её соли т.е. используется в качестве качественной реакции, для распознавания хлорид-ионов.
Практическая работа
7) Взаимодействует с окислителями (MnO2, KMO4
, KClO3)6HCl + KClO3 = KCl + 3H2O + 3Cl2↑
Вывод: во всех нами изученных реакциях получились хлориды- соли соляной кислоты.
Переходим к изучению солей соляной кислоты, которые называются хлориды.
Соли соляной кислоты- хлориды.
Получение:
1.Взаимодействием металлов с хлором.
2Fe + 3Cl2 → 2FeCl3
2. Взаимодействие соляной кислоты с металлами.
Mg + 2HCl → MgCl2 + H2
3.Взаимодействие соляной кислоты с оксидами
CaO + 2HCl → CaCl2 + H2O
4.Взаимодействие соляной кислоты с гидроксидами
Ba(OH)
5.Взаимодействие соляной кислоты с некоторыми солями
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl => 2Ag + Cl2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
Осуществите превращения по схеме:
HCl → Cl2 → AlCl3 →Al(OH)3 → Al2O3 →AlCl3 → Cl2
Zn, Cu, Al, MgO, SiO2, Fe2O3, NaOH, Al(OH)3, Fe2(SO4)3, CaCO3, Fe(NO3)3
Какие из указанных веществ будут реагировать с соляной кислотой. Составьте уравнения химических реакций
№3. Решите задачу:
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Д/З п. 49, задача 4-5 стр.169.
Рефлексия
Учитель (совместно с учащимися оценивает урок, принимает их предложения и пожелания).
Ребята, чему каждый из вас научился на сегодняшнем уроке?
Освоены ли вами понятия: «хлориды», «ингибитор», «качественная реакция»?
Были ли моменты непонимания?
Смогли ли мы их разрешить в ходе разговора? Назовите самые удачные ответы ваших товарищей.
Что вам понравилось или не понравилось на уроке и почему?
Учащиеся отвечают на вопросы, оценивают полноту полученных знаний, производят самооценку своей работы. Выявляют наиболее интересные и полноценные ответы, обосновывают свою точку зрения.
Выявляется степень выполнения учебных целей.
Соляная кислота, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Хлороводород | Encyclopedia.com
Свойства
Раннее открытие хлористого водорода
Получение и использование
Ресурсы
Хлористый водород представляет собой химическое соединение, состоящее из элементов водорода и хлора. Он легко растворяется в воде с образованием раствора, называемого соляной кислотой. Оба вещества имеют множество важных промышленных применений, в том числе в металлургии, производстве фармацевтических препаратов, красителей и синтетического каучука.Соляная кислота встречается в большинстве лабораторий, так как ее сильная кислая природа делает ее чрезвычайно полезным веществом в анализах и в качестве общей кислоты. Поскольку хлористый водород и соляная кислота так тесно связаны, их обычно обсуждают вместе.
Хлористый водород представлен химической формулой HCl. Это означает, что молекула хлористого водорода содержит один атом водорода и один атом хлора. При комнатной температуре (около 77°F [25°C]) и давлении в одну атмосферу хлороводород существует в виде газа.Следовательно, его обычно хранят под давлением в металлических контейнерах.
При комнатной температуре (около 77°F [25°C]) и давлении в одну атмосферу хлороводород существует в виде газа.Следовательно, его обычно хранят под давлением в металлических контейнерах.
Гораздо более удобным способом использования хлороводорода является растворение его в воде для образования раствора. Хлористый водород очень хорошо растворяется в воде, причем последняя растворяет в сотни раз больше собственного объема газообразного хлороводорода. Полученный раствор известен как соляная кислота, и ему обычно присваивается химическая формула HCl. Коммерческая соляная кислота обычно содержит 28-35% хлористого водорода по весу и обычно называется концентрированной соляной кислотой.Когда небольшое количество хлороводорода растворено в воде, раствор известен как разбавленная соляная кислота.
Хлористый водород представляет собой бесцветный негорючий газ с резким запахом. Газ конденсируется в жидкость при -121°F (-85°C) и замерзает в твердое состояние при -173,2°F (-114°C). Соляная кислота представляет собой бесцветную дымящуюся жидкость с раздражающим запахом. И хлористый водород, и соляная кислота вызывают коррозию, поэтому с ними нужно обращаться очень осторожно. Оба вещества сильно раздражают глаза и очень токсичны при вдыхании или проглатывании.Воздействие паров хлороводорода может повредить носовые проходы и вызвать кашель, пневмонию, головные боли и учащенное сердцебиение; смерть может наступить от воздействия уровней в воздухе, превышающих примерно 0,2%. Концентрированные растворы соляной кислоты вызывают ожоги и воспаление кожи. Химики всегда надевают защитные перчатки и защитные очки при использовании хлористого водорода или соляной кислоты и обычно работают в хорошо проветриваемом помещении, чтобы уменьшить воздействие паров.
И хлористый водород, и соляная кислота вызывают коррозию, поэтому с ними нужно обращаться очень осторожно. Оба вещества сильно раздражают глаза и очень токсичны при вдыхании или проглатывании.Воздействие паров хлороводорода может повредить носовые проходы и вызвать кашель, пневмонию, головные боли и учащенное сердцебиение; смерть может наступить от воздействия уровней в воздухе, превышающих примерно 0,2%. Концентрированные растворы соляной кислоты вызывают ожоги и воспаление кожи. Химики всегда надевают защитные перчатки и защитные очки при использовании хлористого водорода или соляной кислоты и обычно работают в хорошо проветриваемом помещении, чтобы уменьшить воздействие паров.
В то время как сухой газообразный хлористый водород довольно неактивен, влажный газообразный хлористый водород (и растворы соляной кислоты) реагируют со многими металлами.Следовательно, сухой газообразный хлористый водород можно хранить в металлических контейнерах, тогда как растворы высококоррозионной соляной кислоты необходимо хранить в кислотоупорных материалах, таких как керамика или стекло. Когда соляная кислота реагирует с металлами, обычно образуются газообразный водород и соединения, известные как хлориды металлов. Хлориды металлов образуются, когда металл вытесняет водород из хлороводорода. Например, металлический цинк растворяется в соляной кислоте с образованием газообразного водорода и хлорида цинка.И влажный хлористый водород, и соляная кислота также реагируют со многими соединениями, включая оксиды, гидроксиды и карбонаты металлов. Все это примеры основных соединений, которые нейтрализуют соляную кислоту и образуют хлориды металлов.
Когда соляная кислота реагирует с металлами, обычно образуются газообразный водород и соединения, известные как хлориды металлов. Хлориды металлов образуются, когда металл вытесняет водород из хлороводорода. Например, металлический цинк растворяется в соляной кислоте с образованием газообразного водорода и хлорида цинка.И влажный хлористый водород, и соляная кислота также реагируют со многими соединениями, включая оксиды, гидроксиды и карбонаты металлов. Все это примеры основных соединений, которые нейтрализуют соляную кислоту и образуют хлориды металлов.
Как и большинство кислот, хлороводород образует в воде ионы водорода. Это положительно заряженные атомы водорода, которые очень реакционноспособны и ответственны за то, что все кислоты ведут себя примерно одинаково. Поскольку все атомы водорода в хлороводороде превращаются в ионы водорода, соляную кислоту называют сильной кислотой.Азотная и серная кислоты являются другими примерами сильных кислот.
Средневековые алхимики впервые получили хлористый водород путем нагревания обыкновенной соли (хлорида натрия) с сульфатом железа. Немецкий химик Иоганн Глаубер (1604-1668) получил хлористый водород реакцией соли с серной кислотой, и это стало обычным методом удобного получения хлористого водорода в лаборатории. При пропускании газообразного хлористого водорода в воду образуется соляная кислота.
Немецкий химик Иоганн Глаубер (1604-1668) получил хлористый водород реакцией соли с серной кислотой, и это стало обычным методом удобного получения хлористого водорода в лаборатории. При пропускании газообразного хлористого водорода в воду образуется соляная кислота.
Поскольку хлороводород сначала получали из соли, соляную кислоту первоначально называли соляным спиртом.В коммерческих целях его также обычно называли соляной кислотой, от латинского muria, , что означает рассол или соленая вода. Соляная кислота растворяет многие вещества, и алхимики нашли эту кислоту очень полезной в своей работе. Например, его применяли для растворения нерастворимых руд, упрощая тем самым методы химического анализа для определения содержания металлов в рудах. Смесь соляной и азотной кислот (известная как царская водка) также стала очень полезной, поскольку это была единственная кислота, растворяющая золото.
Хлористый водород можно получить в промышленных масштабах реакцией соли с серной кислотой. Он также быстро образуется при температуре выше 482 ° F (250 ° C) в результате прямого соединения элементов водорода и хлора и образуется как побочный продукт при производстве хлорированных углеводородов. Соляную кислоту получают пропусканием газообразного хлористого водорода в воду.
Он также быстро образуется при температуре выше 482 ° F (250 ° C) в результате прямого соединения элементов водорода и хлора и образуется как побочный продукт при производстве хлорированных углеводородов. Соляную кислоту получают пропусканием газообразного хлористого водорода в воду.
И хлористый водород, и соляная кислота имеют множество важных практических применений. Они используются в производстве фармацевтических гидрохлоридов (водорастворимые лекарства, растворяющиеся при приеме внутрь), хлора и различных хлоридов металлов, в многочисленных реакциях органических (углеродсодержащих) соединений, а также в производстве пластмасс и текстиля.Соляная кислота используется для производства удобрений, красителей, искусственного шелка, пигментов для красок; при рафинировании пищевых масел и жиров; в гальванике, дублении кожи, рафинировании и обогащении руд, производстве мыла, добыче нефти, очистке металлов, а также в фотографической и резиновой промышленности.
Небольшие количества соляной кислоты встречаются в природе в выбросах действующих вулканов и в водах вулканических горных источников. Кислота также присутствует в пищеварительных соках, выделяемых железами стенки желудка, и поэтому является важным компонентом желудочного пищеварения.Когда в пищеварительной системе вырабатывается слишком много соляной кислоты, могут образовываться язвы желудка. Недостаточная секреция желудочной кислоты также может привести к проблемам с пищеварением.
Кислота также присутствует в пищеварительных соках, выделяемых железами стенки желудка, и поэтому является важным компонентом желудочного пищеварения.Когда в пищеварительной системе вырабатывается слишком много соляной кислоты, могут образовываться язвы желудка. Недостаточная секреция желудочной кислоты также может привести к проблемам с пищеварением.
См. также Кислоты и основания.
КНИГИ
Эмсли, Джон. Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд: Издательство Оксфордского университета, 2002.
Хейзерман, Д.Л. Изучение химических элементов и их соединений . Саммит Blue Ridge, Пенсильвания: Tab Publications, 1992.
Mahn, W.J. Справочник по химическим опасностям академической лаборатории . Нью-Йорк: Ван Ностранд Рейнхольд, 1991.
Зальцберг, Х.В. От пещерного человека до химика . Вашингтон, округ Колумбия: Американское химическое общество, 1991.
Sittig, M. Справочник по токсичным и опасным химическим веществам и канцерогенам . 3-е изд. Park Ridge, NJ: Noyes Publications, 1991.
3-е изд. Park Ridge, NJ: Noyes Publications, 1991.
ДРУГОЕ
Агентство по охране окружающей среды США: Сеть передачи технологий, веб-сайт Air Toxics .«Соляная кислота (хлористый водород)»
Университетский колледж Корка, химический факультет . «Хлористый водород»
Николас К. Томас
Преломление — Энциклопедия Нового Света
Соломинка, смоченная в цветном растворе, кажется сломанной из-за преломления света при переходе из раствора в воздух. Преломление — это изменение направления волны вследствие изменения ее скорости, наблюдаемое при переходе волны из одной среды в другую. Наиболее распространенным примером является преломление света, как это происходит при образовании радуги на небе или радужных полос, когда белый свет проходит через стеклянную призму. Преломлению подвергаются и другие виды волн, например, при переходе звуковых волн из одной среды в другую.
Преломлению подвергаются и другие виды волн, например, при переходе звуковых волн из одной среды в другую.
Преломление волн в среде количественно определяется так называемым показателем преломления (или показателем преломления ).Показатель преломления среды — это мера того, насколько скорость света (или других волн) уменьшается внутри среды по сравнению со скоростью света в вакууме или воздухе. Например, если образец стекла имеет показатель преломления 1,5, это означает, что скорость света, проходящего через стекло, в 1/1,5 = 0,67 {\ displaystyle 1/1,5 = 0,67} умножается на скорость света в вакууме или воздухе. .
На основе знаний о свойствах преломления и показателя преломления был разработан ряд приложений.Например, изобретение линз и телескопов-рефракторов основано на понимании преломления. Также знание показателя преломления различных веществ используется для оценки чистоты вещества или измерения его концентрации в смеси. При проверке зрения, проводимой офтальмологами или оптометристами, свойство рефракции лежит в основе метода, известного как рефрактометрия .
Пояснение
В оптике преломление происходит, когда световые волны распространяются из среды с определенным показателем преломления во вторую среду с другим показателем преломления.На границе сред фазовая скорость волны изменяется, она меняет направление, длина волны увеличивается или уменьшается, но частота остается постоянной. Например, световой луч будет преломляться, когда он входит и выходит из стекла. Понимание этой концепции привело к изобретению линз и телескопа-рефрактора.
Преломление световых волн в воде. Темный прямоугольник представляет фактическое положение карандаша в миске с водой. Светлый прямоугольник представляет видимое положение карандаша.Обратите внимание, что конец (X) выглядит так, как будто он находится в (Y), положение, которое значительно меньше, чем (X).
Преломление можно увидеть, глядя в чашу с водой. Воздух имеет показатель преломления около 1,0003, а вода имеет показатель преломления около 1,33. Если человек смотрит на прямой предмет, например, на карандаш или соломинку, который находится под наклоном частично в воде, кажется, что этот предмет изгибается у поверхности воды. Это происходит из-за искривления световых лучей при переходе из воды в воздух.Как только лучи достигают глаза, глаз прослеживает их обратно в виде прямых линий (линий взгляда). Линии обзора (показанные пунктирными линиями) пересекаются в более высоком положении, чем место, где исходят фактические лучи. Это приводит к тому, что карандаш кажется выше, а вода кажется более мелкой, чем она есть на самом деле. Глубина, которой кажется вода, если смотреть сверху, известна как кажущаяся глубина,
Это происходит из-за искривления световых лучей при переходе из воды в воздух.Как только лучи достигают глаза, глаз прослеживает их обратно в виде прямых линий (линий взгляда). Линии обзора (показанные пунктирными линиями) пересекаются в более высоком положении, чем место, где исходят фактические лучи. Это приводит к тому, что карандаш кажется выше, а вода кажется более мелкой, чем она есть на самом деле. Глубина, которой кажется вода, если смотреть сверху, известна как кажущаяся глубина,
На диаграмме справа показан пример преломления волн на воде.Рябь движется слева и проходит по более мелкой области, наклоненной под углом к фронту волны. Волны распространяются медленнее на мелководье, поэтому длина волны уменьшается, и волна изгибается на границе. Пунктирная линия представляет нормаль к границе. Пунктирная линия представляет исходное направление волн. Это явление объясняет, почему волны на береговой линии никогда не ударяются о береговую линию под углом. В каком бы направлении ни двигались волны в глубокой воде, они всегда преломляются к нормали, когда входят в более мелкую воду возле пляжа.
В каком бы направлении ни двигались волны в глубокой воде, они всегда преломляются к нормали, когда входят в более мелкую воду возле пляжа.
Преломление также отвечает за радугу и за расщепление белого света на радужный спектр, когда он проходит через стеклянную призму. Стекло имеет более высокий показатель преломления, чем воздух, и разные частоты света распространяются с разной скоростью (рассеивание), в результате чего они преломляются под разными углами, так что вы можете их видеть. Разные частоты соответствуют разным наблюдаемым цветам.
В то время как рефракция позволяет создавать красивые явления, такие как радуга, она также может создавать необычные оптические явления, такие как миражи и фата-моргана.Это связано с изменением показателя преломления воздуха в зависимости от температуры.
Преломление в плексигласовом (акриловом) блоке.Закон Снелла используется для расчета степени преломления света при переходе из одной среды в другую.
Недавно были созданы метаматериалы с отрицательным показателем преломления. С метаматериалами мы также можем получить явления полного преломления, когда волновые сопротивления двух сред совпадают. Отраженной волны нет.
С метаматериалами мы также можем получить явления полного преломления, когда волновые сопротивления двух сред совпадают. Отраженной волны нет.
Кроме того, поскольку рефракция может заставить объекты казаться ближе, чем они есть на самом деле, она позволяет воде увеличивать объекты. Во-первых, когда свет входит в каплю воды, он замедляется. Если поверхность воды не плоская, то свет изгибается в новый путь. Эта круглая форма изгибает свет наружу, и по мере его распространения изображение, которое вы видите, становится больше.
Показатель преломления
Показатель преломления (или показатель преломления ) среды представляет собой обратное отношение фазовой скорости (определенной ниже) волнового явления, такого как свет или звук, и фазовой скорости в эталонной среде (веществе, которое волна проходит).Чаще всего он используется в контексте света с вакуумом в качестве эталонной среды, хотя исторически были распространены другие эталонные среды (например, воздух при стандартном давлении и температуре). Обычно ему присваивается символ n, . В случае света он равен
Обычно ему присваивается символ n, . В случае света он равен
- n=ϵr до н.э. ;r{\displaystyle n={\sqrt {\epsilon _{r}\mu _{r}}}},
, где ε r — относительная диэлектрическая проницаемость материала (как материал влияет на электрическую поле), а μ r — его относительная проницаемость (как материал реагирует на магнитное поле).Для большинства материалов μ r очень близко к 1 на оптических частотах, поэтому n приблизительно равно ϵr {\ displaystyle {\ sqrt {\ epsilon _ {r}}}}. n может быть меньше 1, и это имеет практические технические применения, такие как эффективные зеркала для рентгеновских лучей на основе полного внутреннего отражения.
Фазовая скорость определяется как скорость, с которой любая часть сигнала перемещается в пространстве; то есть скорость, с которой движется фаза сигнала.Групповая скорость — это скорость распространения огибающей формы волны; то есть скорость изменения амплитуды (максимальное движение вверх и вниз) формы волны. Именно групповая скорость, скорость, с которой гребни и впадины волны движутся в пространстве, (почти всегда) представляет собой скорость, с которой информация (и энергия) может передаваться волной, — например, скорость, с которой импульс света распространяется по оптическому волокну.
Именно групповая скорость, скорость, с которой гребни и впадины волны движутся в пространстве, (почти всегда) представляет собой скорость, с которой информация (и энергия) может передаваться волной, — например, скорость, с которой импульс света распространяется по оптическому волокну.
Скорость света
Преломление света на границе двух сред с разными показателями преломления, при n 2 > n 1 .Во второй среде скорость меньше (v 2 1 ), поэтому угол преломления θ 2 меньше угла падения θ 1 ; то есть луч в среде с более высоким индексом ближе к нормали.Скорость всего электромагнитного излучения в вакууме одинакова, примерно 3×10 8 метров в секунду, и обозначается c . Следовательно, если v — фазовая скорость излучения определенной частоты в конкретном материале, показатель преломления определяется выражением
- n = cv {\ displaystyle n = {\ frac {c} {v}}}.

Обычно это число больше единицы: чем выше индекс материала, тем сильнее замедляется свет. Однако на определенных частотах (например, рентгеновские лучи) n на самом деле будет меньше единицы. Это не противоречит теории относительности, согласно которой ни один несущий информацию сигнал никогда не может распространяться быстрее, чем c, , потому что фазовая скорость не совпадает с групповой скоростью или скорость сигнала не совпадает с групповой скоростью, за исключением случаев, когда волна проходит через поглощающую среду.
Иногда определяют «показатель преломления групповой скорости», обычно называемый групповым показателем :
- ng = cvg {\ displaystyle n_ {g} = {\ frac {c} {v_ {g}}}}
, где v g — групповая скорость. Это значение не следует путать с n, , которое всегда определяется относительно фазовой скорости.
В микромасштабе фазовая скорость электромагнитной волны замедляется в материале, потому что электрическое поле создает возмущение в зарядах каждого атома (в первую очередь электронов), пропорциональное (отношение ау = кх {\ displaystyle y = kx}) к диэлектрическая проницаемость. Заряды, как правило, колеблются немного не в фазе относительно управляющего электрического поля. Таким образом, заряды излучают собственную электромагнитную волну той же частоты, но с фазовой задержкой. Макроскопическая сумма всех таких вкладов в материале представляет собой волну с той же частотой, но меньшей длиной волны, чем исходная, что приводит к замедлению фазовой скорости волны. Большая часть излучения колеблющихся материальных зарядов модифицирует приходящую волну, изменяя ее скорость.Однако некоторая чистая энергия будет излучаться в других направлениях (см. рассеяние).
Заряды, как правило, колеблются немного не в фазе относительно управляющего электрического поля. Таким образом, заряды излучают собственную электромагнитную волну той же частоты, но с фазовой задержкой. Макроскопическая сумма всех таких вкладов в материале представляет собой волну с той же частотой, но меньшей длиной волны, чем исходная, что приводит к замедлению фазовой скорости волны. Большая часть излучения колеблющихся материальных зарядов модифицирует приходящую волну, изменяя ее скорость.Однако некоторая чистая энергия будет излучаться в других направлениях (см. рассеяние).
Если известны показатели преломления двух материалов для данной частоты, то по закону Снеллиуса можно вычислить угол, на который будет преломляться излучение этой частоты при переходе от первого материала ко второму.
Отрицательный показатель преломления
Недавние исследования также продемонстрировали существование отрицательного показателя преломления, которое может иметь место, если ε и μ являются одновременно отрицательными. Не считается естественным, это может быть достигнуто с помощью так называемых метаматериалов. Он предлагает возможность создания идеальных линз и других экзотических явлений, таких как обращение закона Снеллиуса.
Не считается естественным, это может быть достигнуто с помощью так называемых метаматериалов. Он предлагает возможность создания идеальных линз и других экзотических явлений, таких как обращение закона Снеллиуса.
Список показателей преломления
Многие материалы имеют хорошо охарактеризованные показатели преломления, но эти показатели сильно зависят от частоты света. Поэтому любое числовое значение индекса не имеет смысла, если не указана соответствующая частота.
Существуют также более слабые зависимости от температуры, давления/напряжения и т. д., а также от точного состава материала.Однако для многих материалов и типичных условий эти вариации находятся на уровне процентов или меньше. Поэтому особенно важно указать источник для измерения индекса, если требуется точность.
В общем случае показатель преломления представляет собой комплексное число, имеющее как действительную, так и мнимую части, где последняя указывает на силу потерь поглощения на определенной длине волны — поэтому мнимую часть иногда называют коэффициентом экстинкции k. Такие потери становятся особенно значительными, например, в металлах при коротких длинах волн (таких как видимый свет) и должны быть включены в любое описание показателя преломления.
Такие потери становятся особенно значительными, например, в металлах при коротких длинах волн (таких как видимый свет) и должны быть включены в любое описание показателя преломления.
Рассеивание и абсорбция
В реальных материалах поляризация не мгновенно реагирует на приложенное поле. Это вызывает диэлектрические потери, которые могут быть выражены диэлектрической проницаемостью, которая является комплексной и зависит от частоты. Реальные материалы также не являются идеальными изоляторами, а это означает, что они имеют ненулевую проводимость постоянного тока (DC). Принимая во внимание оба аспекта, мы можем определить комплексный показатель преломления:
Здесь n — показатель преломления, указывающий фазовую скорость, а κ — коэффициент экстинкции, который указывает величину потери поглощения, когда электромагнитная волна распространяется через материал.И n , и κ зависят от частоты.
Эффект, заключающийся в том, что n изменяется в зависимости от частоты (за исключением вакуума, где все частоты c распространяются с одинаковой скоростью), известен как дисперсия, и это то, что заставляет призму делить белый свет на составляющие его спектральные цвета, именно так образуются радуги в дождь или туман. Дисперсия также является причиной хроматических аберраций в объективах.
Дисперсия также является причиной хроматических аберраций в объективах.
Поскольку показатель преломления материала зависит от частоты (и, следовательно, длины волны) света, обычно указывается соответствующая длина волны в вакууме, при которой измеряется показатель преломления.Как правило, это делается на различных четко определенных спектральных линиях излучения; например, n D — это показатель преломления на линии Фраунгофера «D», центре желтого двойного излучения натрия на длине волны 589,29 нм.
Уравнение Селлмейера — это эмпирическая формула, которая хорошо работает при описании дисперсии, а коэффициенты Селлмейера часто указываются в таблицах вместо показателя преломления. Некоторые репрезентативные показатели преломления на разных длинах волн см. в списке показателей преломления.
Как показано выше, диэлектрические потери и ненулевая проводимость по постоянному току в материалах вызывают поглощение. Хорошие диэлектрические материалы, такие как стекло, имеют чрезвычайно низкую проводимость по постоянному току, а на низких частотах диэлектрические потери также незначительны, что приводит к почти полному отсутствию поглощения (κ ≈ 0). Однако на более высоких частотах (таких как видимый свет) диэлектрические потери могут значительно увеличить поглощение, уменьшая прозрачность материала для этих частот.
Однако на более высоких частотах (таких как видимый свет) диэлектрические потери могут значительно увеличить поглощение, уменьшая прозрачность материала для этих частот.
Действительная и мнимая части комплексного показателя преломления связаны соотношением Крамерса-Кронига.Например, можно определить полный комплексный показатель преломления материала как функцию длины волны из спектра поглощения материала.
Двулучепреломление
Кристалл кальцита, лежащий на бумаге, с некоторыми буквами, показывающими двойное лучепреломление.Показатель преломления некоторых сред может различаться в зависимости от поляризации и направления распространения света в среде. Это известно как двойное лучепреломление и описано в области кристаллооптики.
Нелинейность
Сильное электрическое поле света высокой интенсивности (например, излучение лазера) может вызывать изменение показателя преломления среды при прохождении через нее света, что приводит к возникновению нелинейной оптики. Если показатель изменяется квадратично с полем (линейно с интенсивностью), это называется оптическим эффектом Керра и вызывает такие явления, как самофокусировка и фазовая самомодуляция. Если индекс изменяется линейно с полем (что возможно только в материалах, не обладающих инверсионной симметрией), это называется эффектом Поккельса.
Если показатель изменяется квадратично с полем (линейно с интенсивностью), это называется оптическим эффектом Керра и вызывает такие явления, как самофокусировка и фазовая самомодуляция. Если индекс изменяется линейно с полем (что возможно только в материалах, не обладающих инверсионной симметрией), это называется эффектом Поккельса.
Неоднородность
Линза с градиентным показателем преломления с параболическим изменением показателя преломления (n) с радиальным расстоянием (x) .Линза фокусирует свет так же, как и обычная линза. Если показатель преломления среды не является постоянным, а постепенно изменяется в зависимости от положения, материал известен как среда с градиентным показателем преломления и описывается оптикой с градиентным показателем. Свет, проходящий через такую среду, может быть искривлен или сфокусирован, и этот эффект можно использовать для изготовления линз, некоторых оптических волокон и других устройств. Некоторые распространенные миражи вызваны пространственно изменяющимся показателем преломления воздуха.
приложений
Показатель преломления материала является наиболее важным свойством любой оптической системы, использующей свойство преломления.Он используется для расчета фокусирующей способности линз и рассеивающей способности призм.
Поскольку показатель преломления является фундаментальным физическим свойством вещества, его часто используют для идентификации конкретного вещества, подтверждения его чистоты или измерения его концентрации. Показатель преломления используется для измерения твердых тел (очки и драгоценные камни), жидкостей и газов. Чаще всего он используется для измерения концентрации растворенного вещества в водном растворе. Рефрактометр — это прибор, используемый для измерения показателя преломления.Для раствора сахара показатель преломления можно использовать для определения содержания сахара.
В медицине, в частности в офтальмологии и оптометрии, метод рефрактометрии использует свойство преломления для проведения проверки зрения. Это клинический тест, в котором используется фороптер для определения аномалии рефракции глаза и, исходя из этого, назначаются лучшие корректирующие линзы. Представлен ряд тестовых линз с разной оптической силой или фокусным расстоянием, чтобы определить, какие из них обеспечивают наиболее четкое и четкое зрение.
Это клинический тест, в котором используется фороптер для определения аномалии рефракции глаза и, исходя из этого, назначаются лучшие корректирующие линзы. Представлен ряд тестовых линз с разной оптической силой или фокусным расстоянием, чтобы определить, какие из них обеспечивают наиболее четкое и четкое зрение.
Альтернативное значение: Рефракция в металлургии
В металлургии термин преломление имеет другое значение. Это свойство металлов, которое указывает на их способность противостоять нагреву. Металлы с высокой степенью преломления относятся к тугоплавким . Эти металлы имеют высокие температуры плавления из-за сильных межатомных сил, которые участвуют в металлических связях. Для преодоления этих сил требуется большое количество энергии.
Примеры тугоплавких металлов включают молибден, ниобий, вольфрам и тантал.Карбид гафния — самое тугоплавкое известное бинарное соединение с температурой плавления 3890 градусов C. [1] [2]
См.
 также
такжеСсылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Фишбейн, Пол М. и др. 2005. Физика для ученых и инженеров, 3-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education. ISBN 0131418815.
Внешние ссылки
Все ссылки получены 27 июля 2019 г.
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Каковы общие области применения соляной кислоты в промышленности?
Соляная кислота или «HCL», или широко известная как соляная кислота, используется в широком спектре промышленных и коммерческих приложений. Для людей, которые работают в отраслях, где используется это химическое вещество, важно понимать, как обычно используется соляная кислота, для каких целей она служит, и что вам нужно знать, чтобы обращаться с ней безопасно и ответственно.
Соляная кислота представляет собой жидкую версию хлороводорода, кислого газа.Это происходит в природе, а также производится в промышленных масштабах. Хотя это может быть коррозионная и опасная жидкость, HCL естественным образом встречается в наших телах.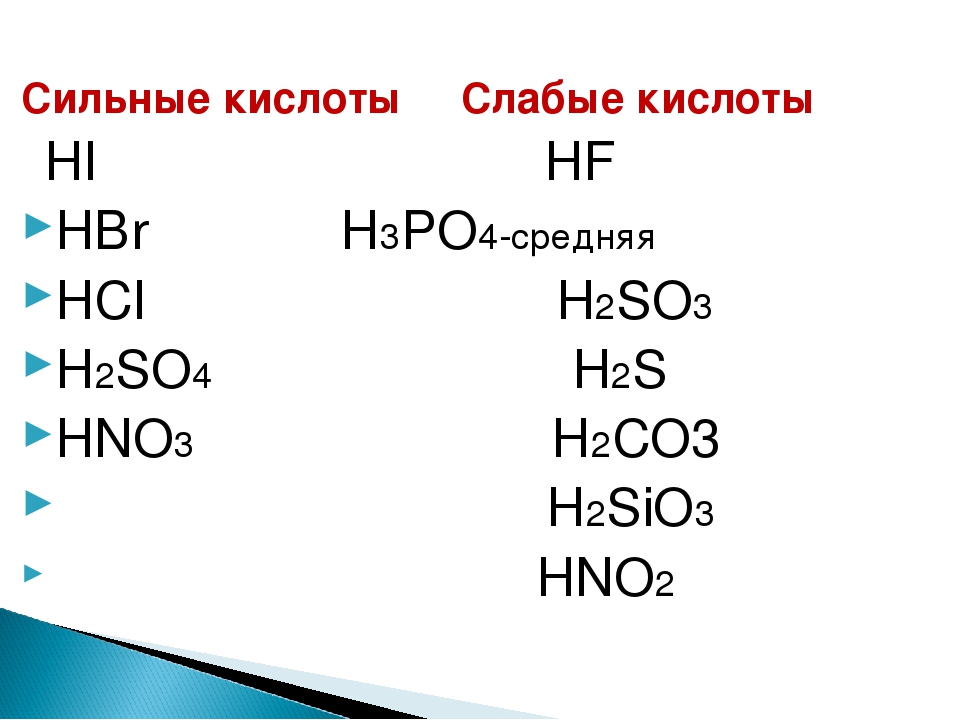 Это химическое вещество используется в нашей пищеварительной системе, регулируется слизью в слизистой оболочке желудка, а также гормоном секретином.
Это химическое вещество используется в нашей пищеварительной системе, регулируется слизью в слизистой оболочке желудка, а также гормоном секретином.
В жидкой форме HCL вызывает коррозию и издает резкий раздражающий запах. Система идентификации опасностей Национальной ассоциации противопожарной защиты классифицирует промышленные вещества на основе различных факторов риска и ранжирует каждую область риска от 0 до 4.Оценка 0 означает, что материал не содержит угрозы, а оценка 4 означает опасность для жизни. Рейтинг NFPA HCL:
- Риск для здоровья: 3 (крайняя опасность)
- Воспламеняемость: 0 (не горит при нормальных условиях)
- Стабильность: 1 (обычно стабилен, но может стать нестабильным при повышенных температурах и давлениях)
Любой, кто взаимодействует с соляной кислотой, должен знать об этих факторах, потому что надлежащая защита и локализация жизненно важны. Имейте в виду, что надлежащие процедуры обращения с соляной кислотой варьируются от отрасли к отрасли, но всегда следует следовать передовым отраслевым практикам.
Имейте в виду, что надлежащие процедуры обращения с соляной кислотой варьируются от отрасли к отрасли, но всегда следует следовать передовым отраслевым практикам.
Итак, как же HCL используется в различных отраслях промышленности?
HCL используется в производстве ПВХ
Поливинилхлорид (ПВХ) устойчив к коррозии соляной кислотой, что является одной из основных причин, по которой ПВХ используется для многих аспектов удержания и транспортировки HCL. HCL можно использовать для производства органических соединений, которые затем используются для производства ПВХ.
Регулирование уровня pH
Подобно тому, как соляная кислота регулирует уровень pH в нашем желудке, ее также можно использовать для регулирования уровня pH в расходных материалах и лекарствах. Он может способствовать балансу pH нашей питьевой воды, продуктов питания и фармацевтических препаратов.
Безопасность для плавательного бассейна
Соляная кислота является одним из химических веществ, которые играют роль в поддержании безопасного уровня pH для пловцов в общественных и частных бассейнах.
Очистка соли
При добавлении к хлориду натрия HCL запускает процесс очистки, в результате которого получается безопасная и пригодная к употреблению поваренная соль.
Травильная сталь
Металлурги используют HCL для процесса травления, который удаляет ржавчину со стали как в рулонах, так и в виде листов.
Обработка кожи
Соляная кислота является одним из веществ, используемых в процессе дубления кожи. Кожевенные заводы используют HCL, чтобы остановить развитие бактерий и поддерживать надлежащий уровень pH кожи.
Иониты регенерирующие
Это важный шаг в обеспечении безопасности на воде. По сути, HCL способствует процессу удаления ионизированных частиц из воды.Любой, кто купил деионизированную воду, выиграл от роли HCL в процессе ионного обмена.
Управление сточными водами
Помимо обработки питьевой воды, соляная кислота используется для производства неорганических соединений, используемых при обработке наших сточных вод.
Добыча нефти
HCL используется в процессе гидроразрыва пласта и во многих процессах добычи газа и нефти для подкисления скважины для удаления карбонатных резервуаров или известняков из породы или в сочетании с другими материалами для растворения кварца, песка и глины в породах.Другие добавки могут быть введены в скважину, чтобы кислота не разрушала стальные обсадные трубы.
Пищевая промышленность использует
Несколько добавок, используемых в пищевой промышленности, включают HCL в процессе разработки. К ним относятся фруктоза, лимонная кислота и гидролизованный растительный белок.
Этот список демонстрирует, что HCL можно использовать для самых разных целей, о которых большинство людей даже не подумали бы. Многие из этих применений довольно безобидны, хотя сама соляная кислота звучит пугающе.Самое главное, чтобы существовали надлежащие процедуры для использования HCL в каждом из этих процессов.
Кислоты и основания I: Введение
В этой статье будет рассмотрено следующее:
Определения:
Разные ученые по-разному определяют кислоты и основания. Вы, наверное, слышали о трех наиболее распространенных: Аррениус, Льюис и Бренстед-Лоури.
Вы, наверное, слышали о трех наиболее распространенных: Аррениус, Льюис и Бренстед-Лоури.
Аррениус Определение: При растворении в воде кислота отдает в раствор Н+, а основание отдает в раствор ОН-.
Льюис Определение: Кислота принимает пару электронов, основание отдает пару электронов.
Я Бренстед-Лоури: при растворении кислота отдает раствору Н+, а основание отдает раствору ОН-.
Как видите, определения Аррениуса и Бренстеда-Лоури в основном одинаковы, с той лишь разницей, что определение Аррениуса требует, чтобы растворителем была вода, а определение BL — нет. Скорее всего, вам придется определить, какая кислота или основание относится к каждому определению.
Сильные и слабые кислоты и основания:
Существуют две классификации, сравнивающие силы кислот и оснований, слабые и сильные. Обычно считается 6 сильных кислот и 6 сильных оснований.
Эти кислоты будут полностью ионизированы в растворе, или, другими словами, если вы растворите 1 моль соляной кислоты HCl в воде, будет 1 моль ионов H+ и 1 моль ионов Cl-. То же самое справедливо и для любого из оснований: 1 моль КОН, растворенный в воде, дает 1 моль ионов калия и 1 моль гидроксид-ионов.Однако будьте осторожны, следите за стехиометрией. Из 1 моля H3SO4 образуется 2 моля ионов водорода и 1 моль сульфат-ионов.
То же самое справедливо и для любого из оснований: 1 моль КОН, растворенный в воде, дает 1 моль ионов калия и 1 моль гидроксид-ионов.Однако будьте осторожны, следите за стехиометрией. Из 1 моля H3SO4 образуется 2 моля ионов водорода и 1 моль сульфат-ионов.
С другой стороны, слабые кислоты и основания не диссоциируют на 100%. Степень их ионизации зависит от конкретной слабой кислоты или основания и обозначается значением Ka. «Более сильное» слабое основание может диссоциировать на 30% или 40%, а «более слабое» слабое основание может диссоциировать только на 10%, 1% или даже меньше. Для слабой кислоты, которая диссоциирует только на 10%, мы могли бы представить себе раствор воды с 10 растворенными в ней молекулами уксусной кислоты (Ch4COOH).Если диссоциирует только 10%, то значит в растворе будет 9 молекул Ch4COOH, 1 молекула Ch4COO- и 1 молекула H+.
Основные вещества:
Когда задают вопрос о том, какие основные вещества присутствуют в растворе, речь идет о том, какие соединения в значительной степени диссоциируют на ионы. Например, если бы вы растворяли поваренную соль в воде, основными ее компонентами были бы Na+, Cl- и h3O. Та же концепция применима к кислотам и основаниям — если бы вы растворили HCl в воде, основными частицами были бы H+, Cl- и h3O.Однако что, если вместо HCl вопрос будет задан об уксусной кислоте Ch4COOH? Поскольку это слабая кислота, она лишь частично диссоциирует. Из-за этого в растворе у вас будет вода, Ch4COO-, H+, а также Ch4COOH еще в кислой форме.
Например, если бы вы растворяли поваренную соль в воде, основными ее компонентами были бы Na+, Cl- и h3O. Та же концепция применима к кислотам и основаниям — если бы вы растворили HCl в воде, основными частицами были бы H+, Cl- и h3O.Однако что, если вместо HCl вопрос будет задан об уксусной кислоте Ch4COOH? Поскольку это слабая кислота, она лишь частично диссоциирует. Из-за этого в растворе у вас будет вода, Ch4COO-, H+, а также Ch4COOH еще в кислой форме.
Какие компоненты являются основными, а какие второстепенными? В качестве быстрого трюка, который работает в большинстве случаев, вы можете предположить, что сильные кислоты будут диссоциировать на основные виды, в то время как слабые кислоты будут диссоциировать на второстепенные виды. Используя пример с уксусной кислотой, это означает, что основными частицами будут вода и Ch4COOH, а второстепенными продуктами будут Ch4COO- и H+.
Конъюгированные кислоты и конъюгированные основания:
Конъюгированные кислота и основание просто означают дополнение основания или кислоты соответственно. Возьмем равновесие муравьиной кислоты (HCOOH) в воде:
Возьмем равновесие муравьиной кислоты (HCOOH) в воде:
Легче всего начать с компонента, который, как вы знаете, является кислотой или основанием, в данном случае муравьиной кислоты. Мы обозначим HCOOH как кислоту. Поскольку это кислотно-щелочная реакция, мы знаем, что должно быть основание, чтобы принять водород, отдаваемый кислотой, поэтому мы можем обозначить воду как основание.
Теперь перейдем к другой стороне уравнения, где у нас есть h4O+ и HCOO-. Поскольку это равновесие, реакция протекает как в прямом, так и в обратном направлении, поэтому в правой части уравнения также имеет место кислотно-щелочная реакция. Однако мы также не классифицируем их как кислоты или основания, вместо этого они обозначаются как сопряженная кислота и сопряженная основа . Сопряженная кислота отдаст протон и станет основанием, а сопряженное основание примет протон и станет кислотой.
Обратите внимание, что кислота сочетается с сопряженным основанием, а основание — с сопряженной кислотой (не кислота с сопряженной кислотой, а основание с сопряженным основанием). В этом примере сопряженным основанием будет HCOO-, а сопряженной кислотой будет h4O+.
В этом примере сопряженным основанием будет HCOO-, а сопряженной кислотой будет h4O+.
Вода и кВт:
В нейтральном растворе концентрация ионов водорода равна концентрации ионов гидроксида. Вода обычно считается нейтральной, а KW используется для демонстрации кислотности воды.KW имеет значение 1,0×10-14 и равно концентрации ионов водорода, умноженной на концентрацию ионов гидроксида:
Раствор чистой воды при идеальных условиях всегда будет иметь равные части H+ и OH- для поддержания стехиометрии, таким образом, [h4O+] = [OH-], поэтому KW = [h4O+]2 = [OH-]2. Находя концентрацию иона гидроксония или гидроксид-иона, мы берем квадратный корень из KW, 1,0×10-14, и находим, что они оба равны 1,0×10-7. Это наш базовый уровень. Если концентрация ионов водорода превышает это значение, раствор будет кислым.Если концентрация ионов гидроксида превышает это значение, т. е. концентрация ионов водорода падает ниже этого числа, то раствор будет щелочным.
Обратите внимание, что при других условиях KW больше не будет равняться 1,0×10-14, а концентрации гидроксида и водорода больше не будут эквивалентны.
рН и основные расчеты:
Мы не можем обсуждать кислоты и основания, не говоря о рН. pH измеряет кислотность/основность раствора. Растворы с рН ниже 7 считаются кислыми, а растворы с рН выше 7 считаются щелочными.Само число pH — это просто более простой способ обозначить концентрацию ионов водорода. На самом деле «p» можно перевести как «-log()». Следовательно, pH можно преобразовать в –log(H), где H — это просто концентрация ионов водорода. Этот трюк с –log() можно использовать и в других случаях, например, pOH pKa.
Если концентрация водорода составляет 1,0×10-7, pH = -log(1,0×10-7) = 7,0. Если концентрация составляет 1,0×10-2, рН = 2,0.
pH + pOH = 14. Вы, вероятно, встретите вопрос, который либо требует от вас рассчитать pOH, либо использовать pOH для расчета чего-то еще.Единственное изменение, которое вам нужно сделать, это использовать концентрацию гидроксида вместо конкреции водорода, которую можно найти либо с помощью приведенного выше уравнения Kw, либо уравнения, приведенного в начале этого абзаца.
Опасности, связанные с соляной кислотой, и советы по технике безопасности
Что такое соляная кислота и где ее найти?Соляная кислота звучит как страшное вещество, и на самом деле это может быть так. Однако вы можете быть удивлены, узнав, что соляная кислота является обычной жидкостью, используемой в нескольких отраслях промышленности по всему миру.Ежегодно в мире производится около 20 миллионов тонн соляной кислоты, и вы можете найти ее даже у себя дома! Эти советы по безопасности при работе с соляной кислотой помогут вам безопасно и правильно обращаться с этим токсичным веществом, независимо от того, сталкиваетесь ли вы с ним дома или на рабочем месте.
Соляная кислота, ее применение и свойства Соляная кислота представляет собой водорастворимую жидкость от бесцветной до светло-желтой с резким раздражающим запахом. Произведенная еще в 16 ом веке, соляная кислота была исторически известна как « спирты соли» и иногда называлась соляной кислотой . Он используется для различных целей и доступен в концентрациях от 10 до 34 процентов в зависимости от области применения. Соляная кислота используется для:
Он используется для различных целей и доступен в концентрациях от 10 до 34 процентов в зависимости от области применения. Соляная кислота используется для:
- Травление стали
- Производство органических соединений (для ПВХ, активированного угля, аскорбиновой кислоты и фармацевтических препаратов)
- Производство химикатов для обработки воды
- Регулирование рН воды
- Обработка кожи
- Очистка соли
- Бытовые чистящие средства
- Строительство зданий
- Кислотная обработка нефтяных скважин
- Производство желатиновых продуктов
Соляная кислота является опасной жидкостью, которую следует использовать с осторожностью.Сама кислота вызывает коррозию, а концентрированные формы выделяют кислотные туманы, которые также опасны. При попадании кислоты или тумана на кожу, глаза или внутренние органы повреждение может быть необратимым, а в тяжелых случаях даже смертельным. Необходимо использовать средства индивидуальной защиты.
Необходимо использовать средства индивидуальной защиты.
Безопасность имеет первостепенное значение при работе с опасными химическими веществами, такими как соляная кислота. Агентство по охране окружающей среды регулирует соляную кислоту как токсичное вещество, и с ней следует обращаться соответствующим образом.При использовании соляной кислоты любой концентрации рекомендуется носить следующие средства защиты:
- Парозащитный респиратор
- Резиновые перчатки
- Сапоги
- Полный костюм
- Маска для лица
При использовании соляной кислоты на рабочем месте настоятельно рекомендуется иметь доступ к устройству для промывания глаз на случай случайного воздействия. Вам также следует ознакомиться со всей информацией о паспортах безопасности соляной кислоты, прежде чем вступать в контакт.
При использовании бытовых чистящих средств на основе соляной кислоты в вашем доме строго следуйте указаниям на этикетке и инструкциям по технике безопасности. (Обычно рекомендуется сначала разбавить очиститель, чтобы уменьшить его концентрацию.) При использовании разбавленной кислоты по-прежнему важно носить защитную одежду, чтобы она не попала на кожу, глаза или рот.
(Обычно рекомендуется сначала разбавить очиститель, чтобы уменьшить его концентрацию.) При использовании разбавленной кислоты по-прежнему важно носить защитную одежду, чтобы она не попала на кожу, глаза или рот.
В зависимости от концентрации соляной кислоты, с которой вы работаете, случайное воздействие может произойти при попадании на кожу, в глаза, при проглатывании или вдыхании паров кислоты.Каждый из этих видов воздействия может представлять серьезную опасность для вашего здоровья и должен быть немедленно устранен.
Контакт с кожей – При попадании соляной кислоты на кожу немедленно промойте ее большим количеством воды в течение не менее 15 минут и снимите всю загрязненную одежду. В случае серьезного контакта с кожей используйте воду, дезинфицирующее мыло и антибактериальный крем. Немедленно обратитесь за медицинской помощью.
Попадание в глаза – При попадании в глаза соляной кислоты или кислотных туманов немедленно промойте их большим количеством воды в течение не менее 15 минут. Немедленно обратитесь за медицинской помощью.
Немедленно обратитесь за медицинской помощью.
Проглатывание – При проглатывании не вызывать рвоту. Немедленно обратитесь за медицинской помощью.
Вдыхание – При вдыхании паров или тумана соляной кислоты немедленно обратитесь на свежий воздух и к врачу.
Хранение и утилизация соляной кислотыСоляную кислоту следует хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от источников влаги. Хранить вдали от несовместимых материалов, таких как окислители, органические материалы, металлы и щелочи.Соляная кислота способна разъедать металлические поверхности. Держите контейнер плотно закрытым и храните в надежном месте.
Узнайте больше о безопасности соляной кислоты от экспертов MSDS
Независимо от того, встречаетесь ли вы с соляной кислотой в разбавленных бытовых чистящих средствах дома или в концентрированных формах на рабочем месте, безопасность чрезвычайно важна при обращении с этой токсичной коррозионной жидкостью. Для получения дополнительной информации об использовании, безопасности или утилизации соляной кислоты выполните поиск в нашей базе данных информации о паспортах безопасности.
Для получения дополнительной информации об использовании, безопасности или утилизации соляной кислоты выполните поиск в нашей базе данных информации о паспортах безопасности.
Знайте об использовании соляной кислоты
Соляная кислота, также широко известная как соляная кислота, производится путем растворения газообразного хлороводорода в воде. Это сильная и летучая кислота с характерным резким запахом. Его выделяют из раствора с помощью процесса мембранной перегонки. В газообразном виде соляная кислота бесцветна и является чрезвычайно важным лабораторным реагентом. Он содержится в организме человека как компонент желудочной секреции. Гидрохлорид широко используется для получения других химических соединений и имеет большое коммерческое значение.Молекула HCl состоит из водорода и хлора в соотношении 1:1. Также говорят, что это соль, если она протонирована водой и хлоридом.
Вот точечная структура молекулы HCL по Льюису —
[Изображение будет загружено в ближайшее время]
Использование соляной кислоты
Соляная кислота широко используется в различных областях. Ниже перечислены цели, для которых используется соляная кислота.
Ниже перечислены цели, для которых используется соляная кислота.
В синтезе органических соединений:Из него получают дихлорметан, винилхлорид, поливинилхлорид и др. Эти органические соединения имеют большое промышленное значение. Они используются в пластмассовой промышленности. Соляная кислота также используется для синтеза бисфенола А, который, в свою очередь, используется для производства пластика.
При приготовлении царской водки: Царская водка представляет собой желтую дымящуюся жидкость, полученную путем смешивания концентрированной азотной кислоты и концентрированной соляной кислоты в соотношении 1:3. Он может растворять благородные металлы, такие как платина и золото.Царская водка используется для чистки и изготовления украшений.
Для очистки поваренной соли: HCl используется для очистки поваренной соли.
 При этом нечистая соль растворяется в воде, содержащей растворенную соляную кислоту. Из-за общего ионного эффекта ионизация NaCl подавляется, что приводит к отложению чистой соли.
При этом нечистая соль растворяется в воде, содержащей растворенную соляную кислоту. Из-за общего ионного эффекта ионизация NaCl подавляется, что приводит к отложению чистой соли.Для поддержания pH фармацевтических продуктов: Соляная кислота известна своей способностью поддерживать кислый pH вещества.Следовательно, он используется для поддержания pH многих веществ.
Синтез неорганических соединений: Многие неорганические соединения синтезируются с использованием соляной кислоты в качестве основного реагента или катализатора. Примерами таких соединений являются хлорид полиалюминия (PAC), хлорид железа (III) и т. д.
Кожевенная промышленность: Соляная кислота используется для дубления кожи. Он изменяет рН кожи, чтобы предотвратить рост бактерий на ней.
Для очистки сахара: Соляная кислота используется для очистки сахара.
 После удаления ксилозы и глюкозы кислотным гидролизом сока сахарного тростника остальные органические вещества в растворе удаляются соляной кислотой, которая дает концентрированный раствор.
После удаления ксилозы и глюкозы кислотным гидролизом сока сахарного тростника остальные органические вещества в растворе удаляются соляной кислотой, которая дает концентрированный раствор.Для травления стали: Это одно из наиболее важных применений соляной кислоты. Соляная кислота — очень сильная кислота, и вы можете удалить пятна с металлических предметов, таких как железо, медь и сплавы, такие как латунь. Например, он может удалить ржавчину с железа. Следует иметь в виду, что даже для целей очистки он используется в очень разбавленном виде.Технически при травлении углеродистой стали используется концентрация HCl 18%.
Fe3O4 + Fe +HCl 4 🡪 FeCl3 + 4h3O
Моющие свойства: Из-за своей силы соляная кислота используется для очистки. Он используется для очистки плитки, кирпича и т. д. Он также используется в производстве газообразного диоксида хлора, который является чрезвычайно сильным дезинфицирующим средством.

2NaClO3 + 4HCl 🡪 2ClO + 2NaCl + 2h3O
Производство и добыча минерального масла: соляная кислота является сильным коррозионным агентом.Следовательно, его закачивают в породы, содержащие минеральное масло (нефть). HCl образует большие поры, которые способствуют добыче и добыче нефти.
Для устранения жесткости воды: использование HCl также распространяется на очистку воды. Соляная кислота эффективна при регенерации смол методом ионного обмена. HCl используется для устранения постоянной жесткости воды.
Химическая очистка сточных вод: Из-за высокой коррозионной активности соляная кислота используется для удаления из воды накипи, образующейся из-за присутствия в воде различных солей.Он действует как деэмульгатор в сточных водах.
Соляная кислота: интересный факт
Соляная кислота играет очень важную роль в пищеварении человека, запуская пищеварительный фермент пепсин и помогая убивать бактерии, попадающие в желудок. Соляная кислота вырабатывается париетальными клетками желудочной железы, присутствующими в слизистой оболочке желудка. В случае недостаточного количества соляной кислоты в желудке, известного как ахлоргидрия, человеку в качестве лекарства требуется сильно разбавленная соляная кислота.А вот и таблетка гидрохлорида, используемая в качестве заменителя. В таком случае также используется раствор гидрохлорида.
Соляная кислота вырабатывается париетальными клетками желудочной железы, присутствующими в слизистой оболочке желудка. В случае недостаточного количества соляной кислоты в желудке, известного как ахлоргидрия, человеку в качестве лекарства требуется сильно разбавленная соляная кислота.А вот и таблетка гидрохлорида, используемая в качестве заменителя. В таком случае также используется раствор гидрохлорида.
Соляная кислота является очень важным химическим соединением из-за его разнообразного использования в лабораториях и на производстве. Однако обращаться с ним следует с особой осторожностью и только под наблюдением профессионалов. Это очень агрессивная кислота, которая может вызвать серьезные ожоги кожи. Следует любой ценой избегать прямого контакта с кожей.
%PDF-1.6 % 406 0 объект > эндообъект внешняя ссылка 406 77 0000000016 00000 н 0000002984 00000 н 0000003214 00000 н 0000003258 00000 н 0000003393 00000 н 0000003429 00000 н 0000003519 00000 н 0000003984 00000 н 0000004035 00000 н 0000004387 00000 н 0000004634 00000 н 0000004751 00000 н 0000004966 00000 н 0000005105 00000 н 0000005173 00000 н 0000005234 00000 н 0000005871 00000 н 0000006397 00000 н 0000006970 00000 н 0000007538 00000 н 0000008103 00000 н 0000008695 00000 н 0000009272 00000 н 0000009734 00000 н 0000009875 00000 н 0000010029 00000 н 0000010191 00000 н 0000010357 00000 н 0000010512 00000 н 0000010674 00000 н 0000010804 00000 н 0000010936 00000 н 0000011078 00000 н 0000011222 00000 н 0000011302 00000 н 0000039755 00000 н 0000040010 00000 н 0000040249 00000 н 0000066916 00000 н 0000067167 00000 н 0000067406 00000 н 0000086566 00000 н 0000087052 00000 н 0000088013 00000 н 0000088384 00000 н 0000128115 00000 н 0000128445 00000 н 0000128772 00000 н 0000136261 00000 н 0000136518 00000 н 0000136809 00000 н 0000141768 00000 н 0000141994 00000 н 0000142165 00000 н 0000157995 00000 н 0000158344 00000 н 0000158821 00000 н 0000165428 00000 н 0000165673 00000 н 0000165945 00000 н 0000168088 00000 н 0000168337 00000 н 0000168704 00000 н 0000170403 00000 н 0000170617 00000 н 0000170641 00000 н 0000170686 00000 н 0000171103 00000 н 0000622450 00000 н 0000622690 00000 н 0000623866 00000 н 0000623902 00000 н 0000623937 00000 н 0000624438 00000 н 0000624513 00000 н 0000624698 00000 н 0000001836 00000 н трейлер ]>> startxref 0 %%EOF 482 0 объект >поток xڤU{PTu]v
aY5%Ҷ.

 При этом нечистая соль растворяется в воде, содержащей растворенную соляную кислоту. Из-за общего ионного эффекта ионизация NaCl подавляется, что приводит к отложению чистой соли.
При этом нечистая соль растворяется в воде, содержащей растворенную соляную кислоту. Из-за общего ионного эффекта ионизация NaCl подавляется, что приводит к отложению чистой соли. После удаления ксилозы и глюкозы кислотным гидролизом сока сахарного тростника остальные органические вещества в растворе удаляются соляной кислотой, которая дает концентрированный раствор.
После удаления ксилозы и глюкозы кислотным гидролизом сока сахарного тростника остальные органические вещества в растворе удаляются соляной кислотой, которая дает концентрированный раствор.