VII НАЦИОНАЛЬНЫЙ ЧЕМПИОНАТ СКВОЗНЫХ РАБОЧИХ ПРОФЕССИЙ ВЫСОКОТЕХНОЛОГИЧНЫХ ОТРАСЛЕЙ ПРОМЫШЛЕННОСТИ WORLDSKILLS HI-TECH 2020
Дорогие друзья!
Приветствую участников VII Национального чемпионата рабочих профессий высокотехнологичных отраслей промышленности WorldSkills Hi-Tech!
Мы гордимся, что именно в нашем индустриальном регионе, в Екатеринбурге — Городе трудовой доблести — традиционно проводятся самые масштабные соревнования по профессиональному мастерству рабочих высокотехнологичных отраслей. С каждым годом Чемпионат совершенствуется, расширяется перечень компетенций, растёт число участников, появляются новые соревнования. Так, в этом году уже в третий раз в рамках соревнований пройдет Национальный чемпионат «Навыки мудрых», в котором участвуют работники предприятий старше 50 лет.
В этом году по понятным причинам соревнования пройдут в дистанционном формате. В конкурсе по 24 компетенциям примут участие более 300 профессионалов из России и 15 стран мира: Франции, Белоруссии, Китая, Германии, Бразилии, ЮАР и других.
Сегодня, когда перед Россией стоят масштабные исторические задачи прорывного развития, Чемпионат приобретает особое значение. Это площадка, где закладываются кадровые основы роста национальной экономики. Здесь высококлассные специалисты демонстрируют свое мастерство, обмениваются опытом и совершенствуют профессиональные навыки. Здесь решаются задачи повышения производительности труда, престижа рабочих специальностей, кадрового обеспечения высокотехнологичных отраслей промышленности. Здесь формируются новые образовательные программы, стандарты обучения специалистов рабочих профессий, необходимых новой экономике.
Поздравляю участников с открытием соревнований и желаю удачного выступления на максимуме своих профессиональных и творческих возможностей, новых жизненных свершений и побед.
Губернатор
Свердловской области
Е.В. Куйвашев
Cro-mo и Hi-ten сталь
Перейти в каталог Выбора экстримальных велосипедов
Cro-mo и Hi-ten сталь
Автор: Антон Степанов
Новичков с каждым годом все прибавляется. Как и следует ожидать, вопросы, которые они задают, особой оригинальностью не отличаются. Сегодня в очередной раз разберем один из самых популярных и актуальных вопросов. Это касается всех любителей фристайла на MTB и BMX велосипедах.
Как и следует ожидать, вопросы, которые они задают, особой оригинальностью не отличаются. Сегодня в очередной раз разберем один из самых популярных и актуальных вопросов. Это касается всех любителей фристайла на MTB и BMX велосипедах.
- Чем отличается Cro-Mo 4130 от Hi-Ten?
- Стоит ли переплачивать за Cro-Mo рамы?
- Так ли важно, чтобы все трубы в раме были Cro-Mo?
- В каких узлах допустимо использование Hi-Ten?
Начнем с того, что оба этих индекса являются марками стали. Для тех кто не учился в технических учебных заведениях поведаю: сталь это сплав железа (Fe) и углерода (C). Самая обычная и дешевая сталь назвается углеродистой. Углеродистая сталь хорошо сваривается, однако обладает низкими физичекими и химическими свойствами. Если упростить длинные объяснения, то физические свойства это способность выдерживать ударные нагрузки. Разрыв, растяжение, скручивание и так далее. Химические свойства показывают, как будет вести себя сталь в агрессивных средах. В кислоте, при высоких и низких температурах, банальная стойкость к коррозии. Так вот углеродистая сталь это и есть hi-ten, хотя строго говоря, термин расшифровывается, как высокопрочная сталь. Однако, никакой высокой прочности там нет и в помине. Производители не имеют однозначного регламента по hi-ten стали, то есть эта марка стали теоретически может быть очень даже ничего, но в итоге, эта марка делается с максимально возможной экономией. Чтобы понять, как можно было бы сделать «хороший» hi-ten, нужно понять, что такое легированная сталь.
В кислоте, при высоких и низких температурах, банальная стойкость к коррозии. Так вот углеродистая сталь это и есть hi-ten, хотя строго говоря, термин расшифровывается, как высокопрочная сталь. Однако, никакой высокой прочности там нет и в помине. Производители не имеют однозначного регламента по hi-ten стали, то есть эта марка стали теоретически может быть очень даже ничего, но в итоге, эта марка делается с максимально возможной экономией. Чтобы понять, как можно было бы сделать «хороший» hi-ten, нужно понять, что такое легированная сталь.
Легированная сталь – это углеродистая сталь с добавлением некоторых химических элементов. Такая операция называется легирование стали. Cro-Mo 4130 это сталь легированная хромом и молибденом. Кроме них имеются и другие добавки, но их содержание незначительно. Совсем небольшое добавление в сплав этих химических элементов способно очень серьезно изменить физические и химические свойства сплава. В зависимости от требуемого результата сталь легируется разными элементами. Cro-Mo 4130 по прежнему легко сваривается. То есть не требует от производства сложных манипуляций перед процессом сварки. Например, подогрева перед сваркой и плавного охлаждение после или обязательного отпуска. Сплав почти в 2 раза прочнее и устойчивее к коррозии, чем hi-ten. Теперь про то, почему hi-ten мог бы быть хорош: если Cro-Mo 4130 это строго регламентированная марка стали, где не может быть превышения уровня хрома или молибдена ни на сотую долю процента, то hi-ten не предполагает такого строгого регламента. Теоретически hi-ten может быть таким же как и Cro-Mo, но это никому не нужно, поэтому не попадитесь в эту ловушку. Я находил в интернете формулировки, которые допускают существование качественной hi-ten стали, однако в вело промышленности ее нет. Я думаю теперь вы понимаете, в чем отличие этих марок стали. Cro-Mo почти в два раза превосходит по всем параметрам Hi-Ten. Это значит, что для достижения приемлемой прочности, нужно использовать трубы в два раза толще. Средняя рама из Cro-Mo 4130 на комплит велосипедах весит 2400-2800 грамм.
Cro-Mo 4130 по прежнему легко сваривается. То есть не требует от производства сложных манипуляций перед процессом сварки. Например, подогрева перед сваркой и плавного охлаждение после или обязательного отпуска. Сплав почти в 2 раза прочнее и устойчивее к коррозии, чем hi-ten. Теперь про то, почему hi-ten мог бы быть хорош: если Cro-Mo 4130 это строго регламентированная марка стали, где не может быть превышения уровня хрома или молибдена ни на сотую долю процента, то hi-ten не предполагает такого строгого регламента. Теоретически hi-ten может быть таким же как и Cro-Mo, но это никому не нужно, поэтому не попадитесь в эту ловушку. Я находил в интернете формулировки, которые допускают существование качественной hi-ten стали, однако в вело промышленности ее нет. Я думаю теперь вы понимаете, в чем отличие этих марок стали. Cro-Mo почти в два раза превосходит по всем параметрам Hi-Ten. Это значит, что для достижения приемлемой прочности, нужно использовать трубы в два раза толще. Средняя рама из Cro-Mo 4130 на комплит велосипедах весит 2400-2800 грамм. Следовательно из Hi-Ten она будет весить 5000 грамм!!! Такого производители допустить не могут и используют трубы с той же толщиной стенки, с которой были бы трубы из Cro-Mo 4130, а это приводит нас к трещинам, гнущимся перьям, разочарованию и слезам. Сгинь нечистая сила!
Следовательно из Hi-Ten она будет весить 5000 грамм!!! Такого производители допустить не могут и используют трубы с той же толщиной стенки, с которой были бы трубы из Cro-Mo 4130, а это приводит нас к трещинам, гнущимся перьям, разочарованию и слезам. Сгинь нечистая сила!
Теперь вы понимаете, почему стоит переплачивать за Cro-Mo рамы!
Из Cro-Mo должны быть все трубы! Hi-Ten мягкий материал, а подшипники сделаны из жесткой стали. Таким образом вы можете деформировать рулевой или кареточный стакан, если проморгаете люфт в рулевой колонке или будите менять подшипники в раме. Дропауты легко гнутся, особенно при гриндах. Любое лобовое столкновение может привести к непоправимым повреждениями рамы. Руль согнется, вилка тоже, ну и перья рамы на десерт.
Из Hi-Ten допустимо сделать звездочку или подседельный штырь. Рама, руль, вилка, шатуны, оси втулок и педалей должны быть из Cro-Mo!
Если вы покупаете велосипед ребенку, именно ребенку и уверены на 200%, что он не будет на нем прыгать, то можно взять Hi-Ten велосипед. Если на велосипеде вы будите просто кататься или будет просто ездить прямо девушка, то можно рискнуть. Во всех остальных случаях из Hi-Ten может быть сделана, только звездочка или подседельный штырь.
Если на велосипеде вы будите просто кататься или будет просто ездить прямо девушка, то можно рискнуть. Во всех остальных случаях из Hi-Ten может быть сделана, только звездочка или подседельный штырь.
Да, Cro-Mo детали тоже ломаются, трескаются, гнутся, но держатся дольше и стоят своих денег.
Перейти в каталог Выбора экстримальных велосипедов
Belzona 4301 химостойкий эпоксидный композит
Belzona 4301 (Magma CR1 Hi-Build)
Прочный, двухкомпонентный ремонтный композит для долговременный защиты металлических и бетонных поверхностей от воздействия широкого спектра химических веществ, включая кислоты и щелочи. Belzona 4301 (Magma CR1 Hi-Build) идеально подходит для восстановления поверхностей, поврежденных в результате воздействия химических веществ, а также для ремонта химостойких покрытий.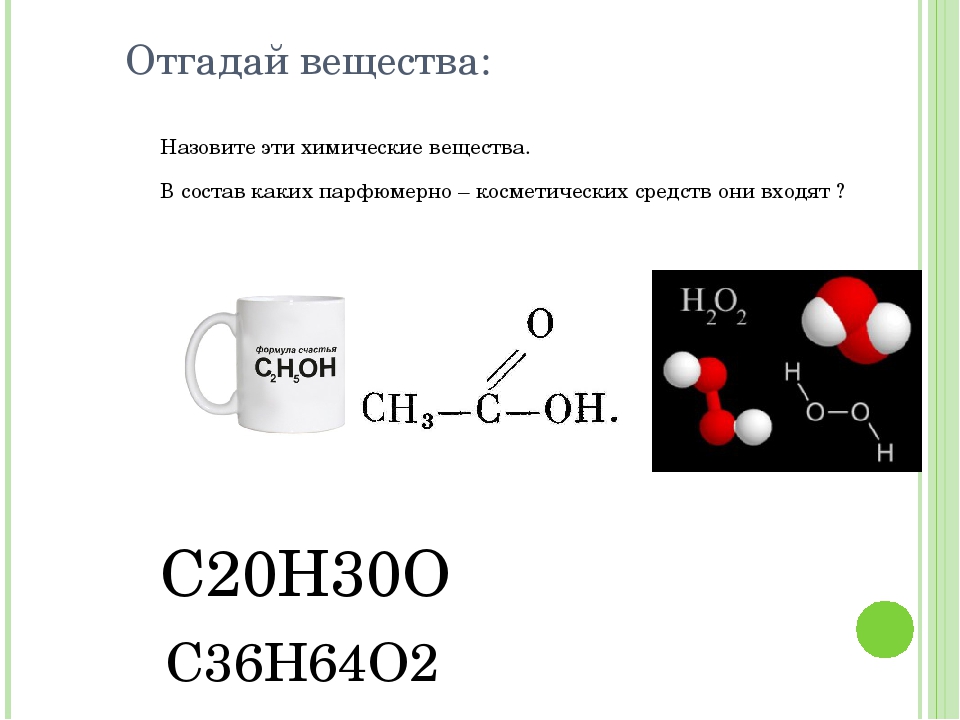 Этот не содержащий растворителя материал также используется для достижения необходимого профиля и выравнивания поверхности перед нанесением Belzona 4311 (Magma CR1).
Этот не содержащий растворителя материал также используется для достижения необходимого профиля и выравнивания поверхности перед нанесением Belzona 4311 (Magma CR1).
Belzona 4301 (Magma CR1 Hi-Build) легко смешивать и наносить без использования специального оборудования. Отверждение этого материала происходит при комнатной температуре.
Основные преимущества:
- Отличная защита от воздействия широкого ряда химических веществ, включая кислоты и щелочи
- Легко смешивать и наносить без использования специального оборудования
- Отсутствие растворителя снижает пожароопасность и риск причинения вреда здоровью
- Нанесение и отверждение при комнатной температуре — без огнеопасных работ
- Отсутствие усадки, объемного расширения и деформации
- Превосходные электроизоляционные характеристики
- Отличная адгезия ко всем твердым подложкам, включая бетон, камень, кирпич, нержавеющую сталь, мягкую сталь, углеродистую сталь, медь, латунь, бронзу и другие материалы
- Превосходная прочность на сжатие
Области применения Belzona 4301 (Magma CR1 Hi-Build):
- Ремонт фланцев на месте поломки и создание втулок патрубков
- Защита желобов, каналов и стоков химических веществ
- Защита оснований и корпусов насосов от воздействия химических веществ
- Химостойкий материал для ремонта зон вторичного обвалования, участков, подверженных аварийному разливу химикатов, основ резервуаров и удерживающих кислот стен
| Ключевая техническая информация: | |
|---|---|
| Жизнеспособность при температуре 25°C | 25 минут |
| Время отверждения для полной химической стойкости при температуре 25°C | 6 дней |
| Прочность на сдвиг (ASTM D1002) | 20 МПа от абразивоструйно обработанной мягкой стали при температуре окружающей среды |
| Прочность на сжатие (ASTM D695) | 97,9 МПа при температуре окружающей среды |
| Теплостойкость | 60°C во влажных условиях, 200°C в сухих условиях |
| Высокая адгезия к таким материалам, как | Алюминий, медь, сталь, нержавеющая сталь, чугун, бетон, камень, кирпич и др |
| Типичные применения | Восстановление металлических и бетонных поверхностей и защита от воздействия химических веществ |
| Размер упаковки продукта | 1 кг. Размер упаковки может варьироваться в зависимости от региона Размер упаковки может варьироваться в зависимости от региона |
Дополнительная информация
Для более подробной информации об этом продукте, пожалуйста, свяжитесь с нами или обратитесь к Вашему региональному дистрибьютору.
Для доступа к дополнительной информации, включая Паспорта Безопасности Веществ и Материалов и Инструкции по Применению, зарегистрируйтесь на Belzona Connect.
Оборудование ЦБК с использованием химических заземляющих электродов, Hi-S-Finer
- Mobil
- Главная страница
- Индустриальные смазочные материалы
- Hitachi Zosen (Hitz)
- Оборудование ЦБК с использованием химических заземляющих электродов, Hi-S-Finer
На основании ваших предпочтений, касающихся файлов cookie, вам могут быть доступны не все функции веб-сайта. Нажмите здесь, чтобы обновить настройки.
Нажмите здесь, чтобы обновить настройки.
Подшипник
| Mobil DTE Oil Light | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
Двигатель с редуктором
| Mobilgear 600 XP 150 | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
Редуктор — понижающая передача
| Mobilgear 600 XP 150 | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
| Mobil Vacuoline 528 | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
Другое
| Mobilgear 600 XP 680 | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
| Mobil Vacuoline 528 | Equipment Operation : Стандартные условия эксплуатации, указанные производителем оборудования |
Hi-Mohs | Soft99
АВТОМОБИЛЬНОЕ ПОКРЫТИЕ, ОПРЕДЕЛЯЮЩЕЕ СТАТУС
Глубокий блеск, излучаемый этим покрытием, напоминает блеск глазури на фарфоре селадон.
Беспрецедентные водо- и маслоотталкивающие свойства, великолепная защита от грязи делают это покрытие самым эффективным двухслойным покрытием на основе стекла в линейке BEAUTIFUL G`ZOX
ГИДРОФОБНЫЕ СВОЙСТВА И УСТОЙЧИВОСТЬ К НЕФТЕПРОДУКТАМ
В отличие от обычных фторполимерных покрытий на основе стекла, HI-MOHS имеет в своём составе компонент Fusso, созданный с использованием фтора высокой степени очистки, который создаёт гладкий защитный слой, придаёт обработанной поверхности устойчивость к нефтепродуктам и исключительные гидрофобные свойства, недостижимые для традиционных покрытий.
Гидрофобный эффект сразу после нанесения
ЗАЩИТА ОТ ЦАРАПИН
HI MOHS создаёт покрытие твёрдостью 7 единиц по шкале Моса, отличающееся поразительной устойчивостью к появлению царапин.
Тест на износостойкость
Устойчивость к воздействию автошампуней
С помощью специальной тестовой машины было смоделировано влияние мойки автомобиля. Исследуемый участок поверхности несколько сотен раз протирался губкой с нанесённым на неё автомобильным шампунем.
Исследуемый участок поверхности несколько сотен раз протирался губкой с нанесённым на неё автомобильным шампунем.
В случае с обычными водоотталкивающими покрытиями при повторных «мойках» отмечалось уменьшение угла контакта поверхности с водой. У HI MOHS же гидрофобные свойства сохранились на высоком уровне.
Тест на износостойкость
HI MOHS
Устойчивость к появлению царапин
После того, как тестовая машина 500 раз протёрла поверхность тряпкой, на участке защищённым HI MOHS можно было обнаружить лишь единичные царапины, что говорит о превосходной устойчивости покрытия к появлению царапин.
Высокая устойчивость к механическим повреждениям
ВЫСОКОЭФФЕКТИВНАЯ ЗАЩИТА ОТ ЗАГРЯЗНЕНИЙ НА ДОЛГИЙ СРОК
Эффективная защита от загрязнений позволяет легко удалять загрязнения при мойке автомобиля с использованием только воды.
Тестирование грязезащитных свойства
Маркер
Краска маркера плохо наносится, легко удаляется.
На правую половину пластины нанесено покрытие HI MOHS. Краска маркера на масляной основе плохо наносится и легко удаляется спиртом, не оставляя следов.
Тестирование грязезащитных свойства
Углерод
На правую половину пластины нанесено покрытие HI MOHS. В целях эксперимента на поверхность наносится углеродная пыль. Поверхность несколько раз протирается губкой, смоченной в воде. К участку, покрытому HI MOHS пыль плохо пристаёт и легко удаляется губкой, не оставляя следов.
Варочные поверхности Gorenje с конфорками Hi-Light – технические преимущества
Электрические варочные панели Gorenje оснащаются современными нагревательными элементами Hi-Light, основным преимуществом которых является практически моментальный нагрев. Приборы имеют множество дополнительных функций, которые позволяют сделать процесс приготовления проще и ускорить его.
Преимущества техники
Для своих варочных панелей словенская компания Горенье использует один из наиболее продвинутых типов нагревательных элементов.
Благодаря быстрому нагреву и высокой температуре конфорок времени на готовку уходит меньше, а значит, расход электроэнергии снижается.
Компания Gorenje оборудовала варочные панели с нагревательными элементами Hi-Light множеством полезных функций, преимущества которых вы оцените сразу. В первую очередь, это так называемые «зоны расширения». Они могут быть круглыми и менять диаметр области нагрева, или овальными. Овальные конфорки FishZone дают возможность готовить в утятницах, рыбницах, больших кастрюлях или прямоугольных сковородах-гриль.
Нагревательные элементы Hi-Light сильно разогревают стеклокерамическую поверхность, поэтому остывает она не сразу. Чтобы вы могли сразу определить, какие из конфорок еще остаются горячими, производитель предусмотрел индикацию остаточного тепла. Символ «H» будет гореть до тех пор, пока температура поверхности не станет безопасной для прикосновения.
Чтобы вы могли сразу определить, какие из конфорок еще остаются горячими, производитель предусмотрел индикацию остаточного тепла. Символ «H» будет гореть до тех пор, пока температура поверхности не станет безопасной для прикосновения.
Для каждой из конфорок можно настроить таймер обратного отсчета. Функция идеально подходит для приготовления блюд, требующих тепловой обработки при постоянной температуре. Когда заданное время закончится, нагрев будет отключен автоматически.
Опция Stop&Go позволит вам в любой момент прервать готовку и ненадолго отлучиться из кухни. Достаточно нажать одну кнопку, чтобы варочная панель сохранила все установленные настройки. Вернувшись, вы сможете продолжить готовить, не тратя время на повторную установку рабочих параметров.
StayWarm – это функция, позволяющая сохранить горячими уже готовые блюда. Их температура поддерживается на уровне 70 градусов, что дает возможность сберечь вкусовые качества.
Заказать варочные панели Gorenje с нагревательными элементами Hi-Light можно в каталоге нашего интернет-магазина. Доставляем технику по Москве, Санкт-Петербургу и другим регионам России.
Доставляем технику по Москве, Санкт-Петербургу и другим регионам России.
«Мы хотим показать всему миру, что такое розе класса hi-end»
Вина из департамента Вар в первую очередь востребованы теми, кто приезжает на курорты Лазурного Берега. Какие перемены внесет в этот тренд ситуация с COVID-19? Сильно ли все это повлияет на ваши продажи?
Конечно, наш главный рынок – Французская Ривьера, многое для нас изменится, но мы уверены, что со временем все будет хорошо. У нас небольшие объемы производства и преданные клиенты, думаю, мы не останемся без покупателей. По нашим прогнозам, рестораны и отели должны открыться в середине июня (интервью состоялось в середине мая 2020 года.– Прим. ред.). Все три наши хозяйства открыты для туристов. Мы организовали систему посещения в соответствии с самыми строгими нормами безопасности.
В 2004 году вы вступили в альянс с группой Louis Roederer. Каковы главные плюсы этого долгого сотрудничества?
Главное преимущество в том, что LR подключили свои безграничные каналы дистрибуции, и мы можем полностью фокусироваться на производстве. Наша цель – делать лучшее розе в мире и лучшие вина Прованса, а для этого нужно много работать на виноградниках и винодельнях, постоянно экспериментировать, держать руку на пульсе каждого винтажа. У нас есть такая возможность благодаря нашим партнерам. Еще мы обмениваемся технической информацией с хозяйствами по всему миру, у нас есть партнеры в Америке и в Шампани, в Португалии и в Бордо.
Наша цель – делать лучшее розе в мире и лучшие вина Прованса, а для этого нужно много работать на виноградниках и винодельнях, постоянно экспериментировать, держать руку на пульсе каждого винтажа. У нас есть такая возможность благодаря нашим партнерам. Еще мы обмениваемся технической информацией с хозяйствами по всему миру, у нас есть партнеры в Америке и в Шампани, в Португалии и в Бордо.
Вы следите за трендами рынка? Сейчас они меняются чуть ли не каждый день. Как вы считаете, стоит ли гнаться за вкусами потребителей?
Виноделие и виноградарство довольно неповоротливы во времени. Если нам что-то хочется изменить, придется потратить годы, если не десятилетия, чтобы выбрать другой курс. Нет, мы не гонимся за модой. Мы как шеф-повара, которые готовят только то, что им самим нравится. Наше виноделие – это страсть, это бесконечность. О каких трендах здесь может быть речь?
Формула иодистоводородной кислоты — Использование, свойства, структура и формула иодистоводородной кислоты
Формула и структура: Химическая формула иодистоводородной кислоты (водный йодоводород) — HI. Его молярная масса составляет 127,91 г / моль. Йодоводород — это газообразная форма, а йодоводородная кислота — водный раствор HI. Оба они взаимозаменяемы. HI представляет собой простую двухатомную молекулу со следующей структурой:
Его молярная масса составляет 127,91 г / моль. Йодоводород — это газообразная форма, а йодоводородная кислота — водный раствор HI. Оба они взаимозаменяемы. HI представляет собой простую двухатомную молекулу со следующей структурой:
Иодистый водород поляризован из-за электроотрицательности иодида.Из-за большого размера иодид-иона отрицательный заряд рассеивается, что приводит к более слабой связи H-I. Это позволяет легко диссоциировать H + и, следовательно, HI является более сильной кислотой, чем HCl, HBr и HF.
Получение: Йодоводородная кислота коммерчески получается реакцией йода (I 2 ) с гидразином с образованием иодистого водорода и газообразного азота.
2 I 2 + NH 2 NH 2 → 4 HI + N 2Йодоводородная кислота также получается барботированием газообразного сероводорода через водный раствор йода.
H 2 S + I 2 → 2 HI + S В конце реакции HI перегоняют с получением иодистоводородной кислоты в желаемых концентрациях.
Физические свойства: Йодоводород — это бесцветный газ с едким запахом, который легко растворяется в воде с образованием иодистоводородной кислоты. «Концентрированная» иодистоводородная кислота обычно составляет 48-57% HI в воде. Его точные физические свойства (точка кипения, точка плавления и плотность) зависят от концентрации HI в водном растворе.
Химические свойства: Йодоводородная кислота — сильная и реакционная кислота. Его следует использовать осторожно из-за его высокой реакционной способности. Он может бурно реагировать с металлическими порошками, аммиаком и т. Д., Вызывая пожар и взрывы. Он очень агрессивен и сильно реагирует с основаниями. HI также разлагается при нагревании с образованием токсичных паров и быстро окисляется на воздухе.
Применение: Одним из наиболее распространенных применений HI является образование алкилйодидов, важного класса органических соединений, путем взаимодействия HI с алкенами или первичными спиртами.Йодоводородная кислота также является обычным восстановителем для различных промышленных целей.
Опасность для здоровья / воздействие на здоровье: Газ HI токсичен при вдыхании и сильно раздражает кожу, глаза и слизистые оболочки. Йодоводородная кислота может вызвать серьезные ожоги кожи и повреждение глаз и очень токсична при вдыхании, проглатывании или абсорбции через кожу. Длительное воздействие низких концентраций также может вызвать неблагоприятные последствия для здоровья.
Йодистый водород — Sciencemadness Wiki
Иодистый водород представляет собой химическое соединение с формулой HI .Водные растворы HI известны как иодистоводородная кислота, сильная кислота. Однако йодоводород и йодистоводородная кислота отличаются тем, что первый представляет собой газ при стандартных условиях, а другой — водный раствор указанного газа, что означает, что их свойства незначительно отличаются.
Недвижимость
Химическая промышленность
Иодистый водород медленно реагирует с кислородом с образованием воды и йода. Это также произойдет при воздействии света. Во влажном воздухе образуется туман иодистоводородной кислоты.
Во влажном воздухе образуется туман иодистоводородной кислоты.
Физическое
Иодистый водород — бесцветный газ с едким запахом. Он исключительно растворим в воде (245 г / 100 мл), давая иодистоводородную кислоту. Растворение экзотермическое. Также он слабо растворяется в спиртах.
Наличие
Безводный йодистый водород не продается большинством поставщиков химической продукции из-за его нестабильности и реакционной способности. Даже если бы он был продан, он определенно не был бы доступен химику-любителю, поскольку и йодистый водород, и йодоводородная кислота относятся к химическим веществам из Списка I.
Препарат
Есть несколько способов получения иодистого водорода.
Один из распространенных способов заключается в реакции йода и белого фосфора. В небольшую колбу добавляют 11 частей (по массе) йода и медленно добавляют 1 часть высушенного белого фосфора. Реакция происходит немедленно, при этом появляется свет, и два реагента превращают жидкость при контакте. В результате получается трииодид фосфора, который обрабатывают 1,5 частями воды. Это приводит к гидролизу трииодида фосфора и выделению паров иодистоводородной кислоты.Осторожно нагревая смесь, выгоните большую часть паров иодистого водорода. Образующиеся пары HI от реакции пропускаются через влажный красный фосфор, который помещается в U-образную трубку. Нагревание продолжается до тех пор, пока жидкость не станет просто бесцветной, поскольку при дальнейшем нагревании образуются фосфин и йодид фосфония, которые могут вызвать мощный взрыв, не говоря уже о том, что фосфин чрезвычайно токсичен. [1]
В результате получается трииодид фосфора, который обрабатывают 1,5 частями воды. Это приводит к гидролизу трииодида фосфора и выделению паров иодистоводородной кислоты.Осторожно нагревая смесь, выгоните большую часть паров иодистого водорода. Образующиеся пары HI от реакции пропускаются через влажный красный фосфор, который помещается в U-образную трубку. Нагревание продолжается до тех пор, пока жидкость не станет просто бесцветной, поскольку при дальнейшем нагревании образуются фосфин и йодид фосфония, которые могут вызвать мощный взрыв, не говоря уже о том, что фосфин чрезвычайно токсичен. [1]
Более удобный способ — это реакция йода с тиолами.Реакция протекает в хлороформе или ТГФ при комнатной температуре в течение 30 минут. [2]
Другой метод включает использование йода в тетралине (тетрагидронафталине). В колбе на 500 мл растворяют 40 г иодида в 160 г тетралина при 40 ° C. В другой колбе на 500 мл 40 г тетрагидронафталина нагревают до 200 ° C, близкой к точке кипения, при перемешивании. Раствор йода непрерывно добавляли во вторую колбу в течение 2 часов, поддерживая температуру на уровне 200 ° C.Образующийся в результате нечистый газообразный йодистый водород собирается в холодном пальце, если требуется безводный йодистый водород. Если иодистоводородная кислота является желаемым веществом, то пары иодистого водорода представляют собой пузырьки в объеме 1 литра воды. Выход неочищенного иодистого водорода составляет 94,6% с чистотой 99,5%. [3]
Раствор йода непрерывно добавляли во вторую колбу в течение 2 часов, поддерживая температуру на уровне 200 ° C.Образующийся в результате нечистый газообразный йодистый водород собирается в холодном пальце, если требуется безводный йодистый водород. Если иодистоводородная кислота является желаемым веществом, то пары иодистого водорода представляют собой пузырьки в объеме 1 литра воды. Выход неочищенного иодистого водорода составляет 94,6% с чистотой 99,5%. [3]
Ту же реакцию, описанную выше, также можно использовать для получения безводного бромистого водорода.
Этот газ также можно получить реакцией безводного йодида калия с 85% фосфорной кислотой при осторожном нагревании.
Другие методы можно найти здесь и здесь
Проектов
- Сделать иодистоводородную кислоту
- Производство безводных йодистых солей
Обращение
Безопасность
Йодоводород вызывает коррозию и чрезвычайно токсичен. Это вызовет сильные ожоги кожи, глаз и слизистых тканей. При вдыхании или проглатывании это может привести к летальному исходу. Он также может проникать через кожу, и контакт может вызвать ожоги или, если он разжижен, обморожения. [4]
При вдыхании или проглатывании это может привести к летальному исходу. Он также может проникать через кожу, и контакт может вызвать ожоги или, если он разжижен, обморожения. [4]
Законность
Как и его водный раствор, йодистый водород классифицируется как химическое вещество, включенное в Список I DEA, и его продажа ограничена.
Хранилище
Безводный йодистый водород нестабилен и чрезвычайно агрессивен, поэтому его лучше всего производить на месте и использовать сразу после его изготовления.
Утилизация
Достаточно взаимодействия с основанием или тиосульфатом натрия.
Список литературы
- ↑ http://bitnest.ca/Rhodium/chemistry/hydriodic.html
- ↑ http://pubs.acs.org/doi/abs/10.1021/ol9d
- ↑ http://www.google.com/patents/US5693306
- ↑ http: // cameochemicals.noaa.gov/chemical/11597
Соответствующие темы Sciencemadness
Обратимая реакция | Химия для неосновных
Цели обучения
- Определите обратимую реакцию.

- Приведите примеры обратимых реакций.
Как изменить цвет раствора?
Раствор хлорида кобальта в воде имеет розовый цвет из-за присутствия сольватированного иона Co 2+ .Если добавлено достаточное количество HCl, раствор станет синим, поскольку образуется ион CoCl 4 2-. Реакция может вернуться к розовой форме, если к раствору добавить больше воды.
Обратимые реакции
До этого момента мы писали уравнения химических реакций таким образом, который, казалось бы, указывает на то, что все реакции протекают полностью, пока все реагенты не будут превращены в продукты. В действительности очень многие химические реакции не проходят полностью.Обратимая реакция — это реакция, в которой превращение реагентов в продукты и превращение продуктов в реагенты происходят одновременно. Одним из примеров обратимой реакции является реакция газообразного водорода и паров йода с образованием иодистого водорода. Прямые и обратные реакции можно записать следующим образом.
Прямые и обратные реакции можно записать следующим образом.
В прямой реакции водород и йод соединяются с образованием иодистого водорода. В обратной реакции иодистый водород снова разлагается на водород и йод.Две реакции можно объединить в одно уравнение с помощью двойной стрелки.
Двойная стрелка указывает на то, что реакция обратима.
Когда газообразные водород и йод смешиваются в герметичном контейнере, они начинают реагировать с образованием йодистого водорода. Сначала происходит только прямая реакция, потому что HI отсутствует. По мере протекания прямой реакции она начинает замедляться по мере того, как концентрации H 2 и I 2 уменьшаются.Как только образовалось некоторое количество HI, оно начинает снова распадаться на H 2 и I 2 . Скорость обратной реакции начинается медленно из-за низкой концентрации HI. Постепенно скорость прямой реакции снижается, а скорость обратной реакции увеличивается. В конце концов, скорость объединения H 2 и I 2 с образованием HI становится равной скорости разложения HI на H 2 и I 2 . Когда скорости прямой и обратной реакций сравнялись, реакция достигла состояния равновесия.
Когда скорости прямой и обратной реакций сравнялись, реакция достигла состояния равновесия.
Сводка
- Определена обратимая реакция.
Практика
Прочтите материалы на XtremePapers.com и ответьте на следующие вопросы:
- Какого цвета гидратированный сульфат меди?
- Если прямая реакция экзотермическая, как бы вы увеличили выход продукта?
- Как мы можем увеличить образование аммиака в процессе Габера?
Обзор
- Все ли химические реакции завершаются?
- Почему приведенная выше реакция считается обратимой?
- Как обозначить обратимую реакцию?
Глоссарий
- обратимая реакция: Реакция, в которой превращение реагентов в продукты и превращение продуктов в реагенты происходят одновременно.
Учебное пособие по химии алканолов и галогеноводородной кислоты
(1) Обратите внимание, что сильная кислота Бренстеда-Лоури (донатор протонов) также будет кислотой Льюиса (акцептор электронной пары, электрофил).
H + — это кислота Бренстеда-Лоури, кислота Льюиса и электрофил (любящий электроны).
Галогенид-ионы (X — ) представляют собой основания Бренстеда-Лоури (акцепторы протонов), основания Льюиса (донаторы электронных пар) и нуклеофилы (любящие ядра).
(2) Обратите внимание, что фтористоводородная кислота (HF (водн.) ) является галогеноводородной кислотой, но это слабая кислота, а не сильная кислота, поэтому она не включена в это обсуждение.
(3) pK a для диссоциации каждой галогеноводородной кислоты приведен в таблице ниже:
| Кислота | pK a | тренд силы кислоты |
|---|---|---|
| HF (водн.) | 3.2 | слабее |
| HCl (водн.) | -7 | ↓ |
| HBr (водн.) | -9 | ↓ |
HI (водн. ) ) | -9,5 | сильнейший |
Чем больше pK a , тем меньше диссоциация кислоты, поэтому кислота слабее.
Чем меньше pK a , тем больше диссоциация кислоты, поэтому кислота сильнее.
(4) В кислотном растворе гидроксильная функциональная группа протонирована (R-OH 2 + ), эта протонированная функциональная группа фактически является уходящей группой (она уходит в виде воды, H 2 O). Молекула воды также уносит с собой пару электронов связи C: O, оставляя атом C с дефицитом электронов (положительно заряженный, карбокатион или ион карбония).Галогенид-ион передает электронную пару этому атому C, образуя новую ковалентную связь между C и X.
(5) Третичный карбокатион (ион карбония) является наиболее стабильным. Первичный карбокатион (ион карбония) наименее устойчив.
Порядок стабильности ионов карбония: 3 °> 2 °> 1 °
Следовательно, необходимо нагревать первичный алканол с использованием катализатора в реакции с HCl (водн. ) , в то время как нагревание не требуется при использовании катализатора с вторичным алканолом, а третичный алканол будет реагировать при комнатной температуре без необходимости катализатор.
) , в то время как нагревание не требуется при использовании катализатора с вторичным алканолом, а третичный алканол будет реагировать при комнатной температуре без необходимости катализатор.
Аррениусовы кислоты и основания
12.1 Аррениусовы кислоты и основания
Цели обучения
- Определите кислоту Аррениуса и основание Аррениуса.
- Напишите химическую реакцию между кислотой Аррениуса и основанием Аррениуса.
Исторически первое химическое определение кислоты и основания было предложено шведским химиком Сванте Аррениусом в 1884 году.Кислота Аррениуса — соединение, которое увеличивает концентрацию ионов водорода в водном растворе. представляет собой соединение, которое увеличивает концентрацию ионов H + в водном растворе. Ион H + — это всего лишь голый протон, и довольно ясно, что голые протоны не плавают в водном растворе. Вместо этого химия определила ион гидроксония — фактическое химическое соединение, которое представляет собой ион водорода. (H 3 O + ) как фактическое химическое соединение, которое представляет ион H + .Ионы H + и ионы H 3 O + часто считаются взаимозаменяемыми при написании химических уравнений (хотя правильно сбалансированное химическое уравнение также должно включать дополнительный H 2 O). Классическими аррениусовыми кислотами можно считать ионные соединения, в которых H + является катионом. В таблице 12.1 «Некоторые кислоты Аррениуса» перечислены некоторые кислоты Аррениуса и их названия.
(H 3 O + ) как фактическое химическое соединение, которое представляет ион H + .Ионы H + и ионы H 3 O + часто считаются взаимозаменяемыми при написании химических уравнений (хотя правильно сбалансированное химическое уравнение также должно включать дополнительный H 2 O). Классическими аррениусовыми кислотами можно считать ионные соединения, в которых H + является катионом. В таблице 12.1 «Некоторые кислоты Аррениуса» перечислены некоторые кислоты Аррениуса и их названия.
Таблица 12.1 Некоторые аррениусовы кислоты
| Формула | Имя |
|---|---|
| HC 2 H 3 O 2 (также пишется CH 3 COOH) | уксусная кислота |
| HClO 3 | хлорная кислота |
| HCl | соляная кислота |
| HBr | бромистоводородная кислота |
| HI | иодоводородная кислота |
| HF | плавиковая кислота |
| HNO 3 | азотная кислота |
| H 2 C 2 O 4 | щавелевая кислота |
| HClO 4 | хлорная кислота |
| H 3 PO 4 | фосфорная кислота |
| H 2 SO 4 | серная кислота |
| H 2 SO 3 | сернистая кислота |
Основание Аррениуса Соединение, которое увеличивает концентрацию гидроксид-иона в водном растворе. представляет собой соединение, которое увеличивает концентрацию ионов OH — в водном растворе. Ионные соединения иона OH — являются классическими основаниями Аррениуса.
представляет собой соединение, которое увеличивает концентрацию ионов OH — в водном растворе. Ионные соединения иона OH — являются классическими основаниями Аррениуса.
Пример 1
Определите каждое соединение как кислоту Аррениуса, основание Аррениуса или ни то, ни другое.
- HNO 3
- СН 3 ОН
- Мг (OH) 2
Решение
- Это соединение представляет собой ионное соединение между ионами H + и ионами NO 3 — , так что это кислота Аррениуса.
- Хотя в этой формуле есть ОН, мы не распознаем оставшуюся часть молекулы как катион. Это ни кислота, ни основание. (Фактически, это формула метанола, органического соединения.)
- В этой формуле также есть ОН, но на этот раз мы признаем, что магний присутствует в виде катионов Mg 2+ .
 Таким образом, это ионное соединение иона OH — и основание Аррениуса.
Таким образом, это ионное соединение иона OH — и основание Аррениуса.
Проверьте себя
Определите каждое соединение как кислоту Аррениуса, основание Аррениуса или ни то, ни другое.
- КОН
- H 2 SO 4
- С 2 В 6
Ответ
- Основание Аррениуса
- Аррениусовая кислота
- ни один
Кислоты обладают некоторыми общими свойствами. Они окрашиваются лакмусовой бумажкой, растительным экстрактом, в красный цвет. Они реагируют с некоторыми металлами с выделением газа H 2 . Они реагируют с карбонатными и гидрокарбонатными солями с выделением газообразного CO 2 .Попавшие внутрь кислоты обычно имеют кислый, острый вкус. (Название кислота происходит от латинского слова acidus , что означает «кислый». ) Основания также обладают некоторыми общими свойствами. Они скользкие на ощупь, становятся лакмусово-синими и имеют горький вкус при проглатывании.
) Основания также обладают некоторыми общими свойствами. Они скользкие на ощупь, становятся лакмусово-синими и имеют горький вкус при проглатывании.
Кислоты и основания обладают еще одним свойством: они реагируют друг с другом, образуя воду и ионное соединение, называемое солью. Соль — любое ионное соединение, которое образуется в результате реакции между кислотой и основанием.в химии — это любое ионное соединение, полученное путем соединения кислоты с основанием. Реакция между кислотой и основанием называется реакцией нейтрализации: реакция кислоты и основания с образованием воды и соли. и может быть представлен следующим образом:
кислота + основание → H 2 O + сольСтехиометрия сбалансированного химического уравнения зависит от количества ионов H + в кислоте и количества ионов OH — в основании.
Пример 2
Напишите вычисленное химическое уравнение реакции нейтрализации H 2 SO 4 и KOH. Как называется образующаяся соль?
Как называется образующаяся соль?
Решение
Общая реакция следующая:
H 2 SO 4 + KOH → H 2 O + сольПоскольку кислота содержит в своей формуле два иона H + , нам нужны два иона OH — , чтобы вступить в реакцию с ней, образуя две молекулы H 2 O в качестве продукта. Оставшиеся ионы, K + и SO 4 2−, образуют солевой сульфат калия (K 2 SO 4 ).Сбалансированная химическая реакция выглядит следующим образом:
H 2 SO 4 + 2KOH → 2H 2 O + K 2 SO 4Проверьте себя
Напишите вычисленное химическое уравнение реакции нейтрализации HCl и Mg (OH) 2 . Как называется образующаяся соль?
Ответ
2HCl + Mg (OH) 2 → 2H 2 O + MgCl 2 ; хлорид магния
Основные выводы
- Кислота Аррениуса — это соединение, которое увеличивает концентрацию ионов H + в водном растворе.

- Основание Аррениуса — это соединение, которое увеличивает концентрацию ионов OH — в водном растворе.
- Реакция между кислотой Аррениуса и основанием Аррениуса называется нейтрализацией и приводит к образованию воды и соли.
Упражнения
Каковы некоторые общие свойства кислот Аррениуса?
Каковы некоторые общие свойства базисов Аррениуса?
Обозначьте каждое вещество как кислоту Аррениуса, основание Аррениуса или ни то ни другое.
- NaOH
- С 2 H 5 ОН
- H 3 PO 4
Обозначьте каждое вещество как кислоту Аррениуса, основание Аррениуса или ни то ни другое.

- C 6 H 12 O 6
- HNO 2
- Ba (OH) 2
Напишите вычисленное химическое уравнение реакции нейтрализации КОН и H 2 C 2 O 4 .Что такое соль?
Напишите вычисленное химическое уравнение реакции нейтрализации между Sr (OH) 2 и H 3 PO 4 . Что такое соль?
Напишите вычисленное химическое уравнение реакции нейтрализации HCl и Fe (OH) 3 . Что такое соль?
Напишите вычисленное химическое уравнение реакции нейтрализации между H 2 SO 4 и Cr (OH) 3 .
 Что такое соль?
Что такое соль?CaCl 2 будет продуктом реакции какой кислоты и какого основания?
Zn (NO 3 ) 2 будет продуктом реакции какой кислоты и какого основания?
BaSO 4 будет продуктом реакции какой кислоты и какого основания?
Na 3 PO 4 будет продуктом реакции какой кислоты и какого основания?
ответов
соединение, повышающее концентрацию H + в воде
кислый вкус, реагирует с металлами и становится красной лакмусовой бумажкой
- Основание Аррениуса
- ни один
- Аррениусовая кислота
2KOH + H 2 C 2 O 4 → 2H 2 O + K 2 C 2 O 4 ; К 2 С 2 О 4
3HCl + Fe (OH) 3 → 3H 2 O + FeCl 3 ; FeCl 3
ответов — наименование кислот
ответ — наименование кислот| Арканзас
Государственный университет Отдел химии и Физика |
Напишите формулы для каждой из кислот, перечисленных ниже:
| Азотная кислота | HNO 3 |
| Синильная кислота | HCN (водн. ) ) |
| Хлорная кислота | HClO 3 |
| Уксусная кислота | CH 3 COOH |
| Бромистоводородная кислота | HBr (водн.) |
| Сернистая кислота | H 2 SO 3 |
| Хлористая кислота | HClO 2 |
| Борная кислота | H 3 BO 3 |
| Соляная кислота | HCl (водн.) |
| Фосфорная кислота | H 3 PO 4 |
| Азотистая кислота | HNO 2 |
| Плавиковая кислота | HF (водн.) |
| Хлорная кислота | HClO 4 |
| Йодоводородная кислота | HI (водн.) |
| Фосфорная кислота | H 3 PO 3 |
| Угольная кислота | H 2 CO 3 |
| Серная кислота | H 2 SO 4 |
| Муравьиная кислота | HCOOH |
Назовите каждую из следующих кислот:
| HClO 4 | хлорная кислота |
| HCOOH | муравьиная кислота |
| H 3 PO 4 | фосфорная кислота |
HCl (водн. ) ) | соляная кислота |
| H 3 BO 3 | борная кислота |
| H 2 SO 4 | серная кислота |
| HNO 2 | азотистая кислота |
| HI (водн.) | иодистоводородная кислота |
| CH 3 COOH | уксусная кислота |
| HF (водн.) | плавиковая кислота |
| H 3 PO 3 | фосфорная кислота |
| HCN (водн.) | синильная кислота |
| HClO 3 | хлорная кислота |
| H 2 CO 3 | угольная кислота |
| H 2 SO 3 | сернистая кислота |
| HClO 2 | хлорноватистая кислота |
| HNO 3 | азотная кислота |
HBr (водн. ) ) | бромистоводородная кислота |
Константы ионизации неорганических кислот
Общее название | Формула | Константа кислотности | ПК а |
|---|---|---|---|
серная кислота | H 2 SO 4 | К 1 = 2.4 * 10 6 | -6,62 |
хромовая кислота | H 2 CrO 4 | К 1 = 3,55 | -0. |
сернистая кислота | H 2 SO 3 | К 1 = 1,71 * 10 -2 | 1,77 |
фосфорная кислота | H 3 PO 4 | К 1 = 7.1 * 10 -3 | 2,15 |
фосфорная кислота | H 3 PO 3 | К 1 = 1. | 1,8 |
пирофосфорная кислота | H 4 P 2 O 7 | К 1 = 3 * 10 -2 | 1,52 |
угольная кислота | H 2 CO 3 | К 1 = 4. | 6,36 |
сероводород | H 2 S | K 1 = 9 * 10 -8 | 6.97 |
кислота борная | H 3 BO 3 | K 1 = 7,2 * 10 -10 | 9.14 |

 Таким образом, это ионное соединение иона OH — и основание Аррениуса.
Таким образом, это ионное соединение иона OH — и основание Аррениуса.

 Что такое соль?
Что такое соль? 55
55  6 * 10 -2
6 * 10 -2  35 * 10 -7
35 * 10 -7