Металлические нанопорошки
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМПандемия коронавируса COVID-19 показала, что существует неотложная потребность в эффективных мерах по предотвращению распространения вирусных инфекций различных нозологий. Последние случаи вспышек вируса атипичной пневмонии, птичьего гриппа, гриппа h2N1, и наконец, коронавируса COVID-19 показали, что высокоэффективные бытовые технические средства, позволяющие прервать пути распространения инфекций, отсутствуют. На данный момент известно, что есть два главных пути передачи вирусов. Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.
В настоящее время для прерывания путей передачи вирусов в быту в качестве индивидуальных защитных средств используются маски, защищающие органы дыхания, перчатки и различные антисептики, которыми обрабатываются руки и окружающие предметы и поверхности.
Защитные маски позволяют уменьшить распространение респираторных вирусов, особенно при использовании в замкнутом пространстве или при тесном контакте с человеком с симптомами заражения [1, 2]. Однако сами маски также могут быть источником инфекции [3]. Маска примерно через два часа становится влажной и уже в ней начинают размножаться микроорганизмы. По мнению ВОЗ, маски не гарантируют защиты от COVID-19. Установлено, что эффективность хирургических масок даже самого высокого класса защиты FFP3 недостаточна (гриппом заражается не менее 23 % медицинских сестер, носивших хирургические маски класса FFP3).
Вирус COVID-19 передается не только воздушно-капельным, но и контактным путем, и может сохраняться на поверхностях до 72 часов. Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Одним из путей решений вышеуказанных проблем является придание натуральным и искусственным, в т. ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5]. Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5]. Кроме того серебро имеет высокую стоимость, что приведет к заметному увеличению цены конечной продукции. Поэтому сейчас основное внимание уделяется применению в качестве бактерицидных и противовирусных материалов наночастицам CuO и ZnO, которые практически малотоксичны для человека.
Например, импрегнация биоактивных наночастиц оксида меди в фильтрующий материал позволяет придать одноразовым респираторным маскам мощные биоцидные свойства без изменения их барьерных свойств [6]. При контакте с вирусом ионы меди вызывают массовое повреждение компонентов клеточной стенки, вирусных генов и ключевых белков [7].
Таким образом, с использованием нанопорошков оксидов меди и цинка, возможно разработать ряд продуктов, позволяющих прервать пути передачи вирусов в быту и в медицинских учреждениях – лицевых масок, одежды медицинского персонала, перчаток, больничных простыней, корпусов медицинского оборудования, контейнеры для хранения продуктов, клавиатуру компьютеров, корпуса мобильных телефонов и др.
Компания «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» может изготовить нанопорошки оксидов меди и цинка для разработки новых антимикробных материалов.
1. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2008) Physicalinterventions to interrupt or reduce the spread of respiratory viruses: systematicreview. BMJ 336: 77–80.
BMJ 336: 77–80.
2. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2007) Interventions for the interruption or reduction of the spread of respiratoryviruses. Cochrane Database Syst Rev 6207.
3. Zhiqing L. et al. Surgical masks as source of bacterial contamination during operative procedures //Journal of orthopaedic translation.2018; 14: 57-62.
4. Borkow, G. and Gabbay, J. (2004). Putting Copper into Action:Copper-impregnated Products with Potent Biocidal Activities, FASEB Jounal,18(14): 1728–1730.
5. Akter M. et al. A systematic review on silver nanoparticles-induced cytotoxicity: Physicochemical properties and perspectives //Journal of advanced research. – 2018. – Т. 9. – С. 1-16.
6. Gadi Borkow et al. A Novel Anti-Influenza Copper Oxide Containing Respiratory Face Mask // PLoS ONE, June 2010, Volume 5, Issue 6.
7. Borkow & Gabbay (2005) Copper as a biocidal tool. Current Medicinal Chemistry12:2163-75
ООО «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ»
Адрес: 634055, Российская Федерация, Томск, проспект Академический, 8/8
Телефон/Факс: +7 (3822) 28-68-72 , 8-961-888-16-24
http://www. nanosized-powders.com
nanosized-powders.com
Оксид меди (II)
| Оксид меди (II) | |
|---|---|
| | |
| Систематическое наименование | Оксид меди (II) |
| Хим. формула | CuO |
| Состояние | черный порошок |
| Молярная масса | 79,545 г/моль |
| Плотность | 6,31 г/см³ |
| Температура | |
| • плавления | 1447 |
| • кипения | 2000 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | нерастворим |
| ГОСТ | ГОСТ 16539-79 |
| Рег. номер CAS | [1317-38-0] |
| PubChem | 164827 |
| Рег. номер EINECS | 215-269-1 |
| SMILES | |
| InChI |
1S/Cu. KKCXRELNMOYFLS-UHFFFAOYSA-N |
| RTECS | GL7900000 |
| ChEBI | 75955 |
| ChemSpider | 144499 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид меди (II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм, b = 0.34226(5) нм, c = 0.51288(6) нм, α = 90°, β = 99,54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Получение
Получить оксид меди (II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C):
- 2Cu + O2 → 2CuO
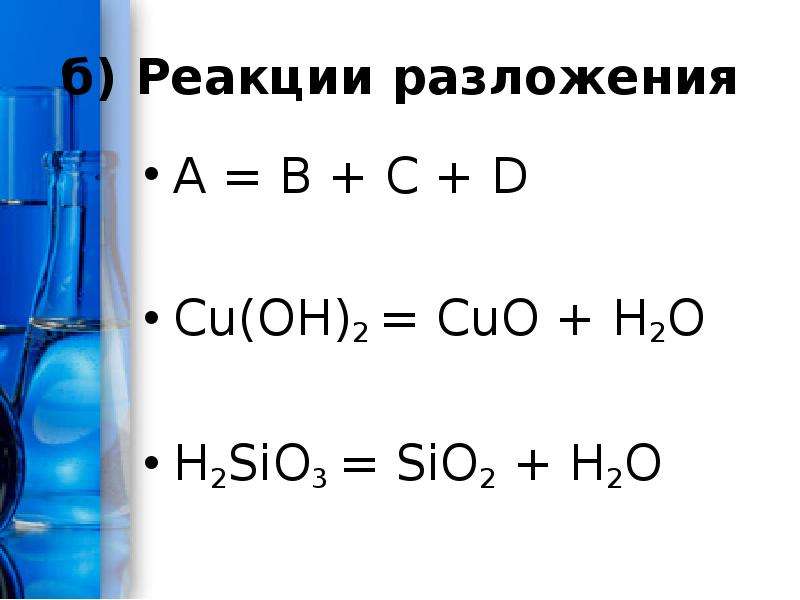
- нагревая гидроксид меди (II), её нитрат или карбонат:
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- CuCO3 → CuO + CO2
- Cu(OH)2 → CuO + H2O
- нагревая малахит:
- Cu2CO3(OH)2 →ot 2CuO + CO2 + H2O
Химические свойства
Оксид меди (II) реагирует с кислотами с образованием соответствующих солей меди (II) и воды:
- CuO + 2HNO3 → Cu(NO3)2 + H2O
При сплавлении CuO со щелочами образуются купраты:
- CuO + 2KOH →ot K2CuO2 + H2O
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди (II) соответствует гидроксид меди (II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
- Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (тетрагидроксокупрат (II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
- CuO + H2 → Cu + H2O
- 2CuO + C → 2Cu + CO2
Физические свойства
Оксид меди (II) относится к моноклинной кристаллической системе.
Работа выхода электрона из кристалла CuO составляет 5,3 эВ.
Оксид меди (II) представляет собой полупроводник p-типа с узкой шириной запрещенной зоны 1,2 эВ.
Оксид меди может быть использован для производства сухих батарей.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски.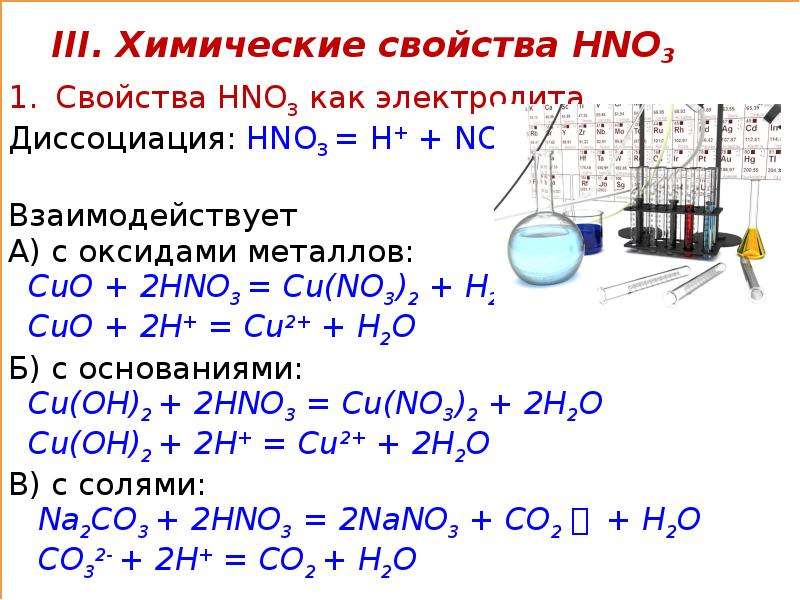 Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Химические свойства меди
Медь
Химическая активность меди невелика. В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
Сначала образуется оксид Cu2O, затем — оксид CuO.
В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
2Cu + 8NH3·H2O + O2 = 2[Cu(NH3)4](OH)2 + 6H2O
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2NH2OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5H2O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Cu2O + 4HCl = 2 H[CuCl2] + H2O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Cu2O + 2NaOH + H2O = 2Na[Cu(OH)2]
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4NH3*H2O = [Cu(NH3)4](OH)2 + 4H2O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + H2O
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+. При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Взаимодействие оксида меди 2 с водой. Оксид меди (I, II, III): свойства, получение, применение
Cuprum (Cu) относится к числу малоактивных металлов. Для него характерно образование химических соединений со степенями окисления +1 и +2. Так, например, два окисла, представляющих собой соединение из двух элементов Cu и кислорода O: со степенью окисления +1 — закись меди Cu2O и степенью окисления +2 — окись меди CuO. Несмотря на то, что состоят они из одинаковых химических элементов, но каждый из них имеет свои особые характеристики. На холоде металл очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой, представляющей собой оксид меди, который препятствует дельнейшему окислению cuprum. При нагревании это простое вещество с порядковым номером 29 в таблице Менделеева полностью окисляется. При этом образуется также оксид меди (II): 2Cu + O2 → 2CuO.
При этом образуется также оксид меди (II): 2Cu + O2 → 2CuO.
Закись представляет собой коричневато-красное твердое вещество с молярной массой 143,1 г/моль. Соединение имеет температуру плавления 1235°С, температуру кипения 1800°С. Оно не растворяется в воде, но растворяется в кислотах. Разводится оксид меди (I) в (концентрированном), при этом образуется бесцветный комплекс +, который легко окисляется на воздухе до аммиачного комплекса сине-фиолетового цвета 2+, растворяющегося в соляной кислоте с образованием CuCl2. В истории полупроводниковой физики Cu2O является одним из наиболее изученных материалов.
Оксид меди (I), известный также как гемиоксид, обладает основными свойствами. Он может быть получен окислением металла: 4Cu + O2 → 2 Cu2O. Примеси, такие как вода и кислоты, влияют на скорость этого процесса, а также дальнейшее окисление до двухвалентного оксида. Закись меди может растворяться в при этом образуется чистый металл и соль: h3SO4 + Cu2O → Cu + CuSO4 + h3O. По аналогичной схеме происходит взаимодействие окисла со степенью +1 с другими кислородосодержащими кислотами.
Встречается оксид меди (I) в природе в виде красной руды (это устаревшее название, наряду с таким как рубиновая Cu), называемой минералом «Куприт». На его образование требуется длительное время. Он может быть получен искусственно при высоких температурах или под высоким давлением кислорода. Гемиоксид обычно используется как фунгицид, как пигмент, как противообрастающее средство в подводной или морской краске, и применяется также в качестве катализатора.
Однако воздействие этого вещества с химической формулой Cu2O на организм может быть опасным. При вдыхании вызывает одышку, кашель, а также изъязвление и перфорацию дыхательных путей. При попадании внутрь раздражает желудочно-кишечный тракт, что сопровождается рвотой, болью и диареей.
h3 + CuO → Cu + h3O;
CO + CuO → Cu + CO2.
Используется оксид меди (II) в керамике (как пигмент) для получения глазури (синей, зеленой и красной, а иногда и розовой, серой или черной).
Воздействие химического соединения CuO также может быть опасным для организма человека. При вдыхании вызывает раздражение легких. Оксид меди (II) может вызвать лихорадку металлических паров (MFF). Окись Cu провоцирует изменение цвета кожи, могут появиться проблемы со зрением. При попадании в организм, как и гемиоксид, приводит к отравлению, которое сопровождается симптомами в виде рвоты и болевых ощущений.
Как и все d-элементы, ярко окрашены.
Так же как у у меди наблюдается провал электронов — с s-орбитали на d-орбитальЭлектронное строение атома:
Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.
Простое вещество: металл золотисто-розового цвета.
Оксиды меди: Сu2O оксид меди (I) \ оксид меди 1 — красно-оранжевого цвета
СuO оксид меди (II) \ оксид меди 2 — черного цвета.
Другие соединения меди Cu(I), кроме оксида, неустойчивы.
Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в после водорода, поэтому не выделяет его из кислот:
- с горячей серной кислотой: Сu + 2h3SO4 = CuSO4 + SO2 + 2h3O
- с холодной серной кислотой: Сu + h3SO4 = CuO + SO2 + h3O
- с концентрированной :
Cu + 4HNO3 = Cu(NO3)2 + 4NO2 + 4h3O - с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2NO +4 h3O
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте.
Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
2Сu(NO3)2 → 2CuO↓ +4 NO2 + O2
Твердый осадок — оксид меди (II).
CuO + h3S → CuS↓ + h3O
Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
2СuS + 3O2 = 2CuO + 2SO2
Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
СuO + 2HNO3 = Cu(NO3)2 + h3O
CuS + 2HNO3 = Cu(NO3)2 + h3S
возможна так же другая реакция:
СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4h3O
Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + h3O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2h3O
Zn(NO 3) 2 + 4NaOH = Na 2 + 2NaNO 3
Химические свойства оксида меди (II)
Краткая характеристика оксида меди (II):
Оксид меди (II) – неорганическое вещество черного цвета.
2. реакция оксида меди (II) с углеродом:
CuО + С → Cu + СО (t = 1200 o C).
углерода .
3. реакция оксида меди (II) с серой:
CuО + 2S → Cu + S 2 О (t = 150-200 o C).
Реакция протекает в вакууме. В результате реакции образуется медь и оксид серы .
4. реакция оксида меди (II) с алюминием:
3CuО + 2Al → 3Cu + Al 2 О 3 (t = 1000-1100 o C).
В результате реакции образуется медь и оксид алюминия .
5. реакция оксида меди (II) с медью:
CuО + Cu → Cu 2 О (t = 1000-1200 o C).
В результате реакции образуется оксид меди (I).
6. реакция оксида меди (II) с оксидом лития :
CuО + Li 2 О → Li 2 CuО 2 (t = 800-1000 o C, О 2).
Реакция протекает в токе кислорода. В результате реакции образуется купрат лития.
7. реакция оксида меди (II) с оксидом натрия :
CuО + Na 2 О → Na 2 CuО 2 (t = 800-1000 o C, О 2).
Реакция протекает в токе кислорода. В результате реакции образуется купрат натрия.
8. реакция оксида меди (II) с оксидом углерода :
CuО + СО → Cu + СО 2 .
В результате реакции образуется медь и оксид углерода (углекислый газ).
9. реакция оксида меди (II) с оксидом железа :
CuО + Fe 2 O 3 → CuFe 2 О 4 (t o).
В результате реакции образуется соль – феррит меди. Реакция протекает при прокаливании реакционной смеси.
10. реакция оксида меди (II) с плавиковой кислотой:
CuO + 2HF → CuF 2 + H 2 O.
В результате химической реакции получается соль – фторид меди и вода.
11. реакция оксида меди (II) с азотной кислотой:
CuO + 2HNO 3 → 2Cu(NO 3) 2 + H 2 O.
В результате химической реакции получается соль – нитрат меди и вода .
Аналогично проходят реакции оксида меди (II) и с другими кислотами.
12. реакция оксида меди (II) с бромистым водородом (бромоводородом):
CuO + 2HBr → CuBr 2 + H 2 O.
В результате химической реакции получается соль – бромид меди и вода .
13. реакция оксида меди (II) с йодоводородом:
CuO + 2HI → CuI 2 + H 2 O.
В результате химической реакции получается соль – йодид меди и вода .
14. реакция оксида меди (II) с гидроксидом натрия :
CuO + 2NaOH → Na 2 CuO 2 + H 2 O.
В результате химической реакции получается соль – купрат натрия и
вода .
15. реакция оксида меди (II) с гидроксидом калия :
CuO + 2KOH → K 2 CuO 2 + H 2 O.
В результате химической реакции получается соль – купрат калия и вода .
16. реакция оксида меди (II) с гидроксидом натрия и водой:
CuO + 2NaOH + H 2 O → Na 2 2 (t = 100 o C).
Гидрокосид натрия растворен в воде. Раствор гидроксида натрия в воде 20-30 %. Реакция протекает при киппении. В результате химической реакции получается тетрагидроксокупрат натрия.
17. реакция оксида меди (II) с надпероксидом калия:
2CuO + 2KO 2 → 2KCuO 2 + О 2 (t = 400-500 o C).
В результате химической реакции получается соль – купрат (III) калия и
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C , постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит , другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780-1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.
Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10 −27 кг = 1,660 540 2(10) × 10 –24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10 −27 кг = 1,660 540 2(10) × 10 –24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см 3 . Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3 .
Плавится при температуре 1447 °C , под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней .
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4Nh4 + h3O = (OH) 2.
В кислотной среде образует сульфат и воду: CuO + h3SO4 = CuSO4 + h3O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + h3O.
Реакция CuO NaOH
Образуется:
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + h3O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ -> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + h3 = Cu + h3O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен . По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности , как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.
Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.
Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Видео
Из видео вы узнаете, что такое оксид меди.
§1. Химические свойства простого вещества (ст. ок. = 0).
а) Отношение к кислороду .
В
отличие от своих соседей по подгруппе
– серебра и золота, — медь непосредственно
реагирует с кислородом. Медь проявляет
к кислороду незначительную активность,
но во влажном воздухе постепенно
окисляется и покрывается пленкой
зеленоватого цвета, состоящей из основных
карбонатов меди:
Медь проявляет
к кислороду незначительную активность,
но во влажном воздухе постепенно
окисляется и покрывается пленкой
зеленоватого цвета, состоящей из основных
карбонатов меди:
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например, при 600-800 0 C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Q образования (Cu 2 O) = 84935 кДж.
Рисунок 2. Строение оксидной пленки меди.
б) Взаимодействие с водой .
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
Молекулярный
водород вытесняет металлы подгруппы
меди с большим трудом. Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
в) Взаимодействие с кислотами .
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют.
Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
Исключение составляет только иодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I):
2 Cu + 3 HI → 2 H [ CuI 2 ] + H 2
Медь так же реагирует с кислотами – окислителями, например, с азотной:
Cu
+ 4HNO 3( конц . ) →
Cu(NO 3 ) 2 +2NO 2 +2H 2 O
) →
Cu(NO 3 ) 2 +2NO 2 +2H 2 O
3Cu + 8HNO 3( разбав .) → 3Cu(NO 3 ) 2 +2NO+4H 2 O
А так же с концентрированной холодной серной кислотой:
Cu + H 2 SO 4(конц.) → CuO + SO 2 + H 2 O
C горячей концентрированной серной кислотой:
Cu + 2H 2 SO 4( конц ., горячая ) → CuSO 4 + SO 2 + 2H 2 O
C безводной серной кислотой при температуре 200 0 С образуется сульфат меди (I):
2Cu + 2H 2 SO 4( безводн .) 200 °C → Cu 2 SO 4 ↓ + SO 2 + 2H 2 O
г)
Отношение к галогенам и некоторым другим
неметаллам .
Q образования (CuCl) = 134300 кДж
Q образования (CuCl 2) = 111700 кДж
Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX 2 .. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl 2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например:
При этом монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Медь так же достаточно легко ступает в реакции с серой и селеном при нагревании (300-400 °C):
2Cu +S→Cu 2 S
2Cu +Se→Cu 2 Se
А
вот с водородом, углеродом и азотом медь
не реагирует даже при высоких температурах.
д) Взаимодействие с оксидами неметаллов
Медь при нагревании может вытеснять из некоторых оксидов неметаллов (например, оксид серы (IV) и оксиды азота (II, IV)) простые вещества, образуя при этом термодинамически более устойчивый оксид меди (II):
4Cu+SO 2 600-800°C →2CuO + Cu 2 S
4Cu+2NO 2 500-600°C →4CuO + N 2
2 Cu +2 NO 500-600° C →2 CuO + N 2
§2. Химические свойства одновалентной меди (ст.ок. = +1)
В водных растворах ион Cu + очень неустойчив и диспропорционирует:
Cu + ↔ Cu 0 + Cu 2+
Однако медь в степени окисления (+1) может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразовния .
а) Оксид меди (I ) Cu 2 O
Амфотерный
оксид. Кристаллическое вещество
коричнево-красного цвета. В природе
встречается в виде минерала куприта.
Исскуственно может быть получен
нагреванием раствора соли меди (II)
с щелочью и каким-нибудь сильным
восстановителем, например, формалином
или глюкозой . Оксид меди(I)
не реагирует с водой. Оксид меди(I)
переводится в раствор концентрированной
соляной кислотой с образованием
хлоридного комплекса:
Кристаллическое вещество
коричнево-красного цвета. В природе
встречается в виде минерала куприта.
Исскуственно может быть получен
нагреванием раствора соли меди (II)
с щелочью и каким-нибудь сильным
восстановителем, например, формалином
или глюкозой . Оксид меди(I)
не реагирует с водой. Оксид меди(I)
переводится в раствор концентрированной
соляной кислотой с образованием
хлоридного комплекса:
Cu 2 O +4 HCl →2 H [ CuCl 2]+ H 2 O
Так же растворим в концентрированном растворе аммиака и солей аммония:
Cu 2 O+2NH 4 + →2 +
В разбавленной серной кислоте диспропорционирует на двухвалентную медь и металлическую медь:
Cu 2 O+H 2 SO 4(разбав.) →CuSO 4 +Cu 0 ↓+H 2 O
Также оксид меди(I) вступает в водных растворах в следующие реакции:
1. Медленно окисляется кислородом
до гидроксида
меди(II):
Медленно окисляется кислородом
до гидроксида
меди(II):
2 Cu 2 O +4 H 2 O + O 2 →4 Cu (OH ) 2 ↓
2. Реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
Cu 2 O +2 H Г→2 Cu Г↓ + H 2 O (Г= Cl , Br , J )
3.Восстанавливается до металлической меди типичными восстановителями, например, гидросульфитом натрия в концентрированном растворе:
2 Cu 2 O +2 NaSO 3 →4 Cu ↓+ Na 2 SO 4 + H 2 SO 4
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
1. При нагревании до 1800 °C (разложение):
2 Cu 2 O — 1800 ° C →2 Cu + O 2
2. При нагревании в токе водорода, монооксида
углерода,
с алюминиеми прочими типичными восстановителями:
При нагревании в токе водорода, монооксида
углерода,
с алюминиеми прочими типичными восстановителями:
Cu 2 O + H 2 — >250°C →2Cu +H 2 O
Cu 2 O + CO — 250-300°C →2Cu +CO 2
3 Cu 2 O + 2 Al — 1000° C →6 Cu + Al 2 O 3
Также, при высоких температурах оксид меди(I) реагирует:
1. C аммиаком (образуется нитрид меди(I))
3 Cu 2 O + 2 NH 3 — 250° C →2 Cu 3 N + 3 H 2 O
2. С оксидами щелочных металлов:
Cu 2 O+M 2 O- 600-800°C →2 М CuO (M= Li, Na, K)
При
этом образуются купраты меди (I).
Оксид меди (I) заметно реагирует с щелочами :
Cu 2 O +2 NaOH (конц.) + H 2 O ↔2 Na [ Cu (OH ) 2 ]
б) Гидроксид меди (I ) CuOH
Гидроксид меди(I) образует жёлтое вещество, не растворяется в воде.
Легко разлагается при нагревании или кипячении:
2 CuOH → Cu 2 O + H 2 O
в) Галогениды CuF , Cu С l , CuBr и CuJ
Все эти соединения – белые кристаллические вещества, плохо растворимые в воде, но хорошо растворимые в избытке NH 3 , цианидных ионов, тиосульфатных ионов и иных сильных комплексообразователей. Иод образует только соединение Cu +1 J. В газообразном состоянии образуются циклы типа (CuГ) 3 . Обратимо растворимы в соответствующих галогенводородных кислотах:
Cu Г + HГ ↔ H [ Cu Г 2 ] (Г= Cl , Br , J )
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4 Cu Г +2 H 2 O + O 2 →4 Cu (OH )Г (Г=Cl, Br)
г) Прочие соединения меди (I )
1. Ацетат меди (I) (СН 3 СООСu)
— соединение меди, имеет вид бесцветных
кристаллов. В воде медленно гидролизуется
до Сu 2 О,
на воздухе окисляется до ацетата
двухвалентной меди; Получают СН 3 СООСu
восстановлением (СН 3 СОО) 2 Сu
водородом или медью, сублимацией
(СН 3 СОО) 2 Сu
в вакууме или взаимодействием (NH 3 OH)SO 4
с (СН 3 СОО) 2 Сu
в р-ре в присутствии Н 3 СООNH 3 .
Вещество токсично.
Ацетат меди (I) (СН 3 СООСu)
— соединение меди, имеет вид бесцветных
кристаллов. В воде медленно гидролизуется
до Сu 2 О,
на воздухе окисляется до ацетата
двухвалентной меди; Получают СН 3 СООСu
восстановлением (СН 3 СОО) 2 Сu
водородом или медью, сублимацией
(СН 3 СОО) 2 Сu
в вакууме или взаимодействием (NH 3 OH)SO 4
с (СН 3 СОО) 2 Сu
в р-ре в присутствии Н 3 СООNH 3 .
Вещество токсично.
2. Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. Устойчивы во влажном состоянии. При детонации в отсутствие кислорода не образуется газообразных веществ. Под действием кислот разлагается. Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I):
С 2 H 2 +2[ Cu (NH 3 ) 2 ](OH ) → Cu 2 C 2 ↓ +2 H 2 O +2 NH 3
Данная
реакция используется для качественного
обнаружения ацетилена.
3. Нитрид меди — неорганическое соединение с формулой Cu 3 N, тёмно-зелёные кристаллы.
Разлагается при нагревании:
2 Cu 3 N — 300° C →6 Cu + N 2
Бурно реагирует с кислотами:
2 Cu 3 N +6 HCl — 300° C →3 Cu ↓ +3 CuCl 2 +2 NH 3
§3. Химические свойства двухвалентной меди (ст.ок. = +2)
Наиболее устойчивая степень окисления у меди и самая характерная для нее.
а) Оксид меди (II ) CuO
CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета. Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2 HNO 3 → Cu (NO 3 ) 2 + H 2 O
При сплавлении CuO со щелочами образуются купраты меди (II):
CuO +2 KOH — t ° → K 2 CuO 2 + H 2 O
При нагревании до 1100 °C разлагается :
4CuO- t ° →2 Cu 2 O + O 2
б) Гидроксид меди (II) Cu (OH ) 2
Гидроксид
меди(II) — голубое аморфное или кристаллическое
вещество, практически не растворимое
в воде.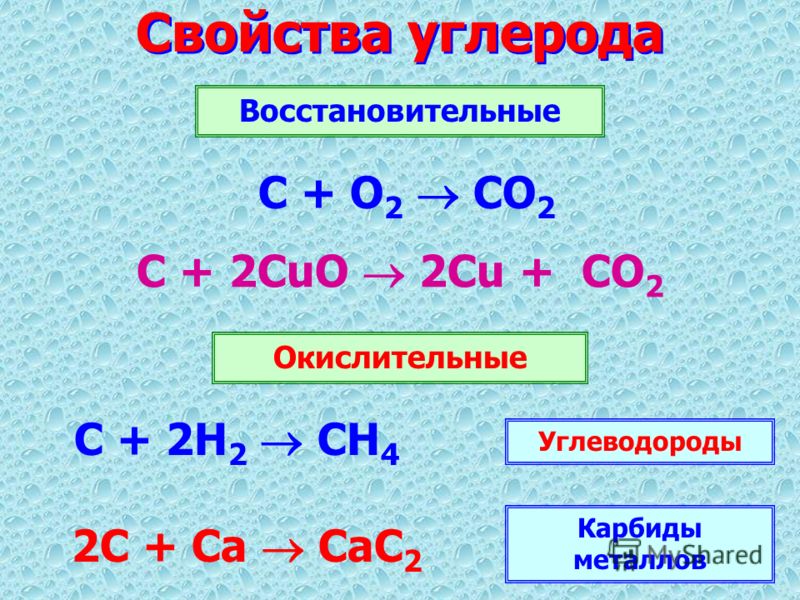 При нагревании до 70-90 °C порошка
Cu(ОН) 2
или его водных суспензий разлагается
до CuО и Н 2 О:
При нагревании до 70-90 °C порошка
Cu(ОН) 2
или его водных суспензий разлагается
до CuО и Н 2 О:
Cu (OH ) 2 → CuO + H 2 O
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Гидроксид меди(II) со слабыми кислотами образует основные соли . Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH) 2 +4NH 4 OH→(OH) 2 +4H 2 O
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu 2+ в растворе.
в) Соли меди (II )
Простые
соли меди (II)
известны для большинства анионов, кроме
цианида и иодида, которые при взаимодействии
с катионом Cu 2+
образуют ковалентные соединения меди
(I),
нерастворимые в воде.
Соли меди (+2), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона 2+ . Они часто кристаллизуются в виде гидратов. Так, из водного раствора хлорида меди (II) ниже 15 0 С кристаллизуется тетрагидрат, при 15-26 0 С – тригидрат, свыше 26 0 С – дигидрат. В водных растворах соли меди (II) в небольшой степени подвержены гидролизу, и из них часто осаждаются основные соли .
1. Пентагидрат сульфата меди (II) (медный купорос)
Наибольшее практическое значение имеет CuSO 4 *5H 2 O, называемый медным купоросом. Сухая соль имеет голубую окраску, однако при несильном нагревании (200 0 С) она теряет кристаллизационную воду. Безводная соль белого цвета. При дальнейшем нагревании до 700 0 С она превращается в оксид меди, теряя триоксид серы:
CuSO 4 — t ° → CuO + SO 3
Готовят
медный купорос растворением меди в
концентрированной серной кислоте. Эта
реакция описана в разделе «Химические
свойства простого вещества». Медный
купорос применяют при электролитическом
получении меди, в сельском хозяйстве
для борьбы с вредителями и болезнями
растений, для получения других соединений
меди .
Медный
купорос применяют при электролитическом
получении меди, в сельском хозяйстве
для борьбы с вредителями и болезнями
растений, для получения других соединений
меди .
2. Дигидрат хлорида меди (II).
Это темно-зеленые кристаллы, легкорастворимые в воде. Концентрированные растворы хлорида меди имеют зеленый цвет, а разбавленные – голубой. Это объясняется образованием хлоридного комплекса зеленого цвета:
Cu 2+ +4 Cl — →[ CuCl 4 ] 2-
И его дальнейшим разрушением и образованием голубого аквакомплекса.
3. Тригидрат нитрата меди (II).
Кристаллическое вещество синего цвета. Получается при растворении меди в азотной кислоте. При нагревании кристаллы сначала теряют воду, затем разлагаются с выделением кислорода и диоксида азота, переходя в оксид меди (II):
2Cu(NO 3 ) 2 — t° →2CuO+4NO 2 +O 2
4. Карбонат гидроксомеди (II).
Карбонат гидроксомеди (II).
Карбонаты меди малоустойчивы и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди Cu 2 (OH) 2 CO 3 , который встречается в природе в виде минерала малахита. При нагревании легко разлагается с выделением воды, оксида углерода (IV) и оксида меди (II):
Cu 2 (OH) 2 CO 3 — t° →2CuO+H 2 O+CO 2
§4. Химические свойства трехвалентной меди (ст.ок. = +3)
Эта степень окисления является наименее стабильной для меди, и поэтому соединения меди (III) являются скорее исключениями, чем «правилами». Тем не менее, некоторые соединения трехвалентной меди существуют.
а) Оксид меди (III) Cu 2 O 3
Это кристаллическое вещество, темно-гранатового цвета. Не растворяется в воде.
Получается окислением гидроксида меди(II) пероксодисульфатом калия в щелочной среде при отрицательных температурах:
2Cu(OH) 2 +K 2 S 2 O 8 +2KOH — -20°C →Cu 2 O 3 ↓+2K 2 SO 4 +3H 2 O
Это вещество разлагается при температуре 400 0 С:
Cu 2 O 3 — t ° →2 CuO + O 2
Окисид
меди (III)
– сильный окислитель. При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора :
При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора :
Cu 2 O 3 +6 HCl — t ° →2 CuCl 2 + Cl 2 +3 H 2 O
б) Купраты меди (Ш)
Это черные или синие вещества, в воде не устойчивы, диамагнитны, анион – ленты квадратов (dsp 2). Образуются при взаимодействии гидроксида меди(II) и гипохлорита щелочного металла в щелочной среде :
2 Cu (OH ) 2 + М ClO + 2 NaOH →2М CuO 3 + NaCl +3 H 2 O (M = Na — Cs )
в) Калия гексафторкупрат(III)
Зеленое вещество, парамагнитно. Октаэдрическое строение sp 3 d 2 . Комплекс фторида меди CuF 3 , который в свободном состоянии разлагается при -60 0 С. Образуется нагреванием смеси хлоридов калия и меди в атмосфере фтора:
3KCl + CuCl + 3F 2 → K 3 + 2Cl 2
Разлагает
воду с образованием свободного фтора.
§5. Соединения меди в степени окисления (+4)
Пока науке известно лишь одно вещество, где медь в степени окисления +4, это гексафторкупрат(IV) цезия – Cs 2 Cu +4 F 6 — оранжевое кристаллическое вещество, стабильное в стеклянных ампулах при 0 0 С. Бурно реагирует с водой. Получается фторированием при высоком давлении и температуре смеси хлоридов цезия и меди :
CuCl 2 +2CsCl +3F 2 — t ° р → Cs 2 CuF 6 +2Cl 2
Рекомендуем также
Химические свойства меди — Технические вопросы
Химическая активность меди невелика, в сухом воздухе при комнатной температуре почти не окисляется. При нагревании тускнеет из-за образования пленки оксидов. Заметное взаимодействие с кислородом воздуха начинается около 200°С по схеме.
Сначала при t
= 377°С образуется Cu2O, а выше 377°С – двухслойная
окалина, внутренний слой которой состоит из Cu2O,
внешний из CuO.
При низкотемпературном окислении пленок меди образуются две стабильные фазы: CuO0.67 при 383 К и СuO при 523 К.
Медь вытесняется из своих солей более электроотрицательными элементами и не растворимых в кислотах, не являющихся окислителями. Медь растворяется в азотной кислоте, с образованием Сu( NO3)2 и оксидов азота, в горячей концентрированной H2SO4 с образованием CuSO4 и SO2. В нагретой разбавленной H2SO4 медь растворяется только при продувании через раствор воздуха. Влажный хлор взаимодействует с медью уже при комнатной температуре, образуя хлорид меди (II), хорошо растворимый в воде. Медь реагирует и с другими галогенами.
Особое сродство
проявляет медь к сере: в парах серы она горит с водородом, азотом, углеродом
медь не реагирует даже при высоких температурах. Растворимость водорода в
твердой меди незначительна и при 4000°С составляет 0,06г в 100 г меди. Присутствие водорода в меди резко ухудшает ее механические свойства (так
называемая ‘водородная болезнь’). При пропускании аммиака над раскаленной медью
образуется Cu2N. Карбиды Cu2C2 и CuC2 могут быть получены
действием ацетилена на аммиачные растворы солей меди.
Присутствие водорода в меди резко ухудшает ее механические свойства (так
называемая ‘водородная болезнь’). При пропускании аммиака над раскаленной медью
образуется Cu2N. Карбиды Cu2C2 и CuC2 могут быть получены
действием ацетилена на аммиачные растворы солей меди.
Ввиду высокой тепло- и электропроводности, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Химические свойства медиОксид меди (I) Cu2O красного цвета, незначительно растворяется в воде. При взаимодействии сильных щелочей с солями меди (I) выпадает желтый осадок, переходящий при нагревании в осадок красного цвета, по-видимому, CuO. Гидроксид меди (I) обладает слабыми основными свойствами, он несколько растворим в концентрированных растворах щелочей.
CuO встречается в природе и может быть получен при
накаливании металлической меди на воздухе, хорошо растворяется в кислотах,
образуя соответствующие соли.
Гидроксид меди (II) Cu(OH)2 в виде объемистого осадка голубого цвета может быть получен при действии избытка водного раствора щелочи на растворы солей меди (II). В воде этот осадок малорастворим, а при нагревании переходит в CuO, отщепляя молекулу воды. Гидроксид меди (II) обладает слабо выраженными амфотерными свойствами и легко растворяется в водном растворе аммиака с образованием осадка темно-синего цвета. Осаждение гидроксида меди происходит при pH=5,5.
CuO2-это диамагнитное соединение голубовато-стального цвета.
При действие фтора на смесь KCl и CuCl2 образуются светло-зеленые кристаллы парамагнитного соединения K3CuF6.
Соединения меди (III)При действии
спиртового раствора щелочи и пероксида водорода на охлажденный до 50°С
спиртовой раствор хлорида меди (II) выпадает коричнево-черный
осадок пероксида меди CuO2. Это соединение в
гидратированой форме можно получить при действии пероксида водорода на раствор
соли сульфата меди, содержащего в небольших количествах Na2CO3. Суспензия Cu(OH)2 в растворе KOH взаимодействует с хлором, образуя осадок Cu2O3 красного цвета, частично
переходящий в раствор.
Суспензия Cu(OH)2 в растворе KOH взаимодействует с хлором, образуя осадок Cu2O3 красного цвета, частично
переходящий в раствор.
Теория по теме Хром и медь 11 класс профиль
Хром и медь
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
В природе хром встречается в виде следующих соединений.
Fe(CrO2)2 — хромистый железняк, хромит
(Mg, Fe)Cr2O4 — магнохромит
(Fe, Mg)(Cr, Al)2O4 — алюмохромит
Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Также применяют алюминотермию для вытеснения хрома из его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
Реакции с неметаллами
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3
Реакция с водой
Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑ + коэффициенты
Реакции с кислотами
Cr + 2HCl = CrCl2 + H2↑
Cr + H2SO4(разб. ) = CrSO4 + H2↑
) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Реакции с солями менее активных металлов
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III, реагирует с кислотами, кислотными оксидами.
4CrO + O2 = 2Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.
Оксид хрома III реагирует как с растворами щелочей, образуя комплексные соли, так и с кислотами.
Cr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + NaOH + H2O = Na3[Cr(OH)6] (нет прокаливания — в водном растворе, гексагидроксохромат натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления)
Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
CuFeS2 — медный колчедан, халькопирит
Cu2S — халькозин
Cu2CO3(OH)2 — малахит
Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
Реакции с неметаллами
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Реакции с кислотами
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
С оксидами неметаллов
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
Реакции с кислотами
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
Разложение
CuO = (t) Cu2O + O2
Восстановление
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди II — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
Разложение
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Реакции с кислотами
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Реакции с щелочами
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Реакции с кислотными оксидами
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II — (CuOH)2CO3)
Оксид меди(II) | AMERICAN ELEMENTS®
РАЗДЕЛ 1.
 ИДЕНТИФИКАЦИЯ
ИДЕНТИФИКАЦИЯНаименование продукта: Оксид меди(II)
Номер продукта: Все применимые коды продуктов American Elements, например. CU2-OX-02 , CU2-OX-03 , CU2-OX-04 , CU2-OX-05
Номер CAS: 1317-38-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
4
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS07
Acute Tox. 4 h402 Вреден при проглатывании.
Классификация согласно Директиве 67/548/ЕЭС или Директиве 1999/45/ЕС
Xn; Вреден для здоровья
R22: Вреден при проглатывании.
Н; Опасно для окружающей среды
R50/53: Очень токсичен для водных организмов, может вызывать долговременные неблагоприятные последствия в водной среде.
Информация об особых опасностях для человека и окружающей среды:
Н/Д
Опасности, не классифицированные иначе
Нет данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с Регламентом CLP .
Пиктограммы, обозначающие опасности
GHS07
Сигнальное слово: Осторожно
Указания на опасность
h402 Вреден при проглатывании.
Меры предосторожности
P264 Тщательно вымыть после работы.
P270 Не ешьте, не пейте и не курите при использовании этого продукта.
P301+P312 ПРИ ПРОГЛАТЫВАНИИ: Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу/…/, если вы плохо себя чувствуете.
P330 Прополоскать рот.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
WHMIS Классификация
Не контролируемая
Система классификации
HMIS Ratings (масштаб 0-4)
(система идентификации опасных материалов)
Здоровье
Огонь
Реактивность
2
0
0
Здоровье (острые эффекты) = 2
воспламеняемость = 0
Физическая опасность = 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
РАЗДЕЛ 3.СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
Вещества
Номер CAS / Название вещества:
1317-38-0 Оксид меди(II)
Идентификационный номер(а):
Номер ЕС: 215-269-1
РАЗДЕЛ 4. МЕРЫ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт негорючий.Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пар оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты.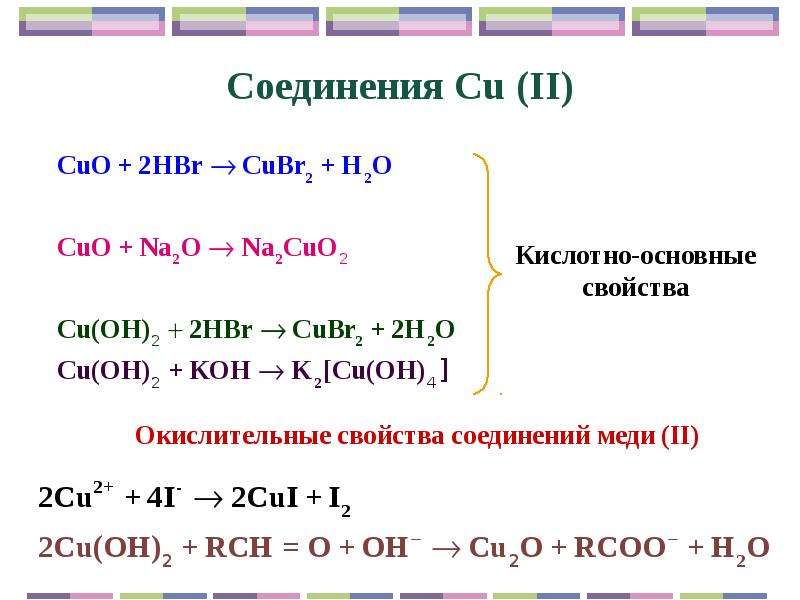 Держите незащищенных людей подальше.
Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Хранить вдали от алюминия, алюминиевых сплавов.
Хранить вдали от металлических порошков.
Хранить вдали от магния/магниевых сплавов.
Хранить вдали от щелочных металлов.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Особое конечное использование(я)
Данные отсутствуют
РАЗДЕЛ 8.КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем:
Правильно работающий химический вытяжной шкаф, предназначенный для опасных химических веществ и имеющий среднюю скорость не менее 100 футов в минуту.
Параметры управления
Компоненты с предельными значениями, требующими контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа N95 (США) или PE (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха.Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Материал перчаток
Нитрилкаучук, NBR
Время проникновения через материал перчаток (в минутах): Данные отсутствуют
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9.ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Различные формы (порошок/чешуйки/кристаллы/гранулы и т.д.)
Цвет: Черный
Запах: Без запаха
Порог восприятия запаха: Нет данных.
pH: нет данных
Точка плавления/диапазон плавления: 1326 °C (2419 °F)
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ): данные отсутствуют доступный.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров:
Н/Д
Плотность при 20 °C (68 °F): 6,3–6,49 г/см 3 (52,574–54,159 фунтов) /гал)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): Нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Данные отсутствуют
РАЗДЕЛ 10.СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Опасные реакции не известны
Условия, которых следует избегать
Нет данных
Несовместимые материалы:
Окислители
Металлические порошки
Щелочные металлы
Алюминий/алюминиевые сплавы.
Магний/сплавы магния
Опасные продукты разложения:
Пар оксида металла
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Вреден при проглатывании.
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD/LC50, соответствующие классификации: Пероральная LD50 470 мг/кг (крыса)
Раздражение или коррозия кожи: Может вызывать раздражение
Раздражение или коррозия глаз: Может вызывать раздражение
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность:
EPA-D: Канцерогенность для человека не классифицируется: неадекватные доказательства канцерогенности для людей и животных или данные отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность на орган-мишень — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна имеется
Потенциал биоаккумуляции
Нет данных
Подвижность в почве
Нет данных
Экотоксическое воздействие:
Примечание:
Очень токсичен для водных организмов
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Также ядовит для рыб и планктона в водоемах.
Может оказывать долговременное вредное воздействие на водные организмы.
Избегайте попадания в окружающую среду.
Очень токсичен для водных организмов
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
Другие неблагоприятные воздействия официальные правила для обеспечения надлежащей утилизации.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA
UN3077
Надлежащее отгрузочное наименование ООН
DOT
Опасные для окружающей среды вещества, твердые, н.у.к. (оксид меди(II))
IMDG, IATA
ВЕЩЕСТВО ТВЕРДОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ, Н.У.К. (оксид меди(II))
Класс(ы) опасности при транспортировке
DOT, IMDG
Класс
9 Прочие опасные вещества и изделия.
Маркировка
9
Класс
9 (M7) Прочие опасные вещества и изделия
Маркировка
9
IATA
Класс
9 Прочие опасные вещества и изделия.
Этикетка
9
Группа упаковки
DOT, IMDG, IATA
III
Опасность для окружающей среды:
Специальная маркировка (ADR):
Символ (рыба и дерево)
Специальная маркировка (IATA):
Символ (рыба и дерево)
Особые меры предосторожности для пользователя
Предупреждение: Различные опасные вещества и предметы
Номер EMS:
FA,SF
Транспортировка навалом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
N/A
Транспорт/Дополнительная информация:
DOT
Загрязнитель морской среды ( DOT):
№
ООН «Модельный регламент»:
UN3077, Вещества, опасные для окружающей среды, твердые, н.Операционные системы. (оксид меди(II)), 9, III
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Агентство по защите Закон о контроле за токсичными веществами Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
1317-38-0 Оксид меди(II)
Предложение 65 штата Калифорния
Предложение 65 – Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Прочие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16.ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом.Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Оксид меди – свойства, структура, использование и получение
Что такое оксид меди(I)?
Оксид меди, в котором медь находится в жидкой форме, называется оксидом меди. Cu2O представляет собой химическую структуру закиси меди. Ну, здесь в Cu2O медь и кислород имеют ковалентную связь; следовательно, он, естественно, имеет ковалентные связи.Кристаллы закиси меди имеют кубическую форму. При нагревании раствора Cu2O в присутствии водорода раствор быстро восстанавливается. Он диспропорционирует в растворе кислоты с образованием ионов меди и меди (II). Закись меди при нагревании с металлической медью превращается в закись меди. При наличии влаги в воздухе кислород вступает в реакцию с медью на поверхности любого предмета, и оксид меди в таких условиях может выступать в качестве антикоррозионного средства. Он будет служить защитным слоем тонкого оксида.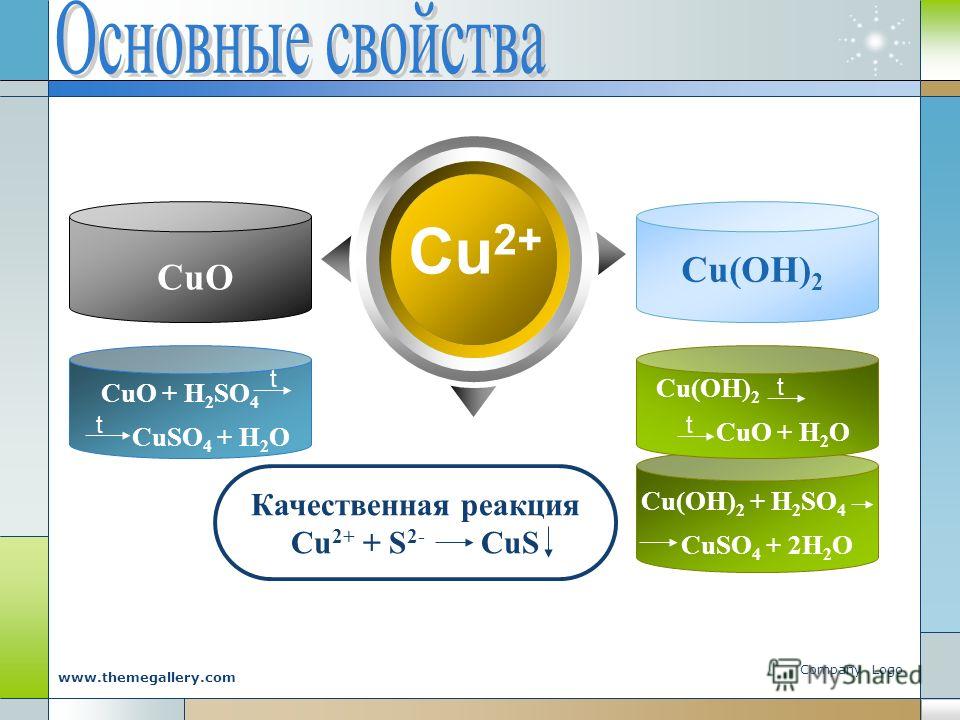
Оксид меди представляет собой чистое соединение всех разновидностей соединений меди. Это заметно из-за удобства использования и универсальности физических свойств. Сверхпроводимость при более высокой температуре, эффекты электронных корреляций и спиновая динамика делают оксид меди полезным во многих отношениях. Кроме того, оба его свойства, то есть химические и физические, очень стабильны и, следовательно, могут быть легко смешаны с водными растворами или полимерами. Кроме того, оксид меди не дорог.
Другие химические названия, используемые для оксида меди: Red Cu 2 O, оксид меди и оксид меди.
Cu 2 O Химические названия: оксид меди (I), оксид меди (II)
Физические свойства оксида меди
Цвет оксида меди
Цвет оксида меди немного сбивает с толку, так как иногда вы могли видеть красный цвет или оксиды меди черного цвета. Что ж, здесь вы должны иметь четкое представление о том, что существует два типа оксидов меди, такие как оксид меди (I) черного цвета и оксид меди (II) красного цвета.
Другие Технические характеристики
O39Cu 2 O | |||
плотность | 6 г / см³ | ||
Молекулярный Вес/Молярная масса | 143.09 г / моль | ||
кипение | 1 800 ° C | ||
1,232 C | |||
Химическая формула оксида меди | CU2O |
Медь (I) Оксидная структура — CU2O
[изображение будет загружено в ближайшее время]
физические свойства меди (I) оксида — CU2O
0появление | Cold-Colidal | ||
без запаха | |||
COOVELELENTE-BANDED | 3 0 | ||
сложности | 2. | ||
Heavy Atom Count | 3 | 3 | |
60439 | 11 | Нерастворимый в воде |
Химические свойства: Медь (I) Оксид — CU2O
Медь (I ) Оксид может реагировать с водой, поскольку в воде присутствует кислород, и образовывать гидроксид меди (II). Ниже приводится химическое уравнение для понимания химической реакции оксида меди (I) и воды.
2Cu2O + 4h3O + O 2 → 4Cu(OH)2
В результате химической реакции между хлористым водородом и оксидом меди (I) образуется хлорид меди (I). Ну, кислород оксида меди (I) восстанавливается атомами хлора и относительно образует хлорид меди. Вы можете понять химическую реакцию между хлористым водородом и Cu 2 O из приведенного ниже химического уравнения.
Cu2O + 2HCl → 2CuCl + h3O
Использование оксида меди Cu2O
Дно корабля обычно подвергается воздействию морской воды, поэтому необходимо покрыть дно краской, а оксид меди является лучшим вариантом для необрастающих красок.
 Оксид меди обладает свойством эффективно контролировать коррозию.
Оксид меди обладает свойством эффективно контролировать коррозию.Часть фарфоровых красок.
Фотоэлементы для изготовления выпрямителей и люксметров содержат полупроводник p-типа, которым может быть оксид углерода.
Может использоваться как протравитель семян и фунгицид.
Они используются в высокотехнологичных сверхпроводниках, полупроводниках и преобразовании солнечной энергии.
Может применяться в термоэлектрических материалах, катализаторах, сверхпроводящих материалах, стекле, сенсорных материалах, керамике и других областях.
Медь и оксид меди: разница
Медь образует два разных оксида в зависимости от валентности. Оксид меди и оксид меди. Оксид меди представляет собой порошок коричневого цвета, а оксид меди — красного цвета.
Когда атом медной полосы присоединен к молекуле кислорода, то это медная кислота. Когда атом кислорода присоединен к двум атомам меди, говорят, что это закись меди. Закись меди находится в основном в активном состоянии, а окись меди в полностью окисленном состоянии.
Насколько оксид меди безвреден для человека?
Высокореактивные молекулы необходимы для уничтожения бактерий, а оксид меди хорошо улавливает электроны. Он также может высвобождать свободные радикалы, а также обладает способностью уничтожать любой патоген, если он обнаружен на поверхности. Закись меди нестабильна и поэтому действует быстрее, чем окись меди.
Таким образом, можно сделать вывод, что закись меди безопасна для человека и токсична для бактерий. Что ж, размер также имеет значение, когда речь идет о соотношении между клетками оксида меди и некоторыми бактериями.
Получение оксида меди
Наиболее распространенный способ получения оксида меди (I) путем окисления металлической меди.
4Cu + O2 → 2Cu2O
Это происходит, если оставить медь на воздухе. Это чертовски медленно (как железо ржавеет). Вы можете ускорить процесс, добавив воду и определенные кислоты, но он все равно будет медленным.
Оксид меди (I), наиболее часто производимый в промышленных масштабах с использованием другой формы оксида меди, оксида меди (II). Вы помещаете оксид меди (II) в печь с элементарной медью, и происходит окислительно-восстановительная реакция, в результате которой образуется оксид меди (I).
Оксид меди (I) можно также получить путем электролиза водного раствора хлорида натрия между медными электродами.
Оксид меди – получение, свойства, применение и часто задаваемые вопросы
Оксид меди – это неорганическое химическое соединение, состоящее из иона меди и иона оксида. Медно-медные соединения представляют собой две формы ионов меди. Медь существует в двух типах оксидов: один с более высокой степенью окисления, а другой с более низкой степенью окисления, оксид меди и оксид меди соответственно.
Окись меди и окись меди
Оксиды меди бывают двух типов:
Оксид меди – также известен как оксид меди. Степень окисления меди в этом соединении равна +2. +2 — высшая степень окисления меди. Вообще, короче, можно написать как оксид меди. Он существует в моноклинной кристаллической системе.
Закись меди — степень окисления меди в этом соединении +1. +1 — промежуточная степень окисления меди. Он может легко окисляться или восстанавливаться.
Оксиды меди представлены как CuO и Cu2O соответственно.
Получение оксида меди и оксида меди
Оксид меди можно получить следующими способами:
Его можно получить термическим разложением карбоната меди.
CuCO3 → CuO + CO2
При термическом разложении карбоната меди образуется оксид меди в качестве продукта и газообразный диоксид углерода в качестве побочного продукта.
Другим способом получения оксида меди является нагревание меди в присутствии воздуха при высокой температуре (около 300-800 градусов Цельсия).
Cu + O2 → CuO
Нагрев нитрата меди- Нитрат меди термически нестабилен. При нагревании нитрата меди при температуре около 180 градусов Цельсия.
2Cu (NO3)2 → 2 CuO + O2 + 4 NO2 (реакция протекает при температуре около 180 градусов Цельсия) Он легко разлагается на оксид меди при нагревании.
Cu(OH)2 → CuO + h3O
Свойства оксида меди
Физические свойства оксида меди
Оксид меди представляет собой соединение черного цвета.
Оксид меди существует в виде порошка (аморфного).

Температура плавления оксида меди 1326 градусов Цельсия.
Оксид меди нерастворим в воде.
Оксид меди растворим в хлориде аммония и цианиде калия.
Химические свойства оксида меди
CuO + HNO3 → Cu (NO3)2 + h3O
CuO + 2HCl → CuCl2 + h3O
CuO + h3SO4 → CuSO4 + h3O
Cu(OH)4]
CuO + h3 → Cu + h3O
CuO + CO → Cu + CO2
2CuO + C → 2Cu + CO2
Использование оксида меди
Оксид меди используется в качестве пигмента агент в керамических компаундах.Дает синюю, красную, зеленую, серую, розовую и черную глазури.
Оксид меди широко используется в лабораториях для получения различных солей меди.

Оксид меди используется в производстве консервантов для древесины.
Оксид меди используется в процессе сварки.
Оксид меди используется в производстве литиевых батарей.
Знаете ли вы?
Парамелаконит — медный минерал.В этом минерале медь существует как в +1, так и в +2 степени окисления.
Как вы думаете, медь была первым элементом, использованным человеком наряду с золотом и железом?
Медь является важным элементом для человеческого организма.
Медь используется при формировании сплавов.

Кровь осьминога содержит медь в качестве переносчика кислорода. Поэтому цвет крови у них голубой.
Медь является важным микроэлементом.
Медь используется в качестве добавки к железу для людей с анемией.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Электрические свойства наночастиц оксида меди
[1]
Дж. Г. Ху, Т.В. Одом и К.М. Либер, акк. хим. Рез. 32, 435 (1999).
Г. Ху, Т.В. Одом и К.М. Либер, акк. хим. Рез. 32, 435 (1999).
[2] А.Хенглейн, хим. 89, 1861 (1989).
[3]
Э.П. Вольффарт, Ферромагнитные материалы, Vol. II, Северная Голландия, Амстердам, Нью-Йорк, Оксфорд, Токио (1980).
II, Северная Голландия, Амстердам, Нью-Йорк, Оксфорд, Токио (1980).
[4] М.Чанг, Х. Лю, С.Ю. Тай, Порошковые технологии 207, 378–386 (2011).
[5]
ЧАС. Ван, Дж. Сюй, Дж. Чжу, Х. Чен, Журнал роста кристаллов 244, 88–94 (2002).
Ван, Дж. Сюй, Дж. Чжу, Х. Чен, Журнал роста кристаллов 244, 88–94 (2002).
[6] А.Э. Рахшни, Solid State Electron 29, 7 (1986).
[7]
Т. Исихара, К. Kometani, M.Hashida, and Y.Takita, J.Electrochem. Soc 138, 173–177 (1991).
Kometani, M.Hashida, and Y.Takita, J.Electrochem. Soc 138, 173–177 (1991).
[8] А.Кумар, К. Перумал и П. Тирунавуккарасу, J. Optoelectron. Доп. Матер. Быстрое Сообщество 4, 831–833 (2010).
[9]
К. С. Ким, У.Х. Пэк, Дж. М. Ким, Т.С. Юн, Х.Х. Ли, Си Джей Кан и Ю.С. Ким, Дж. Сенс 10, 765–774 (2010).
С. Ким, У.Х. Пэк, Дж. М. Ким, Т.С. Юн, Х.Х. Ли, Си Джей Кан и Ю.С. Ким, Дж. Сенс 10, 765–774 (2010).
[10] Д.Сюэ, К. Китамура, Solid State Commun 122, 537–541 (2002).
[11]
С. П. Смит, Диэлектрическое поведение и структура. Acta Cryst 9, 838-839 (1956).
П. Смит, Диэлектрическое поведение и структура. Acta Cryst 9, 838-839 (1956).
[12] Н.М. Равиндра, Р.П. Бхарадвадж, К. Сунил Кумар и В.К. Шривастава, Infrared Phys 21, 369-381 (1981).
[13]
В. Кумар и Б.С.Р. Sastry, J. Phys. хим. Твердые тела 66, 99-102 (2005).
Кумар и Б.С.Р. Sastry, J. Phys. хим. Твердые тела 66, 99-102 (2005).
[14] Д.Р. Пенн, Phys. 128, 2093–2097 (1962).
[15]
Н. М. Равиндра и В.К. Шривастава, Infrared Phys 20, 399-418 (1980).
[16] Р.R. Reddy, Y. NazeerAhammed и M.J. Ravi Kumar, Phys. хим. Твердые тела 56, 825-829 (1995).
CuO | PVEducation
Основная информация
Альтернативные имена:
- оксид меди (ii)
- оксид меди
- черная медь
- Тенорит — назван в честь профессора Микеле Теноре, итальянского ботаника из Неаполитанского университета, Италия [1]
CuO — вторичный минерал меди, редкоземельный металл и наиболее стабильная форма окисленной меди
Встречается в зоне окисления гидротермальных месторождений меди, вулканическая возгон [1]
CuO — полупроводник p-типа
Кристаллическая структура
Данные рентгеновской дифракции:
ДЛИНА ВОЛНЫ РЕНТГЕНОВСКОГО ИЗЛУЧЕНИЯ: 1. 541838
541838
МАКС. АБС. ИНТЕНСИВНОСТЬ / ОБЪЕМ**2: 94,00384821
| 2θ | Интенсивность | D-интервал | Х | К | л | Множественность |
|---|---|---|---|---|---|---|
| 32,72 | 5,84 | 2,7372 | 1 | 1 | 0 | 4 |
| 35,64 | 30,43 | 2,5191 | 0 | 0 | 2 | 2 |
| 35.76 | 80,26 | 2,5108 | -1 | 1 | 1 | 4 |
| 38,96 | 100 | 2,3118 | 1 | 1 | 1 | 4 |
| 39,26 | 23,3 | 2,2947 | 2 | 0 | 0 | 2 |
| 46,54 | 1,59 | 1,9516 | -1 | 1 | 2 | 4 |
| 49.1 | 28,24 | 1,8553 | -2 | 0 | 2 | 2 |
| 51,67 | 1,03 | 1,769 | 1 | 1 | 2 | 4 |
| 53,76 | 11,47 | 1,705 | 0 | 2 | 0 | 2 |
| 58,72 | 14,81 | 1,5724 | 2 | 0 | 2 | 2 |
61. 92 92 | 20,59 | 1,4986 | -1 | 1 | 3 | 4 |
| 66,18 | 16.04 | 1.412 | 0 | 2 | 2 | 4 |
| 66,8 | 15,56 | 1.4004 | -3 | 1 | 1 | 4 |
| 68,34 | 9,91 | 1,3726 | 1 | 1 | 3 | 4 |
| 68.57 | 14.08 | 1,3686 | 2 | 2 | 0 | 4 |
| 73.01 | 7,87 | 1,296 | 3 | 1 | 1 | 4 |
| 75,48 | 5,82 | 1,2596 | 0 | 0 | 4 | 2 |
| 75,77 | 6,97 | 1.2554 | -2 | 2 | 2 | 4 |
| 80.76 | 2,32 | 1. 1899 1899 | -2 | 0 | 4 | 2 |
| 83,06 | 5,17 | 1,1628 | -3 | 1 | 3 | 4 |
| 83,66 | 5,08 | 1.1559 | 2 | 2 | 2 | 4 |
| 84,43 | 4 | 1.1474 | 4 | 0 | 0 | 2 |
График рентгенограмм тонких пленок оксида меди после осаждения и отжига при различных температурах можно найти в ссылке .
График порошковой рентгенограммы наночастиц CuO (образец № 2) (а) до прокаливания, (б) после прокаливания (матрица ПЭГ), (в) после прокаливания (матрица ПВС) и (г) после прокаливания (шаблон PPG) можно найти по ссылке.
Фотоэлектрические приложения
CuO использовался в исследованиях солнечных элементов. В Университете Шиги слои CuO толщиной 100 нм были нанесены центрифугированием на подложку FTO. Был сделан вывод, что формирование тонких пленок CuO более высокого качества может повысить эффективность ячейки CuO в будущем.-2 и напряжение холостого хода ( В OC ) 45мВ. Солнечный элемент CuO(450°C)/(эвач.) показал аналогичные фотоэлектрические характеристики. Эту таблицу можно найти по ссылке.
Был сделан вывод, что формирование тонких пленок CuO более высокого качества может повысить эффективность ячейки CuO в будущем.-2 и напряжение холостого хода ( В OC ) 45мВ. Солнечный элемент CuO(450°C)/(эвач.) показал аналогичные фотоэлектрические характеристики. Эту таблицу можно найти по ссылке.
В Чиангмайском университете солнечные элементы, сенсибилизированные красителем ZnO (DSSC) с различными фотоэлектродами, изучались на влияние слоя CuO в качестве барьерного слоя на характеристики преобразования энергии.
Принципиальную схему структур DSSC с различными фотоэлектродами для слоя ZnO/CuO можно найти по ссылке.
Полупроводниковые оксиды являются многообещающей альтернативой солнечным элементам на основе кремния, поскольку они обладают высоким оптическим поглощением и состоят из недорогих материалов.
Возможные области применения: фотопроводящие, фототермические датчики, датчики катализа и газа
CuO использовался в фотоэлектрохимических элементах
CuO использовался в качестве слоя переноса отверстий и барьерного слоя для солнечных элементов, сенсибилизированных красителем, активного слоя в различных типах солнечных элементов, пассивного слоя в солнечно-селективных поверхностях.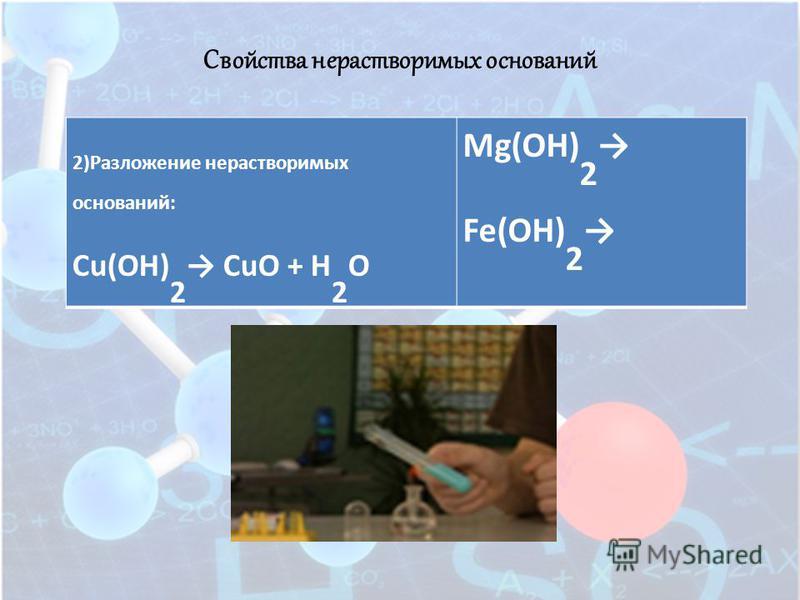
Из него может получиться хороший селективный поглощающий слой из-за его высокой солнечной абсорбции и низкого коэффициента теплового излучения.
Подготовлено: напылением, химической конверсией, химическим отбеливанием, травлением, электроосаждением, электронно-лучевым испарением, реактивным напылением постоянным током и химическим осаждением из паровой фазы
| 25°С | 100°С | 200°С | 300°С | ||
| α с | 0.73 | 0,73 | 0,73 | 0,73 | |
| CuO | ε | 0,040 | 0,038 | 0,044 | 0,052 |
| 300°С | α с / ε | 18,2 | 19,1 | 16,4 | 13,9 |
| α с | 0,90 | 0,90 | 0. 90 90 | 0,90 | |
| CuO | ε | 0,52 | 0,55 | 0,59 | 0,65 |
| 500°С | α с / ε | 1,73 | 1,63 | 1,51 | 1,39 |
[10] Солнечное поглощение α S , тепловое воздействие ε , и селективность α S
Cuo пленки, нанесенные на стеклянную подложку с золотой покрытием
CuO, приготовленная при 500°C, показывает меньшие значения селективности, что указывает на то, что хорошо закристаллизованная пленка CuO не может быть использована в качестве поверхности, селективной к солнечному свету.
Основные параметры при 300 К
| Кристаллическая структура | Моноклиника | [11] |
| Группа симметрии | – С 2/с | [11], [12] |
| Объем ячейки: | В 80,63 ų | |
| Плотность | 6,31 г/см³ | |
| Диэлектрическая проницаемость | 18,1 | [13] |
| Эффективная масса электрона | 0. 4-0,95 4-0,95 | |
| 7,9 м или | ||
| Сродство к электрону | 4,07 эВ | |
| Константы решетки | а = 4,652 Å б = 3,410 Å с = 5,108 Å | [11], [12] |
| Ширина запрещенной зоны | 1,35 эВ |
Структура полос и концентрация носителей
Диаграмма, показывающая ширину запрещенной зоны: 1,3 – 1.3/T в интервале температур 125–365 K и график зависимости проводимости от температуры в виде ln(σT 1/2 ) vs. 10 3 /T можно найти по ссылке [17].
Эффективная масса: 7,9 м 0
Электрические свойства
Доступны ограниченные данные
CuO антиферромагнитен
| Подвижные отверстия [18]: | 0,1 см 2 В −1 с−1 |
| Электрический дипольный момент [19]: | 4. 500,5 (Дебай) 500,5 (Дебай) |
График зависимости плотности тока прибора от напряжения ( СП ) как в темноте, так и на свету (при освещении АМ 1,5 100 мВт/см2) двухслойной ячейки с толщиной слоя CuO ~40 нм можно найти по ссылке.
График измеренных J-V характеристик тонких пленок CuO/ в темноте и при освещении AM1.5 можно найти по ссылке .
Оптические свойства
Основная информация [20]:
| Тип: | Анизотропный |
| Анизотропизм: | Сильный, от синего до серого |
| Двойное отражение: | Сильный |
| Цвет в отраженном свете: | светло-серый с золотистым оттенком |
| Плеохромизм: | Слабый |
| Комментарии: | Отчетливый, от светло-коричневого до темно-коричневого |
| Коэффициент поглощения [21]: | α=0 |
График спектров оптического пропускания ( T %) тонкой пленки оксида меди после осаждения и отжига при различных температурах можно найти по ссылке Serin2005.
Показатель преломления: n=2,65498 и коэффициент экстинкции: k=0 можно найти из ссылки [21].
Тепловые свойства
| Энтальпия образования (298,15 К) [19]: | 306,27 кДж/моль (Погрешность: 41,8 кДж/моль) |
| Энтропия (298,15 К) [19]: | 234,62 Дж/моль*К |
| Интегральная теплоемкость (0-298,15 К) [19]: | -9,75 кДж/моль |
| Теплоемкость (298.15 К) [19]: | 35,69 Дж/моль*К |
График рентгенограмм под углом скольжения тонкой пленки оксида меди на пластине n-Si при различных температурах осаждения, график рентгеновских фотоэмиссионных спектров Cu 2p пленки оксида меди при различных температурах осаждения и график Спектрофотометрическое пропускание пленки оксида меди, осажденной при различных температурах, можно найти по ссылке.
Механические свойства
| Колебательная нулевая энергия [19]: | 320. 1 1 |
| Постоянные вращения [19]: | А: 0 Б: .44454 С: .44454 |
| Произведение моментов инерции [19]: | 37, а.е.м. Å 6,29711E-39 г см² |
| Модуль Юнга [23]: | 81,6 ГПа |
Каталожные номера
[11] О. Маделунг, Полупроводники: основные данные (Springer-Verlag, Германия, 1996) с.11
[12] Ландольт-Бёрнштейн, Численные данные и функциональные отношения в науке и технике.
Полупроводники 17, (1983)
Диэлектрик%20Constants.htm>
[19] NIST Computational Chemistry Comparison and Benchmark DataBase 101, «Список экспериментальных
группа=КРИСТАЛЛ&материал=CuO>(2008)
Разработка этих страниц о свойствах фотогальванических материалов была выполнена в Университете штата Юта в первую очередь студентами бакалавриата Джеффом Провостом и Кариной Хан, работающими с проф. Майк Скарпулла. Кейтлин Арндт, Кристиан Роберт, Кэти Фурс, Джаш Саяни и Лиз Лунд также внесли свой вклад. Работа была полностью поддержана Национальным научным фондом США в рамках программы Materials World Network, награда 1008302. Эти страницы находятся в стадии разработки, и мы запрашиваем информацию у знающих сторон по всему миру для получения более точной или дополнительной информации. Свяжитесь с [email protected] с такими предложениями. Ни Университет Юты, ни NSF не гарантируют точность этих значений.
Майк Скарпулла. Кейтлин Арндт, Кристиан Роберт, Кэти Фурс, Джаш Саяни и Лиз Лунд также внесли свой вклад. Работа была полностью поддержана Национальным научным фондом США в рамках программы Materials World Network, награда 1008302. Эти страницы находятся в стадии разработки, и мы запрашиваем информацию у знающих сторон по всему миру для получения более точной или дополнительной информации. Свяжитесь с [email protected] с такими предложениями. Ни Университет Юты, ни NSF не гарантируют точность этих значений.
Формирование поверхностей с наноцветами CuO путем погруженного фотосинтеза кристаллитов и их антимикробная активность
SPSC для изготовления поверхности с наноцветами CuO
лечение плазмой. В установке с плазмой раствора эволюция плазмы соответствует увеличению тока и напряжения от высокого до низкого (дополнительный рисунок S1). Условия тлеющего разряда с голубовато-зеленым световым излучением достигались при диапазоне приложенного напряжения 110–140 В. Плазма дугового разряда с интенсивным красновато-оранжевым световым излучением образовывалась при приложенном напряжении >160 В. При 110 В можно было наблюдать свечение с нижнего конца катода. Здесь электрическое поле усиливалось с увеличением напряжения на ячейке и приводило к растеканию плазмы по поверхности катода. При воздействии УФ-облучения в течение 48 часов на образцы, обработанные плазмой при напряжении 110–140 В, формировались цветкообразные нанокристаллы (рис. 1 (e–g)). На поверхности образцов, прошедших дуговой разряд >160 В, образования таких кристаллов не наблюдалось (рис.1(з)). После тлеющего разряда образовались затравочные неоднородности оксида металла (нановыпуклости) (рис. 2(b)) 19, 21, 22 . Поэтому мы выбираем диапазон напряжений 130–140 В в качестве оптимизированных условий плазменной обработки для следующих экспериментов SPSC.
Плазма дугового разряда с интенсивным красновато-оранжевым световым излучением образовывалась при приложенном напряжении >160 В. При 110 В можно было наблюдать свечение с нижнего конца катода. Здесь электрическое поле усиливалось с увеличением напряжения на ячейке и приводило к растеканию плазмы по поверхности катода. При воздействии УФ-облучения в течение 48 часов на образцы, обработанные плазмой при напряжении 110–140 В, формировались цветкообразные нанокристаллы (рис. 1 (e–g)). На поверхности образцов, прошедших дуговой разряд >160 В, образования таких кристаллов не наблюдалось (рис.1(з)). После тлеющего разряда образовались затравочные неоднородности оксида металла (нановыпуклости) (рис. 2(b)) 19, 21, 22 . Поэтому мы выбираем диапазон напряжений 130–140 В в качестве оптимизированных условий плазменной обработки для следующих экспериментов SPSC.
Морфология поверхности после SPSC медной подложки. Изображения FE-SEM поверхностей образцов ( a – d ) после обработки плазмой раствора при 110–160 В и ( e – h ) образцов после 48 часов УФ-облучения с последующей плазменной обработкой, описанной выше. На вставках ( a – d ) представлены фотографии образцов в процессе плазменной обработки. Вставки ( e — h ) представляют собой увеличенные изображения каждого.
На вставках ( a – d ) представлены фотографии образцов в процессе плазменной обработки. Вставки ( e — h ) представляют собой увеличенные изображения каждого.
Отслеживание фотохимической реакции образования CuO. График pH-температура во время SPSC в ( a ) с соответствующим временем УФ-облучения, обозначенным красными линиями. На вставке показана увеличенная зависимость рН от времени во время начального 2-часового УФ-облучения. ( b ) FE-SEM изображение образца до УФ-облучения.Врезка — увеличенное изображение. Можно наблюдать мелкие неровности порядка нескольких нанометров на поверхности (нановыпуклости). ( c ) Мелкие волокнистые кристаллы, видимые в образцах после 5-часового УФ-облучения. ( d ) Образец после 24-часового УФ-облучения; на поверхности образовались наноцветы.
Кроме того, с точки зрения анализа EDS было подтверждено, что компоненты наноцветка имеют состав CuO (дополнительный рисунок S2 и таблица S1). Как видно на образце из состояния дугового разряда, когда после плазменной обработки не происходило образования нановыпуклостей на поверхности образца, образования кристаллов наноцветков после УФ-облучения не наблюдалось. Дуговой разряд обеспечивает высокую проводимость, поскольку большое количество электронов поступает за счет термоэлектронной эмиссии с нагретого катода 21 . В это время текущее значение становится очень высоким. Если материал, используемый в качестве катода, представляет собой металл с низкой температурой плавления, металл плавится мгновенно 21,22,23 .По этой причине в условиях дугового разряда на поверхности образца не образовывались нановыпуклости.
Как видно на образце из состояния дугового разряда, когда после плазменной обработки не происходило образования нановыпуклостей на поверхности образца, образования кристаллов наноцветков после УФ-облучения не наблюдалось. Дуговой разряд обеспечивает высокую проводимость, поскольку большое количество электронов поступает за счет термоэлектронной эмиссии с нагретого катода 21 . В это время текущее значение становится очень высоким. Если материал, используемый в качестве катода, представляет собой металл с низкой температурой плавления, металл плавится мгновенно 21,22,23 .По этой причине в условиях дугового разряда на поверхности образца не образовывались нановыпуклости.
Механизм фотохимической реакции роста наностержней CuO
На рисунке 2(а) показан график временной зависимости рН и температуры во время СФСК. Черные линии показывают значения pH, а синяя линия показывает температуру. Температура воды резко повышалась с 20 °C в течение первых 1–2 часов УФ-облучения. Затем она стала постоянной при ~35 °C. При этом исходное значение рН начало колебаться от 7.0 в течение первых 1–2 часов УФ-облучения. pH после 5 часов облучения был в значительной степени постоянным, а затем начал повышаться и стал постоянным при pH = 8,5 примерно через 24 часа облучения. Изображения
Затем она стала постоянной при ~35 °C. При этом исходное значение рН начало колебаться от 7.0 в течение первых 1–2 часов УФ-облучения. pH после 5 часов облучения был в значительной степени постоянным, а затем начал повышаться и стал постоянным при pH = 8,5 примерно через 24 часа облучения. Изображения
FE-SEM после 5 часов УФ-излучения и после 24 часов УФ-излучения показаны на рис. 2(c,d). Волокнистые кристаллиты Cu(OH) 2 наблюдались на 5-часовом УФ-облученном образце. Цветкообразные кристаллы CuO с наностержнями CuO с заостренными концами наблюдались на поверхностях образцов, подвергнутых 24-часовому УФ-облучению.Однако в случае без УФ-облучения, то есть только в гидротермических условиях при повышенной температуре, такое образование наноцветков не наблюдалось (дополнительный рисунок S3).
Результаты РФА на каждом этапе представлены на рис. 3. С увеличением времени УФ-облучения доля CuO увеличивалась. Из этих результатов было подтверждено, что поверхностный слой содержал не только CuO, но также Cu и Cu 2 O. В спектрах XRD не наблюдалось четкого пика Cu(OH) 2 .Таким образом, был проведен дополнительный анализ поверхности с помощью XPS. На рисунке 4 показаны результаты XPS-анализа образцов поверхности, обработанных плазмой, УФ-излучением 5 часов и УФ-излучением 24 часа. Пики при 529,5–530,2 эВ соответствуют CuO, а пики Cu 2 O — при 530,2–530,8 эВ. Считается, что Cu(OH) 2 имеет пик при 530,9–531,5 эВ. Каждый спектр имел подтвержденные пики Cu(OH) 2 , CuO и Cu 2 O, и, таким образом, было подтверждено присутствие Cu(OH) 2 на поверхностях. Кроме того, при сравнении интенсивностей пиков CuO и Cu(OH) 2 каждого образца соотношение CuO увеличивалось с увеличением времени УФ-облучения, в то время как Cu(OH) 2 демонстрировало тенденцию к снижению.Было исследовано соотношение Cu и O с увеличением времени УФ-облучения, приближающееся к 1 через 24 часа УФ-облучения, что позволяет предположить, что реакция Cu(OH) 2 с CuO происходила во время УФ-облучения.
В спектрах XRD не наблюдалось четкого пика Cu(OH) 2 .Таким образом, был проведен дополнительный анализ поверхности с помощью XPS. На рисунке 4 показаны результаты XPS-анализа образцов поверхности, обработанных плазмой, УФ-излучением 5 часов и УФ-излучением 24 часа. Пики при 529,5–530,2 эВ соответствуют CuO, а пики Cu 2 O — при 530,2–530,8 эВ. Считается, что Cu(OH) 2 имеет пик при 530,9–531,5 эВ. Каждый спектр имел подтвержденные пики Cu(OH) 2 , CuO и Cu 2 O, и, таким образом, было подтверждено присутствие Cu(OH) 2 на поверхностях. Кроме того, при сравнении интенсивностей пиков CuO и Cu(OH) 2 каждого образца соотношение CuO увеличивалось с увеличением времени УФ-облучения, в то время как Cu(OH) 2 демонстрировало тенденцию к снижению.Было исследовано соотношение Cu и O с увеличением времени УФ-облучения, приближающееся к 1 через 24 часа УФ-облучения, что позволяет предположить, что реакция Cu(OH) 2 с CuO происходила во время УФ-облучения.
Рентгенограммы образца после плазменной обработки и после УФ-облучения. ( a ) Плазменная обработка, ( b ) УФ 5 часов и ( c ) УФ 24 часа.
Рисунок 4XPS-спектры.Данные РФЭС образца после плазменной обработки и после УФ-облучения. ( a ) Плазменная обработка, ( b ) УФ 5 часов, ( c ) УФ 24 часа.
На рисунке 5 показаны изображения поперечного сечения образцов после образования на поверхности цветкообразных нанокристаллов CuO. Рисунок 5(b,c) представляет собой изображения FE-SEM в поперечном сечении. Из этих изображений видно, что есть два слоя; темные и светлые внутри образца. Толщина темной части приблизительно равна 0.8–1,0 мкм, и на нем наблюдалось большое количество растущих палочек. Эти палочки образуют наноцветы. Мы сравнили компоненты Cu и O, исключив результаты углерода при количественном анализе. Исходя из этих результатов, наноцветы состоят из CuO, а более темная часть под ними представляет собой Cu 2 O, образовавшуюся во время плазменной обработки; более светлая часть представляет собой подложку из меди. Эти результаты согласуются с результатами РФА на рис. 3. Поскольку самый черный верхний слой поверхности образца состоит из CuO после плазменной обработки и SPSC, в дальнейшем мы рассматриваем только образование CuO, а не Cu 2 O.
Исходя из этих результатов, наноцветы состоят из CuO, а более темная часть под ними представляет собой Cu 2 O, образовавшуюся во время плазменной обработки; более светлая часть представляет собой подложку из меди. Эти результаты согласуются с результатами РФА на рис. 3. Поскольку самый черный верхний слой поверхности образца состоит из CuO после плазменной обработки и SPSC, в дальнейшем мы рассматриваем только образование CuO, а не Cu 2 O.
Поперечные сечения. ( a ) FE-SEM изображение поверхности образца после одной недели SPSC. На поверхности образовывались наноцветы. ( b ) Изображение поперечного сечения FE-SEM ( a ) и ( c ) представляет собой увеличенный вид прямоугольной области в ( b ). P1-5 — это точка анализа EDS. Результат количественного определения указан в таблице 1. Черная часть верхней части представляет собой смолу, которая использовалась для поперечного сечения. ( d ) Схематическая диаграмма поперечного сечения образцов, приготовленных SPSC.
( d ) Схематическая диаграмма поперечного сечения образцов, приготовленных SPSC.
нанокристаллов Cu(OH) 2 2 и CuO показаны на рис. 6. Они были извлечены из сверхчистой воды после УФ-облучения. Имеются крупные кристаллы двух оксидов, волокнистые и похожие на рисовые зерна (рис. 6 (а, б)). Кольцевая дифракционная картина, наблюдаемая на изображении волокнистого кристалла с помощью SAED (рис.6(c)) показывает, что часть состоит из мелких кристаллов Cu(OH) 2 . С другой стороны, картина SAED, полученная от листа наностержня CuO в форме цветка (рис. 6 (e)) согласуется с смоделированной картиной дифракции электронов CuO. Таким образом, в процессе роста по направлению к кристаллическому листу CuO происходит агрегация частиц Cu(OH) 2 , и, таким образом, можно сделать вывод, что конусовидная форма CuO возникла в результате агрегации Cu(OH) 2 в воде с последующим реакция дегидратации под действием света на рост монокристаллов. Таким образом, делается вывод, что кристалл CuO растет по реакции Cu → Cu(OH) 2 → CuO, которая сопровождается фотохимической реакцией.
Таким образом, делается вывод, что кристалл CuO растет по реакции Cu → Cu(OH) 2 → CuO, которая сопровождается фотохимической реакцией.
Структурная характеристика кристаллов CuO. ПЭМ-изображения ( a ) связанных частиц Cu(OH) 2 и ( b ) листьев наноцветков CuO. Считается, что кристаллы оксида отслоились в процессе роста при УФ-облучении. ( c ) Cu(OH) 2 Схема колец SAED части, окруженной красным квадратом в ( a ), и расчетная схема колец Cu (OH) 2 с правой стороны.( d ) Расчетная электронограмма CuO и ( e ) SAED картина части, окруженной красным кругом листа CuO в ( b ). ( f ) Кристаллическая структура Cu(OH) 2 : Орторомбическая пирамидальная с параметрами решетки a = 0,295, b = 1,059, c = 0,5527 (нм). ( г ) Кристаллическая структура CuO: Моноклинный кристалл с параметрами решетки a = 0,4684, b = 0,3423, c = 0. {+})\)) при попадании УФ-света на нановыпуклости. Вместо рекомбинации некоторые сгенерированные электроны и дырки разделяются. Отверстия перемещаются к основанию вогнутых нановыпуклостей, создавая локальный анод, в то время как электроны накапливаются в апикальной части нановыпуклостей, создавая катодную среду 20, 24 . Фотохимическая реакция за счет расщепления воды (уравнение (1)) затем приводит к образованию отверстий на дне (анод), что впоследствии способствует образованию радикалов ОН 25 и/или фотокоррозии CuO.{2+}+2OH\quad ({\rm{фотокоррозия}})$$
{+})\)) при попадании УФ-света на нановыпуклости. Вместо рекомбинации некоторые сгенерированные электроны и дырки разделяются. Отверстия перемещаются к основанию вогнутых нановыпуклостей, создавая локальный анод, в то время как электроны накапливаются в апикальной части нановыпуклостей, создавая катодную среду 20, 24 . Фотохимическая реакция за счет расщепления воды (уравнение (1)) затем приводит к образованию отверстий на дне (анод), что впоследствии способствует образованию радикалов ОН 25 и/или фотокоррозии CuO.{2+}+2OH\quad ({\rm{фотокоррозия}})$$
(2)
Рисунок 7Механизм роста кристаллов CuO. Схематическое изображение механизма роста кристаллов CuO в процессе SPSC.
С другой стороны, электроны, собранные на кончике, посредством образования гидратированных электронов (уравнение (3)), побуждают радикалы ОН трансформироваться в ионы ОН — и вносят свой вклад в генерируемую щелочную атмосферу на кончике нановыступа. 19 .{-}\) и т. д. происходят в пределах микросекундного порядка 26 . Тем не менее, локальное разделение OH — на вершине и H + на дне происходит на поверхности нанобугорков (рис. 7), чему способствует вышеупомянутый морфологический эффект 19 . В противном случае H 2 O сразу воспроизведется в обратной реакции.
19 .{-}\) и т. д. происходят в пределах микросекундного порядка 26 . Тем не менее, локальное разделение OH — на вершине и H + на дне происходит на поверхности нанобугорков (рис. 7), чему способствует вышеупомянутый морфологический эффект 19 . В противном случае H 2 O сразу воспроизведется в обратной реакции.
Считается, что образование наноцветков CuO в результате SPSC делится на следующие три стадии реакции 2, 27,28,29 .{-}$$
(5)
Уравнение (5) представляет собой нормальную гидротермальную коррозию поверхности металла с выделением ионов Cu 28 , а уравнение (2) представляет собой фотокоррозию в воде при наличии оксида. В настоящей работе генерации кислорода не наблюдалось. Этот факт подразумевает, что выход кислорода впоследствии приведет к образованию радикала ОН, как будет описано ниже. Наряду с этими реакциями значения рН временно повышаются примерно на 1–2 часа (рис. {-}+{H}_{2}O$$
{-}+{H}_{2}O$$
(8)
В это время ионы OH − объединяются с Cu 2+ в соответствии с указанными выше реакциями (6)–(8) с образованием CuO. Кроме того, эти управляемые светом реакции индуцируются преимущественно на кончике, что является фактором апикального роста кристаллов 20 .
Соответственно, чистая реакция, представляющая рост CuO из-за SPSC, представлена следующим образом.{-}$$
(9)
Здесь, в отличие от цинка, газообразный водород не образуется, что было подтверждено газовой хроматографией при получении нанокристаллов оксида меди методом SPSC. Это связано с меньшей склонностью Cu к ионизации по сравнению с водородом и цинком (Cu 2+ < H + < Zn 2+ ). Подобно поляризационному эффекту в гальваническом элементе, где ингибируется осаждение водорода на поверхность меди, происходит реакция \({H}_{2}\to 2{H}^{+}+2{e}^{-}\). на поверхности медного электрода из-за более высокой склонности к ионизации водородом 30 .Основываясь на результатах наших термодинамических расчетов с помощью программного обеспечения HSC Chemistry (Outokumpu Researh Oy, Пори, Финляндия), образование CuO (уравнение (9)) с газообразным водородом (H 2 ) маловероятно, поскольку необходимая энергия Гиббса (ΔG) составляет примерно 110 кДж, тогда как в случае образования ZnO значение ΔG отрицательно (-81 кДж). Это также предполагает, что реакция SPSC останавливается, если образующийся водород покрывает всю поверхность. Действительно, мы не наблюдали усиления роста кристаллов после более чем 48 часов УФ-облучения с менее чем 0.Увеличение веса на 1% (дополнительная таблица S2). Это значение объясняет, что была изменена только часть поверхности. Однако обновление воды привело к повторному росту CuO. Мы могли изготовить цветы CuO микрометрового размера, как показано на рис. 5 (a), путем последовательного освежения воды, хотя часто наблюдались кристаллиты, которые отслоились в воде из-за фотокоррозии, как в уравнении (2).
на поверхности медного электрода из-за более высокой склонности к ионизации водородом 30 .Основываясь на результатах наших термодинамических расчетов с помощью программного обеспечения HSC Chemistry (Outokumpu Researh Oy, Пори, Финляндия), образование CuO (уравнение (9)) с газообразным водородом (H 2 ) маловероятно, поскольку необходимая энергия Гиббса (ΔG) составляет примерно 110 кДж, тогда как в случае образования ZnO значение ΔG отрицательно (-81 кДж). Это также предполагает, что реакция SPSC останавливается, если образующийся водород покрывает всю поверхность. Действительно, мы не наблюдали усиления роста кристаллов после более чем 48 часов УФ-облучения с менее чем 0.Увеличение веса на 1% (дополнительная таблица S2). Это значение объясняет, что была изменена только часть поверхности. Однако обновление воды привело к повторному росту CuO. Мы могли изготовить цветы CuO микрометрового размера, как показано на рис. 5 (a), путем последовательного освежения воды, хотя часто наблюдались кристаллиты, которые отслоились в воде из-за фотокоррозии, как в уравнении (2).
Сравнение с гамма-облучением и добавлением СОД
Для подтверждения того, что SPSC включает фоторадикальную реакцию, были проведены два дополнительных эксперимента по методу SPSC с использованием гамма-облучения и добавления супероксиддисмутазы (SOD).{-}\), H(H 2 ), H 2 O 2 и H 3 O + 26 . На рисунке 8 показаны изображения образцов методом FE-SEM после облучения гамма-лучами вместо УФ. Их облучали в различных условиях, варьируя время облучения и мощность дозы. Хотя образец, подвергшийся 24-часовому гамма-облучению дозой 96 кГр (далее такие образцы обозначаются как 96 кГр 24 ч), не показал образования кристаллов, было подтверждено, что образцы 46 кГр 48 ч генерировали мелкие игольчатые CuO кристаллы.При сравнении образцов 576 кГр 24 ч и 513 кГр 48 ч образцы с более высокой мощностью дозы (но более короткое время) 576 кГр показали меньший рост кристаллов. Было обнаружено, что при превышении определенной дозы, необходимой для образования нанокристаллов, время облучения влияет на рост размера кристаллов. {-}\ ).{-}\) играет важную роль в росте CuO. По результатам этих двух дополнительных экспериментов было установлено, что образование кристаллов посредством SPSC вызывается продуктами фотолиза или радиолиза в насыщенной кислородом воде.
{-}\ ).{-}\) играет важную роль в росте CuO. По результатам этих двух дополнительных экспериментов было установлено, что образование кристаллов посредством SPSC вызывается продуктами фотолиза или радиолиза в насыщенной кислородом воде.
Тест на добавление SOD. Изображения FE-SEM поверхности после облучения ( a ) 24 часа гамма-лучами 380 кГр без SOD в сверхчистой воде. ( b ) Облучение гамма-лучами 380 кГр с СОД в сверхчистой воде. ( c ) Увеличенный вид области прямоугольника в ( b ).( d ) УФ-облучение в течение 24 часов. ( e ) УФ-облучение в течение 24 часов с добавлением СОД. ( f ) Увеличенный вид прямоугольника в ( e ).
Тест на антимикробную активность
В качестве иллюстрации мы провели тест на антибактериальную активность поверхностей CuO с наноцветами в отношении грамположительных ( Staphylococcus aureus ) и грамотрицательных ( Escherichia coli K12) бактерий. После 24 часов инкубации при 37 °C вокруг образцов фольги, отожженной CuO, наблюдались четкие зоны ингибирования (см.S4), CuO-плазма и цветки CuO, образованные SPSC (рис. 10). Средние зоны ингибирования для Staphylococcus составляли 1,0 см для отожженной CuO, 1,2 см для CuO-плазмы и SPSC-CuO и 0 см для необработанной меди. Средние зоны ингибирования Escherichia coli K12 составляли 1,0 см для отожженной CuO, 1,1 см для CuO-плазмы и SPSC-CuO и 0 см для необработанной меди. Исходя из этих результатов, мы заметили, что антимикробная активность обработанного плазмой CuO и SPSC-CuO в форме цветка была выше, чем отожженного CuO.Кроме того, CuO и SPSC-CuO, обработанные плазмой, обладали более высокой антибактериальной активностью в отношении S. aureus , чем E. coli . Эта различная чувствительность может быть связана с различиями в структуре бактериальных клеток. Staphylococcus состоит из толстого слоя пептидогликана, восприимчивого к внутриклеточной трансдукции, вызывающей разрушение клеточной стенки.
После 24 часов инкубации при 37 °C вокруг образцов фольги, отожженной CuO, наблюдались четкие зоны ингибирования (см.S4), CuO-плазма и цветки CuO, образованные SPSC (рис. 10). Средние зоны ингибирования для Staphylococcus составляли 1,0 см для отожженной CuO, 1,2 см для CuO-плазмы и SPSC-CuO и 0 см для необработанной меди. Средние зоны ингибирования Escherichia coli K12 составляли 1,0 см для отожженной CuO, 1,1 см для CuO-плазмы и SPSC-CuO и 0 см для необработанной меди. Исходя из этих результатов, мы заметили, что антимикробная активность обработанного плазмой CuO и SPSC-CuO в форме цветка была выше, чем отожженного CuO.Кроме того, CuO и SPSC-CuO, обработанные плазмой, обладали более высокой антибактериальной активностью в отношении S. aureus , чем E. coli . Эта различная чувствительность может быть связана с различиями в структуре бактериальных клеток. Staphylococcus состоит из толстого слоя пептидогликана, восприимчивого к внутриклеточной трансдукции, вызывающей разрушение клеточной стенки.
Тест на антимикробную активность. Фото после посева с ( a ) Грамположительные ( Стафилококки aureus ) и ( b ) грамотрицательные ( Escherichia coli K12) бактерии в агаре в чашке Петри в течение 24 часов при 37 °C.{-}\), радикал OH и H 2 O 2 , которые вызывают нарушение синтеза аминокислот, что приводит к гибели бактерий 28, 35 . В нашем эксперименте, когда тестовые пластины (рис. 10) были помещены под флуоресцентный свет, в фотокаталитическом процессе также возможно возбуждение электронно-дырочных пар в CuO с образованием Cu 2+ . Сосредоточив внимание на CuO и Cu 2 O, образец, отожженный при 700 ° C (отожженный CuO), предположительно продемонстрировал эффект Cu 2+ от CuO на основе его спектров XRD (дополнительный рис.S4) и около значения зон ингибирования с SPSC-CuO и CuO-плазмой. Кроме того, черная поверхность отожженного CuO означает, что CuO преобладает на поверхности, чем Cu 2 O. Cu(OH) 2 считается наименее активным веществом, влияющим на антибактериальные свойства.
Кроме того, черная поверхность отожженного CuO означает, что CuO преобладает на поверхности, чем Cu 2 O. Cu(OH) 2 считается наименее активным веществом, влияющим на антибактериальные свойства.
По сравнению с образцами CuO скорость таких реакций увеличивается с увеличением площади поверхности образцов SPSC-CuO из-за наноразмерных эффектов. Результаты анализа Брунауэра-Эммета-Теллера (BET) показали, что удельная площадь поверхности для Raw-Cu, обработанного плазмой CuO и SPSC-CuO составляет 6.8 × 10 −2 (m 2 /г), 4,1 × 10 −1 (m 2 /г) и 1,8 (m 2 /г) соответственно. Примечательно, что образцы, использованные для измерения БЭТ, имели объемную форму пластины (20 × 5 × 0,5 мм). Как упоминалось ранее, с помощью SPSC модифицировали только часть поверхности, ссылаясь на <0,1% увеличения общей массы образца. Таким образом, настоящие результаты БЭТ могут предположительно давать гораздо меньшее, чем логическое значение, только из части оксидных наночастиц. Тем не менее, отношение удельной поверхности равно 1.0: 6,0: 26,4, что указывает на то, что удельная площадь поверхности пластины CuO значительно увеличилась после плазменной обработки и процесса SPSC.
Тем не менее, отношение удельной поверхности равно 1.0: 6,0: 26,4, что указывает на то, что удельная площадь поверхности пластины CuO значительно увеличилась после плазменной обработки и процесса SPSC.
В некоторых случаях металл Cu сам по себе обладает лучшей антибактериальной активностью, чем CuO, из-за лучшего акцепта электронов в Cu 36 . Например, прямой перенос электронов между бактериями (отрицательными) и Cu (акцепторами электронов) лучше всего описывает антибактериальную активность за счет разрушения клеточной мембраны. Однако наша относительно гладкая поверхность образца необработанной меди проявляла наименьшую неактивную антибактериальную активность (зона ингибирования 0 см).Таким образом, мы пришли к выводу, что Cu 2+ из CuO отвечает за антибактериальные свойства.
Следовательно, различия в антимикробной активности различных образцов CuO могут отражать их способность продуцировать АФК в чашках с агаром. Таким образом, наноструктурированные поверхности SPSC-CuO проявляют высокую антибактериальную активность.
 O/q+2;-2
O/q+2;-2 Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
 8
8 Оксид меди обладает свойством эффективно контролировать коррозию.
Оксид меди обладает свойством эффективно контролировать коррозию.