Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
- Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH - Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al 2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H 2SO4 (разб. ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
Ошибка 404. Страница не найдена!
Уважаемые родители будущих первоклассников!
График приема родителей c 01.04.2021г:
понедельник 14.00-17.00
среда 14.00-17.00
пятница 14.00-17.00
С 01.09.2021 года в гимназии будут открыты 4 первых класса.
Количество мест в первых классах — 112.
Прием документов начинается с 01.04.2021 г.
ИЗМЕНЕНИЯ ПОДАЧИ ЗАЯВЛЕНИЙ НА СДАЧУ ОГЭ В 2021
Дубненские выпускники 9-х классов смогут подать заявление на сдачу основного государственного экзамена (далее-ОГЭ) дистанционно. Подробнее>>
Уважаемые учащиеся и родители!
Уважаемые родители!
В соответствии с Приказом Министерства просвещения Российской Федерации от 02.09.2020 № 458 «Об утверждении Порядка приема на обучение по образовательным программам начального общего, основного общего и среднего общего образования» информируем Вас
Уважаемые родители!
Информируем вас о том, что записаться на «Родительский контроль» — проект по оценке качества питания в школах — в Подмосковье теперь можно в режиме онлайн. Сделать это можно на Школьном портале региона. Регистрация проходит быстро — вся процедура займет не более трех минут.
— Нужно перейти во вкладку «Родительская»;
— Перейти в раздел «Школьное питание»;
— Выбрать желаемую дату и время;
— Нажать кнопку «Записаться».
Школа автоматически получит заявку и в назначенное время родителя будет ожидать классный руководитель или ответственный за питание.
Проект «Билет в будущее»
Билет в будущее» — это проект ранней профессиональной ориентации школьников 6−11 классов.
Кампания проекта проходит с июля по ноябрь 2020 года. Родителю и ребенку нужно пройти регистрацию на Платформе проекта по адресу https://bilet.worldskills.ru/, у каждого будет свой личный кабинет, в котором будут отражаться результаты участия.
Инструкция для регистрации .pdf
Подготовка к егэ
Приказ №164 от 29.05.2020г. «Об организации подготовки к ЕГЭ в режиме онлайн в 2020г».pdf
График консультаций ЕГЭ в режиме онлайн. pdf
Приказ №166 от 29.05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 01.06.2020 по 14.06.2020г.» .pdf
внимание
Приказ №151а от 12.05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 31.05.2020» .
Приказ №142 от 29.04.2020 «О внесении изменений в приказ №136 от 06.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 30.04.2020» .pdf
Северное инспекторское отделение Центра ГИМС ГУ МЧС России по Московской области информирует
Сейчас на территории Подмосковья действует режим самоизоляции и покидать дома без острой необходимости запрещается, а прогулки у воды без присмотра взрослых могут стоить жизни. К сожалению, не все родители объясняют своим детям, что же означает этот режим, и к каким последствиям могут привести прогулки.
Самоизоляция – это комплекс ограничительных мер для населения, которые вводит правительство на определенный срок для борьбы с распространением опасного заболевания.
Граждан просят соблюдать режим: не выходить на улицу без острой необходимости, ограничить контакты с другими людьми и соблюдать все рекомендации по профилактике вирусных заболеваний, предложенные медицинским сообществом.
Уважаемые родители и дети просим Вас не пользоваться береговой зоной водоемов и не нарушать режим самоизоляции.
Берегите себя и своих близких!!!
Приказ №136 от 06.04.2020 «Об организации работы сотрудников гимназии №11 с 06.04.2020г. по 30.04.2020г » .pdf
Приказ №134 от 03.04.2020 «О переходе на обучение с использованием электронного обучения и дистанционных образовательных программ» .pdf
Регламент организации дистанционного обучения в Гимназии №11
Дорогие участники образовательного процесса, учащиеся, учителя, родители! Познакомьтесь с регламентом организации дистанционного обучения .pdf
Изменения в Постановлении Губернатора Московской области
Уважаемые родители и ученики! Согласно постановлению Губернатора Московской области №171-ПГ от 02.04.2020 образовательный процесс в Гимназии №11 с 06.04.2020 по 30.04.2020 будет осуществляться с использованием электронного обучения и дистанционных образовательных технологий .pdf
О режиме повышенной готовности в гимназии №11
20 марта на сайте гимназии опубликован приказ №122 » О введении режима повышенной готовности в гимназии №11″ .pdf
меры профилактики гриппа и ОРВИ
Уважаемые родители!
Ежегодно в конце зимы и начале весны увеличивается число заболевших гриппом и ОРВИ. Давайте отнесемся к здоровью наших детей в этот период с особым вниманием. Узнать более подробно о мерах профилактики данных заболеваний:
https://www.rospotrebnadzor.ru/about/info/news_time/news_details.php?ELEMENT_ID=13566
УВАЖАЕМЫЕ РОДИТЕЛИ! ПРИМИТЕ УЧАСТИЕ В ОПРОСЕ
Родителям будущих первоклассников!
График приема родителей: (приказ.pdf)
1 февраля 2020г. — с 09.00 до 17.00 (обед 13. 00-14.00)
00-14.00)
2 февраля 2020г. — с 09.00 до 17.00 (обед 13.00-14.00)
с 03.02.2020 — 30.06.2020г. с с 09.00 до 18.00 (обед 13.00-14.00) с понедельника по пятницу
С 1 февраля 2020 года начинается прием заявлений от родителей (законных представителей) на зачисление детей в 1 класс 2020 – 2021 учебного года в электронном виде для граждан, проживающих на закрепленной территории, посредством Портала государственных и муниципальных услуг Московской области https://uslugi.mosreg.ru/.
Подробнее по ссылке>>
Учитель шахмат
Департамент государственной политики в сфере общего образования Министерства Просвещения РФ информирует о проведении конкурса «Учитель шахмат», организатором которого является Общероссийская общественная организация «Федерация шахмат России». Заявки на участие в конкурсе принимаются до 15 апреля 2019 года.
Показать/скрытьФорму заявки можно скачать по ссылке. Конкурсные материалы принимаются с 16 апреля до 30 июня 2019 года. Форму для прикрепления конкурсных материалов можно скачать здесь. Контактное лицо: руководитель проекта «Шахматный всеобуч России» Костьев Александр Николаевич, тел. 8(968)732-00-74, адрес электронной почты: [email protected].
Урок мужества
1 марта 2019 г. во всех классах школы пройдет Урок мужества. В этот день будет проходить торжественная церемония награждения детей-лауреатов Всероссийской общественной инициативы «Горячее сердце».
Показать/скрытьЦелью такого урока является формирование у школьников готовности к общественной полезной деятельности, преодолению сложных ситуаций в семье или ограничений здоровья.
Лауреатами «Горячего сердца» являются дети, которые спасли людей при пожарах, помогли оказавшимся в беде или в сложной ситуации, участвовали в борьбе с распространением наркотиков, а также добились успеха в различных видах деятельности, несмотря на ограничения здоровья.
Методические рекомендации
Ребята и их родители!
Приглашаем вас принять участие в увлекательных конкурсах! Зарегистрируйтесь на сайте https://www. prav-pit.ru/, если есть вопросы, обращайтесь за помощью к координатору конкурса в гимназии №11социальному педагогу Волковой Елене Ивановне.
prav-pit.ru/, если есть вопросы, обращайтесь за помощью к координатору конкурса в гимназии №11социальному педагогу Волковой Елене Ивановне.
01.11.2018 – 15.06.2019
Конкурс семейной фотографии. Участники конкурса должны подготовить семейный фотоплакат, демонстрирующий важность здорового образа жизни.
15.10.2018 – 30.08.2019
Фотоконкурс “Воспитываем здоровых и счастливых”. Участвуйте конкурсе и размещайте свои фотографии, рассказывающие о том, как в вашей семье воспитывают здоровых и счастливых!
Авторы фотографий, за которых проголосует больше всего посетителей сайта, получат главный приз — 3 дневную экскурсионную поездку в Москву.
ЕСИА Условия успешной авторизации на Школьном портале через ЕСИА (только для пользователей старше 14 лет)
1.Наличие Подтверждённой учётной записиЕСИА (подробно о том, как и где подтвердить учётную запись ЕСИА, рассказано здесь)
2.Наличие учётной записи в системе «Школьный портал»
3.Совпадение ФИО и СНИЛС в учётных записях ЕСИА и системы «Школьный портал»
ВНИМАНИЕ! В случае отсутствия СНИЛС в учетной записи необходимо выполнить связывание своих учетных записей вручную. Как это сделать: https://helpschool.mosreg.ru/hc/ru/articles/360001467547
Уважаемые родители!Информацию о приеме в кружки и секции дополнительного образования на 2018/2019 уч.г. можно посмотреть в разделе Родителям
Уважаемые учащиеся!
Предлагаем вам ознакомиться с материалами и принять участие в VIII Всероссийском конкурсе социальной рекламы «Новый взгляд». Подробнее…Уважаемые учащиеся и родители!
Министерство здравоохранения Московской области в рамках подготовки к Всемирному Дню сердца предлагает ознакомиться с видео-роликом о первых признаках инсульта «УДАР», а также на сайте службы медицинской профилактики Московской области пройти анкетирование и ознакомиться с полезной информацией о факторах риска развития инсульта.
Новости школы -Подготовка к ЕГЭ по химии. Часть А-3.
Неорганические вещества, их номенклатура, классификация.
Характерные химические свойства неорганических веществ
различных классов
Обязательный минимум знаний
Схема 2
Классификация неорганических веществ
Вещества
Простые Сложные
Металлы Благородные Оксиды Соли
газы
Неметаллы Кислоты Основания
Схема 3
Оксиды и их классификация
Оксиды – бинарные соединения с кислородом в с.о. – 2
Несолеобразующие Солеобразующие
N2O, NO, CO 1. Основные – оксиды металлов в с.о. +1, +2
(оксиды металлов IА и IIА групп но не ZnO,
BeO), оксиды металлов в низших с.о. (СrO, FeO)
2. Кислотные – оксиды неметаллов (N2O5, SO2,
SO3) и металлов с высокой с.о. +5,+6,+7, (CrO3, Mn2O7).
3. Амфотерные — ZnO, BeO, Al2O3,
оксиды металлов в промежуточных с.о. (Cr2O3, Fe2O3).
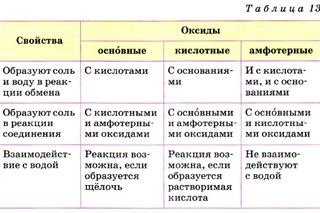
Таблица 2
Характерные химические свойства солеобразующих оксидов
Гр. Оксидов Свойства | Основные оксиды | Кислотные оксиды | Амфотерные оксиды |
Образуют соль и воду в реакции обмена при взаимодействии | с кислотами | с основаниями | и с кислотами, и с основаниями |
Образуют соль в реакции соединения при взаимодействии | с кислотными и амфотерными оксидами | с основными и амфотерными оксидами | с основными и кислотными оксидами |
Образуют растворимый гидроксид при взаимодействии с водой | щелочи | кислородсодержащие кислоты | не взаимодействуют с водой |
Основания
Основания (в свете атомно-молекулярного учения) – сложные вещества, состоящие из металла и гидроксогрупп.
Основания (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы гидроксогрупп.
Основания (в свете протонной теории) – акцепторы катионов водорода.
Таблица 3
Классификация оснований
Характерные химические свойства оснований
и амфотерных гидроксидов
1. 1) Основание (или амфотерный гидроксид) + кислота = соль + вода
2) Бескилородное основание (аммиак, амины) + кислота = соль
2. Основание + кислотный оксид = соль + вода
Основание + кислотный оксид = соль + вода
3. Щелочь + растворимая соль = новая соль + новое основание (если образуется осадок или газ)
4. Щелочь + амфотерный гидроксид = соль + вода
t
5. Нерастворимые основания (или амфотерный гидроксид) =
= оксид металла + вода
Кислоты
Кислоты (в свете атомно-молекулярного учения) – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Кислоты (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
Кислоты (в свете протонной теории) – доноры катионов водорода.
Характерные химические свойства кислот
1. Кислота + металл = соль + водород, если:
— металл находится в ряду напряжений до водорода,
— образуется растворимая соль,
— кислота растворима,
Примечания:
· щелочные металлы для реакций с растворами кислот не берут, так как они взаимодействуют, в первую очередь, с водой,
· азотная кислота любой концентрации и концентрированная серная кислота взаимодействует с простыми веществами по-особому (см. табл. 5)
2. Кислота + оксид металла (основный или амфотерный) = соль + вода
3. Кислота + основание (гидроксид или бескислородное основание) = соль +
+ вода (для бескилородных оснований — только соль).
4. Кислота + соль = новая кислота + новая соль (если образуется осадок, газ или слабый электролит).
Таблица 4
Классификация кислот
Соли
Соли (в свете атомно-молекулярного учения) – сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли (в свете теории электролитической диссоциации) – электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
Примечание. Эти определения справедливы только для нормальных или средних солей.
Схема 4
Классификация солей
Соли
Средние Кислые Основные Двойные Комплексные
или нормальные Сa (HCO3)2, (CuOH)CO3, (NH4)2Fe (SO4)2, K3[Fe (CN)6]
NaCl, K2SO4, NaHSO4, Al (OH)2Cl, KAl (SO4)2, K4[Fe (CN)6]
CaCO3, RCOONa KH2PO4 Fe (OH)SO4 KCl∙NaCl
Характерные химические свойства солей
1. Соль + кислота = новая кислота + новая соль (если образуется осадок или газ).
2. Растворимая соль + щелочь = новая соль + новое основание (если образуется осадок или газ)
3. Соль1 (раствор) + соль2 (раствор) = соль3 + соль4 (если образуется осадок)
4. Соль (раствор) + металл = новая соль + новый металл, если:
· металл находится в ряду напряжений до металла соли,
· образуется растворимая соль.
Примечание: щелочные металлы для реакций с растворами солей не берут, так как они взаимодействуют, в первую очередь, с водой.
Примеры тестовых заданий и
рекомендации к их выполнению
1. Только солеобразующие оксиды находятся в ряду
1) P2O5, ZnO, NO
2) CO, N2O5, Na2O
3) Al2O3, N2O, N2O3
4) SiO2, BeO, CaO
Это задание следует выполнить методом исключения тех рядов веществ, в которых содержаться формулы несолеобразующих оксидов, так как таких оксидов немного и их нужно знать. Исключаются варианты ответов 1-3. Ответ 4.
Исключаются варианты ответов 1-3. Ответ 4.
2. Амфотерными гидроксидами являются вещества, формулы которых
1) CsOH и Cr (OH)2
2) KOH и Ca (OH)2
3) Be (OH)2и Cr (OH)3
4) NaOH и Mg (OH)2
Это задание также следует выполнить методом исключения тех пар веществ, в которых содержатся формулы щелочей, так как таких веществ в школьном курсе изучается немного и их следует знать. Ответ 3.
3. Кислотными оксидами являются вещества, формулы которых
1) N2O3, N2O5, CrO3
2) Cr2O3, CrO, N2O
3) NO, Na2O, P2O5
4) SiO2, BeO, CaO
Для быстрого определения верного ответа из предложенных вариантов необходимо исключить те, в которых встречаются оксиды металлов в с.о. +1, +2, +3, т.е. варианты 2, 3, 4. В первом варианте также встречается оксид металла CrO3, но в с.о. +6, т.е. кислотный оксид. Ответ 1.
4. Содержит все три типа гидроксидов ряд веществ, формулы которых
1) H2SO4, Ca (OH)2, NaOH
2) Cr (OH)3, Cr (OH)2, H2CrO4
3) NaOH, HNO3, Mg (OH)2
4) KOH, HClO4, Ba (OH)2
Достаточно сложное, многофакторное задание, которое требует знания ряда химических понятий: гидрооксиды (это понятие объединяет основания, амфотерные гидрооксиды и кислородсодержащие кислоты), зависимость свойств оксидов и гидроксидов металлов от величины с. о. (как правило, оксид и гидроксид с низшей с.о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
о. (как правило, оксид и гидроксид с низшей с.о. проявляют основные свойства, с высшей – кислотные, с промежуточной — амфотерные), а, следовательно, и знание понятия с.о. Экзаменующийся должен найти ряд формул, в котором будут записаны основание, кислота и амфотерный гидроксид. Следовательно, можно исключить те ряды, в которых содержится два гидроксида одного типа: 1,3,4, — т.к. они содержат по два основания каждый. Ответ 2.
5. Формулы только кислых солей записаны в ряду
1) K2SO4, KOH, H2SO4, NaHCO3
2) Fe (HSO4)2, CaHPO4, CaCO3, Ca (OH)NO3
3) NH4HSO4, NH4NO3, (NH4)2HPO4, (NH4)2 CO3
4) NaH2PO4, Na2HPO4, NaHCO3, NaHS
Для быстрого определения верного ответа нужно ориентироваться на ключевое словосочетание «кислая соль», т.е. соль, содержащая атом водорода в составе кислотного остатка. Все четыре соли должны отвечать этому требованию. Ответ 4.
6. Двухосновная, растворимая, кислородсодержащая, сильная и стабильная кислота имеет формулу
1) H2SO3 2) H2S 3) H2SO4 4) H2S2O3
Условию задания отвечает вариант 3, т.к. любому школьнику известно, что сернистая кислота нестабильна, а сероводородная – слабая. Тиосерная кислота для обычного школьника представляет собой «экзотику», поэтому необходимо остановиться на привычной и хорошо известной серной кислоте. Ответ 3.
Ответ 3.
7. Средняя соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Сa (НСO3)2, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
Для успешного выполнения этого задания необходимо мысленно разделить предложенные ответы на три подстолбика. Анализируя первый столбик, приходим к выводу, что условию задания не соответствуют ответ 3. При анализе второго подстолбика исключаем варианты ответов 1 и 4, следовательно, верный ответ – 2 (обращаем внимание, что амфотерный гидроксид может быть записан как Аl (OH)3, так и Н3AlO3 или HAlO2∙H2O). Ответ 2.
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3)FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
Успешное выполнение этого задания зависит от ключевого слова «соответственно», которое задает порядок поиска верного ответа: средняя, кислая и основная соли. Методика поиска может строиться на нахождении средней соли в первом вертикальном подстолбике (основной соли в последнем подстолбике, или кислой соли в среднем подстолбике). Ответ 2.
Ответ 2.
9. В следующей характеристике гидроксида бария неверно положение
1) кислородсодержащее основание, щелочь
2) сильное двухкислотное основание
3) способно образовать два ряда солей – средние и основные
4) летучее, непрочное соединение
Ключевым словосочетанием к выполнению задания является «неверно положение», оно и позволит определить искомый ответ. Ответ 4.
10. Оксиду фосфора (V) не соответствует кислота, формула которой
1) H3PO4 2) H4P2O7 3)H3PO3 4) HPO3
Ключом к решению этого задания является положение о том, что с.о. элемента, образующего оксид и соответствующий ему гидроксид (в нашем случае – фосфорные кислоты), должны быть одинаковы. Этому условию не отвечает ответ 3, который и будет правильным. Ответ 3.
11. Соль и водород образуются при взаимодействии разбавленной серной кислоты с каждым из металлов ряда
1) Al, Zn, Cu 2) Zn, Fe, Pb 3) Mg, Zn, Fe 4) Pb, Cu, Ag
Разбавленная серная кислота проявляет характерные свойства кислот, а потому не будет реагировать с металлами, стоящими в ряду напряжений после водорода, что автоматически исключает ответы 1 и 4. Варианты 2 и 3 предлагают металлы, стоящие в ряду напряжений до водорода. Какой выбрать? Очевидно, следует исключить из числа вероятных ответ 2, так как он содержит свинец, а сульфат свинца (II) – практически нерастворимая соль, о чем свидетельствует соответствующая клеточка в таблице растворимости. Ответ 3.
Ответ 3.
12. При термическом разложении нерастворимых оснований образуются
1) оксид неметалла и вода
2) водород и оксид металла
3) вода и оксид металла
4) металл и вода
Как неверные, должны быть исключены ответы 1, 2 и 4. Ответ 3.
13. С раствором хлорида меди (II) не реагирует
1) Mg 2) Zn 3) Fe 4) Ag
Легкое заданий на знание ряда напряжений металлов. Ответ 4.
14. С раствором сульфата меди (II) не реагирует
1)Pb 2)Zn 3) Fe 4) Mg
Задание аналогично предыдущему, но с учетом условий протекания реакций между раствором соли и металлом. Реакция идет, если образующаяся соль растворима в воде. Следовательно, верный ответ 1, так как сульфат свинца (II) практически не растворим. Ответ 1.
15. Основание образуется при взаимодействии с водой оксида, формула которого
1) Fe2O3 2) CuO 3) CaO 4) FeO
В основе поиска верного ответа лежит знание о том, что оксиды металлов взаимодействуют с водой лишь в случае образования растворимого гидроксида – щелочи. Следовательно, это должен быть оксид щелочного или щелочноземельного металла. Ответ 3.
16. Серебро из раствора нитрата серебра вытесняют все металлы ряда
1) Na, Cr, Zn 2) K, Fe, Cu 3) Fe, Zn, Cu 4) Zn, Fe, Au
Задание на знание свойств солей и ряда напряжений металлов. Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
Обратите внимание на тот факт, что медь в ряду напряжений стоит после водорода, но перед серебром. Ответ 3.
17. При взаимодействии меди с концентрированной серной кислотой образуются
1) CuSO4, SO2, H2O
2) CuSO4, H2
3) CuO, SO2, H2O
4) Cu2SO4, SO2, H2O
Задание на знание свойств концентрированной серной кислоты, которая при взаимодействии с металлами, стоящими в ряду напряжений до и после водорода, образует соль, воду и один из продуктов восстановления сульфат-иона (SO2, S или H2S). Это знание позволит выбрать ответы 1 и 4. Более вероятен ответ 1, так как серная кислота – сильный окислитель и образование Cu2SO4 неневозможно. Ответ 1.
18. Железо способно вытеснять из растворимых солей – нитратов магния, свинца (II), меди (II), ртути (II), серебра – металлы
1) Mg, Pb, Cu, Hg, Ag
2) Pb, Cu, Hg, Ag
3) Cu, Hg, Ag
4) Hg, Ag
Задание на знание свойств солей и ряда напряжений металлов. Ответ 2.
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
Так как разбавленная серная кислота проявляет характерные свойства растворов кислот, то она не взаимодействует с металлами, стоящими в ряду напряжений металлов после водорода. Верный ответ, записанный в вариантах первым, позволит другие ответы не рассматривать. Ответ 1.
20. И с гидроксидом натрия, и с соляной кислотой реагирует
1) СaO 2) BeO 3) SiO2 4) P2O5
И с кислотой, и со щелочью взаимодействует амфотерный оксид. Ответ 2.
21. С гидроксидом бария реагирует ряд веществ, имеющих формулы
1) NaCl, Na2SO4, Na2CO3
2) HNO3, NaOH, K2SO4
3) ZnO, K2O, CO2
4) Al (OH)3, CuSO4, HCl
Так как Ba (OH)2 – щелочь, то знание свойств растворимых оснований и особенностей протекания реакций с их участием позволит определить верный ответ – 4. К такому результату можно прийти, исключив варианты 2 (он включает щелочь) и 3 (он, кроме амфотерного и кислотного, включает основный оксид). Остаются варианты 1 и 4. Все соединения первого варианта – соли, но если две последние соли образуют осадок с гидроксидом бария, то первая – нет. Ответ 4.
22. Сульфат железа (II) не может быть получен взаимодействием
1) железа с разбавленной серной кислотой
2) железа с раствором медного купороса
3) железа с раствором сульфата магния
4) гидроксида железа (II) с разбавленной серной кислотой
Задание на знание свойств классов неорганических соединений: кислот, солей, гидроксидов. Это знание позволит определить верный ответ. Ответ 3.
23. Веществами, при взаимодействии которых образуется соль, являются
1) щелочь и основный оксид
2) основный оксид и вода
3) кислотный оксид и щелочь
4) кислотный оксид и вода
Несложное задание на знание химических свойств оксидов. Ответ 3.
Ответ 3.
24. В цепочке превращений
S →X1→SO3→X2→CuSO4→X3→CuO→Cu
веществами X1,X2 и X3 являются соответственно
1) H2S, H2SO4, Cu (OH)2
2) FeS, H2SO4, Cu (OH)2
3) SO2, H2SO4, CuCl2
4) SO2, H2SO4, Cu (OH)2
Ответы 1 и 2 следует отбросить, так как при окислении сероводорода и сульфида железа (II) образуется не SO3, а SO2. В варианте 3 первые два искомых вещества указаны верно, а CuCl2 — нет, поскольку эту соль превратить в оксид в одну стадию нельзя. Ответ 4.
25. В цепочке превращений
Сa → X1 → Ca (OH)2 →X2 →Ca (HCO3)2 → X2 → CaO
веществами X1, X2 являются соответственно
1) CaCl2, СaCO3,
2) CaO, Ca (NO3)2
3) CaО, СaCO3
4) CaО, Ca3 (PO4)2
Вещество X1 определить несложно – это CaO. Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
Вещество X2 – не может быть никакой другой солью, кроме карбоната, так как следующее звено представляет собой кислую соль угольной кислоты – гидрокарбонат кальция. Ответ 3.
26. В цепочке превращений
Zn → X1 → Zn (NO3)2 → X2 → Na2ZnO2 →ZnCl2→AgCl→X3
веществами X1, X2 и X3 являются соответственно
1) ZnCl2, ZnO, Ag
2) ZnO, Zn (OH)2, Ag
3) ZnSO4, Zn (OH)2, PbCl2
4) ZnO, Zn (OH)2, AgNO3
Рассуждения, аналогичные приведенным выше, но с учетом амфотерности гидроксида цинка, позволят определить вещества X1, X2 — ZnO, Zn (OH)2 соответственно. Вещество X3 средней солью быть не может, так как AgCl нерастворим. Это даст возможность исключить ответы 3 и 4. Теперь, даже не зная способности хлорида серебра к разложению, нетрудно выбрать верный ответ. Ответ 2.
27. В схеме превращений
X1 X2 X3
AlCl3 → Al (OH)3 → NaAlO2 → AlCl3
веществами X1,X2 и X3 являются соответственно
1) H2O, NaOH, NaCl
2) H2O, Cu (OH)2, HCl
3) NaOH, NaCl, HCl
4) NaOH, Na2O, HCl
Непростое задание на знание свойств солей и амфотерных гидроксидов.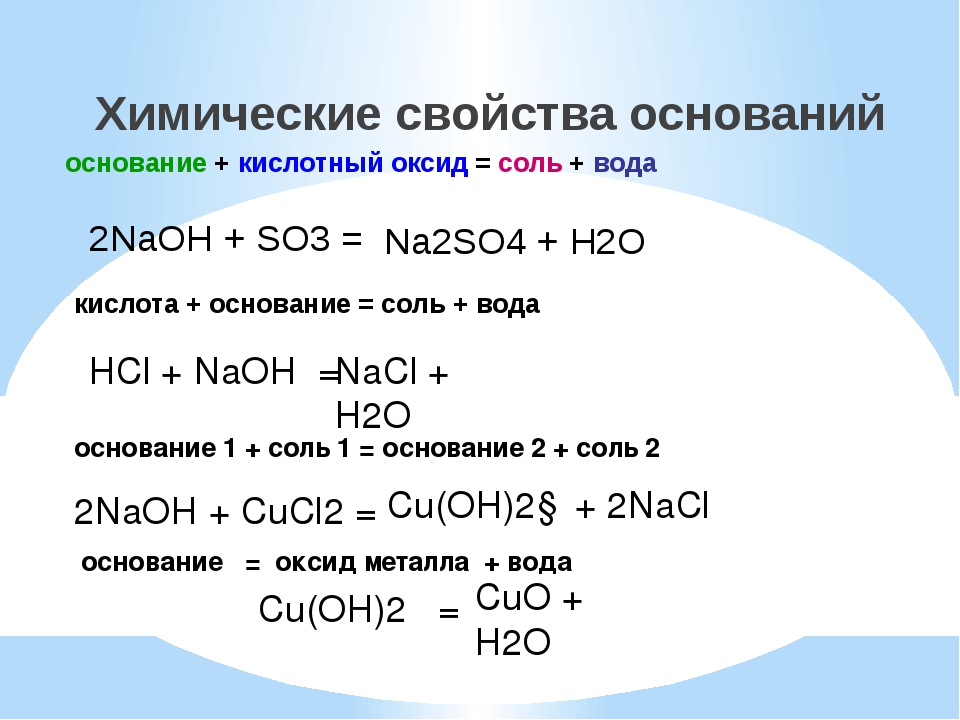 Для выпускников определение X2 представляет сложность, т.к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
Для выпускников определение X2 представляет сложность, т.к.существует стереотип, что амфотерные гидрооксиды выступают в роли кислот при взаимодействии со щелочами – т.е. NaAlO2 можно получить взаимодействием Al (OH)3 с NaOH. Однако автор тестового задания уже использовал это соединение для X1 и в качестве X2 предложил Na2O. Ответ 4.
28. Вещество, которое может реагировать с фосфорной кислотой, гидроксидом натрия и цинком, имеет формулу
1) Al (OH)3 2) Ba (NO3)2 3) CuCl2 4) NaHCO3
Для решения этого задания необходимо отнести каждое из предложенных веществ к соответствующей группе: амфотерный нерастворимый гидроксид, две средние соли, кислая соль. Со всеми перечисленными в условии веществами реагирует только CuCl2. Ответ 3.
29. Веществу, которое может реагировать с хлором, нитратом серебра и ацетатом свинца, соответствует формула
1) KI 2) Cu 3) K2SO4 4) NaF
Задание более сложное, чем 28, так как требует знания о «ряде активности галогенов» (каждый предыдущий галоген вытесняет каждый последующий из растворов галогеноводородных кислот и их солей), а также знание номенклатуры солей органических кислот: ацетату свинца соответствует формула (CH3COO)2Pb. Обращение к таблице растворимости и учет условий взаимодействия растворов солей между собой позволят прийти к правильному решениию. Ответ 1.
30. Верны ли следующие суждения применительно к солям
Верны ли следующие суждения применительно к солям
А) В результате взаимодействия кислых солей со щелочами образуются средние соли
Б) В результате взаимодействия средних солей с основаниями образуются кислые соли
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Второе утверждение неверно, т.к. результатом взаимодействия средних солей с основаниями образуются не кислые соли, а основные. Первое суждение верно. Ответ 1.
Задания для самостоятельной работы
1. В перечне веществ
1) N2O
2) N2O5
3) N2O3
4) CO2
5) NO
6) CO
к несолеобразующим оксидам относятся вещества, формулы которых обозначены цифрами:
1) 1,4,6 2) 3,5,6 3) 1,5,6 4) 4,5,6
2. Амфотерными оксидами являются вещества
1) оксид серы (IV), оксид железа (III)
2) оксид цинка, оксид кальция
3) оксид хрома (III), оксид бериллия
4) оксид алюминия, оксид магния
3. Основными оксидами являются вещества
1) оксид кальция, оксид хрома (II)
2) оксид калия, оксид олова (IV)
3) оксид меди (I), оксид алюминия
4) оксид бериллия, оксид железа (П)
4. Содержит все три типа гидроксидов ряд веществ
1) H3AlO3, Fe (OH)3, H2SO4
2) H2ZnO2, H3PO4, Ba (OH)2
3) H2BeO2, HCI, Cu (OH)2
4) H2CO3, H2CrO4, NaOH
5. Формулы только основных солей записаны в ряду
Формулы только основных солей записаны в ряду
1) (CaOH)2SO4, Ca (OH)2, CaOHCl
2) Fe (OH)3, Fe (OH)2NO3, [Fe (OH)2]SO4
3) MnOHNO3, CuOHCl2, Mg (OH)2
4) FeOHCl2, FeOHCl, [Fe (OH)2]SO4
6. Двухкислотное, растворимое, нелетучее и стабильное основание имеет формулу
1) Mg (OH)2 2) NH3 3) NaOH 4) Ва (ОН)2
7. Кислая соль, амфотерный гидроксид и основная соль соответственно расположены в ряду
1) Na2SO4, Be (OH)2, Fe (OH)Cl2
2) K2CO3, Н3AlO3, Cu (OH)NO3
3) NaHSO3, H3CrO3, Fe (OH)SO4
4) ZnSO4, H3PO4, Cr (OH)Cl2
8. Формулы средней, кислой и основной солей соответственно записаны в ряду
1) Cu (HSO4)2, Cu (OH)NO3, CuCl2
2) CaCO3, Ca (HCO3)2, Ca (OH)Cl
3) FeSO4, Fe (OH) Cl, Fe (OH)2Cl
4) BaSO4, Ba (OH)NO3, Ba (H2PO4)2
9. Гидроксид алюминия – это
1) амфотерный гидроксид
2) трехкислотное основание
3) щелочь
4) летучее основание
10. Оксиду марганца (VII) соответствует гидроксид, формула которого
1) Mn (OH)2 2) MnO (OH) 3) H2MnO4 4) HMnO4
11. Водород можно получить при взаимодействии
1) меди с разбавленной азотной кислотой
2) свинца с концентрированной азотной кислотой
3) цинка с концентрированной серной кислотой
4) алюминия с концентрированным раствором гидроксида калия
12. При термическом разложении нитрата серебра образуются
При термическом разложении нитрата серебра образуются
1) оксид серебра и оксид азота (V)
2) серебро, оксид азота (IV) и кислород
3) серебро, азот и кислород
4) оксид серебра, оксид азота (II) и кислород
13. С раствором щелочи не реагирует
1) Mg 2) Zn 3) Al 4) Be
14. С раствором сульфата меди (II) взаимодействует
1) Pb 2) Hg 3) Fe 4) Ag
15. Взаимодействием соответствующего оксида с водой нельзя получить
1) Cu (OH)2 2) Ba (OH)2 3) H2SO4 4) NaOH
16. Медь из раствора сульфата меди (II) вытесняет все металлы ряда
1) Na, Cr, Zn
2) K, Fe, Cu
3) Fe, Zn, Al
4) Zn, Fe, Au
17. При взаимодействии меди с концентрированной азотной кислотой образуются
1) CuO, NO2, H2O
2) Cu (NO3)2, H2
3) Cu (NO3)2, NO, H2O
4) Cu (NO3)2, NO2, H2O
18. Окислительно-восстановительная реакция протекает при разложении соли, формула которой
1) NH4Cl 2) KMnO4 3) CaCO3 4) (CuOH)2CO3
19. C концентрированной азотной кислотой при комнатной температуре не взаимодействует
1) медь
2) железо
3) серебро
4) цинк
20. С раствором серной кислоты реагируют все три вещества набора
1) СaO, NaOH, KCl
2) Cu (OH)2, HCl, CH3COONa
3) BaCl2, Zn, SiO2
4) MgCO3, Fe, Al (OH)3
21. И с соляной кислотой, и с водой реагирует
И с соляной кислотой, и с водой реагирует
1) аммиак 2) хлор 3) никель 4) карбонат кальция
22. Сульфат железа (III) может быть получен взаимодействием железа с
1) разбавленной серной кислотой
2) раствором сульфата меди (II)
3) хлором
4) серой
23. Веществами, при взаимодействии которых не образуется соль, являются
1) кислотный оксид и щелочь
2) кислотный оксид и вода
3) основный оксид и кислота
4) кислота и основание
24. В цепочке превращений
Ca →X1→Ca (OH)2 → X2→ CaO → X3→ AgCl
веществами X1,X2 и X3 являются соответственно
1) CaO, CaCO3, CaCl2
2) CaSO4, CaCO3, CaCl2
3) CaO, CaSO4, CaCl2
4) CaO, Ca (HCO3), CaCO3
25. В цепочке превращений
N2 → X1 → NO →X2 → HNO3
веществами X1, X2 являются соответственно
1) N2O, NO2
2) NO2, NH3
3) N2O3, N2O
4) NH3, NO2
26. В цепочке превращений
Al → X1 → Al2 (SO4)3 → X2 → KAlO2 →AlCl3→X2®Al2O3
веществами X1 и X2 являются соответственно
1) AlCl3, AlN
2) Al (OH)3, KAl (SO4)2
3) Al2O3, Al2S3
4) Al2O3, Al (OH)3
27. В схеме превращений
X1 X2 X3
SO2 → SO3 → H2SO4 → (NH4)2SO4
веществами X1,X2 и X3 являются соответственно
1) O2, H2O, NH3
2) NO2, H2, NH3
3) O2, H2O, N2
4) O2, H2, NH3∙H2O
28. Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
Вещество, которое может реагировать с соляной кислотой, гидроксидом калия и алюминием, имеет формулу
1) Cl2 2) H2SO4 3) Сr2O3 4) Na2CO3
29. При нагревании не разлагается на простые вещества
1) аммиак 2) хлорид натрия 3) оксид ртути (II) 4) иодоводород
30. Верны ли следующие суждения применительно к кислотам
А) Любую кислоту можно получить растворением соответствующего кислотного оксида в воде
Б) Кислоты способны взаимодействовать со щелочами
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
03 Октябрь 2011, 15543 просмотра.
Комментарии
Урок-расследование «Химические свойства кислот, оснований, солей в свете ТЭД». 9-й класс
Тип урока: урок обобщения и систематизации З и У.
Вид урока: экспериментально-поисковый с элементами игры.
Главная ДЦ: создать условия для систематизации изученного материала, выявления уровня овладения системой знаний и умений, опытом творческой деятельности.
Задачи:
Образовательный аспект:
- обобщить знания о свойствах кислот, оснований и солей через деятельность учащихся по раскрытию приведённой схемы;
- проверить степень сформированности ЗУН на практике в нестандартной и творческой ситуации.
Развивающий аспект:
развитие психических процессов:
- речевой деятельности;
- логического мышления;
- творческих возможностей, фантазии и воображения.
Воспитательный аспект:
воспитание качеств личности:
- уважения в условиях работы в группах;
- ответственности за результаты своей работы.

ФОПД: групповая (группы гетерогенного состава).
Реактивы:
- дихромат аммония, этиловый спирт,
- раствор соляной, серной, азотной кислот, гидроксид железа (III)
Истина не рождается в голове отдельного
человека,
она рождается между людьми, совместно ищущими,
в процессе их диалогического общения.
М.М. Бахтин
Ход урока
На прошлых уроках мы с вами рассмотрели химические свойства кислот, оснований, солей в свете ТЭД. Сегодня мы обобщим наши знания и немного поиграем. А урок у нас будет РАССЛЕДОВАНИЕ. Что же мы будем расследовать? Давайте посмотрим на дерево:(Презентация)
На нём зашифрованы формулы химических веществ. Ваша задача: узнать, что это за вещества, но не просто узнать, а заработать как можно больше КРЕАТИВИКОВ, то есть включить свое креативное мышление. Для этого мы с вами заранее разделились на три группы — три расследовательских бюро. Чтобы получить сегодня отметку — необходимо заработать креативики:
| ОТМЕТКА | ЧИСЛО КРЕАТИВИКОВ |
| «5» | 40 и больше |
| «4» | 30-40 |
| «3» | 20-30 |
1 задание:
Дать название своему бюро. Время -1 минута.
1 блок МОТИВАЦИЯ
Сегодняшнее расследование мы начнём с опыта (проделывается «ОПЫТ ВУЛКАН»)
Какое бы название вы дали этому опыту?
Сегодня на уроке мне бы хотелось услышать от вас столько креативных мыслей, сколько вы увидели искр из этого вулкана!
(Над каждым заданием работают все три группы. Если отвечающая группа не справляется с
заданием, право ответа переходит другой группе.)
Если отвечающая группа не справляется с
заданием, право ответа переходит другой группе.)
2 блок СОДЕРЖАТЕЛЬНАЯ ЧАСТЬ I
На протяжении всей содержательной части I перед учащимися — выбор задания:
- 1 вариант — 10 креативиков
- 2 вариант — 20 креативиков
Каждый вариант имеет подсказку, но если команда ею воспользуется, то из общей суммы вычитается 5 баллов. Время выполнения каждого задания — 5 минут.
2 задание: 1 вариант — стоимость 10 креативиков
Определить вещество А
ШИФРОГРАММА: определить тип элемента (s-, p-, d-,f-) и расшифровать название простого вещества.
2 задание: 2 вариант — стоимость 20 креативиков
Определить вещество А
ЗАГАДКА
3 задание: 1 вариант — стоимость 10 креативиков
Определить вещество В
РЕБУС
3 задание: 2 вариант — стоимость 20 креативиков
Определить вещество В
ШИФРОВКА: в тексте спряталось название неорганического вещества. Найти способ чтения и прочитать его.
Подсказка:
В тексте читать только русские буквы, пропуская знаки латинского алфавита через определённое число знаков.
4 задание: 1 вариант — стоимость 10 креативиков
Определить вещество С
СОБЕРИ МОЗАЙКУ (можно предложить учащимся карточку с любым химическим рисунком, которая разрезается на геометрические фигуры)
4 задание: 2 вариант — стоимость 20 креативиков
Определить вещество С
ШИФРОВКА: чтобы прочесть зашифрованное название неорганического вещества, надо заменить цифры буквами из названия, изображенного над цифрами предмета или символа. Буквы взять из каждого слова в порядке стоящих под ним цифр.
5 задание: 1 вариант — стоимость 10 креативиков
Определить вещество D
«НЕМОЙ ВИДЕОФРАГМЕНТ»
Просмотрев «немой» видеофрагмент лабораторного опыта, определите название получившегося осадка. (Опыт получение гидроксида железа (III))
Подсказка:
Восстановить записи шпаргалки и определить название формулы на месте кляксы.
5 задание: 2 вариант — стоимость 20 креативиков
Определить вещество D
ШИФРОВКА: определить названия химических знаков и соединений. Найти способ чтения и прочитать название неорганического вещества (воспользоваться справочным материалом «Тривиальные названия неорганических веществ» Приложение 1).
Подсказка:
Используем только первые буквы названий знаков и химических соединений
В ходе нашего расследования вы расшифровали 4 формулы неорганических веществ, но на нашем дереве остался ещё знак вопроса.
6 задание: стоимость — 20 креативиков
Лабораторный опыт
- 1 группа: гидроксид железа (III) и соляная кислота
- 2 группа: гидроксид железа (III) и серная кислота
- 3 группа: гидроксид железа (III) и азотная кислота
Выбрать одно из предложенных вам веществ и провести с ним опыт.
Написать молекулярное, полное ионное и сокращённое ионное уравнения (сдать учителю).
В написанных вами уравнениях не должно быть исправлений. Каждое исправление считается ошибкой.
3 блок ПСИХОЛОГИЧЕСКАЯ РАЗГРУЗКА
«Математический фокус» с периодической таблицей:
- Задумайте два химических элемента так, чтобы они образовывали бинарное химическое соединение. Запомните их номера.
- Порядковый номер первого элемента удвойте.
- К полученному числу прибавьте 5.
- Сумму умножьте на 50.
- К произведению прибавьте порядковый номер второго элемента.
Учитель из полученной суммы вычитает число 250. Получается четырёхзначное число. Первые две цифры — это порядковый номер 1-го химического элемента, вторые две цифры — порядковый номер 2-го химического элемента.
4 блок СОДЕРЖАТЕЛЬНАЯ ЧАСТЬ II
(домашнее задание)
СКАЗКА
Придумать СКАЗКУ-ЗАГАДКУ или РАССКАЗ-ЗАГАДКУ (в прозе или в стихах), где были бы сведения о свойствах, получении и применении всех неорганических веществ из генетической цепочки. Разыграть её в лицах.
В качестве примера вы можете использовать:
Уставший господин Ферр пришёл домой. Не успел он стряхнуть с себя металлическую пыль, как неожиданно к нему влетел:
Что же было дальше?
В помощь:
:и предложил создать совместное:
:зная его коварный нрав:
:но тут явилась очаровательная:
:приступив его бдительность и осторожность:
:Ферр стал покрываться бурым налётом:
5 блок РЕЗЮМЕ
В конце урока подводим итоги. Предлагаю учащимся построить 3 графика:
- Моё эмоциональное состояние на уроке.
- Как я работал в группе.
- Содержание урока.
Свойства кислот и оснований
Цели обучения
- Перечень характеристик кислот.
- Список свойств баз.
Свойства кислот
Кофе еще не готов?
Многие люди любят пить кофе. Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения.Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости. Только не забудьте пропустить воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, которая более известна как витамин С.Газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи.
Кислоты представляют собой особый класс соединений из-за свойств их водных растворов. Эти свойства описаны ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток. Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты меняют цвет некоторых кислотно-основных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
- Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Свойства оснований
Были ли у вас кислотные расстройства желудка?Возможно, вы съели слишком много пиццы и через несколько часов почувствовали себя очень некомфортно. Это ощущение возникает из-за того, что вырабатывается избыток желудочной кислоты. С дискомфортом можно справиться с помощью антацида. Основа в антациде вступит в реакцию с HCl в желудке и нейтрализует ее, устраняя неприятные ощущения.
Базы
Рисунок 1. Индикатор фенолфталеина в присутствии основания.
Основания обладают свойствами, которые больше всего контрастируют со свойствами кислот.
- Водные растворы оснований также являются электролитами. Основания могут быть сильными или слабыми, как и кислоты.
- Основания часто имеют горький вкус и встречаются в пищевых продуктах реже, чем кислоты. Многие основы, например мыло, скользкие на ощупь.
- Базы также меняют цвет индикаторов.Лакмус становится синим в присутствии основания, а фенолфталеин становится розовым.
- Основания не реагируют с металлами так, как кислоты.
- Основания реагируют с кислотами с образованием соли и воды.
Обратите внимание, что дегустация химикатов и прикосновение к ним НЕ являются хорошей лабораторной практикой и, другими словами, не делайте этого дома.
Основы менее распространены в качестве пищевых продуктов, но, тем не менее, они присутствуют во многих бытовых товарах. Многие чистящие средства содержат в качестве основы аммиак.Гидроксид натрия содержится в очистителе канализации. Антациды , которые борются с избытком желудочной кислоты, состоят из оснований, таких как гидроксид магния или гидрокарбонат натрия.
Сводка
- Описаны свойства кислот.
- Перечислены свойства баз.
Практика
Кислоты
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
- Какой из четырех растворов является кислотным?
- Остановите видео на 0:30 минут и спрогнозируйте электропроводность.
- Какого цвета изменились кислоты при добавлении универсального индикатора?
Базы
Прочтите эту страницу о химических свойствах оснований и ответьте на следующие вопросы:
- Что дает реакция между кислотой и основанием?
- Как называется эта реакция?
- Что происходит при реакции основания с солью аммония?
Обзор
Кислоты
- Все ли кислоты электролиты в воде?
- В какой цвет превращается синяя лакмусовая бумажка в присутствии кислоты?
- Что дает реакция кислоты и основания?
Базы
- Основания — электролиты?
- Какого цвета основа превращает фенолфталеин?
- Реагируют ли основания с металлами так же, как кислоты?
Глоссарий
- антацид: Коммерческий препарат, нейтрализующий кислоту желудка.
21.1: Свойства кислот — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Кислоты
- Сводка
- Авторы и авторство
Многие люди любят пить кофе.Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости. Только не забудьте пропустить воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи.
Кислоты представляют собой особый класс соединений из-за свойств их водных растворов. Эти свойства описаны ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \] - Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Сводка
- Описаны свойства кислот.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
кислотных оснований и солей | Свойства кислот, оснований и солей
Кислоты, основания и соли влияют на химию, а также на нашу повседневную жизнь.Их легко определить по вкусу; то есть кислоты имеют кислый вкус, а основания горькие, а сами соли имеют соленый вкус.
Кислоты обычно содержатся во многих веществах, включая различные продукты питания, но их присутствие во многих фруктах очень заметно, например:
Помимо них, есть некоторые кислоты, которые широко используются в лаборатории, например, соляная кислота, серная кислота и азотная кислота.
Обычно основы используются в бытовых чистящих средствах только для удаления жира с окон и полов, а также в мыле, зубной пасте, яичных белках, жидкостях для мытья посуды и бытовом аммиаке.
Наше тело содержит некоторые очень распространенные желудочные кислоты, такие как разбавленная соляная кислота, которая вызывает расстройство пищеварения. Когда содержимое желудка становится слишком кислым, обычно возникает несварение желудка и ощущение жжения.
Кислоты и основания также регулируют некоторые метаболические процессы в организме человека посредством процесса равновесия. Укусы пчел имеют кислую природу, в то время как укусы ос имеют щелочную природу.
Все кислоты при реакции с металлами выделяют водород.Водород обычно является общим для всех кислот.
Кислота + Металл = Соль + Водород
Свойства кислот
HCl + H 2 O → H + + Cl —
Zn + 2HCl → ZnCl₂ + H₂
Когда кислоты реагируют с известняком (CaCO₃), образуется углекислый газ. Например, HCl реагирует с известняком с образованием угольной кислоты и хлорида кальция.
CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
Кислоты подразделяются на органические и неорганические.+} \] ионов на моль кислоты, \ [ex — {H_3} P {O_4} \].
На основании способности отдавать ионы водорода кислоты можно классифицировать как:
Сильные кислоты: Эти кислоты полностью (на 100%) ионизируются в водных растворах. Таким образом, при равновесии концентрация молекул кислоты становится очень меньшей, а концентрация иона водорода достигает максимума; например, \ [HCl, \; HN {O_3}, \; HCl {O_4} \].
Слабые кислоты: Эти кислоты только частично ионизируются в растворе в равновесном состоянии.- \]
Свойства солей:
Соли образуются путем сочетания кислоты и основания в результате реакции нейтрализации.
Кислотная и основная природа солей обычно зависит от кислоты и основания, из которых соль выделяется в реакции нейтрализации.
Пример:
\ [NaOH + HCl \ to NaCl + {H_2} O \]
\ [HCl {\ text {}} + {\ text {}} N {H_4} OH {\ text { }} \ to {\ text {}} N {H_4} Cl {\ text {}} + {\ text {}} {H_2} O \]
\ [C {H_3} COOH {\ text {}} + {\ text {}} NaOH {\ text {}} \ to {\ text {}} C {H_3} COONa {\ text {}} + {\ text {}} {H_2} O \]
\ [C {H_3} COOH {\ text {}} + {\ text {}} N {H_4} OH {\ text {}} \ to {\ text {}} C {H_3} COON {H_4} + {\ text {} } {H_2} O \]
Самая известная или обычная соль — это хлорид натрия или поваренная соль, которая образована комбинацией сильного основного гидроксида натрия и сильнокислой соляной кислоты.
\ [HC {l _ {(aq)}} + NaO {H _ {(aq)}} \ to NaC {l _ {(aq)}} + {H_2} {O _ {(l)}} \]
Другие примеры включают английскую соль \ [(MgS {O_4}) \], которая используется в солях для ванн, нитрат аммония \ [(N {H_4} N {O_3}) \], используемый в качестве удобрения, и пищевую соду \ [(NaHC {O_3}) \] используется в кулинарии.
pH раствора соли также зависит от силы кислот и оснований, которые объединяются в реакции нейтрализации.
Добавление кислот или оснований в воду:
Процесс растворения кислоты или основания в воде сильно экзотермичен.Поскольку в этой реакции обычно выделяется много тепла, необходимо соблюдать особую осторожность при смешивании концентрированных кислот с водой, особенно когда азотная кислота или серная кислота смешиваются с водой.
Правила: Кислоту следует добавлять медленно в воду при непрерывном и постоянном перемешивании, в противном случае это может вызвать выплескивание смеси, что, в свою очередь, вызовет ожоги.
Стеклянный контейнер также может разбиться из-за чрезмерного нагрева, что может вызвать повреждение.-}) \] на единицу объема, тем самым легко рассеивая эффект тепла.
Свойства кислот и оснований
Свойства кислот и оснований
Некоторые свойства кислот:
- Вкус у них кисловатый, лимонный, апельсиновый.
- Их растворимость в воде высока.
- Их водные растворы проводят электрический ток.
- Соединения, включая CO 3 -2 и HCO 3 — , производят газ CO 2 ;
Пример:
CaCO 3 + 2HNO 3 → Ca (NO 3 ) 2 + CO 2 (г) + H 2 O
NaHCO 3 + HCl → NaCl + CO 2 (г) + H 2 O
- Они реагируют с активными металлами с образованием соли и газа H 2 .
Пример:
Zn + H 2 SO 4 (раствор) → ZnSO 4 (раствор) + H 2 (г)
Mg + 2HCl → MgCl 2 + H 2
2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2
Некоторые металлы, такие как Au, Pt, Ag, Cu и Hg, являются исключением из этого свойства. Их называют благородными металлами. Они не образуют газ H 2 в реакциях с кислотами.Однако некоторые благородные металлы реагируют с HNO 3 и H 2 SO 4 и не образуют H 2 .
Пример:
Cu + HCl → реакции не происходит
Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
3Cu + 8HNO 3 → 3Cu (NO 3 ) 2 + 2NO + 4H 2 O
- Кислоты превращают синюю лакмусовую бумажку в красную.
- Кислоты реагируют с основаниями с образованием соли и воды.Этот тип реакции называется реакцией нейтрализации .
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
2HCl + Ba (OH) 2 → BaCl 2 + 2H 2 O
HCl + NaOH → NaCl + H 2 O
Некоторые свойства оснований:
- Их вкус горький, как шампунь.
- Их растворы с водой проводят электрический ток.
- Когда мы касаемся простых вещей, мы чувствуем их скользкими.
- Их растворимость в воде мала по отношению к кислотам.
- Базы превращаются из красной лакмусовой бумажки в синюю.
- Не реагируют с металлами. Однако некоторые металлы, такие как Zn и Al, реагируют с основаниями и образуют газ H 2 и соль. Эти металлы называются амфотерными металлами. Они ведут себя как кислота для основания и основание для кислоты.
Пример:
2Al + 6NaOH → 2Na 3 AlO 3 + 3H 2
Zn + 2NaOH → Na 2 ZnO 2 + H 2
- Они реагируют с кислотами с образованием соли и воды.(Реакции нейтрализации)
Оксиды
Соединения любого элемента с водой называются оксидами . Мы исследуем их под четырьмя заголовками; кислые и основные оксиды, нейтральные оксиды, амфотерные оксиды и пероксиды;
1) Кислые оксиды: Это оксиды, которые соединяются с основаниями и образуют соли. SO 2 , SO 3 , CO 2 , N 2 O 5 являются примерами кислотных оксидов.
SO 3 + 2 NaOH → Na 2 SO 4 + H 2 O
Кислотно-оксидная основа, соленая вода
CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O
Кислотно-оксидная основа, соленая вода
Оксиды кислот соединяются с водой и образуют кислоты.
SO 2 + H 2 O → H 2 SO 3
SO 3 + H 2 O → H 2 SO 4
CO 2 + H 2 O → H 2 CO 3
2) Основные оксиды: Они соединяются с кислотами и образуют соли. Оксиды металлов проявляют это свойство как; Na 2 O, CaO.
Na 2 O + 2HCl → 2NaCl + H 2 O
Основная оксидно-кислая соленая вода
CaO + 2HCl → CaCl 2 + H 2 O
Основная оксидно-кислая соленая вода
Основные оксиды соединяются с водой и образуют основания.
Na 2 O + H 2 O → 2NaOH
BaO + H 2 O → Ba (OH) 2
3) Нейтральные оксиды: Не вступают в реакцию с кислотами и основаниями. Нейтральные оксиды не вступают в реакцию с водой и образуют кислоту или основание. NO, N 2 O и CO являются некоторыми примерами нейтральных оксидов.
4) Амфотерные оксиды: Эти оксиды реагируют с кислотами и основаниями и образуют соли. ZnO и Al 2 O 3 являются примерами амфотерных оксидов.Примеры этих реакций приведены ниже;
ZnO + 2HCl → ZnCl 2 + H 2 O
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
A l2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
Al2O3 + 6NaOH → 2Na 3 AlO 3 + 3H 2 O
5) Пероксиды: Соединения, содержащие в своей структуре (O 2 ) -2 , называются пероксидами.Примеры пероксидов приведены ниже;
H 2 O 2 : Пероксид водорода
Na 2 O 2 : Пероксид натрия
Пример: Какие из следующих утверждений верны для водного раствора серной кислоты H 2 SO 4 ?
I. Превращает лакмусовую бумажку в красный.
II. Проводит электрический ток.
III. При реакции с Mg образуется газ H 2 .
IV. Осуществляет реакцию нейтрализации водным раствором NH 3 .
Решение:
Кислота превращает синюю лакмусовую бумажку в красную. Я верно.
Все кислые водные растворы проводят электрический ток, так что II верно.
Некоторые металлы вступают в реакцию с кислотами, и образуется газ H 2 , Mg является одним из металлов III.
NH 3 — основание, а H 2 SO 4 — кислота, когда они объединяются, происходит реакция нейтрализации.IV тоже верно.
Кислоты и основания, экзамены и решения проблем
Кислоты и Основания <Пред. Далее> Сильные стороны кислот и оснований Каковы свойства кислоты и основания? — Химические заметки
Цели обучения:
- Опишите характерные свойства кислот в реакциях с металлами, основаниями и карбонатами.
- Опишите характерные свойства оснований в реакциях с кислотами и солями аммония.
- Опишите реакцию между ионами водорода и гидроксид-ионами с образованием воды, H + + OH — → H 2 O, в качестве нейтрализации.
- Оксиды классифицируют как кислотные, основные, амфотерные или нейтральные по металлическому / неметаллическому характеру.
Напомним, что кислота — это вещество, которое диссоциирует в воде с образованием ионов водорода (H + ), тогда как основание — это вещество, которое может нейтрализовать кислоту, но может быть или не раствориться в воде.Щелочь — это форма основания, которая растворима в воде и диссоциирует с высвобождением гидроксид-иона (ОН-). Ионы H + и OH — не только придают кислоте или щелочи их физические свойства, но также определяют их химические свойства.
Самая простая химическая реакция с участием кислоты и основания — это реакция нейтрализации. Нейтрализацию можно просто представить так:
Кислота + Основание (растворимое / нерастворимое) ==> Соль + Вода
В частности, для нейтрализации между кислотой и щелочью ионы H + в растворе кислоты реагируют с OH — в щелочи или наоборот с образованием молекул H 2 O.Другими словами, ионы H + нейтрализуются ионами OH — (или наоборот).
Когда количество ионов H + равно количеству ионов OH — , может произойти полная нейтрализация, и конечный раствор будет нейтральным с pH 7. В противном случае, если количество H будет выше. + или OH — для начала, в конце нейтрализации будет большее количество H + или OH — , что приведет к pH меньше или больше 7, соответственно.
Примеры реакции нейтрализации:
NaOH (водн.) + HCl (водн.) ==> NaCl (водн.) + H 2 O (л)
CuO (т.) + HCl (водн.) ==> CuCl 2 (т.) + H 2 O (л)
Ca (OH) 2 (s) + 2HNO 3 (вод.) ==> Ca (NO 3 ) 2 (вод.) + 2H 2 O (л )
Кислота также может реагировать с химически активными металлами, такими как магний и цинк, с образованием соли и водорода.
Кислота + Металл ==> Соль + Водород
Образовавшийся водород во время реакции вызывает образование пузырьков в растворе кислоты. Его можно обнаружить с помощью освещенной шины, которая вызывает воспламенение водорода с хлопком.
Примеры реакции кислоты и металла:
Ca (s) + 2HNO 3 (водный) ==> Ca (NO 3 ) 2 (водный) + H 2 (г)
Mg (тв) + 2HCl (водн.) ==> MgCl 2 (тв) + H 2 (г)
Когда кислота реагирует с карбонатами, образуется соль, вода и диоксид углерода.
Кислота + Карбонат ==> Соль + Вода + Двуокись углерода
Образовавшаяся двуокись углерода вызвала образование пузырьков в растворе кислоты во время реакции и может быть обнаружена с помощью известковой воды. Известковая вода становится молочно-белой, когда через нее пропускают углекислый газ.
Примеры кислотно-карбонатной реакции:
Na 2 CO 3 (т) + HCl (вод. ) ==> 2NaCl (водн.) + CO 2 (г) + H 2 O (л)
ZnCO 3 (т) + 2HNO 3 (вод.) ==> Zn (NO 3 ) 2 (водн.) + H 2 O (л) + CO 2 (г)
Когда соль аммония добавляется к щелочи, образуется соль, вода и газообразный аммиак.
Щелочь + аммиачная соль ==> соль + вода + газообразный аммиак
Аммиак имеет характерный резкий удушливый запах, при этом влажная красная лакмусовая бумажка становится синей. Он также образует белый дым хлорида аммония, когда газообразный хлористый водород из концентрированной соляной кислоты находится рядом с ним.
Примеры реакции солей щелочи и аммония:
NH 4 Cl (т) + NaOH (водн.) → + NaCl (водн.) + H 2 O (л) + NH 3 (г)
Название соли, образующейся в химической реакции, можно предсказать, исходя из используемых реагентов.Первая часть названия — «аммоний», если используемое основание — аммиак. В противном случае это название металла в основе / карбонате (или используемого металла). Вторая часть названия происходит от используемой кислоты. Пример названия соли, полученной в результате реакции нейтрализации, показан ниже.
================================================= ===========================
Оксиды представляют собой химические соединения с одним или несколькими атомами кислорода в сочетании с другим элементом.
Обычно оксид, который соединяется с водой с образованием кислоты или основания, известен как кислотный или основной оксид соответственно. Кислый и основной оксиды часто существуют в форме ангидрида , т.е. они представляют собой твердое вещество, которое ассимилирует H 2 O с образованием либо кислоты, либо основания. С другой стороны, оксид, который соединяется с водой с образованием раствора, который может действовать как кислота или основание, известен как амфотерный оксид . Оксид, который не проявляет ни основных, ни кислотных свойств, известен как нейтральный оксид .
Как я смогу определить конкретную характеристику оксида, если я не могу провести эксперимент с оксидом?
Характеристики оксида также можно определить, глядя на другой элемент, а не на кислород, который содержится в оксидном соединении.
Кислотные оксиды — это оксиды неметаллов (группы 14-17 Периодической таблицы). При добавлении в воду кислотные оксиды образуют кислый раствор.
Эти ангидриды кислот соединяются с основаниями с образованием соли и воды, подобно тому, как кислота реагирует с основанием.Например:
С другой стороны, основные оксиды представляют собой оксиды металлов (из группы I или II Периодической таблицы). Если растворимы, они реагируют с водой с образованием гидроксидов.
Эти оксиды металлов или основные ангидриды реагируют с кислотой с образованием соли и воды.
Амфотерные оксиды — это оксиды металлов, которые проявляют как основные, так и кислотные свойства. Распространенным примером амфотерного оксида является оксид алюминия.
Как это:
Нравится Загрузка …
Химические свойства кислот — Я МОГУ ХИМИЯ
Химические свойства кислотКислота — это вещество, которое производит ионы водорода в водном растворе.
Обычные кислоты включают соляную кислота (HCl), серная кислота (H 2 SO 4 ) и азотная кислота (HNO 3 )
Кислоты имеют значение pH менее 7. чем ниже значение pH, тем кислее раствор. Самая сильная кислота имеет pH 0.
Кислоты реагируют с металлами с образованием соли и водород газ .
Взаимодействие соляной кислоты и металлического магния:
Химическое уравнение: 2HCl (водн.) + Mg (s) → MgCl 2 (водн.) + H 2 (g)
Не все металлы реагируют с кислотами.Например, медь и серебро не реагируют с кислоты.
Свинец не реагирует с серной кислотой и соляной кислотой из-за нерастворимый слой соли образуется вокруг металла, защищая металл от дальнейшая реакция с кислотой.
Газообразный водород можно проверить горящей шиной. Газообразный водород тушит горящую шину со звуком «хлопка».
Кислоты реагируют с основаниями с образованием соли и вода. Эта реакция называется реакцией нейтрализации.
Основания представляют собой оксиды металлов или гидроксиды металлов.Растворимые гидроксиды металлов называют щелочами.
Взаимодействие соляной кислоты и гидроксида натрия является типичным примером реакция нейтрализации.
Химическое уравнение: HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
Давайте составьте ионное уравнение этой реакции. Вещества, которые ионизируются в водный раствор представлен (водн.) государственный символ. Соляная кислота, HCl, ионизируется на ионы водорода и ионы хлоридов.Гидроксид натрия, NaOH, ионизируется на ионы натрия и ионы гидроксидов. Хлорид натрия, NaCl, ионизируется на ионы натрия и хлора. Вода не ионизируется, следовательно, она представлен символом состояния (l).
Ионный уравнение: H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → Na + (водн.) + Cl — (водн.) + H 2 O (л)
Любые ионы, которые появляются слева и справа от уравнения, рассматриваются как зритель ионы.Они не участвуют в реакции и могут быть отменены в уравнение. Отменим Cl — (водн.) и Na + (водн.), оставив нас с H + (водн.) и OH — (водн.).
Ионное уравнение нейтрализации реакция: H + (водн.) + OH — (водн.) → H 2 O (л)
Кислоты реагируют с карбонатами с образованием соль, вода и углекислый газ.
Взаимодействие соляной кислоты и карбоната кальция:
Химическое уравнение: 2HCl (водн.) + CaCO 3 (т) → CaCl 2 (водн.) + H 2 O (л) + CO 2 (г)
Углекислый газ, кислый газ, можно проверить, пропустив его через известковую воду, Ca (OH) 2 .Углекислый газ образует белый осадок с известковой водой. Белый осадок — карбонат кальция, CaCO 3. CO 2 (г) + Ca (OH) 2 (водн.) → CaCO 3 (s) + H 2 O (л)
Нравится:
Нравится Загрузка …
СвязанныеКислоты и основания — Викиверситет
В химии соединение может быть кислотой или основанием. Кислоты и основания очень важны в химии.Они описывают большой класс веществ. Понимание их свойств позволяет нам рационализировать закономерности, встречающиеся в химии.Контрастные свойства кислот и оснований [править | править источник]
Вот список, который противопоставляет их свойства:
- Кислоты превращаются в синюю лакмусовую бумажку в красный цвет. Основа становится красной лакмусовой бумажкой синей.
- Кислоты выделяют ионы H + (водорода) в воде; основания выделяют ионы OH- (гидроксид) в воде.
- Кислоты обычно имеют кислый привкус из-за кислых ионов H +; основы горькие на вкус из-за иона ОН-; но у них могут быть другие вкусы в зависимости от другой части молекулы.
- Основания обычно мыльные.
- Кислоты разъедают активные металлы; Основы денатурируют белок.
- Кислоты имеют pH менее 7; Основания имеют pH больше 7
Аналогичные свойства кислот и оснований [править | править источник]
Вот список свойств, общих для кислот и оснований.
- Когда вы растворяете кислоту или основание в воде, они образуют ионы. Благодаря этому вода лучше проводит электричество.
- Чем сильнее кислота (или основание), тем больше образуется ионов, поэтому проводимость раствора увеличивается.
- Оба они могут проводить электричество.
- Когда кислота реагирует с основанием, образуется соль
- Они оба могут переносить и делить ионы
Кислоты реагируют с металлами 1 и 2 групп с образованием газообразного водорода.
Кислоты с pH менее 3 взорвутся при взаимодействии с раствором Дойера.
Примеры обычных кислых веществ [править | править источник]
- Цитрусовые (апельсины, лимоны, лаймы)
- Яблоки
- Ананасы
- Манго
- Вода и безалкогольные напитки (диоксид углерода реагирует в воде с образованием углекислоты)
- Желудочная кислота
- Уксус
- Жидкие очистители для слива, содержащие серную кислоту (Rooto)
Основы кажутся скользкими и мыльными, потому что они гидролизуют эфир жирных кислот кожи (реакция омыления).
Примеры обычных вещей, которые являются базами [править | править источник]
- Мыло для рук
- Щелок
- Пищевая сода
- Блич
- Шпинат
- Мойщик окон
- Укус осы
- Очиститель дренажа (Drano, Red Devil)
- Зубная паста
 ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2