«Химические явления в повседневной жизни и быту»
Химические явления в повседневной жизни и быту Окружающий нас мир, при всём его богатстве и многообразии, живёт по законам, которые достаточно легко объяснить с помощью таких наук, как физика и химия. И даже в основе жизнедеятельности такого сложного организма, как человек, лежит не что иное, как химические явления и процессы. Химические явления – это такие процессы, при которых взаимодействие двух разных веществ дает третье, новое, вещество. Например, при одних химических реакциях происходит выпадение осадка, при других – образование газа, выделение или поглощение тепла, света. Химические процессы могут быть обратимыми и необратимыми. Например, выпекание пирога – процесс необратимый, гидролиз солей (то есть разложение соли при помощи воды) – обратимый. О том, происходят ли химические явления, мы можем судить по некоторым признакам и изменениям, которые наблюдаются у того или иного тела или вещества. Так, большинство химических реакций сопровождается следующими «опознавательными знаками»: в результате или при протекании таковой выпадает осадок; происходит изменение цвета вещества; может выделяться газ, например, угарный при горении; происходит поглощение или, наоборот, выделение теплоты; возможно излучение света.Например – чайник, поставленный на огонь. Через некоторое время вода начнёт нагреваться, затем закипать. Мы услышим характерное шипение, из горлышка чайника будут вылетать струйки пара. Откуда он взялся, ведь в посуде его изначально не было. Да, но вода, при определённой температуре, начинает превращаться в газ, меняет своё физическое состояние из жидкого на газообразное. Т.е. она осталась всё той же водой, только теперь в виде пара. Это физическое явление. А химические явления мы увидим, если опустим в кипяток пакетик с чайной заваркой. Вода в стакане или другом сосуде окрасится в красно-коричневый цвет. Произойдёт химическая реакция: под воздействием тепла чаинки начнут запариваться, выделяя цветовые пигменты и вкусовые свойства, присущие этому растению. У нас получится новое вещество – напиток со специфическими, свойственными только ему качественными характеристиками. Если туда же добавим несколько ложек сахара, он растворится (физическая реакция), а чай станет сладким (реакция химическая). Таким образом, физические и химические явления часто связаны и взаимозависимы. К примеру, если тот же чайный пакетик поместить в холодную воду, реакции не произойдёт, чаинки и вода не будут взаимодействовать, да и сахар растворяться тоже не пожелает. Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе. Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ. Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо - топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается. Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот - коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ. В идеале реакция полного сгорания топлива должна выглядеть так: Cnh3n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)h3O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа . Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) - тоже из категории бытовых химических явлений. Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * h3O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий. Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + h3O + CO2 = Cu2CO5h3 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе - в виде минерала малахита. Одой из главных химических реакций является фотосинтез, чтобы преобразовать углекислый газ в воду, пищу и кислород. Фотосинтез – одна из самых распространенных и важных химических реакций в жизни. Только благодаря фотосинтезу растения производят для себя и животных еду, он превращает углекислый газ в кислород. 6 СО2 + 6 Н2О + свет → C6h22O6 + 6 O2 Так же аэробное клеточное дыхание - это противоположный процесс фотосинтеза в том, что энергия молекул в сочетании с кислородом, которым мы дышим, с целью высвобождения энергии, необходимым нашим клеткам, плюс углекислый газ и вода. Энергия, используемая клетками, является химической реакцией в формате АТФ. Общее уравнение аэробного клеточного дыхания: C6h22O6 + 6O2 → 6CO2 + 6h3O + energy (36 ATPs) В отличие от аэробного клеточного дыхания, анаэробное дыхание описывает набор химических реакций, которые позволяют клеткам получать энергию от сложных молекул без кислорода.
Ваши клетки в мышцах выполняют анаэробное дыхание, когда Вы исчерпаете кислород, поставляемый им, например, во время интенсивных или продолжительных физических упражнений. Анаэробное дыхание дрожжей и бактерий используется для брожения, производства этанола, диоксида углерода и других химических веществ, которые производят сыр, вино, пиво, хлеб и многие другие продукты питания. Общее химическое уравнение для анаэробного дыхания: C6h22O6 → 2C2H5OH + 2CO2 + энергия Мыло и моющие средства получены чистым путем химических реакций. Мыло превращает грязь в эмульсию, а это значит, масляные пятна связаны с мылом, чтобы они могли быть удалены водой. Моющие средства действуют как поверхностно-активные вещества, понижая поверхностное натяжение воды, чтобы они могли взаимодействовать с маслами, изолировать и промыть их. Это далеко не все примеры химических реакций и явлений в повседневной жизни. В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. 
Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Упражнение: 1 Приведите несколько примеров хорошо известных вам химических и физических явлений. Химические явления: Горение природного газа, почернение серебряных изделий, скисание молока. Упражнение: 3 Почему процессы горения веществ относят к химическим? Приведите примеры практического применения процессов горения. Процесс горение — химический процесс, так как в результате образуются новые вещества (продукты горения). Примеры: горение метана применяют в быту для приготовления пищи, при движении автомобиля происходит горение бензина в двигателях внутреннего сгорания. Упражнение: 5 Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации. Химические реакции: сгорание бензина в двигателях внутреннего сгорания. | Упражнение: 2 Стальные детали в результате длительного пребывания во влажной атмосфере покрываются ржавчиной. Как называют это явление? К физическим или химическим явлениям его отнесете? Почему? Ржавление, коррозия. Явление относится к химическим, так как образуется новое вещество – ржавчина. Упражнение: 4 Назовите вещества, применяемые вами в быту, но не встречающиеся в живой и неживой природе. Синтетические моющие средства: стиральные порошки, пасты, мыло. |
Узнаем чем физические явления отличаются от химических? Физические и химические явления: примеры
Часто от многих людей, которые обсуждают тот или иной процесс, можно услышать слова: «Это физика!» или «Это химия!» Действительно, практически все явления в природе, в быту и в космосе, с которыми встречается человек в течение своей жизни, можно отнести к одной из этих наук. Интересно разобраться, чем физические явления отличаются от химических.
Наука физика
Прежде чем отвечать на вопрос, чем физические явления отличаются от химических, необходимо разобраться, какие объекты и процессы исследует каждая из этих наук. Начнем с физики.
С древнегреческого языка слово «fisis» переводится, как «природа». То есть, физика — это наука о природе, которая изучает свойства объектов, их поведение в различных условиях, преобразования между их состояниями. Цель физики заключается в определении законов, которые регулируют происходящие природные процессы. Для этой науки не важно, из чего состоит изучаемый объект, и каков его химический состав, для нее важно лишь, как будет себя вести объект, если воздействовать на него теплом, механической силой, давлением и так далее.
Цель физики заключается в определении законов, которые регулируют происходящие природные процессы. Для этой науки не важно, из чего состоит изучаемый объект, и каков его химический состав, для нее важно лишь, как будет себя вести объект, если воздействовать на него теплом, механической силой, давлением и так далее.
Физика делится на ряд разделов, которые изучают определенный более узкий круг явлений, например, оптика, механика, термодинамика, атомная физика и так далее. Кроме того, многие самостоятельные науки зависят полностью от физики, например, астрономия или геология.
Наука химия
В отличие от физики, химия является наукой, изучающей структуру, состав и свойства материи, а также ее изменение в результате химических реакций. То есть, объектом изучения химии является химический состав и его изменение в ходе определенного процесса.
Химия, как и физика, имеет множество разделов, каждый из которых изучает определенный класс химических веществ, например, органическая и неорганическая, био- и электрохимия. На достижения этой науки опираются исследования в медицине, биологии, геологии и даже астрономии.
На достижения этой науки опираются исследования в медицине, биологии, геологии и даже астрономии.
Интересно отметить, что химия, как наука, не признавалась древнегреческими философами из-за ее ориентированности на эксперимент, а также из-за псевдонаучных знаний, которые ее окружали (напомним, что современная химия «родилась» из алхимии). Только с эпохи Возрождения и во многом благодаря работам английского химика, физика и философа Роберта Бойля химию стали воспринимать как полноценную науку.
Примеры физических явлений
Можно привести огромное число примеров, которые подчиняются физическим законам. Например, каждый школьник знает уже в 5 классе физическое явление — движение автомобиля по дороге. При этом не важно, из чего состоит этот автомобиль, откуда он берет энергию, чтобы двигаться, важно лишь то, что он перемещается в пространстве (по дороге) вдоль некоторой траектории с определенной скоростью. Более того, процессы разгона и торможения автомобиля также являются физическими. Движением автомобиля и других твердых тел занимается раздел физики «Механика».
Движением автомобиля и других твердых тел занимается раздел физики «Механика».
Еще один всем известный пример физических явлений — таяние льда. Лед, будучи твердым состоянием воды, при атмосферном давлении может сколь угодно долго существовать при температурах ниже 0 oC, но, если температуру окружающей среды увеличить хотя бы на долю градуса, либо, если льду непосредственно передать тепло, например, взяв его в руку, то он начнет таять. Этот процесс, который идет с поглощением тепла и изменением агрегатного состояния материи, является исключительно физическим явлением.
Другими примерами физических явлений являются плавание тел в жидкостях, вращение планет по своим орбитам, электромагнитное излучение тел, преломление света при переходе через границу двух разных прозрачных сред, полет снаряда, растворение сахара в воде и другие.
Примеры химических явлений
Как было сказано выше, любые процессы, которые происходят с изменением химического состава тел, принимающих в них участие, изучаются химией. Если возвращаться к примеру с автомобилем, то можно сказать, что процесс сжигания топлива в его двигателе является ярким примером химического явления, поскольку в результате него углеводороды, взаимодействуя с кислородом, приводят к образованию совершенно других продуктов сгорания, основными из которых являются вода и углекислый газ.
Если возвращаться к примеру с автомобилем, то можно сказать, что процесс сжигания топлива в его двигателе является ярким примером химического явления, поскольку в результате него углеводороды, взаимодействуя с кислородом, приводят к образованию совершенно других продуктов сгорания, основными из которых являются вода и углекислый газ.
К еще одному из ярких примеров рассматриваемого класса явлений относится процесс фотосинтеза в зеленых растениях. Изначально они располагают водой, углекислым газом и солнечным светом, после же завершения фотосинтеза исходных реагентов уже нет, а на их месте образуются глюкоза и кислород.
В общем случае можно говорить, что любой живой организм представляет собой настоящий химический реактор, поскольку в нем происходят огромное количество преобразовательных процессов, например, распад аминокислот и образование из них новых протеинов, перевод углеводородов в энергию для мышечных волокон, процесс дыхания человека, при котором гемоглобин связывает кислород, и многие другие.
Одним из удивительных примеров химических явлений в природе признано холодное свечение светлячков, которое является результатом окисления специального вещества — люциферина.
В технической сфере примером химических процессов является изготовление красителей для одежды и продуктов питания.
Отличия
Чем физические явления отличаются от химических? Ответ на этот вопрос можно понять, если проанализировать приведенную выше информацию об объектах изучения физики и химии. Основным отличием между ними является изменение химического состава рассматриваемого объекта, наличие которого свидетельствует о преобразованиях в нем, в случае же неизменных химических свойствах тела говорят о физическом явлении. Важно не путать перемену в химическом составе и изменение структуры, под которой понимается пространственное расположение атомов и молекул, образующих тела.
Обратимость физических и необратимость химических явлений
В некоторых источниках, при ответе на вопрос, чем физические явления отличаются от химических, можно встретить информацию о том, что физические явления являются обратимыми, а химические — нет, однако, это не совсем верно.
Направление любого процесса можно определить, используя законы термодинамики. Эти законы говорят, что всякий процесс может идти самопроизвольно только в случае уменьшения его энергии Гиббса (уменьшении внутренней энергии и увеличении энтропии). Однако, этот процесс всегда можно обратить вспять, если использовать внешний источник энергии. Для примера скажем, что недавно ученые открыли обратный фотосинтезу процесс, который является химическим явлением.
Процесс горения
Этот вопрос был специально вынесен в отдельный пункт, поскольку многие люди считают горение химическим явлением, но это не верно. Однако, считать процесс горения физическим явлением, тоже будет неправильно.
Распространенное явление горения (костер, сгорание топлива в двигателе, газовая конфорка или горелка и т. д.) — это сложный физико-химический процесс. С одной стороны, он описывается цепью химических реакций окисления, но с другой стороны, в результате этого процесса происходит сильное тепловое и световое электромагнитное излучение, а это уже область физики.
Где находится граница между физикой и химией
Физика и химия — это две разные науки, которые обладают различными методами исследования, при этом физика может быть как теоретической, так и практической, химия же является, в основном, практической наукой. Однако, в некоторых областях эти науки соприкасаются настолько близко, что граница между ними размывается. Ниже приводятся примеры научных отраслей, в которых трудно определить, «где физика, а где химия»:
- квантовая механика;
- ядерная физика;
- кристаллография;
- материаловедение;
- нанотехнологии.
Как видно из списка, физика и химия тесно пересекаются, когда рассматриваемые явления имеют атомный масштаб. Такие процессы принято называть физико-химическими. Любопытно отметить, что единственным человеком, который получил Нобелевскую премию по химии и физике одновременно, является Мария Склодовская-Кюри.
ГДЗ (ответы) Химия 7 класс Григорович А.В. §14 Физические и химические явления » Допомога учням
Другие задания смотри здесь. ..
..
Контрольные вопросы
Вопрос 1 Дайте определения химических и физических явлений. Явления, при которых одни вещества превращаются в другие, называют химическими. Явления, при которых изменяется форма предмета или агрегатное состояние вещества, но не меняется его состав, называют физическими.
Чем они отличаются? Во время химических явлений происходит превращение веществ, а во время физических — не происходит.
Вопрос 2 Перечислите признаки химических реакций. Изменение окраски, запаха, вкуса, образование или исчезновение осадка, выделение или поглощение теплоты, газа или света.
Вопрос 3 При каких условиях происходят химические реакции?
— столкновение веществ и их перемешивание;
— соблюдение температурного режима;
— наличие света или электрического тока и др.
Те реакции, которые протекают в специальных условиях, описываются в химической литературе.
Задания для усвоения материала
Упражнение 1 Выберите из представленного перечня условия протекания реакций:
а) смешивание веществ;
б) выделение газа;
в) предварительное нагревание веществ;
г) выделение теплоты и света;
д) предварительное растворение реагирующих веществ;
е) действие электрического тока;
ж) образование осадка.
Ответ: а), в), д), е)
Упражнение 2 Что происходит с атомами и молекулами в химических реакциях? Выберите правильные утверждения:
а) молекулы реагентов разрушаются, а из них образуются новые молекулы;
б) одни атомы разрушаются, из них образуются другие;
в) молекулы в химических реакциях не изменяются;
г) атомы в химических реакциях не изменяются;
д) атомы перегруппировываются, образуя молекулы новых веществ.
Ответ: а), г), д)
Упражнение 3 Приведите примеры физических явлений, при которых изменяется агрегатное состояние веществ.
Кипение воды (жидкий → газообразный), замерзание воды (жидкий → твердый), таяние снежинок (твердый → жидкий), образование росы (газообразный → жидкий), сушки белья на морозе (твердый → газообразный), образование снежинок (газообразный → твердый).
Упражнение 4 Приведите три примера химических реакций, которые вы наблюдали в природе или в быту. Сгорание древесины, скисание молока, ржавление железа.
Упражнение 5 Выберите, какие из приведенных явлений относятся к химическим, а какие — к физическим:
а) зимой ветви деревьев покрываются изморозью; Физическое явление
б) опавшая листва сгнивает; Химическое явление
в) разлитый ацетон быстро испаряется; Физическое явление
г) запах разлитых духов быстро распространяется по всей комнате; Физическое явление
д) со временем на стенках чайника образуется накипь; Химическое явление
е) в теплом месте молоко быстро скисает; Химическое явление
ж) бронзовые памятники покрываются зеленым налетом; Химическое явление
з) капля грязи на ботинке к утру превращается в коричневое пятно;
Физическое явление
и) ржавый гвоздь очищается от ржавчины наждачной бумагой. Физическое явление
Физическое явление
Упражнение 6 Приведите примеры химических явлений, которые сопровождаются изменением агрегатного состояния веществ. Сода и уксус реагируют между собой с образованием газа, растворимые соли реагируют между собой с образованием осадка, вода разлагается на водород и кислород под действием электрического тока
Упражнение 7 Какие признаки химических реакций наблюдаются при:
а) горении костра; Выделение света и теплоты, изменение цвета
б) ржавлении железа; Изменение цвета
в) скисании пищи? Появление запаха, изменение вкуса
Упражнение 8 Приведите примеры химических реакций из повседневной жизни, которые происходят:
а) при постоянном нагревании; Приготовление пищи
б) после однократного нагревания; Сжигание дров
в) под действием света; Изменение цвета ткани под действием солнца
г) с изменением окраски. Ржавление железа, изменение цвета листьев осенью
Упражнение 9* Проект № 2 «Химические явления в окружающей среде».
Фотосинтез, дыхание, переваривание пищи, горение, гниение, образование горных пород и минералов, вулканические процессы.
Упражнение 10* Проект № 3 «Химические явления в быту».
Приготовление пищи, сжигание дров, горение угля, выцветание цветной ткани на солнце, сгорание топлива в двигателе, порча пищевых продуктов, брожение сока, появление ржавчины на гвоздях в гараже, образование накипи в чайнике, покрытие налетом металлических предметов, сгорание свечи, скисание молока, взаимодействие соды с уксусом.
Упражнение 11* Проект № 4 «Использование химических явлений в художественном творчестве и народных ремеслах». Изготовление ткани, красителей, красок, лекарств, стеклянных и керамических изделий, получение сплавов, обжиг кирпича, виноделие и др.
Другие задания смотри здесь…
Химические явления, их признаки
Ознакомление со смесями и физическими явлениями позволило вам сделать вывод, что и в смесях при выполнении физических явлений состав веществ остается неизменным, а компоненты смесей сохраняют свои свойства. Так, во время плавления льда, кипения и замерзания воды ее молекулы сохраняются.
Так, во время плавления льда, кипения и замерзания воды ее молекулы сохраняются.
Химические явления. Химические явления в корне отличаются от физических. К началу химического явления существуют одни вещества, после него они превращаются в другие.
Химические явления — это изменения, в результате которых одни вещества превращаются в другие. их еще называют химическими реакциями.
Чтобы убедиться, произошло химическое явление, надо обнаружить образование новых веществ. Проще всего это сделать, когда наше зрение фиксирует признаки химического явления: выделение газа, образование осадка, изменение цвета, появление света и тепла. В изображенных на рис. 39 (см. с. 64) примерах химических явлений присутствуют эти признаки.
К признакам химических явлений относится и появление запаха. Достаточно летом подержать мясные продукты несколько дней и даже часов в холодильнике, как
Наведите доказательства того, что в смесях их компоненты сохраняют свойства.
О том, что произошло химическое явление, свидетельствовать появление неприятного запаха.
Признаками химических явлений является выделение газа, образование осадка, изменение цвета, появление запаха, света и тепла.
Гниение как естественное химическое явление. Задумывались ли вы над тем, почему в густом лесу мы не «тонем» в опал ом письме и куда в природе исчезают опавшие ветви деревьев, плоды, засохла трава ? Действительно, есть над чем задуматься и поучиться у природы, чтобы не иметь мороки с мусором.
Оказывается, что при благоприятных условиях отмершие остатки растений и животных перегнивают. Гниением называется естественное химическое явление, во время которого органические вещества, преимущественно белки, превращаются в другие органические, а также неорганические вещества. Вследствие этого почва обогащается питательными веществами (перегноем, или гумусом). Гниению способствуют влажность, бактерии, ограниченный доступ воздуха. Признаком этого природного химического явления является выделение тепла.
Вследствие гниения образуются простые вещества, они попадают в почву, воду, воздух и снова поглощаются растениями и участвуют в образовании новых органических веществ.
Благодаря гниению не накапливаются отмершие остатки организмов, а почва обогащается перегноем.
Это важно в природе химическое явление в быту лини не всегда желательно, так как через него продукты питания становятся непригодными к употреблению. Способами, препятствующими гниению органических веществ пищи, является консервирования, варки, соления, замораживания.
В природе происходит множество химических явлений.
Так в растениях с углекислого газа и воды образуются органические вещества и необходимый для жизни кислород. Благодаря химическим явлениям организм животных и человека получает все необходимые для роста и развития вещества.
копилка знаний
Химические явления люди научились осуществлять в лабораториях и на заводах. Насколько это важно сейчас, вы убеждаетесь постоянно. Прежде всего следует назвать производство металлов, каучука и резины, пластмасс, покрытий для крыш и полов, цемента, удобрений для растений, пищевых добавок для животных. Каждое из этих производств человек осваивал в разные времена. Изучая историю, вы узнаете о бронзовый и железный века. Названия подтверждают важность освоенных людной химических явлений, благодаря которым ей удалось заменить каменный копье, деревянную борону металлическими орудиями.
Изучая историю, вы узнаете о бронзовый и железный века. Названия подтверждают важность освоенных людной химических явлений, благодаря которым ей удалось заменить каменный копье, деревянную борону металлическими орудиями.
Станьте естествоиспытателями
Высушите скорлупу двух куриных яиц и измельчите ее. Полученный порошок разделите на две части и поместите его в две прозрачные сосуды. В одну налейте 2 столовые ложки воды, во вторую — столько же уксуса. Наблюдайте за изменениями ей в обоих сосудах. В какой из них произошло химическое явление? Как вы об этом узнали ?
категория: Биология«Физические и химические явления (химические реакции). Примеры химических и физических явлений в природе
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).

Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Итак, первым делом поговорим про фотосинтез . Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО 2 + 12Н 2 О + свет = С 6 Н 12 О 6 + 6О 2 + 6Н 2 О.
Дыхание , наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С 6 Н 12 О 6 + 6О 2 = СО 2 + 6Н 2 О + 2,87 * 10 6 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О 2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение .
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.
И круг начинается сначала.
Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О 3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О 2 + УФ свет → 2О 3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О 3 .
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе .
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания.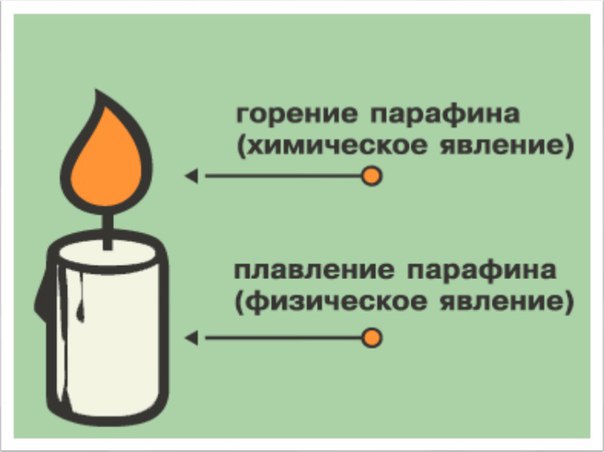 А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: C n H 2n+2 + (1,5 n +0,5) O 2 = nCO 2 + (n +1) H 2 O . В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe 2 O 3 (точнее, Fe 2 O 3 * H 2 O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O 2 + H 2 O + CO 2 = Cu 2 CO 5 H 2 (или CuCO 3 * Cu(OH) 2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag 2 S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H 2 S + O 2 = 2Ag 2 S + 2H 2 O.
Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H 2 S + O 2 = 2Ag 2 S + 2H 2 O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО 3 и Mg СО 3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом .
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO 3 + C H 3 COOH = CH 3 COONa + H 2 O + CO 2 . Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды . Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление , при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО 3 . Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты . А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты .
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Динамические изменения встроены в саму природу. Все меняется так или иначе каждый момент. Если вы внимательно осмотритесь, вы найдете сотни примеров физических и химических явлений, которые являются вполне себе естественными преобразованиями.
Изменения — единственная константа во Вселенной
Как ни странно, изменение является единственной константой в нашей Вселенной. Чтобы понять физические и химические явления (примеры в природе встречаются на каждом шагу), принято классифицировать их по типам, в зависимости от характера конечного результата, вызванного ими. Различают физические, химические и смешанные изменения, которые содержат в себе и первые, и вторые.
Физические и химические явления: примеры и значение
Что такое физическое явление? Любые изменения, происходящие в веществе без изменения его химического состава, являются физическими. Они характеризуется изменениями физических атрибутов и материального состояния (твердое, жидкое или газообразное), плотности, температуры, объема, которые происходят без изменения его фундаментальной химической структуры. Не происходит создание новых химических продуктов или изменения общей массы. Кроме того, этот тип изменений обычно является временным и в некоторых случаях полностью обратимым.
Когда вы смешиваете химикаты в лаборатории, можно легко увидеть реакцию, но в мире вокруг вас происходит множество химических реакций каждый день. Химическая реакция изменяет молекулы, в то время как физическое изменение только перестраивает их. Например, если мы возьмем газ хлора и металлический натрий и объединим их, мы получим столовую соль. Полученное вещество сильно отличается от любого из его составных частей. Это химическая реакция. Если затем растворить эту соль в воде, мы просто смешиваем молекулы соли с молекулами воды. В этих частицах нет изменений, это физическое преобразование.
Примеры физических изменений
Все состоит из атомов. При соединении атомов образуются разные молекулы. Различные свойства, которые наследуют объекты, являются следствием различных молекулярных или атомных структур. Основные свойства объекта зависят от их молекулярного расположения. Физические изменения происходят без изменения молекулярной или атомной структуры объектов. Они просто преобразуют состояние объекта, не изменяя его природы. Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Дополнительные примеры физических изменений: металл, расширяющийся при нагревании, передача звука через воздух, замерзание воды зимой в лед, медь втягивается в провода, формирование глины на разных объектах, мороженое плавится до жидкости, нагревание металла и преобразование его в другую форму, сублимация йода при нагревании, падение любого объекта под действием силы тяжести, чернила поглощаются мелом, намагничивание железных гвоздей, снеговик, тающий на солнце, светящиеся лампы накаливания, магнитная левитация объекта.
Как различать физические и химические изменения?
Множество примеров химических явлений и физических можно встретить в жизни. Часто трудно определить разницу между ними, особенно когда оба могут происходить одновременно. Чтобы определить физические изменения, задайте следующие вопросы:
- Является ли состояние состояния объекта изменением (газообразным, твердым и жидким)?
- Является ли изменение чисто ограниченным физическим параметром или характеристикой, такой как плотность, форма, температура или объем?
- Является ли химическая природа объекта изменением?
- Возникают ли химические реакции, приводящие к созданию новых продуктов?
Если ответ на один из первых двух вопросов да, и ответы на последующие вопросы отсутствуют, это, скорее всего, это физическое явление. И наоборот, если ответ на любой из двух последних вопросов положительный, в то время как первые два отрицательные, это, безусловно, химическое явление. Трюк состоит в том, чтобы просто четко наблюдать и анализировать то, что вы видите.
И наоборот, если ответ на любой из двух последних вопросов положительный, в то время как первые два отрицательные, это, безусловно, химическое явление. Трюк состоит в том, чтобы просто четко наблюдать и анализировать то, что вы видите.
Примеры химических реакций в повседневной жизни
Химия происходит в окружающем вас мире, а не только в лаборатории. Материя взаимодействует для образования новых продуктов посредством процесса, называемого химической реакцией или химическим изменением. Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Есть реакции, когда вы принимаете лекарства, зажигаете спичку и вздыхаете. Вот 10 химических реакций в повседневной жизни. Это всего лишь небольшая выборка из тех примеров физических и химических явлений в жизни, которые вы видите и испытываете много раз каждый день:
- Фотосинтез. Хлорофилл в листьях растений превращает углекислый газ и воду в глюкозу и кислород.
 Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород. - Аэробное клеточное дыхание является реакцией с кислородом в человеческих клетках. Аэробное клеточное дыхание является противоположным процессом фотосинтеза. Разница заключается в том, что молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислый газ и воду. Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ.
- Анаэробное дыхание. Анаэробное дыхание производит вино и другие ферментированные продукты. Ваши мышечные клетки выполняют анаэробное дыхание, когда вы исчерпываете подаваемый кислород, например, при интенсивном или продолжительном упражнении. Анаэробное дыхание дрожжами и бактериями используется для ферментации для производства этанола, углекислого газа и других химических веществ, которые производят сыр, вино, пиво, йогурт, хлеб и многие другие распространенные продукты.

- Сгорание — это тип химической реакции. Это химическая реакция в повседневной жизни. Каждый раз, когда вы зажигаете спичку или свечу, разжигаете костер, вы видите реакцию горения. Сжигание объединяет энергетические молекулы с кислородом для получения двуокиси углерода и воды.
- Ржавчина — общая химическая реакция. Со временем железо развивает красное, шелушащееся покрытие, называемое ржавчиной. Это пример реакции окисления. Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра.
- Смешивание химических веществ вызывает химические реакции. Пекарский порошок и пищевая сода выполняют аналогичные функции при выпечке, но они по-разному реагируют на другие ингредиенты, поэтому вы не всегда можете заменить их на другой. Если вы комбинируете уксус и пищевую соду для химического «вулкана» или молока с порошком для выпечки в рецепте, вы испытываете реакцию двойного смещения или метатезиса (плюс некоторые другие). Ингредиенты рекомбинируют для получения газообразного диоксида углерода и воды.
 Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов.
Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов. - Батареи являются примерами электрохимии. Батареи используют электрохимические или окислительно-восстановительные реакции для превращения химической энергии в электрическую.
- Пищеварение. Тысячи химических реакций происходят во время пищеварения. Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника.
- Кислотно-базовые реакции. Всякий раз, когда вы смешиваете кислоту (например, уксус, лимонный сок, серную кислоту, соляную кислоту) со щелочью (например, пищевой содой, мылом, аммиаком, ацетоном), вы выполняете кислотно-щелочную реакцию.
 Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.
Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O. - Мыло и моющие средства. Их очищают путем химических реакций. Мыло эмульгирует грязь, что означает, что масляные пятна связываются с мылом, чтобы их можно было снять водой. Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать.
- Химические реакции при приготовлении пищи. Кулинария — один большой практический эксперимент по химии. Приготовление использует тепло, чтобы вызвать химические изменения в пище. Например, когда вы сильно кипятите яйцо, сероводород, полученный нагреванием яичного белка, может реагировать с железом из яичного желтка, образуя серо-зеленое кольцо вокруг желтка. Когда вы готовите мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желательный вкус.

Другие примеры химических и физических явлений
Физические свойства описывают характеристики, которые не изменяют вещество. Например, вы можете изменить цвет бумаги, но это еще бумага. Вы можете кипятить воду, но когда вы собираете и конденсируете пар, это все еще вода. Вы можете определить массу листа бумаги, и это все еще бумага.
Химическими свойствами являются те, которые показывают, как вещество реагирует или не реагирует с другими веществами. Когда металлический натрий помещают в воду, он реагирует бурно, образуя гидроксид натрия и водород. Достаточное тепло выделяется тем, что водород вырывается в пламя, реагируя с кислородом в воздухе. С другой стороны, когда вы кладете кусок медного металла в воду, реакция не возникает. Таким образом, химическое свойство натрия заключается в том, что он реагирует с водой, а химическое свойство меди заключается в том, что это не так.
Какие еще можно привести примеры химических явлений и физических? Химические реакции всегда происходят между электронами в валентных оболочках атомов элементов в периодической таблице. Физические явления на низких энергетических уровнях просто включают механические взаимодействия — случайные столкновения атомов без химических реакций, таких как атомы или молекулы газа. Когда энергии столкновений очень велики, целостность ядра атомов нарушается, что приводит к делению или слиянию вовлеченных видов. Спонтанный радиоактивный распад обычно считается физическим явлением.
Физические явления на низких энергетических уровнях просто включают механические взаимодействия — случайные столкновения атомов без химических реакций, таких как атомы или молекулы газа. Когда энергии столкновений очень велики, целостность ядра атомов нарушается, что приводит к делению или слиянию вовлеченных видов. Спонтанный радиоактивный распад обычно считается физическим явлением.
С давних времен люди собирали сведения о том мире, в котором они живут. Была лишь одна наука, объединяющая всю информацию о природе, которую человечество накопило на тот момент. Тогда еще люди не знали, что они наблюдают примеры физических явлений. В настоящее время такая наука носит название «естествознание».
Что изучает физическая наука
Со временем научные представления об окружающем мире заметно изменились — их стало гораздо больше. Естествознание раскололось на много отдельных наук, среди которых: биология, химия, астрономия, география и другие. В ряде этих наук не последнее место занимает физика. Открытия и достижения в этой области позволили человечеству обладать новыми знаниями. К ним можно отнести структуру и поведение различных объектов всяких размеров (начиная с гигантских звезд и заканчивая мельчайшими частицами — атомами и молекулами).
Открытия и достижения в этой области позволили человечеству обладать новыми знаниями. К ним можно отнести структуру и поведение различных объектов всяких размеров (начиная с гигантских звезд и заканчивая мельчайшими частицами — атомами и молекулами).
Физическое тело — это…
Существует специальный термин «материя», которым в кругах ученых называют все, что есть вокруг нас. Состоящее из материи физическое тело — это какое-либо вещество, занимающее определенное место в пространстве. Любое физическое тело в действии можно назвать примером физического явления. Опираясь на это определение, можно сказать, что любой предмет является физическим телом. Примеры физических тел: кнопка, блокнот, люстра, карниз, Луна, мальчик, облака.
Что такое физическое явление
Любая материя находится в постоянном изменении. Одни тела двигаются, другие соприкасаются с третьими, четвертые крутятся. Не зря много лет назад философом Гераклитом была произнесена фраза «Все течет, все меняется». У ученых есть даже специальный термин таким изменениям — это все явления.
У ученых есть даже специальный термин таким изменениям — это все явления.
К физическим явлениям относится все то, что движется.
Какие существуют типы физических явлений
Это явления, когда из-за воздействия температуры некоторые тела начинают трансформироваться (изменяется форма, размер и состояние). Пример физических явлений: под воздействием теплого весеннего солнца тают сосульки и превращаются в жидкость, с наступлением холодов лужи замерзают, кипящая вода становится паром.
- Механические.
Эти явления характеризуют смену положения одного тела по отношению к остальным. Примеры: часы идут, мяч прыгает, дерево качается, ручка пишет, вода течет. Все они находятся в движении.
- Электрические.
Характер этих явлений полностью оправдывает свое название. Слово «электричество» уходит корнями в греческий язык, где «электрон» значит «янтарь». Пример достаточно простой и многим наверняка знакомый. При резком снятии с себя шерстяного свитера слышится небольшой треск. Если проделать это, отключив в комнате свет, то можно увидеть искорки.
Если проделать это, отключив в комнате свет, то можно увидеть искорки.
Тело, участвующее в явлении, которое связанно со светом, называют светящимся. В качестве примера физических явлений можно привести всем известную звезду нашей Солнечной системы — Солнце, а также любую другую звезду, лампу и даже жучка-светлячка.
Распространение звука, поведение звуковых волн при столкновениях с препятствием, а также иные явления, которые так или иначе связаны со звуком, относятся к этому типу физических явлений.
Они происходят благодаря свету. Так, например, человек и животные способны видеть, потому что есть свет. В эту группу также включены явления распространения и преломления света, его отражение от предметов и прохождение сквозь разные среды.
Теперь вы знаете, какие бывают физические явления. Однако стоит понимать, что между природными и физическими явлениями существует определенная разница. Так, при природном явлении происходит одновременно несколько физических явлений. Например, при ударе молнии в землю происходят следующие явления: магнитное, звуковое, электрическое, тепловое и световое.
Например, при ударе молнии в землю происходят следующие явления: магнитное, звуковое, электрическое, тепловое и световое.
0 V_V
Физические явления окружают нас все время. В каком-то смысле, всё, что мы видим — это физические явления. Но, строго говоря, их делят на несколько видов:
· механические
· звуковые
· тепловые
· оптические
· электрические
· магнитные
Пример механических явлений — это взаимодействия каких-то тел, например мяча и пола, когда мяч отскакивает при ударе. Вращение Земли — тоже механическое явление.
Звуковые явления — это распространение звука в какой-то среде, например в воздухе или в воде. К примеру, эхо, звук пролетающего самолета.
Оптические явления — всё, что связано со светом. Преломление света в призме, отражения света в воде или зеркале.
Тепловые явления связаны с тем, что различные тела меняют свою температуру и физическое / агрегатное состояние: лёд плавится и превращается в воду, вода испаряется и превращается в пар.
Электрические явления связаны с возникновением электрических зарядов. Например, когда электризуется одежда или другие ткани. Или во время грозы появляется молния.
Магнитные явления связаны с электрическими, но касаются взаимодействия магнитных полей. Например, работа компаса, северное сияние, притяжение двух магнитов друг к другу.
0 buzz
25.06.2018 оставил(а) комментарий:
Явления, при которых не происходит превращений одних веществ в другие, относят к физическим явлениям. Физические явления могут привести к изменению, например, агрегатного состояния или температуры, но состав веществ останется тем же.
Все физические явления можно разделить на несколько групп.
Механические явления – это явления, которые происходят с физическими телами при их движении относительно друг друга (обращение Земли вокруг Солнца, движение автомобилей, полёт парашютиста).
Электрические явления – это явления, которые возникают при появлении, существовании, движении и взаимодействии электрических зарядов (электрический ток, телеграфирование, молния при грозе).
Магнитные явления – это явления, связанные с возникновением у физических тел магнитных свойств (притяжение магнитом железных предметов, поворот стрелки компаса на север).
Оптические явления – это явления, которые происходят при распространении, преломлении и отражении света (радуга, миражи, отражение света от зеркала, появление тени).
Тепловые явления – это явления, которые происходят при нагревании и охлаждении физических тел (таяние снега, кипение воды, туман, замерзание воды).
Атомные явления – это явления, которые возникают при изменении внутреннего строения вещества физических тел (свечение Солнца и звезд, атомный взрыв).
0 Oleg74
25.06.2018 оставил(а) комментарий:
Природные явления — это изменения в природе. Сложные природные явления рассматривают как совокупность физических явлений — таких, которые можно описать с помощью соответствующих физических законов. Физические явления бывают тепловые, световые, механические, звуковые, электромагнитные и др.
Механические физические явления
Полет ракеты, падение камня, вращение Земли вокруг Солнца.
Световые физические явления
Вспышка молнии, свечение электрической лампочки, свет от костра, солнечные и лунные затмения, радуга.
Тепловые физические явления
Замерзание воды, таяние снега, нагрев пищи, сгорания топлива в цилиндре двигателя, лесной пожар.
Звуковые физические явления
Колокол, пение, раскаты грома.
Электромагнитные физические явления
Разряд молнии, электризация волос, притяжение магнитов.
Например, грозы можно рассматривать как совокупность молнии (электромагнитное явление), раскатов грома (звуковое явление), движения облаков и падения капель дождя (механические явления), пожара, что может возникнуть в результате попадания молнии в дерево (тепловое явление).
Изучая физические явления, ученые, в частности, устанавливают их взаимосвязь (разряд молнии — это электромагнитное явление, которое обязательно сопровождается в канале молнии значительным повышением температуры — тепловое явление). Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь для практического применения электрического разряда — электросварки металлических деталей.
Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь для практического применения электрического разряда — электросварки металлических деталей.
Об окружающем мире. Кроме обычного любопытства, это было вызвано практическими нуждами. Ведь, например, если знаешь, как поднять
и переместить тяжелые камни, то сможешь возвести прочные стены и построить дом, жить в котором удобнее, чем в пещере или землянке. А если научишься выплавлять металлы из руд и изготавливать плуги, косы, топоры, оружие и т. п., сможешь лучше вспахать поле и получить более высокий урожай, а в случае опасности суме ешь защитить свою землю.
В древности существовала только одна наука — она объединяла все знания о природе, которые накопило к тому времени человечество. В наши дни эта наука называется естествознанием.
Узнаём о физической науке
Еще одним примером электромагнитного поля является свет. С некоторыми свойствами света вы познакомитесь при изучении раздела 3.
3. Вспоминаем о физических явлениях
Материя вокруг нас постоянно изменяется. Некоторые тела перемещаются относительно друг друга, часть из них сталкиваются и, возможно, разрушаются, из одних тел образуются другие… Перечень таких изменений можно продолжать и продолжать — недаром еще в глубокой древности философ Гераклит заметил: «Все течет, все меняется». Изменения в окружающем нас мире, то есть в природе, ученые называют специальным термином — явления.
Рис. 1.5 . Примеры природных явлений
Рис. 1.6. Сложное природное явление — грозу можно представить как совокупность целого ряда физических явлений
Восход и закат Солнца, сход снежной лавины, извержение вулкана, бег лошади, прыжок пантеры — все это примеры природных явлений (рис. 1.5).
Чтобы лучше понять сложные природные явления , ученые разделяют их на совокупность физических явлений — явлений, которые можно описать с помощью физических законов.
На рис. 1.6 показана совокупность физических явлений, образующих сложное природное явление — грозу. Так, молния — огромный электрический разряд — представляет собой электромагнитное явление. Если молния попадет в дерево, то оно вспыхнет и начнет выделять тепло — физики в таком случае говорят о тепловом явлении. Грохот грома и потрескивание пылающего дерева — звуковые явления.
Примеры некоторых физических явлений приведены в таблице. Взгляните, например, на первую строку таблицы. Что может быть общего между полетом ракеты, падением камня и вращением целой планеты? Ответ прост. Все приведенные в этой строке примеры явлений описываются одними и теми же законами — законами механического движения. С помощью этих законов можно вычислить координаты любого движущегося тела (будь то камень, ракета или планета) в любой интересующий нас момент времени.
Рис. 1.7 Примеры электромагнитных явлений
Каждый из вас, снимая свитер или расчесывая волосы пластмассовым гребнем, наверняка обращал внимание на появляющиеся при этом крохотные искры. И эти искры, и могучий разряд молнии относятся к одним и тем же электромагнитным явлениям и, соответственно, подчиняются одним и тем же законам. Поэтому для изучения электромагнитных явлений не стоит дожидаться грозы. Достаточно изучить, как ведут себя безопасные искорки, чтобы понять, чего следует ждать от молнии и как избежать возможной опасности. Впервые такие исследования провел американский ученый Б. Франклин (1706-1790), который изобрел эффективное средство защиты от грозового разряда — молниеотвод.
И эти искры, и могучий разряд молнии относятся к одним и тем же электромагнитным явлениям и, соответственно, подчиняются одним и тем же законам. Поэтому для изучения электромагнитных явлений не стоит дожидаться грозы. Достаточно изучить, как ведут себя безопасные искорки, чтобы понять, чего следует ждать от молнии и как избежать возможной опасности. Впервые такие исследования провел американский ученый Б. Франклин (1706-1790), который изобрел эффективное средство защиты от грозового разряда — молниеотвод.
Изучив физические явления по отдельности, ученые устанавливают их взаимосвязь. Так, разряд молнии (электромагнитное явление) обязательно сопровождается значительным повышением температуры в канале молнии (тепловое явление). Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь практического применения электромагнитных и тепловых явлений. Наверняка каждый из вас, проходя мимо строительной площадки, видел рабочих в защитных масках и ослепительные вспышки электросварки. Электросварка (способ соединения металлических деталей с помощью электрического разряда) — это и есть пример практического использования научных исследований.
Электросварка (способ соединения металлических деталей с помощью электрического разряда) — это и есть пример практического использования научных исследований.
4. Определяем, что же изучает физика
Теперь, когда вы узнали, что собой представляют материя и физические явления, пришла пора определить, что же является предметом изучения физики. Эта наука изучает: структуру и свойства материи; физические явления и их взаимосвязь.
- подводим итоги
Окружающий нас мир состоит из материи. Существует два вида материи: вещество, из которого состоят все физические тела, и поле.
В мире, который нас окружает, постоянно происходят изменения. Эти изменения называются явлениями. Тепловые, световые, механические, звуковые, электромагнитные явления — все это примеры физических явлений.
Предмет изучения физики — структура и свойства материи, физические явления и их взаимосвязь.
- Контрольные вопросы
Что изучает физика? Приведите примеры физических явлений. Можно ли считать физическими явлениями события, которые происходят во сне или в воображении? 4. Из каких веществ состоят следующие тела: учебник, карандаш, футбольный мяч, стакан, автомобиль? Какие физические тела могут состоять из стекла, металла, дерева, пластмассы?
Можно ли считать физическими явлениями события, которые происходят во сне или в воображении? 4. Из каких веществ состоят следующие тела: учебник, карандаш, футбольный мяч, стакан, автомобиль? Какие физические тела могут состоять из стекла, металла, дерева, пластмассы?
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты ДополненияФизические и химические явления » Народна Освіта
Физические явления
В окружающем нас мире постоянно происходят изменения. Смена времен года, движение воды в реке, рост растений, кипение воды в чайнике — все это примеры процессов, происходящих вокруг нас. Эти процессы называют явлениями. В зависимости от того, в какой сфере жизни происходят явления, их можно разделить на политические, социальные, геологические, биологические, а также на физические и химические.
Смена времен года, движение воды в реке, рост растений, кипение воды в чайнике — все это примеры процессов, происходящих вокруг нас. Эти процессы называют явлениями. В зависимости от того, в какой сфере жизни происходят явления, их можно разделить на политические, социальные, геологические, биологические, а также на физические и химические.
Сравним действия двух ремесленников: кузнеца и металлурга. Кузнец берет железный брусок, нагревает его, бьет по нему молотом и в результате получает изделие, например подкову или шлем. Изменяется ли в данном случае железо — вещество, из которого состоит брусок? Нет. Под ударами молота частицы (атомы) в железе движутся, смещаются, но сами не меняются (рис. 71). Такое явление относится к физическим.
Явления, при которых изменяется форма предмета или агрегатное состояние вещества, но не меняется его состав, называют физическими.
В результате протекания физических явлений частицы в веществе не изменяются, следовательно, не изменяются и свойства веществ.
Кипение воды, появление капель воды или льда в холодильнике, замерзание рек, отливание изделий из расплавленного металла, измельчение веществ — все это примеры физических явлений.
А что же делает металлург? Он берет железную руду и превращает ее в блестящие бруски железа. Изменилось ли при этом вещество? Железная руда — это бурый порошок или камни, которые не проводят электрический ток и легко рассыпаются от удара молотком. А железо имеет металлический блеск, хорошо проводит электрический ток, при ударе не рассыпается, а расплющивается. Таким образом, железная руда и брусок железа состоят из разных веществ, которые имеют разные свойства (рис. 72). В отличие от кузнеца, металлург превратил частицы железной руды в частицы железа. Такой процесс является химическим.
Явления, при которых одни вещества превращаются в другие, называют химическими.
Горение древесины, появление ржавчины на поверхности железных изделий (рис. 73), скисание молока, пригорание пищи на сковороде — все это примеры химических явлений.
В процессе химических явлений частицы одного вещества (атомы, молекулы или ионы) превращаются в частицы другого, т. е. из одного вещества образуется другое вещество с другими свойствами.
Часто вместо слов «химическое явление» говорят химический процесс или химическая реакция. О веществах, которые вступают в химическую реакцию, говорят, что они реагируют, или взаимодействуют, между собой. Эти вещества называют реагентами или исходными веществами, а новые вещества, образующиеся в результате реакции,— продуктами реакции.
В химических явлениях проявляются химические свойства веществ — их способность изменяться под влиянием различных условий и реагировать с другими веществами. Описать химические свойства вещества — означает указать, как оно может изменяться, с какими другими веществами и при каких условиях может реагировать. Изучение химических свойств веществ — одна из задач химии.
Признаки химических реакций
Очень часто химические и физические явления происходят одновременно. Например, при горении свечи парафин сначала плавится и испаряется (физические явления), а потом пары парафина начинают гореть (химическое явление). Если нагревать кусочек сахара, то он расплавится (физическое явление), а в случае продолжительного нагревания превратится в углевидную черную массу (химическое явление).
Например, при горении свечи парафин сначала плавится и испаряется (физические явления), а потом пары парафина начинают гореть (химическое явление). Если нагревать кусочек сахара, то он расплавится (физическое явление), а в случае продолжительного нагревания превратится в углевидную черную массу (химическое явление).
Как же отличить химические явления от физических? Конечно, можно сказать, что если молекулы вещества изменились, то явление относится к химическим, а если не изменились, то к физическим. Но молекулы сложно увидеть даже в самый сильный микроскоп.
Поскольку в процессе химической реакции образуются новые вещества с новыми свойствами, то о протекании реакции свидетельствует изменение физических свойств реагирующих веществ. Так, если поставить молоко в теплое место, то спустя некоторое время оно превратится в кислое молоко. При скисании молока из молочного сахара образуется молочная кислота, о ходе этой реакции можно судить по изменению вкуса.
Если жир на сковороде начинает подгорать, то о ходе этой реакции мы узнаем по появлению запаха акролеина — продукта разложения жира.
При кипении водопроводной воды из растворенных в ней веществ образуется вещество, которое не растворяется в воде и оседает в виде накипи на стенках чайника — выпадает в осадок (рис. 74).
Выделение газа также свидетельствует о химическом превращении: гашение пищевой соды столовым уксусом или лимонной кислотой сопровождается характерным шипением из-за образования углекислого газа (рис. 75).
Если в стакан со столовым уксусом насыпать соду, то газ начинает выделяться так активно, что кажется, будто жидкость закипает.
Как в этом случае отличить кипение от химической реакции? Для этого нужно вспомнить, как происходит кипение: жидкость закипает, когда нагревается до определенной температуры — температуры кипения (для воды при нормальном давлении это 100 °С).
При кипении воды пузырьки газа (пара) образуются во всем объеме жидкости. В случае взаимодействия уксуса с содой жидкость не нагревается, а газ выделяется только в том месте, где сода контактирует с раствором, а значит кипением этот процесс назвать нельзя.
Часто о химических превращениях свидетельствует изменение окраски (рис. 76а). Например, цвет листьев на деревьях осенью меняется с зеленого на желтый или красный.
Множество химических реакций, например реакции горения, сопровождаются выделением энергии (рис. 766), обычно в виде теплоты и света. Однако есть реакции, которые происходят с поглощением энергии. Например, реакция фотосинтеза в растениях происходит с поглощением энергии солнечного света.
Признаки химических реакций:
• изменение окраски;
• изменение запаха;
• изменение вкуса;
• выпадение или растворение осадка;
• выделение или поглощение газа;
• выделение или поглощение теплоты;
• излучение света.
Для протекания химических реакций необходимы определенные условия. В первую очередь вещества необходимо соединить и перемешать или хотя бы привести в соприкосновение.
Но не всегда химическая реакция начинается сразу после перемешивания веществ. Древесина очень хорошо горит, однако сама по себе она не загорается. Для того чтобы началась реакция горения, древесину необходимо поджечь — т. е. нагреть до определенной температуры. Дальше реакция протекает самостоятельно, пока не закончится один из реагентов. Для протекания многих химических реакций необходимо постоянное нагревание или охлаждение.
Древесина очень хорошо горит, однако сама по себе она не загорается. Для того чтобы началась реакция горения, древесину необходимо поджечь — т. е. нагреть до определенной температуры. Дальше реакция протекает самостоятельно, пока не закончится один из реагентов. Для протекания многих химических реакций необходимо постоянное нагревание или охлаждение.
Некоторые реакции происходят под действием света или электрического тока. Известны неустойчивые вещества, которые разлагаются от трения или удара.
Условия, необходимые для протекания различных реакций, очень разные. Большинство реакций не требует специальных условий, но некоторые происходят лишь при определенных условиях, которые описываются в химической литературе.
ЛАБОРАТОРНЫЙ ОПЫТ № 3
Проведение химических реакций
Оборудование: штатив с пробирками, пробиркодержатель, нагревательный прибор.
Реактивы: растворы щелочи, фенолфталеина, нитратной кислоты, медного купороса, мел, кристаллический аммоний хлорид, сахар.
| Правила безопасности:
• для опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза;
• помните, холодные и горячие предметы выглядят одинаково;
• нагревание проводите с использованием специальных держателей;
• соблюдайте правило определения запаха веществ.
1. Налейте в пробирку около 1 мл щелочи и добавьте несколько капель фенолфталеина. Какие изменения наблюдаете?
2. Насыпьте в пробирку шпателем небольшое количество мела и по каплям добавляйте раствор кислоты. Что происходит с осадком?
3. Налейте в пробирку 1-2 мл раствора медного купороса и добавьте такое же количество раствора щелочи. Какие изменения наблюдаете?
4. Насыпьте в пробирку небольшое количество аммоний хлорида и добавьте 1-2 мл раствора щелочи. Определите запах вещества.
5. В пробирку насыпьте небольшое количество сахара и нагревайте. Какие изменения вы наблюдаете в начале нагревания? А после продолжительного нагревания?
6. Опишите свои наблюдения. По результатам выполненных опытов сделайте выводы о признаках химических реакций. При каких условиях происходят реакции, которые вы провели?
Опишите свои наблюдения. По результатам выполненных опытов сделайте выводы о признаках химических реакций. При каких условиях происходят реакции, которые вы провели?
Выводы:
1. При физических явлениях изменяются форма или агрегатное состояние веществ, но их состав, а следовательно и физические свойства, не меняются. При химических явлениях (химических реакциях) вещества изменяются, т. е. одни вещества превращаются в другие. Это происходит из-за изменения состава веществ.
2. О протекании химических реакций можно судить по определенным признакам: изменение окраски, запаха, вкуса, образование или исчезновение осадка, выделение или поглощение теплоты, газа или света.
Контрольные вопросы
1. Дайте определения химических и физических явлений. Чем они отличаются?
2. Перечислите признаки химических реакций.
3. При каких условиях происходят химические реакции?
Задания для усвоения материала
1. Выберите из представленного перечня условия протекания реакций: а) смешивание веществ; б) выделение газа; в) предварительное нагревание веществ; г) выделение теплоты и света; д) предварительное растворение реагирующих веществ; е) действие электрического тока; ж) образование осадка.
2. Что происходит с атомами и молекулами в химических реакциях? Выберите правильные утверждения: а) молекулы реагентов разрушаются, а из них образуются новые молекулы; б) одни атомы разрушаются, из них образуются другие; в) молекулы в химических реакциях не изменяются; г) атомы в химических реакциях не изменяются; д) атомы перегруппировываются, образуя молекулы новых веществ.
3. Приведите примеры физических явлений, при которых изменяется агрегатное состояние веществ.
4. Приведите три примера химических реакций, которые вы наблюдали в природе или в быту.
5. Выберите, какие из приведенных явлений относятся к химическим, а какие — к физическим: а) зимой ветви деревьев покрываются изморозью; б) опавшая листва сгнивает; в) разлитый ацетон быстро испаряется; г) запах разлитых духов быстро распространяется по всей комнате; д) со временем на стенках чайника образуется накипь; е) в теплом месте молоко быстро скисает; ж) бронзовые памятники покрываются зеленым налетом; з) капля грязи на ботинке к утру превращается в коричневое пятно; и) ржавый гвоздь очищается от ржавчины наждачной бумагой.
6. Приведите примеры химических явлений, которые сопровождаются изменением агрегатного состояния веществ.
7. Какие признаки химических реакций наблюдаются при: а) горении костра; б) ржавлении железа; в) скисании пищи?
8. Приведите примеры химических реакций из повседневной жизни, которые происходят: а) при постоянном нагревании; б) после однократного нагревания; в) под действием света; г) с изменением окраски.
9*. Проект № 2 «Химические явления в окружающей среде».
10*. Проект № 3 «Химические явления в быту».
11*. Проект № 4 «Использование химических явлений в художественном творчестве и народных ремеслах».
12*. Проект № 5 «Вещества и химические явления в литературных произведениях и народном творчестве».
ПРАКТИЧЕСКАЯ РАБОТА № 3
Изучение физических и химических явлений
Оборудование: штатив, тигельные щипцы, пробиркодержатель, спиртовка, стаканы.
Реактивы: медная проволока или пластинка, парафин, свеча, вода, хлоридная кислота, сода.
Правила безопасности:
• для опытов используйте небольшие количества реактивов;
• остерегайтесь попадания реактивов на одежду, кожу, в глаза;
• помните, холодные и горячие предметы выглядят одинаково;
• нагревание проводите с использованием специальных держателей.
1. Плавление парафина
Возьмите кусочек парафина и положите его на металлическую пластинку или в пробирку. Закрепите ее в штативе и осторожно нагревайте в пламени спиртовки. Что происходит? Образовалось ли новое вещество? Запишите свои наблюдения и определите, к каким явлениям относится плавление.
2. Горение свечи
Зажгите свечу и некоторое время наблюдайте процесс горения. Какие явления происходят? Происходит ли превращение вещества? Какие признаки свидетельствуют о физическом явлении, а какие — о химическом? Запишите свои наблюдения.
3. Взаимодействие соды с хлоридной кислотой
Возьмите два стакана: в первый налейте воду, а во второй — хлоридную кислоту. Добавьте в каждый стакан немного питьевой соды. Что происходит в каждом стакане? Запишите свои наблюдения и определите, какое явление произошло в пробирке с кислотой.
Добавьте в каждый стакан немного питьевой соды. Что происходит в каждом стакане? Запишите свои наблюдения и определите, какое явление произошло в пробирке с кислотой.
4. Прокаливание меди
С помощью тигельных щипцов внесите в пламя спиртовки медную проволоку или пластинку и подержите около 1 минуты. Отметьте изменение цвета поверхности проволоки. О чем это свидетельствует? Запишите свои наблюдения и определите, какое явление вы наблюдали.
5. Формулирование выводов
По результатам практической работы сделайте выводы.
При формулировании выводов к практической работе ответьте на следующие вопросы:
1. Какие свойства веществ вы определили в ходе этой работы? К каким свойствам — физическим или химическим — они относятся?
2. Перечислите отдельно физические и химические явления, которые вы наблюдали в этой работе.
3. По каким признаками вы относили явления к химическим или к физическим?
Реакцию взаимодействия соды с уксусной или лимонной кислотой используют при выпекании печенья — благодаря выделению углекислого газа тесто поднимается, становится пышным. Эта же реакция лежит в основе действия кислотных огнетушителей. Углекислый газ выделяется также во время процесса брожения: дрожжи (микроорганизмы), которые добавляют в тесто, питаются растворенным сахаром и выделяют углекислый газ. Поэтому при выпекании хлеба или булочек тесто получается очень пышным и без соды.
Эта же реакция лежит в основе действия кислотных огнетушителей. Углекислый газ выделяется также во время процесса брожения: дрожжи (микроорганизмы), которые добавляют в тесто, питаются растворенным сахаром и выделяют углекислый газ. Поэтому при выпекании хлеба или булочек тесто получается очень пышным и без соды.
Взаимодействие пищевой соды с соком квашеной капусты, лимонной кислотой, кефиром
Вам понадобятся: пипетка, пищевая сода, сок квашеной капусты, лимонная кислота, кефир.
| Правила безопасности
• для опытов используйте небольшие количества веществ;
• остерегайтесь попадания веществ на одежду, кожу, в глаза.
В отдельные емкости поместите понемногу сока квашеной капусты, лимонной кислоты и кефира. К лимонной кислоте добавьте немного воды, чтобы ее растворить.
В каждую емкость добавьте небольшое количество соды (на кончике ложки). Что происходит? Опишите свои наблюдения.
Проверьте свои знания по теме «Начальные химические понятия».
Химические реакции в повседневной жизни — Химические реакции и ответы на часто задаваемые вопросы
Обычные химические реакции в повседневной жизни
В нашей повседневной жизни наблюдается множество различных химических реакций, которые мы замечаем. Мы часто видим хлопьевидный слой коричневого цвета, который появляется на поверхности нескольких металлических предметов, например, кузовов транспортных средств, ворот и т. Д. Во время праздников и празднований Дивали мы сжигаем крекеры, которые при горении дают яркий свет. свет и звук.Яркий свет является результатом горения таких компонентов, как магний, который используется в составе одного из ингредиентов крекеров и бенгальских огней, которые мы сжигаем. В этой статье мы изучим эти химические процессы в повседневной жизни, которые мы видим вокруг себя.
Типы химических реакций в повседневной жизни
1. Фотосинтез:
Процесс фотосинтеза — это процесс, с помощью которого автотрофы стремятся производить пищу. Это одна из естественных химических реакций в повседневной жизни.В присутствии хлорофилла и солнечного света растения производят глюкозу в виде энергии из воды и углекислого газа из окружающей среды.
Это одна из естественных химических реакций в повседневной жизни.В присутствии хлорофилла и солнечного света растения производят глюкозу в виде энергии из воды и углекислого газа из окружающей среды.
6CO₂ + 6H₂O → C₆H₁₂O₆ (вод.) + 6O₂ (г)
[Изображение будет скоро загружено]
2. Ржавчина:
Процесс окисления, который относится к реакции в присутствии кислорода, дает коричневый шелушащийся слой, который мы часто замечаем на металлических поверхностях, таких как железо. Этот слой образуется из-за окисления самого верхнего слоя для образования оксида металла.Мы знаем это и называем это ржавчиной. Точно так же несколько слоев образуются и на других металлах, например, в серебре, в котором слой зеленого цвета образуется, когда он подвергается реакции окисления.
Fe + 3O₂ + xH₂O → Fe₃O₄. xH₂O
[Изображение будет загружено в ближайшее время]
3. Клеточное дыхание:
Процесс дыхания человека в легких также включает химическую реакцию. В этой реакции молекулы глюкозы, как правило, подвергаются реакции окисления и производят воду и углекислый газ вместе с энергией.Этот процесс происходит на клеточном уровне и, следовательно, называется клеточным дыханием.
В этой реакции молекулы глюкозы, как правило, подвергаются реакции окисления и производят воду и углекислый газ вместе с энергией.Этот процесс происходит на клеточном уровне и, следовательно, называется клеточным дыханием.
C₆H₁₂O₆ (вод.) + 60 (г) → 6CO₂ (г) + 6H₂O (л) + энергия
4. Анаэробное дыхание:
Когда живой организм склонен подвергаться процессу ферментации, присутствующие в нем компоненты содержат крахмал или сахар, превращаются в спирт, кислоты и газы.
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
5. Горение:
Процесс горения относится к числу химических изменений в повседневной жизни.Он имеет тенденцию включать реакцию окисления материала, когда он подвергается воздействию тепла и кислорода из окружающей среды с образованием дыма, золы и некоторых других газов.
C + O₂ → CO₂
[Изображение будет загружено в ближайшее время]
6. Кислотно-основные реакции:
Кислотно-основные реакции также являются частью химических реакций в нашей повседневной жизни. В этих реакциях более слабые кислоты, которые вырабатываются во рту за ночь из-за сладких продуктов и бактерий, нейтрализуются в присутствии основания, которое присутствует в зубной пасте, которую мы используем по утрам каждый день.
В этих реакциях более слабые кислоты, которые вырабатываются во рту за ночь из-за сладких продуктов и бактерий, нейтрализуются в присутствии основания, которое присутствует в зубной пасте, которую мы используем по утрам каждый день.
Кислота + основание → соль + вода
Аналогичным образом оксидный слой на металлических артефактах удаляется с помощью более слабых кислот, таких как уксус. Этот процесс помогает нам очистить слой металла и обнажить новый новый слой металла.
CH₃COOH + FeO → CH₃COOFe + H₂O
10 примеров химии в повседневной жизни — StudiousGuy
Если я спрошу вас, что приходит вам в голову в тот момент, когда вы слышите слово ХИМИЯ, я почти уверен, что вы представите себя стоящим в химической лаборатории и держащим в руках различные лабораторные инструменты.Это не? Но если вы внимательно посмотрите на окружающий мир, в любую секунду происходят бесконечные химические реакции. Таким образом, можно справедливо сказать, что химия составляет большую часть вашей повседневной жизни. Химия и химические реакции не ограничиваются только лабораториями, но и миром вокруг вас. Элемент углерод образует основную единицу органических, неорганических и металлоорганических соединений. Прямо в тот момент, когда вы ложитесь спать, пока не проснетесь, в каждой клетке вашего тела происходят бесконечные химические процессы.Даже процессы происходят, когда вы просыпаетесь, все ваши повседневные действия, такие как питьевая вода, душ, приготовление пищи, мыть машину, смеяться или плакать, регулируются различными химическими процессами. Давайте обсудим несколько примеров химии, которые происходят вокруг нас:
Химия и химические реакции не ограничиваются только лабораториями, но и миром вокруг вас. Элемент углерод образует основную единицу органических, неорганических и металлоорганических соединений. Прямо в тот момент, когда вы ложитесь спать, пока не проснетесь, в каждой клетке вашего тела происходят бесконечные химические процессы.Даже процессы происходят, когда вы просыпаетесь, все ваши повседневные действия, такие как питьевая вода, душ, приготовление пищи, мыть машину, смеяться или плакать, регулируются различными химическими процессами. Давайте обсудим несколько примеров химии, которые происходят вокруг нас:
Ваше тело — завораживающее место. Углерод и кислород — два самых важных элемента тела. Другие элементы, которые присутствуют в вашем теле, — это азот, фосфор, водород, кислород, кальций, калий, сера, магний и т. Д.
2. Химия эмоций Когда вы чувствуете себя счастливым, грустным, экстатическим, расслабленным или напряженным, в вашем теле происходит множество химических реакций. Именно из-за химических посредников, называемых нейротрансмиттерами, высвобождаемых в мозгу, вы можете влюбиться и плакать реками из-за горя.
Именно из-за химических посредников, называемых нейротрансмиттерами, высвобождаемых в мозгу, вы можете влюбиться и плакать реками из-за горя.
Растения производят пищу для себя посредством фотосинтеза; что само по себе является сложной химической реакцией.Химическая реакция, происходящая при фотосинтезе, является наиболее распространенной и жизненно важной химической реакцией. Животные также выделяют энергию для выполнения повседневной деятельности через аналогичные респираторные химические реакции.
6 CO 2 + 6 H 2 O + свет → C 6 H 12 O 6 + 6 O 2
Если вы когда-нибудь читали ингредиенты на бутылке с кетчупом, джемом или солеными огурцами, вы можете быть удивлены, увидев нескончаемый список химикатов.Кто они такие? Эти химические вещества называются пищевыми консервантами; которые задерживают рост микроорганизмов в пищевых продуктах. Химические пищевые консерванты не только препятствуют росту бактерий, вирусов и грибков, но также препятствуют окислению жиров, которое делает продукты прогорклыми. Наиболее распространенными химическими пищевыми консервантами являются бензоат натрия, сорбиновая кислота, сорбат калия, сорбат кальция, сорбат натрия, пропионовая кислота и соли азотистой кислоты.
Химические пищевые консерванты не только препятствуют росту бактерий, вирусов и грибков, но также препятствуют окислению жиров, которое делает продукты прогорклыми. Наиболее распространенными химическими пищевыми консервантами являются бензоат натрия, сорбиновая кислота, сорбат калия, сорбат кальция, сорбат натрия, пропионовая кислота и соли азотистой кислоты.
В тот момент, когда вы кладете пищу в рот, в вашем пищеварительном тракте начинается ряд различных химических реакций. Слюна содержит фермент амилазу, который отвечает за расщепление углеводов, желудок начинает вырабатывать соляную кислоту, печень выделяет желчь, и список соединений, выделяемых во время пищеварения, продолжается. Как они работают? Все эти ферменты подвергаются химическим реакциям, поэтому происходит правильное пищеварение, а также усвоение пищи.
9. Действие солнцезащитного крема Перед тем, как выйти в солнечный день, обязательно нанесите солнцезащитный крем. Даже принцип действия солнцезащитного крема имеет химическую основу. В солнцезащитном креме используется комбинация органических и неорганических соединений, которые действуют как фильтр для входящих ультрафиолетовых лучей. С другой стороны, солнцезащитные кремы рассеивают ультрафиолетовый свет; так что он не может глубоко проникнуть в кожу. Кремы для загара содержат сложные химические соединения, такие как оксид цинка или оксид титана, которые предотвращают проникновение УФ-лучей глубже в кожу. 10. Химия в образовании ржавчины
Действие солнцезащитного крема Перед тем, как выйти в солнечный день, обязательно нанесите солнцезащитный крем. Даже принцип действия солнцезащитного крема имеет химическую основу. В солнцезащитном креме используется комбинация органических и неорганических соединений, которые действуют как фильтр для входящих ультрафиолетовых лучей. С другой стороны, солнцезащитные кремы рассеивают ультрафиолетовый свет; так что он не может глубоко проникнуть в кожу. Кремы для загара содержат сложные химические соединения, такие как оксид цинка или оксид титана, которые предотвращают проникновение УФ-лучей глубже в кожу. 10. Химия в образовании ржавчины Со временем на ваших железных инструментах начинает образовываться оранжево-коричневая чешуйчатая пленка, называемая ржавчиной. Ржавчина железа — это разновидность реакции окисления. Атомы металлического железа подвергаются окислению и восстановлению; вызывая ржавчину. Ярко-красный цвет меди и потускнение серебра также являются другими повседневными примерами химических реакций. Химическое уравнение, лежащее в основе ржавчины:
Ярко-красный цвет меди и потускнение серебра также являются другими повседневными примерами химических реакций. Химическое уравнение, лежащее в основе ржавчины:
Fe + O 2 + H 2 O → Fe 2 O 3 .XH 2 O
химических реакций в повседневной жизни | Обзор, примеры и функции — видео и стенограмма урока
Химические реакции в повседневной жизни
Человек не смог бы прожить день без сотен химических реакций. Некоторые из них очень заметны и заметны, в то время как другие трудно распознать и даже могут остаться незамеченными.Некоторые из наиболее узнаваемых примеров химических реакций в повседневной жизни, которые подробно описаны ниже, — это горение, пищеварение, окисление, электролиз и фотосинтез. Какие примеры химических реакций в повседневной жизни?
Сжигание Сжигание топлива требует химической реакции, чтобы использовать доступную энергию. Транспортные средства, работающие на бензине, — легко узнаваемый пример реакции сгорания. Источник топлива, такой как углеводород, будет гореть в присутствии газообразного кислорода с образованием диоксида углерода и водяного пара.Некоторые известные углеводороды, которые сжигаются для получения энергии, — это метан, пропан, бутан и октан.
Транспортные средства, работающие на бензине, — легко узнаваемый пример реакции сгорания. Источник топлива, такой как углеводород, будет гореть в присутствии газообразного кислорода с образованием диоксида углерода и водяного пара.Некоторые известные углеводороды, которые сжигаются для получения энергии, — это метан, пропан, бутан и октан.
{eq} CH_ {4} \; \; + \; \; O_ {2} \: \: \ rightarrow \: CO_ {2} \: \: + \: H_ {2} O {/ eq}
ПищеварениеПереваривание пищи в желудке человека требует химического реакция, чтобы преобразовать энергию, захваченную в пище, в энергию, которая может быть использована человеческим телом. Желудочная кислота — это довольно концентрированная соляная кислота, поэтому она способна расщеплять практически все, что попадает в желудок.Реакции в желудке расщепляют пищу, поэтому питательные вещества могут транспортироваться по телу, но это также позволяет выводить продукты жизнедеятельности.
Окисление Процесс потускнения металла в результате химической реакции известен как окисление. Реакция синтеза соединения металла с кислородом и водой в атмосфере — довольно известная химическая реакция. К сожалению для многих, самая известная часть реакции — это ее постоянный характер.Окисление — это формальный способ сказать, что металл — это ржавчина . Ржавчина — это постоянный процесс на металле, который невозможно отменить.
Реакция синтеза соединения металла с кислородом и водой в атмосфере — довольно известная химическая реакция. К сожалению для многих, самая известная часть реакции — это ее постоянный характер.Окисление — это формальный способ сказать, что металл — это ржавчина . Ржавчина — это постоянный процесс на металле, который невозможно отменить.
{eq} Fe \; \; + \; \; O_ {2} \: \: \ rightarrow \: FeO {/ eq}
ЭлектролизЛюди чаще всего пожинают плоды реакций электролиза в виде батарей. Посредством электролиза электрический ток заставляет реакцию, которая в противном случае не является спонтанной, происходить намного быстрее, чем сама по себе. Это заставляет как окисление, так и восстановление элементов происходить довольно быстрыми темпами.
Одной из наиболее важных химических реакций, ответственных за поддержание жизни на Земле, является фотосинтез. Химический процесс, при котором растения превращают солнечный свет в энергию, представляет собой фотосинтетическую химическую реакцию. У растений есть способность использовать комбинацию энергии солнца с углекислым газом и водой в атмосфере, чтобы производить газообразный кислород и глюкозу в качестве продуктов.Затем глюкоза используется в качестве энергии для растений. Эта реакция будет выглядеть так:
Химический процесс, при котором растения превращают солнечный свет в энергию, представляет собой фотосинтетическую химическую реакцию. У растений есть способность использовать комбинацию энергии солнца с углекислым газом и водой в атмосфере, чтобы производить газообразный кислород и глюкозу в качестве продуктов.Затем глюкоза используется в качестве энергии для растений. Эта реакция будет выглядеть так:
{eq} CO_ {2} \; \; + \; H_ {2} O \; \: \: \ rightarrow \: C_ {6} H_ {12} O_ {6} \: \: + \: O_ {2} {/ eq}
Краткое содержание урока
Химические реакции происходят по всему миру практически в любой мыслимой ситуации. Некоторые реакции ясны и очевидны, что они происходят, в то время как другие более скрытны и трудны для обнаружения. Независимо от того, является ли реакция явной или нет, все они могут быть обнаружены с помощью одних и тех же нескольких сигналов, которые показывают, что химическая реакция, вероятно, имеет место.Эти сигналы включают:
- образование пузырьков газа
- запах, исходящий от продуктов
- температура повышается или понижается
- образование осадка из двух жидких реагентов
- происходит изменение цвета
Эти сигналы часто могут указывать на возникновение реакции, но не гарантируют ее. Истинным фактором, определяющим, произошла ли химическая реакция, является исследование продуктов по отношению к реагентам.Чтобы произошла химическая реакция, необходимо создать новый продукт с точки зрения химического состава.
Истинным фактором, определяющим, произошла ли химическая реакция, является исследование продуктов по отношению к реагентам.Чтобы произошла химическая реакция, необходимо создать новый продукт с точки зрения химического состава.
Несколько известных примеров химических реакций , происходящих в повседневной жизни, которые являются наиболее узнаваемыми:
Горение (огонь с использованием кислорода для превращения топлива в полезную энергию)
Пищеварение (желудочная кислота реагирует с пищей на преобразовать питательные вещества в полезную энергию)
Окисление (металл, вступающий в реакцию с воздухом и водой с образованием оксида металла)
Электролиз (процесс использования принудительного электрического тока через раствор для катализа реакции окисления / уменьшить)
Фотосинтез (растение, преобразующее солнечный свет и углекислый газ в кислород и глюкозу для получения энергии)
Хотя эти примеры представляют собой некоторые из наиболее заметных реакций, которые происходят в обычный день, важно понимать, что сотни химических реакций происходят в очень маленьком масштабе, что помогает поддерживать нормальное функционирование человеческого тела. Сердцебиение, работа мозга и даже загар кожи — все это продукт химической реакции, происходящей внутри человеческого тела.
Сердцебиение, работа мозга и даже загар кожи — все это продукт химической реакции, происходящей внутри человеческого тела.
химических реакций в повседневной жизни — видео и стенограмма урока
Повседневные химические реакции
Давайте взглянем на некоторые повседневные химические реакции. Одна из наиболее очевидных химических реакций — сжигание топлива. Каждый день, когда вы едете на работу или в школу, вы сжигаете газ. Когда вы сидите у костра, вы сжигаете дрова.А когда вы готовите на газовой плите, вы сжигаете природный газ. Все это примеры типа химической реакции, называемой сгорание , которая происходит, когда кислород и другие вещества объединяются, выделяя тепло и часто свет.
Не все химические реакции происходят так быстро и бурно, как горение. Некоторым требуется много времени, чтобы проявиться. Примером этого является ржавчина , которая происходит, когда железо приобретает красный или коричневый цвет из-за воздействия воздуха и воды. Ржавчина возникает в результате реакции окисления , когда железо и кислород соединяются с образованием оксида железа, который имеет красный или коричневый цвет.
Ржавчина возникает в результате реакции окисления , когда железо и кислород соединяются с образованием оксида железа, который имеет красный или коричневый цвет.
Кроме того, есть вещи, которые мы считаем само собой разумеющимися, и многие из нас даже не думают, что они связаны с химическими реакциями. Возьмем, к примеру, батарейки. Хотя батареи кажутся пассивными объектами, которые мы вставляем в наши устройства, и электричество волшебным образом возникает, правда в том, что электричество возникает из-за химической реакции, происходящей внутри батареи.Батареи содержат химическую энергию, которая превращается в электрическую в ходе химической реакции, называемой электролиз .
Это лишь некоторые из химических реакций, окружающих нас в повседневной жизни. Растения подвергаются фотосинтезу. Когда мы готовим или запекаем, происходят многочисленные химические реакции. Мыло и моющие средства вступают в реакцию с грязью, облегчая ее удаление. Химические реакции происходят, когда пациенты принимают лекарства. У этого списка нет конца. Узнав больше о том, как работают химические реакции, мы сможем лучше понять, как и почему происходят повседневные вещи.
У этого списка нет конца. Узнав больше о том, как работают химические реакции, мы сможем лучше понять, как и почему происходят повседневные вещи.
Резюме урока
Химическая реакция происходит, когда одно вещество или реагент превращается в другое. Атомы вещества перестраиваются, образуя новое вещество или продукт. Даже когда мы этого не знаем, химические реакции — постоянная черта нашей повседневной жизни.
Возгорание происходит всякий раз, когда мы сжигаем ископаемое топливо, ржавчина возникает, когда железо подвергается воздействию воздуха и воды, а батареи используют химические реакции для создания электричества.Мы используем химические реакции, чтобы готовить, убирать и ездить по местам, и наш организм использует их каждое мгновение каждого дня, чтобы сохранить нам жизнь. Химические реакции жизненно важны для жизни на Земле.
Результаты обучения
По окончании урока вы должны уметь:
- Объяснять, что такое химическая реакция
- Перечислите некоторые повседневные химические реакции
Химия в повседневной жизни — WorldOfChemicals
Вы когда-нибудь задумывались, почему химия так важна? Почему мы изучаем химию? Какова роль химии в жизни?
Мы все сделаны из химикатов, и все вокруг нас сделано из химикатов. Все, что мы слышим, видим, обоняем, ощущаем на вкус и прикасаемся, связано с химией и химическими веществами (материей). Слушание, видение, дегустация и прикосновение — все это связано с сложной серией химических реакций и взаимодействий в нашем теле. Многие изменения, которые мы наблюдаем в окружающем мире, вызваны химическими реакциями. Химия не ограничивается мензурками и лабораториями. Это повсюду вокруг нас, и чем лучше мы знаем химию, тем лучше мы знаем наш мир. Химия присутствует во всех аспектах жизни, и несколько примеров химии из повседневной жизни:
Все, что мы слышим, видим, обоняем, ощущаем на вкус и прикасаемся, связано с химией и химическими веществами (материей). Слушание, видение, дегустация и прикосновение — все это связано с сложной серией химических реакций и взаимодействий в нашем теле. Многие изменения, которые мы наблюдаем в окружающем мире, вызваны химическими реакциями. Химия не ограничивается мензурками и лабораториями. Это повсюду вокруг нас, и чем лучше мы знаем химию, тем лучше мы знаем наш мир. Химия присутствует во всех аспектах жизни, и несколько примеров химии из повседневной жизни:
1.Небо голубое
Объект окрашен из-за отраженного света. Белый свет солнца содержит все длины волн, но когда он падает на объект, некоторые из его длин волн поглощаются, а некоторые отражаются. Синий цвет неба можно объяснить, рассматривая явление, называемое рэлеевским рассеянием, которое состоит из рассеяния света частицами, которые намного меньше его длины волны. Этот эффект особенно силен, когда свет проходит через газы.
Этот эффект особенно силен, когда свет проходит через газы.
Лед менее плотный, чем жидкая вода. Более тяжелая вода вытесняет более легкий лед, поэтому лед плавает сверху.
Солнцезащитный крем сочетает в себе органические и неорганические химические вещества, чтобы отфильтровать солнечный свет, чтобы меньше его попадало в более глубокие слои кожи. Светоотражающие частицы в солнцезащитном креме обычно состоят из оксида цинка или оксида титана.
4.Блюда готовятся быстрее в скороварке У скороварки более сложная крышка, которая полностью закрывает кастрюлю. Когда мы нагреваем воду, она закипает, и пар не может выйти, поэтому остается внутри и начинает повышать давление. Под давлением температура приготовления повышается намного выше, чем в обычных условиях, поэтому пища готовится намного быстрее. Это означает роль химии в нашей повседневной жизни.
Это означает роль химии в нашей повседневной жизни.
Роль химии лежит в основе каждого шага в отношениях.Когда мы влюбляемся, наш мозг претерпевает некоторые изменения, а также выделяются определенные химические соединения. Любовью движут эти гормоны: окситоцин, вазопрессин, эндорфины.
6. Кофе не дает уснутьКофе не дает нам уснуть из-за присутствия в вашем мозгу химического вещества, называемого аденозином. Он связывается с определенными рецепторами и замедляет активность нервных клеток, когда сигнализирует о сне.
7.Овощ цветной Многие овощи и фрукты сильно окрашены, потому что они содержат особый вид химического соединения, называемого каротиноидами. Эти соединения имеют область, называемую хромофором, которая поглощает и испускает свет определенных длин волн, создавая цвет, который мы затем воспринимаем. Здесь можно раскрыть важность химии.
Здесь можно раскрыть важность химии.
Мыло состоит из молекул с «головой», которая любит воду (гидрофильная), и длинной цепочкой, которая ее ненавидит (гидрофобная).Затем, когда мыло добавляется в воду, длинные гидрофобные цепи его молекул соединяются с частицами масла, а гидрофильные головки уходят в воду. Затем образуется эмульсия масла в воде, это означает, что частицы масла становятся взвешенными в воде и отделяются от ткани. При полоскании удаляется эмульсия. Это проливает свет на повседневную химию.
9. Плачем пока режем лукЛук заставляет плакать из-за присутствия серы в клетках, которые ломаются после разрезания лука.Эта сера смешивается с влагой и раздражает глаза.
© Worldofchemicals Артикул
Химические реакции
Основные идеи «толкать и тянуть» исследуются в
.
Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Дети испытали множество примеров химических изменений, даже не осознавая этого. Они знакомы с процессами горения, приготовления пищи, ржавления и химическими процессами, которые предполагают растворение.Однако на этом уровне ученики не видят, что новые материалы производятся в результате химических изменений, скорее они видят, что существующие материалы просто каким-то образом были изменены. Например, они видят дым как часть дерева, который каким-то образом выделяется при горении дерева. Поскольку учащиеся редко понимают понятие «вещество», они не видят изменения веществ. Тем не менее, понимание химических изменений является фундаментальным для понимания роли химии в их жизни, и на этом уровне студенты могут начать это понимать.
Студенты часто считают, что для того, чтобы получить что-то новое, нужно просто смешать все вместе. Когда химическая реакция действительно имеет место, они считают, что тот или иной реагент просто модифицируется; на самом деле это не изменилось. Например, учащиеся считают, что ржавчина — это все еще железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество.Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Например, учащиеся считают, что ржавчина — это все еще железо / сталь; он только что стал коричневым. Точно так же обычно не замечают отслаивания ржавчины — считается, что утюг просто исчезает. Пузырьки газа, которые часто образуются при растворении таблетки в воде, часто не воспринимаются студентами как новое вещество.Такие процессы, как смешивание с водой, использование красителей в пище, замораживание и кипячение, считаются аналогичными химическим изменениям, которые происходят при приготовлении яиц.
Исследование: Johnson (2002)
Дети часто верят, что при сгорании такие материалы, как дерево или бумага, просто исчезают — в конце концов, от продукта остается немного. По их мнению, воздух имеет мало общего с горением. Студенты считают, что при сжигании углеродных материалов, таких как дерево, древесный уголь (углерод) появляется из горит , а не материал .
Исследование: Государственный университет штата Аризона (2001)
Поскольку многие дети знают о таких вещах, как приготовление пищи и сжигание, они предполагают, что для того, чтобы реакции возникли, всегда необходимо тепло.
В обиходе слово «химический» часто используется как ярлык для нежелательных вещей, которых не должно быть в пищевых продуктах или косметике. Следовательно, учащиеся могут рассматривать химические вещества как группу веществ, обнаруженных в лабораториях, а не рассматривать все вещества в продуктах питания (например) как химические вещества.
Научная точка зрения
Все материалы изготовлены из химических веществ. Химические реакции включают взаимодействие между химическими веществами, так что все реагенты превращаются в новые материалы. Свойства новых материалов отличаются от свойств реагентов. Это отличается от других изменений, таких как испарение, плавление, кипение, замораживание и перемешивание, при которых изменения не связаны с новыми веществами. Хотя для начала реакций часто требуется тепло, это не обязательно.
Химические реакции включают разрыв химических связей между молекулами реагента (частицами) и образование новых связей между атомами в частицах продукта (молекулах). Число атомов до и после химического изменения одинаково, но число молекул изменится.
Число атомов до и после химического изменения одинаково, но число молекул изменится.
Хотя многие химические реакции протекают быстро, небольшие, медленные изменения, такие как ржавление или биологические процессы, могут происходить в течение гораздо более длительных периодов времени.
Химические реакции обратимы (факт, который часто опускается во многих научных текстах), но на практике они больше всего отличаются от других наблюдаемых детьми изменений, таких как плавление, тем, что их очень трудно обратить.
Люди используют химические реакции для производства широкого спектра полезных материалов; разложение отходов также включает химические реакции, которые происходят естественным образом в окружающей среде.Для некоторых антропогенных отходов такие реакции отсутствуют, и в результате они вызывают проблемы.
Критические идеи обучения
При обучении химическим реакциям на этом уровне акцент должен делаться на улучшении понимания учащимися важности химических реакций в нашей жизни в производстве многих вещей, которые мы считаем само собой разумеющимися, а также на улучшении их понимания и понимания что вовлечено в химическое изменение. На данном этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
На данном этапе нет необходимости говорить о таких частицах, как атомы или молекулы, или о химических связях.
- В результате химических реакций образуются новые материалы, которые сильно отличаются от реагирующих веществ. Любые новые материалы происходят из реагирующих веществ.
- Изменения, которые могут сопровождать химическую реакцию, включают цвет, внешний вид и образование новых материалов, например, газа.
- Само по себе смешивание не может вызвать химическую реакцию.
- Хотя для инициирования химической реакции часто требуется тепло, это не всегда необходимо.
- Для производства большей части нашей энергии используются химические реакции.
- Химические реакции широко используются для тестирования, идентификации и анализа широкого спектра материалов (например, наборы для тестирования в бассейне и судебно-медицинские тесты из телешоу, таких как « CSI» ).
- Кислород в воздухе является очень реактивным химическим веществом и играет важную роль во многих химических реакциях, таких как горение, ржавление и реакции, посредством которых мы получаем энергию из пищи, которую едим.

Изучите взаимосвязь между идеями о химических реакциях в Карты развития концепции — (атомы и молекулы, химические реакции, сохранение материи, состояния материи)
При изучении химических реакций студентам необходимо будет описывать различные вещества, которые на этом уровне будут материалами, с которыми они знакомы (кухня и изменения, связанные с приготовлением пищи, являются очень хорошей отправной точкой).Им нужно будет уметь идентифицировать изменения в этих веществах с целью в конечном итоге распознать, когда были произведены новые химические вещества, то есть произошло химическое изменение. Как упоминалось выше, это может быть сложно, поскольку студенты часто не видят разницы между яичным белком, переходящим из жидкого состояния в твердое в процессе приготовления, и такими изменениями, как таяние шоколада или кипячение воды, которые не связаны с химическими изменениями. Обучение должно быть сосредоточено на том, что происходит, когда образуются новые вещества.
Эти идеи также рассматриваются в идее фокуса Проблемы с классификацией.
Также можно учитывать влияние химических реакций на окружающую среду, например, как мы утилизируем некоторые химические вещества после их производства в таких формах, как пластиковые пакеты.
Начать обсуждение через общий опыт
Первоначальная педагогическая деятельность должна быть направлена на выявление существующих идей учащихся. На этом этапе важно поощрять студентов высказывать свои идеи и обсуждать их в небольших группах.Все альтернативы следует рассматривать без разрешения на данном этапе.
Начальным действием может быть наблюдение за горением свечи и обсуждение происходящих изменений. Здесь можно различить плавление воска и появление новых материалов. Можно задать следующие вопросы:
- что происходит с воском?
- что горит?
- как вы думаете, куда идет воск?
- не могли бы вы собрать его снова?
- Это тот же процесс, что и испарение воды?
- горела бы свеча, если бы вокруг не было воздуха?
- воздух или часть воздуха израсходованы при горении свечи?
Содействовать осмыслению и разъяснению существующих идей
Действия, которые ставят проблемы для изучения и оспаривают существующие идеи, полезны для поощрения студентов к поиску новых объяснений наблюдаемых ими вещей. Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
Студенты должны изучить ряд изменений и задать вопросы, аналогичные приведенным выше. Во всех этих случаях студентов следует поощрять наблюдать за происходящими изменениями и определять, какие продукты образуются. Обсуждение также может быть сосредоточено на том, чем они отличаются от исходных материалов. Вот несколько примеров:
- Пищевая сода и уксус в стеклянной бутылке с пробкой — почему пробка отлетает?
- Добавьте бикарбонат соды в стакан с уксусом и шестью смородинами.Почему смородина движется вверх-вниз? Какие пузыри? Откуда берутся пузыри?
- Приготовление щербета — смешайте четыре части сахарной пудры, две части лимонной кислоты и одну часть пищевой соды (все они доступны в супермаркетах). Студенты кладут небольшое количество смеси на язык. Что вызывает шипение? Выделяет ли какой-либо порошок сам по себе шипение?
- Наполните банку стальной мочалкой (без мыла) наполовину и добавьте уксуса, чтобы покрыть стальную мочалку. Оставить на пять дней.
 Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Образуется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Образуется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы. - Приготовление карамели — студентам предлагается изучить сахар. Нагрейте концентрированный сахарный раствор, наблюдая по ходу изменения — растворение сахара, затем потемнение. Карамелизация включает в себя ряд химических изменений.(Существует множество рецептов карамели — для улучшения вкуса, внешнего вида и текстуры можно добавить масло, пищевую соду и соль). Студентов следует поощрять искать доказательства химических изменений, а не плавления.
Практикуйтесь в использовании и укрепляйте воспринимаемую полезность научной модели или идеи
Другие виды деятельности могут включать изготовление шоколада. Учащимся может быть предложено найти различия между приготовлением шоколада, где шоколад тает, и производством карамели / ириса, когда сахар превращается во что-то другое.
Есть много других подобных химических изменений, которые можно исследовать — дальнейшие действия по приготовлению пищи могут включать: приготовление шоколадного торта, плавление и подрумянивание сыра, изготовление сот, выпечку хлеба, приготовление яиц-пашот и приготовление тостов. Другие изменения могут включать настройку двухкомпонентных клеев, таких как Аралдит и смешивание стальной ваты и раствора медного купороса (можно приобрести в питомниках растений). Кислород является очень важным реагентом во многих химических реакциях, и студенты могут исследовать изменения, связанные с этим компонентом воздуха.
Уточнение и объединение идей для / путем общения с другими
На этом этапе важно уточнить и закрепить то, что наблюдали студенты, и сосредоточиться на том, что происходит в химической реакции, которая отличается от плавления, кипения и замораживания. Для достижения этой цели студентов можно попросить в группах сделать мини-плакаты, которые показывают изменения, происходящие в одной или нескольких реакциях, которые они наблюдали, в частности сравнивая продукты с исходными материалами и демонстрируя, чем они отличаются. Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Этому можно способствовать, используя новые названия продуктов, такие как «сажа» или «углекислый газ». Затем студенты представляют свои плакаты классу.
Итоговое обсуждение в классе должно выявить идеи учащихся, изучить альтернативы и перейти к более общепринятым научным взглядам на химические реакции.
Необходимо выполнить задания, которые проверят полезность модели химических реакций и дополнительно укрепят представления учащихся о том, что представляет собой химическая реакция. Студентов можно также побудить сравнить продукты с исходными материалами.Например, студенты могут исследовать ржавление стального гвоздя в различных условиях (например, в воздухе / воде / соленой воде).
Для дальнейшего развития понимания учащимися роли химических изменений в их жизни, они могли бы исследовать производство металлов из руд (таких как алюминий и сталь) или производство пластмасс и синтетических волокон. Акцент в этом исследовании делается на важности химических изменений в производстве материалов, которые мы используем каждый день.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Mystery Substances: ваш первый случай — студенты раскрывают полицейские дела, выявляя чистые вещества и компоненты смесей. Они проводят химические испытания загадочного вещества, такого как соль, пищевая сода или сахар, а также наблюдают и записывают, как каждое вещество реагирует с рядом жидкостей и при нагревании. Затем они обращаются к своей таблице данных о химических свойствах и используют ее для сопоставления загадочного вещества или веществ, обнаруженных на месте преступления.Этот учебный объект является одним из пяти объектов.
Идентификатор учебного ресурса: K6ZRNX
- Загадка сокровищ — ученики должны открыть металлическую дверь в сокровищницу, растворив ее кислотами.
 Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумажкой, бикарбонатом натрия или зубами.
Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумажкой, бикарбонатом натрия или зубами.
Идентификатор учебного ресурса: 46X2PX
- Спасите озеро — Рыбы умирают в озере из-за загрязнения воды.Студенты проверяют воду в озере с помощью химических индикаторов, чтобы определить, какая отрасль является причиной загрязнения. Затем они предлагают изменения, чтобы спасти озеро.
Идентификатор учебного ресурса: MW25YS
Какая связь между химией и жизнью?
Мы были бы счастливы, если бы сообщество здесь могло внести свой вклад или рассмотреть возможность нашего предложения. Поскольку Covid 19 еще далек от завершения, и поиск новой вакцины в настоящее время не выглядит многообещающим с приближающимися зимами, которые могут способствовать второй волне.
Мы предлагаем использовать лист папайи Карика в качестве потенциальное лечение против Covid 19, потому что обнаружено, что он подавляет резистентный к хлорохину плазмодий. Ссылка:
Противомалярийная активность экстракта листьев Carica papaya (Семейство: Caricaceae) против Plasmodium falciparum Помимо этого, мы собрали информацию и данные о том, что экстракт листьев папайи Carica может противодействовать большинству симптомов Covid 19. Он снижает уровень интерлейкина IL-6 и TNF-альфа в исследованиях на людях и животных, интерлейкин IL-6 и TNF-альфа вызывают воспаление легких, приводящее к пневмонии. Он увеличивает количество тромбоцитов, лейкоцитов, Т-клеток Th2, он способен растворять сгусток крови за счет цистеиновой протеазы, увеличивая гемоглобин, уменьшая воспаление, обеспечивая антиоксиданты, такие как витамины C и A, которые необходимы для борьбы с инфекциями дыхательных путей и многое другое.
Он снижает уровень интерлейкина IL-6 и TNF-альфа в исследованиях на людях и животных, интерлейкин IL-6 и TNF-альфа вызывают воспаление легких, приводящее к пневмонии. Он увеличивает количество тромбоцитов, лейкоцитов, Т-клеток Th2, он способен растворять сгусток крови за счет цистеиновой протеазы, увеличивая гемоглобин, уменьшая воспаление, обеспечивая антиоксиданты, такие как витамины C и A, которые необходимы для борьбы с инфекциями дыхательных путей и многое другое.
Мы надеемся соберите как можно больше информации и отзывов, которые могут помочь нам спасти человечество, если это сработает.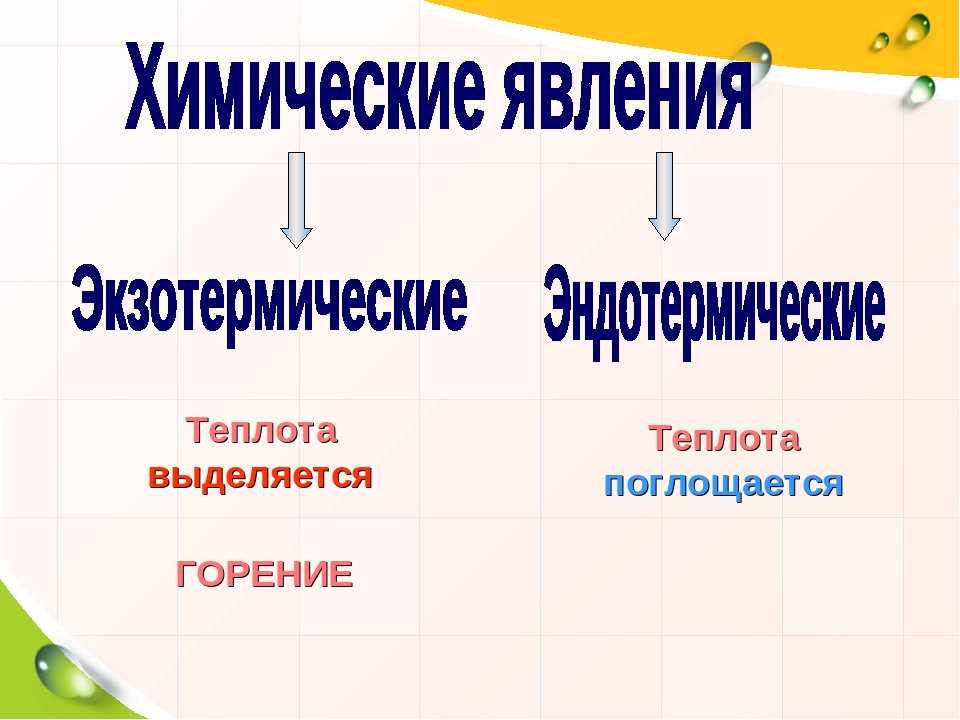

 Таким образом, физические и химические явления часто связаны и взаимозависимы. К примеру, если тот же чайный пакетик поместить в холодную воду, реакции не произойдёт, чаинки и вода не будут взаимодействовать, да и сахар растворяться тоже не пожелает. Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе. Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ. Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо - топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается. Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот - коленчатый вал.
Таким образом, физические и химические явления часто связаны и взаимозависимы. К примеру, если тот же чайный пакетик поместить в холодную воду, реакции не произойдёт, чаинки и вода не будут взаимодействовать, да и сахар растворяться тоже не пожелает. Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе. Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ. Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо - топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается. Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот - коленчатый вал.
 Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + h3O + CO2 = Cu2CO5h3 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе - в виде минерала малахита. Одой из главных химических реакций является фотосинтез, чтобы преобразовать углекислый газ в воду, пищу и кислород. Фотосинтез – одна из самых распространенных и важных химических реакций в жизни. Только благодаря фотосинтезу растения производят для себя и животных еду, он превращает углекислый газ в кислород. 6 СО2 + 6 Н2О + свет → C6h22O6 + 6 O2 Так же аэробное клеточное дыхание - это противоположный процесс фотосинтеза в том, что энергия молекул в сочетании с кислородом, которым мы дышим, с целью высвобождения энергии, необходимым нашим клеткам, плюс углекислый газ и вода. Энергия, используемая клетками, является химической реакцией в формате АТФ. Общее уравнение аэробного клеточного дыхания: C6h22O6 + 6O2 → 6CO2 + 6h3O + energy (36 ATPs) В отличие от аэробного клеточного дыхания, анаэробное дыхание описывает набор химических реакций, которые позволяют клеткам получать энергию от сложных молекул без кислорода.
Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + h3O + CO2 = Cu2CO5h3 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе - в виде минерала малахита. Одой из главных химических реакций является фотосинтез, чтобы преобразовать углекислый газ в воду, пищу и кислород. Фотосинтез – одна из самых распространенных и важных химических реакций в жизни. Только благодаря фотосинтезу растения производят для себя и животных еду, он превращает углекислый газ в кислород. 6 СО2 + 6 Н2О + свет → C6h22O6 + 6 O2 Так же аэробное клеточное дыхание - это противоположный процесс фотосинтеза в том, что энергия молекул в сочетании с кислородом, которым мы дышим, с целью высвобождения энергии, необходимым нашим клеткам, плюс углекислый газ и вода. Энергия, используемая клетками, является химической реакцией в формате АТФ. Общее уравнение аэробного клеточного дыхания: C6h22O6 + 6O2 → 6CO2 + 6h3O + energy (36 ATPs) В отличие от аэробного клеточного дыхания, анаэробное дыхание описывает набор химических реакций, которые позволяют клеткам получать энергию от сложных молекул без кислорода.




 Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
 Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов.
Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов. Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.
Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.

 Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Образуется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы.
Вылейте одну столовую ложку полученной жидкости во вторую банку. Добавьте одну чайную ложку нашатырного спирта и перемешайте. Образуется темно-зеленая клейкая ткань. Опять же, студентов следует попросить подумать о том, что происходит, с упором на развитие понимания того, что создаются новые материалы. Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумажкой, бикарбонатом натрия или зубами.
Они проверяют повседневные вещества, чтобы определить, какие из них являются кислотами: лимонный сок, соленая вода, алкоголь, уксус, вода и газированные безалкогольные напитки. Они видят, реагируют ли вещества с яичной скорлупой, лакмусовой бумажкой, бикарбонатом натрия или зубами.