Урок 21. соли: состав, классификация, номенклатура, способы получения — Химия — 8 класс
Конспект
Соли состав, классификация, номенклатура, способы получения
Соли образуются в результате нейтрализации кислоты основанием:
NaOH + HCl = NaCl + h3O
Поэтому соли состоят из атомов металлов, которые связаны с кислотными остатка-ми. Таким образом, можно сформулировать определение: соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
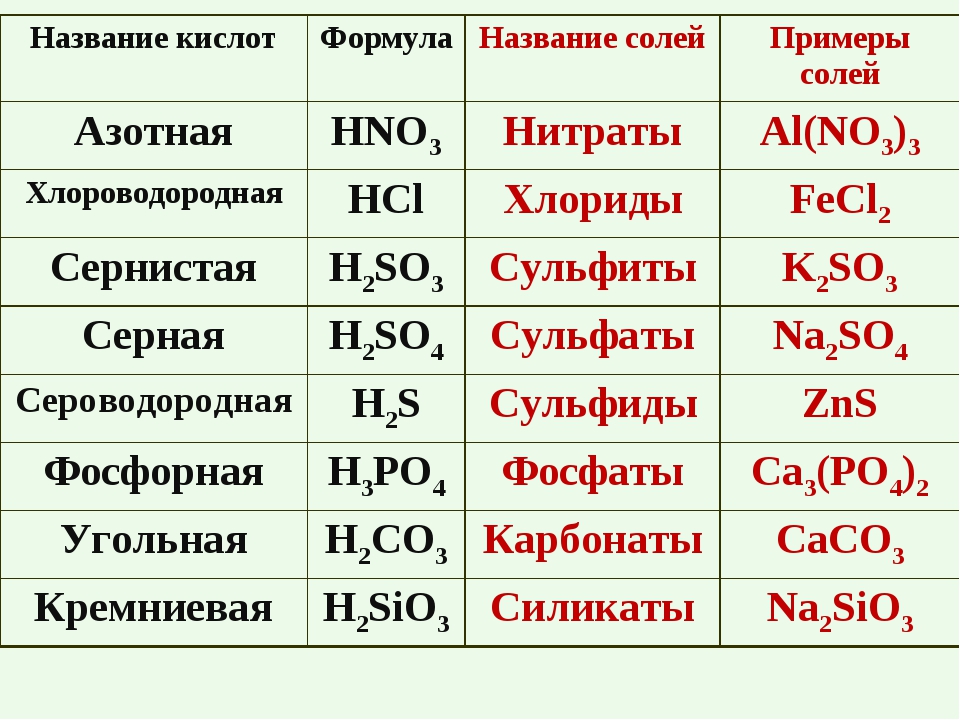
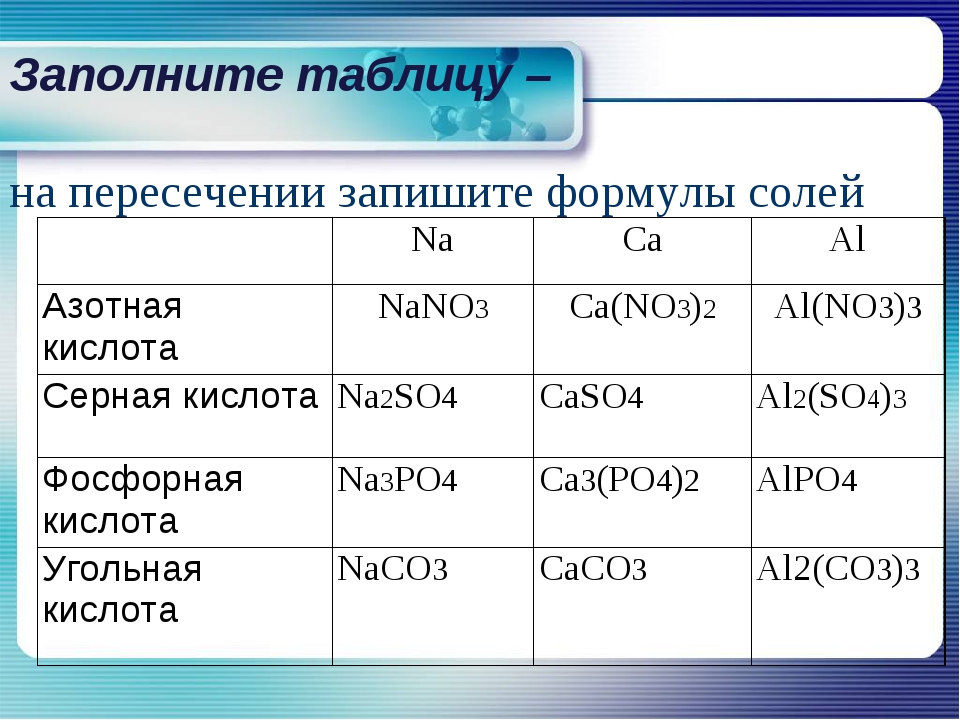
Многие соли имеют свои исторически сложившиеся названия. Но на химическом языке названия солей образуются так: сначала называем кислотный остаток (например, хлорид), добавляем название металла в родительном падеже (например, натрия) – NaCl, CaSO4 – сульфат кальция; CuSO4 – сульфат меди (II).
Если при образовании соли все атомы водорода в молекуле кислоты замещаются атомами металла, то про такую соль говорят «средняя» – Na2SO4.
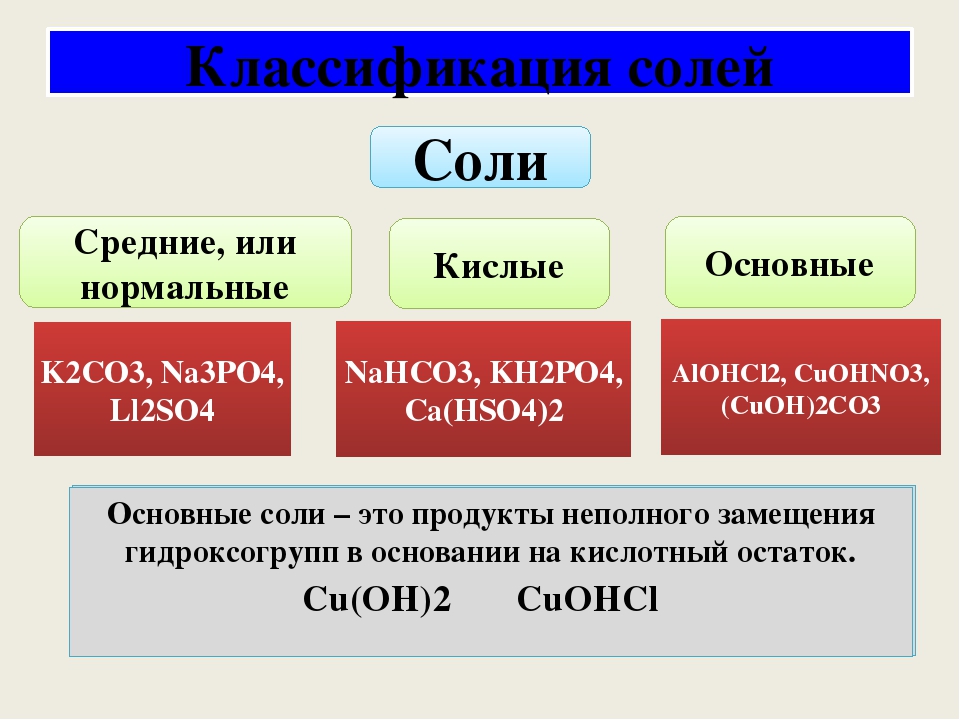
Поэтому по составу соли можно разделить на группы:
• КИСЛЫЕ – образуются при неполном замещении атомов водорода кислоты атомами металлов водорода
• СРЕДНИЕ – образуются при замещении всех атомов водорода кислоты ато-мами металлов
• ОСНÓВНЫЕ – в составе соли присутствуют гидроксильные группы (гидро-ксогруппы)
Существуют различные способы получения солей.
1. Взаимодействие кислот.
— с металлами: 2h4PO4 + 6Na = 2Na3PO4 + 3h3↑
— с основными оксидами: 3h3SO4 + Fe2O3 =(t) Fe2(SO4)3 + 3h3O
— с основаниями: 3HNO3 + Cr(OH)3 = Cr(NO3)3 + 3h3O
2. Взаимодействие кислотных оксидов.
— с щелочами: N2O5 + Ca(OH)2 = Ca(NO3)2 + h3O
— с основными оксидами: SiO2 + CaO =(t) CaSiO3
3. Взаимодействие солей.
— с кислотами: Ca3(PO4)2 + 3h3SO4 =(t) 3CaSO4 + 2h4PO4
— с щелочами: Fe(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
— с металлами: CuSO4 + Fe =(t) FeSO4 + Cu↓
— с нелетучими кислотными оксидами: CaCO3 + SiO2 =(t) CaSiO3 + CO2↑
— с другими солями: Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
4.
 Взаимодействие металлов с неметаллами: 2Fe + 3Cl2 → 2FeCl3 (горение)
Взаимодействие металлов с неметаллами: 2Fe + 3Cl2 → 2FeCl3 (горение)Урок 22. свойства солей — Химия — 8 класс
Урок Конспект Дополнительные материалы КонспектСвойства солей
Во времена Ломоносова определение солей выводили из их физических свойств: «названием солей обозначают хрупкие тела, которые растворяются в воде, причем она остается прозрачной; они не загораются, если в чистом виде подвергаются действию огня».
Один из способов промышленного получения металлов основан на химическом свойстве солей.
 Опустим железный гвоздь в стакан с раствором медного купороса. Цвет раствора изменился. Гвоздь покрылся слоем красно-коричневого металла. В результате химической реакции железо вытеснило медь из раствора соли. Посмотрим на положение меди и железа в ряду напряжений металлов:
Опустим железный гвоздь в стакан с раствором медного купороса. Цвет раствора изменился. Гвоздь покрылся слоем красно-коричневого металла. В результате химической реакции железо вытеснило медь из раствора соли. Посмотрим на положение меди и железа в ряду напряжений металлов:Железо активнее меди: СuSO4 + Fe = Cu + FeSO4.
Менее активный металл не может вытеснить более активный металл: Ag + NaCl ≠
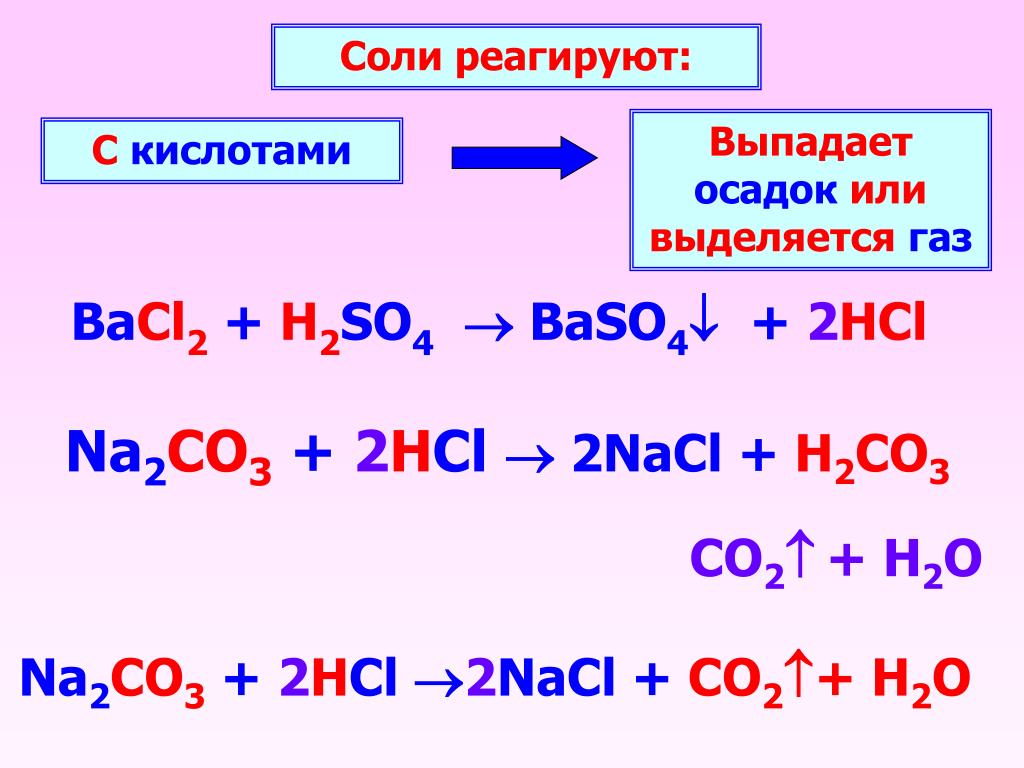
Соли могут взаимодействовать с растворами щелочей с образованием другой соли и другого основания. Реакция протекает, если образуется нерастворимое вещество:
2NaOH + СuSO4 = Cu(OH)2↓ + Na2SO4
Соли могут взаимодействовать между собой с образованием двух других солей: Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
Соли могут взаимодействовать с кислотами с образованием другой соли и другой кислоты: Ca3(PO4)2 + 3h3SO4 =(t) 3CaSO4 + 2h4PO4
Некоторые соли могут разлагаться при нагревании: CaCO3 =(t) CaO + CO2↑
Разработка урока по химии 8 класс.
 Соли, состав, номенклатура
Соли, состав, номенклатураТема6.урок № 7: Соли, остав, номенклатура.
Не в количестве знаний
заключается образование,
а в полном понимании и
искусном применении
А. Дистервег
Цель урока: сформировать понятие о солях как об одном из классов химических соединений; рассмотреть состав, строение, номенклатуру.
Задачи:
образовательная: усвоение новых знаний на основе имеющихся, самостоятельный поиск новых знаний из различных источников и закрепление практических умений и навыков; формирование навыка безопасной работы с химическим оборудованием
развивающая:развитие познавательного интереса, самостоятельности мышления, памяти, инициативы учащихся через использование коммуникативно-деятельностной методики, частично-поискового подхода и элементов проблемного обучения;
— воспитательная: формирование коммуникативных умений, культуры общения, сотрудничества, воспитывать самостоятельность, трудолюбие, добросовестность;
Оборудование: образцы солей, таблицы кабинета, таблица растворимости
Ход урока.
I.Орг.момент
Сегодня мы продолжаем знакомиться с вами с основными классами неорганических соединений. А сначала вспомним прошлые уроки
Из меня не сваришь супа,
Содержу гидроксогруппу,
И активного металла
В моей формуле немало. (Щелочь)
Дать определение класса основания.
Мы состоим из двух частей:
Во-первых, водород, окей!
А во-вторых, остаток наш,
Ну, вот и весь наш экипаж! (Кислоты)
Дайте определение классу кислоты.
В минеральной воде я бурлю,
В вашем классе я просто летаю,
И растеньям я жить помогаю,
И пожар затухать заставляю. (Углекислый газ)
К какому классу веществ относят углекислый газ? (К оксидам)
II. Мотивирование.
Мотивирование.
И ещё одна загадка есть для вас. Загадка о веществе, которое находится в «чёрном ящике»
Когда- то в Голландии существовала мучительная казнь: осуждённые получали только хлеб и воду без добавления этого вещества.
Через некоторое время эти люди умирали, а их трупы мгновенно начинали разлагаться…
А жители некоторых островных государств, чтобы утолить потребность в этом веществе, ели сырую рыбу, обмакивая её в морскую воду. Что же это за вещество?
Загадка.
Отдельно- я не так вкусна,Но в пище каждому нужна.
Это вещество входит в состав крови человека и животных. Оно содержится в Мировом океане. Легионеры Древнего Рима получали часть жалованья этим веществом, а за 5 плиток этого вещества в Абиссинии можно было купить раба. Это самый многочисленный класс из неорганических соединений. Одно вещество из этого класса все вы используете в пищу. Наши предки встречали гостей в знак нерушимой дружбы хлебом и…солью!
Это самый многочисленный класс из неорганических соединений. Одно вещество из этого класса все вы используете в пищу. Наши предки встречали гостей в знак нерушимой дружбы хлебом и…солью!
III.Изучение нового материала.
1. введение в тему урока
такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в \(XVII\) веке. Именно в это время такие учёные, как
2. Получение солей
Сейчас я хочу показать вам один эксперимент: вспомните, как называются вещества, которые меняют свою окраску в зависимости от среды, в которую они попадают.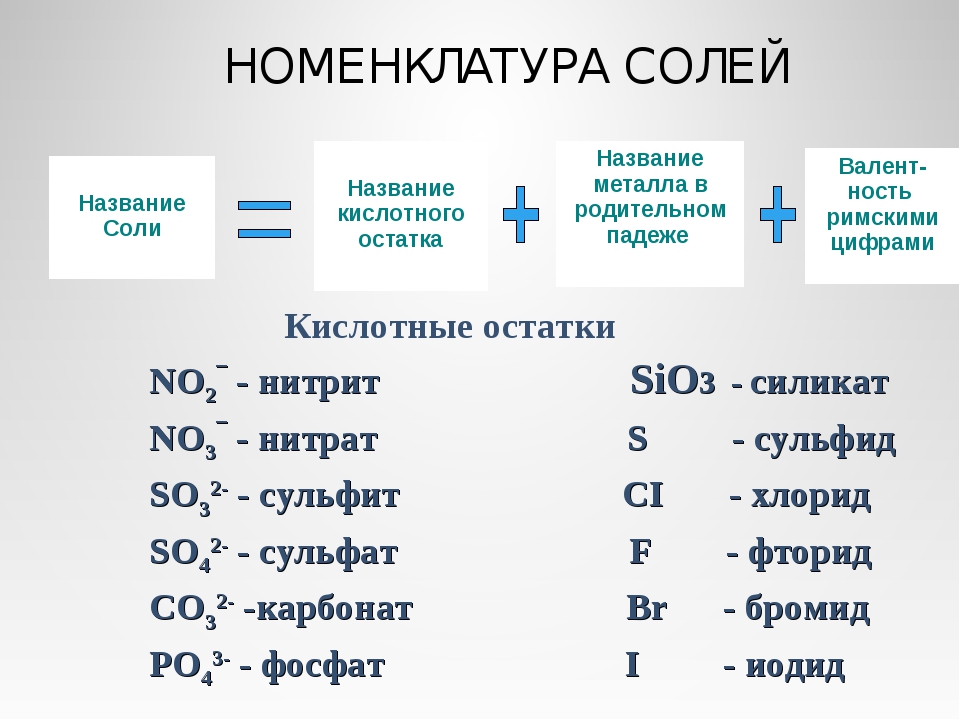 Вспомним, как меняет окраску метилоранж.
Вспомним, как меняет окраску метилоранж.
Давайте проведем эксперимент: у меня в руках две пробирки. Подкрасим их раствором метилоранжа. В одной – кислота, в другой – щелочь. Прильем к раствору кислоты раствор щелочи. Что наблюдаете?
Никаких изменений нет, значит, реакций не было?
А какие изменения должны были бы быть?
Изменение цвета, появление запаха, образование осадка, выделение энергии.
Потрогайте пробирку.
Она слегка нагрелась. Значит, реакция все-таки произошла.
Какие же продукты образовались? Как вы думаете, а какова сущность данной реакции?
Давайте попробуем прилить индикатор, мы видим, что он стал оранжевого цвета, что говорит о наличии нейтральной среды.
Давайте узнаем, что же образовалось. Я выпарила полученный раствор. Что вы видите?
Соль, образовалась соль.
правильно, вот вы сами и дали название новому классу веществ и назвали тему сегодняшнего урока. “Соли: Их состав, классификация и области применения” И как вы думаете, какие цели мы сегодня можем поставить на уроке?
“У кислот и оснований — сто веков войны,
Им о мире разговоры вовсе не нужны.
Только победителей не будет никогда:
В результате всех реакций – соль да плюс вода”.
3. физические свойства солей
Для нас соль с детства – нечто соленое. Однако, далеко не все соли солоны. Соленные соли: поваренная соль NaCl, хлорид калия KCl и другие. Но есть горькая соль, или «английская» соль – сульфат магния MgSO4, которую используют как слабительное и успокоительное.
Есть среди солей и сладкие. Например, хлорид бериллия BeCl2, ученые хотели даже дать название «глициний» за вкус. Цианид калия KCN тоже сладкого вкуса. Но стоит ее попробовать, и не успеешь написать даже заметки, сразу умрешь.
— Все вы знаете, что такое мел. А какой он на вкус? Соленый или нет (нет). Мел на вкус не соленый, но тоже относится к классу «соли»
Формулу мела СаСО3 и называет это вещество – карбонат кальция.
А теперь, давайте познакомимся еще с некоторыми веществами, относящимися к солям.
4. Лабораторная работа «Знакомство с физическими свойствами солей» Выдаются образцы солей.
Лабораторная работа «Знакомство с физическими свойствами солей» Выдаются образцы солей.
– Понятие «соль» мы встречали недавно, при изучении кислот. А с какими солями вы встречаетесь каждый день? (У нас дома есть соль – поваренная или пищевая).
– А еще мел. Это тоже соль.
– Давайте посмотрим на поваренную соль и мел.
[Какой цвет у поваренной соли, мела?] (Белый)
[Какое агрегатное состояние у поваренной соли, мела?] (Твердое)
– Растворимость этих веществ вы определите сами. Давайте вспомним [Правила техники безопасности. Как мы работаем со стеклянной посудой?] (Работать нужно осторожно, чтобы не разбить стекло и не порезаться).
(В двух стаканах вода. Добавим в один немного поваренной соли, а в другой – мел и перемешаем стеклянной палочкой.
– Посмотрите, как растворяется поваренная соль и мел? (Соль растворилась, а мел – нет)
– Значит, cоли бывают растворимые и нерастворимые.
А если соли под рукой нет? Тогда необходимо воспользоваться таблицей растворимости: найти необходимый металл и кислотный остаток и посмотреть, растворима соль или нет.
Правила по технике безопасности:
1. Не берите вещества руками и не пробуйте их на вкус.
2. Для ознакомления с запахом нужно ладонью сделать движение от отверстия сосуда к носу.
Ход работы:
1. Внимательно рассмотрите выданные вам образцы солей. Обратите внимание на физическое состояние, цвет и запах каждого вещества, растворимость в воде запишите в тетрадь.
вещества
Агрегатное состояние
Цвет
Запах
Формула
Раство- рим. в воде
5.Классификация солей
По составу
По растворимости
6.определение
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Ba SO4 K N O3 Na3PO4
7. номенклатура солей
номенклатура солей
IV. закрепление
1.Из перечисленных формул: H2S, K2SO3, КОН, SO3, Fe(OH)3, FeO, N2O3, Cu3(PO4)2, Cu2O, P2O5, H3PO4 — выпишите формулы: а) оксидов; б) кислот; в) оснований; г) солей. Дайте названия веществ.
2.Какая из солей, формулы которых приведены ниже, не растворима в воде?
Ba SO4 K N O3 Na3PO4
V. Домашнее задание § 33
VI. Рефлексия:
Рефлексия:
Успех – не редкость в нашем мире;
Но что такое есть успех?
Успех – отличная отметка;
Успех – удачный поворот;
Увы, успех приходит редко
(Хотелось бы наоборот)!
Сегодня вы все так успешны,
И на вершине той горы
Чтоб голова кружилась только,
Не от проблем, а от весны!!!
Итог урока:
Я знала, всё у нас получится,
Мы будем соли с вами знать.
Всем спасибо вам, молодцы ребята,
В журнал поставлю «хорошо» и «пять».
Урок химии по теме «Соли»
Авторы урока: Онищенко Татьяна Борисовна
Предмет: химия
Класс: 9 «Б» класс
Продолжительность урока: 45 минут
Тема урока: Соли.
Автор учебника: учебник «Химия, 8», О.С.Габриелян, М., Дрофа 2014 г.
Тип урока: Урок ознакомления с новым материалом.
Урок проводится в рамках изучения темы 7 «Растворение. Растворы. Реакции ионного обмена и окислительно–восстановительные реакции». На момент изучения темы данного урока обучающиеся знакомы с основными классами неорганических соединений, их составом, основными положениями теории электролитической диссоциации; умеют составлять реакции ионного обмена, извлекать необходимую информацию из формулы вещества; пользоваться таблицей растворимости; знают условия протекания реакций ионного обмена до конца. Данный урок направлен на развитие имеющихся умений, отработку навыка классификации солей. Урок дает возможность повторить свойства кислот, оснований, является пропедевтикой для пониманий генетической связи между классами неорганических веществ.
Цель урока: изучить классификацию солей в свете теории электролитической диссоциации.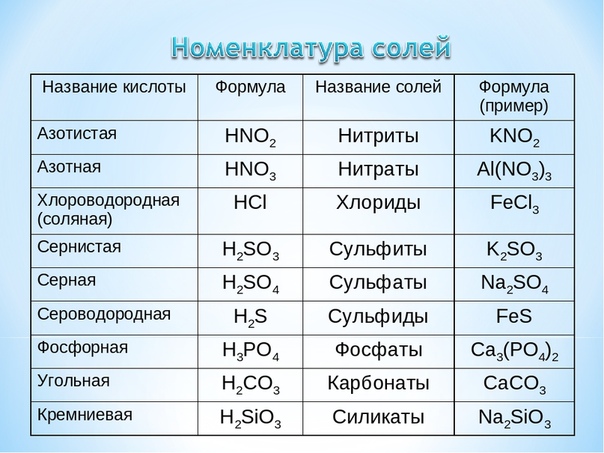
Задачи урока: определить понятия «соли», «кислые соли», «средние соли», «основные соли»; познакомить с принципами классификации солей, обучить умению называть соли по формулам; продолжить развитие умения пользоваться таблицей растворимости, проводить химический эксперимент;
развитие умения устанавливать взаимосвязи между веществами, проведения наблюдений, оформления результатов своей работы, осуществлять индуктивное обобщение и классификацию;
продолжить формирование положительной мотивации на восприятие нового материала, познавательной активности на уроке, умение обсуждать проблемные вопросы в группе и делать выводы.
Формируемые УУД:
Познавательные
Анализ информации.
Использование информации для решения учебной задачи.
Воспроизведение по памяти информации, необходимой для решения учебной задачи.
Презентация информации в наглядном и вербальном виде.
Классификация солей и их номенклатура.
Выделение существенных признаков объекта.
Формулировка вывода.
Установление связи между объектами.
Коммуникативные
Коммуникация.
Умение проявлять эмпатию.
Умение правильно выражать свои мысли письменно и устно.
Умение работать в группе, проводить контроль и взаимоконтроль.
Умение адекватно использовать речь, использовать речевые средства для решения различных коммуникативных задач.
Сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно.
Умение характеризовать качества, признаки объекта, относящие его к определенному классу.
Умение эффективно сотрудничать и способствовать продуктивной кооперации; интегрироваться в группу сверстников и строить продуктивное взаимодействие со сверстниками и взрослыми.
Регулятивные
Умение анализировать условия достижения цели на основе учета выделенных учителем ориентиров действия в новом учебном материале.
Самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности.
В диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Умение адекватно самостоятельно оценивать правильность выполнения действия и вносить необходимые коррективы в исполнение, как в конце действия, так и по ходу его реализации.
Умение осуществлять познавательную рефлексию в отношении действий по решению учебных и познавательных задач.
Личностные
Позитивная моральная самооценка, создание ситуации успешности в обучении. Способность к самооценке.
Умение вести диалог на основе равноправных отношений и взаимного уважения.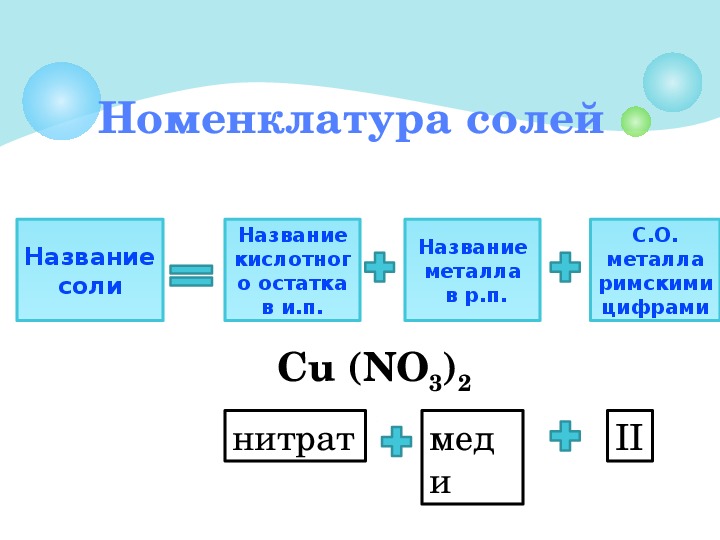
Оборудование: на столах учащихся: хим. реактивы, растворы хлорида натрия, сульфата алюминия, карбоната натрия, лакмуса, фенолфталеина, метилового оранжевого, штатив с пронумерованными пробирками, чистые листочки и карточки с заданиями для проведения проверочной работы, таблица с номенклатурой кислот и солей, таблица растворимости, периодическая система.
Ход урока:
Организационный этап:
Сегодня на уроке нам предстоит выполнить несколько химических опытов.
Вспомните правила по технике безопасности при выполнении лабораторной работы.
Вспомните, какие электролиты вы изучили.
Ответы учащихся: Кислоты, основания. Дают их определения.
Учитель: Как отличить растворы кислот и оснований?
Ответы учащихся: С помощью реактивов-индикаторов.
Задание: Исследовать с помощью двух индикаторов (по выбору) содержимое пробирок №1-3
Записать в таблицу: выбранный индикатор, изменение его окраски в различных средах, выводы (определить кислотность среды в растворе:
щелочная, нейтральная, кислая)
№ пробирки | Индикатор | Изменение окраски индикатора | Кислотность среды в растворе |
№ 1 | |||
№ 2 | |||
№ 3 | |||
№ 4 | |||
№ 5 |
Индикаторы: лакмус, фенолфталеин, метиловый оранжевый
Учащиеся определяют, что в пробирке №1 кислая среда, в пробирке №2 среда щелочная. В пробирке №3 индикаторы окраску не меняли.
В пробирке №3 индикаторы окраску не меняли.
Вопрос: что там может быть? (создание проблемной ситуации и формулирование проблемы учениками)
Учащиеся выдвигают предположения, большинство из которых ошибочны.
Учитель просит назвать вещества, относящиеся к электролитам. Ответ: к электролитам относят кислоты, основания, соли.
Учащиеся выдвигают предположение, что в пробирке №3 раствор соли.
Учащиеся формулируют тему и цель урока: рассмотреть состав и классификацию солей. (слайд 1)
Определение солей: Соли — это сложные вещества, состоящие из ионов металлов и кислотных остатков. (слайд 2)
Актуализация знаний
Работа в парах:
Цель: Усовершенствовать умения в составлении формул солей в соответствии со степенью окисления ионов металла и кислотного остатка, повторить номенклатуру солей.
Составьте формулы солей, образованных ионами и дайте их названия.
Задание для 1 ученика:
Ионы | К+ | Fе 3+ |
CL— | ||
SO42- |
Задание для 2 ученика:
Ионы | Na+ | Mg2+ |
NO3— | ||
РО42- |
Проверьте друг у друга правильность выполнения заданий, задайте не менее 2-х вопросов по работе и оцените её.
 (слайд 3)
(слайд 3)
При выполнении задания используйте данные таблицы «Номенклатура солей» (слайд 4)
Название и формула кислот | Кислотный остаток | Название солей | Примеры |
Азотная HNO3 | NO3 | нитраты | Ca(NO3)2 нитрат кальция |
Кремниевая H2SiO3 | SiO3 | силикаты | Na2SiO3 силикат натрия |
Серная H2SO4 | SO4 | сульфаты | PbSO4 сульфат свинца |
Угольная H2CO3 | CO3 | карбонаты | Na2CO3 карбонат натрия |
Фосфорная H3PO4 | PO4 | фосфаты | AlPO4 фосфат алюминия |
Бромоводородная HBr | Br | бромиды | NaBr бромид натрия |
Иодоводородная HI | I | иодиды | KI иодид калия |
Сероводородная H2S | S | сульфиды | FeS сульфид железа (II) |
Соляная HCl | Cl | хлориды | NH4Cl хлорид аммония |
Фтороводородная HF | F | фториды | CaF2 фторид кальция |
Ионы | К+ | Fe3+ |
CL— | KCL хлорид калия | FeCL3 хлорид железа III |
SO42- | K2SO4 cульфат калия | Fe2(SO4)3 сульфат железа III |
Ионы | Na+ | Mg2+ |
NO3- | NaNO3 нитрат натрия | Mg(NO3)2 нитрат магния |
PO43- | Na3PO4 фосфат натрия | Mg3(PO4)2 фосфат магния |
Какие трудности вы испытывали? Что получилось? Что не получилось?
В неорганической химии великое множество солей. Каким образом мы можем их изучить?
Каким образом мы можем их изучить?
Учащиеся отвечают, что надо разделить класс солей на группы, т.е. изучить классификацию солей.
Получение новых знаний
Классификация солей по признаку растворимости (слайд 7)
Таблица растворимости (слайд 6)
Поиск решения проблемы учениками
Изучите предложенные вам схемы строения солей, выявите признак классификации, сформулируйте определения. (слайды 8-9)
Учащиеся отвечают: Признак классификации – состав солей.
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл.
Кислые соли – это продукты неполного замещения атомов водорода на металл.
Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Проанализируйте способы образования названий солей. (слайд 10)
Ответы учащихся:
В составе кислых солей присутствуют катионы водорода, которые обеспечивают их растворам кислую среду.
В составе основных солей присутствуют гидроксид-ионы, которые обеспечивают их растворам щелочную среду.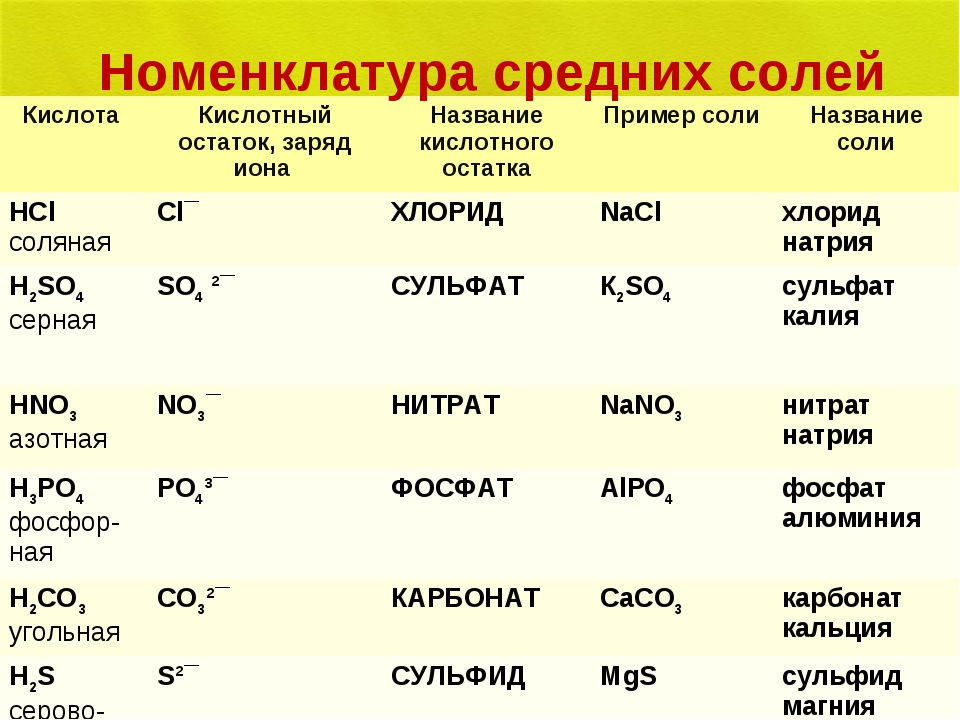 В растворах средних солей среда нейтральная. Индикаторы в таких растворах окраску не меняют.
В растворах средних солей среда нейтральная. Индикаторы в таких растворах окраску не меняют.
Классификация солей
Соли | ||
Средние | Кислые | Основные |
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Na2CO3 — карбонат натрия CuSO4 – сульфат меди (ІІ). Диссоциируют соли на катион металла и анион кислотного остатка: Na2CO3 → 2Na+ + CО32- | Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. NaНCO3 – гидрокарбонат натрия КНSO4 – гидросульфат калия. Диссоциируют кислые соли следующим образом: NaНCO3 → Na+ + НCО3— | Основные соли – это продукты неполного замещения гидроксогруппы в основании на кислотный остаток. СаОНСL– гидроксохлорид кальция (CuОН)2СО3 –гидроксокарбонат меди (ІІ). Диссоциируют основные соли следующим образом: СаОНСL → СаОН+ + СL— |
Применение знаний
Задание: Исследовать с помощью двух индикаторов содержимое пробирок №4 и №5
Записать в таблицу: выбранный индикатор, изменение его окраски в различных средах, выводы (определить кислотность среды в растворе:
щелочная, нейтральная, кислая)
Учащиеся делают вывод, что в пробирке №4 кислая соль, а в пробирке №5 – основная.
Рефлексия
Какую тему мы изучили?
Какова была цель урока?
Достигли ли мы цели?
Было ли на уроке интересно? Что понравилось больше всего?
Оцените свою работу на уроке.
В конце урока учитель подводит итог, высказывая свое мнение, выставляет оценки за практическую и теоретическую части.
3
Формулы соли в химии: Общая характеристика солей — урок. Химия, 8–9 класс. — ЭкоДом: Дом своими руками
Урок 25. Соли – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
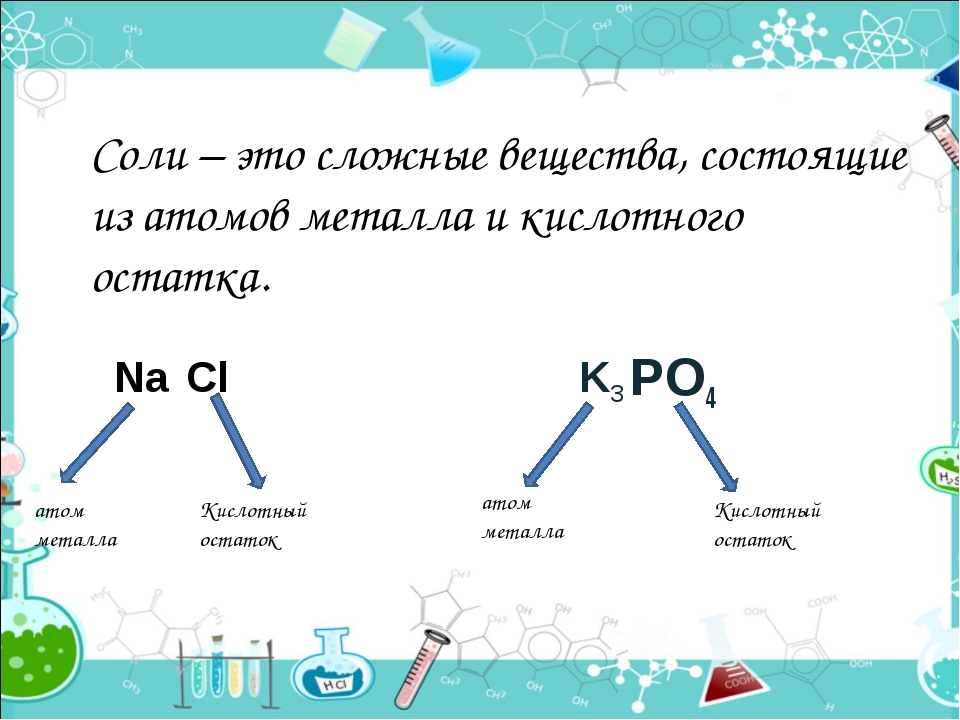
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Конспект урока по химии на тему «Составление формул солей» (8 класс)
Тема 4.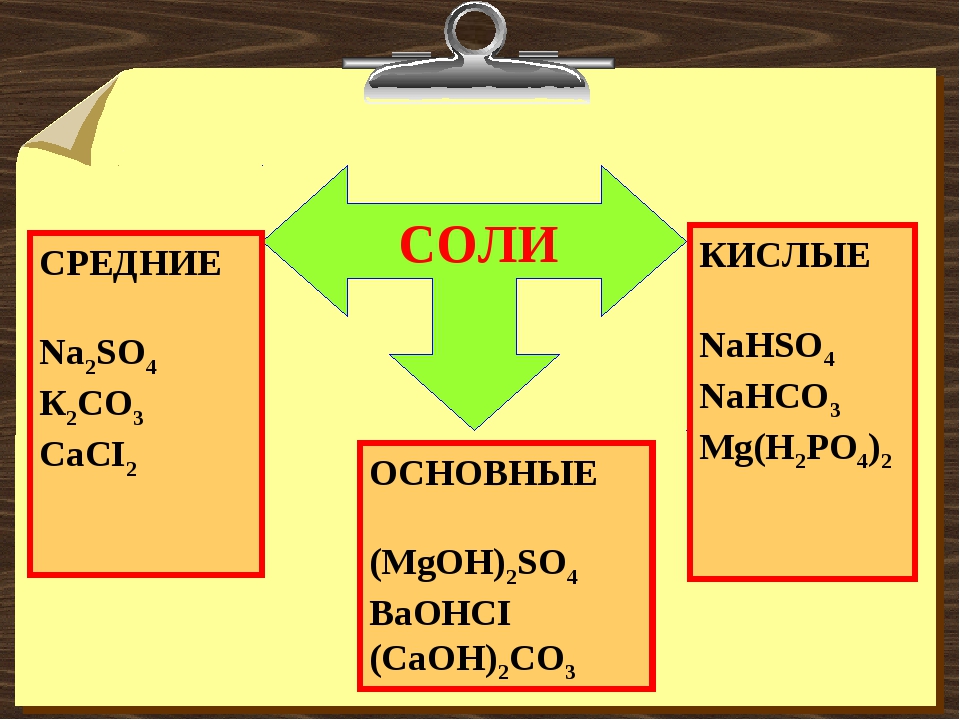 Соединения химических элементов
Соединения химических элементов
Урок № 24
Тема: «Составление формул солей»
Цель: Научиться составлять формулы солей кислородсодержащих и бескислородных кислот.
Оборудование: Таблица Д.И.Менделеева, Таблица растворимости солей, кислот и оснований.
Содержание материала
Мы продолжаем путешествие по стране «Химляндия». Во время нашего последнего путешествия вы познакомились с новым классом веществ — солями.
Вспомним определение солей?
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
Соли могут быть образованы кислородосодержащей кислотой и бескислородной кислотой.
Кислотный остаток образуется, если в формуле кислоты убрать атомы водорода. Заряд кислотного остатка определяется числом атомов водорода в молекуле кислоты. В таблице представлены формулы кислот, кислотных остатков и их заряды.
Название кислоты | Формула кислоты | Формула кислотного остатка | Название кислотного остатка |
Соляная | HCl | Cl- | хлорид |
Азотная | HNO3 | NO3- | нитрат |
Азотистая | HNO2 | NO2- | нитрит |
Серная | h4SO4 | SO42- | сульфат |
Сернистая | h4SO3 | SO32- | сульфит |
Сероводородная | h4S | S2- | сульфид |
Угольная | h4СO3 | СO32- | карбонат |
Кремниевая | h4SiO3 | SiO32- | силикат |
Фосфорная | h5PO4 | PO43- | фосфат |
Алгоритм составления формул солей.
ALS
Записываем формулу соли и проставляем над химическими элементами заряды ионов, пользуясь таблицей растворимости. AL+3S-2
Находим наименьшее общее кратное между зарядами ионов. (2 и 3 – общее кратное 6)
Делим наименьшее общее кратное на заряд каждого иона.
ALS = AL+3S-2 = Al2S3
Заполните таблицу формулами и названиями солей, соответствующих приведенным в ней ионам металлов и кислотным остаткам.
ИОНЫ МЕТАЛЛОВ | ИОНЫ КИСЛОТНЫХ ОСТАТКОВ | ||
Cl— | SO42- | PO43- | |
K+ | KCl – хлорид калия | ||
Ca2+ | |||
Закрепление материала
Тест
1. Соли — это
Соли — это
а) сложные вещества состоящие из атомов водорода и кислотного остатка;
б) сложные вещества состоящие из атомов металла и одной или нескольких гидроксогрупп;
в) сложные вещества состоящие из двух элементов, одним из которых является кислород;
г) сложные вещества, в состав которых входят атомы металлов, соединенные с кислотными остатками.
2. В каком ряду представлены только формулы солей:
a) NaCl, НСl HNO3 б) Na2SO3, K2SO4,CuS
в) Cu(OH)2, H3PO4, Ca3(PO4)2 г) Na2O, NaNO3, HNO3
3.В каком ряду представлены только формулы солей:
a) NaCl, Ca3(PO4)2 Na2SO3 б), K2SO4, CuS, НСl
в) Cu(OH)2, H3PO4, HNO3 г) Na2O, NaNO3, HNO3
4. Вещество формула которого CaСO3 называется
Вещество формула которого CaСO3 называется
а) карбонат кальция в) карбонат калия
б) нитрат кальция г) хлорид кальция
5.Вещество формула которого Na NO3 называется
а) карбонат натрия в) хлорид натрия
б) сульфат натрия г) нитрат натрия
6. Хлориду железа (I I I) соответствует формула
а) Fe CI2 в) FeCl3
б) Fe(OH)3 г) Fe 2O3
7.Ортофосфату калия соответствует формула
а) К 3PO4 в) К PO4
б) КH 2PO4 г) К 2HPO4
8. Соли хорошо растворимые в воде
а) FeCI3 и FeSO4 в) K2SO4 и AgCl
б) CaСO3 и CaSiO3 г) AgCl и CaСO3
9. Формула медного купороса
а) CuSO4 · 3h4O в) CuSO4 · 5h4O
б) CuSO4 · 4h4O г) CuSO4 · 6h4O
10. Оксид, который реагирует с азотной кислотой, образуя соль:
1) Fe2O3 2) P2О5
3) SO3 4) NO
Домашнее задание: Параграф 21, выучить таблицу с названиями солей,
Задание в тетради
Установите соответствие между формулой соли и названием её кислотного остатка
Название кислоты | Кислотный остаток |
Сульфат | |
Хлорид | |
Карбонат | |
Ортофосфат | |
Нитрат | |
Сульфит | |
Нитрит | |
Сульфид |
Ключи: 1)г 2). Б 3).А 4)а 5)г 6) в 7) а 8) а 9) в 10)1
Б 3).А 4)а 5)г 6) в 7) а 8) а 9) в 10)1
Установите соответствие между формулой соли и названием её кислотного остатка.
Название кислоты | Кислотный остаток |
Сульфат | SO4 |
Хлорид | Cl |
Карбонат | CO3 |
Ортофосфат | PO4 |
Нитрат | NO3 |
Сульфит | SO3 |
Нитрит | -NO2 |
Сульфид | S |
Планируемые результаты обучения.
Предметные результаты:
изучить состав солей;
изучить названия солей;
продолжить формирование умений различать и обозначать на письме заряды ионов и степень окисления элемента
продолжить формирование умений описывать и различать изученные классы неорганических соединений
Метапредметные результаты:
продолжить развивать умение формирование гипотез,
продолжить развивать умение выявлять причинно-следственные связи,
продолжить развивать умение работать в группах.

продолжить развивать умение использования различных источников для получения химической информации
Личностные результаты: 1.сформировать умения управлять своей учебной деятельностью
2. помочь в подготовке к осознанию выбора дальнейшей образовательной траектории
Презентация по химии «Составление формул солей»
Презентация может быть использована на уроке химии в 8 классе по теме «Соли» для отработки навыков составления формул солей или первичного закрепления темы «Соли«, или для проверки умения составлять формулы и давать названия солям.
На первом слайде дается алгоритм составления формул солей.
На втором слайде в овальных фигурах записаны формулы кислот и оснований, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами кислот и оснований пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления.
На третьем слайде в прямоугольниках записаны формулы килотных и основных оксидов, используя которые ученик должен составить формулу соли. Правильность выполнения проверяется по клику мышки (в прямоугольнике под формулами оксидов пояляется формула соли). Овалы закрашены в цвета лакмуса в кислой и щелочной средах соответственно, для повторения и визуального закрепеления. Задания расположены в порядке усложнения.
На четвертом слайде дан алгоритм составления названий солей.
На пятом слайде даны формулы солей, которые ученик должен назвать. Правильность названия проверяется по клику мышки (в прямоугольнике справа появляется название соли).
Соли – это сложные вещества, состоящие из атома металла и кислотного остатка.
Чтобы написать формулу соли по названию нужно:
1) написать на первом месте химический знак металла, на втором месте формулу кислотного остатка
2) проставить валентности металла и кислотного остатка
3) найти НОК, разделить НОК на валентности, получить индексы.
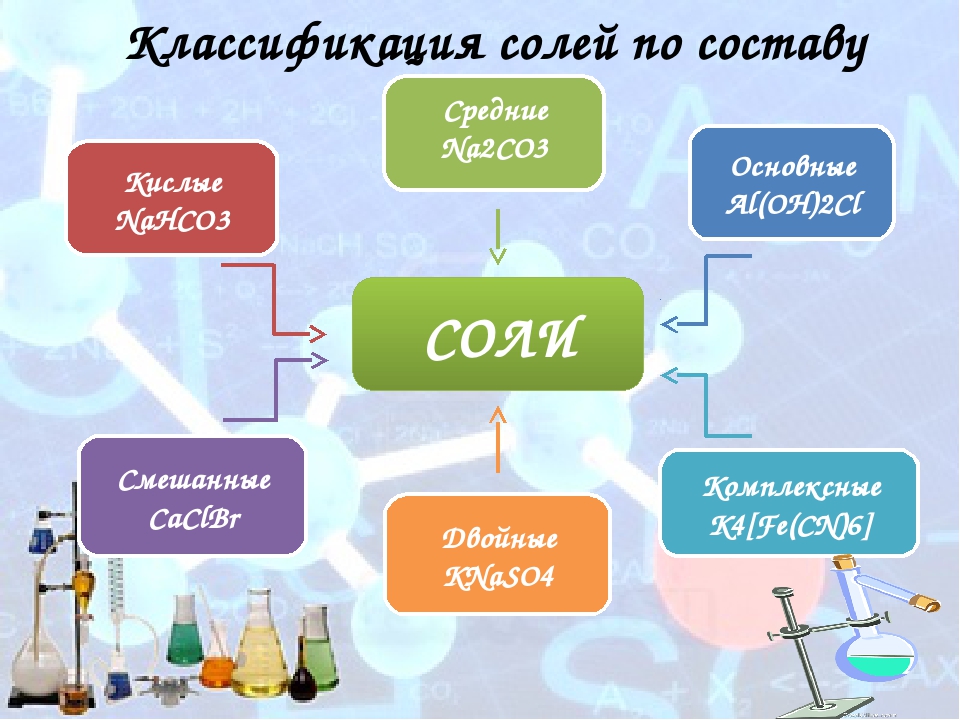
Урок №49. Соли. Классификация. Номенклатура. Способы получения солей
Соли — сложные вещества, состоящие из
атомов металлов (иногда входит водород или гидроксильная группа) и кислотных
остатков.
Классификация солей
СРЕДНИЕ | КИСЛЫЕ | ОСНОВНЫЕ | ДВОЙНЫЕ | СМЕША ННЫЕ | КОМПЛЕК СНЫЕ |
Na2SO4 | NaHSO4 | Mg(OH)Cl | K2NaPO4 | Ca-OCl │ Cl | Na[Al(OH)4] |
Чаще всего
мы будем работать со средними солями:
Названия солей
для средней
соли —
название
кислотного остатка + название металла + указываем валентность для металла с
переменной валентностью
Na2SO4— сульфат
натрия,
CuSO4— сульфат меди (II)
для кислой соли –
«гидро» или «дигидро» + название кислотного остатка + название металла +
указываем валентность для металла с переменной валентностью
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной
соли –
«гидроксо» +
название кислотного остатка + название металла + указываем валентность для
металла с переменной валентностью
Mg(OH)Cl — гидроксохлорид магния
ПОЛУЧЕНИЕ
1. металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 ВИДЕО «ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С СОЛЯМИ» Примечание: (металл2 стоит в ряду Fe + CuCl2 = FeCl2 + Cu |
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
3. кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
4. Из солей: соль1 + соль2 = соль3 NaCl + AgNO3 = NaNO3 +AgCl ↓ соль1 + щелочь = CuSO4 + 2NaOH = соль1 + кислота1 = кислота2 2NaCl + H2SO4 = 2HCl Примечание: Все |
ТРЕНАЖЁРЫ
Тренажёр
№1. «Классы неорганических соединений»
«Классы неорганических соединений»
Тренажёр
№2. «Классификация солей по растворимости в воде»
Тренажёр
№3. «Составление названий солей по формуле»
Тренажёр
№4. «Составление формул солей»
Тренажёр
№5. Задачи на тему «Расчеты с использованием формул солей»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Дайте названия следующим солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
№2.
Составьте химические формулы солей по их названиям: хлорид железа (II),
гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат
железа (III), нитрат магния, карбонат натрия.
№3.
Как двумя способами из оксида кальция
можно получить:
а)
сульфат кальция; б) ортофосфат кальция.
Составьте
уравнения реакций.
Методическая разработка по химии «Алгоритм составления названий и формул солей»
Методическая разработка:
«Алгоритм составления названий и формул солей».
При изучении химии в 8 классе учащиеся сталкиваются с затруднениями в названии химических веществ и составления формул химических соединений. Для лучшего усвоения данного материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении названий и формул солей необходимо знать состав и название кислот, и соответственно название кислотных остатков, входящих в эти кислоты. Для удобства, они указаны в данной разработке.
Названия кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная кислота Cl хлорид
—
HF фтороводородная кислота F фторид
—
HBr бромоводородная кислота Br бромид
—
HI иодоводородная кислота I иодид
2-
h4S сероводородная кислота S сульфид
2-
h4SO3 сернистая кислота SO3 сульфит
2-
h4SO4 серная кислота SO4 сульфат
—
HNO3 азотная кислота NO3 нитрат
—
HNO2 азотистая кислота NO2 нитрит
2-
h4CO3 угольная кислота CO3 карбонат
2-
h4SiO3 кремниевая кислота SiO3 силикат
3-
h5PO4 фосфорная кислота PO4 фосфат
АЛГОРИТМ СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные химические соединения, состоящие из ионов металла, связанного с ионами кислотного остатка.
При составлении названия соли, совершаются поочередно следующие шаги:
1. Называется кислотный остаток, который стоит в формуле соли в конце.
2. Называется металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4 сульфат меди (II) NaCl хлорид натрия
АЛГОРИТМ СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем химические символы металла и кислотного остатка, образующих соль. Металл записываем перед кислотным остатком.
2. Над хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим Наименьшее Общее Кратное между зарядами ионов.
4. НОК делим поочередно: на заряд металла и заряд кислотного остатка.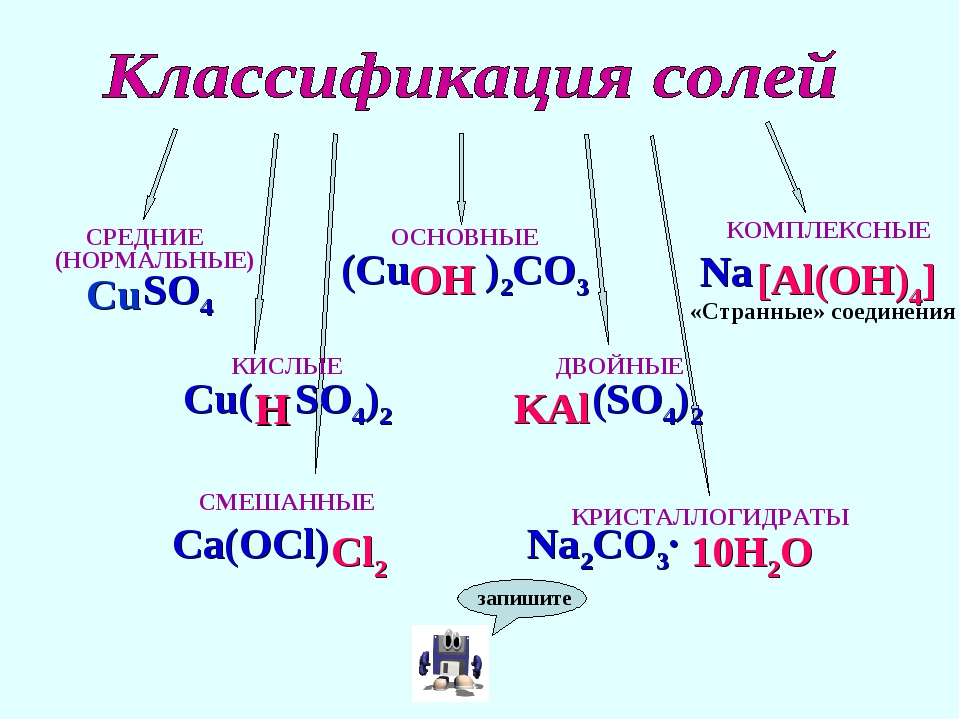
5. Ставим полученные при расчете индексы справа, внизу возле химических элементов. Если кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe NO3
2. 3+ _
Fe NO3
3. 3
3+ —
Fe NO3
4. 3 : 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат алюминия
1. Al SO4
2. 3+ 2-
Al SO4
3. 6
3+ 2-
Al SO4
4. 6 :3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Химические формулы солей
Модуль состоит из четырех кадров, на которых представлены текст, схемы, рисунки, интерактивные схемы, озвученные формулы, иллюстрирующие состав солей. В том числе, ученику предлагается составить формулы средних солей, путем выполнения алгоритма действий: выбрать название соли, формулу которой нужно составить, составить заготовку формулы в соответствии с ее названием, путем переноса нужных элементов из Периодической системы в активные зоны, проставить степени окисления над составными частями формулы, найти индексы и составить химическую формулу вещества, путем вычисления и ввода соответствующих значений в заданные ячейки.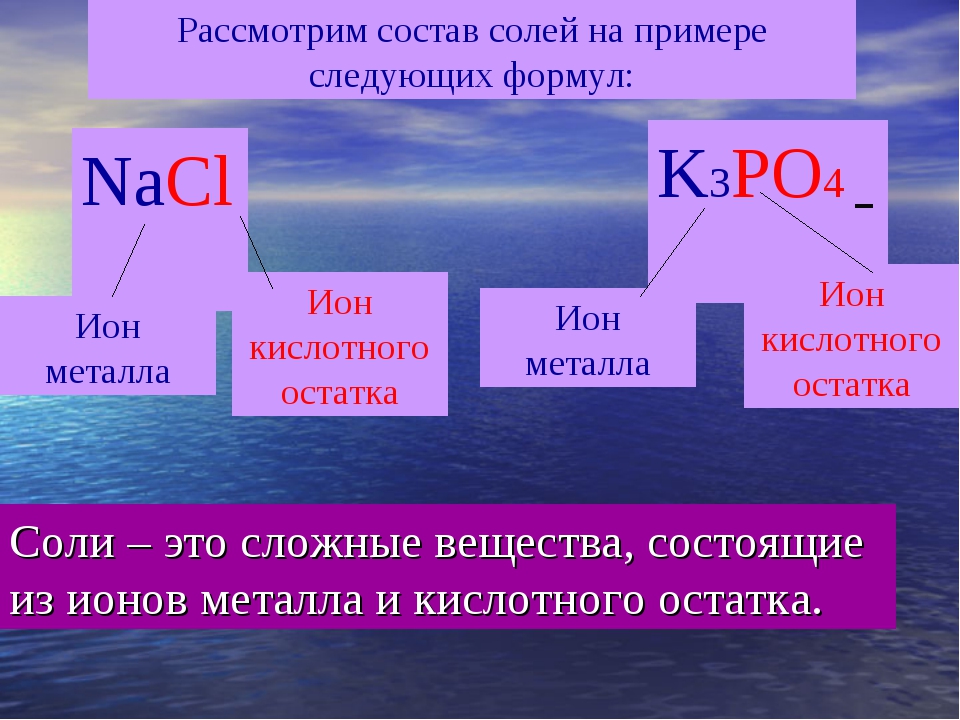
Категория пользователей
Обучаемый, Преподаватель
Контактное время
15 минут
Интерактивность
Средняя
Дисциплины
Химия
/ Неорганическая химия
/ Электролитическая диссоциация
/ Электролиты и неэлектролиты
/ Кислоты, основания, соли в свете теории электролитической диссоциации
Уровень образования
Профессионально-техническая подготовка, повышение квалификации
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
информационный модуль
Место издания
Москва
Ключевые слова
соль
Автор
Морозов Михаил Николаевич
Марийский государственный технический университет
Издатель
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл.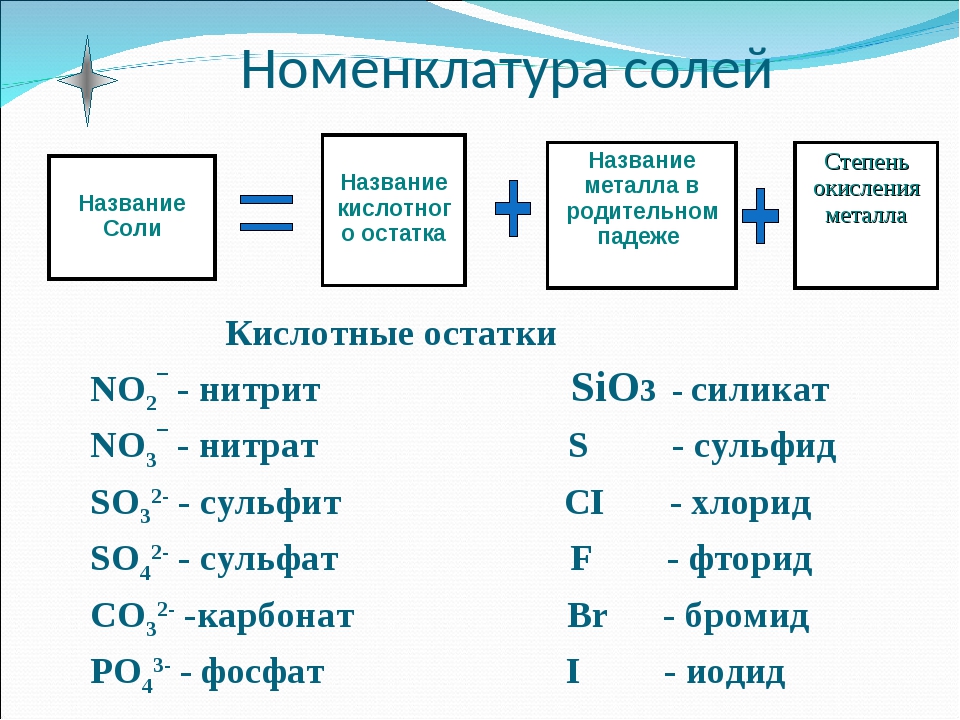 , 3,
, 3,
Сайт —
http://www.mmlab.ru
Эл. почта —
[email protected]
Правообладатель
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул., 51
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/html
Объем цифрового ИР
3 693 964 байт
Проигрыватель
OMS-player версии от 1.0
Категория модифицируемости компьютерного ИР
открытый
Признак платности
бесплатный
Наличие ограничений по использованию
есть ограничения
Рубрикация
Ступени образования
Основное общее образование
Целевое назначение
Учебное
Тип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной школы
8
Уровень образовательного стандарта
Федеральный
Характер обучения
Базовое
|
1. |
Химические формулы солей
|
1 |
|
2. |
Номенклатура средних солей
|
2 |
|
3. |
Составление названий средних солей
|
3 |
|
4. |
Классификация солей
|
1 |
|
5. 
|
Составление химических формул средних солей
|
4 |
|
6. |
Составление названия кислых, основных и комплексных солей
|
2 |
|
7. |
Составление названия кристаллогидрата соли
|
1 |
|
8. |
Составление химических формул кислых, основных и комплексных солей
|
3 |
|
9. 
|
Распознавание соли по её внешнему виду
|
3 |
|
10. |
Растворимость солей
|
1 |
|
11. |
Составление уравнений реакций по химическим свойствам солей
|
4 |
|
12. |
Уравнения реакций по химическим свойствам солей
|
4 |
|
13. 
|
С чем может реагировать соль?
|
4 |
|
14. |
Применение солей
|
1 |
|
15. |
Способы получения средних солей
|
2 |
|
16. |
Образование солей в реакциях обмена
|
5 |
|
17. 
|
Способы получения кислых, основных и комплексных солей
|
5 |
|
18. |
Расчёт по уравнению реакции, если исходное вещество содержит примеси
|
5 |
|
19. |
Расчёт формулы кристаллогидрата и составление его названия
|
5 |
|
20. |
Соли в природе. Названия минералов и горных пород
|
2 |
|
21. 
|
Названия солей, встречающихся в природе
|
2 |
|
22. |
Распространение солей в природе
|
3 |
Именные соли (ионные соединения)
Соли — это ионные соединения, которые при растворении в воде полностью распадаются.
в ионы. Они возникают в результате реакции кислот с основаниями и всегда содержат
катион металла или катион аммония (NH 4 + ).
Примеры солей включают NaCl, NH 4 F, MgCO 3 и Fe 2 (HPO 4 ) 3 .
Соли получают названия, перечисляя имена составляющих их ионов, сначала катион, затем анион.Это включает три отдельных шага.
Шаг 1. Разделите формулу пополам
Начните с вертикального среза формулы
сразу после металла или аммония:
| NaCl | Na | Cl |
| NH 4 F | NH 4 | F |
| MgCO 3 | Mg | CO 3 |
| Fe 2 (HPO 4 ) 3 | Fe 2 | (HPO 4 ) 1 3 3 |
Шаг 2: Определите заряды ионов
Определите ионы и их заряды на каждой половине. Это определенно сложная часть.
Здесь вам пригодятся семь правил:
Правило 1: Все металлы группы 1 (Li — Fr) относятся к категории 1+.
Правило 2: Металлы группы 2 (Be — Ra) — все 2+
Правило 3: Алюминий 3+; Аммоний 1+
Правило 4: Для всех остальных металлов требуется римская цифра.

Правило 5: Неметаллы группы 7 (F — I): все 1–
Правило 6: Неметаллы группы 6 (O — Te) КАК АНИОНЫ обычно 2–
Правило 7: Общий сбор должен составлять 0
Например:
| NaCl | Na | Cl | Na + | Класс — | |
| NH 4 F | NH 4 | F | NH 4 + | F — | |
| MgCO 3 | Mg | CO 3 | Mg 2+ | CO 3 2–9831 | | Fe 2 | (HPO 4 ) 3 | Fe 3+ | HPO 4 2– |
3. Назовите Ионы
Затем назовите эти ионы:
| NaCl | Na + | Cl — | хлорид натрия |
| NH 4 F | NH 4 + | F — | фторид аммония |
| MgCO 3 | Mg 2+ | CO 3 2– | Карбонат магния |
| Fe 2 (HPO 4 ) 3 | Fe 3+ | HPO 4 2– | гидрофосфат железа (III) |
Эти ионы, кстати, называются основными частицами в растворе .
для соли.Выявление основных видов в растворе именно в этом
способ становится ДЕЙСТВИТЕЛЬНО важным, когда вы изучаете равновесие.
Вам тоже нужно знать эти обвинения,
так что вы можете выучить их сейчас и покончить с этим.
Советы для достижения успеха
Могут быть полезны еще несколько советов:
Невозможно обойтись без запоминания имен элементов. Просто сделай это.
Правило 7 гораздо ценнее, чем думает большинство новичков.
Застрял, потому что у вас есть переходный металл, такой как Fe или Mn, и вы не можете вспомнить заряд аниона?
Посмотрите вокруг, чтобы увидеть другие примеры используемого аниона. Например, скажем, вы
необходимо назвать FeSO 4 , и вы не можете вспомнить заряд
по СО 4 . Если вы найдете «Na 2 SO 4 »
где-нибудь еще на экзамене, викторине или
в книге ты дома свободен. Обладая этой информацией, вы узнаете, что SO 4 должен быть 2–,
следовательно, заряд Fe должен быть 2+.
Если вы знаете свои сильные кислоты,
тогда вы знаете «H 2 SO 4 ». H здесь H + , а общий заряд равен 0.
Таким образом, SO 4 должен быть 2–. По аналогии,- HNO 3 дает NO 3 — ,
HClO 3 дает ClO 3 — , и
HClO 4 дает ClO 4 — .
Это работает и со слабыми кислотами, если вы их помните, например
как H 2 CO 3 и H 3 PO 4 .Выучите много названий кислот, потому что они здесь помогают.
Кислоты X-ic образуют анионы X-ate (серная / сульфатная, азотная / нитратная)
Кислоты X образуют анионы Xite (азотистые / нитритные)
Сводка
Ключ, который следует помнить, это то, что система разработана так, чтобы однозначно . Мы должны иметь возможность получить одну и только одну формулу из имени, и это имя
Мы должны иметь возможность получить одну и только одну формулу из имени, и это имя
должно быть стандартным, а не каким-то милым названием, например, nutrasweet .
Таким образом, запомните наиболее распространенные названия и символы элементов,
запомнить семь правил, иметь под рукой таблицу Менделеева,
выучите множество названий кислот и формул, и практикуйтесь, практикуйтесь, практикуйтесь!
ВЫ МОЖЕТЕ ЭТО СДЕЛАТЬ!
Формула соли Учебное пособие по химии
Сноски: ссылка «Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г. » (Красная книга)
(1) «би» означает «два»; раз в два года — это событие, которое проводится два раза в год, раз в два года — это событие, которое происходит каждые два года, двухсотлетие — это событие, которое происходит каждые двести лет, велосипед имеет два колеса, биатлон — это спортивное соревнование, состоящее из двух соревнований (лыжный спорт и стрельба), бицепс это мышца с двумя головками или прикреплениями, двуязычный — это человек, который свободно говорит на двух языках и т. д.
д.
(2) одноатомный или одноатомный или одноатомный? В процитированном выше документе IUPAC используется одноатомный атом, поэтому мы тоже будем его использовать!
(3) Формула соли такая же, как и ее эмпирическая формула.
Также см. Практическое исследование «Определение эмпирической формулы: оксид магния».
(4) Это место вокруг символа элемента на самом деле называется «правым нижним индексом».
| левый верхний индекс | символ | индекс верхний правый |
| левый нижний указатель | индекс нижний правый |
(5) Название элемента с символом Cs — цезий, но ИЮПАК также принимает альтернативное написание цезий.
(6) Систематическое название аммония в ИЮПАК — азан. Большинство людей до сих пор используют название аммоний для катиона NH 4 + , и это приемлемое название IUPAC.
(7) Чтобы соответствовать правилам построения формулы (порядок возрастания электроотрицательности, то есть символ для наименее электроотрицательного атома, записанный первым, символ для наиболее электроотрицательного элемента, записанный последним), гидроксиду следует дать формулу HO — НЕ ОН — .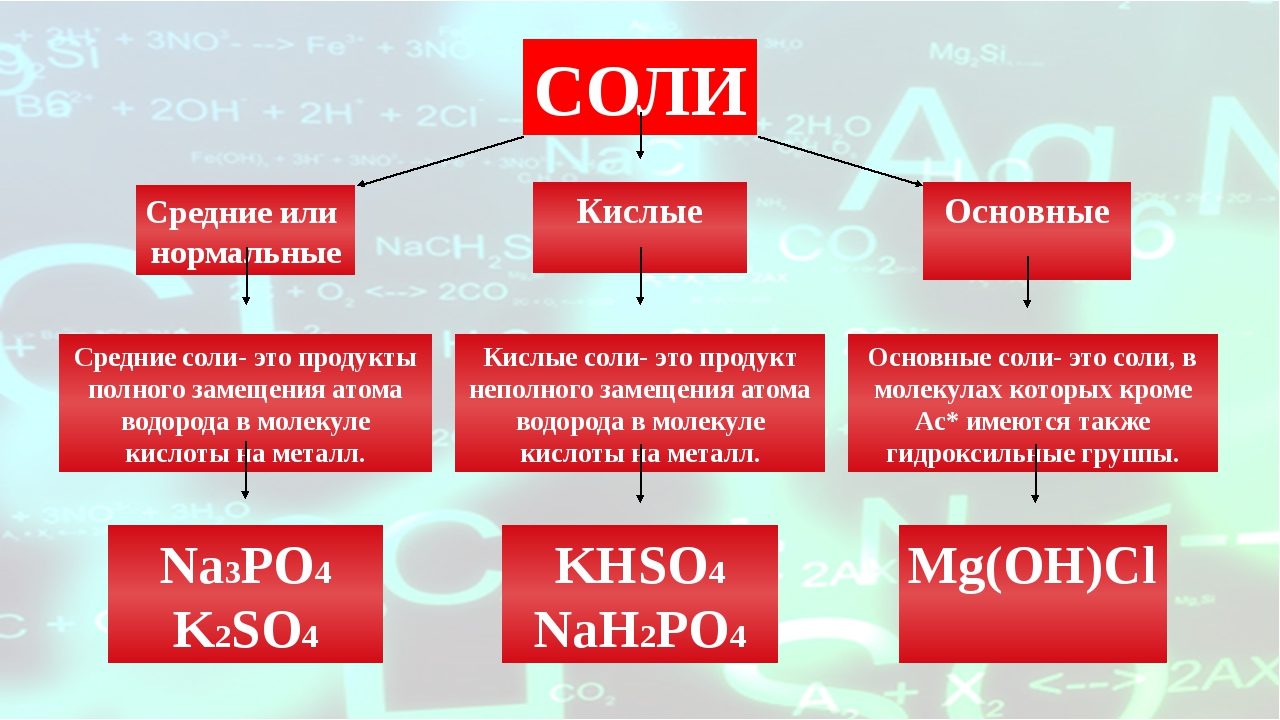 Однако формула OH — для гидроксида хорошо известна и принята.
Однако формула OH — для гидроксида хорошо известна и принята.
Систематические названия гидроксида по ИЮПАК:
- оксиданид (замещающее название: вода, H 2 O, названный оксиданом, отрицательный ион, полученный дегидронацией (депротонированием), является HO —, следовательно, назван оксиданидом)
- гидридооксигенат (1-) (название добавки)
Пять примеров солей для научного класса
Крошечное белое кристаллическое вещество, которое вы посыпаете картофелем-фри, — всего лишь один пример того, что химики называют солями. Фактически, любая ионная молекула, состоящая из кислоты и основания, которая растворяется в воде с образованием ионов, является солью. Хотя соли обычно нейтральны, когда они растворяются в воде, они могут образовывать кислый или щелочной раствор, в зависимости от того, какой из составляющих ионов сильнее. Если ионы одинаковой силы, раствор нейтрален.
TL; DR (слишком долго; не читал)
Соли всегда называются, перечисляя сначала кислотный ион или катион. Ион основания или анион указан вторым.Поваренная соль, например, называется хлоридом натрия (NaCl).
Ион основания или анион указан вторым.Поваренная соль, например, называется хлоридом натрия (NaCl).
Хлорид натрия
••• Брайан Уилкокс / iStock / Getty Images
Хлорид натрия (NaCl) — самый распространенный вид соли в нашей жизни. Известная как поваренная соль, в твердой форме она образует кубическую решетку. Это один из самых безопасных материалов, который вы можете использовать на уроке химии или на кухне.
Катион Na + является кислотой, потому что он акцептор электронной пары. Однако это чрезвычайно слабая кислота из-за большого радиуса действия и низкого заряда.Вы можете распознать анион Cl- как часть соляной кислоты (HCl). Заряд Cl- иона настолько слаб, что он практически нейтрален. При растворении в воде хлорид натрия образует нейтральный раствор.
Дихромат калия
••• Marika- / iStock / Getty Images
Дихромат калия (K 2 Cr 2 O 7 ) представляет собой соль оранжевого цвета, состоящую из калия, хрома и кислорода. Он не только токсичен для людей, но и является окислителем, опасным для возгорания.Никогда не выбрасывайте дихромат калия. Вместо этого его следует смыть в канализацию большим количеством воды. Всегда используйте резиновые перчатки при работе с этим составом. Если вы пролите раствор дихромата калия на кожу, это вызовет химический ожог. Имейте в виду, что любое соединение, содержащее хром, является потенциальным канцерогеном.
Он не только токсичен для людей, но и является окислителем, опасным для возгорания.Никогда не выбрасывайте дихромат калия. Вместо этого его следует смыть в канализацию большим количеством воды. Всегда используйте резиновые перчатки при работе с этим составом. Если вы пролите раствор дихромата калия на кожу, это вызовет химический ожог. Имейте в виду, что любое соединение, содержащее хром, является потенциальным канцерогеном.
Хлорид кальция
••• Carme Balcells / iStock / Getty Images
Хлорид кальция (CaCl 2 ) своим белым цветом напоминает поваренную соль. Он широко используется для удаления льда с дорог. Он более эффективен, чем хлорид натрия в качестве антиобледенителя, потому что хлорид кальция производит три иона, а хлорид кальция — только два. Хлорид кальция может растопить лед до минус 25 F, что на 10 градусов ниже, чем у хлорида натрия. Хлорид кальция настолько гигроскопичен, что означает способность поглощать воду, что, если вы оставите его в комнате непокрытым, он может поглотить достаточно воды из воздуха, чтобы раствориться в растворе самостоятельно.
Бисульфат натрия
••• Эдвард Лам / iStock / Getty Images
Бисульфат натрия (NaHSO 4 ) образуется из натрия, водорода, серы и кислорода.Он создан из серной кислоты и удерживает один из ионов водорода кислоты, что придает этой соли кислотные свойства. Бисульфат натрия, известный как сухая кислота, используется в коммерческих целях, например, для снижения уровня pH в спа-салонах и плавательных бассейнах, для мытья бетона и очистки металлов. В твердой форме бисульфат натрия образует белые шарики. Эта соль ядовита и может повредить кожу, поэтому при обращении с ней используйте резиновые перчатки. В случае проглатывания немедленно обратитесь в токсикологический центр и не вызывайте рвоту.
Сульфат меди
••• Svetl / iStock / Getty Images
Сульфат меди (CuSO 4 ) представляет собой синюю соль, состоящую из меди, серы и кислорода. При растворении в воде становится бесцветным. Если вы окунете железный предмет в раствор сульфата меди и воды, железо вскоре приобретет красный цвет. Это пленка из меди, образовавшаяся в результате химической реакции между раствором и железом. Та же реакция заставляет железо заменять медь в растворе, образуя сульфат железа.
Если вы окунете железный предмет в раствор сульфата меди и воды, железо вскоре приобретет красный цвет. Это пленка из меди, образовавшаяся в результате химической реакции между раствором и железом. Та же реакция заставляет железо заменять медь в растворе, образуя сульфат железа.
Столовая соль Молекулярная формула: хлорид натрия
Поваренная соль — это ионное соединение, которое распадается на составляющие ионы или диссоциирует в воде. Это ионы Na + и Cl —. Атомы натрия и хлора присутствуют в равных количествах (соотношение 1: 1), образуя кубическую кристаллическую решетку. Молекулярная формула поваренной соли — хлорида натрия — NaCl.
В твердой решетке каждый ион окружен шестью ионами, имеющими противоположный электрический заряд.Расположение образует правильный октаэдр. Ионы хлора намного больше, чем ионы натрия. Ионы хлора расположены кубическим массивом относительно друг друга, в то время как небольшие катионы натрия заполняют промежутки между анионами хлорида.
Почему столовая соль на самом деле не NaCl
Если бы у вас был чистый образец хлорида натрия, он бы состоял из NaCl. Однако поваренная соль на самом деле не является чистым хлоридом натрия. К нему могут быть добавлены агенты, предотвращающие слеживание, плюс большая часть поваренной соли содержит микроэлемент йода.В то время как обычная поваренная соль (каменная соль) очищается, чтобы содержать в основном хлорид натрия, морская соль содержит гораздо больше химикатов, включая другие типы соли. Природный (нечистый) минерал называется галит.
Один из способов очистки поваренной соли — ее кристаллизовать. Кристаллы будут относительно чистым NaCl, в то время как большинство примесей останется в растворе. Тот же процесс можно использовать для очистки морской соли, хотя полученные кристаллы будут содержать другие ионные соединения.
Свойства хлорида натрия и его применение
Хлорид натрия жизненно важен для живых организмов и важен для промышленности. Большая часть солености морской воды связана с хлоридом натрия. Ионы натрия и хлора обнаруживаются в крови, гемолимфе и внеклеточных жидкостях многоклеточных организмов. Поваренная соль используется для сохранения продуктов и улучшения вкуса. Он также используется для удаления льда с дорог и пешеходных дорожек и в качестве химического сырья. Соль можно использовать как чистящее средство. Огнетушители Met-L-X и Super D содержат хлорид натрия для тушения металлических пожаров.
Большая часть солености морской воды связана с хлоридом натрия. Ионы натрия и хлора обнаруживаются в крови, гемолимфе и внеклеточных жидкостях многоклеточных организмов. Поваренная соль используется для сохранения продуктов и улучшения вкуса. Он также используется для удаления льда с дорог и пешеходных дорожек и в качестве химического сырья. Соль можно использовать как чистящее средство. Огнетушители Met-L-X и Super D содержат хлорид натрия для тушения металлических пожаров.
Название ИЮПАК : хлорид натрия
Другие названия : поваренная соль, галит, натрий хлористый.
Химическая формула : NaCl
Молярная масса : 58.44 грамма на моль
Внешний вид : Чистый хлорид натрия образует бесцветные кристаллы без запаха. Многие маленькие кристаллы вместе отражают свет, заставляя соль казаться белой. Кристаллы могут принять другой цвет, если присутствуют примеси.
Другие свойства : Кристаллы соли мягкие. Они также гигроскопичны, что означает, что они легко впитывают воду. Чистые кристаллы в воздухе в конечном итоге приобретают матовый вид из-за этой реакции. По этой причине чистые кристаллы часто запаивают в вакууме или в полностью сухой среде.
Они также гигроскопичны, что означает, что они легко впитывают воду. Чистые кристаллы в воздухе в конечном итоге приобретают матовый вид из-за этой реакции. По этой причине чистые кристаллы часто запаивают в вакууме или в полностью сухой среде.
Плотность : 2,165 г / см 3
Точка плавления : 801 ° C (1474 ° F; 1074 K) Как и другие ионные твердые вещества, хлорид натрия имеет высокую температуру плавления, поскольку для разрыва ионных связей требуется значительная энергия.
Точка кипения : 1413 ° C (2575 ° F, 1686 K)
Растворимость в воде : 359 г / л
Кристаллическая структура : гранецентрированная кубическая (ГЦК)
Оптические свойства : Идеальные кристаллы хлорида натрия пропускают около 90% света между 200 нанометрами и 20 микрометрами. По этой причине кристаллы соли могут использоваться в оптических компонентах инфракрасного диапазона.
Использование химических реакций для получения соли
Нейтрализация
Реакция между кислотой и основанием называется нейтрализацией. Именно так работают лекарства от расстройства желудка — они содержат химические вещества, которые реагируют и нейтрализуют избыток желудочной кислоты. Промышленность использует этот же метод для производства широкого спектра солей и продуктов.
Вот как работает нейтрализация:
Кислые растворы содержат ионы водорода (H + ).
Щелочные растворы содержат ионы гидроксида (OH — ).
Вот слово уравнение реакции между кислотой и щелочью:
Кислота + щелочь → соль + вода
Ионное уравнение для всех реакций нейтрализации:
H + (вод.) + OH — (вод.) → H 2 O (л)
Тип соли, образующейся в ходе реакции, зависит от используемых кислоты и щелочи.
Кислоты, щелочи и соли, которые они производят
При нейтрализации соляной кислоты образуются хлоридные соли.
Соляная кислота + гидроксид натрия → хлорид натрия + вода
При нейтрализации азотной кислоты образуются нитратные соли.
Азотная кислота + гидроксид калия → нитрат калия + вода.
При нейтрализации серной кислоты образуются сульфатные соли.
Серная кислота + гидроксид натрия → сульфат натрия + вода.
Изготовление солей из оксидов металлов
Оксиды металлов также могут использоваться в качестве оснований и вступать в реакцию с кислотами с образованием солей и воды.
Вот словесное уравнение реакции между кислотой и металлическим основанием:
Оксид металла + кислота → соль + вода
Например:
Оксид меди (CuO) + соляная кислота (2HCl) → хлорид меди (CuCl 2 ) + вода (H 2 0)
В то время как достаточно химически активные металлы могут реагировать с кислотами с образованием соли и водорода, соли очень инертных металлов, таких как медь, не могут быть получены таким способом, потому что эти металлы не реагируют с кислотами.
И соли очень реакционноспособных металлов, таких как натрий, не могут быть получены таким способом, потому что реакция между металлом и кислотой слишком интенсивна, чтобы ее можно было проводить безопасно.
Получение соли из реакции осаждения
Некоторые нерастворимые соли могут быть получены в результате реакции между двумя растворами. Сульфат бария — нерастворимая соль. Это может быть получено реакцией между растворами хлорида бария и сульфата натрия.
Например:
Хлорид бария + сульфат натрия → сульфат бария + хлорид натрия
Реакции осаждения могут использоваться для удаления нежелательных ионов из растворов. Этот метод используется для очистки питьевой воды и сточных вод.
Изготовление солей из карбонатов металлов
Кислоты могут нейтрализоваться карбонатами металлов с образованием солей. Большинство карбонатов металлов нерастворимы, поэтому они являются основаниями, но не щелочами.
При нейтрализации кислот карбонатами металлов образуются соль, вода и диоксид углерода. Это означает, что такие породы, как известняк, содержащие карбонатные соединения, повреждаются кислотными дождями.
Это означает, что такие породы, как известняк, содержащие карбонатные соединения, повреждаются кислотными дождями.
Вот слово уравнение реакции:
Карбонат металла + кислота → соль + вода + диоксид углерода
Что такое соль в химии? — Определение и формула — Видео и стенограмма урока
Как связаны соли воедино?
Прежде чем мы сможем понять клей, который связывает ионы вместе, нам нужно узнать, почему определенные атомы вообще становятся ионами.Ионы образуются одним из двух способов.
Во-первых, атом может потерять электрон и стать катионом. Помните, что электроны заряжены отрицательно, поэтому, если атом теряет отрицательный заряд, он становится положительным.
Атом может также получить электрон, чтобы стать анионом. Это происходит из-за распределения электронов в атоме и магического числа восемь. Химики часто ссылаются на правило октетов , которое, проще говоря, просто означает, что атом достигнет стабильности, когда он сможет получить восемь валентных или внешних электронов.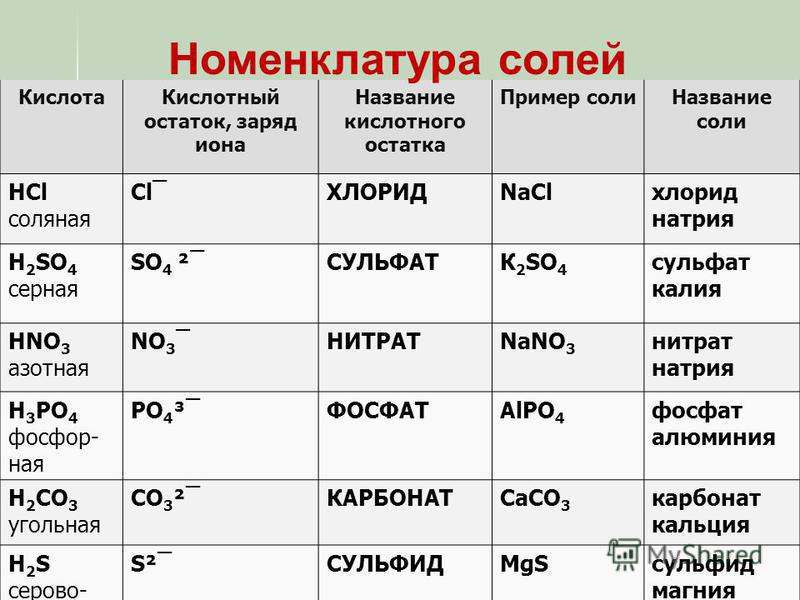 Атом будет похож на ближайший к нему благородный газ в периодической таблице. Один из способов достижения этого — потеря или получение электронов с образованием иона.
Атом будет похож на ближайший к нему благородный газ в периодической таблице. Один из способов достижения этого — потеря или получение электронов с образованием иона.
Мы уже узнали, что металлы образуют катионы, теряя электроны. Например, натрий является металлом группы 1 и, как и все металлы группы 1, имеет один валентный электрон. Этот электрон не очень плотно удерживается атомом и легко теряется, образуя катион Na1 +.
Хлор — неметалл, он находится в группе 17 (или 7A) периодической таблицы Менделеева.У него семь валентных электронов, и ему нужен только один электрон, чтобы достичь магической восьмерки для стабильности! Получение этого дополнительного электрона сформирует анион Cl1-. Обратите внимание, что оба иона (Na1 + и Cl1-) имеют одинаковый числовой заряд, только противоположные знаки.
Итак, что происходит, когда атом металлического натрия встречается с атомом газообразного хлора? Происходит бурная реакция, когда оба атома образуют ионы. Натрий передает свой дополнительный электрон хлору, который дает хлору его волшебные восемь валентных электронов и дает натрию положительный заряд. Эти ионы немедленно притягиваются друг к другу, и образуется соль , хлорид натрия . Ионы склеены между собой ионными связями , которые представляют собой электростатическое притяжение между противоположно заряженными ионами, которое представляет собой электростатическое притяжение между противоположно заряженными ионами.
Эти ионы немедленно притягиваются друг к другу, и образуется соль , хлорид натрия . Ионы склеены между собой ионными связями , которые представляют собой электростатическое притяжение между противоположно заряженными ионами, которое представляет собой электростатическое притяжение между противоположно заряженными ионами.
Каковы свойства соли?
Физические и химические свойства материалов тесно связаны с тем, как они связаны друг с другом. Теперь мы знаем, что ионы в соли сильно притягиваются друг к другу, образуя прочные ионные связи. Для разрыва ионной связи требуется много энергии, и чем сильнее притяжение, тем прочнее связь. Это притяжение между ионами означает, что соединение с ионными связями будет иметь прочную упорядоченную структуру.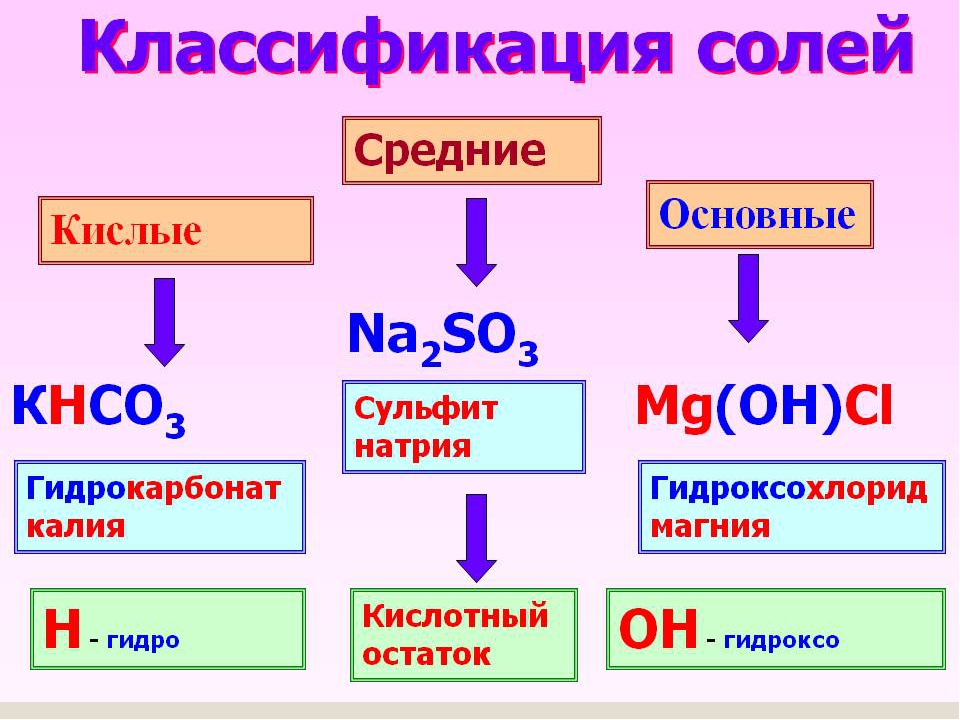
Соли часто образуют кристаллическую структуру или кристаллическую решетку , высокоупорядоченное образование молекул. Вот почему на нашем картофеле фри появляются кристаллы соли.
Эта упорядоченная структура и сильная ионная связь приводит к тому, что многие соли обладают некоторыми особыми свойствами. Во-первых, они имеют тенденцию быть кристаллическими твердыми телами с кристаллической структурой. Твердые частицы также имеют тенденцию быть твердыми и хрупкими из-за сильной ионной связи по всему кристаллу.Соли также имеют высокие температуры кипения и плавления , потому что для разрыва этих связей и изменения состояния вещества соли требуется много энергии. Наконец, соли — это электролиты , то есть они растворяются в воде с образованием свободно движущихся ионов, которые могут проводить электричество.
Имейте в виду, что расплавленные соли также проводят электричество, а твердые соли — нет; ионы должны быть свободными, чтобы проводить электричество.
Поиск химической формулы соли
До сих пор мы говорили только о хлориде натрия, сокращенно NaCl, но все комбинации металлов и неметаллов образуют соли.Примеры включают йодид магния, сокращенно MgI2, и оксид алюминия, Al2O3. Помните, что мы всегда сначала пишем катион, а затем анион. Число после атома говорит нам, сколько атомов этого типа содержится в этом соединении; где нет числа, есть только один атом.
Для оксида алюминия есть два атома алюминия и три атома кислорода, но почему это число? Почему не по одному или по одному алюминию и двум атомам кислорода? Поскольку общая соль всегда электрически нейтральна; другими словами, положительный заряд должен равняться отрицательному, поэтому они компенсируют друг друга. Имея разные заряды для каждого атома, некоторые соли потребуют разного количества атомов для каждого элемента.
Периодическая таблица Менделеева — лучший инструмент химика для определения зарядов ионов и предсказания химической формулы солей, которые они образуют.
В периодической таблице элементы организованы в вертикальные группы. Металлы основной группы — металлы в группах 1 и 2, а также алюминий, образуют только один положительный ион. Неметаллы всегда образуют только один отрицательный ион.Вот краткое изложение различных групп зарядов периодической таблицы.
| Номер группы | Ионный заряд | Примеры |
|---|---|---|
| 1 | 1+ | Li +, Na +, К + |
| 2 | 2+ | Mg2 +, Ca2 +, Ba2 + |
| 13 | 3+ | Al3 + |
| 16 | 2– | O2-, S2- |
| 17 | 1– | F-, Cl-, Br-, I- |
К сожалению, жизнь не всегда так проста для металлов в середине таблицы — так называемых переходных металлов . Эти металлы способны образовывать более одного заряженного катиона, поэтому мы не можем сказать, просто взглянув на их расположение в периодической таблице. Вместо этого химики используют римские цифры в сочетании с названиями элементов, чтобы указать заряд атома. Например, возьмем атом хлорида железа (III). Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Вместо этого химики используют римские цифры в сочетании с названиями элементов, чтобы указать заряд атома. Например, возьмем атом хлорида железа (III). Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Как только мы узнаем заряд двух ионов в соли, мы можем записать химическую формулу с правильным числом атомов, чтобы убедиться, что два в целом имеют нулевое изменение.Особенно простой способ сделать это — использовать метод перекрещивания : здесь заряд одного иона становится числом, следующим за другим. Когда число равно 1, мы просто отбрасываем его.
Давайте рассмотрим несколько примеров, начиная с бромида лития, соли, состоящей из Li1 + и Br1-. Поскольку оба заряда равны 1, мы опускаем оба числа и видим, что соль состоит из одного атома лития и одного атома брома.
Давайте сравним это с сульфидом алюминия, солью, состоящей из Al3 + и S2-. Используя метод крест-накрест, мы берем номера каждого элемента и меняем их местами, чтобы определить количество атомов в соединении.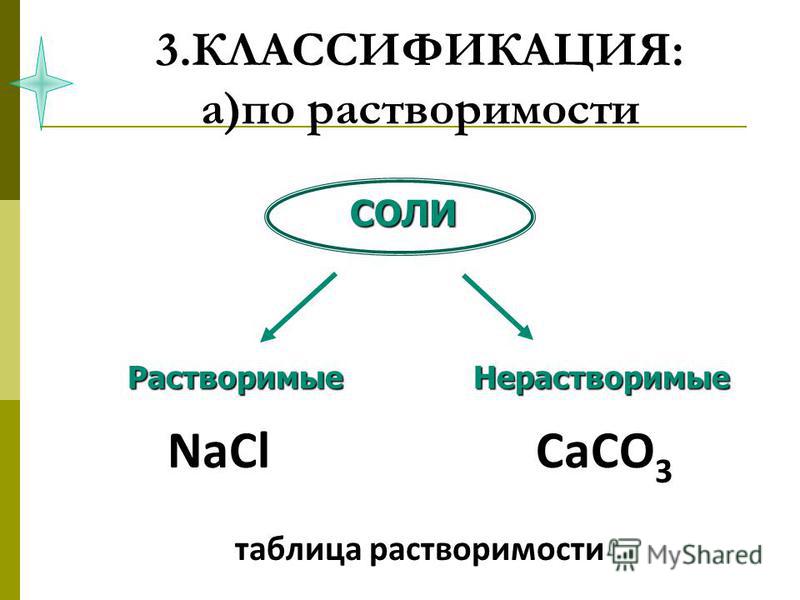 Что мы получаем? Два атома алюминия и три атома серы, что означает, что сульфид алюминия будет называться сокращенно Al2S3.
Что мы получаем? Два атома алюминия и три атома серы, что означает, что сульфид алюминия будет называться сокращенно Al2S3.
Рассмотрим еще один пример. Оксид кальция состоит из Ca2 + и O2-. Метод крест-накрест даст нам результат по два атома Ca2O2; но мы можем разделить на общий знаменатель два, чтобы получить результат только по одному атому и составному символу CaO.
Краткое содержание урока
Соль — это соединение, состоящее из двух ионов — положительно заряженного и отрицательно заряженного иона. Притяжение между двумя ионами образует сильные ионные связи , придавая солям твердую и хрупкую кристаллическую структуру. Соли обладают другими специфическими свойствами из-за этих ионных связей, включая высокие температуры плавления и кипения, а также способность проводить электричество как в расплавленной форме, так и при растворении в воде.
Химические формулы солей часто можно предсказать, найдя заряд одного иона по его положению в периодической таблице, а затем убедившись, что общий заряд соли равен нулю .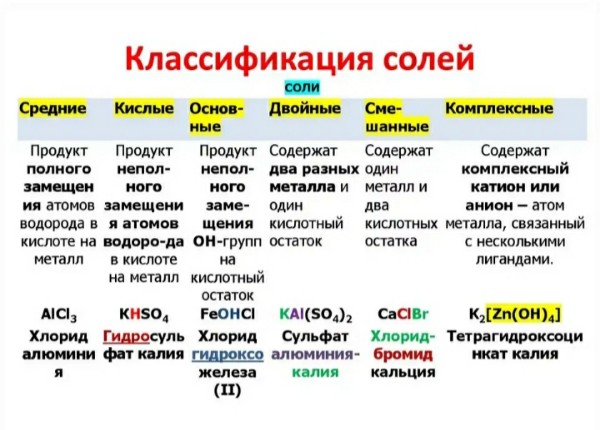 При определении того, сколько атомов потребуется для каждого элемента, просто вспомните крестообразную формулу — заряд каждого элемента дает вам количество атомов, необходимых для другого элемента!
При определении того, сколько атомов потребуется для каждого элемента, просто вспомните крестообразную формулу — заряд каждого элемента дает вам количество атомов, необходимых для другого элемента!
Характеристики солей
| Химическая промышленность | Физическое |
|---|---|
| * Состоит из двух ионов * Изготовлен из металла и неметалла * Электрический заряд 0 * Сильные ионные связи | * Кристаллическая структура * Может проводить электричество * Электролиты * Твердые и хрупкие твердые тела |
Результаты обучения
Анализ этого урока о соли в химии может подготовить вас к:
- Понять химическую структуру соли
- Распознавать ионы, составляющие соль
- Перечислите некоторые физические свойства солей
- Объясните поведение ионов, образующих соли
- Рассчитайте химическую формулу соли
7 видов соли в химии
Определение солей
Соли — это химические соединения (ионные), состоящие из положительных и отрицательных ионов. Соль — это результат реакции кислоты и основания. Положительный ион происходит от основания, а отрицательный ион — от кислоты. Например, в нашей поваренной соли NaCl ион Na + происходит от NaOH (основания), а отрицательный ион (Cl-) происходит от HCl (кислоты). Соли могут быть получены из морской воды или из горных пород. В этой статье мы обсудим 7 типов солей на основе различных классификаций с некоторыми примерами.
Соль — это результат реакции кислоты и основания. Положительный ион происходит от основания, а отрицательный ион — от кислоты. Например, в нашей поваренной соли NaCl ион Na + происходит от NaOH (основания), а отрицательный ион (Cl-) происходит от HCl (кислоты). Соли могут быть получены из морской воды или из горных пород. В этой статье мы обсудим 7 типов солей на основе различных классификаций с некоторыми примерами.
Виды соли
- Простые соли
- Кислые соли
- Основные соли
- Нейтральные соли
- Двойные соли
- Комплексные соли
- Смешанные соли
Соли можно разделить на следующие типы:
Простые соли
Простые соли образуются в результате простого взаимодействия кислоты и основания.Наиболее распространенным примером простой соли является NaCl, который является производным HCl (кислота) и NaOH (основание). В зависимости от предшественника солей простые соли можно дополнительно разделить на три типа солей: кислые соли, основные соли и нейтральные / нормальные соли.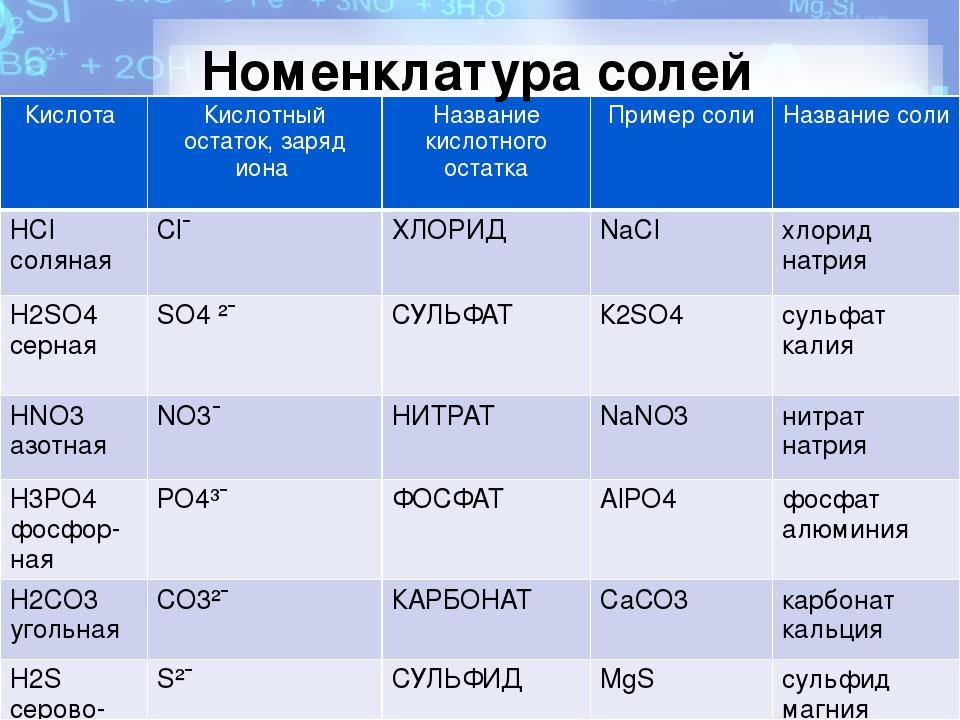
Нейтральные соли
Образующиеся нейтральные соли не содержат замещаемых протонов (атомов водорода) или гидроксильных ионов. У них pH около 7, и они не обладают кислотным или щелочным характером.
Примеры нейтральных солей
- Хлорид натрия (NaCl)
- Нитрат натрия (NaNO3)
- Сульфат калия (K2SO4)
- Хлорид калия (KCl)
- Хлорат калия (KClO3)
- Фосфат кальция (Ca3 (PO4) 2)
- Ортоборат натрия (Na3BO3)
- Nah4PO2 (Ион h4PO2- является производным от кислоты h5PO2, которая является одноосновной, поэтому оба атома H не заменяются)
- Перхлорат калия (KClO 4 )
Кислотные соли
Кислые соли являются результатом реакции между сильной кислотой и слабым основанием.Таким образом, происходит неполная нейтрализация кислот, в результате чего соли имеют pH ниже 7 и проявляют кислотные свойства. Эти соли содержат один или несколько замещаемых атомов водорода из-за неполной нейтрализации. Вы можете узнать больше о кислотных солях здесь.
Эти соли содержат один или несколько замещаемых атомов водорода из-за неполной нейтрализации. Вы можете узнать больше о кислотных солях здесь.
Примеры кислотных солей
- Карбонат натрия (NaHCO3)
- Бисульфат натрия (NaHSO4)
- Дигидрофосфат натрия (Nah4PO4)
- Гидрофосфат двунатрия (Na2HPO4)
- Бисульфит калия (KHSO4)
- Хлорид аммония (Nh84
- ) Nh5) 2SO4)
Основные соли
Основные соли являются результатом реакции между сильным основанием и слабой кислотой.Таким образом, происходит неполная нейтрализация оснований, в результате чего соли имеют pH выше 7 и проявляют щелочные свойства. Эти соли обычно содержат один или несколько гидроксильных ионов. Вы можете узнать больше об основных солях здесь.
Примеры основных солей
- гидроксид цинка хлорида (Zn (OH) Cl)
- цианид калия (KCN)
- гидроксид натрия (NaOH)
- оксихлорид магния (Mg (OH) Cl)
- гидроксид железа (II) (Fe (OH) 2Cl )
- Ацетат натрия (NaOOCCH 3 )
- Оксихлорид висмута (Bi (OH) 2Cl)
Двойные соли
Двойные соли содержат более одного катиона или аниона в составе. Это происходит из-за реакции между двумя простыми солями, и получающаяся формула обычно очень сложна. Такие соли обычно наиболее стабильны в твердой форме.
Это происходит из-за реакции между двумя простыми солями, и получающаяся формула обычно очень сложна. Такие соли обычно наиболее стабильны в твердой форме.
Примеры двойной соли
- Калий фторид церия (KCeF4)
- Соль Мора ((Nh5) 2Fe (SO4) 2,6h4O)
- Калийные квасцы, (K2SO4Al2 (SO4) 3,24h4O)
- Калий иодид иттербия (K4 [Yb121 9050] Смешанные соли
Смешанные соли состоят из двух анионов с общим катионом или двух катионов с общим анионом.Эти соли возникают в результате реакции между более чем одной кислотой или основанием, которая приводит к дисбалансу количества катионов или анионов.
Примеры смешанных солей
- Обесцвечивающий порошок (Ca (ClO) 2)
- Динатрий кальция EDTA
- Сульфат натрия-калия (NaKSO4)
Комплексные соли
Комплексные соли представляют собой комбинацию ионов и молекулярных соединений.
 Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.
Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.Примеры комплексных солей
- Тетрааминсульфат меди ([Cu (NH 3 ) 4 ] SO 4 )
- Ферроцианид калия (K 4 [Fe (CN) 6 ])
- Гексамин хром (III) хлорид [Cr (Nh5) 6] Cl3]
- Карбонил никеля [Ni (CO) 4]
Какие существуют типы пищевой соли?
Соли, которые мы используем на кухне, можно разделить на множество различных видов солей на основе незначительных различий в составе и происхождении соли.
- Поваренная соль
- Кошерная соль
- Копченая соль
- Маринованная соль
- Гималайская розовая соль
- Морская соль
- Черная соль
Гималайская розовая соль
Изображение monicore с сайта PixabayЧто такое очищающая соль?
Чистящие соли — это соли, которые обычно используются для обработки жесткой воды и чистых металлических поверхностей посредством реакций ионного обмена.
 Жесткая вода обычно содержит соли, такие как магний и кальций.Очищающие соли подвергаются катионообменной реакции, чтобы избавиться от этих катионов в воде. Эти соли непригодны для употребления и должны использоваться только для очистки.
Жесткая вода обычно содержит соли, такие как магний и кальций.Очищающие соли подвергаются катионообменной реакции, чтобы избавиться от этих катионов в воде. Эти соли непригодны для употребления и должны использоваться только для очистки.Стиральная сода, используемая для очистки поверхностей
Изображение Monfocus с сайта PixabayРаствор поваренной соли также можно использовать для простых целей очистки. Обычно стиральная сода (карбонат натрия) используется в наших домах для уборки.
См. Также
.
Классификация солей — A Plus Topper
Классификация солейЧто такое соль?
Соль образуется в реакции нейтрализации между кислотой и основанием. Соль — это общий термин, используемый для веществ, которые образуются при взаимодействии кислоты и основания.
Эта реакция называется реакцией нейтрализации .
Кислота + основание → соль + вода
Соль — это ионное соединение , состоящее из катиона , такого как ион металла или ион аммония из основания и анион из кислоты .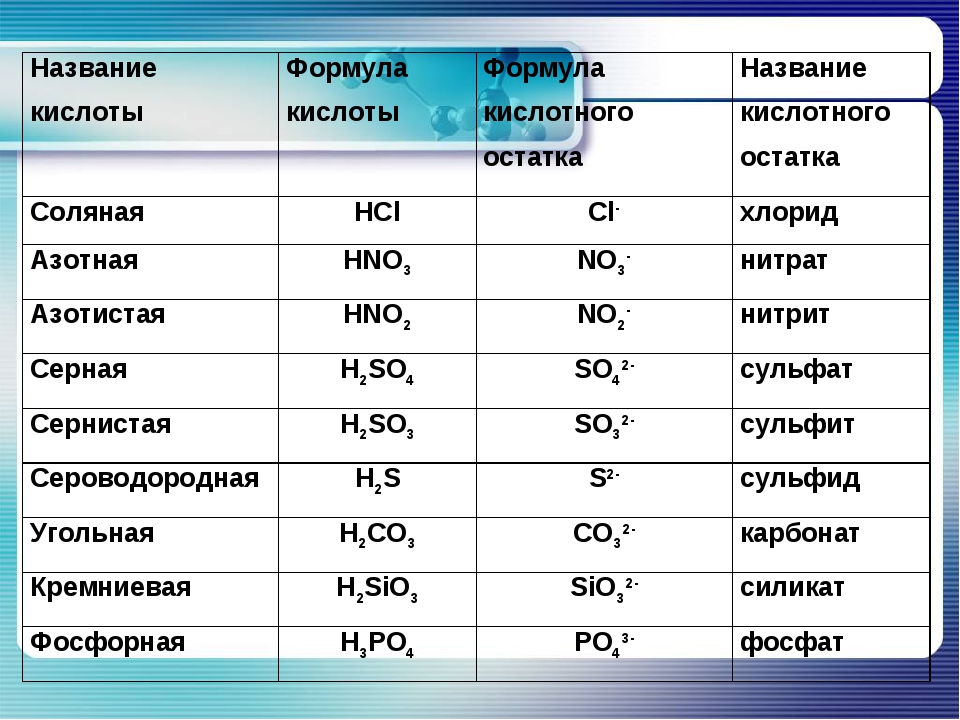
Пример:
Реакция между уксусом и пищевой содой является реакцией нейтрализации. Уксус, как мы уже знаем, содержит кислоту, а пищевая сода — основание. Когда уксус вступает в реакцию с пищевой содой, образуется соль. Вода и углекислый газ также являются продуктами этой реакции.
Точно так же обычная поваренная соль образуется при реакции соляной кислоты (HCl) с гидроксидом натрия (NaOH).
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (l)
Следовательно, соль можно определить следующим образом.
Соль представляет собой соединение, образующееся, когда ион водорода в кислоте заменяется на ион металла или ион аммония.
Люди также спрашивают
Таблица: Примеры солей из различных кислот
| Кислота | Соль | |||
| Соляная кислота | HCl | хлорид соли Натрий хлорид Аммоний хлорид | NaCl NH 3 Cl | |
| Азотная кислота | HNO 3 | Нитрат соли | Калий нитрат Алюминий | 38 Нитрат алюминия 6038 3|
| Серная кислота | H 2 SO 4 | Сульфат соли | Аммоний сульфат Магний сульфат NH67 | 4 ) 2 SO 4|
| Угольная кислота | H 2 CO 3 | Карбонат соли | Железо (ll) c арбонат Кальций Карбонат | FeCO 3 CaCO 3 |
| Фосфорная кислота | H 3 PO 4 | Фосфат соли | Железо (lll) фосфат Аммоний фосфат | FePO 4 (NH 4 ) PO 4 |
| Этановая кислота | CH 3 COOH | Этаноат соли | Свинец (II) этаноат Медь (II) этаноат | Pb (CH 3 ) 2 Cu (CH 3 COO) 2 |
Соли могут быть кислыми, основными или нейтральными. Кислые соли образуются, когда сильная кислота реагирует со слабым основанием. Основные соли образуются, когда сильное основание реагирует со слабой кислотой. Когда сильная кислота реагирует с сильным основанием, образуются нейтральные соли.
Кислые соли образуются, когда сильная кислота реагирует со слабым основанием. Основные соли образуются, когда сильное основание реагирует со слабой кислотой. Когда сильная кислота реагирует с сильным основанием, образуются нейтральные соли.
Типы солей:
Существуют различные типы солей: нормальная соль, кислая соль, основная соль и двойная соль.
1. Нормальная соль : Соль, не содержащая заменяемых атомов водорода или гидроксильных групп, называется нормальной солью.
Примеры:
Na 2 SO 4 , полученный в реакции между H 2 SO 4 и NaOH, является нормальной солью, поскольку она образуется в результате полного замещения обоих атомов H в H 2 SO 4 ,
Аналогичным образом, сульфат кальция (CaSO 4 ), фосфат натрия (Na 3 PO 4 ) и фосфат калия (K 3 PO 4 ) также являются нормальными солями.
2. Кислотная соль: Когда многоосновная кислота не полностью нейтрализована основанием, полученная соль будет содержать замещаемые атомы водорода.Следовательно, он может также принимать участие в реакции с основанием в виде кислоты. Такая соль называется кислой солью. Например, соль NaHSO 4 , полученная в реакции между NaOH и H 2 SO 4 , является кислой солью, потому что она способна к дальнейшей реакции с основанием NaOH с образованием нормальной соли Na 2 SO 4 .
H 2 SO 4 + NaOH → NaHSO 4 + H 2 O
NaHSO 4 + NaOH → Na 2 SO 4 + H 2 O
Таким образом, кислотная соль может быть определена следующим образом.
Соль, содержащая замещаемые атомы водорода, называется кислотной солью.
Примеры:
NaHSO 4 , NaH 2 PO 4 и Na 2 HPO 4 являются примерами кислотных солей.
3. Основная соль: Когда поликислотное основание реагирует с меньшим количеством кислоты, чем необходимо для полной нейтрализации, полученная соль также содержит гидроксильную группу (группы) (ОН). Такая соль называется основной солью.
Примеры:
1 моль Pb (OH) 2 требует 2 моля HCl для полной нейтрализации.Но когда 1 моль Pb (OH) 2 вступает в реакцию с 1 моль HCl, некоторое количество Pb (OH) 2 остается непрореагировавшим. Получаемая соль представляет собой не PbCl 2 , а Pb (OH) Cl.
Аналогичным образом, когда один моль Bi (OH) 3 реагирует с 1 моль HNO 3 , образуется соль Bi (OH) 2 NO 3 .
Bi (OH) 3 + HNO 3 → Bi (OH) 2 NO 3 + H 2 O
Соли, такие как Pb (OH) Cl и Bi (OH) 2 NO 3 содержат группу ОН.Эти соли называются основными солями, потому что они могут далее реагировать с кислотами с образованием H 2 O и соответствующих нормальных солей.
Pb (OH) Cl + HCl → PbCl 2 + H 2 O
Bi (OH) 2 NO 3 + HNO 3 → Bi (OH) (NO 3 ) 2 + H 2 O
Bi (OH) (NO 3 ) 2 + HNO 3 → Bi (NO 3 ) 3 + H 2 O
Таким образом, a основная соль образуется, когда поликислотное основание реагирует с меньшим количеством кислоты, чем необходимо для образования нормальной соли.
4. Двойная соль: В двойной соли есть два разных отрицательных и / или положительных иона. Например, минеральный доломит CaCO 3 · MgCO 3 содержит ионы Ca 2+ и Mg 2+ . Следовательно, это двойная соль. Калийные квасцы, K 2 SO 4 · Al 2 (SO 4 ) 3 .24H 2 O, также является двойной солью.
Двойные соли существуют только в твердом состоянии. При растворении в воде они распадаются на смесь двух отдельных солей.Например, когда калийные квасцы растворяются в воде, они распадаются следующим образом.
При растворении в воде они распадаются на смесь двух отдельных солей.Например, когда калийные квасцы растворяются в воде, они распадаются следующим образом.
- Соли — это ионные соединения, и они могут растворяться в воде. Однако в результате экспериментов, проведенных химиками, не все соли оказались растворимыми в воде.
- Например, хлорид натрия NaCl легко растворяется в воде, но хлорид серебра AgCl не растворяется в воде.
- В таблице перечислены некоторые распространенные растворимые и нерастворимые соли.
Таблица: Растворимость солей в воде
| Тип соли | Растворимость в воде |
| Соли аммония | Все растворимы. |
| Соли натрия и калия | Все растворимы. |
| Соли этаноата | Все растворимы. |
| Нитратные соли | Все растворимы. |
| Хлоридные соли | Все растворимы, кроме AgCl, HgCI и PbCl 2 |
| Сульфатные соли | Все растворимы, кроме PbSO 4 , CaSO 4 , BaSO 4 и Ag2SO 4 |
| Карбонатные соли | Все нерастворимы, кроме Na 2 CO 3 , K2CO 3 и (NH 4 ) 2CO 3 |
| Соли свинца (II) | Все нерастворимы, кроме Pb (NO 3 ) 2 и Pb (CH 3 COO) 2 |
Активность
Цель: Продемонстрировать реакцию нейтрализации
Необходимые материалы: Гидроксид натрия, разбавленная соляная кислота и фенолфталеин
Метод:
Возьмите 30 мл разбавленного раствора гидроксида натрия в коническую колбу и добавьте в него каплю фенолфталеина.Теперь по каплям налейте в него соляную кислоту, используя пипетку, до тех пор, пока цвет раствора не изменится.
Наблюдение: Раствор становится розовым при добавлении фенолфталеина к гидроксиду натрия. Раствор становится бесцветным, когда весь гидроксид натрия прореагирует. При тестировании бесцветного раствора лакмусовой бумагой нет изменений ни с красной, ни с синей лакмусовой бумагой.
Заключение: Цвет лакмусовой бумаги не изменился, что свидетельствует о том, что раствор стал нейтральным.
Классные ресурсы | Гидролиз солей
Урок
. Фон Эта лаборатория исследует, как растворенные соли влияют на pH водных растворов. Когда соль растворяется в воде, раствор не всегда бывает нейтральным. Это связано с тем, что молекулы воды могут действовать как доноры протонов (H + ) или акцепторы протонов. Соли могут вызывать образование ионов H + и OH — в результате реакции одного из его ионов с водой.Эта реакция называется гидролизом («расщепление водой») .
Соль, образованная слабой кислотой и сильным основанием, обычно образует щелочные водные растворы. Основной анион принимает протон от молекулы воды, образуя слабую кислоту и оставляя ионы OH — из молекул воды в растворе. Раствор будет основным из-за увеличения концентрации ионов ОН — . Например, соль NaNO 2 может быть образована из слабой кислоты HNO 2 и сильное основание NaOH.Если NaNO 2 добавлен в воду, нитрит-ион, NO 2 — , реагирует с водой с образованием гидроксид-ионов:
НЕТ 2 — + H 2 O ⇌ HNO 2 + OH —
Ионы натрия не реагируют с водой, так как NaOH является сильным и полностью диссоциированным в воде. Следовательно, нитрит натрия составляет основного в воде.
Аналогичным образом, соли, образованные из сильной кислоты и слабого основания, обычно образуют кислые водные растворы. Кислый катион отдает протон молекуле воды, образуя слабое основание и создавая в растворе ионы H 3 O + . Например, соль NH 4 NO 3 может быть образована из сильной кислоты HNO 3 и слабого основания NH 3 (в воде). Нитрат-ионы не реагируют с водой, поскольку HNO 3 — сильная кислота.Однако ионы аммония реагируют с водой с образованием ионов гидроксония. Следовательно, нитрат аммония кислый в воде:
Кислый катион отдает протон молекуле воды, образуя слабое основание и создавая в растворе ионы H 3 O + . Например, соль NH 4 NO 3 может быть образована из сильной кислоты HNO 3 и слабого основания NH 3 (в воде). Нитрат-ионы не реагируют с водой, поскольку HNO 3 — сильная кислота.Однако ионы аммония реагируют с водой с образованием ионов гидроксония. Следовательно, нитрат аммония кислый в воде:
NH 4 + + H 2 O ⇌ NH 3 + H 3 O +
Кроме того, молекулы воды могут принимать протоны от гидратированных катионов металлов; представьте, что молекулы воды, окружающие ионы металлов, заменяются ионами гидроксида.
Для ионов металла (II): M (H 2 O) 6 2+ + H 2 O ⇌ M (H 2 O) 5 (OH) + + H 3 O +
Для ионов металла (III): M (H 2 O) 6 3+ + H 2 O ⇌ M (H 2 O) 5 (ОН) +2 + H 3 O +
Цель этого эксперимента — наблюдать за гидролизом и определять, какие солевые растворы являются нейтральными, кислотными или основными. Ваша задача — предсказать, будет ли каждая соль кислотной, щелочной или нейтральной в растворе, проверить свои прогнозы и затем доложить классу.
Ваша задача — предсказать, будет ли каждая соль кислотной, щелочной или нейтральной в растворе, проверить свои прогнозы и затем доложить классу.
- мензурки 100 мл
- Шпатели
- Стеклянные стержни для перемешивания
- pH Hydrion paper
- Вода дистиллированная
- Соли (см. Таблицу)
- Лента этикеточная и маркеры
- Универсальный индикатор
- Парафильм
- Большая бумага для плакатов или белая доска
- Всегда надевайте защитные очки и фартук при работе с химическими веществами в этой лаборатории.Все соли могут вызывать раздражение кожи и глаз.
- Тщательно вымойте руки перед тем, как покинуть лабораторию.
- Следуйте инструкциям учителя по очистке материалов и утилизации химикатов.
- Хлорат калия — сильный окислитель; не нагревайте и не протыкайте шпателем.

- Оксалат натрия — яд. Обязательно вымойте руки и хорошо протрите прилавки после лаборатории.
Вы являетесь частью исследовательской группы.Каждой команде было поручено исследовать три соли. Для каждой из назначенных вам солей предскажите, будет ли соль кислотной, основной или нейтральной в воде.
- Напишите свои прогнозы для каждой соли, а также причины своих прогнозов, в полных предложениях ниже. (Оставьте немного места после каждого из них для исправлений, если это необходимо, когда вы перейдете к разделу «Объяснение» лаборатории).
- Четко пометьте стакан с названием и номером каждой соли.
- Смешайте небольшое количество (мерную ложку размером с горошину) каждой соли примерно с 30-50 мл деионизированной воды в стакане емкостью 100 мл и перемешайте стеклянной палочкой для перемешивания.
 Не перемешивайте металлическим шпателем.
Не перемешивайте металлическим шпателем. - Добавьте 3-4 капли универсального индикатора. Обратите внимание на цвет. При необходимости добавьте больше индикатора, чтобы увидеть определенный цвет. Сравните цвета с этой таблицей. Запишите цвет в предоставленной таблице данных.
- Определите приблизительный pH, используя стеклянную палочку для перемешивания, поместив каплю раствора на pH-гидрионную бумагу.Запишите свои данные и наблюдения в приведенную ниже таблицу «Сбор данных».
- Сохраните мензурки, чтобы использовать их в отчетах. Обложка парафильмом.
- Смойте стержни для перемешивания и шпатели.
- Выбросьте использованную pH-бумагу.
- Для каждой соли сравните свои прогнозы (участие / предварительный вопрос) с вашими результатами. Напишите пару предложений о том, насколько ваши прогнозы похожи или отличаются от ваших результатов для каждой реакции.Если они разные, также объясните, почему, по вашему мнению, pH оказался таким же.

- Напишите чистые ионные уравнения для каждого иона каждой из присвоенных вам солей в воде. (Уравнения для других солей будут завершены после презентаций классов) Добавьте только один протон к основным анионам. Убедитесь, что ваши уравнения согласуются с вашими результатами (образуются ионы гидроксония, если он кислый, ионы гидроксида образуются, если он был основным, нет чистого ионного уравнения, если он был нейтральным).
| Соль | Чистые ионные уравнения в воде | |
| 1 | NaCl | |
| 2 | NaC 2 H 3 O 2 | |
| 3 | AlCl 3 | |
| 4 | Na 2 C 2 O 4 | |
| 5 | Na 2 CO 3 | |
| 6 | КНО 3 | |
| 7 | NH 4 Cl | |
| 8 | NaHCO 3 | |
| 9 | ЗнСО 4 | |
| 10 | CuSO 4 | |
| 11 | Na 3 PO 4 | |
| 12 | KClO 3 |
- Вы сообщите о своих выводах остальному классу.
 Заранее решите, какая информация будет сообщаться каждым участником — каждый человек должен сообщить о каком-либо разделе вашего исследования. Используйте ваши мензурки и большую плакатную бумагу / белую доску, предоставленные для облегчения вашей презентации. Обязательно укажите в своем отчете:
Заранее решите, какая информация будет сообщаться каждым участником — каждый человек должен сообщить о каком-либо разделе вашего исследования. Используйте ваши мензурки и большую плакатную бумагу / белую доску, предоставленные для облегчения вашей презентации. Обязательно укажите в своем отчете:- Ваши прогнозы и объяснения
- Ваши наблюдения
- Ваши изменения в прогнозах с пояснениями
- Ваши уравнения (крупно на плакатной бумаге /)
- Как сообщают другие группы, запишите их выводы в отведенном для этого месте в таблице данных.Обращать внимание!
- Задайте вопросы подотчетным группам. Попросите их объяснить свои прогнозы и окончательные уравнения.
- Очистка: как только все сообщат, вылейте раствор в раковину, удалите этикетки и хорошо промойте водой. Вымойте руки и хорошо протрите столешницы.
- Заполните приведенную ниже таблицу сбора данных для всех солей.
 Только переместите на один протон , чтобы сделать родителей!
Только переместите на один протон , чтобы сделать родителей! - Вернитесь и запишите чистые ионные уравнения для обоих ионов из каждой соли этой лаборатории в воде (все двенадцать ) в предоставленной таблице.Если нет Net Ionic Equation, напишите «No NIE».
- В пространстве после таблицы «Сбор данных» напишите абзац о том, что вы узнали из этой лабораторной работы. Используйте свои результаты, а также результаты других групп в качестве примеров. Как можно улучшить эту лабораторию?
| Сбор данных | |||||||
| Раствор соли нормальный | Цвет с U.I. | Примерный pH (гидрион) | Исходная кислота | Исходная кислота: сильная или слабая? | Материнская база | Материнская база: сильная или слабая? | |
| 1 | NaCl | ||||||
| 2 | NaC 2 H 3 O 2 | ||||||
| 3 | AlCl 3 | ||||||
| 4 | Na 2 C 2 O 4 | ||||||
| 5 | Na 2 CO 3 | ||||||
| 6 | КНО 3 | ||||||
| 7 | NH 4 Cl | ||||||
| 8 | NaHCO 3 | ||||||
| 9 | ЗнСО 4 | ||||||
| 10 | CuSO 4 | ||||||
| 11 | Na 3 PO 4 | ||||||
| 12 | KClO 3 | ||||||
Что такое соль в химии? — Определение и формула — Видео и стенограмма урока
Как соль связана?
Прежде чем мы сможем понять клей, который связывает ионы вместе, нам нужно узнать, почему определенные атомы вообще становятся ионами. Ионы образуются одним из двух способов.
Ионы образуются одним из двух способов.
Во-первых, атом может потерять электрон и стать катионом. Помните, что электроны заряжены отрицательно, поэтому, если атом теряет отрицательный заряд, он становится положительным.
Атом также может получить электрон, чтобы стать анионом. Это происходит из-за распределения электронов в атоме и магического числа восемь. Химики часто ссылаются на правило октетов , которое, проще говоря, просто означает, что атом достигнет стабильности, когда он сможет получить восемь валентных или внешних электронов.Атом будет похож на ближайший к нему благородный газ в периодической таблице. Один из способов достижения этого — потеря или получение электронов с образованием иона.
Мы уже узнали, что металлы образуют катионы, теряя электроны. Например, натрий является металлом группы 1 и, как и все металлы группы 1, имеет один валентный электрон. Этот электрон не очень плотно удерживается атомом и легко теряется, образуя катион Na1 +.
Хлор — неметалл, он находится в группе 17 (или 7A) периодической таблицы Менделеева. У него семь валентных электронов, и ему нужен только один электрон, чтобы достичь волшебной восьмерки для стабильности! Получение этого дополнительного электрона сформирует анион Cl1-. Обратите внимание, что оба иона (Na1 + и Cl1-) имеют одинаковый числовой заряд, только противоположные знаки.
У него семь валентных электронов, и ему нужен только один электрон, чтобы достичь волшебной восьмерки для стабильности! Получение этого дополнительного электрона сформирует анион Cl1-. Обратите внимание, что оба иона (Na1 + и Cl1-) имеют одинаковый числовой заряд, только противоположные знаки.
Итак, что происходит, когда металлический атом натрия встречается с газообразным атомом хлора? Происходит бурная реакция, когда оба атома образуют ионы. Натрий передает свой лишний электрон хлору, который дает хлору его волшебные восемь валентных электронов и дает натрию положительный заряд.Эти ионы немедленно притягиваются друг к другу, и образуется соль хлорида натрия . Ионы склеены между собой ионными связями , которые представляют собой электростатическое притяжение между противоположно заряженными ионами, которое представляет собой электростатическое притяжение между противоположно заряженными ионами.
Каковы свойства соли?
Физические и химические свойства материалов тесно связаны с тем, как они связаны друг с другом. Теперь мы знаем, что ионы в соли сильно притягиваются друг к другу, образуя прочные ионные связи. Для разрыва ионной связи требуется много энергии, и чем сильнее притяжение, тем прочнее связь. Это притяжение между ионами означает, что соединение с ионными связями будет иметь прочную упорядоченную структуру.
Соли часто образуют кристаллическую структуру или кристаллическую решетку , высокоупорядоченное образование молекул. Вот почему на нашем картофеле фри появляются кристаллы соли.
Эта упорядоченная структура и сильная ионная связь приводит к тому, что многие соли обладают некоторыми особыми свойствами. Во-первых, они обычно представляют собой кристаллических твердых частиц с кристаллической структурой. Твердые частицы также имеют тенденцию быть твердыми и хрупкими из-за сильной ионной связи по всему кристаллу.Соли также имеют высокие точки кипения и плавления , потому что требуется много энергии, чтобы разорвать эти связи и изменить состояние вещества соли. Наконец, соли — это электролиты , то есть они растворяются в воде с образованием свободно движущихся ионов, которые могут проводить электричество.
Во-первых, они обычно представляют собой кристаллических твердых частиц с кристаллической структурой. Твердые частицы также имеют тенденцию быть твердыми и хрупкими из-за сильной ионной связи по всему кристаллу.Соли также имеют высокие точки кипения и плавления , потому что требуется много энергии, чтобы разорвать эти связи и изменить состояние вещества соли. Наконец, соли — это электролиты , то есть они растворяются в воде с образованием свободно движущихся ионов, которые могут проводить электричество.
Имейте в виду, что расплавленные соли также проводят электричество, а твердые соли — нет; ионы должны быть свободными, чтобы проводить электричество.
Поиск химической формулы соли
До сих пор мы говорили только о хлориде натрия, сокращенно NaCl, но все комбинации металлов и неметаллов образуют соли.Примеры включают йодид магния, сокращенно MgI2, и оксид алюминия, Al2O3. Помните, что мы всегда сначала пишем катион, а затем анион. Число после атома говорит нам, сколько атомов этого типа содержится в этом соединении; где нет числа, есть только один атом.
Число после атома говорит нам, сколько атомов этого типа содержится в этом соединении; где нет числа, есть только один атом.
Для оксида алюминия есть два атома алюминия и три атома кислорода, но почему это число? Почему не по одному из них или по одному алюминию и двум атомам кислорода? Поскольку общая соль всегда электрически нейтральна; другими словами, положительный заряд должен равняться отрицательному, поэтому они компенсируют друг друга.Имея разные заряды для каждого атома, некоторые соли потребуют разного количества атомов для каждого элемента.
Периодическая таблица Менделеева — лучший инструмент химика для определения зарядов ионов и предсказания химической формулы солей, которые они образуют.
В периодической таблице элементы организованы в вертикальные группы. Металлы основной группы — металлы в группах 1 и 2, а также алюминий, образуют только один положительный ион. Nonmetals всегда образует только один отрицательный ион. Вот краткое изложение различных групп зарядов периодической таблицы.
Вот краткое изложение различных групп зарядов периодической таблицы.
| Номер группы | Ионный заряд | Примеры |
|---|---|---|
| 1 | 1+ | Li +, Na +, К + |
| 2 | 2+ | Mg2 +, Ca2 +, Ba2 + |
| 13 | 3+ | Al3 + |
| 16 | 2– | O2-, S2- |
| 17 | 1– | F-, Cl-, Br-, I- |
К сожалению, жизнь не всегда так проста для металлов в середине таблицы — так называемых переходных металлов .Эти металлы способны образовывать более одного заряженного катиона, поэтому мы не можем сказать, просто взглянув на их расположение в периодической таблице. Вместо этого химики используют римские цифры в сочетании с названиями элементов, чтобы указать заряд атома. Например, возьмем атом хлорида железа (III). Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Римская цифра после железа — III — говорит нам, что заряд катиона железа 3+.
Как только мы узнаем заряд двух ионов в соли, мы можем написать химическую формулу с правильным числом атомов, чтобы убедиться, что два в целом имеют нулевое изменение.Особенно простой способ сделать это — использовать метод перекрещивания : здесь заряд одного иона становится числом, следующим за другим. Когда число равно 1, мы просто отбрасываем его.
Давайте рассмотрим несколько примеров, начиная с бромида лития, соли, состоящей из Li1 + и Br1-. Поскольку оба заряда равны 1, мы опускаем оба числа и видим, что соль состоит из одного атома лития и одного атома брома.
Давайте сравним это с сульфидом алюминия, солью, состоящей из Al3 + и S2-.Используя метод крест-накрест, мы берем номера каждого элемента и меняем их местами, чтобы определить количество атомов в соединении. Что мы получаем? Два атома алюминия и три атома серы, что означает, что сульфид алюминия будет называться сокращенно Al2S3.
Рассмотрим еще один пример. Оксид кальция состоит из Ca2 + и O2-. Метод «крест-накрест» даст нам результат по два атома в каждом, Ca2O2; но мы можем разделить на общий знаменатель два, чтобы получить результат всего по одному атому и составному символу CaO.
Краткое содержание урока
Соль — это соединение, состоящее из двух ионов — положительно заряженного и отрицательно заряженного иона. Притяжение между двумя ионами образует сильных ионных связей , придавая солям твердую и хрупкую кристаллическую структуру. Соли обладают другими специфическими свойствами из-за этих ионных связей, включая высокие температуры плавления и кипения, а также способность проводить электричество как в расплавленной форме, так и при растворении в воде.
Химические формулы солей часто можно предсказать, найдя заряд одного иона по его положению в периодической таблице, а затем убедившись, что общий заряд соли равен нулю . При определении того, сколько атомов потребуется для каждого элемента, просто вспомните крестообразную формулу — заряд каждого элемента дает вам количество атомов, необходимых для другого элемента!
Характеристики солей
| Химическая промышленность | Физический |
|---|---|
| * Состоит из двух ионов * Изготовлен из металла и неметалла * Электрический заряд 0 * Сильные ионные связи | * Кристаллическая структура * Может проводить электричество * Электролиты * Твердые и хрупкие твердые тела |
Результаты обучения
Анализ этого урока о соли в химии может подготовить вас к:
- Понять химическую структуру соли
- Распознавать ионы, составляющие соль
- Перечислить некоторые физические свойства солей
- Объясните поведение ионов, образующих соли
- Рассчитать химическую формулу соли
7.
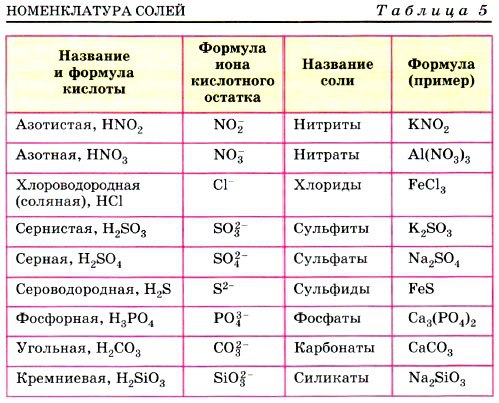 -] \]
-] \]\ [pH = 12,77 \]
14.4 Гидролиз солей — Химия 2e
Задачи обучения
К концу этого раздела вы сможете:
- Предсказать, будет ли солевой раствор кислым, основным или нейтральным
- Рассчитайте концентрации различных веществ в солевом растворе
- Опишите кислотную ионизацию гидратированных ионов металлов
Соли кислотных ионов
Соли — это ионные соединения, состоящие из катионов и анионов, каждый из которых может подвергаться кислотной или основной ионизационной реакции с водой.Следовательно, водные солевые растворы могут быть кислыми, основными или нейтральными, в зависимости от относительной кислотно-щелочной силы ионов, составляющих соль. Например, растворение хлорида аммония в воде приводит к ее диссоциации, как описано уравнением
Nh5Cl (т) ⇌Nh5 + (водн.) + Cl- (водн.) Nh5Cl (т) ⇌Nh5 + (водн.) + Cl- (водн.)Ион аммония представляет собой сопряженную кислоту основного аммиака, NH 3 ; реакция его кислотной ионизации (или кислотного гидролиза) представлена
Nh5 + (водн. ) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / KbNh5 + (aq) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / Kb
) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / KbNh5 + (aq) + h3O (l) ⇌h4O + (aq) + Nh4 (aq) Ka = Kw / KbПоскольку аммиак является слабым основанием, можно измерить K b и K a > 0 (ион аммония является слабой кислотой).
Хлорид-ион является сопряженным основанием соляной кислоты, поэтому реакция его основной ионизации (или гидролиза основанием ) представлена как
Cl− (aq) + h3O (l) ⇌HCl (aq) + OH− (aq) Kb = Kw / KaCl− (aq) + h3O (l) ⇌HCl (aq) + OH− (aq) Kb = Kw / КаПоскольку HCl является сильной кислотой, K a неизмеримо велико и K b ≈ 0 (ионы хлора не подвергаются заметному гидролизу).
Таким образом, растворение хлорида аммония в воде дает раствор слабых кислотных катионов (Nh5 + Nh5 +) и инертных анионов (Cl — ), в результате чего получается кислый раствор.
Пример 14.15
Расчет pH кислого солевого раствора
Анилин — это амин, который используется для производства красителей. Он выделяется в виде хлорида анилиния, [C6H5Nh4] Cl, [C6H5Nh4] Cl, соли, полученной реакцией слабого основного анилина и соляной кислоты. Каков pH 0,233 M раствора хлорида анилина C6H5Nh4 + (водн.) + H3O (l) ⇌h4O + (водн.) + C6H5Nh3 (водн.) C6H5Nh4 + (водн.) + H3O (l) ⇌h4O + (водн.) + C6H3 )Раствор
K a для иона анилиния является производным от K b для его сопряженного основания, анилина (см. Приложение H): Ка = KwKb = 1.0 × 10–144,3 × 10–10 = 2,3 × 10–5Ka = KwKb = 1,0 × 10–144,3 × 10–10 = 2,3 × 10–5На основе предоставленной информации подготовлена таблица ICE для этой системы:
Подстановка этих членов равновесной концентрации в K выражение дает
Ka = [C6H5Nh3] [h4O +] / [C6H5Nh4 +] 2. 3 × 10−5 = (x) (x) /0.233−x) Ka = [C6H5Nh3] [h4O +] / [C6H5Nh4 +] 2.3 × 10−5 = (x) (x) /0,233−x)
3 × 10−5 = (x) (x) /0.233−x) Ka = [C6H5Nh3] [h4O +] / [C6H5Nh4 +] 2.3 × 10−5 = (x) (x) /0,233−x)Предполагая x << 0,233, уравнение упрощается и решается для x :
2.3 × 10−5 = x2 / 0.233x = 0,0023M2,3 × 10−5 = x2 / 0,233x = 0,0023MВ таблице ICE x определяется как молярность иона гидроксония, поэтому значение pH рассчитывается как
. pH = −log [h4O +] = — log (0,0023) = 2,64 pH = −log [h4O +] = — log (0,0023) = 2,64Проверьте свои знания
Какова концентрация ионов гидроксония в 0,100– M растворе нитрата аммония, NH 4 NO 3 , соли, состоящей из ионов Nh5 + Nh5 + и NO3 − .NO3−. Какая кислота сильнее C6H5Nh4 + C6H5Nh4 + или Nh5 +? Nh5 +?Отвечать:
[H 3 O + ] = 7.5 × × 10 −6 M ; C6H5Nh4 + C6H5Nh4 + — более сильная кислота.
Соли основных ионов
В качестве другого примера рассмотрим растворение ацетата натрия в воде:
NaCh4CO2 (т) ⇋Na + (водн.) + Ch4CO2- (водн.) NaCh4CO2 (т) ⇋Na + (водн.) + Ch4CO2- (водн.)Ион натрия не подвергается заметной кислотной или щелочной ионизации и не влияет на pH раствора. Это может показаться очевидным из формулы иона, которая указывает на отсутствие атомов водорода или кислорода, но некоторые растворенные ионы металлов действуют как слабые кислоты, о чем будет сказано далее в этом разделе.
Ацетат-ион, Ch4CO2-, Ch4CO2-, является сопряженным основанием уксусной кислоты, CH 3 CO 2 H, и поэтому реакция его ионизации основанием (или гидролиза оснований ) представлена как
Ch4CO2− (водный раствор) + h3O (l) ⇌Ch4CO2H (водный раствор) + OH− (водный раствор) Kb = Kw / KaCh4CO2− (водный раствор) + h3O (l) ⇌Ch4CO2H (водный раствор) + OH− (водный раствор) Kb = Kw / Ка Поскольку уксусная кислота является слабой кислотой, ее K a можно измерить, а K b > 0 (ацетат-ион является слабым основанием).
Растворение ацетата натрия в воде дает раствор инертных катионов (Na + ) и слабых основных анионов (Ch4CO2 -), (Ch4CO2-), приводя к базовому решению.
Пример 14,16
Равновесие в растворе соли слабой кислоты и сильного основания
Определите концентрацию уксусной кислоты в растворе с [Ch4CO2 -] = 0,050M [Ch4CO2 -] = 0,050M и [OH — ] = 2,5 × × 10 −6 M в состоянии равновесия. Реакция такая: Ch4CO2− (водн.) + H3O (l) ⇌Ch4CO2H (водн.) + OH− (водн.) Ch4CO2− (водн.) + H3O (l) ⇌Ch4CO2H (водн.) + OH− (водн.)Раствор
Приведенные равновесные концентрации и значение константы равновесия позволят рассчитать недостающую равновесную концентрацию.Рассматриваемый процесс представляет собой основную ионизацию ацетат-иона, для которой Kb (forCh4CO2 -) = KwKa (forCh4CO2H) = 1.0 × 10−141.8 × 10−5 = 5.6 × 10−10Kb (forCh4CO2 -) = KwKa (forCh4CO2H) = 1. 0 × 10−141.8 × 10−5 = 5.6 × 10− 10
0 × 10−141.8 × 10−5 = 5.6 × 10− 10Подстановка доступных значений в выражение K b дает
Kb = [Ch4CO2H] [OH -] [Ch4CO2 -] = 5,6 × 10-10 Kb = [Ch4CO2H] [OH -] [Ch4CO2 -] = 5,6 × 10-10 = [Ch4CO2H] (2,5 × 10–6) (0,050) = 5,6 × 10–10 = [Ch4CO2H] (2,5 × 10–6) (0,050) = 5,6 × 10–10Решение вышеуказанного уравнения для молярности уксусной кислоты дает [CH 3 CO 2 H] = 1.1 × × 10 −5 M .
Проверьте свои знания
Каков pH 0,083– M раствора NaCN?Соли кислотных и основных ионов
Некоторые соли состоят как из кислотных, так и из основных ионов, поэтому pH их растворов будет зависеть от относительной силы этих двух видов. Аналогичным образом, некоторые соли содержат единственный ион, который является амфипротонным, и поэтому относительная сила кислотного и основного характера этого иона будет определять его влияние на pH раствора. Для обоих типов солей сравнение значений K a и K b позволяет прогнозировать кислотно-щелочной статус раствора, как показано в следующем примере упражнения.
Для обоих типов солей сравнение значений K a и K b позволяет прогнозировать кислотно-щелочной статус раствора, как показано в следующем примере упражнения.
Пример 14,17
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:(а) KBr
(б) NaHCO 3
(в) Na 2 HPO 4
(г) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на pH раствора, как показано здесь:(a) Катион K + инертен и не влияет на pH.Ион бромида является сопряженным основанием сильной кислоты, поэтому его основная сила незначительна (нет заметной ионизации основания). Раствор нейтральный.
(b) Катион Na + инертен и не влияет на pH раствора; в то время как анион HCO3-HCO3- является амфипротонным. K a HCO3 − HCO3− составляет 4,7 × × 10 −11 , а его K b составляет 1,0 × 10−144,3 × 10−7 = 2,3 × 10−8,1,0 × 10. −144,3 × 10−7 = 2,3 × 10−8.
K a HCO3 − HCO3− составляет 4,7 × × 10 −11 , а его K b составляет 1,0 × 10−144,3 × 10−7 = 2,3 × 10−8,1,0 × 10. −144,3 × 10−7 = 2,3 × 10−8.
Начиная с K b >> K a , решение является базовым.
(c) Катион Na + инертен и не влияет на pH раствора, в то время как анион HPO42-HPO42- является амфипротонным. K a HPO42 − HPO42− составляет 4,2 × × 10 −13 ,
, а его K b составляет 1,0 × 10−146,2 × 10−8 = 1,6 × 10−7,1,0 × 10−146,2 × 10−8 = 1,6 × 10−7. Поскольку K b >> K a , решение является основным.
(d) Ион Nh5 + Nh5 + является кислым (см. Обсуждение выше), а ион F — является основным (сопряженное основание слабокислой HF). Сравнение двух констант ионизации: K a Nh5 + Nh5 + составляет 5,6 × × 10 −10 и K b для F — составляет 1,6 × × 10 −11 , поэтому раствор кислый, так как K a > K b .
Сравнение двух констант ионизации: K a Nh5 + Nh5 + составляет 5,6 × × 10 −10 и K b для F — составляет 1,6 × × 10 −11 , поэтому раствор кислый, так как K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:(а) K 2 CO 3
(б) CaCl 2
(в) KH 2 PO 4
(г) (NH 4 ) 2 CO 3
Отвечать:
(а) базовый; (б) нейтральный; (в) кислая; (г) базовая
Ионизация гидратированных ионов металлов
В отличие от ионов металлов 1 и 2 групп предыдущих примеров (Na + , Ca 2+ и т. Д.), некоторые ионы металлов действуют как кислоты в водных растворах. Эти ионы не просто слабо сольватируются молекулами воды при растворении, вместо этого они ковалентно связаны с фиксированным числом молекул воды с образованием сложного иона (см. Главу о координационной химии). Например, растворение нитрата алюминия в воде обычно представлено как
Д.), некоторые ионы металлов действуют как кислоты в водных растворах. Эти ионы не просто слабо сольватируются молекулами воды при растворении, вместо этого они ковалентно связаны с фиксированным числом молекул воды с образованием сложного иона (см. Главу о координационной химии). Например, растворение нитрата алюминия в воде обычно представлено как
Однако ион алюминия (III) на самом деле реагирует с шестью молекулами воды с образованием стабильного комплексного иона, и поэтому более явное представление процесса растворения составляет
Al (NO3) 3 (т) + 6h3O (ж) ⇌Al (h3O) 63+ (водн.) + 3NO3- (водн.) Al (NO3) 3 (т) + 6h3O (ж) ⇌Al (h3O) 63+ ( водн.) + 3NO3− (водн.)Как показано на Рисунке 14.13, Al (h3O) 63 + Al (h3O) 63+ ионы включают связи между центральным атомом Al и атомами O шести молекул воды. Следовательно, связи O – H связанных молекул воды более полярны, чем в несвязанных молекулах воды, что делает связанные молекулы более склонными к отдаче иона водорода:
Al (h3O) 63+ (вод.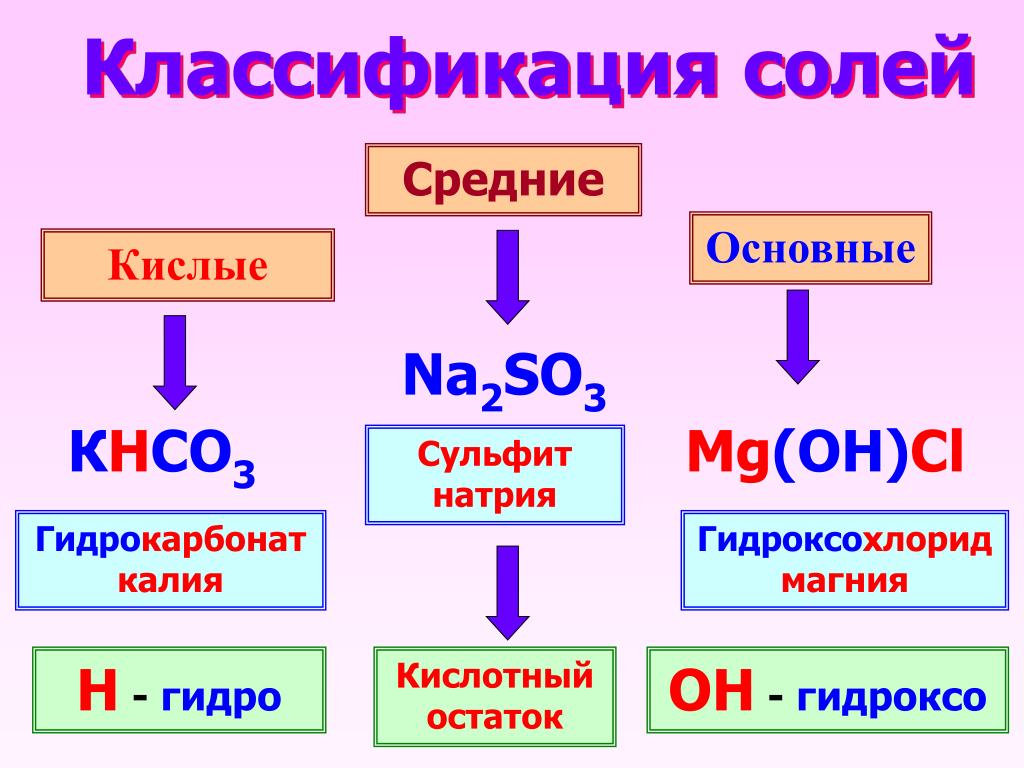 (л) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 · 10−5
(л) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 · 10−5Конъюгированное основание, полученное этим способом, содержит пять других связанных молекул воды, способных действовать как кислоты, поэтому возможен последовательный или ступенчатый перенос протонов, как показано в нескольких уравнениях ниже:
Al (h3O) 63+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Al (h3O) 63+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 5 ( ОН) 2+ (водн.) Al (h3O) 5 (OH) 2+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 4 (OH) 2+ (водн.) Al (h3O) 5 (OH) 2+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 4 (OH) 2+ (водн.) Al (h3O) 4 (OH) 2+ (водн.) + H3O (l) ⇌h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.) Al (h3O) 4 (OH) 2+ (водн.) + h3O (l) ⇌h4O + (водн.) + Al (h3O) 3 (OH) 3 (водн.)Это пример полипротонной кислоты, о которой мы поговорим в следующем разделе этой главы.
Фигура
14,13
Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.
За исключением щелочных металлов (группа 1) и некоторых щелочноземельных металлов (группа 2), большинство ионов других металлов в некоторой степени подвергается кислотной ионизации при растворении в воде. Кислотная сила этих комплексных ионов обычно увеличивается с увеличением заряда и уменьшением размера ионов металла. Уравнения кислотной ионизации первого шага для нескольких других кислотных ионов металлов показаны ниже:
Fe (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (водн.) + Fe (h3O) 5 (OH) 2+ ( aq) pKa = 2.74Fe (h3O) 63+ (водн.) + H3O (l) ⇌h4O + (aq) + Fe (h3O) 5 (OH) 2+ (aq) pKa = 2.74Cu (h3O) 62+ (водн.) + H3O (l) ⇌h4O + (водн.) + Cu (h3O) 5 (OH) + (водн.) PKa = ~ 6,3Cu (h3O) 62+ (водн.) + H3O (l) ⇌h4O + (водн.) + Cu (h3O) 5 (OH) + (aq) pKa = ~ 6.3Zn (h3O) 42+ (aq) + h3O (l) ⇌h4O + (aq) + Zn (h3O) 3 (OH) + (aq) pKa = 9.6Zn (h3O) 42+ ( водн.) + h3O (l) ⇌h4O + (водн.) + Zn (h3O) 3 (OH) + (водн.) pKa = 9,6Пример 14,18
Гидролиз [Al (H
2 O) 6 ] 3+ Рассчитайте pH 0,10- M раствора хлорида алюминия, который полностью растворяется с образованием гидратированного иона алюминия [Al (h3O) 6] 3+ [Al (h3O) 6] 3+ в растворе.
Решение
Уравнение реакции и K a :Al (h3O) 63+ (вод. (л) ⇌h4O + (водн.) + Al (h3O) 5 (OH) 2+ (водн.) Ka = 1,4 × 10-5
Таблица ICE с предоставленной информацией —
Подставляя выражения для равновесных концентраций в уравнение для константы ионизации, получаем:
Предполагая x << 0,10 и решая упрощенное уравнение, получаем:
Таблица ICE определила x как равную концентрации иона гидроксония, поэтому вычисленный pH равен
.
Проверьте свои знания
Что такое [Al (h3O) 5 (OH) 2 +] [Al (h3O) 5 (OH) 2+] в 0. 15- M , раствор Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы довести [H 3 O + ] до 0,10 M ?
15- M , раствор Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы довести [H 3 O + ] до 0,10 M ?% PDF-1.3
%
187 0 объект
>
эндобдж
xref
187 53
0000000016 00000 н.
0000001411 00000 н.
0000001590 00000 н.
0000001637 00000 н.
0000001694 00000 н.
0000001750 00000 н.
0000001806 00000 н.
0000002513 00000 н.
0000002688 00000 н.
0000002754 00000 п.
0000002932 00000 н.
0000003051 00000 н.
0000003263 00000 н.
0000003399 00000 н.
0000003489 00000 н.
0000003579 00000 п.
0000003733 00000 н.
0000003824 00000 н.
0000003959 00000 н.
0000004055 00000 н.
0000004243 00000 п.
0000004352 00000 п.
0000004541 00000 н.
0000004631 00000 н.
0000004722 00000 н.
0000004883 00000 н.
0000004973 00000 н.
0000005064 00000 н.
0000005216 00000 н.
0000005306 00000 н.
0000005403 00000 п. 0000005561 00000 н.
0000005636 00000 н.
0000005797 00000 н.
0000005928 00000 н.
0000006054 00000 н.
0000006164 00000 н.
0000006283 00000 п.
0000006388 00000 п.
0000006558 00000 н.
0000006654 00000 н.
0000006748 00000 н.
0000006922 00000 н.
0000007614 00000 н.
0000007795 00000 н.
0000008011 00000 н.
0000008679 00000 н.
0000009473 00000 п.
0000009689 00000 н.
0000009795 00000 н.
0000009905 00000 н.
0000001847 00000 н.
0000002491 00000 н.
трейлер
]
>>
startxref
0
%% EOF
188 0 объект
>
эндобдж
189 0 объект
[
190 0 р 191 0 р 192 0 р
]
эндобдж
190 0 объект
>
/ Ж 226 0 Р
>>
эндобдж
191 0 объект
>
/ Ж 28 0 Р
>>
эндобдж
192 0 объект
>
/ Ж 36 0 Р
>>
эндобдж
193 0 объект
>
эндобдж
238 0 объект
>
ручей
Hb«f`7g`201 +; 6tr @ & kƹ
LuS868٠1E @ ЊU4’2> iAFG) ܉ L |: (9xIc0S * ivfsuAt
0000005561 00000 н.
0000005636 00000 н.
0000005797 00000 н.
0000005928 00000 н.
0000006054 00000 н.
0000006164 00000 н.
0000006283 00000 п.
0000006388 00000 п.
0000006558 00000 н.
0000006654 00000 н.
0000006748 00000 н.
0000006922 00000 н.
0000007614 00000 н.
0000007795 00000 н.
0000008011 00000 н.
0000008679 00000 н.
0000009473 00000 п.
0000009689 00000 н.
0000009795 00000 н.
0000009905 00000 н.
0000001847 00000 н.
0000002491 00000 н.
трейлер
]
>>
startxref
0
%% EOF
188 0 объект
>
эндобдж
189 0 объект
[
190 0 р 191 0 р 192 0 р
]
эндобдж
190 0 объект
>
/ Ж 226 0 Р
>>
эндобдж
191 0 объект
>
/ Ж 28 0 Р
>>
эндобдж
192 0 объект
>
/ Ж 36 0 Р
>>
эндобдж
193 0 объект
>
эндобдж
238 0 объект
>
ручей
Hb«f`7g`201 +; 6tr @ & kƹ
LuS868٠1E @ ЊU4’2> iAFG) ܉ L |: (9xIc0S * ivfsuAt
kYwtM ة u’7Oi67} | #pc ٔ1 E7 / Ӎ [[wƬSi19 / O M5? ۲hpdM! _Ϝ + C \ v; hl @ A6
9.{-}) \) ионов, то также образуется
вода . Слово соль — это общий термин, применяемый к продуктам всех кислотно-основных реакций. Соль — это продукт, который
состоит из \ (\ color {blue} {\ textbf {cation}} \) из \ (\ color {blue} {\ textbf {base}} \) и
\ (\ color {red} {\ textbf {anion}} \) из \ (\ color {red} {\ textbf {acid}} \).
Соль — это продукт, который
состоит из \ (\ color {blue} {\ textbf {cation}} \) из \ (\ color {blue} {\ textbf {base}} \) и
\ (\ color {red} {\ textbf {anion}} \) из \ (\ color {red} {\ textbf {acid}} \).Реакции нейтрализации (ESCP9)
Катион — ион (заряженный атом или молекула) с положительным (+) обвинение.Анион — это ион с отрицательным (-) зарядом.
Соль — это не просто поваренная соль, которую вы добавляете в пищу. Соль — это любое соединение, полученное стехиометрически эквивалентных количеств катионов и анионов, чтобы получить нейтральное ионное соединение.
Гептагидрат сульфата магния (\ (\ text {MgSO} _ {4}. 7 \ text {H} _ {2} \ text {O} \)), обычно
известная как английская соль, может использоваться в качестве геля для лечения болей и болей, в качестве ванны.
соли и имеет много других применений.
7 \ text {H} _ {2} \ text {O} \)), обычно
известная как английская соль, может использоваться в качестве геля для лечения болей и болей, в качестве ванны.
соли и имеет много других применений.
Когда реагирует эквивалентное количество кислоты и основания (так что ни кислота, ни основание не в избытке), реакция достигла точки , эквивалентной . На данный момент нейтрализация достигнута.
- Точка эквивалентности
Когда стехиометрически эквивалентное количество молей обоих реагентов имеет был добавлен в реакционный сосуд.
Чтобы лучше понять стехиометрическую эквивалентность, рассмотрите следующие уравнения:
\ (1 \ color {красный} {\ text {HA (aq)}} + 1 \ color {blue} {\ text {BOH (aq)}} \ to \) \ (1 \ text {AB} (\ text {aq}) + 1 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
\ (1 \ color {красный} {\ text {H} _ {2} {\ text {A (aq)}}} + 2 \ color {blue} {\ text {BOH (aq)}} \ to \) \ (1 \ text {AB} _ {2} (\ text {aq}) + 2 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
В первом примере выше стехиометрически эквивалентное количество моль один моль \ (\ color {red} {\ text {HA}} \) на каждые один родинка \ (\ color {blue} {\ text {BOH}} \). Во втором примере стехиометрически
эквивалентное количество молей на один моль
\ (\ color {red} {\ text {H} _ {2} {\ text {A}}} \) на каждые два моль
\ (\ color {blue} {\ text {BOH}} \).
Во втором примере стехиометрически
эквивалентное количество молей на один моль
\ (\ color {red} {\ text {H} _ {2} {\ text {A}}} \) на каждые два моль
\ (\ color {blue} {\ text {BOH}} \).
- Нейтрализация
Реакция нейтрализации включает реакцию кислоты и основания с образованием соль.
Посмотрите на следующие примеры:
Соляная кислота с гидроксидом натрия
Соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия ( соль) и вода.
 {-} \) из
кислота \ ((\ text {HCl}) \).
{-} \) из
кислота \ ((\ text {HCl}) \).\ (\ text {H} {\ color {red} {\ textbf {Cl}}} {\ text {(aq)}} + \ color {blue} {\ textbf {Na}} {\ text {OH (aq)}} \ к {\ color {blue} {\ textbf {Na}}} {\ color {red} {\ textbf {Cl}}} {\ text {(aq)}} + {\ text {H}} _ {2} {\ text {O (ℓ)}} \)
Бромистый водород с гидроксидом калия
Бромистый водород реагирует с гидроксидом калия с образованием бромида калия. (соль) и вода.{-} \) анионы из кислота \ ((\ text {HBr}) \).
\ (\ text {H} {\ color {red} {\ textbf {Br}}} {\ text {(aq)}} + \ color {blue} {\ textbf {K}} \ text {OH (aq)} \ к \ color {blue} {\ textbf {K}} \ color {red} {\ textbf {Br}} {\ text {(aq)}} + {\ text {H}} _ {2} \ text {O (ℓ)} \)
Соляная кислота с гидрокарбонатом натрия
Соляная кислота реагирует с гидрокарбонатом натрия с образованием хлорида натрия.
 {-} \) ионы,
и поэтому продукты представляли собой соль и воду .{-} \) ионы. А
соль по-прежнему образуется как один из продуктов, но углекислый газ (\ (\ text {CO} _ {2} \)) остается
добывается так же, как и вода.
{-} \) ионы,
и поэтому продукты представляли собой соль и воду .{-} \) ионы. А
соль по-прежнему образуется как один из продуктов, но углекислый газ (\ (\ text {CO} _ {2} \)) остается
добывается так же, как и вода.Этот эксперимент можно использовать для неформальной оценки. Это поможет определить, учащиеся понимают, что происходит в реакции нейтрализации. Учащиеся работа с сильной кислотой и сильным основанием в этой реакции.Концентрированный, сильные кислоты и основания могут вызвать серьезные ожоги. Напомните учащимся, чтобы они будьте осторожны и надевайте соответствующее защитное снаряжение при обращении со всеми химическими веществами, особо концентрированные кислоты и основания.
 К защитному снаряжению относятся перчатки,
защитные очки и защитную одежду.
К защитному снаряжению относятся перчатки,
защитные очки и защитную одежду.Температурные изменения реакций нейтрализации
Цель
Для исследования изменения температуры, связанного с нейтрализацией реакция.{-3} $} \) раствор соляной кислоты (\ (\ text {HCl} \))
Градусник, стакан, мерный цилиндр
Метод
Концентрированные кислоты и основания могут вызвать серьезные ожоги. {3} $} \) натрия
раствор гидроксида в стакан.{3} $} \) соляной кислоты в
стакан с помощью мерного цилиндра.
{3} $} \) натрия
раствор гидроксида в стакан.{3} $} \) соляной кислоты в
стакан с помощью мерного цилиндра.
Повторите шаги \ (\ text {2} \) и \ (\ text {3} \) довольно быстро. пока температура не перестанет существенно меняться.
Наблюдения
Вы должны записать свою температуру и объем в таблицу (помните, что объем гидроксида натрия постоянен при \ (\ text {20} \) \ (\ text {cm $ ^ {3} $} \)):
Объем (HCl) | Температура (℃) |
\ (\ text {0} \) | комнатная температура |
Обсуждение
Вы должны обнаружить, что реакция выделяет тепло, и поэтому температура
увеличивается.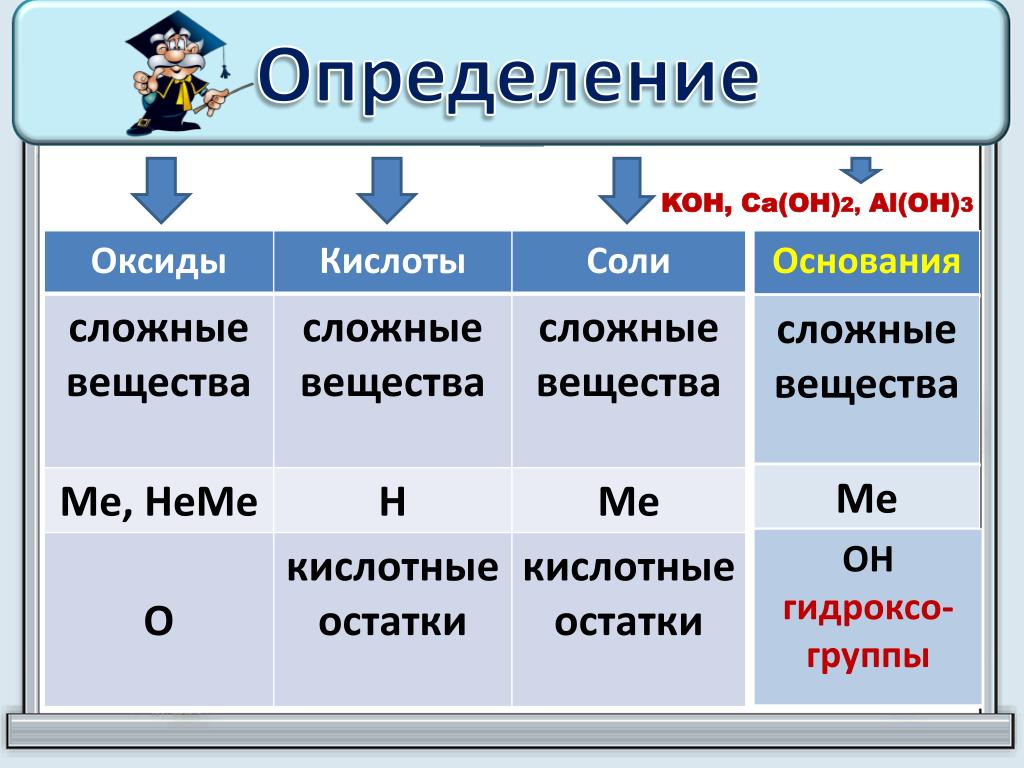 После того, как вся основа будет нейтрализована, температура
больше не должно увеличиваться. Это потому, что реакция нейтрализации экзотермический (выделяет тепло). Когда вся база была
нейтрализован, нет реакции на добавление кислоты, и нет
выделяется больше тепла.
После того, как вся основа будет нейтрализована, температура
больше не должно увеличиваться. Это потому, что реакция нейтрализации экзотермический (выделяет тепло). Когда вся база была
нейтрализован, нет реакции на добавление кислоты, и нет
выделяется больше тепла.
После того, как реакция закончилась (основание нейтрализовано) есть
больше не выделяется тепло.В результате температура будет
больше не вставать. На самом деле может даже быть уменьшение
температура обратно к комнатной температуре, поскольку тепло от
реакционный сосуд (стакан) рассеивается.
Соли могут быть разных цветов.
\ (\ color {purple} {\ textbf {Перманганат калия}} \) (\ (\ color {purple} {\ textbf {KMnO} _ {4}} \))
\ (\ color {blue} {\ textbf {Медный купорос}} \) (\ (\ color {blue} {\ textbf {CuSO} _ {4}} \))
\ (\ color {darkgreen} {\ textbf {хлорид никеля}} \) (\ (\ color {darkgreen} {\ textbf {NiCl} _ {2}} \))
\ (\ color {gold} {\ textbf {Хромат натрия}} \) (\ (\ color {gold} {\ textbf {Na} _ {2} {\ textbf {CrO}} _ {4}} \))
\ (\ color {red} {\ textbf {Дихромат калия}} \) (\ (\ color {red} {\ textbf {K} _ {2} {\ textbf {Cr}} _ {2} {\ textbf {O}} _ {7}} \))
Реакции нейтрализации очень важны в повседневной жизни. Ниже приведены несколько примеров:
Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция \ ((\ text {CaO}) \) используется для нейтрализации кислой почвы. Порошкообразный известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие значительно медленнее и менее эффективно. Эти вещества также можно использовать на больших масштаб в сельском хозяйстве и в реках.
Биологические применения
Соляная кислота \ ((\ text {HCl}) \) в желудке играет важную роль в помогает переваривать пищу.
 Важно отметить, что слишком много кислоты в
желудок может привести к образованию язв в тех случаях, когда
Повреждена слизистая желудка (например,г. инфекцией).
Важно отметить, что слишком много кислоты в
желудок может привести к образованию язв в тех случаях, когда
Повреждена слизистая желудка (например,г. инфекцией).Антациды (которые являются основаниями) берутся для нейтрализации лишнего желудочная кислота, чтобы предотвратить повреждение кишечника. Примеры антацидов гидроксид алюминия, гидроксид магния («магнезиальное молоко») и бикарбонат натрия («бикарбонат соды»).
Промышленное использование
Щелочной гидроксид кальция (известковая вода) используется для поглощения вредных кислотных \ (\ text {SO} _ {2} \) газ, выбрасываемый электростанциями и сжигание ископаемого топлива.

Пожалуйста, не используйте основание для нейтрализации кислоты, если вы пролили ее на себя во время эксперимента. Сильная база может сжечь тебя так же сильно, как и сильная кислота. Лучше тщательно промойте это место водой.
Укусы пчел кислые, их pH от \ (\ text {5} \) до \ (\ text {5,5} \).Они могут успокоиться с помощью таких веществ, как лосьон с каломином, который является слабой щелочью на основе оксида цинка. Также можно использовать бикарбонат соды или мыло. Щелочи помогает нейтрализовать кислотный укус пчелы и уменьшить зуд.
Кислоты и соединения металлов
Изучите реакции, которые происходят при добавлении кислоты к следующие соединения:
(Ваша книга для 11-го класса будет полезна в этом исследовании)
Напишите отчет, который включает:
Общее уравнение (прописью) каждой реакции.

Описание происходящего в этой реакции.
Пример такого типа реакции в виде уравновешенного уравнение.
Ниже приводится пример того, как учащиеся соединений кислот и металлов отчет можно посмотреть:
Кислота + металл \ (\ к \) соль + водород
К чистому металлу добавляют разбавленную кислоту с образованием соли и водорода.
 газ.Соль образована катионом металла и анионом из
кислота. В этой реакции металл выступает в качестве основы. За
пример:
газ.Соль образована катионом металла и анионом из
кислота. В этой реакции металл выступает в качестве основы. За
пример:\ (\ color {red} {\ text {соляная кислота}} + \ color {blue} {\ text {цинк}} \ to \ color {blue} {\ text {zinc}} \ color {red} {\ text {chlor}} \) + водород
\ (2 \ text {HCl} (\ text {aq}) + \ text {Zn} (\ text {s}) \) \ (\ to \) \ (\ text {ZnCl} _ {2} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \)
Кислота + гидроксид металла \ (\ к \) соль + вода
К гидроксиду металла добавляют разбавленную кислоту с образованием соли и воды.
 Соль образована катионом металла и анионом из
кислота. В этой реакции гидроксид металла действует как основание.
Например:
Соль образована катионом металла и анионом из
кислота. В этой реакции гидроксид металла действует как основание.
Например:\ (\ color {red} {\ text {соляная кислота}} + \ color {blue} {\ text {цинк гидроксид}} \ to \ color {синий} {\ text {цинк}} \ color {красный} {\ text { хлорид}} \) + вода
\ (2 \ text {HCl} (\ text {aq}) + \ text {Zn} (\ text {OH}) _ {2} (\ text {s}) \) \ (\ to \) \ (\ text {ZnCl} _ {2} (\ text {aq}) + 2 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Кислота + оксид металла \ (\ to \) соль + вода
К оксиду металла добавляют разбавленную кислоту с образованием соли и воды.
 В
Соль образована катионом металла и анионом кислоты.
В этой реакции оксид металла действует как основание. За
пример:
В
Соль образована катионом металла и анионом кислоты.
В этой реакции оксид металла действует как основание. За
пример:\ (\ color {red} {\ text {соляная кислота}} + \ color {blue} {\ text {цинк оксид}} \ to \ color {синий} {\ text {цинк}} \ color {красный} {\ text { хлорид}} \) + вода
\ (2 \ text {HCl} (\ text {aq}) + \ text {ZnO} (\ text {s}) \) \ (\ to \) \ (\ text {ZnCl} _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Кислота + карбонат металла \ (\ to \) соль + вода + углекислый газ
К карбонату металла добавляют разбавленную кислоту с образованием соли, воды и углекислый газ.
 Соль образована катионом металла и
анион из кислоты. В этой реакции карбонат металла
выступая в качестве базы. Например:
Соль образована катионом металла и
анион из кислоты. В этой реакции карбонат металла
выступая в качестве базы. Например:\ (\ color {red} {\ text {соляная кислота}} + \ color {blue} {\ text {цинк карбонат}} \ to \ color {синий} {\ text {цинк}} \ color {красный} {\ text { хлорид}} \) + вода + углекислый газ
\ (2 \ text {HCl} (\ text {aq}) + \ text {ZnCO} _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {ZnCl} _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) + \ text {CO} _ {2} (\ text {g}) \)
Кислота + гидрокарбонат металла \ (\ to \) соль + вода + углекислый газ
К гидрокарбонату металла добавляют разбавленную кислоту с образованием соли, вода и углекислый газ.
 Соль образована металлом
катион и анион из кислоты. В этой реакции металл
гидрокарбонат действует как основание. Например:
Соль образована металлом
катион и анион из кислоты. В этой реакции металл
гидрокарбонат действует как основание. Например:\ (\ color {red} {\ text {соляная кислота}} + \ color {blue} {\ text {цинк бикарбонат}} \ to \ color {синий} {\ text {цинк}} \ color {красный} {\ text { хлорид}} \) + вода + углекислый газ
\ (2 \ text {HCl} (\ text {aq}) + \ text {Zn} (\ text {HCO} _ {3}) _ {2} (\ text {s}) \) \ (\ to \) \ (> \ text {ZnCl} _ {2} (\ text {aq}) + 2 \ text {H} _ {2} \ text {O} (\ text {ℓ}) + 2 \ text {CO} _ {2} (\ text {g}) \)
Опасность кислот и щелочей
Найдите информацию о следующих сильных кислотах и основаниях:
Соляная кислота (\ (\ text {HCl} \))
Серная кислота (\ (\ text {H} _ {2} \ text {SO} _ {4} \))
Гидроксид натрия (\ (\ text {NaOH} \))
Гидроксид калия (\ (\ text {KOH} \))
Напишите отчет, который включает:
Использование этих соединений в промышленности
Если применимо, экологические отходы, содержащие эти соединения
Каким будет эффект большого разлива этих соединений
Ниже приводится пример информации, о которой учащиеся должны сообщать:
Соляная кислота
Соляная кислота используется в промышленности для очистки железа и стали от ржавчины, а также
переработка руд. При попадании в окружающую среду соляная кислота будет
снизить pH любой воды, которую он загрязняет. Это изменение pH может серьезно повлиять на
рост растений и повреждение экосистем.
При попадании в окружающую среду соляная кислота будет
снизить pH любой воды, которую он загрязняет. Это изменение pH может серьезно повлиять на
рост растений и повреждение экосистем.
Рабочий пример 8: Определение уравнений из исходных материалов
Карбонат магния (\ (\ text {MgCO} _ {3} \)) растворяется в азотной кислоте. (\ (\ text {HNO} _ {3} \)).Приведите сбалансированное химическое уравнение для этого реакция.
Какие реагенты?
Кислота (\ (\ text {HNO} _ {3} \)) и карбонат металла (\ (\ text {MgCO} _ {3} \)).
Какие будут продукты?
Поскольку это реакция кислоты и карбоната металла, продукты будут
соль, вода и углекислый газ. {2 +} \).
{2 +} \).
Следовательно, формула соли будет следующей: \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} \).
Напишите уравнение этой реакции
\ (\ text {HNO} _ {3} (\ text {aq}) + \ text {MgCO} _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) + \ text {CO} _ {2} (\ text {g}) \)
Убедитесь, что уравнение сбалансировано
Уравнение не сбалансировано.
Номер слева | Номер справа | |
H | \ (\ text {1} \) | \ (\ text {2} \) |
№ | \ (\ text {1} \) | \ (\ text {2} \) |
О | \ (\ text {6} \) | \ (\ text {9} \) |
мг | \ (\ text {1} \) | \ (\ text {1} \) |
К | \ (\ text {1} \) | \ (\ text {1} \) |
Чтобы уравновесить это уравнение, должны быть две молекулы азотной кислоты на
левая сторона.
\ (2 \ text {HNO} _ {3} (\ text {aq}) + \ text {MgCO} _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) + \ text {CO} _ {2} (\ text {g}) \)
Номер слева | Номер справа | |
H | \ (\ text {2} \) | \ (\ text {2} \) |
№ | \ (\ text {2} \) | \ (\ text {2} \) |
О | \ (\ text {9} \) | \ (\ text {9} \) |
мг | \ (\ text {1} \) | \ (\ text {1} \) |
К | \ (\ text {1} \) | \ (\ text {1} \) |
Уравнение сбалансировано.
Рабочий пример 9: Определение уравнений из исходных материалов
Йодоводородная кислота (\ (\ text {HI} \)) добавляется к твердому гидроксиду калия. (\ (\ текст {КОН} \)). Приведите сбалансированное химическое уравнение этой реакции.
Какие реагенты?
Кислота (\ (\ text {HI} \)) и основание (\ (\ text {KOH} \)).
Какие будут продукты?
Поскольку это реакция кислоты и основания (которое содержит гидроксид
анион) продукты будут солью и водой. {-} (\ text {aq}) +
\ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
{-} (\ text {aq}) +
\ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Убедитесь, что уравнение сбалансировано
Уравнение сбалансировано.
Рабочий пример 10: Определение уравнений из исходных материалов
Серная кислота (\ (\ text {H} _ {2} \ text {SO} _ {4} \)) и аммиак (\ (\ text {NH} _ {3} \)) совмещены. Приведите сбалансированное химическое уравнение этой реакции.
Какие реагенты?
Кислота (\ (\ text {H} _ {2} \ text {SO} _ {4} \)) и основание (\ (\ text {NH} _ {3} \)). {+} \)).{2 -} \).
{+} \)).{2 -} \).
Следовательно, формула соли будет следующей: \ ((\ text {NH} _ {4}) _ {2} \ text {SO} _ {4} \).
Напишите уравнение этой реакции
\ (\ text {H} _ {2} \ text {SO} _ {4} (\ text {aq}) + \ text {NH} _ {3} (\ text {g}) \) \ (\ к\) \ ((\ text {NH} _ {4}) _ {2} \ text {SO} _ {4} (\ text {aq}) \) (+ может быть другой продукт)
Определить, будет ли другой товар
Нет типов атомов, которые не учитывались бы по обе стороны
уравнение, поэтому маловероятно, что появится другой товар. Если уравнение можно сбалансировать, другого продукта нет.
Если уравнение можно сбалансировать, другого продукта нет.
Убедитесь, что уравнение сбалансировано
Уравнение не сбалансировано.
Номер слева | Номер справа | |
H | \ (\ text {5} \) | \ (\ text {8} \) |
S | \ (\ text {1} \) | \ (\ text {1} \) |
О | \ (\ text {4} \) | \ (\ text {4} \) |
№ | \ (\ text {1} \) | \ (\ text {2} \) |
Чтобы сбалансировать это уравнение, слева должны быть две молекулы аммиака. стороны стороны.
стороны стороны.
\ (\ text {H} _ {2} \ text {SO} _ {4} (\ text {aq}) + 2 \ text {NH} _ {3} (\ text {g}) \) \ ( \к\) \ ((\ text {NH} _ {4}) _ {2} \ text {SO} _ {4} (\ text {aq}) \)
Номер слева | Номер справа | |
H | \ (\ text {8} \) | \ (\ text {8} \) |
S | \ (\ text {1} \) | \ (\ text {1} \) |
О | \ (\ text {4} \) | \ (\ text {4} \) |
№ | \ (\ text {2} \) | \ (\ text {2} \) |
Уравнение сбалансировано. {2 +} \).
{2 +} \).
Следовательно, соль — это \ (\ text {CaCl} _ {2} \).
\ (\ text {HCl} (\ text {aq}) + \ text {Ca} (\ text {s}) \) \ (\ to \) \ (\ text {CaCl} _ {2} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \)
Чтобы сбалансировать это уравнение, должно быть два \ (\ text {HCl} \) молекулы.
\ (2 \ text {HCl} (\ text {aq}) + \ text {Ca} (\ text {s}) \) \ (\ to \) \ (\ text {CaCl} _ {2} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \)
Азотная кислота и магний
кислота (\ (\ text {HNO} _ {3} \)) + металл (\ (\ text {Mg} \)) \ (\ to \) соль + водород
Анион (из кислоты) представляет собой \ (\ text {NO} _ {3} ^ {-} \), катион
(из металла) это \ (\ text {Mg} ^ {2 +} \).
Следовательно, соль — это \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} \).
\ (\ text {HNO} _ {3} (\ text {aq}) + \ text {Mg} (\ text {s}) \) \(\к\) \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \)
Чтобы сбалансировать это уравнение, должно быть два \ (\ text {HNO} _ {3} \) молекулы.
\ (2 \ text {HNO} _ {3} (\ text {aq}) + \ text {Mg} (\ text {s}) \) \(\к\) \ (\ text {Mg} (\ text {NO} _ {3}) _ {2} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \)
Соляная кислота и гидроксид магния
кислота (\ (\ text {HCl} \)) + гидроксид металла (\ (\ text {Mg} (\ text {OH}) _ {2} \)) \ (\ to \) соль + вода
Анион (из кислоты) — \ (\ text {Cl} ^ {-} \), катион (из
металл) равно \ (\ text {Mg} ^ {2 +} \).
Следовательно, соль — это \ (\ text {MgCl} _ {2} \).
\ (\ text {HCl} (\ text {aq}) + \ text {Mg} (\ text {OH}) _ {2} (\ text {s}) \) \ (\ to \) \ (\ text {MgCl} _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Чтобы сбалансировать это уравнение, должно быть два \ (\ text {HCl} \) молекулы и две \ (\ text {H} _ {2} \ text {O} \) молекулы.
\ (2 \ text {HCl} (\ text {aq}) + \ text {Mg} (\ text {OH}) _ {2} (\ text {s}) \) \ (\ to \) \ (\ text {MgCl} _ {2} (\ text {aq}) + 2 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Азотная кислота и гидроксид алюминия
кислота (\ (\ text {HNO} _ {3} \)) + гидроксид металла (\ (\ text {Al} (\ text {OH}) _ {3} \)) \ (\ to \) соль + вода
Анион (из кислоты) представляет собой \ (\ text {NO} _ {3} ^ {-} \), катион
(из металла) это \ (\ text {Al} ^ {3 +} \).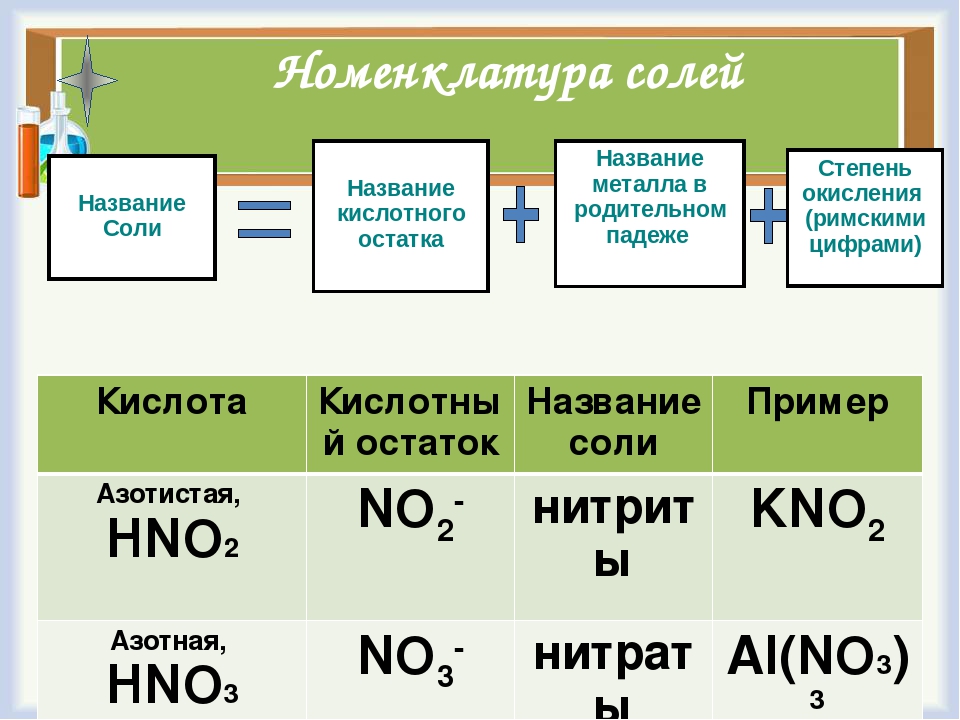
Следовательно, соль — это \ (\ text {Al} (\ text {NO} _ {3}) _ {3} \).
\ (\ text {HNO} _ {3} (\ text {aq}) + \ text {Al} (\ text {OH}) _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {Al} (\ text {NO} _ {3}) _ {2} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Чтобы сбалансировать это уравнение, должно быть три
\ (\ text {HNO} _ {3} \) молекулы и три
\ (\ text {H} _ {2} \ text {O} \) молекулы.
\ (3 \ text {HNO} _ {3} (\ text {aq}) + \ text {Al} (\ text {OH}) _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {Al} (\ text {NO} _ {3}) _ {3} (\ text {aq}) + 3 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Соляная кислота и оксид алюминия
кислота (\ (\ text {HCl} \)) + оксид металла (\ (\ text {Al} _ {2} \ text {O} _ {3} \)) \ (\ to \) соль + вода
Анион (из кислоты) — \ (\ text {Cl} ^ {-} \), катион (из
металл) — это \ (\ text {Al} ^ {3 +} \).
Следовательно, соль — это \ (\ text {AlCl} _ {3} \).
\ (\ text {HCl} (\ text {aq}) + \ text {Al} _ {2} \ text {O} _ {3} (\ text {s}) \) \ (\ to \) \ (\ text {AlCl} _ {3} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Чтобы сбалансировать это уравнение, должно быть шесть
\ (\ text {HCl} \) молекулы, две
\ (\ text {AlCl} _ {3} \) молекулы и три
\ (\ text {H} _ {2} \ text {O} \) молекулы.
\ (6 \ text {HCl} (\ text {aq}) + \ text {Al} _ {2} \ text {O} _ {3} (\ text {s}) \) \ (\ to \) \ (2 \ text {AlCl} _ {3} (\ text {aq}) + 3 \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Серная кислота и оксид магния
кислота (\ (\ text {H} _ {2} \ text {SO} _ {4} \)) + оксид металла (\ (\ text {MgO} \)) \ (\ to \) соль + вода
Анион (из кислоты) представляет собой \ (\ text {SO} _ {4} ^ {2 -} \), катион
(из металла) это \ (\ text {Mg} ^ {2 +} \).
Следовательно, соль — это \ (\ text {MgSO} _ {4} \).
\ (\ text {H} _ {2} \ text {SO} _ {4} (\ text {aq}) + \ text {MgO} (\ text {s}) \) \ (\ to \) \ (\ text {MgSO} _ {4} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {ℓ}) \)
Это уравнение сбалансировано.
.
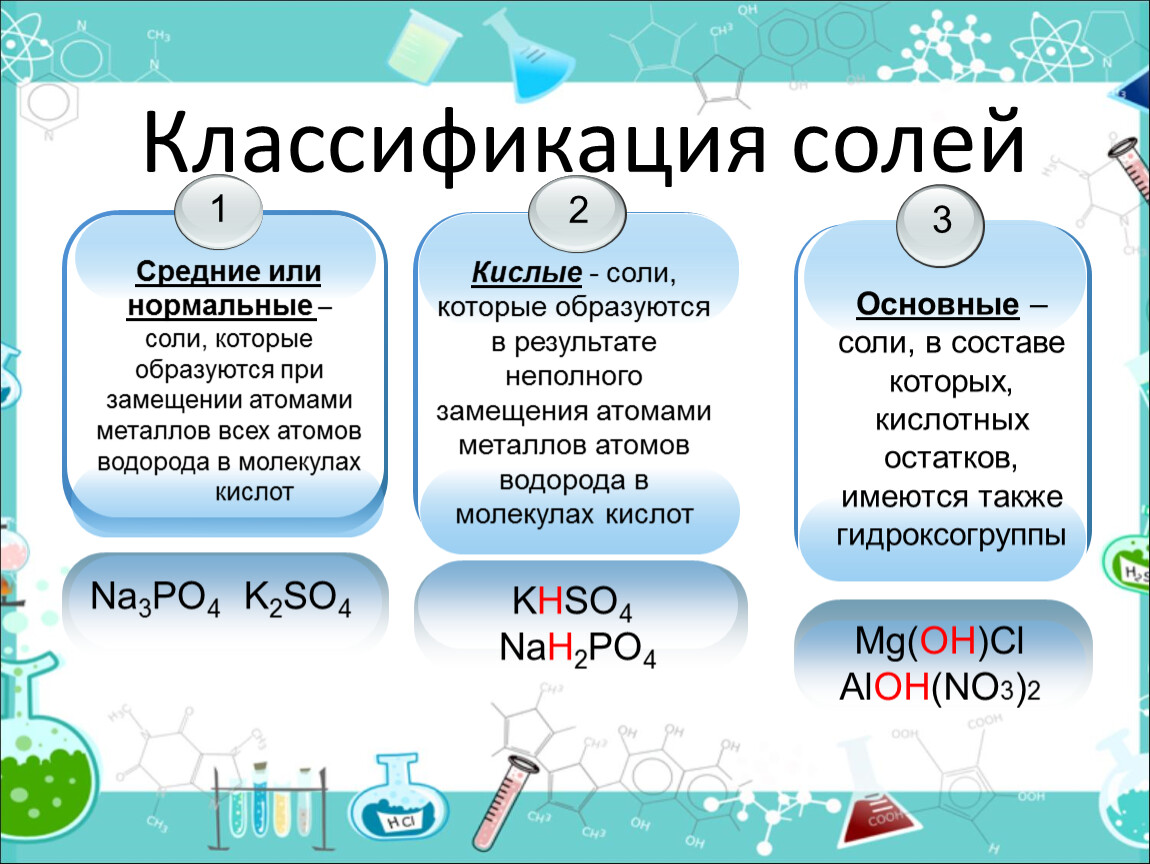 (слайд 3)
(слайд 3)
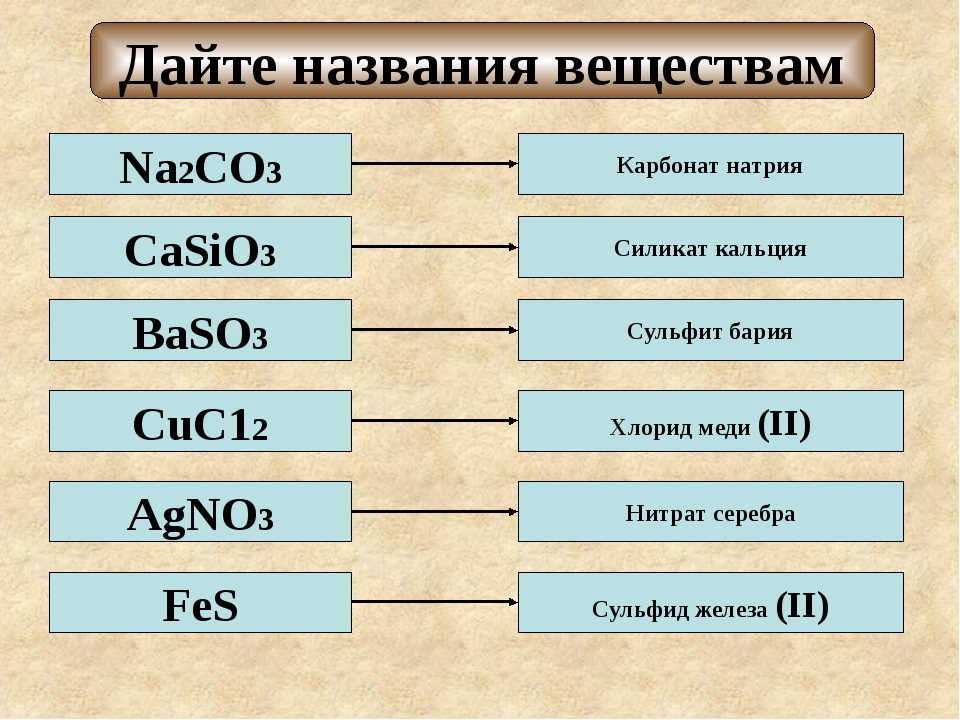
 Из
Из Реакция
Реакция


 Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами.
Обычно он имеет центральный атом металла, окруженный нейтральными молекулами и заряженными ионами. Жесткая вода обычно содержит соли, такие как магний и кальций.Очищающие соли подвергаются катионообменной реакции, чтобы избавиться от этих катионов в воде. Эти соли непригодны для употребления и должны использоваться только для очистки.
Жесткая вода обычно содержит соли, такие как магний и кальций.Очищающие соли подвергаются катионообменной реакции, чтобы избавиться от этих катионов в воде. Эти соли непригодны для употребления и должны использоваться только для очистки.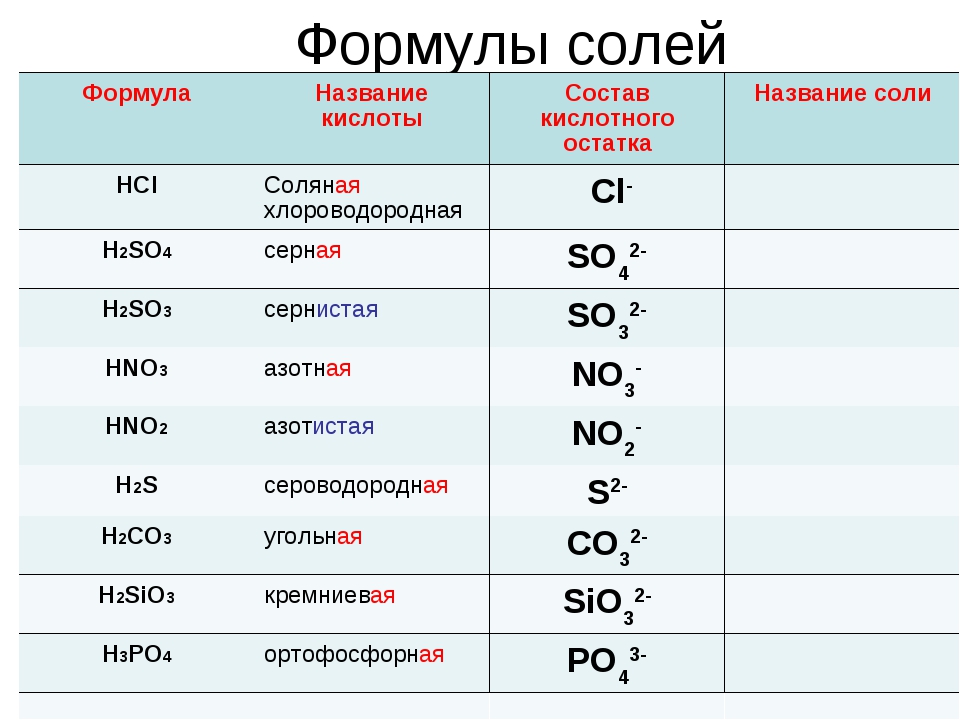
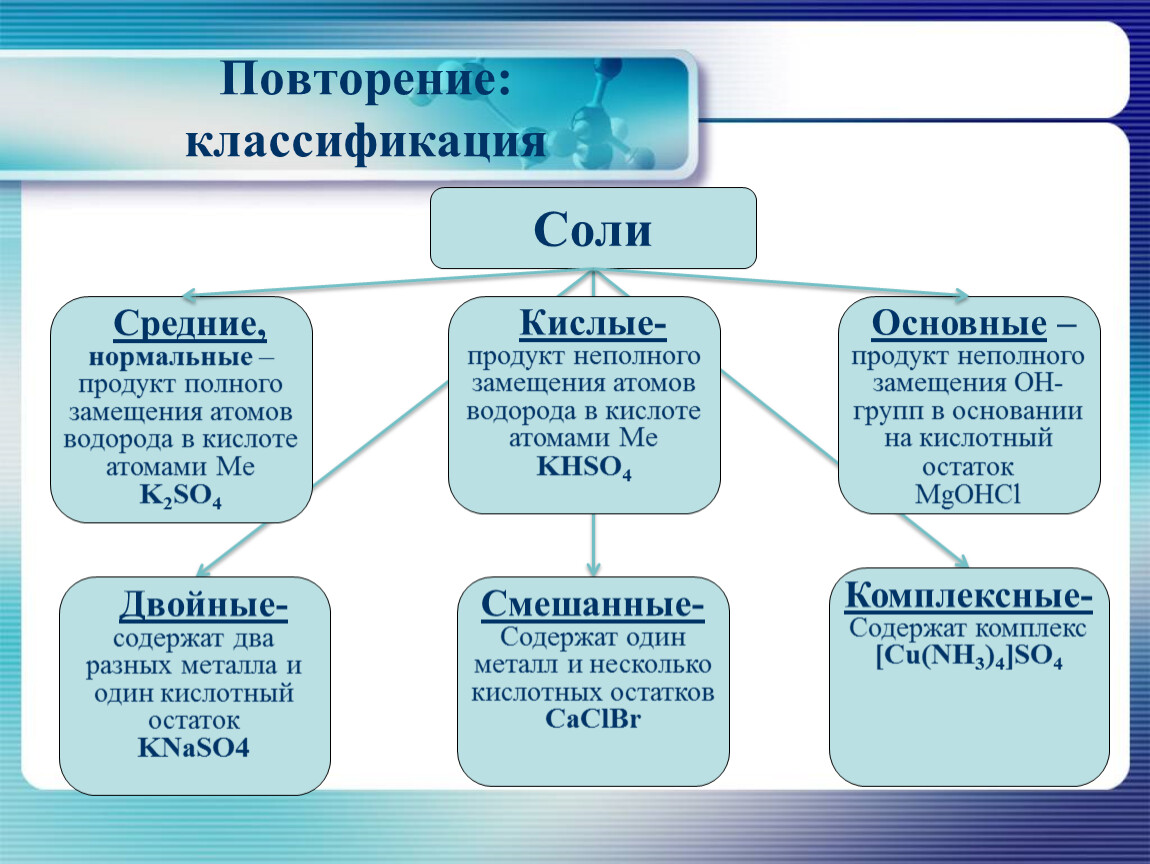 Не перемешивайте металлическим шпателем.
Не перемешивайте металлическим шпателем.
 Заранее решите, какая информация будет сообщаться каждым участником — каждый человек должен сообщить о каком-либо разделе вашего исследования. Используйте ваши мензурки и большую плакатную бумагу / белую доску, предоставленные для облегчения вашей презентации. Обязательно укажите в своем отчете:
Заранее решите, какая информация будет сообщаться каждым участником — каждый человек должен сообщить о каком-либо разделе вашего исследования. Используйте ваши мензурки и большую плакатную бумагу / белую доску, предоставленные для облегчения вашей презентации. Обязательно укажите в своем отчете: Только переместите на один протон , чтобы сделать родителей!
Только переместите на один протон , чтобы сделать родителей! Притяжение между двумя ионами мгновенно связывает их вместе, образуя NaCl.
Притяжение между двумя ионами мгновенно связывает их вместе, образуя NaCl. {-} \) из
кислота \ ((\ text {HCl}) \).
{-} \) из
кислота \ ((\ text {HCl}) \).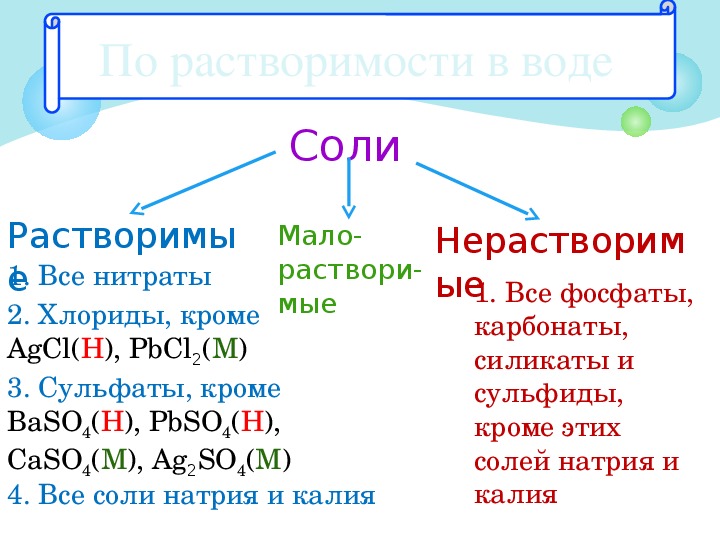 {-} \) ионы,
и поэтому продукты представляли собой соль и воду .{-} \) ионы. А
соль по-прежнему образуется как один из продуктов, но углекислый газ (\ (\ text {CO} _ {2} \)) остается
добывается так же, как и вода.
{-} \) ионы,
и поэтому продукты представляли собой соль и воду .{-} \) ионы. А
соль по-прежнему образуется как один из продуктов, но углекислый газ (\ (\ text {CO} _ {2} \)) остается
добывается так же, как и вода. К защитному снаряжению относятся перчатки,
защитные очки и защитную одежду.
К защитному снаряжению относятся перчатки,
защитные очки и защитную одежду. Важно отметить, что слишком много кислоты в
желудок может привести к образованию язв в тех случаях, когда
Повреждена слизистая желудка (например,г. инфекцией).
Важно отметить, что слишком много кислоты в
желудок может привести к образованию язв в тех случаях, когда
Повреждена слизистая желудка (например,г. инфекцией).

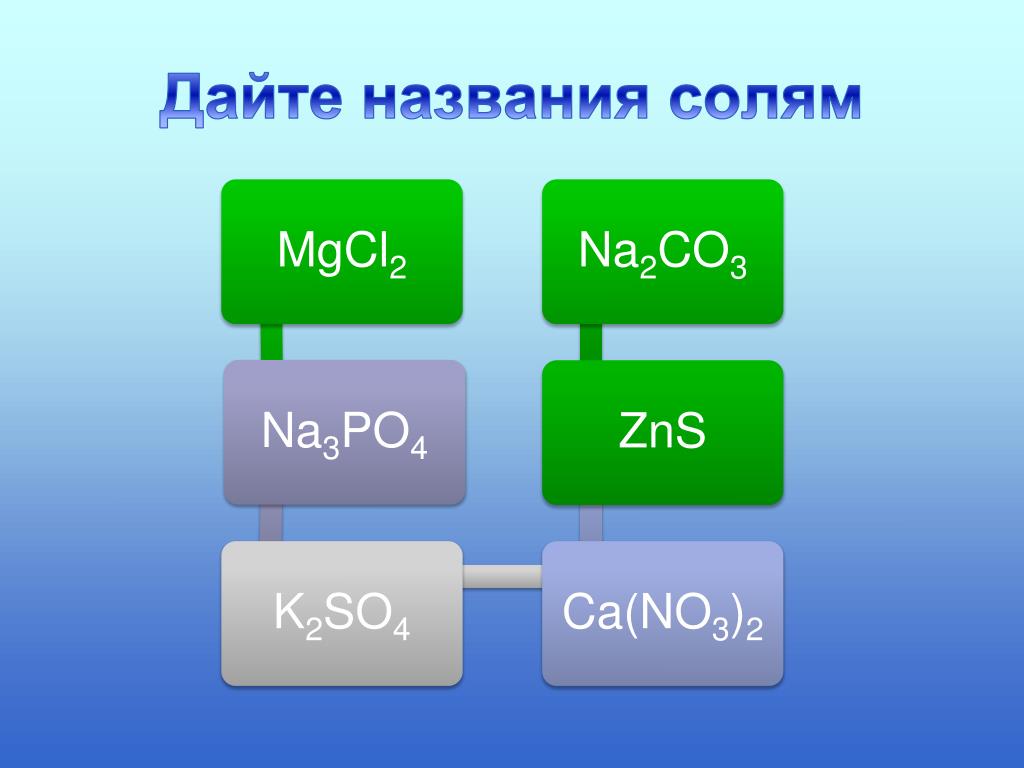 газ.Соль образована катионом металла и анионом из
кислота. В этой реакции металл выступает в качестве основы. За
пример:
газ.Соль образована катионом металла и анионом из
кислота. В этой реакции металл выступает в качестве основы. За
пример: Соль образована катионом металла и анионом из
кислота. В этой реакции гидроксид металла действует как основание.
Например:
Соль образована катионом металла и анионом из
кислота. В этой реакции гидроксид металла действует как основание.
Например: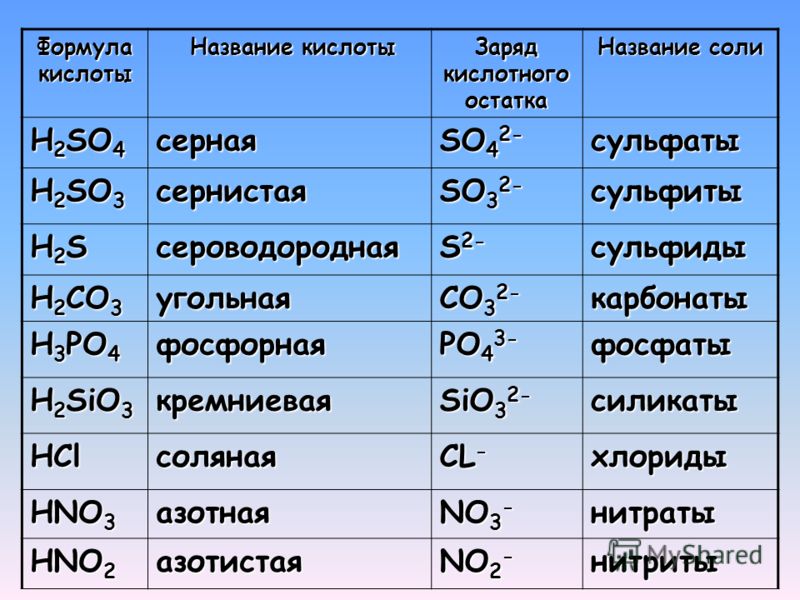 В
Соль образована катионом металла и анионом кислоты.
В этой реакции оксид металла действует как основание. За
пример:
В
Соль образована катионом металла и анионом кислоты.
В этой реакции оксид металла действует как основание. За
пример: Соль образована катионом металла и
анион из кислоты. В этой реакции карбонат металла
выступая в качестве базы. Например:
Соль образована катионом металла и
анион из кислоты. В этой реакции карбонат металла
выступая в качестве базы. Например: Соль образована металлом
катион и анион из кислоты. В этой реакции металл
гидрокарбонат действует как основание. Например:
Соль образована металлом
катион и анион из кислоты. В этой реакции металл
гидрокарбонат действует как основание. Например: