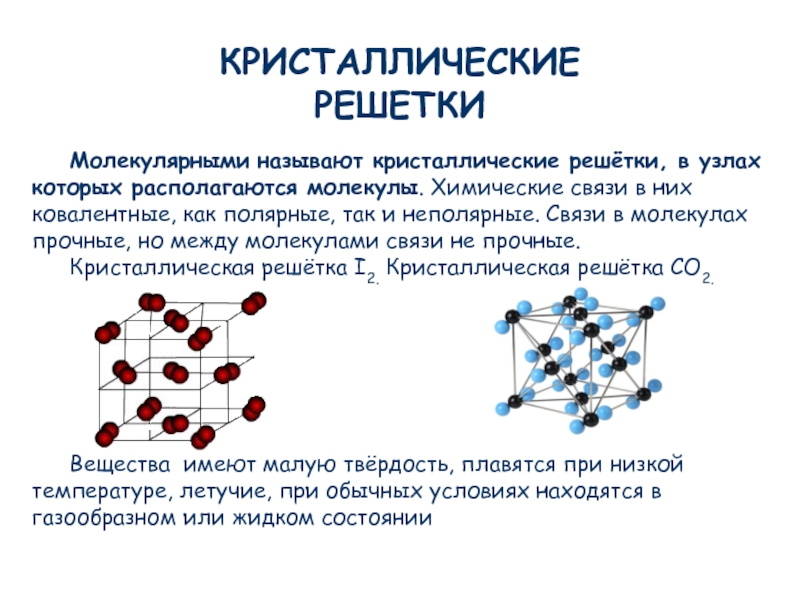
Кристаллические решетки
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком, твёрдом. Например, кислород, является газом, но при температуре -194 0С он превращается в голубую жидкость, а при температуре -218,8 0С – затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Твёрдые вещества делят на кристаллические и аморфные. Аморфные вещества не имеют четкой температуры плавления, при нагревании размягчаются и переходят в текучее состояние. К аморфным веществам относятся пластмассы, воск, шоколад, пластилин, жевательные резинки.
Кристаллические вещества состоят из частиц, которые имеют четкое расположение в определенных точках пространства. Если соединить эти частицы, то получится своеобразный каркас, который называется кристаллической решеткой
 А
точки, где находятся частицы – узлами кристаллической решетки. В узлах
кристаллической решетки могут находиться ионы, атомы, молекулы. Эти частицы
совершают колебательные движения. При повышении температуры размах этих
колебаний увеличивается, что приводит к тепловому расширению тел.
А
точки, где находятся частицы – узлами кристаллической решетки. В узлах
кристаллической решетки могут находиться ионы, атомы, молекулы. Эти частицы
совершают колебательные движения. При повышении температуры размах этих
колебаний увеличивается, что приводит к тепловому расширению тел.Кристаллическая решётка
В зависимости от типа частиц в кристаллической решетки и характера связи между ними, различают ионные, атомные, молекулярные и металлические кристаллические решётки.
Ионные кристаллические решётки
Ионными,
называются кристаллические решётки, в узлах которых находятся ионы. Их образуют
вещества с ионным типом связи. Это соли, основания, некоторые оксиды.
Например, кристалл хлорида натрия, построен из чередующихся ионов Na +
и
Cl—.
Они образуют решётку в виде куба. Связи в этом кристалле очень прочные, поэтому
вещества с ионным типом связи имеют высокую твердость и прочность, они
нелетучи и тугоплавки.
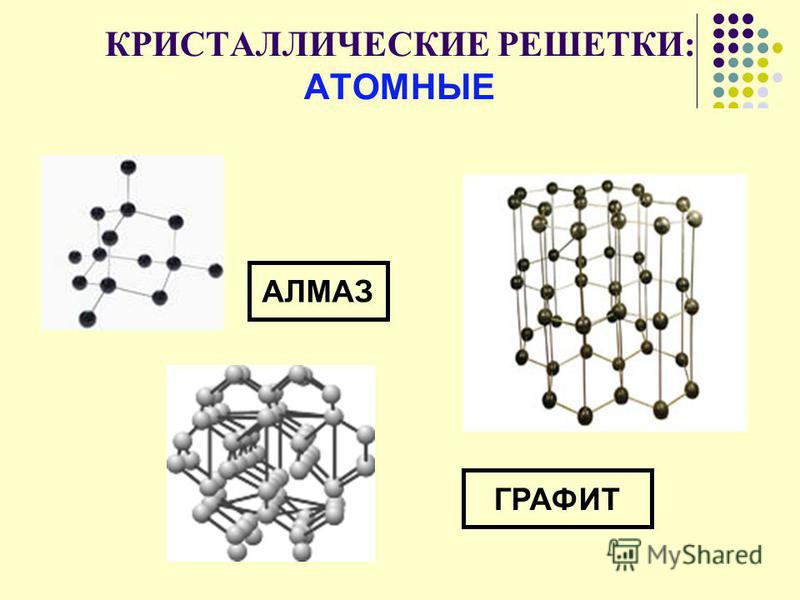
Атомные кристаллические решётки
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. Эти атомы между собой соединены очень прочными ковалентными связями. Атомную кристаллическую решётку имеет алмаз. Ограненный и отшлифованный алмаз называют бриллиантом. Он широко используется в ювелирном деле.
Кроме алмаза атомную кристаллическую решётку имеют и такие простые вещества, как бор, кремний, германий, и сложные: кремнезём, кварц, песок, горный хрусталь, в состав которых входит SiO2. Вещества с атомной кристаллической решеткой имеют
Молекулярные кристаллические решётки
Молекулярная
кристаллическая решётка – это кристаллическая решетка, в узлах которой
находятся молекулы. Связи у веществ с молекулярной кристаллической решёткой
могут быть ковалентными полярными, как в молекулах HCl,
H2O,
и ковалентными неполярными, как в молекулах O2,
O3, N2,
H2 и др. Атомы
внутри молекулы связаны прочно, а вот связи между самими молекулами непрочные.
Поэтому вещества с молекулярной кристаллической решеткой имеют малую
твердость, низкие температуры плавления и кипения, летучи. К веществам с
молекулярной кристаллической решеткой относятся: лед (вода в твердом
агрегатном состоянии), который уже при температуре выше 0 0С
переходит в жидкое состояние, его кристаллическая структура разрушается; твердый
оксид углерода (IV)
– «сухой лед», который возгоняется при увеличении температуры,
т.е. превращается в газ, твёрдые хлороводород и сероводород, твёрдые простые
вещества. Такие как, одноатомные благородные газы, двухатомные молекулы (O2,
N2, H2,
Cl2,
I2), трёхатомные (O3),
четырёхатомные, как Р4, восьмиатомные молекулы, как S8.
Молекулярную кристаллическую решетку имеют большинство органических веществ: глюкоза,
сахар, нафталин, спирт, лимонная кислота.
Атомы
внутри молекулы связаны прочно, а вот связи между самими молекулами непрочные.
Поэтому вещества с молекулярной кристаллической решеткой имеют малую
твердость, низкие температуры плавления и кипения, летучи. К веществам с
молекулярной кристаллической решеткой относятся: лед (вода в твердом
агрегатном состоянии), который уже при температуре выше 0 0С
переходит в жидкое состояние, его кристаллическая структура разрушается; твердый
оксид углерода (IV)
– «сухой лед», который возгоняется при увеличении температуры,
т.е. превращается в газ, твёрдые хлороводород и сероводород, твёрдые простые
вещества. Такие как, одноатомные благородные газы, двухатомные молекулы (O2,
N2, H2,
Cl2,
I2), трёхатомные (O3),
четырёхатомные, как Р4, восьмиатомные молекулы, как S8.
Молекулярную кристаллическую решетку имеют большинство органических веществ: глюкоза,
сахар, нафталин, спирт, лимонная кислота.
Металлические кристаллические решётки
Металлическую кристаллическую решётку имеют
Для веществ молекулярного строения справедлив закон французского химика Ж. Л. Пруста – закон постоянства состава: молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста – основной из законов химии, однако он несправедлив для веществ немолекулярного строения.
Кристаллические решетки — Справочник химика 21
Адсорбция бывает физическая и химическая. При химической адсорбции (хемосорбции) полярные концы молекул, связываясь с поверхностью тела, образуют на ней монослой своего рода химического соединения.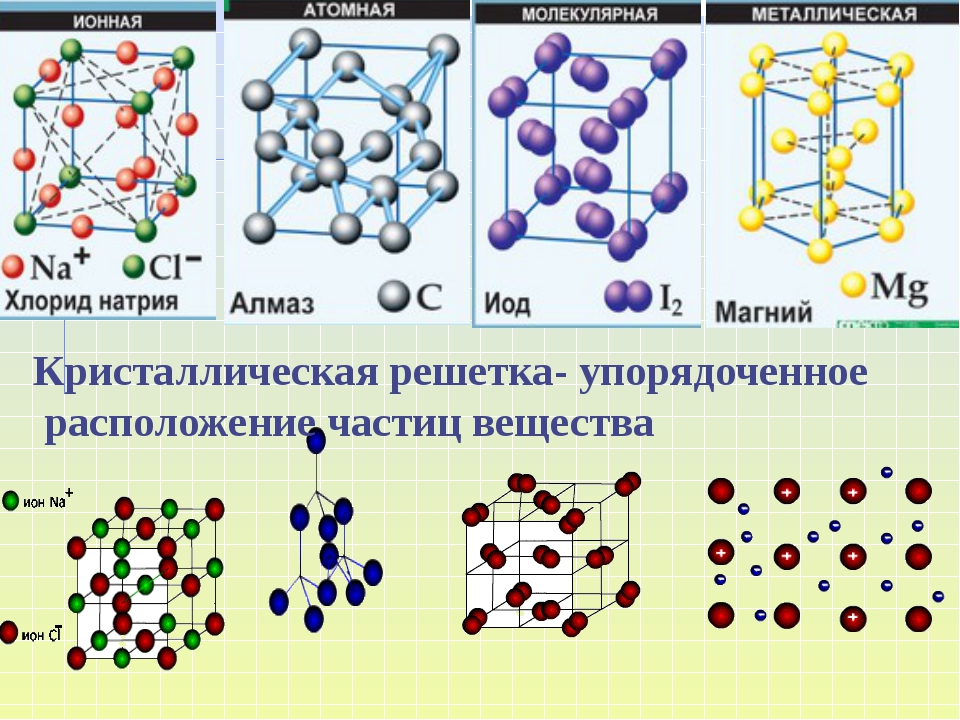 Подвижность молекул в результате этого сильно ограничивается. Хемосорбция в отличие от физической адсорбции носит избирательный характер она протекает с большей интенсивностью в местах нарушений кристаллической решетки включениями или незаполненными узлами. [c.60]
Подвижность молекул в результате этого сильно ограничивается. Хемосорбция в отличие от физической адсорбции носит избирательный характер она протекает с большей интенсивностью в местах нарушений кристаллической решетки включениями или незаполненными узлами. [c.60]
Анодное растворение металла с переходом его в раствор в виде простых гидратированных (или в виде комплексных) ионов во многом представляет собой обращение процесса катодного выделения металлов. Анодный процесс начинается с разрушения кристаллической решетки и заканчивается образованием ионов металла в растворе вместо стадий формирования кристаллической решетки появляются стадии ее разрушения, вместо разряда ионов — ионизация атомов металла и т. д. Общую реакцию анодного растворения металла, если образуются простые гидратированные ноны, можно записать в виде уравнения [c.475]
Образование смешанных кристаллов — изоморфизм.
Поверхностно-активные молекулы, попадая на твердую поверхность, занимают всю свободную поверхность за счет способности перемещаться (мигрировать). Перемещаясь, молекулы проникают в микротрещины на поверхности раздела зерен, в незаполненные узлы кристаллической решетки. При этом значительно понижается свободная поверхностная энергия твердого тела, что в свою очередь приводит к облегчению пластического течения в поверхностном слое. Это действие поверхностно-активных веществ известно как эффект адсорбционной пластификации. [c.61]
Энергии и теплоты сольватации электролитов были рассчитаны впервые Борном и Габером (1919) фи помощи циклов, основанных на термохимическом законе Гесса.
Окклюзия. При окклюзии загрязняющие вещества находятся внутри частиц осадка. Окклюдированные вещества не участвуют в построении кристаллической решетки осадка, хотя в некоторых учебниках образование смешанных кристаллов изоморфизм) рас-смагривается как частный случай окклюзии. Таким образом, окклюзия отличается от адсорбции тем, что соосажденные примеси находятся не на поверхности, а внутри частиц осадка.
Здес ) /(м — константа Маделунга, зависящая от характера взаимного расположения ионов в кристаллической решетке (ее значения известны Д.ПЯ различных типов решетки так, например, для решетки Na l — гранецентрированного куба —/(м = 1,7476) г—равновесное расстояние между ионами противоположного знака в данном кристалле (обычно оно определяется по принципу плотной упаковки и отвечает сумме кристаллохимических радиусов Гольдшмидта) п — константа, характеризующая изменение сил отталкивания с расстоянием между частицами оиа лежит в пределах от 5 до 12 (для Na l п = 7,5). [c.44]
Реально образующиеся кристаллы обычно не бывают идеальными , т. е. не образуют совершенно правильной кристаллической решетки.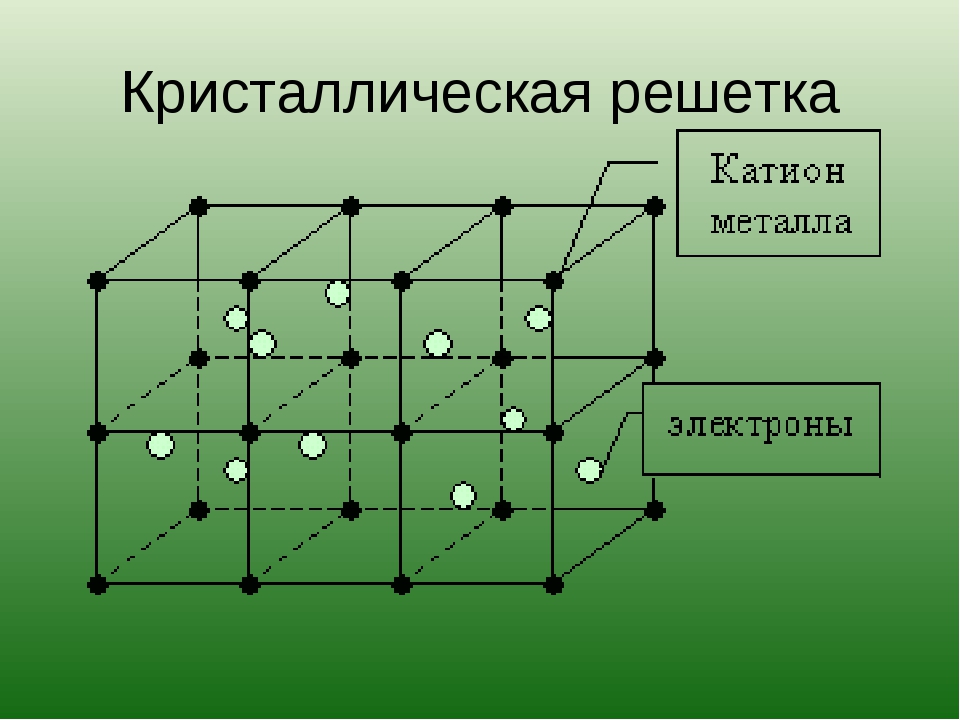 В них имеются мельчайшие трещинки, пустоты, которые заполняются маточным раствором. Кроме того, мельчайшие кристаллики могут слипаться, захватывая маточный раствор. Механический захват посторонних примесей происходит тем сильнее, чем быстрее идет кристаллизация, так как при быстрой кристаллизации ионы как бы не успевают образовать правильную кристаллическую решетку. [c.113]
В них имеются мельчайшие трещинки, пустоты, которые заполняются маточным раствором. Кроме того, мельчайшие кристаллики могут слипаться, захватывая маточный раствор. Механический захват посторонних примесей происходит тем сильнее, чем быстрее идет кристаллизация, так как при быстрой кристаллизации ионы как бы не успевают образовать правильную кристаллическую решетку. [c.113]
Несмотря на все особенности протекания процессов электрохимического выделения металлов, создающие серьезные трудности при проведении экспериментов и при теоретической интерпретации их результатов, к настоящему времени уже накоплен значительный фактический материал и сформировались определенные взгляды на природу этих процессов. Получение достаточно достоверных опытных данных сделалось возможным благодаря развитию техники эксперимента (применение новых методов исследования, при помощи которых удается избежать осложнений, связанны.х с особенностями построения кристаллической решетки и изменением  458]
458]
До сих пор остается недостаточно ясным, почему существует такое большое различие в величине и природе металлического перенапряжения для нормальных и инертных металлов и с какими свойствами металлов (или растворов) оно связано. Была сделана попытка объяснить эти явления различным соотношением между прочностью связи ионов в растворе и в кристаллической решетке нормальных и инертных металлов. Подобное предположение эквивалентно допущению, что в разряде участвуют ионы в той форме, в какой они присутствуют в растворе, и что разряд переводит ион непосредственно в его конечное положение в решетке металла. [c.465]
Нитрид бора ВЫ кристаллизуется в гексагональной системе. Кристаллическая решетка его аналогична решетке графита, в которой один атом замещен бором, а другой азотом. Атомы бора и азота расположены в горизонтальных слоях попеременно. Расстояние между соседними слоями у нитрида бора 3,34А, что несколько меньше, чем у графита, поэтому связь между слоями у ВЫ прочнее, чем у графита. [c.206]
[c.206]
В условиях химического анализа осадок не вносится в раствор в готовом виде, а образуется в нем по мере прибавления осадителя. При этом возникают сначала мельчайшие зародышевые кристаллы, которые постепенно растут, причем поверхность их иепре-рыг.но обновляется за счет отложения все новых и новых слоев соогветствующего вещества. В то же время эта постоянно обнов-лякрщаяся поверхность кристалла непрерывно адсорбирует различные примеси из раствора. В процессе роста кристалла эти примеси постепенно вытесняются ионами, входящими в состав кристаллической решетки осадка. Однако такое вытеснение обычно происходит недостаточно полно. В зависимости от условий осаждения большая или меньшая часть примесей, первоначально находившихся на поверхности частиц, в результате адсорбции оказывается отделенной от раствора вновь отложившимися слоями осаждаемого вещества. [c.113]
Иногда при однократной перекристаллизации достигнуть этого не удается, тогда ее повторяют 2—3 раза.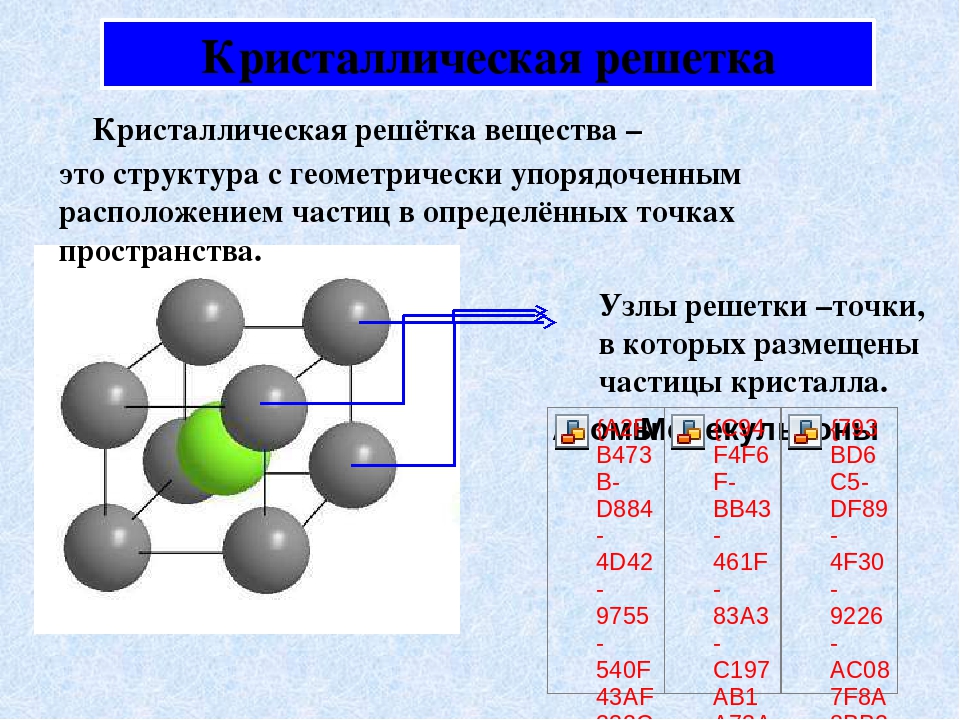 Встречаются, однако, материалы, даже многократная перекристаллизация которых не приводит к цели вследствие того, что соответствующая примесь участвует в построении кристаллической решетки очищаемого вещества, образуя с ним так называемые смешанные кристаллы. [c.42]
Встречаются, однако, материалы, даже многократная перекристаллизация которых не приводит к цели вследствие того, что соответствующая примесь участвует в построении кристаллической решетки очищаемого вещества, образуя с ним так называемые смешанные кристаллы. [c.42]
Существенным недостатком теории А()рениуса является и то, что оиа не указывает причин, вызываощих ионизацию электролитов в растворах. Расчеты энергии кристаллической решетки АС,,, разрушение которой должно предшествовать появлению свободных ионов, присутствующих в растворе, показывают, что количество термической энергии ири обычных температурах слишком мало по сравнению с тем, которое надо затратит1з на раз[)ушение решетки. Одним из первых и в то >ке время одним из наиболее точных уравнений для подсчета энергии решетки считается уравнение Борна (1918) [c.44]
Как видно из сказанного, называть эти осадки аморфными не совсем правильно. Правильнее было бы называть их скрытокристаллическими , поскольку они образуются из кристаллов, хотя и мельчайших. Действительно, наличие кристаллической решетки у аморфных осадков может быть в большинстве случаев доказано на опыте путем исследования их с помощью рентгеновских лучей, а иногда и под микроскопом. [c.99]
Действительно, наличие кристаллической решетки у аморфных осадков может быть в большинстве случаев доказано на опыте путем исследования их с помощью рентгеновских лучей, а иногда и под микроскопом. [c.99]
В каких случаях ионы могут изоморфно замещать друг друга при построении кристаллической решетки [c.159]
При погружении какого-либо металла в водный раствор, содер-лкатионы этого металла, катионы из кристаллической решетки металла способны частично перейти в близлежащий слой раствора (процесс окисления) и, наоборот, небольшая часть катионов [c.344]
Сущность изоморфизма заключается в том, что ионы, имеющие одинаковое координационное число и близкие радиусы, могут замещать друг друга в кристаллической решетке, не нарушая ее [c.115]
Как влияют на адсорбцию а) температура, б) концентрация адсорбируемых веществ в растворе В чем проявляется избирательный характер адсорбции Какие ионы адсорбируются дайной кристаллической решеткой лучше других [c. 159]
159]
Полезную работу выполняют все уровни кирпича и веществ, из которых он состоит. Кирпич работает на уровне камня, на уровне теплоизолирующих полостей, на уровне пор и капилляров, на уровне кристаллической решетки, на молекулярном уровне и т. д. [c.116]
Застывание масла может быть связано с двумя различными процессами постепенным повышением вязкости вплоть до превращения масла в аморфную стекловидную массу или образованием кристаллического каркаса из высокоплавких парафиновых углеводородов. При производстве масел для обеспечения низкой температуры застывания из них стараются удалить высокоплавкие парафины. Крометого, понизить температуру застывания можно специальными присадками — депрессаторами. Действие депрессаторов объясняют способностью их ослаблять силы молекулярного взаимодействия между кристаллами парафина, вследствие чего уменьшается возможность образования пространственной кристаллической решетки. [c.158]
[c.158]
Для вещественных структур определенного уровня пустотой являются структуры нижних уровней (см. примечание 25). Так, для кристаллической решетки пустотой являются отде тьные сложные молекулы, для молекул —отдельные атомы и т. д. [c.201]
Диселенид молибдена Мо5е2 имеет гексагональную решетку с параметрами а = 3,28А, С = 12,84А. Кристаллическая решетка МоЗег аналогична решетке Мо32, в которой атомы серы заменены атомами селена. До температуры 400° С на воздухе диселенид молибдена не окисляется. [c.206]
В отличие от радиуса Ва + радиус Са + (1,06 А) значительно меньше, чем радиус Ка2+. Вследствие этого Са + и Ка2+ не могут входить в одну и ту же кристаллическую решетку, т. е. изоморфно замещать друг друга. В соответствии с этим Ка +-ионы не соосаждаются с Са304. [c.116]
В 27 указывалось, что осадки с ионной кристаллической решеткой обычно особенно сильно адсорбируют из раствора одноименные ионы. Например, осадок Agi сильнее всего адсорбирует Ag+ или 1 , смотря по тому, избыток каких из них находится в данный момент в титруемом растворе. Поэтому, если титруют раствор KI раствором AgNOa, то до достижения точки эквивалентности частицы осадка Agi адсорбируют из раствора 1 , заряжаясь вследствие этого отрицательно. Эти отрицательно заряженные частицы притягивают из раствора противононы К+, т. е. осадок будет содержать примесь KI. [c.326]
Например, осадок Agi сильнее всего адсорбирует Ag+ или 1 , смотря по тому, избыток каких из них находится в данный момент в титруемом растворе. Поэтому, если титруют раствор KI раствором AgNOa, то до достижения точки эквивалентности частицы осадка Agi адсорбируют из раствора 1 , заряжаясь вследствие этого отрицательно. Эти отрицательно заряженные частицы притягивают из раствора противононы К+, т. е. осадок будет содержать примесь KI. [c.326]
У —работа вырыиання иона ия кристаллической решетки (Дж-моль- ) у — работа выры1 ання нона из кристаллической решетки, отнесенная к [c.7]
Причину различия в значениях металлического перенапряжения и в характере катодных осадков можно было бы искать в неодинаковой склонности металлов к пассивированию и в их разной адсорбционной способности. Появле иен на поверхностн растущего осадка посторонних веществ затрудняет и разряд металлических иоиов, и их внедрение в кристаллическую решетку. Этот тормозящий эффект должен быть тем замегпее, чем легче пассивируется данный металл. Пассивирующими агентами могут быть растворенный кислород, примеси органических соединет1ий и каталитичес- [c.468]
Пассивирующими агентами могут быть растворенный кислород, примеси органических соединет1ий и каталитичес- [c.468]
Пассивационные и концентрационные эффекты играют важную роль в процессах роста кристаллов, однако они не исчерпывают всех причин, вызывающих отклснение реальной картины кристаллизации от идеализированной модели Фольмера. Отклонения от модели Фольмера объясняются и нарушениями идеальной структуры кристалла, т. е. дефектами кристаллической решетки, и в первую очередь появлением участков с расположением структурных элементов, отличным от их расположения в идеальной решетке данного кристаллического тела, так называемых дислокаций. [c.338]
Электролитическое вгзгделепие ме7аллов чаще всего проводят нз растворов нх простых солей — сульфатов,. хлоридов или нитратов. Суммарной катодной реакцией в этом случае будет разряд гидратированных металлических иопов с их последующим переходом в кристаллическую решетку образующегося на катоде осадка [c. 453]
453]
Химия (1986) — [ c.100 ]
Неорганическая химия (1987) — [ c.104 , c.258 ]
Химия (1979) — [ c.104 ]
Курс неорганической химии (1963) — [ c.230 , c.231 , c.233 , c.235 , c.237 , c.240 , c.241 , c.242 , c.244 , c.245 , c.329 , c.331 , c.482 ]
Теоретические проблемы органической химии (1956) — [
c. 32
,
c.34
]
32
,
c.34
]
Основные начала органической химии том 1 (1963) — [ c.0 ]
Курс химии Часть 1 (1972) — [ c.142 ]
Основные начала органической химии Том 1 Издание 6 (1954) — [ c.0 ]
Общая химия 1982 (1982) — [ c.53 , c.118 , c.162 , c.536 ]
Общая химия 1986 (1986) — [ c.152 , c.155 , c.519 ]
Общая и неорганическая химия (1959) — [ c.110 ]
Неорганическая химия (1978) — [
c. 237
]
237
]
Химия (1975) — [ c.102 ]
Химия (1982) — [ c.53 ]
Общая химия Издание 18 (1976) — [ c.156 , c.158 , c.530 ]
Общая химия Издание 22 (1982) — [ c.53 , c.118 , c.162 , c.536 ]
Курс неорганической химии (1972) — [ c.206 , c.221 , c.294 , c.295 ]
Кристаллические решетки — Персональный сайт учителя химии Куликовой Надежды Владимировны
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» — пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
Таблица: Свойства веществ с различной кристаллической решёткой
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
Атомная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся отдельные атомы. Атомы в таких решётках соединены между собой прочными ковалентными связями.
Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами.
Ионная кристаллическая решётка образована ионами, связанными друг с другом электростатическим взаимодействием.
Такая кристаллическая решётка характерна, например, для поваренной соли — хлорида натрия.
Молекулярная кристаллическая решётка — это кристаллическая решётка, в узлах которой находятся молекулы какого–либо вещества.
IV. Закрепление
Задание №1. Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4COOH), сахар (C12h32O11), калийное удобрение (KCl), речной песок (SiO2) – температура плавления 1710 0C, аммиак (Nh4), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
Задание №2. По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
По формулам приведённых веществ: SiC, CS2, NaBr, C2h3 — определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
V. Тренажеры
Тренажёр №1. «Кристаллические решётки»
Тренажёр №2. «Тестовые задания»
VI. Выполните тест
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a) тугоплавки и хорошо растворимы в воде
б) легкоплавки и летучи
в) тверды и электропроводны
г) теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
a) вода
б) кислород
в) алмаз
г) озон
3) Атомная кристаллическая решётка характерна для:
a) алюминия и графита
б) серы и йода
в) оксида кремния и хлорида натрия
г) алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а) молекулярная
б) атомная
в) ионная
г) металлическая
Презентация «Кристаллические решётки»
Конспект урока химии в 8 классе на тему
«Кристаллические решётки» (слайд 1)
Тип урока: урок изучения нового материала.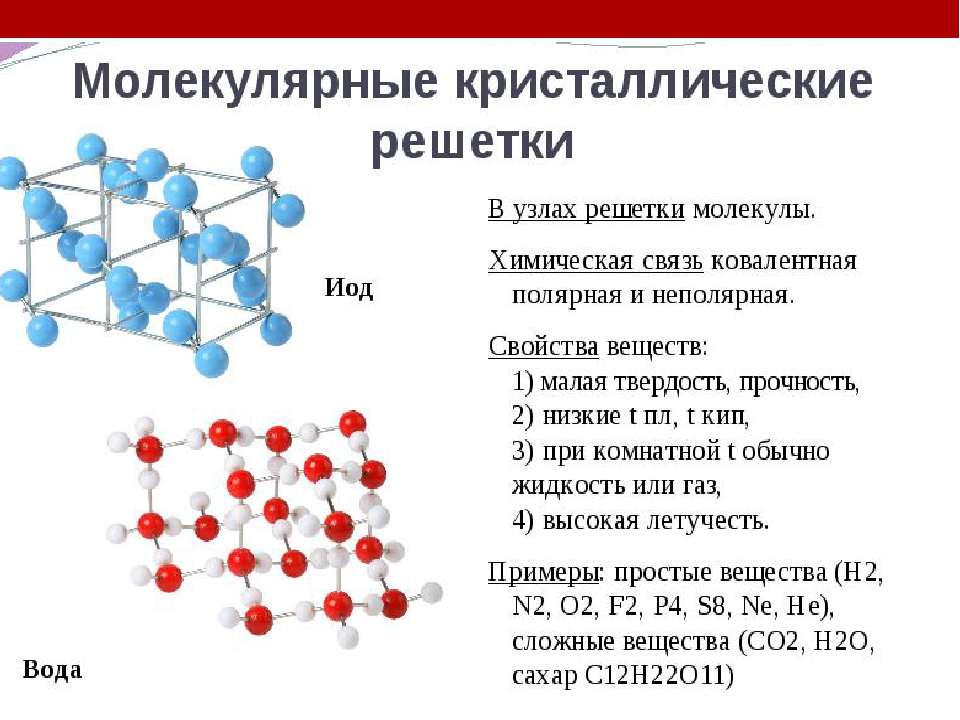
Методы и технологии, применяемые при обучении: проблемное обучение, ИКТ, самостоятельная работа учащихся.
Цель: изучение типов кристаллических решеток.
Задачи:
Образовательные:
создать условия для самостоятельного решения учебно-познавательных задач;
способствовать актуализации и закреплению знаний обучающихся об агрегатных состояниях веществах и условиях перехода вещества из одного состояния в другое;
ознакомить с понятиями «аморфного» и «кристаллического» веществ, выявить зависимость «свойство вещества – тип кристаллической решетки», «свойство вещества — химическая связь», «свойство вещества — строение атомов»;
создать условия для овладения первичными навыками определения типа кристаллической решетки и определение по типу решётки физических свойств веществ;
Развивающие:
способствовать развитию познавательного интереса обучающихся к предмету;
развивать познавательные умения;
развивать навыки работы с информацией, представленной в различном виде (текстовая, видео, графическая), и перевода её в другую форму, систематизации в виде схемы или таблицы;
развивать коммуникативные навыки общения через работу в парах;
Воспитательные:
культуры умственного труда (ведения записей, самостоятельного оформления информации и др.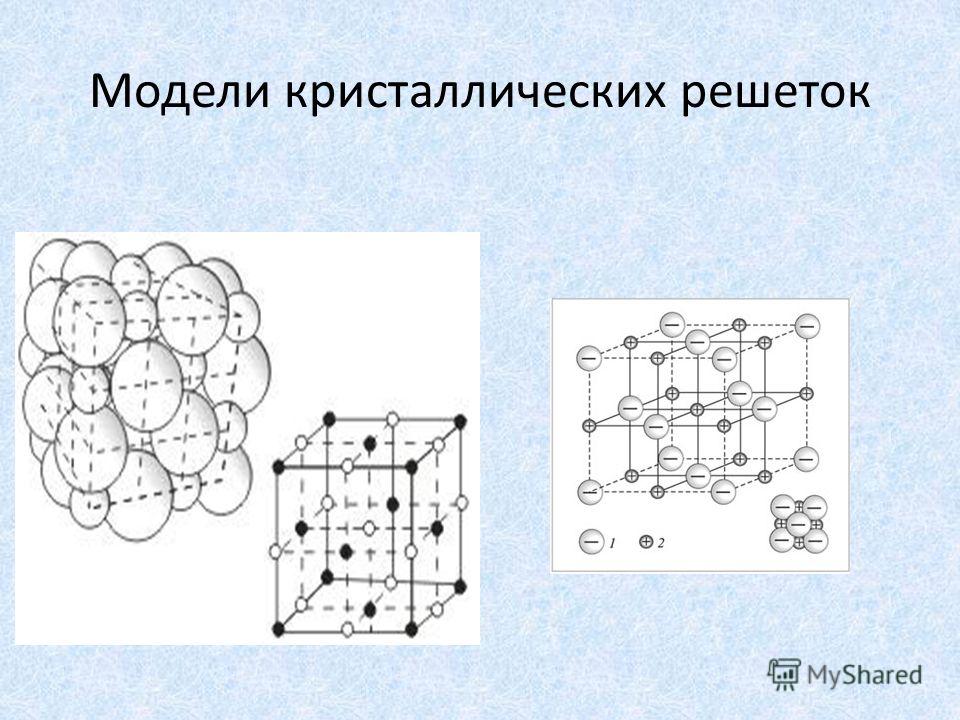 ).
).
Оборудование:
Мультимедийное: проектор, экран или интерактивная доска, компьютер или ноутбук, презентация;
Вещества: пластилин, мука, пластмасса, соль, сахар, графит.
ХОД УРОКА
Химия создала свой предмет. Эта творческая способность, подобная искусству, коренным образом отличает химию от остальных естественных наук.
М. Бертло
I. Организационный момент
— Здравствуйте, ребята! Каково настроение на начало урока?
II. Актуализация знаний учащихся
— Ответьте на вопрос, пожалуйста, в каком виде чаще всего существуют химические элементы?
— А если есть соединения, это значит, что между атомами элементов этого соединения существует какая-то связь. Вы согласны с этим?
— Какие виды химической связи вам известны?
— Давайте проверим, насколько хорошо вы их помните и выполним небольшую проверочную работу.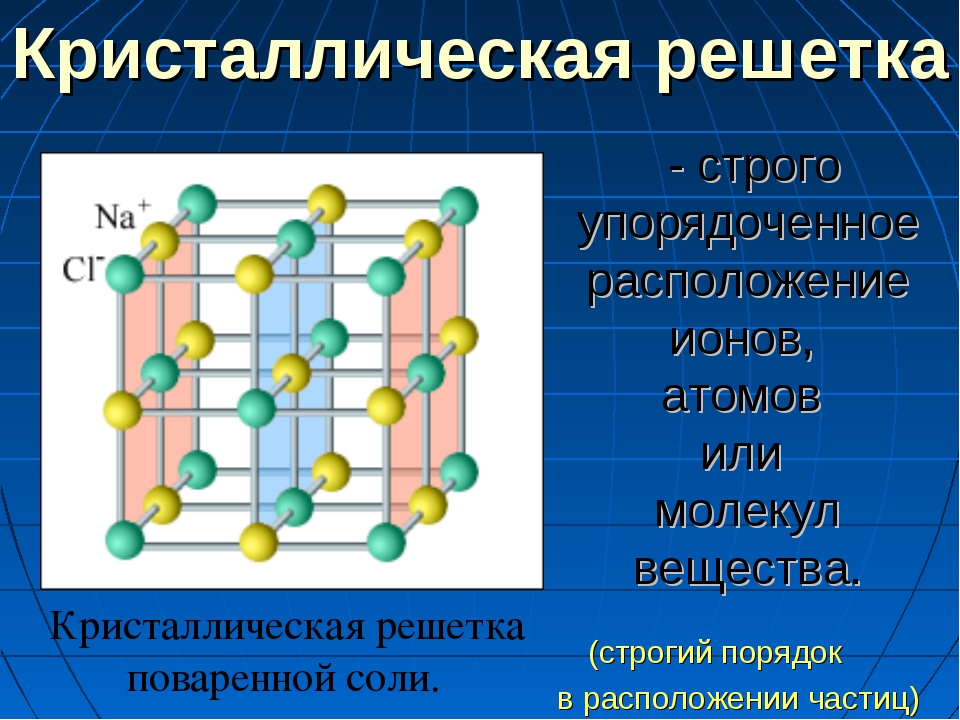
Задачи: повторить виды химических связей, особенности образования связей (слайд 2 — 4)
— Выберите правильный ответ:
1. В молекуле Cl2 тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
2. В молекуле Н2О тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
3. В молекуле NaF тип связи:
а) ковалентная полярная; б) ковалентная неполярная; в) ионная
4. В образовании ионной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
5. В образовании ковалентной полярной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
6. В образовании ковалентной неполярной связи принимают участие:
В образовании ковалентной неполярной связи принимают участие:
а) атомы одного и того же неметалла; б) металл и неметалл; в) атомы разных неметаллов.
7. В веществах металлах возникает связь: а) ионная, б) ковалентная неполярная, в) металлическая
После выполнения работы – взаимопроверка по парам.
III. Новый материал
-Веществ, которые нас окружают, множество. И всё многообразие этих веществ объединяет и в то же время разделяет то, что они имеют разное внутреннее строение (слайд 5)
— Очень часто, сами того не замечая, мы встречаемся и с веществами-кристаллами. Мы ходим по кристаллам, строим из кристаллов, создаём приборы и изделия из кристаллов, широко применяем кристаллы в науке и технике, едим кристаллы, находим кристаллы в живых организмах…
— Так что же такое кристаллы?
— Задачи нашего урока: понять, что такое кристаллическое и аморфное состояние твёрдых веществ, познакомиться с типами кристаллических решёток.
— Какие агрегатные состояния веществ вам известны? (слайд 6-7)
— Посмотрите на вещества на ваших столах и распределите их на 2 группы.
— Какие вещества вы отнесли в 1-ю группу? (пластилин, мука, пластмасса)
— Это аморфные вещества. У них нет постоянной температуры плавления, наблюдается текучесть, нет кристаллической решётки.
— Какие вещества отнесли ко 2-й группе? (соль, сахар, графит)
— Это кристаллические вещества. Для них характерны чёткие температуры плавления, симметрия, чёткие правильные формы.
— Применение находят и аморфные, и кристаллические вещества. (слайд 8)
Вещества обладают самыми разными свойствами. Различают физические и химические свойства веществ. Какие свойства мы отнесём к физическим? Какие к химическим?
— Используя только понятие о физических свойства попробуем дать характеристику следующим веществам: водород, углекислый газ, сахар, сажа.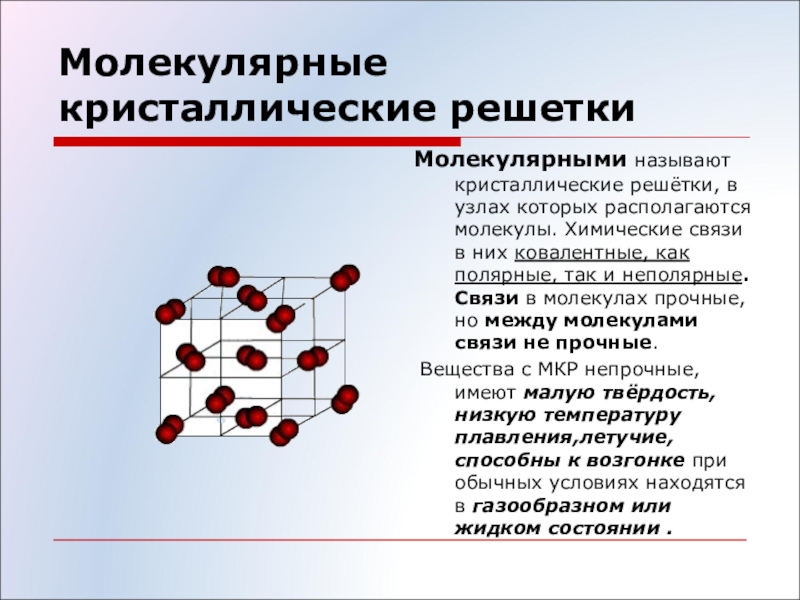
— По физическим свойствам веществ можно определить их строение: СТРОЕНИЕ АТОМА – ХИМИЧЕСКАЯ СВЯЗЬ – КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА – СВОЙСТВА ВЕЩЕСТВА
— Что же такое кристаллическая решётка? Как вы это понимаете? (слайд 9)
— Всего выделяют четыре типа кристаллических решёток (слайд 10)
Физминутка (слайд 11)
Зайцы бегали в лесу, (бег на месте)
Повстречали там лису (повилять «хвостиком»)
Прыг-скок, прыг-скок, (прыжки на месте)
Убежали под кусток. (присесть)
— А теперь вместе постараемся с вами заполнить таблицу «Типы кристаллических решеток» (слайд 12 — 16)
— Вещества с молекулярным строением подчиняются закону постоянства состава вещества; вещества молекулярного строения имеют постоянный состав независимо от способа их получения. Данный заключение принадлежит Ж.Л. Прусту, и в дальнейшем стало Законом Пруста. (слайд 17 — 18)
(слайд 17 — 18)
— Давайте возьмём вещество Н2О. Как называется это вещество (привести всевозможные названия)?
— Простое или сложное?
— Какие химические элементы входят в состав?
— Какую кристаллическую решётку имеет?
— Найдите молярную массу.
— Число молекул?
IV. Закрепление
Работа в парах.
— Оксид кремния имеет атомную кристаллическую решётку. Каковы его физические свойства?
— Какой тип кристаллической решётки у карбоната кальция? (ионная)
— Оксид углерода (IV) имеет низкую температуру плавления, а кварц SiO3 — очень высокую. Какие кристаллические решётки они должны иметь? (молекулярную и атомную соответственно).
V. Обобщение, итог
— На сегодняшнем занятии мы с вами постарались заглянуть внутрь веществ и, в целом, вещей.
Сейчас давайте заслушаем несколько сообщений о некоторых драгоценных камнях (выступают отдельные обучающиеся с индивидуальными сообщениями).
IV. Домашнее задание. Домашний химический эксперимент «Выращивание кристаллов»
— Некоторые вещества встречаются в виде кристаллов. Кристаллы можно встретить не только в природе, но и вырастить в бытовых условиях. Попробуйте «похимичить» дома и выполнить практическое домашнее задание по выращиванию кристаллов. Инструкция по выполнению этого задания у вас на партах.
— Параграф 22.
Рефлексия.
— Скажите, каково ваше настроение в конце урока, закончив предложения
Мне понравилось…
У меня возникли затруднения при … (затруднения с …)
Я хотел бы …
Благодарю вас за работу. (слайд 19)
(слайд 19)
Оборудование и вещества: чистые стаканы, картон, карандаш, нитки, вода, соль (хлорид натрия, или медный купорос).
Ход работы
1 способ. Банку с насыщенным раствором закройте картоном и подождите, пока при медленном охлаждении на дно выпадут кристаллы. Обсушите кристаллы на салфетке, несколько самых привлекательных укрепите на нитке, привяжите к карандашу и опустите в насыщенный раствор, освобожденный от других кристаллов. Кристаллы могут расти 2-3 недели
2 способ. Приготовьте насыщенный раствор выбранной вами соли. Для этого в горячую воду насыпьте порциями соль и перемешивайте до растворения. Как только соль перестанет растворяться, раствор насыщен. Раствор профильтруйте через марлю. Этот раствор налейте в стакан, положите карандаш с ниткой и грузом (пуговичка, например). Через 2-3 дня груз должен обрасти кристалликами.
Список литературы
Энциклопедия «Эрудит»
Энциклопедия «Я познаю мир»
Интернет — ресурсы
www. alhimik.ru
alhimik.ru
www.1september.ru
http://www.hemi.nsu.ru/ucheb139.htm
http://www.alhimikov.net/elektronbuch/Page-11.html
Химические элементы и вещества в свете электронной теории. Кристаллическая структура 9 класс онлайн-подготовка на
Химические связи. Кристаллическая структура
Практически все вещества в природе могут находиться в трех агрегатных состояниях — газообразном, жидком и твердом. При этом вполне обычным представляется их последовательный переход из одного состояния в другое, например, при охлаждении: газ конденсируется в жидкость, а затем кристаллизуется.
Одинаковые молекулы связаны между собой во всем объеме одинаково. Это приводит к образованию периодически повторяющейся в пространстве структуры – кристаллической решетки.
Твердыми кристаллическими именуются те вещества и тела, которые имеют определенный тип пространственной кристаллической решетки, то есть обладают способностью изменяться в определенном направлении, но не во всех (это называется анизотропия).
Изотропия — способность менять физические характеристики по всем направлениям одновременно.
Строение, свойства кристаллических и аморфных тел совершенно различны. Если первые имеют четко ограниченную структуру, состоящую из упорядоченно расположенных частиц в пространстве, то у вторых всякий порядок отсутствует.
Общие свойства:
● Механические — то есть: упругость, твердость, способность к деформации.
● Тепловые — это температуры кипения и плавления, а также коэффициент теплового расширения. Электрические и магнитные — проводимость тепловая и электрическая.
Если описывать строение кристаллических и аморфных тел, то в первую очередь следует указать тип частиц, которые их слагают. В случае кристаллов это могут быть ионы, атомы, атом-ионы (в металлах), молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
1. Ионная кристаллическая решетка. Её имеют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.
2. Металлическая кристаллическая решетка обусловлена металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны.
3. Атомная кристаллическая решетка — атомы веществ соединены между собой прочными ковалентными химическими связями.
4. Молекулярная кристаллическая решетка
В узлах молекулярного типа кристаллической решётки располагаются молекулы. Как правило, легко разрушить.
Как устроена кристаллическая решетка металлов
Твердое, жидкое, газообразное тело: что в них общего? Конечно, частицы, из которых они состоят. Таким образом, все химические вещества образуются из мельчайших частиц, которые соединяются между собой связями: более или менее сильными, в зависимости от агрегатного состояния. Частицы образуют решетки. Кристаллическая решетка металлов — это одна из типов решеток, представленных в природе.
Таким образом, все химические вещества образуются из мельчайших частиц, которые соединяются между собой связями: более или менее сильными, в зависимости от агрегатного состояния. Частицы образуют решетки. Кристаллическая решетка металлов — это одна из типов решеток, представленных в природе.
Состав кристаллической решетки
Итак, еще из школьного курса химии и физики нам известно, что абсолютно все вещества состоят из мелких частиц, которые связаны между собой. И вот именно от силы связей зависит то, в каком агрегатном состоянии находится тело: твердое, жидкое или газообразное. Когда частицы имеют строгую ориентацию в пространстве, то они формируют твердое тело. Все твердые тела имеют четкие контуры из-за четкой структуры их мелких частей. Что же касается мелких частиц, то, несмотря на свое строгое место в пространстве, они все равно продолжают двигаться. Скорость и амплитуда такого движения напрямую зависит от температуры: если она ниже нуля, то скорость падает и образуется твердое тело, что касается высоких температур, то в таком случае будут образовываться газообразные и жидкие тела, а частицы будут просто быстро двигаться и перемещаться.
Остановимся все же на организации твердых тел. Когда частицы (атомы, молекулы или ионы) точно определены с местом в пространстве, то таким образом обязуется кристаллическая решетка. Частицы могут располагаться как между узлами в пространстве, так и непосредственно в узлах. Молекулярная, атомная, металлическая и ионная – эти четыре типа решеток существуют в природе. Разница между решетками сводится до частиц, которые находятся в узлах и связях, протекающих между ними.
Молекулярные решетки
Молекулярная кристаллическая решетка представляет собой молекулы, которые располагаются в узлах. Связаны такие частицы довольно слабыми связями – межмолекулярными, которые еще называются Ван-дер-Ваальсовыми. Тем не менее, сами молекулы состоят из атомов. Между атомами существует связь намного прочнее и крепче, которая называется ковалентной. Такой тип кристаллической решетки имеется в хлоре, двуокиси углерода, твердом водороде и других веществах, которые являются газообразными при обычной температуре. Именно такая структура зачастую встречается в природе. При этом даже неорганические вещества могут обладать такой структурой: твердые галогеноводороды, лед, сера и некоторые другие. Из-за низкой температуры плавления тела с такой структурой строения очень быстро воспламеняются и плавятся.
Именно такая структура зачастую встречается в природе. При этом даже неорганические вещества могут обладать такой структурой: твердые галогеноводороды, лед, сера и некоторые другие. Из-за низкой температуры плавления тела с такой структурой строения очень быстро воспламеняются и плавятся.
Что же касается структуры, которую представляет металлическая кристаллическая решетка, то такие типы частиц свободно движутся лишь в теле кристалла, расположенном в четко определенном узле. Но все же такие частицы имеют возможность свободно передвигаться по кристаллической решетке. Благодаря тому, что частицы, из которых состоит кристаллическая решетка металлов, заряжены по-разному, то они притягиваются друг к другу и образовывают структуру металла.
Благодаря электронном газу, который состоит из свободных движущихся электронов, металл может иметь свойства высокой электро- и теплопроводности. Как только в поле решетки появляется электрическое поле, то электроны тут же направляются в сторону положительных частиц. За счет таких движений образуется ток. Такой тип решетки зачастую составляет элементарные металлы и приспособлен для соединения разных металлов.
За счет таких движений образуется ток. Такой тип решетки зачастую составляет элементарные металлы и приспособлен для соединения разных металлов.
Но несмотря на это нельзя точно утверждать, что свойства всех металлов одинаковы, они, наоборот, кардинально отличаются друг от друга. Ведь взаимодействие между электронами и ионами создают тип металла. Также кристаллическая решетка формируется за счет свободных электродов, которые летают в области решетки. За счет решетки металлы имеют высокую температуру плавления (выше, чем органические вещества).
Видео: Опыты по химии. Модели кристаллических решеток
§23. Кристаллические решетки | 8 класс
1. В каком агрегатном состоянии будет находиться кислород при -205°С?
Так как температура кипения кислорода равна -183°С, а плавления -218°, то при -205°С кислород будет в жидком состоянии.
2. Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твердого кислорода, используя его описание, приведенное в книге.
В произведении Беляева есть описание жидкого воздуха: «Жидкий воздух!.. Ведь его плотность в 800 раз больше атмосферного… Жидкий воздух представляет легко подвижную прозрачную жидкость бледно-голубого цвета с температурой минус сто девяносто три градуса Цельсия при нормально-атмосферном давлении… Полученный из аппарата воздух бывает мутным в следствие примеси замерзшей углекислоты, которая в незначительном количестве содержится в воздухе. После профильтрования через бумажный фильтр воздух становится прозрачным… При испарении жидкого воздуха сначала выделяется кипящий азот, точка кипения которого минус сто девяносто четыре градуса Цельсия, потом аргон…»
3. К какому типу веществ (кристаллические или аморфные) относятся пластмассы? Какие свойства пластмасс лежат в основе их промышленного применения?
Пластмассы – это аморфные вещества. Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять заданную форму после охлаждения или отвердения. Именно эти свойства лежат в основе широкого применения пластмасс в промышленности.
Название «пластмассы» означает, что эти материалы под действием нагревания и давления способны формироваться и сохранять заданную форму после охлаждения или отвердения. Именно эти свойства лежат в основе широкого применения пластмасс в промышленности.
4. К какому типу относится кристаллическая решетка алмаза? Перечислите характерные для алмаза физические свойства.
Алмаз – прозрачное кристаллическое вещество, которое является самым твердым из всех существующих. Такая твердость алмаза вызвана особой структурой атомной кристаллической решетки, где каждый атом углерода окружен другими атомами углерода, расположенными в вершинах правильного тетраэдра. У алмаза наиболее высокая теплопроводность среди всех твердых тел 900-2300 Вт/(м·К), большой показатель преломления и дисперсия.
5. К какому типу относится кристаллическая решетка йода? Перечислите характерные для йода физические свойства.
Йод – простое вещество при нормальных условиях – кристаллы черно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I₂). Молекулярная кристаллическая решетка.
Молекула вещества двухатомна (формула I₂). Молекулярная кристаллическая решетка.
6. Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
Температура плавления зависит от прочности структуры кристаллической решетки, которая, в свою очередь, зависит от формы решетки, структуры составляющих ее ионов и многих других факторов. Кроме того, атомов металлов очень много, и они весьма разнятся по своим свойствам – диаметру атома, заряду ядра, количество внешних электронов и т.д. из-за этого и разница в значениях энергии связи и, как следствие, температурах плавления.
7. Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком – нет? Почему?
В кремнии атомная кристаллическая решетка, атомы соединены между собой ковалентной связью.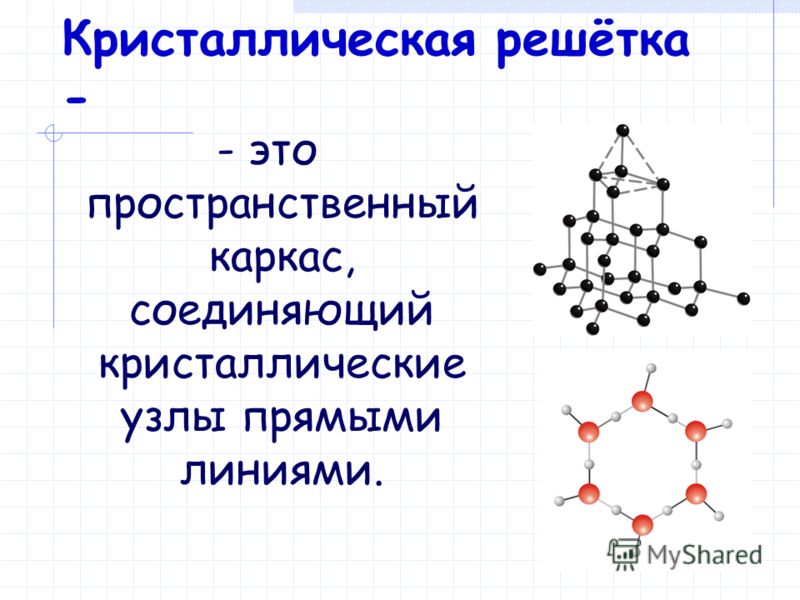 Во время удара ковалентные химические связи Si-Si разрываются, и изделия из кремния раскалываются.
Во время удара ковалентные химические связи Si-Si разрываются, и изделия из кремния раскалываются.
Атомы свинца связаны между собой металлической связью и образуют металлическую кристаллическую решетку, где все электроны общие. При ударе происходит деформация кристаллической решетки, но разрушение химической связи не происходит, так как этому мешают общие электроны.
Основы кристаллографии | Цех химического приборостроения
Основы кристаллографии
Q1. Что такое кристалл?
Q2. Что такое кристаллическая структура?
Q3. Что такое элементарная ячейка и решетка?
Q4. Как расположение атомов определяет кристаллическую структуру?
Q1. Что такое Кристалл?
А1. Кристалл состоит из вещества, состоящего из упорядоченного трехмерного расположения атомов, молекул или ионов.Это можно представить как укладку кирпичей в стену (напоминающую двумерное упорядоченное расположение кирпичей!).
| 2D Заказанные Организация кирпича | 3D Заказанные ассортимент атомов | |
Q2. Что такое кристаллическая структура?
А2. Кристаллическая структура – это уникальное расположение атомов, молекул или ионов в кристалле. Он состоит из мотива, представляющего собой набор атомов, расположенных определенным образом, и решетки.Мотивы располагаются на точках решетки, которая представляет собой массив точек, периодически повторяющихся в трех измерениях. Точки можно представить себе как образующие одинаковые крошечные коробки, называемые элементарными ячейками , которые заполняют пространство решетки.
Длины ребер элементарной ячейки и углы между ними называются параметрами решетки.
В природе часто наблюдается, что один элемент/молекула может существовать в различной кристаллической структуре, основанной на различиях в периодическом расположении атомов по отношению друг к другу.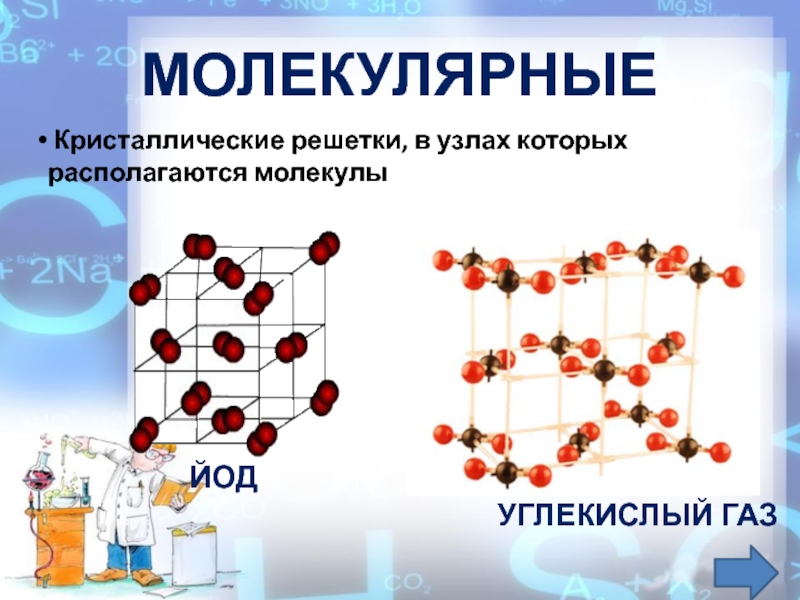 Это свойство материалов существовать более чем в одной форме или кристаллической структуре называется полиморфизмом .
Это свойство материалов существовать более чем в одной форме или кристаллической структуре называется полиморфизмом .
Примером полиморфизма, который легко увидеть в нашей повседневной жизни, является углерод; он существует как алмаз и графит, из которых алмаз является самым твердым материалом, который используется в режущих инструментах, а также в ювелирных изделиях. Однако графит — мягкий материал, который находит применение в наших карандашах и смазках. На приведенных ниже рисунках показаны принципиальные различия в том, как атомы расположены в трехмерных массивах в алмазе и графите, которые состоят из одного и того же элемента углерода.
| Атомы углерода в Diamond | Атомы углерода в графите |
Q3. Что такое элементарная ячейка и решетка? Существует ли какая-либо классификация элементарных ячеек и решеток, основанная на расположении атомов?
А3. Элементарная ячейка является наименьшим строительным блоком кристалла и репрезентативной единицей повторяющихся мотивов в кристаллической структуре.
Элементарная ячейка является наименьшим строительным блоком кристалла и репрезентативной единицей повторяющихся мотивов в кристаллической структуре.
Решетка является геометрической основой всех кристаллов. Решетку можно рассматривать как правильное и бесконечное расположение точек/атомов, где каждая точка/атом имеет одно и то же окружение. Это одинаково применимо в одно-, двух- и трехмерном пространстве.
Решетки в трех измерениях имеют три некомпланарных постоянных решетки (как коробка для обуви!), обозначенные векторами переноса Y , и Z соответственно для трех вершин, обращенных к перпендикулярному друг другу), и угол между тремя вершинами BC, AC, и AB , обозначенный α (альфа) , β (бета) и g (гамма) соответственно.
Начнем с двумерной решетки, которую можно рассматривать как сеть , как показано ниже.
Двумерная решетка в виде сетки
Сетка представляет собой массив точек (показан розовыми точками!). Эта чистая решетка (выше) представляет собой двойную вращательную симметрию относительно каждой розовой точки (представляющей положение атома).
При выборе элементарной ячейки соблюдаются универсальные кристаллографические правила; элементарная ячейка — это наименьшая повторяющаяся единица, для которой ее очерчивающие векторы параллельны или совпадают с важными направлениями симметрии в решетке.На приведенном выше рисунке a и b — это возможная элементарная ячейка, но она не дает информации о симметрии решетки, если рассматривать ее отдельно. Однако a` и b` (зеленые) совпадают с линиями симметрии (зеркальными) в сети, поэтому они предпочтительнее.
Трехмерные решетки (также известные как решетки Браве) можно представить себе как возникающие путем регулярного укладки сетей. Это можно сделать 14 способами, как показано ниже:
Элементарные ячейки 14 решеток Браве (трехмерные решетки)
Каждая решетка представлена элементарной ячейкой, очерченной тремя векторами a, b, и c . В соответствии с соглашением эти векторы выбираются так, чтобы они оба образовывали параллелепипед наименьшего объема в решетке и были параллельны или совпадали с важными направлениями симметрии в решетке, так что не все обычные элементарные ячейки являются примитивными. В трех измерениях мы сталкиваемся с элементарными ячейками, центрированными на паре противоположных граней, объемно-центрированными или центрированными на всех гранях.
В соответствии с соглашением эти векторы выбираются так, чтобы они оба образовывали параллелепипед наименьшего объема в решетке и были параллельны или совпадали с важными направлениями симметрии в решетке, так что не все обычные элементарные ячейки являются примитивными. В трех измерениях мы сталкиваемся с элементарными ячейками, центрированными на паре противоположных граней, объемно-центрированными или центрированными на всех гранях.
Для получения дополнительной информации прочитайте книгу, указанную в справочнике.
Ссылка: Определение структуры с помощью рентгеновской кристаллографии, М.ФК Лэдд и Р.А. Палмер, 3-е издание, Plenum Press, Нью-Йорк.
Q4. Как различное расположение атомов в элементарной ячейке и решетке помогает определить кристаллическую структуру соединения?
А4. Из-за различного расположения атомов в элементарной ячейке рентгеновские лучи дифрагируют по-разному. Каждая структура имеет уникальную рентгенограмму (сравнимую с отпечатками пальцев человека), которая дает информацию об определенном пространственном расположении атомов в элементарной ячейке и решетке. Это, в свою очередь, дает информацию о кристаллической структуре.
Это, в свою очередь, дает информацию о кристаллической структуре.
Следующий раздел >> Состояние вопроса
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.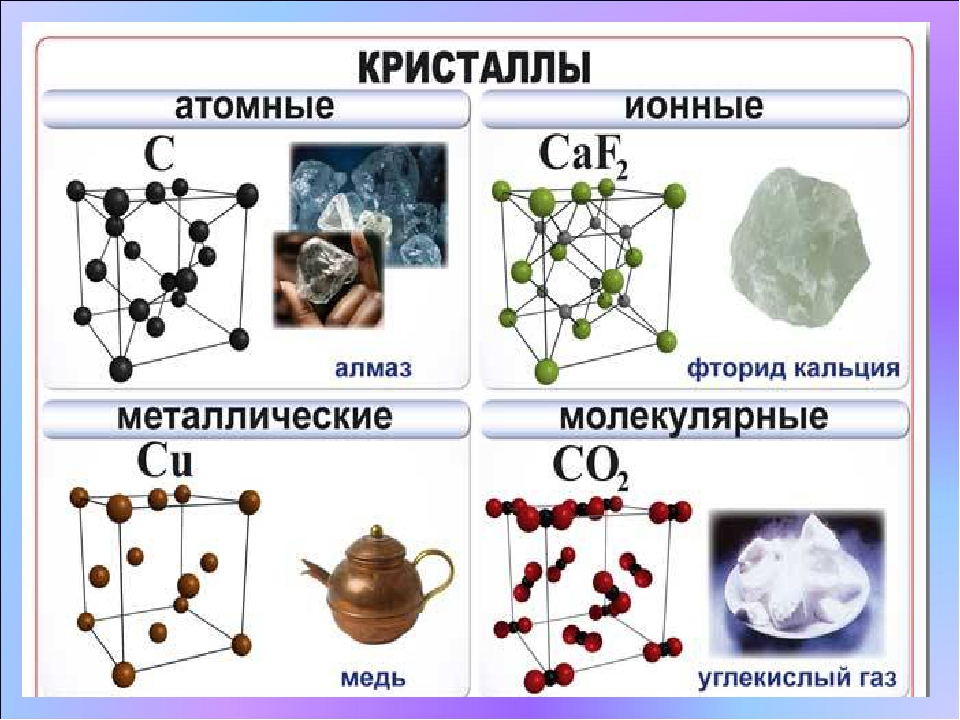
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Кристаллическая решетка — Как обсудить
Кристаллическая решетка
Каковы свойства кристаллической решетки? Свойства кристаллической решетки Каждая точка решетки представляет собой частицу кристалла, это точка решетки. Эта конкретная частица может быть атомом, молекулой или даже ионом. Эти точки кристаллической решетки соединены между собой прямыми линиями.
Что такое определение кристаллической решетки?
Кристаллическая кювета.
Что такое точка решетки в кристалле?
Свойства кристаллической решетки В кристаллической решетке каждый атом, молекула или ион (составная частица) представлен точкой.
Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией. Соединив эти прямые линии, можно получить трехмерное изображение конструкции.
Какова структура кристаллической решетки?
Структура кристаллической решетки похожа на решетку, но она состоит из ряда атомов, а не точек.Кристаллическая решетка в общем случае имеет симметричную геометрическую форму, каждая вершина которой представляет собой атом.
Что составляет структуру кристаллической решетки?
Структура кристаллической решетки состоит из мелких элементарных ячеек: атомов, молекул, ионов и других элементарных частиц. Здесь показана структура кристаллической решетки. Существует четырнадцать типов кристаллических решеток. Ионная сеть. Атомная сеть. Молекулярная сеть. проволочная сетка.
Каковы свойства ионной решетки?
Молекулярная сеть.проволочная сетка. Ионная решетка имеет электрический заряд, противоположный заряду ионов. Эти электрические заряды создают электромагнитное поле, и это поле определяет свойства веществ с ионной решеткой: огнестойкость, твердость, плотность и способность проводить электричество.
Эти электрические заряды создают электромагнитное поле, и это поле определяет свойства веществ с ионной решеткой: огнестойкость, твердость, плотность и способность проводить электричество.
Чем похожи поваренная соль и алмазные решетки?
Если вы посмотрите на структуру кристаллической решетки решетки хлорида натрия (NaCl) (a) и решетки алмаза (b), вы увидите, что они обе имеют различную структуру решетки.Одна сторона поваренной соли состоит из красных и зеленых точек. Это означает, что существует более одного типа атома.
Какой структурой является решетка Браве?
Если перед кристаллической решеткой находится атом одного типа, он называется одноатомным. Наличие более одного типа атомов означает, что структура решетки многоатомна. Существует 14 различных типов стеклянных решеток, называемых решетками Браве.
Каковы свойства материалов кристаллической решетки
Кристаллическая решетка представляет собой повторяющийся узор из математических точек, охватывающих пространство.
Это повторение вызвано силами химических связей. Именно этот повторяющийся паттерн контролирует такие свойства, как сопротивление, пластичность, плотность, проводимость (способность проводить или передавать тепло, электричество и т. д.) и форму.
Какие бывают виды решетки?
Существует множество типов решетчатых структур, которые могут иметь стеклянные конструкции, в том числе: Куб в центре лицевой стороны — это обычная решетчатая структура для меди, серебра, платины, никеля и алюминия.Объемно-центрированный куб представляет собой общую структуру решетки для тантала, железа, хрома и молибдена.
Какой тип связи образуется в кристаллической решетке?
Типы связей в кристаллах Ионные связи. Когда формируются ионные кристаллы, электроны выскакивают со своих орбит и связываются с соответствующим эталонным атомом. Ковалентные связи. Как следует из названия, ковалентная связь представляет собой кристаллическую структуру, в которой электроны не покидают своих орбит. Облигации Ван-дер-Ваальса. Водородные мосты. Металлические звенья.
Облигации Ван-дер-Ваальса. Водородные мосты. Металлические звенья.
Для чего можно использовать хрусталь в стекле?
Хрусталь часто используется для изготовления изделий из стекла и украшений с эффектными гранями, подчеркивающими призматические свойства стекла. Свинцовое стекло имеет высокую вязкость, а значит, его можно обрабатывать при низких температурах.
Какое стекло является полным кристаллом?
Ниже приведены распространенные типы хрусталя и очки, которые к нему подходят. Хрусталь или твердое стекло — это стекло, содержащее более 24% оксида свинца (PbO) в соответствии с директивой Совета Европы 1969 года.Это тяжелое стекло с высоким показателем преломления и сильным светорассеянием.
Сколько оксида свинца в хрустальном стекле?
Содержит от 18 до 40 весовых процентов оксида свинца (II). Номенклатура свинцового стекла была изменена таким образом, что любое стекло, содержащее не менее 24 весовых процентов PbO, называется «свинцовым хрусталем», а любое стекло, содержащее менее 24 весовых процентов PbO, называется хрустальным стеклом.
Чем кристаллы отличаются от стекла и поликристаллов?
Кристаллы могут обладать особыми электрическими, оптическими и механическими свойствами, которыми обычно не обладают стекло и поликристаллы.Эти свойства связаны с анизотропией кристалла, отсутствием вращательной симметрии в расположении его атомов.
Каковы свойства энергии кристаллической решетки
Энергия решетки является мерой прочности ионных связей в ионном соединении. Перечисляет различные свойства ионных твердых тел, включая их летучесть, растворимость и твердость. Энергия решетки ионного твердого тела не может быть измерена напрямую. Однако его можно оценить с помощью цикла Борна-Габера.
Что определяет энергию решетки?
Двумя основными факторами, влияющими на величину энергии в решетке, являются заряд и радиус связанных ионов.
Какая формула для энергии решетки?
Уравнение Борна-Ланде используется для определения энергии решетки соединения, формула уравнения: E = .
Что является примером энергии решетки?
Определяется как теплота образования противоположно заряженных ионов в газовой фазе, которые объединяются, образуя ионное твердое вещество.Например, энергия решетки хлорида натрия, NaCl, представляет собой энергию, выделяющуюся при объединении газообразных ионов Na+ и Cl- с образованием решетки чередующихся ионов в кристалле NaCl.
Что такое энергия решетки в химии?
Энергия решетки n (химическая) Химия Энергия, необходимая для отделения ионов на бесконечном расстоянии от кристалла, обычно выражается в джоулях на моль.
Каковы свойства диаграммы кристаллической решетки
В структуре решетки алмаза есть только одна цветовая точка (синяя).Эта структура является одноатомной. Существует 14 различных типов стеклянных решеток. Каждый тип однозначно описывает геометрическую симметрию кристалла. Более конкретно, эти типы кристаллических решеток называются решетками Браве.
Как решетка кристалла влияет на его свойства?
Пыль может сильно повлиять на свойства материала. Ниже вы видите, например, два кристалла графита и алмаза. Каждый из них содержит только один тип атома углерода. Разница в расположении этих атомов.
Сколько существует различных типов кристаллической решетки?
Одна сторона поваренной соли состоит из красных и зеленых точек. Это означает, что существует более одного типа атома. Следовательно, эта структура является многоатомной. В структуре решетки алмаза есть только одна цветовая точка (синяя). Эта структура является одноатомной. Существует 14 различных типов стеклянных решеток.
Какой структурой является кристаллическая решетка?
Кристаллическая решетка представляет собой повторяющийся узор из математических точек, охватывающих пространство.Существует 14 основных типов моделей, известных как леггинсы Bravais. Некоторые свойства кристаллических тел зависят от кристаллической структуры материала, от того, как атомы, ионы или молекулы расположены в пространстве.
Как операции симметрии выражаются в кристаллической решетке?
Ряд операций для симметрии элементарной ячейки формально выражается как пространственная группа кристаллической структуры. Векторы и плоскости в кристаллической решетке описываются трехзначным индексом Миллера.Этот синтаксис использует нижние индексы m и n в качестве адресных параметров.
Каковы свойства структур кристаллической решетки
Кристаллическая сетка представляет собой повторяющийся узор из математических точек, охватывающих пространство. Это повторение вызвано силами химических связей. Именно этот повторяющийся паттерн контролирует такие свойства, как сопротивление, пластичность, плотность, проводимость (способность проводить или передавать тепло, электричество и т. д.) и форму.
Из каких блоков состоит решетка?
Сетка представляет собой трехмерную периодическую таблицу, состоящую из одинаковых строительных блоков.Строительными блоками являются атомы или группы атомов.
Кристаллы часто имеют структурные дефекты и примеси. Периодичность кристаллов хорошо подтверждается экспериментальными исследованиями рентгенограмм, нейтронной и электронной дифракции.
Как расположены атомы в кристаллической решетке?
Большинство твердых объектов содержат небольшие вложенные друг в друга кристаллы. Кристалл — это твердый материал, содержащий атомы или группы атомов, образующие высокоупорядоченную структуру. Эта блок-схема является трехмерной. Кристаллическая решетка описывает расположение этих атомов в кристалле и характеризуется трансляционной симметрией.
Как форма кристаллической решетки влияет на ее свойства?
Форма сетки определяет не только к какой кристаллической системе относится камень, но и все его физические свойства и внешний вид. В некоторых практиках исцеления кристаллами считается, что осевая симметрия кристалла напрямую влияет на его метафизические свойства.
Как увидеть структуру кристалла?
Чтобы эти структуры были видны, нужно взять кристалл (твердый предмет), положить его под микроскоп и визуализировать расположение кристаллической решетки. Здесь показана структура кристаллической решетки. Помните, что кристаллическая решетка — это расположение атомов в кристалле (черные и белые точки на картинке — это их атомы).
Здесь показана структура кристаллической решетки. Помните, что кристаллическая решетка — это расположение атомов в кристалле (черные и белые точки на картинке — это их атомы).
Все ли твердые тела состоят из кристаллической решетки?
Большинство твердых тел имеют периодические атомные решетки, образующие так называемую кристаллическую решетку. Исключение составляют аморфные твердые тела и стекла. Существование кристаллической решетки предполагает некоторую степень симметрии в ее устройстве, и существующие симметрии были тщательно исследованы.Одним из эффектов симметричной решетки атомов является то, что она может поддерживать колебательные моды резонансной решетки.
Что такое решетка в химии?
Сетка — это упорядоченная сетка точек, описывающая расположение частиц, составляющих кристалл. Элементарная ячейка кристалла определяется узлами решетки.
Как образуется кристаллическая решетка?
Кристаллическая решетка представляет собой трехмерную структуру, состоящую из положительных ионов, окруженных отрицательными ионами, и отрицательных ионов, окруженных положительными ионами.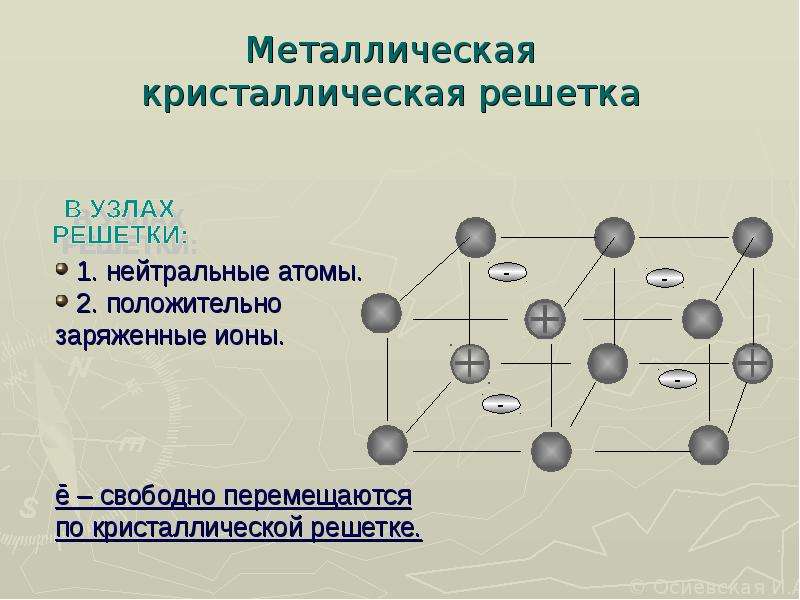
Что такое определение кристаллической решетки в химии
Кристаллическая ячейка. Нью-Мексико. Геометрическое расположение точек в пространстве, где находятся атомы, молекулы или ионы кристалла.
Что такое кристалл
Научное определение кристалла основано на микроскопическом расположении атомов в нем, так называемой кристаллической структуре. Кристалл – твердое тело, атомы которого образуют периодическое расположение. (Квазикристаллы являются исключением, см. ниже).Не все твердые тела являются кристаллами.
Что лежит в основе кристалла?
Кристалл определяется как решетка с основанием, добавленным к каждой точке решетки. Обычно основание состоит из атома, группы атомов или молекулы. Для многих твердых тел лучше всего рассматривать их как кристаллы, поскольку они состоят из небольших групп атомов, расположенных в повторяющемся порядке.
Является ли кристалл твердым телом?
Кристаллические твердые вещества. Кристаллическое твердое тело, также известное как кристалл, по определению представляет собой твердое тело, основные компоненты которого, такие как атомы, ионы и молекулы, организованы в высокоупорядоченную и четко определенную микроскопическую структуру, известную как кристаллическая решетка.
Кристаллическое твердое тело, также известное как кристалл, по определению представляет собой твердое тело, основные компоненты которого, такие как атомы, ионы и молекулы, организованы в высокоупорядоченную и четко определенную микроскопическую структуру, известную как кристаллическая решетка.
Что означает монокристалл?
Монокристалл или монокристаллическое твердое тело представляет собой материал, в котором кристаллическая решетка всего образца является непрерывной, без границ зерен и не прерывается по краям образца.
Какой синоним к слову хрусталь?
Кристалл (существительное) представляет собой твердое тело, которое образуется в результате затвердевания химического вещества и имеет очень правильную атомную структуру. Синонимы: часовое стекло, кварц, кварцевое стекло, часовое стекло, лечателит, кристаллизация, кварцевое стекло.
Что такое определение диаграммы кристаллической решетки
Определение словаря химии кристаллической решетки. Химический словарь. Определение кристаллической решетки. Что такое решетка? Сетка — это упорядоченная сетка точек, описывающая расположение частиц, составляющих кристалл. Элементарная ячейка кристалла определяется узлами решетки.
Химический словарь. Определение кристаллической решетки. Что такое решетка? Сетка — это упорядоченная сетка точек, описывающая расположение частиц, составляющих кристалл. Элементарная ячейка кристалла определяется узлами решетки.
Какая самая маленькая часть решетки?
Что такое шпалера? Сетка — это упорядоченная сетка точек, описывающая расположение частиц, составляющих кристалл.Элементарная ячейка кристалла определяется узлами решетки. Ячейка — это наименьшая часть кристалла, которая, регулярно повторяясь посредством трехмерного переноса, составляет весь кристалл.
Чем решетки Браве отличаются от кристаллических решеток?
Сетки Браве более математически и абстрактны, чем кристаллические. Они почти такие же, как стеклянные сетки. Однако, в отличие от кристаллической решетки, точки в решетке Браве больше не представляют положение конкретного атома.Вместо этого точка на сетке указывает, где можно разместить атом.
Почему точки решетки важны в химии твердого тела?
Таким образом, сетка является чисто абстрактным математическим объектом. В трех измерениях есть 14 сетей Браве, которые заполняют все пространство. Его важность в химии твердого тела заключается в том, что любая кристаллическая структура возникает в результате складывания одной из этих решеток Браве с основанием (основанием является атом или группа атомов).
Что такое точка решетки в кристаллической структуре
Кристаллическая решетка представляет собой симметричную трехмерную структуру атомов, ионов или молекул (составляющих) в кристаллическом твердом теле в виде точек.Его можно определить как геометрическое расположение атомов, ионов или молекул кристаллического твердого тела в виде точек в пространстве.
Каким образом ионы окружены пространственной решеткой?
В кристалле каждый ион окружен 6 ближайшими соседями с противоположными зарядами. Пространственная решетка представляет собой ГЦК-решетку, в основе которой Na + при 1/2 (111) и Cl при (000). На рисунке показана обычная элементарная ячейка. Диаметр ионов уменьшен относительно клетки для улучшения пространственного расположения.
Пространственная решетка представляет собой ГЦК-решетку, в основе которой Na + при 1/2 (111) и Cl при (000). На рисунке показана обычная элементарная ячейка. Диаметр ионов уменьшен относительно клетки для улучшения пространственного расположения.
Что такое точка решетки
Кристалл определяется как решетка с основанием, добавленным к каждой точке решетки. Обычно основание состоит из атома, группы атомов или молекулы. Для многих твердых тел лучше всего рассматривать их как кристаллы, поскольку они состоят из небольших групп атомов, расположенных в повторяющемся порядке.
Что такое решетка Браве?
Решетка Браве. В геометрии и кристаллографии решетка Браве, названная Огюстом Браве (1850 г.), представляет собой бесконечную решетку дискретных точек, созданную серией дискретных операций переноса, описанных в трехмерном пространстве:
Что такое кристаллическая решетка?
Кристаллическая решетка представляет собой трехмерную форму, определяющую форму отдельных кристаллических единиц. Скорее, сетка — это не физическая вещь, это термин, описывающий физическую форму.
Скорее, сетка — это не физическая вещь, это термин, описывающий физическую форму.
Что такое плоская решетка?
Расписание сетки. Кристаллическую решетку можно представить как серию параллельных, равноотстоящих друг от друга плоскостей с высокой плотностью сетевых узлов. Вот почему слои сети также называют точками разделения.Сетка расписания.
Химия точек решетки
Точка в решетке — это положение в элементарной ячейке или кристалле, где вероятность обнаружения атома или иона наибольшая. Другими словами, атомы или ионы занимают места в сети в кристаллическом твердом теле.
Каково определение решетки в науке?
Сетка представляет собой набор точек, расположенных определенным образом. Структура кристаллической решетки похожа на решетку, но она состоит из ряда атомов, а не точек.
Что такое кристаллическая решетка?
Кристаллическая решетка описывает расположение этих атомов в кристалле и характеризуется трансляционной симметрией. Если перед кристаллической решеткой находится один тип атома, он называется одноатомным. Наличие более одного типа атомов означает, что структура решетки многоатомна.
Если перед кристаллической решеткой находится один тип атома, он называется одноатомным. Наличие более одного типа атомов означает, что структура решетки многоатомна.
Что такое точка решетки в кристалле
Точки на кристаллической решетке, которые представляют положения структурных единиц (атомов, молекул или ионов) в типичном кристалле, называются точками решетки.Каждая точка решетки кристалла имеет то же окружение, что и структурные единицы реального кристалла. Количество узлов решетки в элементарной ячейке зависит от типа кристалла.
Какую структуру решетки имеет алюминий?
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в элементарную кубическую ячейку с атомами во всех углах и в центре каждой плоскости, как показано на рисунке 7 (FCC).
Что такое точка решетки в кристаллической пирамиде
Свойства кристаллической решетки: В кристаллической решетке каждый атом, молекула или ион (компонентная частица) представлен точкой.
Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией.
Как описать структуру ГПУ-решетки?
трусливый. (От A&M) Структура графического процессора. Вы можете представить себе две простые взаимопроникающие шестиугольные сети, которые движутся по вертикали на c/2 вдоль общей оси и перемещаются по горизонтали так, что точки одной образуются непосредственно в центрах треугольников, проходящих через точки другой.
Что составляет структуру кристалла?
Кристалл состоит из вещества, состоящего из упорядоченного расположения атомов, молекул или ионов. Поскольку есть повторяющиеся единицы, кристаллы имеют узнаваемую структуру. Существует семь систем кристаллических структур, также называемых решетками или пространственными решетками. 1. Кубическая или изометрическая форма не всегда является кубической формой!
Какая точка является вакантной в кристаллическом твердом теле?
Другими словами, атомы или ионы занимают места в сети в кристаллическом твердом теле.
Позиции решетки, занимаемые составляющими частицами, представлены точками в открытой структуре элементарной ячейки. В некоторых случаях точка сетки может быть свободной.
Что подразумевается под термином «химия решетки»?
Химический словарь. Сетка — это упорядоченная сетка точек, описывающая расположение частиц, составляющих кристалл. Элементарная решетка кристалла определяется узлами решетки. Ячейка — это наименьшая часть кристалла, которая, регулярно повторяясь посредством трехмерного переноса, составляет весь кристалл.
Что такое решетчатая конструкция?
Сетчатая конструкция. Дизайн смеси представлен в виде треугольника, где каждый угол представляет собой отдельный ингредиент, центры с каждой стороны представляют собой однородную смесь ингредиентов, а углы соединены со сторонами.
Что такое регулярная решетка?
Гладкая решетка. Условно полная сетка, в которой выполняется следующее условие (называемое также аксиомой регулярности): для любого множества ограниченных множеств для чего.
существуют конечные подмножества с тем же свойством (где это означает сходимость по порядку, см. Также пространство Рисса).
Какова структура кристаллической решетки хлорида натрия
Ионы соединения, такого как хлорид натрия, находятся в гигантской ионной структуре (также известной как гигантская ионная решетка). Это правильное расположение приводит к образованию кристалла. Эта картина повторяется во всех направлениях, что приводит к массивной трехмерной решетчатой структуре в кристаллах хлорида натрия.
Имеет ли хлорид натрия гигантскую структуру?
Ионы соединения, такого как хлорид натрия, находятся в гигантской ионной структуре (также известной как гигантская ионная решетка). Это правильное расположение приводит к образованию кристалла.
Какова структурная формула хлорида натрия?
Хлорид натрия является одним из самых известных и широко используемых химических веществ, также известным как поваренная соль. Формула и структура: Химическая формула хлорида натрия – NaCl, а его молекулярная масса – г/моль.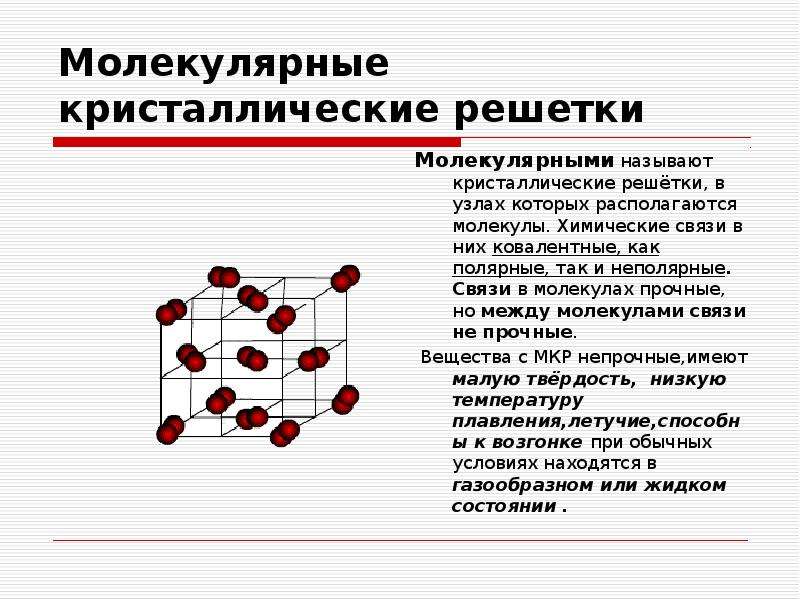 Это ионное соединение, состоящее из катиона натрия (Na+) и аниона хлорида (Cl).
Это ионное соединение, состоящее из катиона натрия (Na+) и аниона хлорида (Cl).
Что удерживает ионы вместе в хлориде натрия?
Ионные соединения, такие как хлорид натрия, связаны ионными связями. Этот тип связи возникает, когда противоположно заряженные ионы притягиваются друг к другу.
Что такое гигантская ионная решетка?
Гигантская ионная решетка представляет собой очень регулярное расположение анионов и катионов, гигантскую решетку, которая регулярно повторяется.
Атомы кристаллической решетки
Кристаллическая решетка представляет собой симметричную трехмерную структуру атомов, ионов или молекул (составляющих) в кристаллическом твердом теле в виде точек. Его можно определить как геометрическое расположение атомов, ионов или молекул кристаллического твердого тела в виде точек в пространстве. Свойства кристаллической решетки.
Энергия кристаллической решетки
Хлорид натрия Кристаллическая решетка Концепция энергии решетки была первоначально разработана для каменной соли и соединений сфалерита, таких как NaCl и ZnS, где ионы занимают высокосимметричные положения в кристаллической решетке. В случае NaCl энергия решетки – это энергия, выделяющаяся в реакции Na + (г) + Cl — (г) → NaCl (т).
В случае NaCl энергия решетки – это энергия, выделяющаяся в реакции Na + (г) + Cl — (г) → NaCl (т).
Структура кристаллической решетки nacl
NaCl имеет кубическую кристаллическую систему и своего рода гранецентрированную решетку, также можно сказать, что NaCl имеет гранецентрированную кубическую кристаллическую структуру. NaCl представляет собой гранецентрированную кубическую элементарную ячейку, содержащую четыре катиона и четыре аниона. «Элементарные ячейки — это простейшие базовые элементы, которые повторяются по определенному образцу, образуя законченную кристаллическую решетку.».
Какова структурная формула NaCl?
Хлорид натрия, также известный как соль или галит, представляет собой ионное соединение с химической формулой NaCl, которая представляет собой соотношение ионов натрия и хлорида 1:1.
Какова решетка NaCl?
NaCl представляет собой простую кубическую решетку с чередующимися положениями атомов Na и Cl.
Если предположить, что атомы представляют собой твердые сферы с ближайшими соседями в контакте, то какова постоянная решетки для NaCl? (Эффективный радиус Na равен ангстрему, а эффективный радиус Cl равен ангстрему.) 2. 3. Я сделал a = 2 (r 1 + r 2) = 2 (+) = Ангстрем.
NaCl это кристалл?
1 ответ. NaCl, или хлорид натрия, представляет собой ионный кристалл, поскольку он образуется в результате переноса электронов от металлического иона натрия к неметаллическому иону хлора.
Сколько атомов в NaCl?
Молекула хлорида натрия, NaCl, состоит из натрия и хлора. Следовательно, каждая молекула NaCl имеет только 2 атома. Точно так же они могут вычислить общее число атомов в 1 моле хлорида натрия.
Что такое элементарная ячейка в химии?
Элементарная ячейка — это наименьшая часть кристаллической решетки, которая показывает трехмерную структуру всего кристалла. Кристалл можно представить как одну и ту же элементарную ячейку, многократно повторяющуюся в трех измерениях.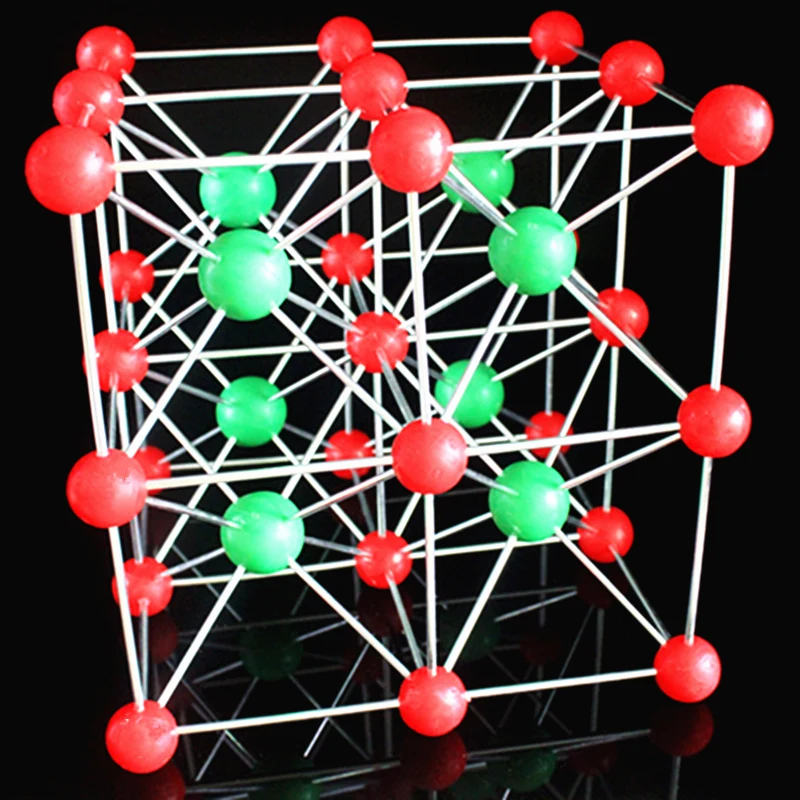 На рисунке ниже показано соотношение между элементарной ячейкой и полной кристаллической решеткой.
На рисунке ниже показано соотношение между элементарной ячейкой и полной кристаллической решеткой.
Как найти объем элементарной ячейки?
Объем элементарной орторомбической ячейки соответствует формуле куба, поэтому вам просто нужно умножить три измерения оси ячейки (V = a x b x c).
Что такое примитивная ячейка и элементарная ячейка?
Элементарная решетка — это наименьшая повторяющаяся единица в сети. Примитивная ячейка — это наименьшая возможная элементарная ячейка в сети. Следовательно, примитивная ячейка является своего рода элементарной ячейкой. Основное различие между элементарной ячейкой и примитивной ячейкой заключается в том, что элементарная ячейка имеет геометрию параллелепипеда, в то время как 2D-примитивная ячейка имеет геометрию параллелепипеда, а 3D-примитивная ячейка имеет геометрию параллелепипеда.
Что такое параметр элементарной ячейки?
Параметр элементарной ячейки.Имеется шесть параметров элементарной ячейки.
Это 3 ребра a, b, c и углы между ребрами α, β. Края элементарных ячеек могут быть или не быть перпендикулярными друг другу.
Солевая кристаллическая решетка
Стеклянная решетка и единичная соляная ячейка. Правильное трехмерное расположение атомов или ионов в кристалле обычно описывается пространственной решеткой и элементарной ячейкой. Этот состав также содержит соль. Формула соли — NaCl, состоящая из ионов натрия и хлора.
Какова кристаллическая структура соли?
По форме кристаллы соли представляют собой шестиугольный куб, похожий на куб. Напротив, кристаллы сахара выглядят как шестиугольная призма. Края кристаллов сахара обычно более острые.
Какова структура соли?
Соль имеет особую кристаллическую структуру. В отличие от структуры воды, которая четырехгранна, как скрипка, структура соляной сетки кубическая. Солнечная световая/тепловая энергия исчезла из земных океанов более 250 миллионов лет назад, а жизненная сила, ощущаемая этим недостатком жидкости, была отложена в сторону как потенциальная жизненная сила в платоническом теле соляной паутины.
Какова структура кристаллической решетки NaCl?
NaCl представляет собой кристаллическую структуру с гранецентрированной кубической решеткой Браве и двумя атомами в основании. Кристаллическая структура: NaCl. Решетка Браве: кубоид в центре. Космическая группа: 225 (F м 3 м), структурный отчет: B1, символ Пирсона: cF8.
12 Химия Кристаллическая решетка твердого тела и элементарная ячейка
Кристаллические решетки и элементарные ячейки
Кристаллическая решетка представляет собой изображение трехмерного расположения составляющих частиц (атомов, молекул, ионов) кристаллических твердых тел в виде точек.Или геометрическое расположение составляющих частиц кристаллических тел как точки в пространстве называется кристаллической решеткой.
Характеристики кристаллической решетки:
- Каждая составляющая частица представлена одной точкой в кристаллической решетке.

- Эти точки известны как точка решетки или узел решетки.
- Точки решетки в кристаллической решетке соединены прямыми линиями.
- Соединением узлов решетки прямыми линиями формируется геометрия кристаллической решетки.
Элементарная ячейка: Наименьшая часть кристаллической решетки называется элементарной ячейкой. Повторяясь в разных направлениях, элементарная ячейка порождает всю решетку.
Параметры элементарной ячейки:
- Элементарная ячейка характеризуется шестью параметрами. Этими параметрами являются три ребра (a, b и c) и углы между ними (α, β и γ).
- Размеры по краям элементарной ячейки представлены буквами a, b и c.
- Края элементарной ячейки могут быть или не быть взаимно перпендикулярными.
- Угол между b и c обозначается α, между a и c — β, а между a и b — γ.
Типы элементарных ячеек: Существует два типа элементарных ячеек – примитивные и центрированные элементарные ячейки.
Примитивные элементарные ячейки: Когда частицы в элементарной ячейке присутствуют только в углах, это называется примитивной элементарной ячейкой.
Центральная единичная ячейка: Когда частицы присутствуют в других положениях в дополнение к тем, которые находятся в углах в элементарной ячейке, это называется центрированной единичной ячейкой.
Существует три типа центрированных ячеек
(a) Объемно-центрированные элементарные ячейки: Если одна составляющая частица лежит в центре тела элементарной ячейки в дополнение к частицам, лежащим по углам, такая ячейка называется объемно-центрированной элементарной ячейкой.
(b) Элементарные гранецентрированные ячейки: Если одна составляющая частица лежит в центре каждой грани помимо частиц, лежащих в углу, это известно как гранецентрированные элементарные ячейки.
(c) Концево-центрированная элементарная ячейка: Если одна составляющая частица лежит в центре любых двух противоположных граней, помимо частиц, лежащих по углам, она называется торцево-центрированной элементарной ячейкой. Он также известен как элементарная ячейка с центром в основании.
Он также известен как элементарная ячейка с центром в основании.
Образуются семь типов элементарных ячеек. Это кубические, тетрагональные, орторомбические, моноклинные, гексагональные, ромбоэдрические или тригональные и триклинные.
Решетки Браве
Существует только 14 возможных кристаллических решеток, которые называются решетками Браве.
Кубическая решетка Для кубической решетки возможны три типа решетки.
Примитивные или простые, центрированные по телу, центрированные по граням решетки.В этих типах решеток все стороны имеют одинаковую длину. Углы между их гранями равны 90 0 в кубической решетке.
Тетрагональная решетка Существует два возможных типа тетрагональных решеток. Примитивные и объемно-центрированные элементарные ячейки. В этих решетках одна сторона различна по длине, а углы между гранями равны 90°.
Орторомбическая решетка Возможны четыре типа ромбической решетки. Они примитивны, сосредоточены на конце, сосредоточены на теле и сосредоточены на лице.У них неравные стороны. Углы между их гранями равны 90°.
Они примитивны, сосредоточены на конце, сосредоточены на теле и сосредоточены на лице.У них неравные стороны. Углы между их гранями равны 90°.
Моноклинная решетка Существует два возможных типа моноклинной решетки. Они являются примитивными и конечными. У них неравные стороны, а две грани имеют углы, отличные от 90°.
Шестиугольная решетка Шестиугольная решетка только одного типа. У него одна сторона отличается по длине от двух других, а углы на двух гранях равны 60°.
Ромбоэдрическая решетка Для ромбоэдрической решетки возможен только один тип решетки.У него все стороны равны, а углы на двух гранях меньше 90°.
Триклинная решетка Триклинная решетка имеет только один тип решетки. У него неравные стороны и ни один из углов между гранями не равен 90°.
Количество атомов в элементарной ячейке
Кристаллическая решетка состоит из очень большого количества элементарных ячеек, а точки решетки представляют собой составляющие частицы. Следовательно, количество атомов в элементарной ячейке кристаллической решетки можно рассчитать.
Следовательно, количество атомов в элементарной ячейке кристаллической решетки можно рассчитать.
Количество атомов в примитивной кубической элементарной ячейке
В примитивной элементарной ячейке атомы присутствуют только в углах. В кристаллической решетке каждый угол разделен восемью соседними элементарными ячейками. Следовательно, только 1/8 атома или других составляющих частиц принадлежит конкретной элементарной ячейке.
Следовательно,
Поскольку в элементарной ячейке на каждом углу находится 8 атомов,
Следовательно, общее число атомов в одной элементарной ячейке `=8xx1/8=1`
Таким образом, в примитивной кубической элементарной ячейке присутствует 1 атом.
Объемно-центрированная кубическая (ОЦК) элементарная ячейка – восемь атомов находятся в каждом углу и один атом присутствует в центре тела в объемно-центрированной кубической (ОЦК) элементарной ячейке.
Следовательно, количество атомов, присутствующих в объемно-центрированной кубической (ОЦК) элементарной ячейке
8 углов `xx1/8` атомов на угол `=8xx1/8=1` атом
Атом центра тела `=1xx1=1` атом
Следовательно, общее число атомов в элементарной ячейке в ОЦК Элементарная ячейка `=1+1=2` атом
Единичная ячейка с гранецентрированной кубической решеткой (ГЦК)
В элементарной гранецентрированной кубической ячейке в каждом углу находится восемь атомов. У куба шесть граней, поэтому в центре каждой грани находится шесть атомов.
У куба шесть граней, поэтому в центре каждой грани находится шесть атомов.
Каждый атом, присутствующий в углах, является общим для восьми соседних атомов, а каждый атом, присутствующий в центре грани, является общим для двух соседних атомов.
Следовательно, число атомов в элементарной ячейке ГЦК —
8 углов `xx1/8` атомов на угол `=8xx1/8=1` атом
6 гранецентрированных атомов `xx1/2` атомов на элементарную ячейку `=6xx1/2=3`
Следовательно, общее число атомов на элементарную ячейку в элементарной ячейке ГЦК `=1+3=4`
Copyright © excellup 2014
Кристаллическая решетка: определение и структура
Все материальные вещества существуют в трех основных состояниях: жидком, твердом и газообразном.Еще есть состояние плазмы, которое ученые считают четвертым состоянием вещества, но наша статья не о плазме. Знаете, что общего у поваренной соли и прекрасного бриллианта? Основываясь на своей структуре, они оба являются твердыми объектами.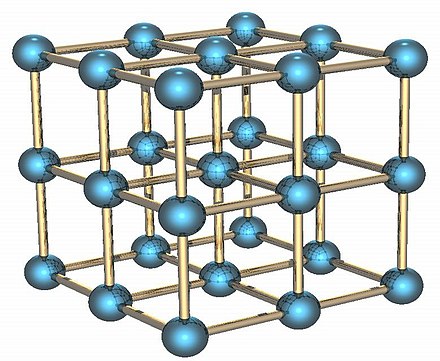 Твердые объекты (будь то алмаз или соль) имеют особую кристаллическую структуру; они содержат крошечные взаимосвязанные кристаллы. Эта кристаллическая структура имеет определенный порядок, создавая кристаллическую решетку. Кристаллическая решетка — это расположение атомов в кристалле.
Твердые объекты (будь то алмаз или соль) имеют особую кристаллическую структуру; они содержат крошечные взаимосвязанные кристаллы. Эта кристаллическая структура имеет определенный порядок, создавая кристаллическую решетку. Кристаллическая решетка — это расположение атомов в кристалле.
Структура кристаллической решетки состоит из мелких элементарных ячеек: атомов, молекул, ионов и других элементарных частиц. Здесь показано строение кристаллической решетки.
Существует четырнадцать типов кристаллических решеток.
Ионная решетка имеет противоположный электрический заряд ионов. Эти электрические заряды создают электромагнитное поле, и это поле определяет свойства веществ, имеющих ионную решетку: тугоплавкость, твердость, плотность и способность проводить электричество.Поваренная соль является хорошим примером ионной решетки.
Вещества с атомной решеткой имеют сильную ковалентную связь в своих узлах, состоящих из самих атомов. Ковалентные связи возникают, когда два одинаковых атома делят электроны друг с другом. Они образуют общую пару электронов для соседних атомов. Именно поэтому ковалентные связи связывают атомы в строгом порядке. Возможно, это самая характерная черта атомной решетки. Химические элементы с атомной решеткой имеют высокую температуру плавления.Такие химические элементы, как алмаз, кремний, германий и бор, имеют атомные решетки.
Они образуют общую пару электронов для соседних атомов. Именно поэтому ковалентные связи связывают атомы в строгом порядке. Возможно, это самая характерная черта атомной решетки. Химические элементы с атомной решеткой имеют высокую температуру плавления.Такие химические элементы, как алмаз, кремний, германий и бор, имеют атомные решетки.
Молекулярная решетка характеризуется наличием стабильных и плотно упакованных молекул. Они расположены в узлах кристаллической решетки. Их удерживают силы Ван-дер-Уолша, которые в десять раз слабее сил ионного взаимодействия. Хорошим примером молекулярной решетки является лед – твердое вещество, имеющее свойство переходить в жидкое вещество. Связи между молекулами решетки довольно слабые.
Металлическая решетчатая структура более гибкая и пластичная, чем ионная, хотя внешне они очень похожи. Металлические решетки имеют положительно заряженные ионы металлов в узлах решетки. Между узлами находятся электроны, которые участвуют в создании электрического поля. Иногда эти электроны называют электрическим газом. Структура решетки металла объясняет его свойства: механическую прочность, теплопроводность, электропроводность и плавкость.
Иногда эти электроны называют электрическим газом. Структура решетки металла объясняет его свойства: механическую прочность, теплопроводность, электропроводность и плавкость.
Автор: Павел Чайка, главный редактор журнала «Познавайка»
При написании этой статьи я старался сделать ее максимально интересной и полезной.Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Вы также можете написать свое пожелание/вопрос/предложение на мою почту [email protected] или в Facebook.
Кубическая кристаллическая решетка — элементарная ячейка
Что такое кристаллическая решетка?
Кристаллическая решетка , образованная упорядоченным расположением атомов, ионов или молекул в пространственной решетке или трехмерной системе.Изучая химию или физику, Брэггс вывел очень простое, но полезное соотношение между длинами волн электромагнитного спектра рентгеновских лучей и расстоянием между плоскостями кристаллической решетки, nλ = 2d sinθ, где n = 1,2,3 и т. д. d = расстояние между плоскостями решетки. Брэггс также разработал характер линейчатого спектра, образованного рентгеновскими лучами, который используется для кристаллографических исследований в химии. Для каждого кристаллического твердого тела существует три или четыре плоскости решетки, расстояние между которыми показывает положение или точки составляющих.
д. d = расстояние между плоскостями решетки. Брэггс также разработал характер линейчатого спектра, образованного рентгеновскими лучами, который используется для кристаллографических исследований в химии. Для каждого кристаллического твердого тела существует три или четыре плоскости решетки, расстояние между которыми показывает положение или точки составляющих.
Что такое элементарные ячейки?
Например, кубический хлорид натрия, образованный ионной связью, и плоскости (100), (110) или (111) дают необходимую информацию о кристаллической решетке.
Пространственная решетка делится на большое количество мелких симметричных единиц, когда сходные точки соединяются наборами параллельных линий вдоль трехмерных координатных осей. Эти основные элементы пространственной решетки известны как элементарные ячейки.
Что такое решетка Браве?
Браве в 1848 году показывает, что все 14 классов расположения определяют все возможные формы кристаллического твердого тела, такие как бура, борная кислота, алмаз, металлические кристаллы и т. д.Кубическая, тетрагональная, орторомбическая и моноклинная системы имеют более одного типа расположения составляющих атом, ион или молекулу. Эти 14 элементарных ячеек, происходящих из семи кристаллических систем, известны как решетка Браве.
д.Кубическая, тетрагональная, орторомбическая и моноклинная системы имеют более одного типа расположения составляющих атом, ион или молекулу. Эти 14 элементарных ячеек, происходящих из семи кристаллических систем, известны как решетка Браве.
Примеры кристаллической решетки
В хлориде натрия атом натрия теряет один электрон в результате ионизации с образованием иона натрия, а атом хлора имеет сродство к электрону и получает эту электронную частицу с образованием иона хлорида. Они связывают друг друга электростатической силой притяжения, образуя ионный объемно-центрированный кубический кристалл хлорида натрия с выделением энергии решетки.Но кристаллы льда, образованные водородными связями молекул воды и различными типами сил, такими как ван-дер-ваальсовы, электростатические, водородные связи и т. д., ответственны за формирование кубических кристаллов льда.
Типы элементарных кубических ячеек
Среди этих 14 кристаллических систем кубические кристаллы образуют три типа элементарных ячеек
- Примитивная или простая элементарная ячейка
- Элементарная ячейка с центрированием тела
- Элементарная гранецентрированная ячейка
Примитивная кубическая элементарная ячейка
В простой или примитивной кубической кристаллической решетке, где атомы присутствуют только в углах. Каждый атом поровну делится на восемь атомов, потому что каждый куб содержит восемь углов. Следовательно, вклад каждого атома в элементарную ячейку = 1/8. Следовательно, количество атомов в элементарной ячейке = 8 × (1/8) = 1.
Каждый атом поровну делится на восемь атомов, потому что каждый куб содержит восемь углов. Следовательно, вклад каждого атома в элементарную ячейку = 1/8. Следовательно, количество атомов в элементарной ячейке = 8 × (1/8) = 1.
Объемно-центрированная кубическая элементарная ячейка
Объемно-центрированный атом принадлежит исключительно элементарной ячейке. Следовательно, общее число атомов в элементарной ячейке = 1 (для тела) + 1 (для угла) = 2,
.Пример объемно-центрированного кубического кристалла
Щелочные металлы, такие как литий, натрий, калий, рубидий, цезий в периодической таблице, являются примерами объемно-центрированной кубической решетки.Этот тип кубической кристаллической системы имеет один атом в центре и восемь атомов в углах куба. У хлорида цезия корпусные элементы и угловые элементы отличаются. В полярном хлориде цезия все ионы хлора находятся в углу, а катион цезия находится в центре кубического кристалла или наоборот.
Элементарная гранецентрированная кубическая ячейка
В гранецентрированной кубической решетке, где атомы присутствуют на шести гранях и восьми углах. Но атомы граней поровну разделены между двумя элементарными ячейками.Следовательно, общее число атомов в элементарной ячейке = 3 (для грани) + 1 (для угла) = 4. Следовательно, плотность элементов в гранецентрированных элементарных ячейках больше, чем в примитивных или объемноцентрированных элементарных ячейках.
Но атомы граней поровну разделены между двумя элементарными ячейками.Следовательно, общее число атомов в элементарной ячейке = 3 (для грани) + 1 (для угла) = 4. Следовательно, плотность элементов в гранецентрированных элементарных ячейках больше, чем в примитивных или объемноцентрированных элементарных ячейках.
Пример гранецентрированного кубического кристалла
Число химических элементов таблицы Менделеева, таких как медь, серебро, золото, никель, платина и затвердевшие инертные газы (гелий, неон, аргон, криптон, ксенон) нашей окружающей среды, обладают гранецентрированной кубической кристаллической структурой.
Закон рациональных показателей
Чтобы описать кристаллографическую структуру кристаллического твердого тела, нам необходимо обсудить ориентацию плоскости, проходящей через точку решетки кубического кристалла.Но ориентация плоскости решетки описывается точками пересечения плоскости с тремя базисными векторами решетки. Пересечения любой плоскости вдоль трех кристаллографических структур либо равны отношению элементарной ячейки, либо некоторому их целому кратному.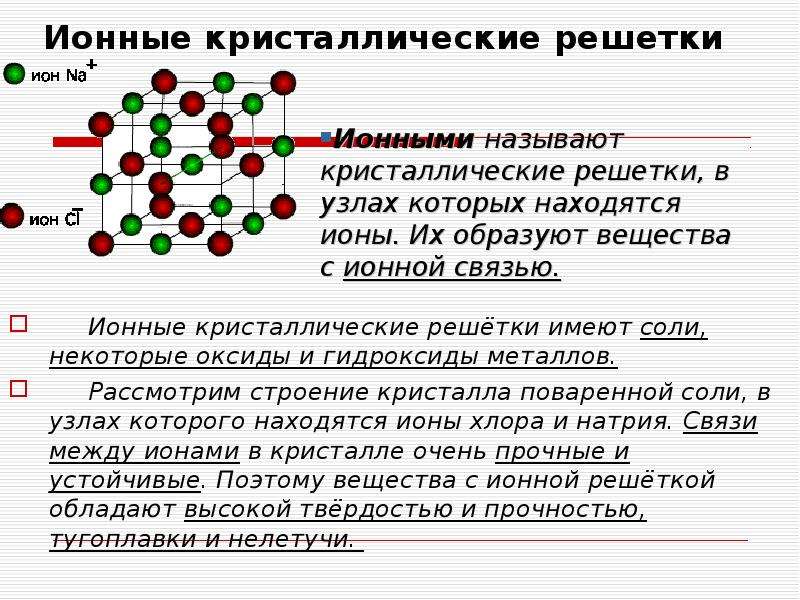 Это известно как закон индексов вращения.
Это известно как закон индексов вращения.
Что такое индексы Миллера?
Изучая химию, пусть одна плоскость пересекает две трехмерные оси через a и b, а третья ось уходит в бесконечность. Следовательно, индексы Вейсса = 1, 1, ∞.Для лучшего представления плоскости индексации мы избегали бесконечности, рассматривая обратные значения, поскольку бесконечность неудобна для определения. Обратная величина индексов Вейса называется индексами Миллера. Например, индексы Вейсса (11∞) и (12∞) представлены в индексах Миллера как (110) и (210) соответственно.
Как рассчитать индексы Миллера?
Кубическая система — простейший тип кристаллической системы. Следовательно, точка пересечения по трем осям равна и все углы равны 90°.В простой кубической решетке точки находятся в углах куба. Плоскости, которые могут проходить через точку решетки, имеют индексы Миллера (100), (110), (111). Плоскости (100) пересекают только оси x, но параллельны осям y и z, но плоскости (110) пересекают оси x и y, но параллельны оси z, а плоскости (111) пересекают x, у, оси z.
Гигантская кристаллическая решетка является мезопористой, но не MOF | Исследования
Японские ученые создали мезопористое ионное твердое вещество из одного сложного катиона.Твердое тело имеет пористую структуру, большую, чем топологически связанные металлоорганические каркасы (MOF), и имеет более 2 миллионов Å 90 695 3 90 696 , оно имеет самый большой объем ячеек среди не-MOF.
Как правило, мезопористые кристаллические трехмерные структуры, такие как MOF, удерживаются вместе координационными связями между металлическими узлами и органическими линкерами или ковалентными или водородными связями. Такуми Конно и его коллеги из Университета Осаки создали первый пример мезопористого ионного твердого тела, удерживаемого вместе только нековалентными взаимодействиями CH … π.
Исследователи сначала приготовили хиральный металлолиганд тризолота(i), содержащий D-пеницилламин, к которому они добавили соли серебра(i) и меди(ii). После выращивания кристаллов при 0°C и анализа структуры с помощью рентгеновской кристаллографии монокристаллов они обнаружили, что образовалась непористая соль, содержащая катионоактив Au I 6 Ag I 3 Cu II 3 додекануклеарный комплекс.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией. Соединив эти прямые линии, можно получить трехмерное изображение конструкции.
Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией. Соединив эти прямые линии, можно получить трехмерное изображение конструкции.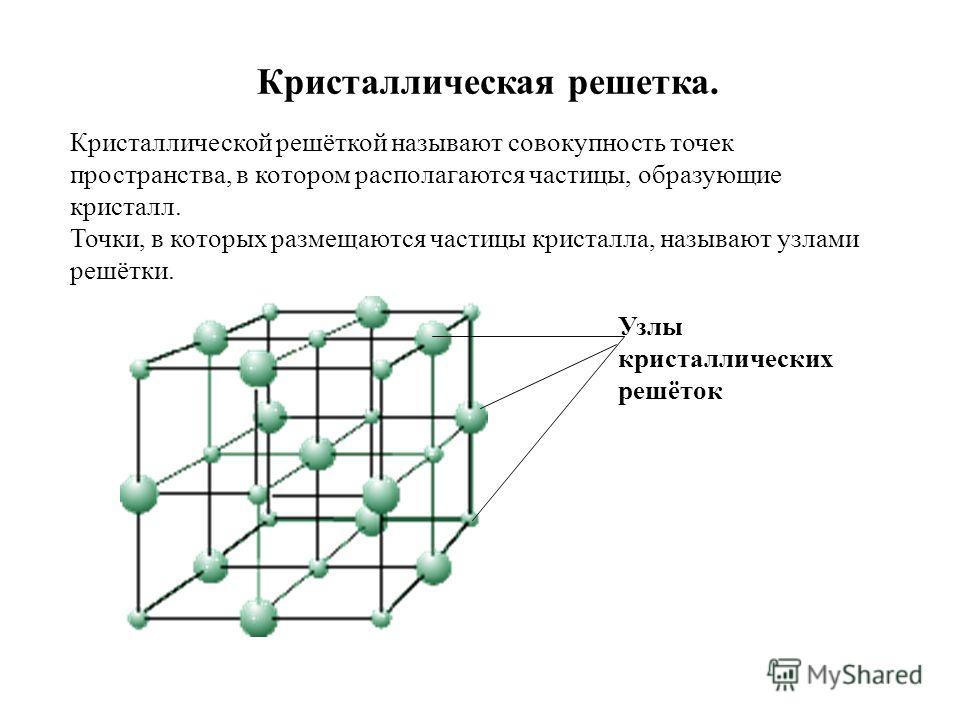 Это повторение вызвано силами химических связей. Именно этот повторяющийся паттерн контролирует такие свойства, как сопротивление, пластичность, плотность, проводимость (способность проводить или передавать тепло, электричество и т. д.) и форму.
Это повторение вызвано силами химических связей. Именно этот повторяющийся паттерн контролирует такие свойства, как сопротивление, пластичность, плотность, проводимость (способность проводить или передавать тепло, электричество и т. д.) и форму.


 Кристаллы часто имеют структурные дефекты и примеси. Периодичность кристаллов хорошо подтверждается экспериментальными исследованиями рентгенограмм, нейтронной и электронной дифракции.
Кристаллы часто имеют структурные дефекты и примеси. Периодичность кристаллов хорошо подтверждается экспериментальными исследованиями рентгенограмм, нейтронной и электронной дифракции.
 Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией.
Эти точки называются сетевыми местоположениями или сетевыми точками. Положения или точки сетки соединяются друг с другом на стеклянной сетке прямой линией. Позиции решетки, занимаемые составляющими частицами, представлены точками в открытой структуре элементарной ячейки. В некоторых случаях точка сетки может быть свободной.
Позиции решетки, занимаемые составляющими частицами, представлены точками в открытой структуре элементарной ячейки. В некоторых случаях точка сетки может быть свободной. существуют конечные подмножества с тем же свойством (где это означает сходимость по порядку, см. Также пространство Рисса).
существуют конечные подмножества с тем же свойством (где это означает сходимость по порядку, см. Также пространство Рисса). Если предположить, что атомы представляют собой твердые сферы с ближайшими соседями в контакте, то какова постоянная решетки для NaCl? (Эффективный радиус Na равен ангстрему, а эффективный радиус Cl равен ангстрему.) 2. 3. Я сделал a = 2 (r 1 + r 2) = 2 (+) = Ангстрем.
Если предположить, что атомы представляют собой твердые сферы с ближайшими соседями в контакте, то какова постоянная решетки для NaCl? (Эффективный радиус Na равен ангстрему, а эффективный радиус Cl равен ангстрему.) 2. 3. Я сделал a = 2 (r 1 + r 2) = 2 (+) = Ангстрем. Это 3 ребра a, b, c и углы между ребрами α, β. Края элементарных ячеек могут быть или не быть перпендикулярными друг другу.
Это 3 ребра a, b, c и углы между ребрами α, β. Края элементарных ячеек могут быть или не быть перпендикулярными друг другу.