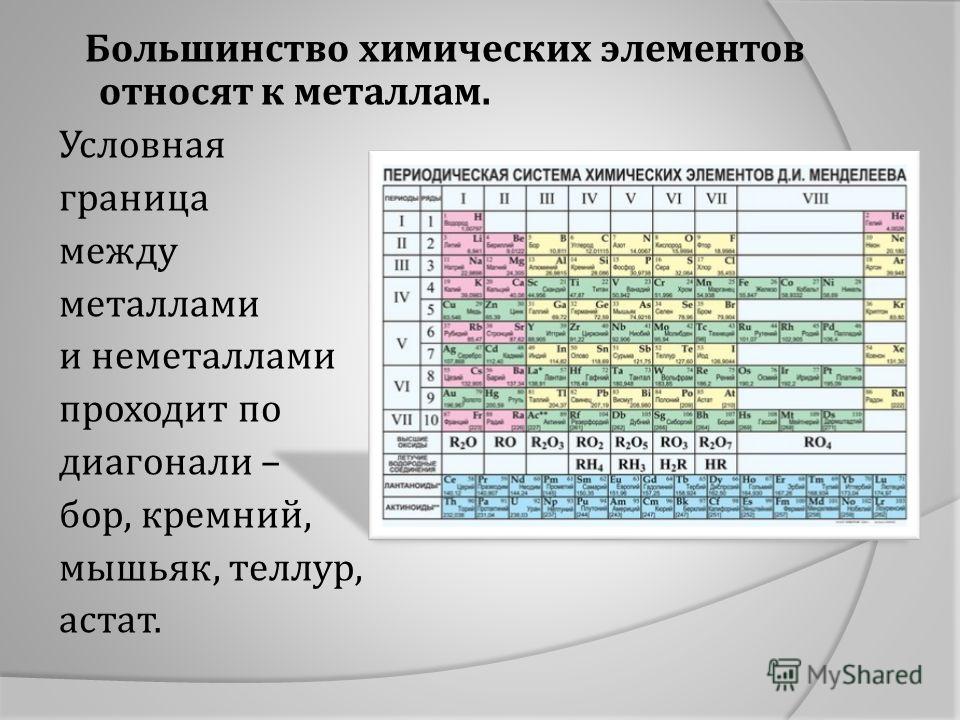
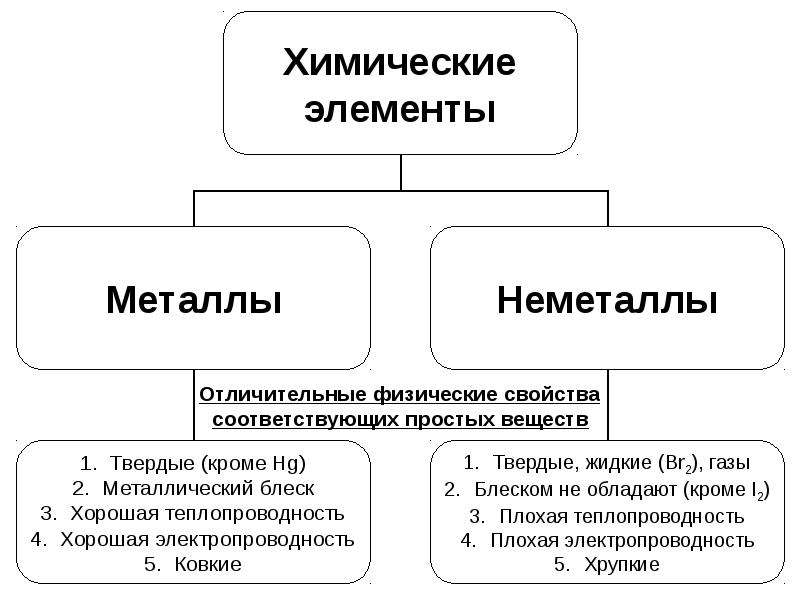
Металлы и неметаллы — Химия
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra
а также вне определённых групп бериллий и магний
38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi
7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам [как проводникам] противоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)).
Происхождение слова «металл»:
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).
Нахождение в природе:
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Свойства металлов:
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается.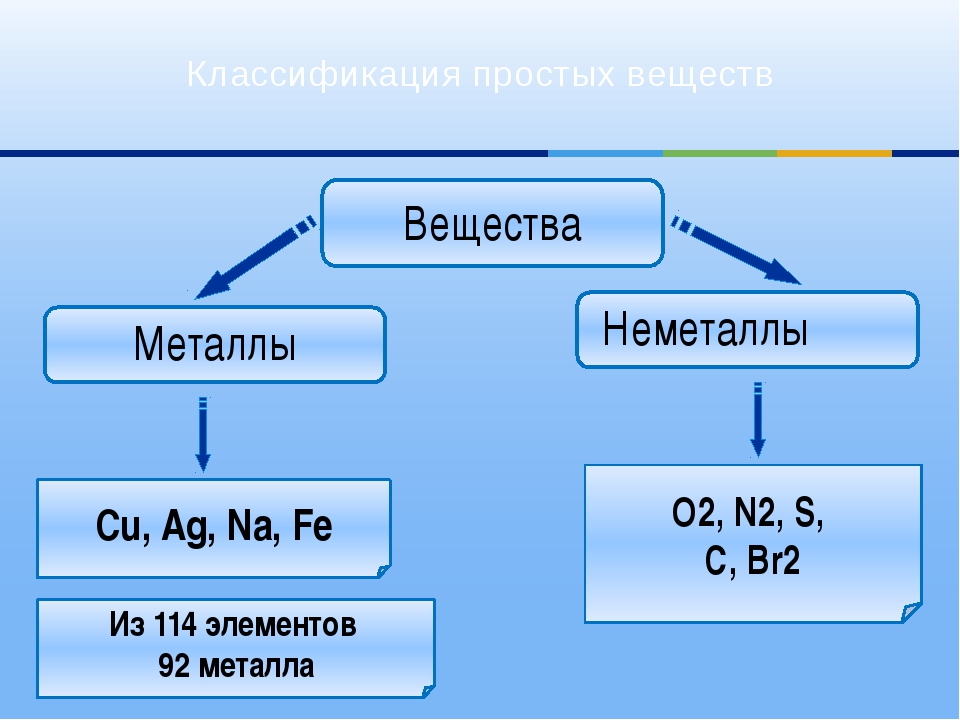 Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами:
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
2. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Что такое металлы и неметаллы? | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема: Химические вещества и элементы
Среди простых веществ некоторые отличаются рядом общих признаков. Они имеют характерный блеск, ковкость, хорошо проводят электрический ток. Такие простые вещества называют металлами (рис. 11.3), а соответствующие химические элементы — металлическими элементами. Все металлы имеют немолекулярное строение. Один из самых важных металлов — железо.
Таблица. Некоторые металлы, изделия из них и упоминание в литературе
|
Au Золотая пектораль (фрагмент) |
Гул утих, и зарево померкло,Только золото солнцем сияет,Ветер свистом над синей степьюИмя скифское прославляет. Борис Мозолевский. Скифская степь |
|
Al Изделия из алюминия |
Скульптура «Эрос» на площади Пикадилли в Лондоне, Великобритания — одна из первых скульптур, при изготовлении которой был использован алюминий. |
|
Cu Медный флюгер |
Медь, как и золото, отличается от других металлов характерным цветом.
А ступку медную, красной меди, только пест перебит… Иван Карпенко Карый. Сто тысяч
Вот к Святославу подошла мать — княгиня Ольга, она держала в руках сделанный лучшими кузнецами из красной меди, позолоченный, украшенный множеством драгоценных камней шлем. Семен Скляренко. |
|
Hg Ртуть при стандартных условиях (t = 25 °С, Р = 1 атм) — жидкость |
И на несколько сажен вокруг лодки тускло серебрилась тяжелая, неподвижная, как ртуть, мертвая зыбь. Чингиз Айтматов. Пегий пес, бегущий краем моря |
|
Ag Серебряные монеты |
Блажен человек, который снискал мудрость, и человек, разум обретший, потому что обретение его лучше, чем обретение серебра. Иван Огиенко. Библия |
|
Zn Оцинкованная посуда |
Ой, сколько, сколько майских луж —Обрезков голубого цинка!
Василии Казин.
Пруд по краям выложен цинком, и раз в неделю этот цинк снимается, относится в кухню, где и драится до блеска. Джером К. Джером. Трое на велосипедах / Перевод А. Попова |
Неметаллам не присущи свойства, характерные для металлов. Тем не менее между этими группами веществ не существует четкой границы. Материал с сайта http://worldofschool.ru
Например, кремний — неметалл. Однако по внешнему виду его легко спутать с металлом. Кремний широко используют как материал для изготовления полупроводниковых приборов, пластин для систем солнечной энергетики. Неметалл графит, подобно металлам, проводит электрический ток.
Неметаллам соответствуют неметаллические химические элементы.
Углерод, серу, фосфор, кислород, азот, хлор, бром и йод относят к неметаллам. Хлор — газ. Бром — летучая жидкость. Кристаллы йода имеют характерные цвет и блеск, которые делают его кое в чем подобным металлам. При нагревании йод образует пары фиолетового цвета.
Хлор — газ. Бром — летучая жидкость. Кристаллы йода имеют характерные цвет и блеск, которые делают его кое в чем подобным металлам. При нагревании йод образует пары фиолетового цвета.
Неметаллы преимущественно состоят из молекул. Однако алмаз (простое вещество углерода) и кремний — вещества атомного строения.
Названия металлов и неметаллов — нарицательные, а не собственные.
Как из периодической системы узнать, металлическим или неметаллическим является химический элемент?
Шпаргалка по химии металлы и неметаллы
Школьный доклад-неметаллы
Что такое металлы и неметаллы химия
Что металл и неметалл гдз
Сообщение по металлам и неметаллам
Приведи примеры металлических и неметаллических элементов.

Химия — Металлы и неметаллы 2
Твердый материал, который обычно является твердым, пластичным, блестящим, плавким и пластичным, известен как металлы. Например, железо, медь, алюминий, магний, натрий, свинец, цинк и т. Д.
Обычно металлы имеют хорошую электрическую и теплопроводность.
Металлы в чистом виде имеют блестящую поверхность, известную как металлический блеск .
Металлы могут быть разбиты на тонкие листы; это свойство известно как податливость .
Свойство металлов втягиваться в тонкие проволоки известно как пластичность . Например, золото — самый пластичный металл.
Серебро и медь — лучший проводник тепла.
Неметаллы обычно находятся в твердом или газообразном состоянии. Тем не менее, бром является исключением, которое находится в жидком состоянии.
Некоторые из основных примеров неметаллов — это углерод, сера, йод, кислород, водород и т. Д.
Д.
Все металлы существуют в твердой форме при комнатной температуре, кроме ртути.
Галлий и цезий имеют очень низкие температуры плавления; эти два металла плавятся даже на ладони.
Йод неметаллический, но он блестящий (блестящий — это свойство металла).
Углерод — это неметалл, который может существовать в разных формах. Каждая форма называется аллотропом.
Алмаз — это аллотроп углерода, и это самое твердое из известных природных веществ.
Температура плавления и кипения алмаза очень высока.
Графит также является аллотропом углерода; это проводник электричества.
Щелочные металлы, такие как литий, калий, натрий, являются примерами мягких металлов, так как их можно резать ножом.
Почти все металлы в сочетании с кислородом образуют оксиды металлов.
Разные металлы имеют разную частоту реакции; некоторые реагируют медленно, но некоторые реагируют очень быстро. Например, калий и натрий очень активны, и они загораются, только если их держать на открытом воздухе.
Поэтому калий и натрий хранятся в керосиновом масле, чтобы они не могли загореться.
Однако среди всех металлов натрий (наиболее вероятно) является наиболее реакционноспособным металлом.
Анодирование — это процесс формирования толстого защитного оксидного слоя алюминия, который защищает от коррозии.
Элементы или соединения, которые встречаются в природе в земной коре (верхний слой), известны как минералы.
Минералы в сыром виде известны как руды . Например, золото, серебро, железо и т. Д. (Железная руда показана на рисунке ниже) —
Руды, которые извлекаются из земли, обычно загрязнены большим количеством примесей, таких как смесь с некоторыми элементами, почвой, песком и т. Д., Известными как «жила» .
Исходя из реакционной природы и извлечения из руд, металлы можно классифицировать как —
Металлы и неметаллы – методическая разработка для учителей, Якшина Светлана Викторовна
|
Цели обучения: |
8. |
|
Цели урока: |
определять простые вещества металлы и неметаллы; перечислять отличительные физические свойства металлов и неметаллов по положению в периодической таблице. |
|
Критерии достижения: |
прогнозирует металлические свойства; прогнозирует неметаллические свойства. |
|
Языковые цели: |
Предметная лексика и терминология металлические свойства и неметаллические свойства, основные/кислотные свойства. Серия полезных фраз для диалога/письма Металлические/неметаллические свойства сверху вниз в группе увеличиваются/ уменьшаются, так как… Металлические/неметаллические свойства слева направо в периодах увеличиваются/ уменьшаются, так как… |
|
Привитие ценностей: |
Коммуникативные навыки. |
|
Межпредметные связи: |
Физика. |
|
Предварительные знания: |
Строение атома (7.4A) Расположение электронов в атомах (8.1A) Строение соединений (9.1B) |
Ход урока
|
Запланированные этапы урока |
Запланированная деятельность на уроке |
Ресурсы |
|
Начало урока 5 мин |
Приветствие. Организация урока. Встаньте прямо, улыбнитесь и пожелайте друг другу удачи. Я желаю вам хорошей плодотворной работы на уроке, чтоб наш урок прошел интересно, и вы многому научились. Выход на тему урока (5 мин) К вашему вниманию предоставляю сказку… (ученики слушают сказку). Итак, тема сегодняшнего урока «Металлы и неметаллы», целью которого является определить простые вещества металлы и неметаллы; перечислить отличительные физические свойства металлов и неметаллов по положению в периодической таблице. |
Приложение 1. «Сказка о металлах и неметаллах» |
|
Середина урока (30 мин) |
Сегодня на уроке мы будем изучать тему по ресурсам сайта «BilimLand». Зайдите на курс химии 8 класс и найдите раздел «Периодическая система химических элементов» и выберите тему: «Металлы и неметаллы». Войдите в обзор урока и посмотрите следующие видео: 1. Положение металлов и неметаллов в периодической системе. 2. Образование катионов металлов. 3. Образование катионов неметаллов. 4. Металлы и неметаллы.
Закрепление нового материала Выполните упражнения (открываем ресурс BilimLand): Упр №1 Классифицируй вещества на металлы и неметаллы. кальций металл бром неметалл железо алюминий сера углерод магний фосфор Упр №2 Расположи следующие элементы сверху вниз в порядке убывания температур плавления. сера магний железо фосфор Упр №3 Заверши предложения. Наблюдая за показаниями термометра, мы можем увидеть, что металлы плавятся при высокой температуре, а неметаллы плавятся при более низкой температуре.
Выполните тест (открываем ресурс BilimLand) Вопрос №1. Укажи верные утверждения.
— только 1 — 1 и 3 — 1, 2 и 3 — 1 и 2 — 2 и 3 Вопрос № 2. Металл, который при нормальных условиях находится в жидком состоянии, – это — натрий — ртуть — магний — калий — бром Вопрос № 3. — Поддаются ковке — Имеют высокую температуру плавления — Слабо проводят тепло и электричество — Имеют различную окраску — Твердые Вопрос №4. Выбери свойства, которые характерны для неметаллов. — Имеют большее количество внешних электронов. — Имеют металлический блеск. — Имеют небольшое количество внешних электронов. — Хорошо проводят тепло и электричество. — Обладают способностью присоединять дополнительные электроны. Ребята, чтобы узнать результаты тестирования, выберите – Итог урока. Самостоятельная работа (на рабочих листах) После этого каждому ученику раздают рабочие листы, который он выполняет самостоятельно. |
https://bilimland.kz/ru/subject/ximiya/8-klass/obshie-xarakteristiki-metallov-i-nemetallov?mid=%info%
https://bilimland.kz/ru/subject/ximiya/8-klass/obshie-xarakteristiki-metallov-i-nemetallov?mid=%info%
https://bilimland.kz/ru/subject/ximiya/8-klass/obshie-xarakteristiki-metallov-i-nemetallov?mid=%info%
https://bilimland. |
|
Конец урока 5 мин |
Рефлексия: Прием: «Дерево успеха» Ученикам предлагается на стикерах «яблочки» написать свое мнение о том, как прошел урок, что понравилось на уроке. Домашняя работа: Зайдите на курс химии в раздел: Химия – Неорганическая химия – Металлы и неметаллы (Просмотрите видео и выполните данные задания) |
Дерево успеха https://bilimland.kz/ru/courses/chemistry-ru/neorganicheskaya-ximiya/ehlementy-i-ix-soedineniya/lesson/metally-i-nemetally |
Приложение 1
Жили себе великаны в одном королевстве (Металлы), которые не скрывали своей силы, были чем-то похожи на сечевых казаков, и были у них недруги в этом же королевстве – Неметаллы, которые тоже были сильными и мужественными. Они не дружили между собой, но однажды их хотели помирить.
Они не дружили между собой, но однажды их хотели помирить.
Полем боя была периодическая система. Прикордонная линия пролегала под диагональю от В к Аt, все элементы металлы расположены в левой части периодической системы. Главным у металлов был Франций, а поскольку его появления никто не видел, т. к. он маскировался, то командовал ими заместитель Цезий, а у Неметаллов – Фтор. Металлы отличались строением. Каждый из них принадлежал к определенному семейству и имел свой цвет. Одни были красные, другие – зеленые, третьи – синие. Были и такие, которые пытались помирить Металлы и Неметаллы и одевались в желтый цвет, как Неметаллы, и становились на границе. Их не считали предателями, они были послами доброй воли для соседских отношений. Как можно обидится на олово – короля консервных банок или на необыкновенно легкий алюминий? Щедрые Металлы никогда не были скупыми и щедро отдавали электроны Неметаллам и на некоторое время восстанавливался мир.
Mg0 + S0 = Mg2+S2-
Металлы были пассивными и ставали в очередь последними. Металлы были дружными и помогали друг другу в беде. Если кто-то сгорал в плену объятий Неметаллов, то активные Металлы, жертвуя собой, освобождали своих братьев, давали им новую жизнь. Внутри металла бушевал электронный газ, т. е. наличие свободных электронов своим движением по всему объему металла объясняла электропроводность, теплопроводность и характерный металлический блеск. Они разбирались в технике. Любили работать в поле, на заводах и в быту. Металлы были настоящими казаками – гибкие, пластичные, сияющие, красивые.
Металлы были дружными и помогали друг другу в беде. Если кто-то сгорал в плену объятий Неметаллов, то активные Металлы, жертвуя собой, освобождали своих братьев, давали им новую жизнь. Внутри металла бушевал электронный газ, т. е. наличие свободных электронов своим движением по всему объему металла объясняла электропроводность, теплопроводность и характерный металлический блеск. Они разбирались в технике. Любили работать в поле, на заводах и в быту. Металлы были настоящими казаками – гибкие, пластичные, сияющие, красивые.
Ртуть, которая хоть и принадлежала к Металлам, была женского рода – очень нежная, серебристая, красивая. Металлы это замечали, влюблялись в нее, но прикоснувшись теряли свою красоту.
Приложение 2
Тема: Металлы и неметаллы
Класс: ____
Ф. И. ученика (-цы): ______________________________
- Выше дана схема периодической таблицы. Покажи, где в периодической таблице расположены металлы.
 Проведи штрихи или закрась серым цветом ту область, где они должны быть расположены.
Проведи штрихи или закрась серым цветом ту область, где они должны быть расположены.
______________________________________________________________________________________________________________________________________________________
____________________________________________________________________________
- Укажи место, в котором должны располагаться неметаллы в данной таблице. Чем обусловлено расположение неметаллов в таблице?
________________________________________________________________________________
- Некоторые элементы относят к полуметаллам или металлоидам.
а) Где эти элементы располагаются в таблице? Выдели их.
________________________________________________________________________________
______________________________________________________________________________
- b) Приведи пример одного полуметалла.
________________________________________________________________________________
- Покажи, где в периодической таблице расположены переходные металлы.

________________________________________________________________________________
- Элемент III группы образует ион с зарядом +3. Какой ион образует элемент II группы?
________________________________________________________________________________
- Железо – металл, сера – неметалл. Заполни таблицу, чтобы показать различия между металлами и неметаллами. Используй термины, представленные ниже.
слабый проводник высокая хороший проводник
ковкий низкая хрупкий
|
Элемент |
Проводит тепло |
Проводит электричество |
Точка плавления |
Точка кипения |
Прочность |
|
|
|
|
|
|
|
|
|
|
|
|
|
- Укажи физические свойства металлов и неметаллов.

|
Металлы |
Неметаллы |
|
|
|
Тема: Металлы и неметаллы
Класс: ____
- Выше дана схема периодической таблицы. Покажи, где в периодической таблице расположены металлы. Проведи штрихи или закрась серым цветом ту область, где они должны быть расположены.
Ответ
Металлы выделены серым цветом.
- Укажи место, в котором должны располагаться неметаллы в данной таблице. Чем обусловлено расположение неметаллов в таблице?
Ответ
Неметаллы выделены желтым цветом.
- Некоторые элементы относят к полуметаллам или металлоидам.
а) Где эти элементы располагаются в таблице? Выдели их.
Ответ
Металлоиды выделены синим цветом.
- b) Приведи пример одного полуметалла.
Ответ
Si
- Покажи, где в периодической таблице расположены переходные металлы.
Ответ
Переходные металлы расположены между 2 и 13 группами.
- Элемент III группы образует ион с зарядом +3. Какой ион образует элемент II группы?
Ответ
Ион с зарядом +2
- Железо – металл, сера – неметалл. Заполни таблицу, чтобы показать различия между металлами и неметаллами. Используй термины, представленные ниже.
слабый проводник высокая хороший проводник
ковкий низкая хрупкий
|
Элемент |
Проводит тепло |
Проводит электричество |
Точка плавления |
Точка кипения |
Прочность |
|
Хороший проводник |
Хороший проводник |
Высокая |
Высокая |
Ковкий |
|
|
Слабый проводник |
Слабый проводник |
Низкая |
Низкая |
Хрупкий |
7. Укажи физические свойства металлов и неметаллов.
Укажи физические свойства металлов и неметаллов.
Ответ
|
Металлы |
Неметаллы |
|
1) Металлический блеск. 2) Хорошая теплопроводность и электропроводность. 3) Ковкость. |
1) Различная окраска. 2) Плохая электропроводность и теплопроводность. 3) Хрупкие твердые тела. |
Неметаллы — это… Что такое Неметаллы?
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород[источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Металлы и неметаллы разработка урока Сальниковой С.И.
Декабрь 23rd, 2014 admin- Класс: 8
- Тема урока: Простые вещества металлы и неметаллы
- Базовый учебник (название, автор): Химия 8 класс Габриелян О.
 С.
С. - Цель урока: создать условия для самостоятельной работы учащихся по определению состава и строения простых веществ металлов и неметаллов, изучению их физических свойств с последующим закреплением полученных знаний в виде выполнения упражнений.
- Предполагаемые результаты обучения:
-личностные: постепенно выстраивать собственное целостное мировоззрение,осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки.
-метапредметные: В диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации(составление таблицы), использование различных источников для получения химической информации.
-предметные:определять простые вещества металлы и неметаллы;перечислять отличительные физические свойства металлов и неметаллов; составлять уравнения химических реакций, характеризующих свойства металлов и неметаллов.
- УУД, формируемые (базовые) на уроке :анализировать, сравнивать, классифицировать и обобщать факты и явления. Создавать схематические модели с выделением существенных характеристик объекта.Самостоятельно организовывать учебное взаимодействие в парах, исследуя свойства металлов и неметаллов, описывать простые вещества с помощью химических формул и химических уравнений, составлять опорный конспект.
- Тип урока: изучение нового материала
- Формы работы учащихся: работа с учебником, работа в парах, работа с Интернет-ресурсом
- Необходимое оборудование (дидактическое, техническое, компьютерное):
Учебник, компьютер учителя, проектор, презентация к уроку, Интернет-ресурс
Структура и ход урока
| № | Этап урока | Основной вид деятельности со средствами ИКТ (название используемых ЭОР, действий с ЭОР и интерактивной доской, с указанием порядкового номера из Таблицы 2) | Деятельность преподавателя (функции и виды: организация деятельности по постановке цели, система вопросов, организация урока в деятельностной парадигме, дифференцированный подход, индивидуальная помощь, система контроля, критериальное оценивание, рефлексия и т. д.) д.)
| Деятельность учащихся (формы и виды) | Время (в мин.)
|
| 1 | Организационный | Слайды презентации Должны знать; должны уметь Домашнее задание | Сообщение плана урока | Слушают план | 2мин |
| 2 | Актуализация знаний учащихся | 1.Простые вещества
2. Моделирование. Химические формулы простых веществ
3.Образцы некоторых металлов и неметаллов
| Беседа. Какие вещества называются простыми? На какие группы делятся все простые вещества?
Как по внешнему виду отличить металл от неметалла? ( Демонстрация металлов и неметаллов).
| Беседа. Отвечают на вопросы
| 8 мин |
| 3 | Изучение нового материала |
Слайды презентации
3. Видеофрагменты: Теплопроводность Температура плавления Ковкость
Основа опорного конспекта на слайде | Знакомит со строением и физическими свойствами металлов и неметаллов. Демонстрация кристаллических решеток металлов и неметаллов Вводит понятия веществ молекулярного и немолекулярного строения Демонстрирует видеофрагменты о физических свойствах металлов и неметаллов
Химические свойства простых веществ.
| Сравнивают физические свойства металлов и неметаллов.
Составляют таблицу, используя полученные сведения из видеофрагментов и слайдов презентации.
Дополняют опорный конспект Выполняют задание стр.81 в.2,3 | 20 мин |
| 4 | Первичное закрепление материала | Дает задания разной уровни сложности из учебника. Дифференцированный подход. Индивидуальная помощь при составлении химических уравнений. | Работа в парах. Выполнение заданий стр.81, в. 4, 5, 6 | 13 мин | |
| 5 | Подведение итогов | Объявляет критерии оценивания работы на уроке | Ученик работает на доске с выполненным заданием в. 6 стр.81. 6 стр.81.Остальные проверяют и подсчитывают число заработанных баллов | 2 мин |
Перечень используемых на данном уроке ЭОР:
Таблица 2
- Создать условия психологически-комфортного микроклимата для каждого обучающегося.
- Обеспечить условия для восприятия и осмысления понятий «металлы» и «неметаллы» посредством нестандартных заданий для самостоятельной работы.
- Обеспечить условия для формирования устойчивого интереса обучающихся к изучаемому предмету, «химического» стиля мышления при обсуждении относительности деления элементов на металлы и неметаллы.
Задачи.
- Воспитательные: способствовать формирования коммуникативных навыков учащихся; навыков работы в паре и группах, личной и коллективной ответственности за результаты работы; проводить рефлексию собственной деятельности; содействовать воспитанию потребности в здоровом образе жизни; возбудить интерес к дальнейшей учебной деятельности, снять напряжение при ответах.

- Метапредметные: обеспечить «ситуацию успеха», создать условия для самореализации личности, развивать у обучающихся способность легко отличать простые вещества от сложных, металлы от неметаллов; развивать умение логически мыслить, сопоставлять, анализировать, делать выводы и умозаключения; продолжить развитие у учащихся навыков работы с различными источниками информации.
- Предметные: создать условия для усвоения понятий «металлы» расширить и углубить химические знания учащихся; содействовать формированию экспериментальных умений и навыков; включить элементы опережающего обучения как базу для более легкого последующего усвоения знаний о строении и свойствах веществ.
Тип урока: урок изучения новых знаний и первичных их закреплений.
Методы урока: частично-поисковый,частично-исследовательский, иллюстративный,эвристический; работа в паре и в группах,тестирование, работа с коллекциями,самоконтроль, взаимоконтроль.
Формы урока: индивидуальная, парная,групповая,фронтальная беседа.
Средства обучения, оборудование: ПСХЭ,коллекции металлов и неметаллов, инструкционные карты, слайд-презентация урока, подготовленная учителем, проектор, компьютер, поддерживающий формат MicrosoftPower Point-2007.
Применяемые технологии: урок построен с использованием здоровьесберегающих технологий, современных информационных технологий – программы MicrosoftPowerPoint. Презентация происходит в виде сменяющихся слайдов. Урок построен на основе личностно-ориентированного подхода в условиях гуманизации обучения.
Планируемые результаты
Урок позволяет создать ситуацию успеха,психологическую комфортную обстановку в учебном процессе, дает возможность, увидеть ученику свои сильные стороны, быть понятым.Личностно-ориентированный подход дает возможность строить учебный процесс на разных уровнях сложности, использовать нетрадиционные формы обучения.
План урока
1. Организационный момент.Вступительное слово учителя.
2. Актуализация темы.
3. Формулировка темы урока.
4. Целеполагание.
5. Изучение нового материала.
6. Заполнение таблицы
7. Первичная проверка понятия материала.
8. Физкультминутка.
9. Литературная разминка
10. Рефлексия.
11. Заключительное слово учителя. Оценка работы обучающихся на уроке.
12. Домашнее задание.
ХОД УРОКА.
Этапы урока | Основное содержание | Деятельность учащихся |
| 1. Оргмомент | Приветствие учащихся | |
2. Актуализация темы Актуализация темы | Чтобы сформулировать тему урока, предлагаю сначала ответить на несколько вопросов. 1. Что такое элемент? На какие две группы делятся все элементы в ПСХЭ? 2. Какие виды химической связи наблюдаются в веществах? 3. Дайте характеристику металла как простого вещества, опираясь на знания из курса физики. Что означает электронная схема элемента? 4.Составить электронную схему следующих элементов: AL. S.CL. | Фронтальная беседа
Работа у доски двух учащихся. |
| 3. Формулировка темы урока | Знания о простых и сложных веществах подводит нас к формулировке темы урока. Но прежде чем записать ее в тетрадь прошу вас отгадать загадку. В одной удивительной и загадочной стране жили два народа. Жители большого народа обладали твердым, но пластичным характером, они были теплы в общении и носили блестящие одежды. А жители малого народа носили разные одежды, были холодные и хрупкие. Что это за два народа? Какова же тема урока? А жители малого народа носили разные одежды, были холодные и хрупкие. Что это за два народа? Какова же тема урока? | Формулируют тему урока: «Простые вещества – металлы Записывают тему урока в тетради. |
| 4. Целеполагание | Эпиграфом нашего сегодняшнего урока, будут следующие слова: «Сами, трудясь. Вы сделаете все и для близких людей и для себя, а если при труде успеха не будет, неудача – не беда, попробуйте еще» Д.И.Менделеев Я не случайно взяла эти слова. Сегодня вы многое будете делать самостоятельно, сами будете добывать знания. Предлагаю вам сформировать цели урока исходя из темы. Цель урока: Познакомиться с понятием металлы, их физическими свойствами. Выявить отличие металлов от неметаллов .Итак начнем нашу работу с уточнения понятий: металлы – простые вещества, металлы – элементы. Ответим на вопросы . -в яблоках есть железо — в состав ляписа входит серебро — алюминий – легкий металл -степень окисления галлия +3
Выводы записываем в тетрадь. | Формулируют цель урока, исходя из темы: научиться отличать металлы от неметаллов.
Фронтально- воспроизводящая беседа. |
| 5. Изучение новой темы | Великий русский ученый М.В.Ломоносов, которому в этом году исполнилось 301год, определял металл как «твердое, непрозрачное, светлое тело, которое на огне плавить и холодное ковать можно»
Эти свойства относятся к металлам.Что означает термин « металлы»? А какие еще физические свойства характерны для металлов? Послушайте стихотворение о металлах.
Металл – это точность. Металл – это прочность. Скорость, высота, Блеск и красота. Не сразу в дом пришел металл, Не сразу вилкой, ложкой стал И заводной игрушкой Был путь металла долог…
Он в проводах несет нам свет, Металл – коньки, велосипед, Метро, трамвай, будильник, Утюг и холодильник . Многие металлы были известны с глубокой древности.Что это были за металлы? Стр.72 упр.1
Семь металлов создал свет Семь металлов, известные еще в Древнем Египте, считались представителями на Земле семи планет. Вам дано задание, найти металлы, известные еще в древности и соответствующие им планеты. Назовите их? Какое вещество не относят к металлам? Почему?. Вы убедились, что свойства металлов отличаются от свойств остальных веществ. Все металлы обладают рядом общих физических свойств. «Мощь и сила науки во множестве фактов,цель –в обобщении этого множества.» Сейчас вы с помощью раздаточного материала(набора металлов, картин, магнита,воды, планшетов с металлическими предметами) попробуете определить физические свойства металлов, работая в группе. Распределяю учащихся по группам. Выводы запись в тетрадях) — металлы имеют свойства: электро -теплопроводность, ковкость,блеск.звон.магнитизм,твердость Дополнение на слайде. Какой металл самый самый… | Ребята коллективно обсуждают проблему и определяют общие свойства металлов. Учащиеся отвечают с места.
Записывают общие свойства металлов в тетрадь
Работа в .группе По окончании работы – оглашение результатов ответственному в группе. |
| 6. Первичное закрепление понятия материала | Сейчас вам предстоит решить первую контекстную задачу, а именно по описанию угадать, что это за вещество и является ли это вещество металлом . | Работа в группах с информационными текстами по описанию вещества После обсуждения и коллективной работы, отчет каждой группы. |
| 7. Физкультминутка | «Гимнастика для глаз» Вращение глазами по часовой стрелке и обратно. | Делают упражнения для глаз. |
| 8. Литературные ребусы | 1. Корабли меня обходят. Знает лоцман наизусть. Если л на д заменят, То металлом окажусь. (Мель – медь 2. С «ка» – активный я металл, (Калий – галлий. 3. Я металл, меня ты знаешь. (Уран – буран. | Учащиеся все вместе отгадывают ребусы. |
| 9. Рефлексия | Используя новый материал, выполните тестовое задание, каждый индивидуально. После окончания выполнения теста проверьте сами и передайте проверить соседу по парте. Проверяем правильность выполнения тестового задания. Поставьте оценку, согласно критерию: одно задание – два; два задания – три; три задания – четыре; четыре задания – пять. | Индивидуальная работа по выполнению тестового задание. Самопроверка и взаимопроверка теста. |
| 10. Подведение итогов урока | А теперь подумайте и задайте один вопрос, который остался неясным. Почему одни химические элементы образуют простые вещества металлы, а другие не образуют? Для этого нам надо знать еще и химические свойства металлов. А их мы изучим на следующих уроках.
| Ученик задает вопрос.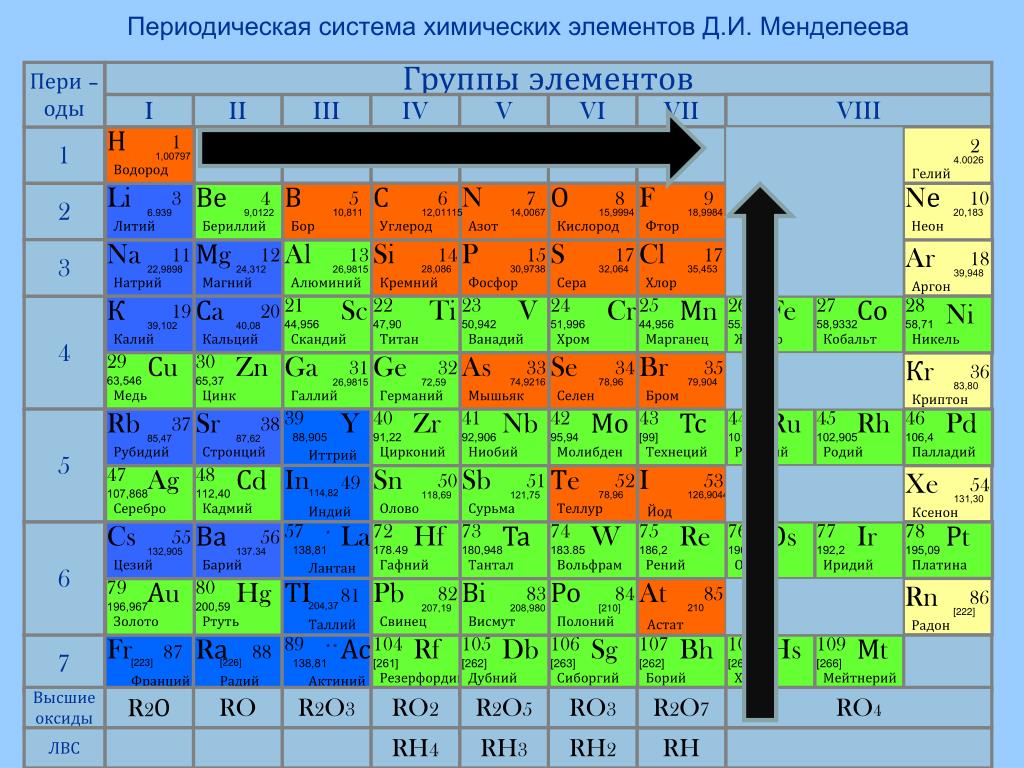 Учащиеся отвечают на вопросы учителя |
| 11. Оценки за работу на уроке | Оценки выставляю за работу на уроке и за выполнение теста. | |
| 12. Домашнее задание | Параграф учебника , подготовить презентации о металлах на выбор: (железо, алюминий, медь, серебро, золото, свинец, олово, натрий, магний, ртуть. |
на Ваш сайт.
Простые вещества. Металлы и неметаллы
Химия. 7 класс. Попель
Материал параграфа поможет вам:
- выделять среди всех веществ простые вещества;
- распознавать металлы и неметаллы;
- понять, почему все металлы похожи по свойствам;
- определять металлические и неметаллические элементы по их размещению в периодической системе.
Простые вещества. Атомы способны соединяться с такими же или другими атомами. Это обуславливает большое разнообразие в мире веществ.
Атомы способны соединяться с такими же или другими атомами. Это обуславливает большое разнообразие в мире веществ.
Вещество, образованное одним химическим элементом, называют простым веществом.
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил в конце XVIII в. выдающийся французский ученый А. Л. Лавуазье.
Металлы. Каждый из вас, не раздумывая, назовет несколько металлов. Они отличаются от остальных веществ особым «металлическим» блеском (рис. 41). Эти вещества имеют много других общих свойств. Металлы в обычных условиях твердые (лишь ртуть является жидкостью), хорошо проводят электрический ток и теплоту, имеют в основном достаточно высокие температуры плавления (свыше 500 °С). Они пластичны; их можно ковать, вытягивать из них проволоку.
Это интересно
До нашей эры людям были известны простые вещества 11 элементов — Au, Ag, Cu, Hg, Pb, Fe, Sn, S, C, Zn и Sb.
Рис. 41. Металлы
Благодаря своим свойствам металлы уверенно вошли в жизнь людей. Об их значении свидетельствуют названия исторических эпох: медный век, бронзовый1 век, железный век.
Сходство металлов обусловлено их внутренним строением. Атомы размещены в металле очень плотно, и часть электронов постоянно переходит от одних атомов к другим. Благодаря этим электронам металлы проводят электрический ток, способны быстро нагреваться и охлаждаться.
Неметаллы. Простых веществ этого типа значительно меньше. К неметаллам относятся азот, кислород, графит, алмаз, сера, иод и др. (рис. 42).
Неметаллы отличаются от металлов прежде всего отсутствием металлического блеска. Лишь графит, иод, кристаллические бор и силиций имеют такой блеск. Неметаллы не проводят электрический ток (исключение — графит). В обычных условиях часть неметаллов находится в газообразном состоянии (металла-газа не существует), другие являются твердыми веществами, и только бром — жидкостью.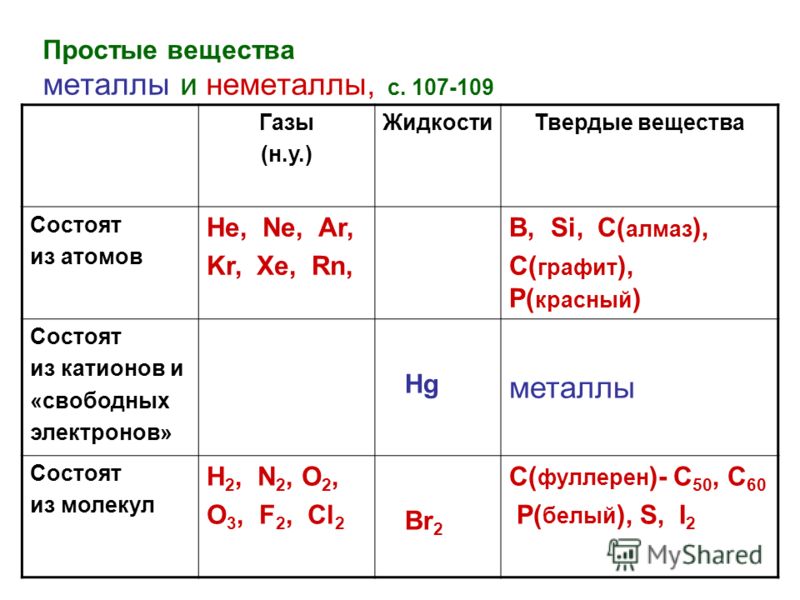
Между собой неметаллы существенно различаются.
1 Бронза — сплав меди с оловом.
Рис. 42. Неметаллы
Часть неметаллов состоит из атомов. В алмазе, графите, боре, силиции, красном фосфоре все атомы соединены друг с другом, а в инертных газах — гелии, неоне, аргоне, криптоне, ксеноне и радоне — они разъединены.
Другие неметаллы образованы молекулами. Атомы в каждой молекуле прочно соединены между собой, а молекулы лишь слабо притягиваются друг к другу. Поэтому вещества молекулярного строения имеют невысокие температуры плавления и кипения.
Из молекул состоят простые вещества Оксигена — кислород и озон. Молекула кислорода содержит два атома, а молекула озона — три (рис. 43).
Рис. 43. Модели молекул: а — кислорода; б — озона
Не только Оксиген, но и немало других элементов образуют по два и более простых веществ. Поэтому простых веществ существует больше, чем химических элементов.
Названия простых веществ. Большинство простых веществ называют так, как и соответствующие химические элементы. Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия элемента (рис. 44).
Рис. 44. Клетка периодической системы
- Назовите простые вещества элементов Лития, Гидрогена, Магния, Нитрогена.
Названия простых веществ внутри предложения записывают с маленькой буквы; они не являются именами собственными. Пример такого предложения: «Неметалл бор состоит из атомов элемента Бора».
Металлические и неметаллические элементы. Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, — неметаллическими. В длинном варианте периодической системы (форзац II) они разделены диагональной ломаной линией. Металлические элементы размещены слева от нее; их значительно больше, чем неметаллических элементов.
Элементы Германий, Стибий, Полоний, клетки которых находятся у диагональной линии, образуют простые вещества, напоминающие по некоторым свойствам металлы, а по другим свойствам — неметаллы.
Выводы
Каждое простое вещество образовано одним элементом.
Простые вещества делят на металлы и неметаллы, а химические элементы — на металлические и неметаллические.
Металлы имеют немало общих свойств благодаря сходству внутреннего строения.
Неметаллы состоят из атомов или молекул и по свойствам отличаются от металлов, а нередко — и друг от друга.
73. Какое вещество называют простым? Назовите несколько таких веществ.
74. Какие типы простых веществ существуют? Как называют соответствующие элементы?
75. Укажите правильное окончание предложения «Каждое простое вещество образовано…»:
- а) одинаковыми молекулами;
- б) одним химическим элементом;
- в) одним металлическим элементом;
- г) одним неметаллическим элементом.

76. По каким физическим свойствам металл можно отличить от неметалла?
77. Заполните пропуски, вставив в соответствующих падежах слова «Нитроген» или «азот», и объясните ваш выбор:
- а) … — газ, которого в воздухе содержится наибольшее количество;
- б) молекула … состоит из двух атомов …;
- в) соединения … поступают в растения из почвы;
- г) … плохо растворяется в воде.
78. Заполните пропуски, вставив слова «элемент», «атом» или «молекула» в соответствующем падеже и числе:
- а) … белого фосфора содержит четыре … Фосфора;
- б) золото — простое вещество … Аурума.
79. Какие элементы образуют следующие простые вещества: фтор, золото, цинк, фосфор, ртуть?
80. Назовите простые вещества элементов Pb, Са, Не, Ag, В.
81. Какая ошибка допущена в утверждении «В яблоках есть железо»? Исправьте ее, используя правильное химическое название.
82. Найдите соответствие, воспользовавшись длинным вариантом периодической системы:
Элемент
- 1) Арсен;
- 2) Вольфрам;
- 3) Стронций;
- 4) Ксенон;
- 5) Уран;
Тип элемента
- а) металлический элемент;
- б) неметаллический элемент.

7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции изменения металлических и неметаллических характеристик Атрибуции
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и из них могут быть изготовлены тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле. - Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1. {-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами обычно имеют ионную природу . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод. ) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.

- Точки плавления и кипения : Точки плавления неметаллов на , как правило, на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и становятся анионами :
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабокислый характер (углекислый газ).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлических и неметаллических свойствах
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
2.11 Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Физические свойства металлоидов
- Химические свойства Металлоиды
- Тенденции в металлическом и неметаллическом характере
- Авторы и авторство
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от нементалов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Металлические элементы | Неметаллические элементы |
|---|---|
Отличительный блеск (блеск) | Бесцветный, разные цвета |
Податливый и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
Проводить тепло и электричество | Плохие проводники |
Оксиды металлов основные, ионные | Неметаллические оксиды кислые, соединения |
Катионы в водном растворе | Анионы, оксианионы в водном растворе |
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга (кусочек золота в виде кубика сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле).

- Пластичность: Металлы можно втягивать в проволоку. Из 100 граммов серебра можно сделать тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения.
 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы обычно имеют низкую энергию ионизации, а обычно теряет электроны (т.е.- \]
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не имеют очевидной закономерности, 2 + является обычным явлением, а также наблюдаются 1 + и 3 +
- Соединения металлов с неметаллами имеют тенденцию быть ионными по природе
- Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
Na 2 O ( с ) + H 2 O ( l ) -> 2NaOH ( водн. )
)
CaO ( с ) + H 2 O ( л ) -> Ca (OH) 2 ( водн. )
- Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей и воды:
Оксид металла + кислота -> соль + вода
MgO ( с ) + HCl ( водн. ) -> MgCl 2 ( водн. ) + H 2 O ( л )
NiO ( с ) + H 2 SO 4 ( водн. ) -> NiSO 4 ( водн. ) + H 2 O ( l )
Пример
Какова химическая формула оксида алюминия?
Решение
Al имеет заряд 3+, ион оксида — O 2-, таким образом, Al 2 O 3
Пример
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
Al 2 O 3 ( s ) + 6HNO 3 ( водн.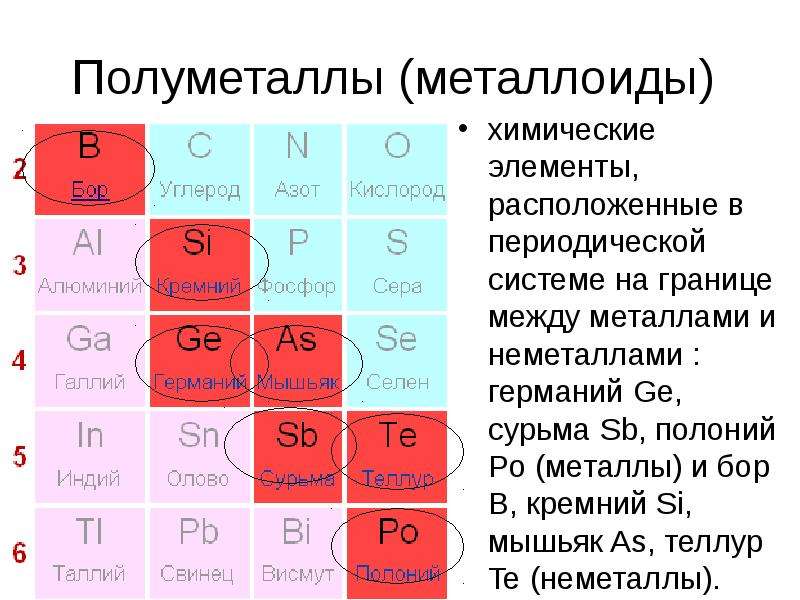 ) -> 2Al (NO 3 ) 3 ( водн. )
) -> 2Al (NO 3 ) 3 ( водн. )
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод).
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Электропроводность : Плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Класс 2 ( г )
- Br 2 ( л )
- I 2 ( л ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами.
 Они имеют электроотрицательный характер.
Они имеют электроотрицательный характер. - Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и становятся анионами:
Неметалл + металл -> Соль
\ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
- Соединения, полностью состоящие из неметаллов, являются молекулярными веществами (не ионными).
- Обычно они образуют кислые или нейтральные оксиды с кислородом, который, растворяясь в воде, вступает в реакцию с образованием кислот:
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {углекислота}} {H_2CO_ {3 (водн.)}} \]
(газированная вода слабокислая)
- Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\ [CO_ {2 (г)} + 2NaOH _ {(водн. )} \ Rightarrow Na_2CO_ {3 (водн.)} + H_2O _ {(l)} \]
)} \ Rightarrow Na_2CO_ {3 (водн.)} + H_2O _ {(l)} \]
Металлоиды
Промежуточные свойства между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Физические свойства металлоидов
- Состояние : Все они твердые при комнатной температуре.

- Проводимость : Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при определенных условиях, поэтому их называют полупроводниками.
Блеск : Кремний , например, выглядит блестящим, но не является ковким или пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.
- Твердые растворы : они могут образовывать сплавы с другими металлами.
Химические свойства металлоидов
- Их физические свойства, как правило, металлические, но их химические свойства, как правило, неметаллические.
- Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлическом и неметаллическом характере
Металлический символ является самым сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению на при перемещении вправо в любой период (неметаллический характер увеличивается с увеличением значений ионизации).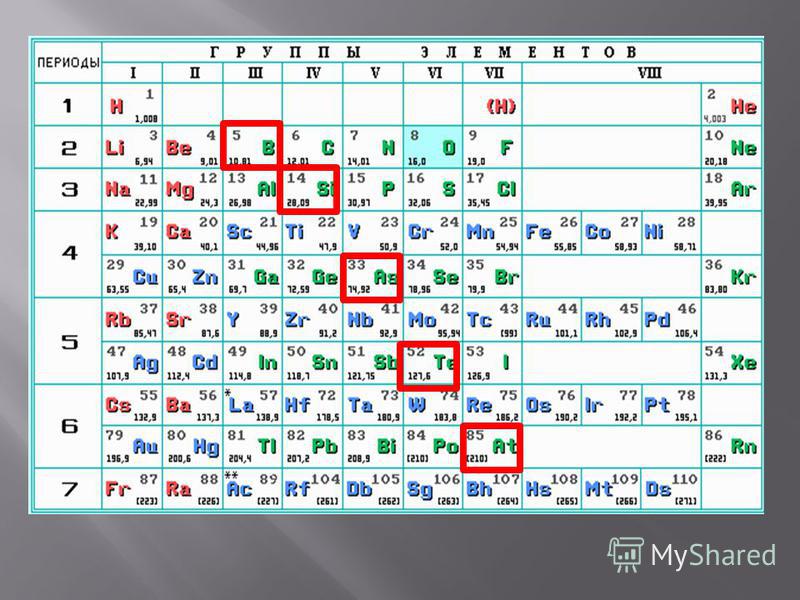 Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами , .
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами , .
Авторы и ссылки
Химия неметаллов
Химия Неметаллы
Какие Неметаллы?
Более 75% известных элементов имеют характеристику
свойства металлов (см. рисунок ниже).У них есть
металлический блеск; они податливы и пластичны; и они проводят
тепло и электричество. Восемь других элементов (B, Si, Ge, As, Sb,
Te, Po и At) лучше всего описать как полуметаллы или металлоиды .
Они часто выглядят как металлы, но имеют тенденцию быть хрупкими и
они скорее будут полупроводниками, чем проводниками
электричество.
После исключения металлов и полуметаллов из перечня известных элементов, только 17 осталось классифицировать как неметаллы .Шесть из этих элементов относятся к семейству инертных газов Группы VIIIA, большинство из которых практически инертны к химическим реакциям. Поэтому дискуссии о химии неметаллов имеют тенденцию сосредоточиться на следующих элементах: H, C, N, O, F, P, S, Cl, Se, Br, Я и Кси.
Неметаллы
В химии основной группы прослеживается четкая закономерность. металлы: Металлы основной группы окисляются во всех их химические реакции. Эти металлы окисляются при они реагируют с неметаллическими элементами. Алюминий, например, окисляется бромом.
Химия неметаллов более интересна, потому что
эти элементы могут подвергаться как окислению, так и восстановлению. Например, фосфор окисляется при взаимодействии с кислородом.
для формирования P 4 O 10 .
Например, фосфор окисляется при взаимодействии с кислородом.
для формирования P 4 O 10 .
Но он уменьшается, когда он вступает в реакцию с кальцием с образованием кальция. фосфид.
Эти реакции можно понять, посмотрев на относительные электроотрицательности этих элементов. Фосфор ( EN = 2.19) менее электроотрицателен, чем кислород ( EN = 3,44). Когда эти элементы реагируют, электроны притягиваются к больше электроотрицательных атомов кислорода. Таким образом, фосфор окисляется в этой реакции, а кислород восстанавливается. Кальций ( EN = 1.00), с другой стороны, значительно менее электроотрицательный чем фосфор ( EN = 2.19). Когда эти элементы реагируют, электроны тянутся к более электроотрицательным атомы фосфора. В результате происходит окисление кальция и фосфора. уменьшен.
Поведение неметаллов можно резюмировать следующим образом.
1. Неметаллы склонны окислять металлы.
| 2 мг ( с ) | + | O 2 ( г ) | 2 MgO ( с ) |
2.Неметаллы с относительно большой электроотрицательностью (например, как кислород и хлор) окисляют вещества, с которыми они вступают в реакцию.
| 2 H 2 S ( г ) | + | 3 O 2 ( г ) | 2 SO 2 ( г ) | + | 2 H 2 O ( г ) |
| PH 3 ( г ) | + | 3 Класс 2 ( г ) | PCl 3 ( л ) | + | 3 HCl ( г ) |
3. Неметаллы с относительно небольшими
электроотрицательность (например, углерод и водород) может уменьшить
другие вещества.
Неметаллы с относительно небольшими
электроотрицательность (например, углерод и водород) может уменьшить
другие вещества.
| Fe 2 O 3 ( s ) | + | 3 C ( с ) | 2 Fe ( с ) | + | 3 CO ( г ) |
| CuO ( с ) | + | H 2 ( г ) | Cu ( с ) | + | H 2 O ( г ) |
Свойства металлов и неметаллов — Металлы и неметаллы — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
0.$0.$1.$0″> Металлы расположены в левой части периодической таблицы, а неметаллы — в правой .Физические свойства
В таблице приведены некоторые типичные свойства металлов и неметаллов.
| Металлы | Неметаллы | |
|---|---|---|
| Блестящий | bwdlno7wm0.0.0.0.1:0.1.0.$0.$2.$2.$2.$0.$1″> Тусклый | |
| Высокие температуры плавления | Низкие температуры плавления | |
| Хорошие проводники электричества | Плохие проводники | |
| Хорошие проводники тепла | Плохие проводники тепла | |
| Высокая плотность | Низкая плотность | |
| Ковкий и пластичный | Хрупкий |
Некоторые элементы обладают нетипичными свойствами.Например:
- ртуть (металл) имеет низкую температуру плавления и существует в виде жидкости при комнатной температуре
- графит, форма углерода (неметалл), имеет высокую температуру кипения и также является хорошим проводником.
 электричества
электричества
Вещество с высокой плотностью означает, что оно имеет большую массу для своего размера.
Тягучие вещества можно сгибать или придавать им форму без разрушения, в то время как хрупкие вещества разбиваются при сгибании или ударе.
Под вязкостью означает, что вещество можно растянуть в длинную проволоку без разрывов и разрывов.
Химические свойства
Металлы и неметаллы также можно отличить по некоторым химическим свойствам.
Наиболее распространенным химическим свойством является тип оксида, который образует элемент. Металлы образуют основные оксиды, но неметаллы образуют кислые оксиды. Например, сера и углерод — неметаллы. Они реагируют с кислородом с образованием диоксида серы и диоксида углерода.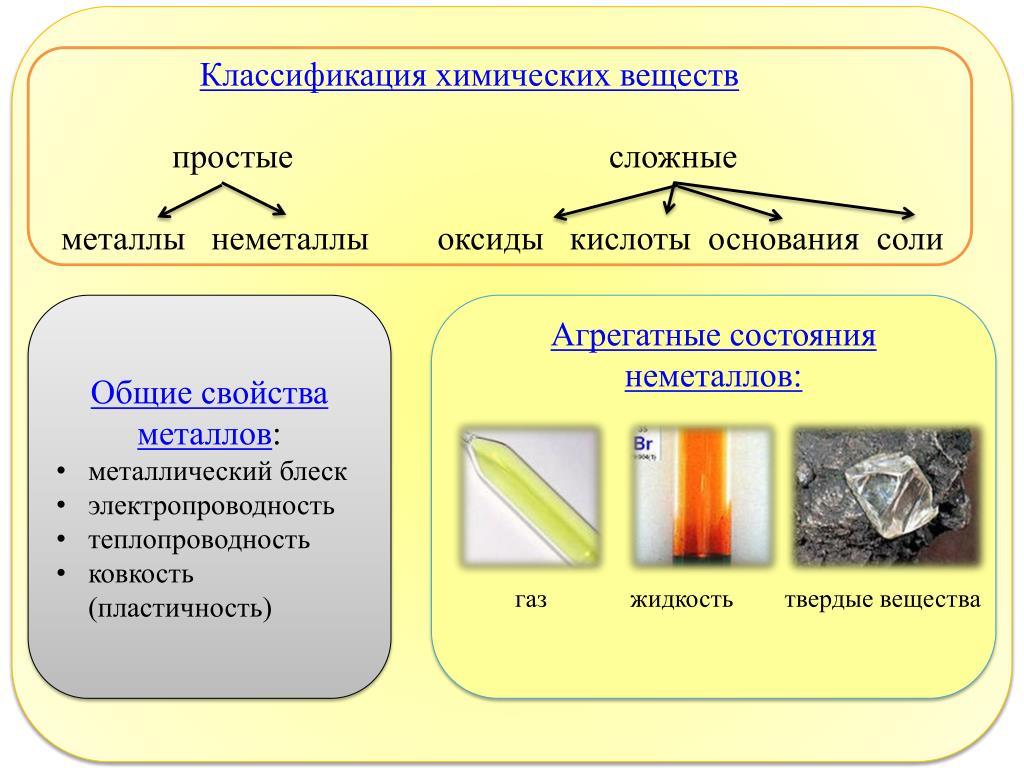 Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Эти соединения представляют собой газы, присутствующие в воздухе и растворяющиеся в дождевой воде, делая ее кислой.
Некоторые оксиды не растворяются в воде, поэтому они не повлияют на цвет индикатора, добавленного в воду.
- Вопрос
Элемент таллий образует оксид Tl 2 O. Оксид таллия не растворяется в воде, но реагирует с кислотами с образованием солей таллия. Таллий — это металл или неметалл? Поясните свой ответ.
- Показать ответ
Таллий — это металл.
 Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.
Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.
Металлы также более подвержены коррозии, чем неметаллы. Это означает, что неметаллы с меньшей вероятностью реагируют с водой или кислотами, чем металлы.
Металлы и неметаллы в таблице Менделеева
Gethin: Сегодня с нами супер учитель естествознания мисс Армит. То, что она не знает о химии, знать не стоит. И сегодня мы собираемся взглянуть на таблицу Менделеева.
Мисс Армит — объясните.
Мисс Армит: Итак, то, что мы собираемся рассмотреть сегодня, — это металлические элементы в группе 1 периодической таблицы, а также металлические элементы в блоке переходных металлов периодической таблицы и их свойства.
Gethin: Я думаю, это будет хорошо, не так ли.
Итак, мы собираемся поговорить о переходных металлах, которые находятся в середине периодической таблицы. Каковы их основные свойства?
Каковы их основные свойства?
Miss Armit: Итак, их ключевые свойства — они проводят электричество, проводят тепло, они пластичны — а это значит, что они гибкие — и они блестящие.
Gethin: Хорошо. И о каких металлах здесь идет речь и для чего они используются.
Мисс Армит: Что ж, у нас есть медь, и она действительно хороший проводник электричества, поэтому мы используем ее в наших проводах. У нас также есть железо и алюминий, и они отлично проводят тепло, поэтому мы используем эти металлы для наших кастрюль и сковородок. А золото и серебро используются в украшениях, потому что они блестящие, податливые и не вступают в реакцию с кислородом, поэтому они не ржавеют.
Вы можете назвать жидкий переходный металл?
Gethin: Я бы сказал, ртуть.
Мисс Армит: Очень хорошо.
Gethin: Ага.
Miss Armit: Это единственный металл жидкого транзистора, и благодаря своим свойствам он идеально подходит для термометра.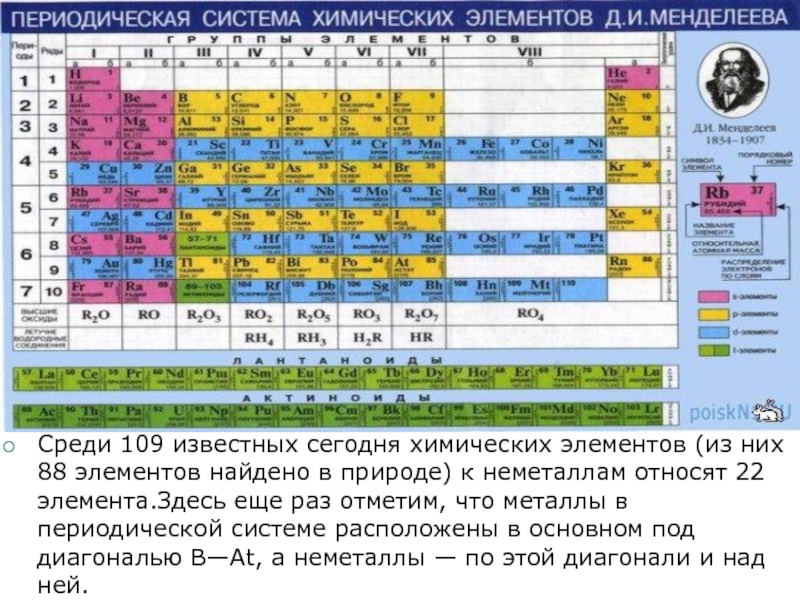 Как вы думаете, почему это так?
Как вы думаете, почему это так?
Gethin: Ну тут дело в тепле.
Мисс Армит: Да, потому что ртуть отлично проводит тепло.Итак, когда становится жарко, пространство между частицами расширяется, и тогда термометр поднимается вверх.
Gethin: Итак, он отлично подходит для термометров, но не так хорош для кастрюль и сковородок.
Мисс Армит: Именно так.
Gethin: Они просто растают, и все равно будет беспорядок.
Металлы и неметаллы — Американское химическое общество
Бесплатные статьи
ChemSumer: Химия цифровой фотографии и печати
, февраль 2006 г. (стр. 4–7)
Автор: Брайан Рориг
Химия Связи: Атомная теория, Связь, Металлы / Неметаллы, Периодичность
Описание: Начинается с очень краткого описания пленочной фотографии и ее химии.Затем описывается роль полупроводников типа «n» и «p» в формировании диодов, фотосайтов или пикселей в датчике цифровой камеры. Также обсуждаются различия между черным и белым и цветными датчиками. Затем обсуждаются процессы струйной и лазерной печати, уделяя особое внимание разнице в заряде для передачи изображения или текста.
Также обсуждаются различия между черным и белым и цветными датчиками. Затем обсуждаются процессы струйной и лазерной печати, уделяя особое внимание разнице в заряде для передачи изображения или текста.
Захватывающая химия монет
апреля 2007 г. (стр. 14-17)
Автор: Брайан Рориг
Химия Связи: Металлы / Неметаллы
Описание: Обсуждает разницу в составе и свойствах чистых металлов и металлических сплавов.Приведена краткая история монет. Подробно описывает разницу между пенни до и после 1982 года и способы их различения. Также обсуждаются различия между десятицентовыми монетами, четвертями, полдолларами и однодолларовыми монетами до и после 1964 года и способы их различения. Показывает различные свойства канадских монет (например, магнитный никель и точку Кюри). В статье представлены три эксперимента, которые студенты могут проделать с монетами.
Bling Zinger: Ведущее содержание ювелирных изделий
апрель 2006 г. (стр.
 11–14)
11–14) Автор: Кристен Браунли
Химические связи: История / биография, металлы / неметаллы
Описание: Описывает свойства свинца и некоторых его соединений, которые использовались на протяжении всей истории человечества.Описывает его использование в древних виадуках, керамике, ювелирных изделиях, кристаллах и даже в продуктах питания. Основное внимание уделяется современному использованию соединений свинца в бензине, красках и ювелирных изделиях, а также опасностям, которые это использование представляет для человека. Объясняет, что свинец — это нейротоксин, который накапливается в организме и подавляет выработку гемоглобина, а также имитирует поведение ионов кальция в нервной системе. Описывает хелатную терапию для удаления свинца из организма.
В поисках чистого напитка
апрель 2008 г. (стр. 4–6)
Автор: Кристен Браунли
Химические связи: Связь, Металлы / Неметаллы, Реакции, Решения, Устойчивость
Описание: Рассказывает о проблемах в Индии и Бангладеш, связанных с получением чистой питьевой воды, начиная с загрязнения поверхностных вод. с последующим загрязнением подземных вод мышьяком.Затем обсуждаются три различных практических метода очистки воды от мышьяка, которые успешно используются в этих странах. Иллюстрируется химия, включая уравнения процессов.
с последующим загрязнением подземных вод мышьяком.Затем обсуждаются три различных практических метода очистки воды от мышьяка, которые успешно используются в этих странах. Иллюстрируется химия, включая уравнения процессов.
Flaking Away 914 — 26 февраля 2006 г. (стр. 17–19)
Автор: Кристен Браунли
Химия Связи: Металлы / Неметаллы, Реакции, Растворы, Устойчивое развитие
Описание: Рассказывает о гибели старых автомобилей из-за ржавчины, уделяя особое внимание роли электронов в этой химической реакции, окислению -снижение.Обсуждается, как разные области одной и той же металлической детали могут действовать как аноды и катоды одновременно, и как вода, как растворитель для ионов на поверхности, является соединителем между этими двумя областями положительного и отрицательного заряда, что позволяет возникать окислительно-восстановительному потенциалу. Различия в скорости ржавления в разных географических регионах страны объясняются наличием соли либо из-за океанских брызг в прибрежных районах, либо из-за засоления дорог в более холодных регионах страны. Также обсуждается: обращение вспять процесса ржавления (непрактично), другие объекты, которые ржавеют, стоимость ржавчины и краски для предотвращения коррозии.Приведены химические уравнения коррозии.
Также обсуждается: обращение вспять процесса ржавления (непрактично), другие объекты, которые ржавеют, стоимость ржавчины и краски для предотвращения коррозии.Приведены химические уравнения коррозии.
Объяснитель уроков: металлы, неметаллы и металлоиды
В этом пояснительном механизме мы узнаем, как описывать, сравнивать и объяснять физические и химические свойства металлов, неметаллы и металлоиды.
Периодическая таблица элементов имеет много интересных тенденций, и одна из наиболее очевидных — переход металлов в
металлоиды, а затем неметаллы, когда мы перейдем от левой части таблицы Менделеева к правой.В
явление увлекательное не только потому, что оно поддерживается почти для всех строк периодической таблицы, но и потому, что
это можно объяснить относительно простыми теориями об обмене валентными электронами и межмолекулярных связях.
узоры. Таблица Менделеева довольно давно была разделена на отдельные металлические и неметаллические разделы. Йенс Якоб Берцелиус был ученым 19 века, который считается одним из основоположников современной химии. Он классифицировал
элементы как металлы или неметаллы более ста лет назад.Его классификации основывались на физическом
свойства элементов.
Йенс Якоб Берцелиус был ученым 19 века, который считается одним из основоположников современной химии. Он классифицировал
элементы как металлы или неметаллы более ста лет назад.Его классификации основывались на физическом
свойства элементов.
На следующем рисунке используются красный и синий цвета, чтобы показать, как периодическая таблица Менделеева переходит от металлических элементов к неметаллам. элементы. Металлические элементы представлены красным цветом, и их можно найти в левой части периодической шкалы. Таблица. Неметаллические элементы представлены синим цветом, и их можно найти в правой части периодической таблицы. Таблица. Металлоидные элементы представлены желтым цветом, и их можно найти между левым и правым. разделы периодической таблицы.Белые клетки представляют собой химические элементы с неизвестными химическими свойствами.
Водород — единственный элемент, который не соответствует простому и понятному принципу, что металлы находятся на
в левой части таблицы Менделеева, а неметаллы — в правой.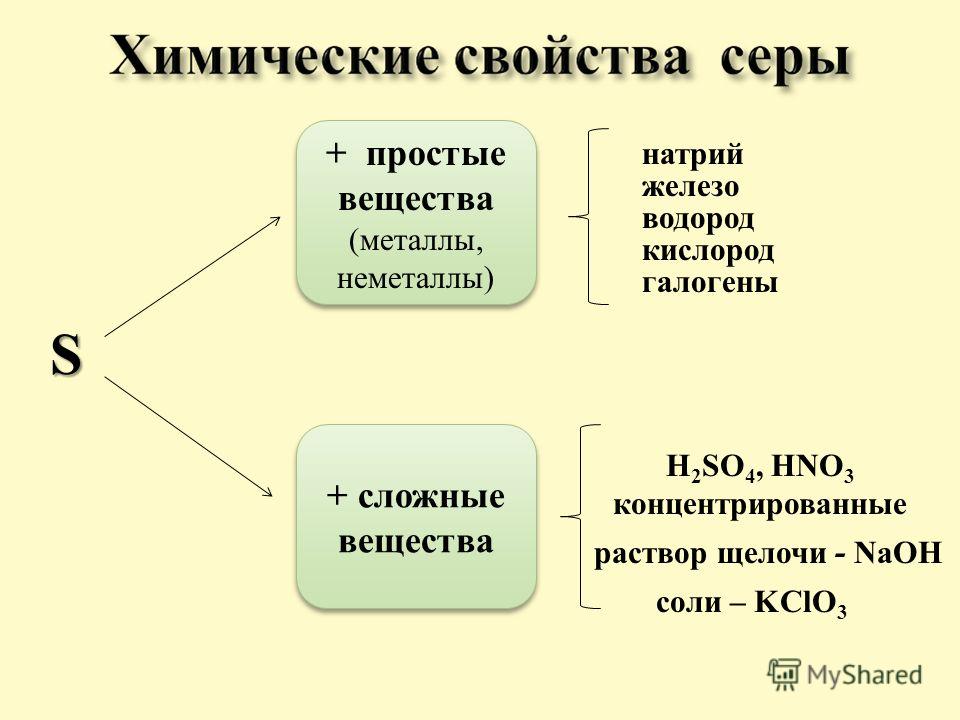 Водород — довольно необычный элемент, потому что
он имеет конфигурацию валентных электронов металла, но имеет неметаллические химические свойства. Это подстегнуло некоторых
Интересные споры о месте водорода в периодической таблице.Некоторые ученые утверждают, что водород должен быть
помещен над углеродом в периодической таблице. Другие ученые заявляют, что его следует размещать выше фтора. Водород
в настоящее время размещается выше металлов группы 1, но в будущем может оказаться выше другой группы.
Водород — довольно необычный элемент, потому что
он имеет конфигурацию валентных электронов металла, но имеет неметаллические химические свойства. Это подстегнуло некоторых
Интересные споры о месте водорода в периодической таблице.Некоторые ученые утверждают, что водород должен быть
помещен над углеродом в периодической таблице. Другие ученые заявляют, что его следует размещать выше фтора. Водород
в настоящее время размещается выше металлов группы 1, но в будущем может оказаться выше другой группы.
Металлические и неметаллические элементы имеют очень разные химические и физические свойства, потому что они состоят из атомов, которые
связаны очень разными способами. Атомы металлов обычно образуют гигантские трехмерные структуры, состоящие из миллиардов
положительно заряженные ионы в море делокализованных электронов.Атомы неметаллов обычно образуют гораздо более мелкие ковалентно связанные молекулы. Металлы не более полезны, чем неметаллы, и неметаллы не обязательно более полезны, чем металлы. В материалах есть
очень разные физические и химические свойства, и каждое из них очень хорошо подходит для ряда конкретных промышленных и
коммерческие приложения.
В материалах есть
очень разные физические и химические свойства, и каждое из них очень хорошо подходит для ряда конкретных промышленных и
коммерческие приложения.
Известно, что металлы являются твердыми и имеют высокие температуры плавления и кипения, поскольку они состоят из катионов металлов в
море делокализованных электронов.Между катионами металлов и делокализованным слоем возникают сильные электростатические силы притяжения.
электроны. Для их разрушения требуется много тепла или механической энергии. Атомы вольфрама удерживаются вместе с некоторыми из
самые прочные металлические связи среди всех чистых металлических элементов. Металлический вольфрам имеет самую высокую температуру плавления из всех металлических элементов. Он имеет температуру плавления 3422∘C. Металлический вольфрам используется для изготовления
нити большинства лампочек, особенно потому, что они могут раскалиться добела, не плавясь.Атомы ртути удерживаются вместе
с чрезвычайно слабыми металлическими связями. У ртути самая низкая температура плавления из всех металлических элементов. Имеет точку плавления
всего -39∘C. Ртуть используется для изготовления термометров.
потому что он имеет низкую температуру плавления и является жидкостью при комнатной температуре.
У ртути самая низкая температура плавления из всех металлических элементов. Имеет точку плавления
всего -39∘C. Ртуть используется для изготовления термометров.
потому что он имеет низкую температуру плавления и является жидкостью при комнатной температуре.
Определение: Металлическое соединение
Металлическое соединение — это сильное электростатическое притяжение, которое существует между положительно заряженными катионами металлов и делокализованными электроны.
Большинство металлов являются прочными, что делает их пригодными для изготовления транспортных средств и компонентов несущих конструкций.
крупных зданий и памятников. Твердые металлы регулярно используются для производства автомобилей, а также для изготовления более крупных транспортных средств.
транспортные средства, такие как грузовые корабли и даже самолеты. Также здесь находится невообразимо много больших зданий и памятников.
которые содержат стальные каркасы или другие типы металлических опорных конструкций.
Металлы, как известно, имеют относительно низкое количество валентных электронов и относительно большой атомный радиус.Металлы обычно имеют валентная оболочка, заполненная менее чем наполовину, и их атомный радиус больше, чем у неметаллов того же периода. Металлы имеют тенденцию иметь относительно низкое сродство к электрону и энергию ионизации, потому что они имеют такой большой атомный радиус.
Пример 1. Понимание того, почему металлы обычно жесткие, а твердые вещества
Какие структурные свойства металлов определяют их твердость?
- Между частицами металла существуют делокализованные электроны.
- Частицы металла удерживаются вместе прочными металлическими связями.
- Частицы в металле имеют правильное расположение.
- Слои частиц в металле могут скользить друг по другу.
- Частицы являются частью гигантской решетки.
Ответ
Металлические элементы состоят из положительно заряженных ионов металла и отрицательно заряженных делокализованных электронов. Там
являются сильными электростатическими взаимодействиями между этими противоположно заряженными частицами, и для этого требуется много теплового
или механическая энергия, чтобы разорвать их.Мы можем использовать эти утверждения, чтобы определить, что вариант B является правильным.
ответ на этот вопрос.
Там
являются сильными электростатическими взаимодействиями между этими противоположно заряженными частицами, и для этого требуется много теплового
или механическая энергия, чтобы разорвать их.Мы можем использовать эти утверждения, чтобы определить, что вариант B является правильным.
ответ на этот вопрос.
Тепловая энергия передается через твердое вещество, когда одна частица сталкивается с другой частицей, и электрическая энергия
передается через твердое вещество, когда носители заряда перемещаются и проводят электрический ток. Металлы имеют высокие
электрическая и теплопроводность, потому что они содержат делокализованные электроны. Делокализованные электроны могут проводить
электрического тока, потому что они очень подвижны и могут легко перемещаться от отрицательного вывода электрической цепи к
его положительный вывод.Делокализованные электроны могут проводить тепловую энергию, потому что они могут легко перемещаться через металлический
решетки и сталкиваются с катионами других металлов и электронами. Для изготовления посуды и радиаторов используется много металлов, потому что
у них такая высокая теплопроводность. Некоторые металлы также используются для изготовления электрического оборудования, потому что они могут проводить
большой электрический ток. Медь использовалась для изготовления электропроводки по всему миру более века, потому что она
особенно хорошо проводит электричество и стоит не слишком дорого.
Для изготовления посуды и радиаторов используется много металлов, потому что
у них такая высокая теплопроводность. Некоторые металлы также используются для изготовления электрического оборудования, потому что они могут проводить
большой электрический ток. Медь использовалась для изготовления электропроводки по всему миру более века, потому что она
особенно хорошо проводит электричество и стоит не слишком дорого.
Пример 2: Свойства металлов
Что из следующего не является общим свойством металлов?
- Высокая электропроводность
- Высокая температура плавления
- Высокая теплопроводность
- Яркий цвет
- Высокая механическая прочность
Ответ
Металлы состоят из решетки положительно заряженных ионов, которые удерживаются вместе за счет сильного электростатического взаимодействия
с отрицательно заряженными делокализованными электронами.Металлы обычно обладают высокой механической прочностью и высокими температурами плавления, потому что
требуется много тепловой или механической энергии, чтобы разорвать прочные металлические связи, связывающие положительно заряженные ионы металлов
и отрицательно заряженные делокализованные электроны вместе. Металлы, как правило, обладают высокими значениями электрической и теплопроводности.
потому что они содержат очень подвижные делокализованные электроны. Делокализованные электроны могут быстро передавать тепловые и электрические
энергия от одной стороны металлической решетки к другой стороне.Металлы в естественном состоянии обычно не имеют яркого цвета,
но их можно красить химическими пигментами. Мы можем использовать эти утверждения, чтобы определить, что вариант D является правильным ответом.
по этому вопросу.
Металлы, как правило, обладают высокими значениями электрической и теплопроводности.
потому что они содержат очень подвижные делокализованные электроны. Делокализованные электроны могут быстро передавать тепловые и электрические
энергия от одной стороны металлической решетки к другой стороне.Металлы в естественном состоянии обычно не имеют яркого цвета,
но их можно красить химическими пигментами. Мы можем использовать эти утверждения, чтобы определить, что вариант D является правильным ответом.
по этому вопросу.
Металлы считаются пластичными, поскольку их можно изменять без разрушения. Они описываются как пластичные, потому что
их можно протянуть в длинные провода без трещин. Металлы обычно не ломаются и не трескаются при сильном ударе.
механическая сила, потому что они содержат высокоэластичное море делокализованных электронов.Положения отдельных ионов металлов
может измениться, когда металл бьют и отливают в форму, но море делокализованных электронов существенно не разрушается или не разрушается. Металлы, как правило, очень звучные, и они издают отчетливо слышимый звук, когда по ним бьют чем-то вроде молотка или
молоток. Их море делокализованных электронов очень гибкое, и оно может распространять поступающую кинетическую энергию как движущийся наружу.
звуковая волна.
Металлы, как правило, очень звучные, и они издают отчетливо слышимый звук, когда по ним бьют чем-то вроде молотка или
молоток. Их море делокализованных электронов очень гибкое, и оно может распространять поступающую кинетическую энергию как движущийся наружу.
звуковая волна.
Определение: Звонкий
Звонкий материал способен издавать звук при сильном ударе.
Пример 3: Понимание того, как определить способность металлических веществ вытягиваться в длинные и тонкие провода
Какое свойство металла позволяет протягивать его в длинные тонкие провода?
- Пластичность
- Прочность
- Электропроводность
- Ковкость
- Точка плавления
Ответ
Материалы можно охарактеризовать как пластичные, если их можно растянуть в длинную проволоку без трещин. Они также могут быть
описываются как пластичные, если они могут деформироваться без потери прочности.Два определения разные
варианты того, что по сути одно и то же. Материалы могут быть вытянуты в длинные провода без трещин, если они могут быть
деформируется без потери прочности. Металлы можно описать одним из этих очень похожих определений. Они могут
могут быть вытянуты в длинные и тонкие проволоки, потому что они не теряют прочности при деформации. Мы можем использовать эти
утверждения, чтобы определить, что вариант А является правильным ответом на этот вопрос.
Материалы могут быть вытянуты в длинные провода без трещин, если они могут быть
деформируется без потери прочности. Металлы можно описать одним из этих очень похожих определений. Они могут
могут быть вытянуты в длинные и тонкие проволоки, потому что они не теряют прочности при деформации. Мы можем использовать эти
утверждения, чтобы определить, что вариант А является правильным ответом на этот вопрос.
Чистые металлические элементы обычно описываются как блестящие (блестящие). Блестящий вид металла можно объяснить следующим образом:
с точки зрения его делокализованных электронов. Говорят, что делокализованные электроны на поверхности металла непрерывно
поглощающие и отражающие фотоны световой энергии. Море электронов непрерывно отражает фотоны света, и это
делает поверхность металла блестящей. Сильно блестящие металлы, такие как золото и серебро, подходят для изготовления декоративных изделий.
украшения, потому что они блестящие, и они также имеют тенденцию быть податливыми. Золото и серебро можно превратить в безделушки и
скульптуры эстетичной формы и блестящей поверхности.
Золото и серебро можно превратить в безделушки и
скульптуры эстетичной формы и блестящей поверхности.
Определение: Блестящий
Блестящие материалы способны равномерно и эффективно отражать свет без блеска и искр.
Известно, что неметаллические элементы имеют относительно большое количество валентных электронов и относительно небольшой атомный радиус. Они обычно имеют валентную оболочку, которая заполнена более чем наполовину, а атомный радиус меньше, чем у металлов того же периода.Неметаллы обычно имеют высокое сродство к электрону и значение энергии ионизации, потому что они имеют такой малый атомный радиус.
Неметаллические элементы обычно образуют простые ковалентно связанные соединения. Эти структуры содержат всего несколько атомов, и они
не создают сильных межмолекулярных сил притяжения. Существуют относительно слабые межмолекулярные взаимодействия между
соседние ковалентно связанные молекулы, и для их разрушения не требуется слишком много энергии. Это объясняет, почему неметалл
элементы почти всегда являются хрупкими, если они образуют твердые тела при комнатной температуре, но это не всегда гарантируется.Немного
неметаллические элементы могут образовывать газ только при комнатной температуре. Твердые и газообразные неметаллические элементы обычно имеют низкую плотность.
потому что существуют слабые межмолекулярные взаимодействия между соседними молекулами неметалла.
Это объясняет, почему неметалл
элементы почти всегда являются хрупкими, если они образуют твердые тела при комнатной температуре, но это не всегда гарантируется.Немного
неметаллические элементы могут образовывать газ только при комнатной температуре. Твердые и газообразные неметаллические элементы обычно имеют низкую плотность.
потому что существуют слабые межмолекулярные взаимодействия между соседними молекулами неметалла.
Неметаллические элементы не склонны проводить электричество, потому что они обычно не содержат частиц, несущих заряд. Однако есть, по крайней мере, пара неметаллических углеродных аллотропов, которые обладают удивительно высокой электропроводностью.
ценности.Графит и наночастицы C60 представляют собой аллотропы углерода, которые могут проводить большие
электрический ток. Эти материалы содержат делокализованные электроны, которые могут двигаться от отрицательной клеммы электрического
цепь к положительной клемме. Графит и наночастицы C60 — одни из единственных
неметаллические элементы, способные проводить большой электрический ток.
Определение: Аллотроп
Различные структурные формы одного и того же элемента в одном физическом состоянии.
Обычные неметаллические материалы обладают низкой теплопроводностью, поскольку не содержат делокализованных электронов.Они составлены атомов, которые не могут быстро обмениваться тепловой энергией друг с другом. Тепловая энергия очень неэффективно передается через неметаллический материал. Он может быть передан только в том случае, если горячие атомы неметалла вибрируют и сталкиваются с холодными атомами неметалла.
Пример 4: Свойства неметаллов
Что из следующего не является общим свойством неметаллов?
- Хрупкость
- Плохая электропроводность
- Плохая теплопроводность
- Низкая плотность
- Блеск
Ответ
Между простыми ковалентно связанными молекулами, содержащимися в неметаллических элементах, существуют только слабые межмолекулярные взаимодействия
как фосфор и кислород. Вещества имеют относительно низкую плотность и относительно хрупкие, поскольку
никаких сильных сил, которые удерживают молекулы вместе. Между неметаллическими элементами имеется большое среднее расстояние разделения.
молекулы, и для их разрушения не требуется слишком много механической силы. Неметаллические элементы обычно имеют низкую электрическую
и значения теплопроводности, потому что они не имеют частиц носителей заряда, которые могут перемещаться между молекулами и
молекулы сталкиваются не очень часто, поэтому они не могут очень эффективно передавать тепловую энергию.Металлы имеют тенденцию быть блестящими и
блестящие, но неметаллы имеют тенденцию быть прозрачными, когда они являются газами, и тусклыми, когда они образуют хрупкие твердые тела. Мы можем использовать эти
утверждения, чтобы определить, что вариант E является правильным ответом на этот вопрос.
Вещества имеют относительно низкую плотность и относительно хрупкие, поскольку
никаких сильных сил, которые удерживают молекулы вместе. Между неметаллическими элементами имеется большое среднее расстояние разделения.
молекулы, и для их разрушения не требуется слишком много механической силы. Неметаллические элементы обычно имеют низкую электрическую
и значения теплопроводности, потому что они не имеют частиц носителей заряда, которые могут перемещаться между молекулами и
молекулы сталкиваются не очень часто, поэтому они не могут очень эффективно передавать тепловую энергию.Металлы имеют тенденцию быть блестящими и
блестящие, но неметаллы имеют тенденцию быть прозрачными, когда они являются газами, и тусклыми, когда они образуют хрупкие твердые тела. Мы можем использовать эти
утверждения, чтобы определить, что вариант E является правильным ответом на этот вопрос.
Графит считается очень полезным неметаллическим материалом, поскольку его можно использовать для изготовления стержней карандашей. Идеально подходит
для изготовления стержней карандашей, потому что он нелегкий и хрупкий. Он разобьется и оставит черный остаток, если попадет в
контакт с более твердыми веществами, такими как бумага.Графит известен своей низкой плотностью и индуктивностью. Другой неметалл
элементы имеют много важных промышленных применений, включая использование хлора для очистки воды и использование
йод как универсальное дезинфицирующее средство. Существует также использование древесного угля для обесцвечивания сахара или использование фосфора для приготовления
спички и удобрения.
Идеально подходит
для изготовления стержней карандашей, потому что он нелегкий и хрупкий. Он разобьется и оставит черный остаток, если попадет в
контакт с более твердыми веществами, такими как бумага.Графит известен своей низкой плотностью и индуктивностью. Другой неметалл
элементы имеют много важных промышленных применений, включая использование хлора для очистки воды и использование
йод как универсальное дезинфицирующее средство. Существует также использование древесного угля для обесцвечивания сахара или использование фосфора для приготовления
спички и удобрения.
Металлоидные элементы расположены между металлическими и неметаллическими элементами в периодической таблице. Это уместно, потому что
металлоидные элементы обладают некоторыми свойствами металлов и некоторыми свойствами неметаллов.Они имеют металлический вид и
значение электроотрицательности, которое находится между высокой электроотрицательностью неметаллов и низкой электроотрицательностью металлов. Они также имеют тенденцию иметь теплопроводность, которая находится между высокой теплопроводностью металлических элементов и низкой теплопроводностью.
теплопроводность неметаллических элементов. На следующем рисунке представлена упрощенная таблица Менделеева. Это показывает
металлоидные элементы наряду с соседними металлическими и неметаллическими элементами.На рисунке показано, что в настоящее время известно шесть металлоидов.
элементы.
Они также имеют тенденцию иметь теплопроводность, которая находится между высокой теплопроводностью металлических элементов и низкой теплопроводностью.
теплопроводность неметаллических элементов. На следующем рисунке представлена упрощенная таблица Менделеева. Это показывает
металлоидные элементы наряду с соседними металлическими и неметаллическими элементами.На рисунке показано, что в настоящее время известно шесть металлоидов.
элементы.
Хорошими примерами металлоидов являются такие элементы, как бор и кремний, которые образуют довольно блестящие и чешуйчатые вещества, которые выглядят несколько
как элементы из переходного металла, только кажутся более мягкими и почти податливыми. Кремний и бор обладают схожими свойствами.
к некоторым элементам переходных металлов, потому что они твердые при комнатной температуре, и оба имеют очень высокие температуры плавления и
точки кипения.У них также есть некоторые свойства, аналогичные свойствам неметаллических элементов. Они хрупкие, и это не
требуется слишком много энергии, чтобы разбить их на мелкие кусочки.
Они хрупкие, и это не
требуется слишком много энергии, чтобы разбить их на мелкие кусочки.
Металлоиды имеют более высокую электропроводность, чем неметаллы, и более низкую электропроводность, чем чистые металлические элементы. Их обычно называют собственными полупроводниками, потому что они могут проводить большой электрический ток при высоких температурах и менее значительный электрический ток при низких температурах.Большинство металлоидных элементов можно использовать для изготовления транзисторов, потому что они полупроводниковые материалы.
Определение: Металлоид
Металлоидные элементы обладают некоторыми физическими и химическими свойствами металлов и некоторыми физическими и химическими свойствами неметаллов.
Металлоиды настолько широко используются в современных электронных устройствах, что некоторые технологические центры получили названия.
как Кремниевая долина. Некоторые люди даже начали называть период конца 20-го — начала 21-го века кремниевым
возраст, потому что кремний был описан как доминирующий материал современной цивилизации. Кремний используется все больше и больше
в конце 20-го века, и теперь он используется для изготовления электронных схем почти для всех современных компьютеров. Германий
также может использоваться для изготовления микрочипов, но, как правило, используется гораздо реже, чем кремний. Сурьма имеет несколько
технологических приложений, и это один из предпочтительных материалов для изготовления компонентов батареи.
Кремний используется все больше и больше
в конце 20-го века, и теперь он используется для изготовления электронных схем почти для всех современных компьютеров. Германий
также может использоваться для изготовления микрочипов, но, как правило, используется гораздо реже, чем кремний. Сурьма имеет несколько
технологических приложений, и это один из предпочтительных материалов для изготовления компонентов батареи.
Металлоидные элементы имеют несколько важных нетехнологических применений. Многие металлоидные соединения используются для катализа
химические реакции.Трифторид бора — это относительно небольшая молекула, которая имеет BF3
химическая формула. Он используется для катализирования реакций полимеризации ненасыщенных простых полиэфиров. Он также используется в качестве катализатора
некоторые реакции изомеризации и ацилирования. Близкородственный трихлорид бора (BCl3)
соединение аналогично используется для катализатора различных типов реакций органического синтеза, поскольку оно расщепляет углерод-кислород
связи (C – O) в молекулах эфира. Некоторые металлоидные вещества также используются для производства полимеров и
керамические вещества.
Некоторые металлоидные вещества также используются для производства полимеров и
керамические вещества.
Металлоидные элементы можно смешивать с металлами для получения сплавов с желаемыми физическими или химическими свойствами. Теллур — это регулярно легируют сталью, чтобы улучшить ее обрабатываемость, а мышьяк смешивают с платиной или медью, чтобы сделать ее более удобной. устойчивы к разным формам коррозии.
Пример 5: Понимание того, как физические свойства металлических элементов сравниваются с физическими свойствами неметалла Элементы
Что из следующего является правильным при сравнении цезия и кремния при комнатной температуре?
- Цезий хрупкий, а кремний твердый.
- Цезий ковкий, а кремний твердый.
- Цезий тусклый, а кремний хрупкий.
- Цезий — полупроводник тепла, а кремний — хороший проводник тепла.
- Цезий пластичен, а кремний — индуктивен.
Ответ
Цезий — блестящий элемент группы 1. Известно, что он пластичный и податливый. Также известно, что он очень реактивен.
и быть эффективным проводником тепла и электричества. Обычно говорят, что цезий мягкий, потому что он
щелочной металл с высоким атомным номером.Щелочные металлы имеют тенденцию быть мягкими и даже пластичными, если они имеют относительно
высокий атомный номер. Металлы цезия обычно имеют бледно-золотой цвет.
Известно, что он пластичный и податливый. Также известно, что он очень реактивен.
и быть эффективным проводником тепла и электричества. Обычно говорят, что цезий мягкий, потому что он
щелочной металл с высоким атомным номером.Щелочные металлы имеют тенденцию быть мягкими и даже пластичными, если они имеют относительно
высокий атомный номер. Металлы цезия обычно имеют бледно-золотой цвет.
Кремний — элемент 14 группы. Известно, что он имеет серебристый цвет, хрупкий и индуцирующий свойства. Кремний имеет электрическую свойства проводимости, которые отчасти похожи на металлы и отчасти на неметаллы. Его свойства позволяют ему быть Собственный полупроводник, электрическая проводимость которого высока при высоких температурах и намного ниже при низких температурах.Кремний обычно считается хорошим проводником тепла.
Предыдущие абзацы можно использовать, чтобы определить правильный ответ на этот вопрос. Вариант А не может быть
правильный ответ, потому что в нем говорится, что цезий хрупкий. Фактически это неверно. Кремний имеет тенденцию быть хрупким и
цезий имеет тенденцию быть пластичным. Вариант Б не может быть правильным ответом, потому что он утверждает, что кремний твердый. Это
Фактически неверно. Кремний описывается как хрупкий, а цезий — как пластичный.Вариант C не может
быть правильным ответом, потому что он утверждает, что цезий тупой. Фактически это неверно. Цезий имеет тенденцию быть блестящим. Обычно он способен равномерно и эффективно отражать свет без блеска и искр. Вариант D не может быть правильным
ответ на этот вопрос, потому что он утверждает, что цезий является полупроводником. Кремний — полупроводник, а цезий —
хороший проводник электричества.
Фактически это неверно. Кремний имеет тенденцию быть хрупким и
цезий имеет тенденцию быть пластичным. Вариант Б не может быть правильным ответом, потому что он утверждает, что кремний твердый. Это
Фактически неверно. Кремний описывается как хрупкий, а цезий — как пластичный.Вариант C не может
быть правильным ответом, потому что он утверждает, что цезий тупой. Фактически это неверно. Цезий имеет тенденцию быть блестящим. Обычно он способен равномерно и эффективно отражать свет без блеска и искр. Вариант D не может быть правильным
ответ на этот вопрос, потому что он утверждает, что цезий является полупроводником. Кремний — полупроводник, а цезий —
хороший проводник электричества.
Эти утверждения могут использоваться для определения того, что последний из перечисленных вариантов должен быть правильным ответом на этот вопрос,
но это тоже можно доказать.Последний из перечисленных вариантов указывает на то, что цезий пластичен, а кремний — индуктивен. Этот
Фактически верно. Цезий — это элемент группы 1, и он податлив. Кремний — это элемент группы 14, и это не так.
пластичный. Это хрупкий и индуцируемый. Можно сделать вывод, что вариант E — правильный ответ на этот вопрос.
Этот
Фактически верно. Цезий — это элемент группы 1, и он податлив. Кремний — это элемент группы 14, и это не так.
пластичный. Это хрупкий и индуцируемый. Можно сделать вывод, что вариант E — правильный ответ на этот вопрос.
Металлический и неметаллический характер любого химического элемента можно определить с помощью энергии ионизации и сродства к электрону. параметры. Ученые могут использовать эти или другие тесно связанные параметры, чтобы показать, что элементы становятся менее металлическими. через любую строку периодической таблицы.Крайние левые элементы имеют тенденцию быть значительно более металлическими, чем элементы, их право. Элементы группы 1 должны иметь наивысший металлический характер, а элементы группы 17 — иметь самый низкий металлический характер.
Параметры энергии ионизации и сродства к электрону могут быть аналогичным образом использованы, чтобы показать, что элементы имеют тенденцию иметь высокий металлический
характер, если они близки к нижней части таблицы Менделеева, и низкий металлический характер, если они близки к вершине таблицы Менделеева.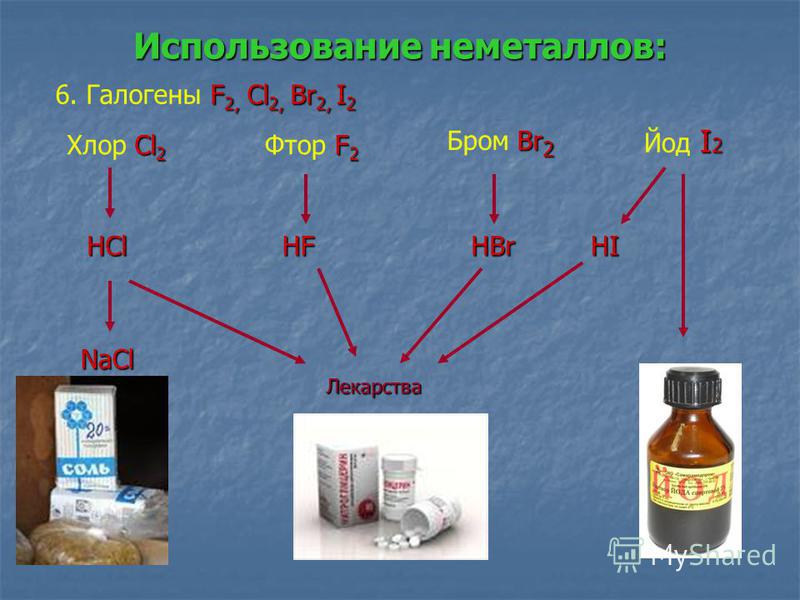 таблица Менделеева.Это утверждение можно переформулировать, чтобы указать, что металлический характер имеет тенденцию усиливаться в любой группе.
таблицы Менделеева. Элементы в нижней части группы, как правило, имеют больший атомный радиус и меньшую ионизацию.
энергии. Металлический характер усиливается в группе, даже если она начинается с металлического элемента. Увеличивается по группе
щелочных металлов, а также увеличивается вниз по группе щелочноземельных металлов. Неметаллический характер уменьшается по группе
даже если он начинается с неметалла.Можно считать, что у йода более низкие неметаллические свойства, чем у фтора, потому что он
имеет меньшее сродство к электрону и первую энергию ионизации.
таблица Менделеева.Это утверждение можно переформулировать, чтобы указать, что металлический характер имеет тенденцию усиливаться в любой группе.
таблицы Менделеева. Элементы в нижней части группы, как правило, имеют больший атомный радиус и меньшую ионизацию.
энергии. Металлический характер усиливается в группе, даже если она начинается с металлического элемента. Увеличивается по группе
щелочных металлов, а также увеличивается вниз по группе щелочноземельных металлов. Неметаллический характер уменьшается по группе
даже если он начинается с неметалла.Можно считать, что у йода более низкие неметаллические свойства, чем у фтора, потому что он
имеет меньшее сродство к электрону и первую энергию ионизации.
Цезий обычно считается элементом с наивысшим металлическим характером, потому что это элемент группы 1, который
находится внизу периодической таблицы. Фтор обычно считается элементом с самым высоким
неметаллический символ, потому что это элемент группы 17, расположенный в верхней части периодической таблицы.
В следующей таблице сравниваются металлоиды с металлическими и неметаллическими элементами. Он резюмирует несколько моментов, которые было сделано на протяжении всего этого объяснителя, и оно сокращает большой объем текста до относительно небольшого количества важных маркеров. точки. Таблицу можно использовать, чтобы доказать основную идею этого объяснителя. Его можно использовать, чтобы доказать, что есть некоторые элементы, которые нельзя отнести к металлам или неметаллам. Некоторые элементы следует отнести к металлоидам, потому что они имеют свойства как металлических, так и неметаллических веществ.
| Металл | Металлоиды | Неметаллы | |||||
|---|---|---|---|---|---|---|---|
| Число валентных электронов | Валентная оболочка обычно на заполнена менее чем наполовину. | Валентная оболочка либо , либо заполнена примерно наполовину. | Валентная оболочка обычно на заполнена более чем наполовину. | ||||
| Атомный радиус | Большой атомный радиус | Промежуточный атомный радиус | Малый атомный радиус | ||||
| Энергия ионизации | Низкая энергия ионизации | Промежуточная энергия ионизации | Высокая энергия ионизации | ||||
| 910 Электронное родство Низкое сродство к электрону | Промежуточное сродство к электрону | Высокое сродство к электрону | |||||
| Электроотрицательность | Низкая электроотрицательность | Промежуточная электроотрицательность | Высокая электроотрицательность | ||||
| Внешний вид | Металлический блеск | ЭлектропроводностьХороший проводник | Полупроводник | Изолятор | |||
| Теплопроводность | Высокая теплопроводность | Промежуточная терма l проводимость | Низкая теплопроводность | ||||
| Механические свойства | Жесткий Ковкий | Жесткий или мягкий Хрупкий | Жесткий или мягкий Хрупкий | ||||
| Склонность к потере или усилению электронов | Электроположительный | Электроположительный | Электроотрицательный |
Ключевые моменты
- Левая часть таблицы Менделеева содержит металлические элементы, а правая часть — неметаллические элементы.

- Металлоидные элементы можно найти в периодической таблице между металлическими и неметаллическими элементами.
- Металлическое соединение — это сильное электростатическое притяжение, которое существует между положительно заряженными катионами металлов и делокализованные электроны.
- Неметаллические элементы обычно образуют ковалентно связанные соединения, которые имеют всего несколько атомов в каждой молекуле, но они иногда образуют гигантские трехмерные структуры, содержащие несколько миллиардов ковалентно связанных атомов.
- Металлические и неметаллические элементы, как правило, имеют очень разные химические и физические свойства, поскольку они различные модели межмолекулярных связей.
- Металлоидные элементы обладают некоторыми физическими и химическими свойствами металлов, а также некоторыми физическими и химическими свойствами. неметаллов.
- Металлический характер имеет тенденцию к уменьшению в течение периода и при движении вверх по любой одной группе периодической таблицы.
 Святослав
Святослав Рабочий май
Рабочий май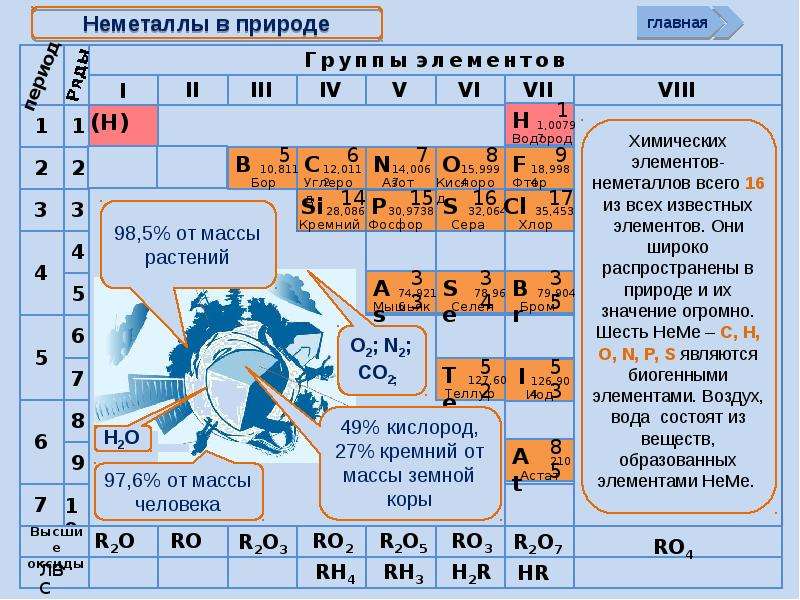
 2.1.7 – прогнозировать свойства химического элемента в зависимости от положения в периодической таблице.
2.1.7 – прогнозировать свойства химического элемента в зависимости от положения в периодической таблице.



 Выбери свойства, которые характерны для металлов.
Выбери свойства, которые характерны для металлов.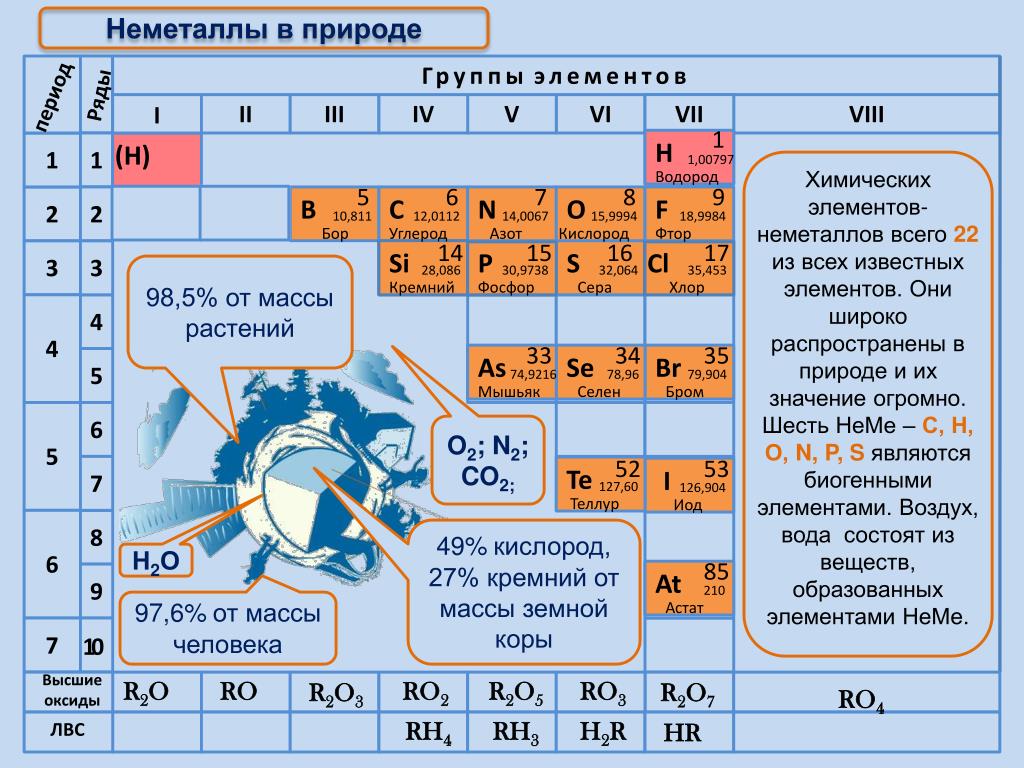
 kz/upload/content/platform_lessons/L_12718/22.pdf?v1533632432298
kz/upload/content/platform_lessons/L_12718/22.pdf?v1533632432298 Проведи штрихи или закрась серым цветом ту область, где они должны быть расположены.
Проведи штрихи или закрась серым цветом ту область, где они должны быть расположены.

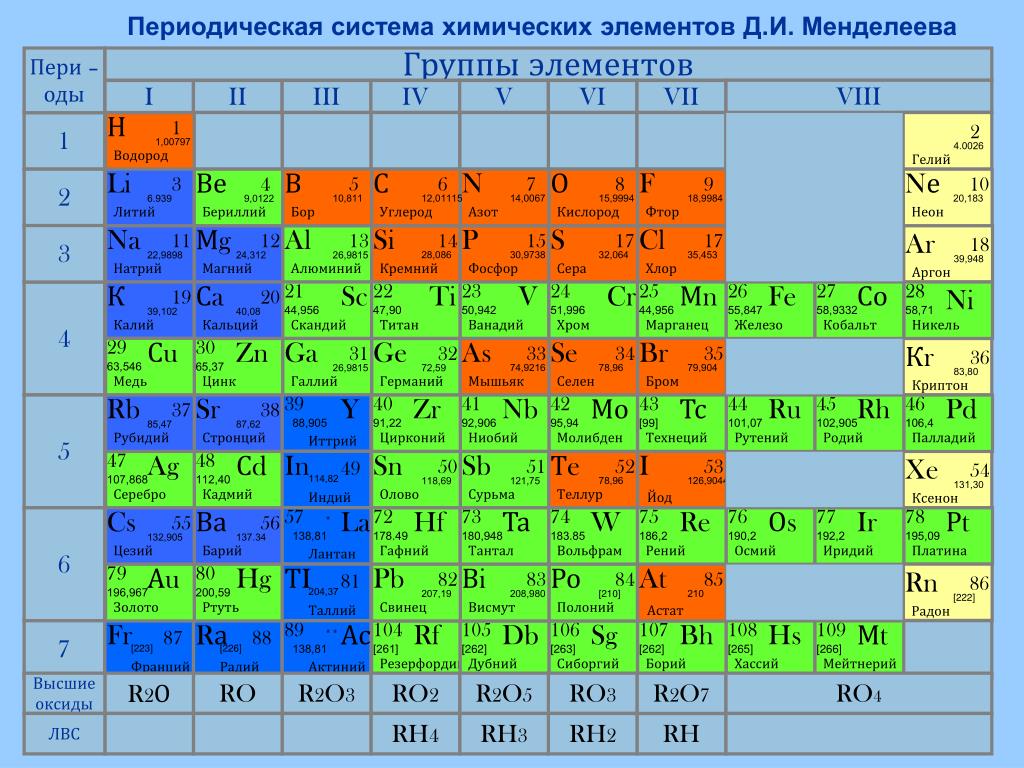 С.
С.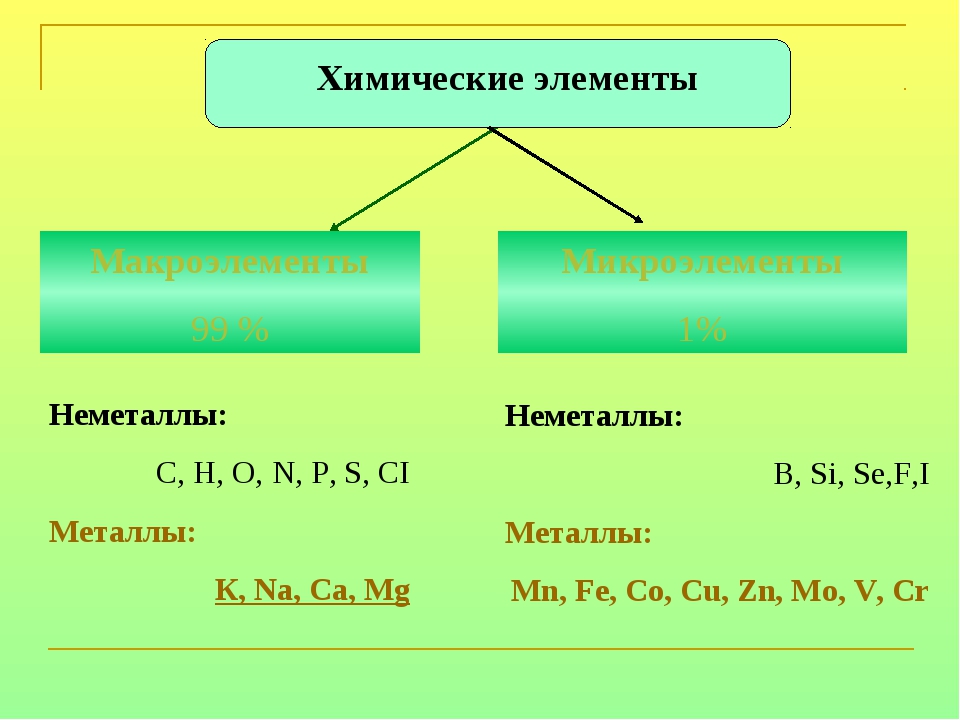 Какие физические свойства металлов вам известны?
Какие физические свойства металлов вам известны? К какому типу относятся данные реакции?
К какому типу относятся данные реакции?
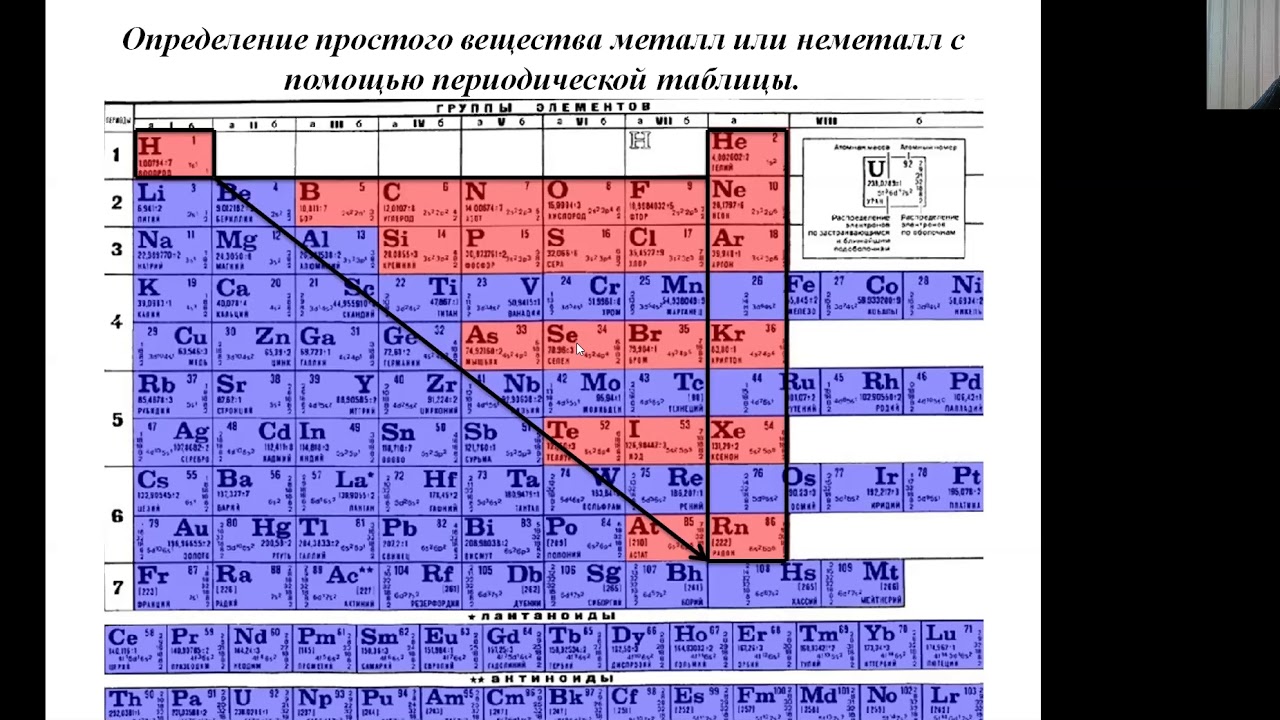






 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле.


 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления. Они имеют электроотрицательный характер.
Они имеют электроотрицательный характер.
 электричества
электричества Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.
Это потому, что оксид таллия реагирует с кислотами, поэтому должен быть основанием.Только металлы образуют оксиды, являющиеся основаниями.