Как определить валентность химических элементов — Разные правила и памятки — Памятки ученикам
Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, NH4Cl, H2S, H3PO4 и т.д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества.
Валентность – это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так:валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода.
Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т.д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным.
Постоянная валентность:
I – H, Na, Li, K, Rb, Cs
II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III – B, Al, Ga, In
Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2.Например, не составит труда найти валентность элементов в следующих соединениях: Na 2O (валентность Na – 1, O – 2), Al2O3 (валентность Al – 3, O – 2).
Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn
Как же мы получили формулу?
Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого. Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Будем составлять в соответствии с алгоритмом:
1. Записываем рядом символы химических элементов:
Mn O
2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2.
3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14 : 7 = 2, 14 : 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы.
Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого.
Mn2O7 (7 · 2 = 2 · 7).
2х = 14,
х = 7.
Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
Валентность и степень окисления, подготовка к ЕГЭ по химии
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю
вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.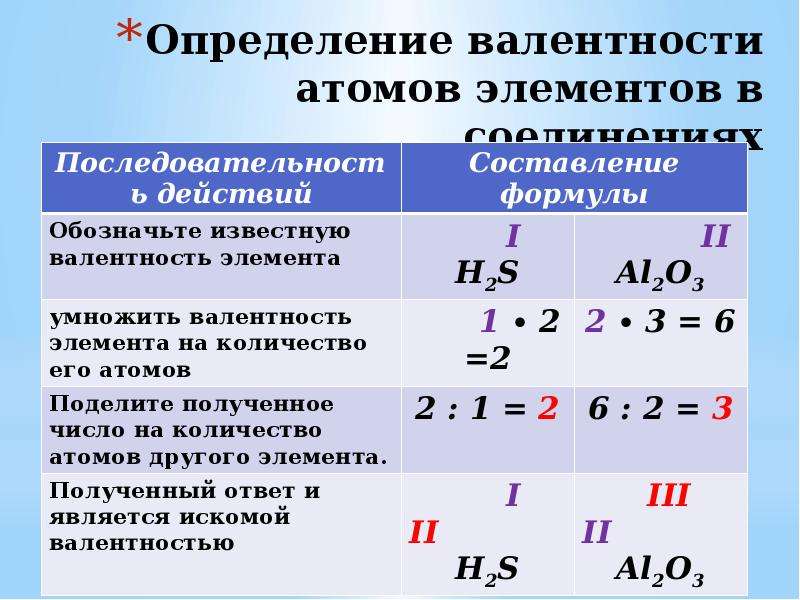
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы — с постоянной валентностью.
Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям,
написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.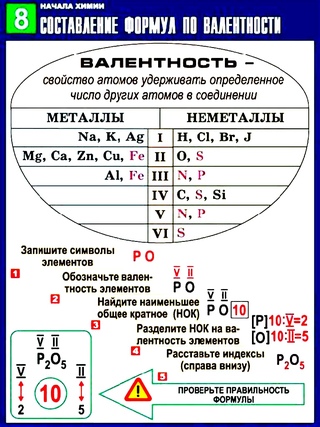
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью — способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток - получает знак «+».
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к
Как определить валентность в органической химии. Что такое валентность
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений : максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N 2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Например, валентность азота в N 2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента .
Пример 1 . Найти валентности всех элементов в соединении NH 3 .
Решение . Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2 . Найти валентности всех элементов в молекуле Cl 2 O 5 .
Решение . У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 2 = 2 Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пусть валентность хлора = Х. Составляем уравнение: 5 2 = 2 Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3 . Найти валентность хлора в молекуле SCl 2 , если известно, что валентность серы равна II.
Решение . Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4 . Составьте формулу соединения кальция с водородом.
Решение . Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — Ca x H y . Вновь составляем известное уравнение: 2 x = 1 у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH 2 .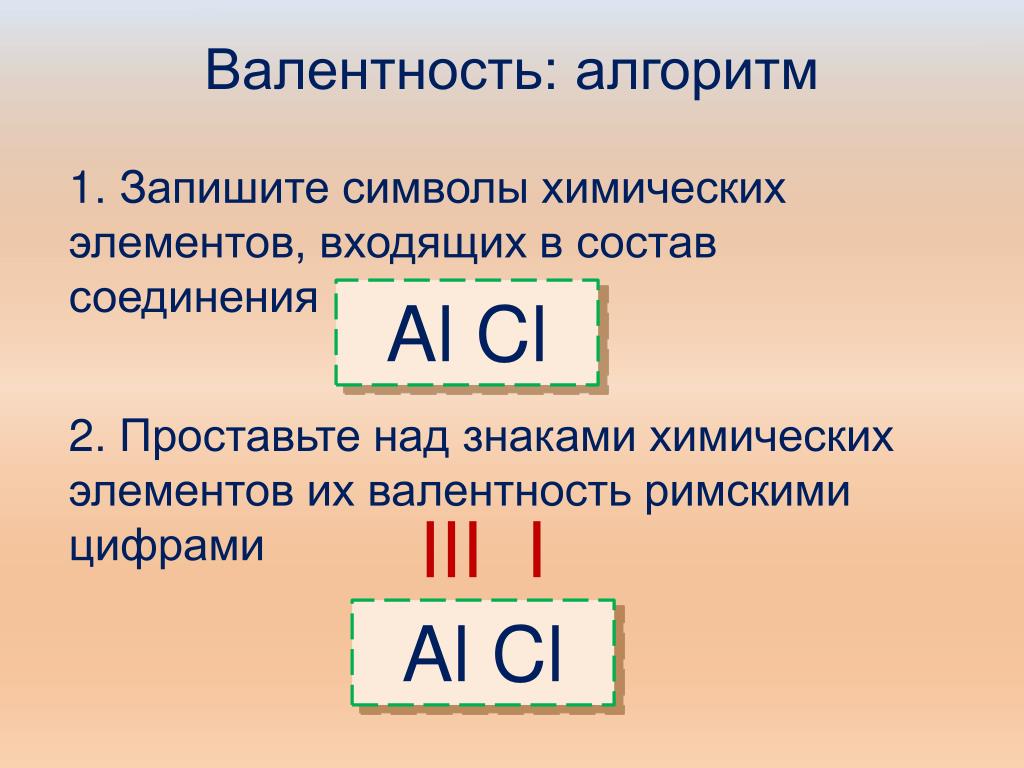
«А почему именно CaH 2 ? — спросите вы. — Ведь варианты Ca 2 H 4 и Ca 4 H 8 и даже Ca 10 H 20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N 2 O 4 или C 6 H 6 невозможны? — спросите вы. — Следует заменить эти формулы на NO 2 и CH?»
Нет, возможны. Более того, N 2 O 4 и NO 2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С 6 Н 6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5 . Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение . Пусть формула соединения — S x F y . Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 x = 1 y.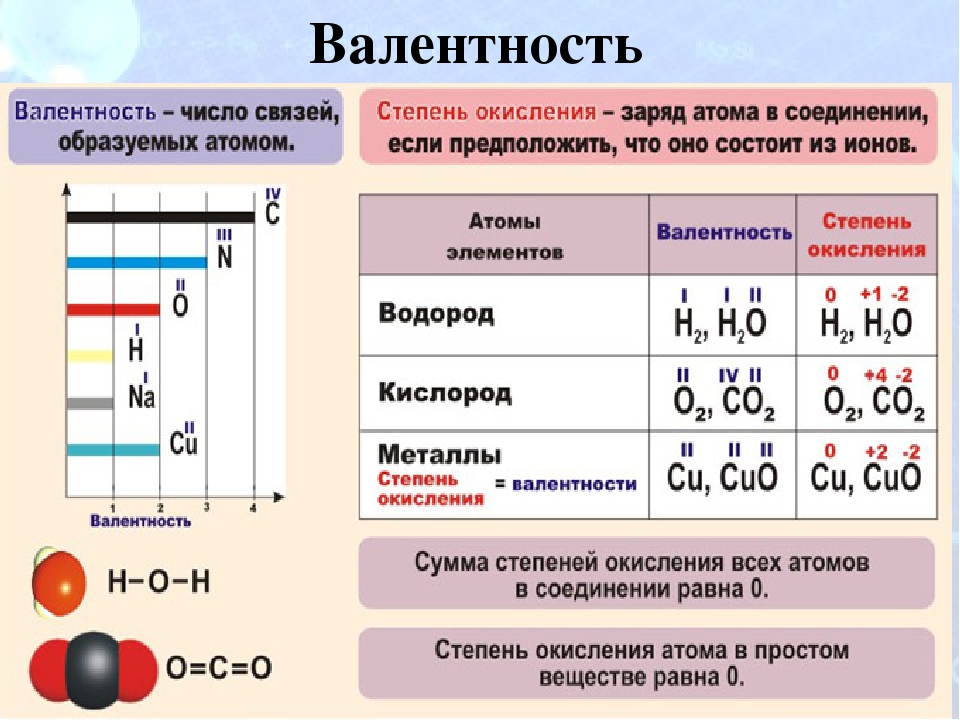 Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF 6 .
Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF 6 .
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность» .
ОПРЕДЕЛЕНИЕ
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H 2 O, NH 3 , CH 4 валентность по водороду хлора равна единице, кислорода — двум, азота — трем, углерода — четырем.
Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H 2 O, NH 3 , CH 4 валентность по водороду хлора равна единице, кислорода — двум, азота — трем, углерода — четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN 2 O, CO, SiO 2 , SO 3 валентность по кислороду азота равна единице, углерода — двум, кремния — четырем, серы — шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H 2 S), а по кислороду — шести (SO 3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая — I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д. И. Менделеева, где они расположены).
И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Примеры решения задач
ПРИМЕР 1
| Задание | Валентность III характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | а) Кальций — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор — неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д. |
| Ответ | Вариант (б) |
ПРИМЕР 2
| Задание | Валентность III характерна для: а)Be; б) F; в) Al; г)C? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности. а) Бериллий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность бериллия равна II. Ответ неверный. б) Фтор — неметалл. Характеризуется единственно возможным значением валентности равным I. Ответ неверный. в) Алюминий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т. |
| Ответ | Вариант (в) |
Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качествен-ный и количественный состав соединений, формулы кото-рых HCl, H 2 O, NH 3 , CH 4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наиболь-шее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность» (от лат. valentia — «сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
valentia — «сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Валентность — общее свойство атомов. Она характе-ризует способность атомов химически (валентными си-лами) взаимодействовать друг с другом.
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ. За единицу валентности бы-ла принята валентностьатома водорода. Если атом хими-ческого элемента соединен с двумя одновалентными атома-ми, то его валентность равна двум. Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наи-высшее значение валентности химических элементов — VIII .
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
Также ученые обнаружили, что немало элементов в раз-ных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
Можно ли определить валентность по положению хими-ческого элемента в периодической системе? Максимальное значение валентности элемента совпадает с номером группы периодической системы, в которой он размещен. Тем не менее бывают и исключения — азот, кислород, фтор, медь и некото-рые другие элементы. Запомни : номер группы обозначен римской цифрой над соответствующим вертикальным столби-ком периодической системы.
Элемент | Валентность | Элемент | Валентность |
Водород (Н) | Кальций (Са) | ||
Натрий (Na) | Барий (Ва) | ||
Кислород(O) | |||
Бериллий(Be) | Алюминий (Al) | ||
Магний (Mg) |
Элемент | Валентность | Элемент | Валентность |
Железо (Fe) | |||
Марганец (Mg) | |||
II, III, VI Материал с сайта | |||
Серебро (Ag) | Фосфор (P) | ||
Золото (Au) | Мышьяк (As) | ||
Углерод (C) | |||
Свинец (Pb) | Кремний (Si) |
На этой странице материал по темам:
Валентность — это способность химических элементов удерживать определенное количество атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Инструкция
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Примите к сведению, что валентность атомов одних элементов постоянна, а других — переменна, то есть, имеет свойство меняться. Например, водород во всех соединениях одновалентен, поскольку образует только одну связь. Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — это валентность атомов элементов, а К — количество атомов в молекуле. С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – h3SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Валентность — это способность атома присоединять другие атомные группы и отдельные атомы. Это важное понятие позволяет определить, сколько атомов того или иного вещества входит в формулу, и изобразить молекулу вещества графически. Вам понадобится таблица валентностей Спонсор размещения P&G Статьи
«Знание шрифтов – одно из самых элементарных требований, предъявляемых к сыщику!», — так наставлял когда-то великий Шерлок Холмс своего друга и летописца доктора Ватсона. Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность химического элемента — это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Нужно помнить, что некоторые атомы одного и того же химического элемента могут иметь разную валентность в разных соединениях. Вам
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
Способность эта атомов химического элемента образовывать связи с другими атомами
Упражнения по теме «Валентность»
Тихонова Ирина Ивановна,
учитель биологии и химии МБОУ ООШ Оренбургского сельского поселения Бикинского района Хабаровского края
Упражнения по теме «Валентность»
1. Определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). Задание в раздаточном материале.
Sih5, CrO3, h3S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, Sih5, Mn2O7, MnO, CuO, N2O3.
2. Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III I III II III I III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl, Ca Cl, Mg N, Al S, Fe Cl, Si Cl, Ca P,
I IV IV IV
Si O, Al Cl, N O, Al O, Si H, Mg Si.
3. Запишите химические формулы следующих соединений:
1) аш-два-эс-о-три
2) пэ-два-о-пять
3) магний-хлор-два
4) купрум-фтор-два
а) аш-три-пэ-о-четыре
б) эн-два-о-три
в) кальций-бром-два
г) барий-йод-два
а) аш-два-эс-о -четыре
б) пэ-два-о-три
в) алюминий-хлор-три
г) барий-фтор-два
а) аш-эн-о-три
б) алюминий-два-о-три
в) феррум-бром-два
г) купрум-йод-два
5. Составьте химические формулы соединений:
а) цинк и бром (I)
б) железо (III) и кислород
в) кремний (IV) и водород
г) сера (VI) и кислород
а) магний и хлор (I)
б) углерод (IV) и водород
в) алюминий и кислород
г) сера (IV) и кислород
а) кальций и бром (I)
б) сера (VI) и кислород
в) азот (III) и водород
г) цинк и кислород
а) барий и кислород
б) сера (IV) и кислород
в) фосфор (III) и водород
г) хлор (I) и кислород
Валентность.
 Химические формулы – методическая разработка для учителей, Аубакирова Асель Габитовна
Химические формулы – методическая разработка для учителей, Аубакирова Асель Габитовна|
Цели обучения: |
7.1.2.11 – уметь правильно составлять формулы биэлементных химических соединений, используя названия элементов, валентность и их атомные соотношения в соединениях. |
|
Цель урока: |
Знают биэлементные химические соединения. |
|
Критерии оценки: |
Умеет правильно составлять формулы биэлементных химических соединений. |
|
Языковые цели: |
Учащиеся будут использовать в письменной и устной речи понятия валентность, химические формулы. |
|
Привитие ценностей: |
Общенациональная идея «Мәңгілік ел». |
|
Межпредметная связь: |
Математика (составление формул), физика (молекулы). |
|
Предшествующие знания: |
Определение понятия «Химический элемент», понятия «атом», «молекулы». |
Ход урока
|
Запланированные этапа урока |
Виды упражнений, запланированных на урок |
Ресурсы |
|
Начало урока |
Приветствие учащихся.
|
Карточка с кроссвордом |
|
Середина урока |
С целью изучения новой темы используется прием «Секретный ящик» (работа в группах).
|
Инструкция (приложение №3), учебник, Ссылка на урок BilimLand Ccылка на урок Валентность |
|
Конец урока |
С целью определения уровня достижения ожидаемых результатов изученного материала. Индивидуальное задание для формативного оценивания.
Взаимопроверка для улучшения своих знаний. Проверка по модельному ответу. С целью установления межпредметной связи химии с математикой и реализации потребностей учащихся с высоким уровнем познавательной активности выполняется тест. Рефлексия прием «Дерево познаний» с целью обратной связи. |
Методическое пособие «Сборник формативного оценивания»
https://bilimland.
|
|
Дифференциация – каким способом вы хотите больше оказывать поддержку |
Оцените, как вы планируете проверить уровень освоения учебного материала учащихся? |
Охрана здоровья и соблюдение техники безопасности |
|
1. По уровню самостоятельности (Работа с различными информационными источниками) |
1.  Взаимооценивание, оценивание индивидуально, устный комментарий. Взаимооценивание, оценивание индивидуально, устный комментарий.2.Выполнение задания для ФО. 3.Обратная связь по итогам рефлексии в форме «Дерево познаний». |
Коллаборативная среда, физминутка |
Рефлексия по уроку
|
Общая оценка 2: Что могло бы посодействовать тому, чтобы урок прошел лучше (касающиеся преподавания и обучения) 2: Что я выяснил на этом уроке о классе или о достижениях/затруднениях отдельных учеников, на что обратить внимание на следующем уроке? |
Приложение №1
«Словарик настроения»
Вам предлагаются прилагательные, описывающее настроение.
- Безоблачное
- Доброе
- Великолепное
- Жизнерадостное
- Игривое
- Лучезарное
- Ликующее
- Отличное
- Ожидающее
- Приподнятое
- Праздничное
- Радужное
- Радостное
- Спокойное
- Хорошее
Приложение №2
Задание
«Кроссворд»
Разгадайте кроссворд и найдите ключевое слово.
Найдите в периодической таблице химические элементы, относительные массы которых:
- Ar = 1
- Ar = 14
- Ar = 39
- Ar = 4
- Ar = 20
- Ar = 23
- Ar = 65
- Ar = 11
- Ar = 16
- Ar = 19
- Ar = 58
Приложение №3
Инструктаж
- По выполнению задания «Секретный ящик»
- Прочитайте текст.

- По команде учителя составьте каждый по 3 вопроса на предложенный текст.
- Запишите каждый вопрос на листочках из ящика.
- На одном из них будет пометка, которая означает что вы хранитель ящика.
- Оцените вопросы и выберите 10 лучших.
- Хранитель идет в соседнюю группу по часовой стрелке и предлагает ей ответить на 10 вопросов, каждому ученику по 2 вопроса.
- Хранитель оценивает ответы всей группы:
- Зеленый флажок – верные ответы.
- Желтый флажок – неверные ответы.
- Движение хранителя продолжается, пока он не окажется в своей группе.
- По итогам работы хранитель дает устный комментарий каждой группе.
Карточка инструкция №1
Учащиеся становятся в круг, находят прилагательное, описывающее их настроение.
Карточка инструкция №2
Формирование групп по цвету карточки.
(Учащимся раздаются каточки разного цвета, на которых написаны символы химических элементов – 1 группа желтые (Li, Na, K, Rb, Cs), 2 группа зеленые (O, Be, Mg, Sr, Ba), 3 группа синие (B, Al, Ga, In, Ti).
Карточка инструкция №3
«Дерево познаний»
Учащиеся вывешивают на дерево яблочки с комментариями (красные – урок понятен …, зеленые – еще придется потрудиться …, желтые – пожелание …).
Модельный ответ задания формативного оценивания
Промежуточная валентность химических элементов. Что такое валентность
До сих пор вы пользовались химическими формулами веществ, приведенными в учебнике, или теми, которые вам называл учитель. Как же правильно составлять химические формулы?
Химические формулы веществ составляются на основе знания качественного и количественного состава вещества. Веществ существует гигантское количество, естественно запомнить все формулы невозможно. Это и не нужно! Важно знать определенную закономерность, согласно которой атомы способны соединяться друг с другом с образованием новых химических соединений.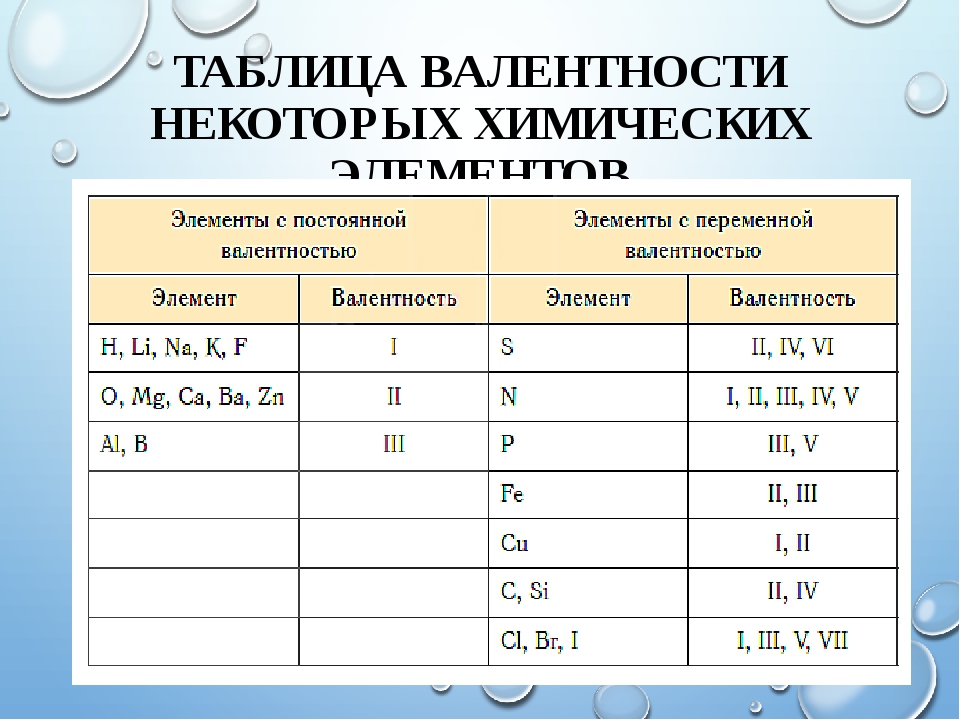 Такая способность называется валентностью.
Такая способность называется валентностью.
Валентность – свойство атомов элементов присоединять определенное число атомов других элементов
Рассмотрим модели молекул некоторых веществ, таких, как вода, метан и углекислый газ.
Видно, что в молекуле воды атом кислорода присоединяет два атома водорода. Следовательно, его валентность равна двум. В молекуле метана атом углерода присоединяет четыре атома водорода, его валентность в данном веществе равна четырем. Валентность водорода в обоих случаях равна одному. Такую же валентность углерод проявляет и в углекислом газе, но в отличие от метана, атом углерода присоединяет два атома кислорода, так как валентность кислорода равна двум.
Существуют элементы, валентность которых не меняется в соединениях. О таких элементах говорят, что они обладают постоянной валентностью. Если же валентность элемента может быть различной – это элементы с переменной валентностью. Валентность некоторых химических элементов приведена в таблице 2. Валентность принято обозначать римскими числами.
Валентность принято обозначать римскими числами.
Таблица 2. Валентность некоторых химических элементов
| Символ элемента | Валентность | Символ элемента | Валентность |
| H, Li, Na, K, F, Ag | I | C, Si, Sn, Pb | II, IV |
| Be, Mg, Ca, Ba, Zn, O | II | N | I, II, III, IV |
| Al, B | III | P, As, Sb | III, V |
| S | II, IV, VI | Cl | I, II,III, IV,V, VII |
| Br, I | I, III, V | Ti | II, III, IV |
Стоит отметить, что высшая валентность элемента численно совпадает с порядковым номером группы Периодической Системы, в которой он находится. Например, углерод находиться в IV группе, его высшая валентность равна IV.
Исключение составляют три элемента:
- азот – находится в V группе, но его высшая валентность IV;
- кислород – находится в VI группе, но его высшая валентность II;
- фтор – находится в VII группе, но его высшая валентность – I.
Исходя из того, что все элементы расположены в восьми группах Периодической Системы, валентность может принимать значения от I до VIII.
Составление формул веществ при помощи валентности
Для составления формул веществ при помощи валентности воспользуемся определенным алгоритмом:
Определение валентности по формуле вещества
Чтобы определить валентность элементов по формуле вещества, необходим обратный порядок действий. Рассмотрим его также при помощи алгоритма:
При изучении данного параграфа были рассмотрены сложные вещества, в состав которых входят только два вида атомов химических элементов. Формулы более сложных веществ составляются иначе.
Бинарные соединения – соединения, в состав которых входит два вида атомов элементов
Для определения порядка последовательности соединения атомов используют структурные (графические) формулы веществ. В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
В таких формулах валентности элементов обозначают валентными штрихами (черточками). Например, молекулу воды можно изобразить как
Н─О─Н
Графическая формула изображает только порядок соединения атомов, но не структуру молекул. В пространстве такие молекулы могут выглядеть иначе. Так, молекула воды имеет угловую структурную формулу:
- Валентность – способность атомов элементов присоединять определенное число атомов других химических элементов
- Существуют элементы с постоянной и переменной валентностью
- Высшая валентность химического элемента совпадает с его номером группы в Периодической Системе химических элементов Д.И. Менделеева. Исключения: азот, кислород, фтор
- Бинарные соединения – соединения, в состав которых входит два вида атомов химических элементов
- Графические формулы отражают порядок связей атомов в молекуле при помощи валентных штрихов
- Структурная формула отражает реальную форму молекулы в пространстве
», «препарат ». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz ). В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.
Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz ). В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт. . Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе », положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле . В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН 4 . Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес . В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории » Арчибальд Скотт Купер .
Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес . В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории » Арчибальд Скотт Купер .
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму ». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства », то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение ». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей , в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей . В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей , предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами . При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей , предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами . При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 — и NH 4 +), фосфора — 5 (PCl 5), серы — 6 (H 2 SO 4), хлора — 7 (Cl 2 O 7).
В ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу .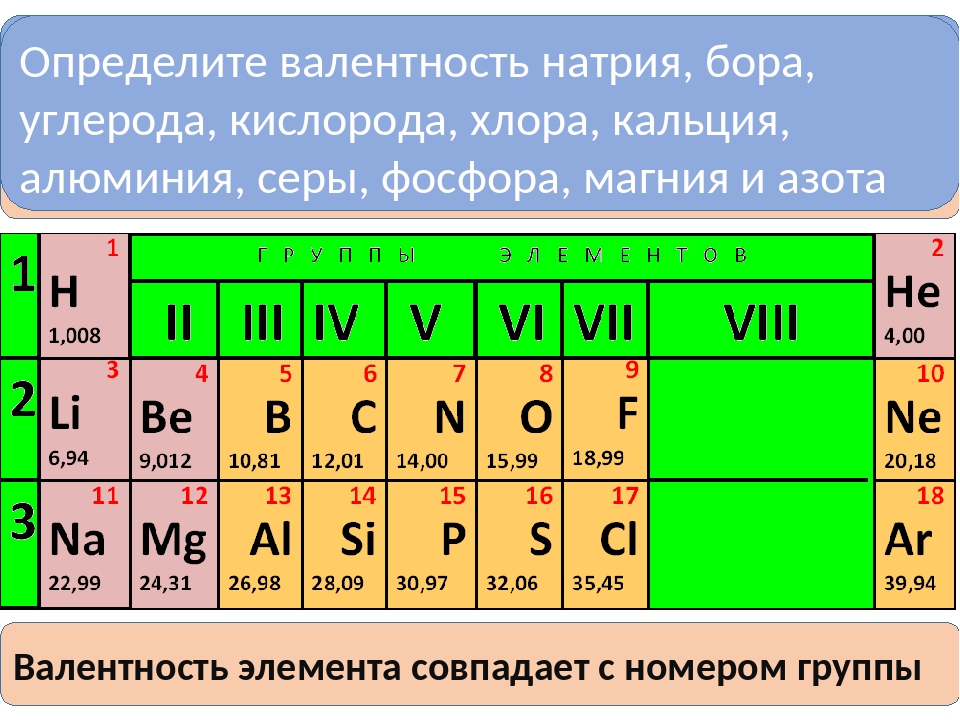 Например, в изоэлектронных молекулах азота N 2 , монооксида углерода CO и цианид-ионе CN — реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Например, в изоэлектронных молекулах азота N 2 , монооксида углерода CO и цианид-ионе CN — реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
См. также
Примечания
Ссылки
- Угай Я. А. Валентность, химическая связь и степень окисления — важнейшие понятия химии // Соросовский образовательный журнал .
 — 1997. — № 3. — С. 53-57.
— 1997. — № 3. — С. 53-57. - / Левченков С. И. Краткий очерк истории химии
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое «Валентность» в других словарях:
ВАЛЕНТНОСТЬ, мера «соединительной способности» химического элемента, равная числу индивидуальных ХИМИЧЕСКИХ СВЯЗЕЙ, которые может образовать один АТОМ. Валентность атома определяется числом ЭЛЕКТРОНОВ на самом верхнем (валентном) уровне (внешней… … Научно-технический энциклопедический словарь
ВАЛЕНТНОСТЬ — (от лат. valere иметь значение), или атомность, число атомов водорода или эквивалентных ему атомов или радикалов, к рое может присоединить данный атом или радикал. В. является одной из основ распределения элементов в периодической системе Д. И.… … Большая медицинская энциклопедия
valere иметь значение), или атомность, число атомов водорода или эквивалентных ему атомов или радикалов, к рое может присоединить данный атом или радикал. В. является одной из основ распределения элементов в периодической системе Д. И.… … Большая медицинская энциклопедия
Валентность — * валентнасць * valence термин происходит от лат. имеющий силу. 1. В химии это способность атомов химических элементов образовывать определенное число химических связей с атомами др. элементов. В свете строения атома В. это способность атомов… … Генетика. Энциклопедический словарь
— (от лат. valentia сила) в физике число, показывающее, со сколькими атомами водорода может соединяться данный атом или замещать их. В психологии валентность есть идущее из Англии обозначение для побуждающей способности. Философский… … Философская энциклопедия
Атомность Словарь русских синонимов. валентность сущ., кол во синонимов: 1 атомность (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
ВАЛЕНТНОСТЬ — (от лат. valentia – крепкий, прочный, влиятельный). Способность слова к грамматическому сочетанию с другими словами в предложении (например, у глаголов валентность определяет способность сочетаться с подлежащим, прямым или косвенным дополнением) … Новый словарь методических терминов и понятий (теория и практика обучения языкам)
valentia – крепкий, прочный, влиятельный). Способность слова к грамматическому сочетанию с другими словами в предложении (например, у глаголов валентность определяет способность сочетаться с подлежащим, прямым или косвенным дополнением) … Новый словарь методических терминов и понятий (теория и практика обучения языкам)
— (от латинского valentia сила), способность атома химического элемента присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи … Современная энциклопедия
— (от лат. valentia сила) способность атома химического элемента (или атомной группы) образовывать определенное число химических связей с другими атомами (или атомными группами). Вместо валентности часто пользуются более узкими понятиями, напр.… … Большой Энциклопедический словарь
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений : максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N 2 равна III, а степень окисления = 0. Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента
.
В соединении A x B y: валентность (А) x = валентность (В) y
Пример 1 . Найти валентности всех элементов в соединении NH 3 .
Решение . Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2 . Найти валентности всех элементов в молекуле Cl 2 O 5 .
Решение . У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 2 = 2 Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3 . Найти валентность хлора в молекуле SCl 2 , если известно, что валентность серы равна II.
Решение . Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4 . Составьте формулу соединения кальция с водородом.
Решение . Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — Ca x H y . Вновь составляем известное уравнение: 2 x = 1 у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH 2 .
«А почему именно CaH 2 ? — спросите вы. — Ведь варианты Ca 2 H 4 и Ca 4 H 8 и даже Ca 10 H 20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N 2 O 4 или C 6 H 6 невозможны? — спросите вы. — Следует заменить эти формулы на NO 2 и CH?»
Нет, возможны. Более того, N 2 O 4 и NO 2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С 6 Н 6).
Более того, N 2 O 4 и NO 2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С 6 Н 6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5 . Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение . Пусть формула соединения — S x F y . Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 x = 1 y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF 6 .
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность» .
Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, NH 4 Cl, H 2 S, H 3 PO 4 и т. д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества.
– это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так: валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода.
Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т.д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным.
Кислород считается постоянно двухвалентным.
Постоянная валентность:
I – H, Na, Li, K, Rb, Cs
II – O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III – B, Al, Ga, In
Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2. Например, не составит труда найти валентность элементов в следующих соединениях: Na 2 O (валентность Na – 1, O – 2), Al 2 O 3 (валентность Al – 3, O – 2).
Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
Как же мы получили формулу?
Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого . Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Будем составлять в соответствии с алгоритмом:
1. Записываем рядом символы химических элементов:
2. Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца – 7, у кислорода – 2.
3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14: 7 = 2, 14: 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода.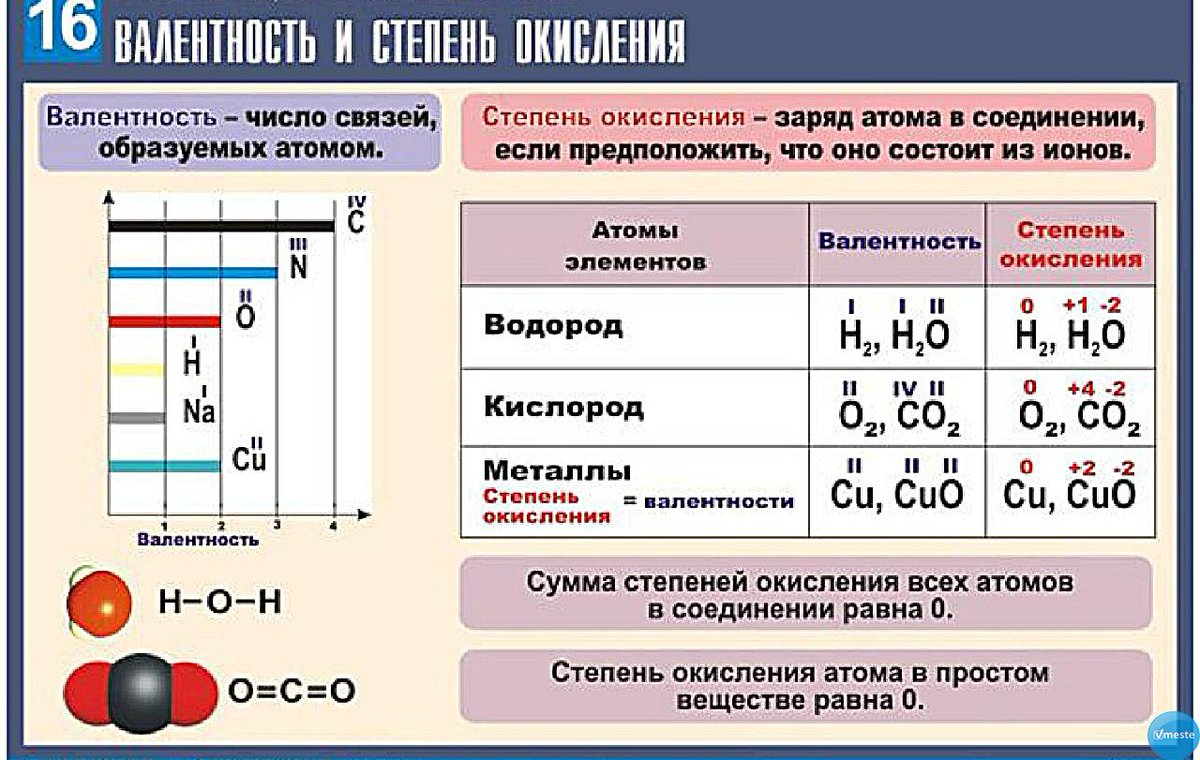 Подставляем индексы.
Подставляем индексы.
Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого.
Mn 2 O 7 (7 · 2 = 2 · 7).
Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
Остались вопросы? Хотите знать больше о валентности?
Чтобы получить помощь репетитора – .
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Разберемся, как определить валентность по таблице Менделеева.
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от , эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения . Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Чем поможет периодическая таблица?
Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.
Такие свойства имеют главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.
То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d.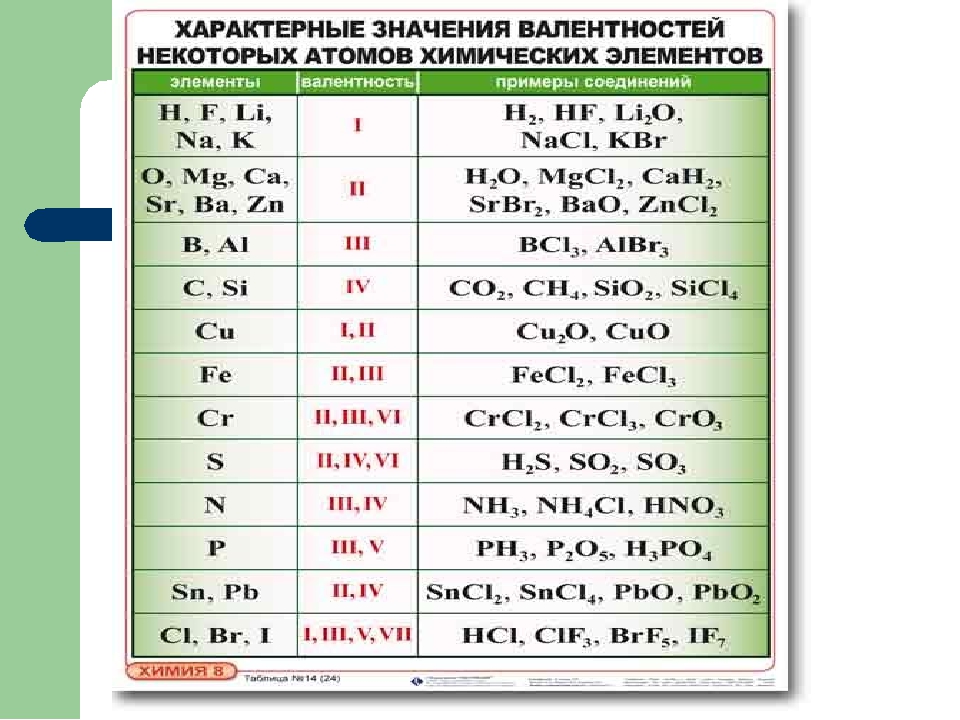 Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе h3S двухвалентна, в составе SO2 — четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.
Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов.
 Примеры — сера, хлор, бром, йод, хром и другие.
Примеры — сера, хлор, бром, йод, хром и другие.
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод;
- сера;
- хлор;
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить . Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение
Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с структурой — ковалентность, а для веществ ионного строения — заряд иона.
Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с структурой — ковалентность, а для веществ ионного строения — заряд иона.
Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Содержание:
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности Определение валентности элементов по формулам их соединений
- Определение валентности элемента по формуле соединения. Составление химических формул по валентности определение валентности элементов по химическим формулам соединений. Знать формулу вещества, состоящего из 2 элементов, и 1 скобка римской цифры указывает на валентность этого элемента. Вы можете определить их 1 валентность, валентность другогоэлемента.
- Например, если формула дана о оксиде меди CuO, то валентность меди можно определить следующим образом: валентность кислорода равна 2,1 атома, имеет 1 атом меди, поэтому валентность меди также равна 2.
 Определить валентность с помощью химической формулы, содержащей не 1.
Определить валентность с помощью химической формулы, содержащей не 1.
Несколько атомов 2 различных химических элементов, довольно сложно. Людмила Фирмаль
Например, чтобы определить валентность железа оксида железа fe203, мы утверждаем: валентность кислорода равна 2.Но так как эта молекула содержит 3 атома кислорода, то общее число валентностей всех 3 атомов кислорода равно 6(2 * 3).Эти 6 валентностей попадают под 2 железа atoms. As в результате на каждый атом железа приходится 3 единицы валентности (6: 2).
- Приведенный выше пример позволяет вывести простое правило. Число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента. Эти соображения позволяют использовать следующие схемы при определении валентности элемента с помощью формул: 1.Напишите химическую формулу вещества и обратите внимание на валентность известных элементов. н я н н н н н ЦУО Н2Ѕ Fe203 С03 2.

Найдите и запишите общее количество валентностей этого элемента. 0 W E) И ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ЦУО Н2Ѕ Fe203 С03 3. Валентность 2-го элемента вычисляется и помещается над химическим символом. Для этого сумма валентностей делится на индекс 2-го элемента. Это II и II и II и Врил III и II с CuO H9S SOo Fe » A л20 OV73 я t2W3
При определении валентности элемента по формуле необходимо обратить внимание на следующие моменты: Людмила Фирмаль
2) Значение валентности не превышает 8. 3) Некоторые химические элементы имеют переменную валентность. Получение химических формул путем Valence. To составляя химическую формулу, нужно знать валентность элементов, образующих это соединение. Валентности наиболее важных элементов приведены в таблице 3. Таблица 3.Валентность атомов некоторых элементов в соединении
Примеры формул валентных элементных оксигенатов Е / 1 II и III Эл и Н II к II и III II и IV, III и V II, в III и VI ч.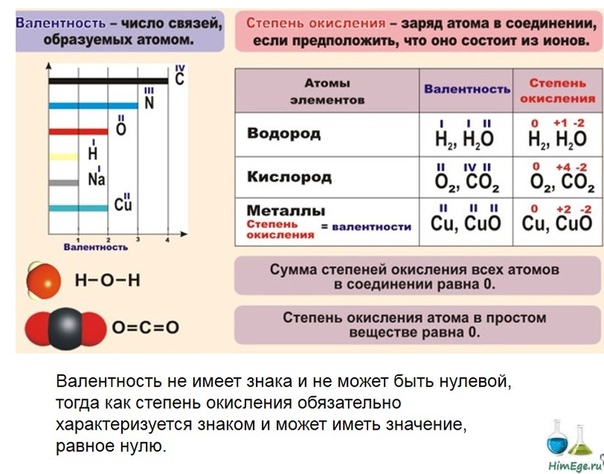 , IV и VI элементы, постоянное бесплодное н. н, К. ли о,, мг, Са ва, ЗН Л1, переменной валентности КР ФК, со, Ni СН, ПБ п з пр добыча Н20, Na20 ГГО, САО, AI2O3 tnost размере 20,ЦУО Фео, Fe2Os СНО, Sn02 РН3,Р2О5 Кро, Cr203h3s, Сг203, ЅО2, ѕо3 При создании химической формулы используйте следующую схему: 1.
, IV и VI элементы, постоянное бесплодное н. н, К. ли о,, мг, Са ва, ЗН Л1, переменной валентности КР ФК, со, Ni СН, ПБ п з пр добыча Н20, Na20 ГГО, САО, AI2O3 tnost размере 20,ЦУО Фео, Fe2Os СНО, Sn02 РН3,Р2О5 Кро, Cr203h3s, Сг203, ЅО2, ѕо3 При создании химической формулы используйте следующую схему: 1.
Затем напишите химические символы элементов, которые составляют соединение. Ко A1CI Аю 2.Над знаками химического элемента добавляется его валентность. |Привет, привет КО AIC1 АЙ 3.Определите минимальное кратное число, представляющее валентность обоих элементов. W•0 Я в в п 。Ко Айти Аю 4.Найдите индекс, разделив наименьшее кратное на валентность соответствующего элемента(не записывайте индекс » 1): [В случае ГД I II III III III II K20 AlCIg Al203
При создании химической формулы для элемента с переменной валентностью, рядом с названием вещества, напишите в скобках цифру, указывающую валентность этого элемента в данном соединении. Например, оксид меди (II) — это CuO, оксид.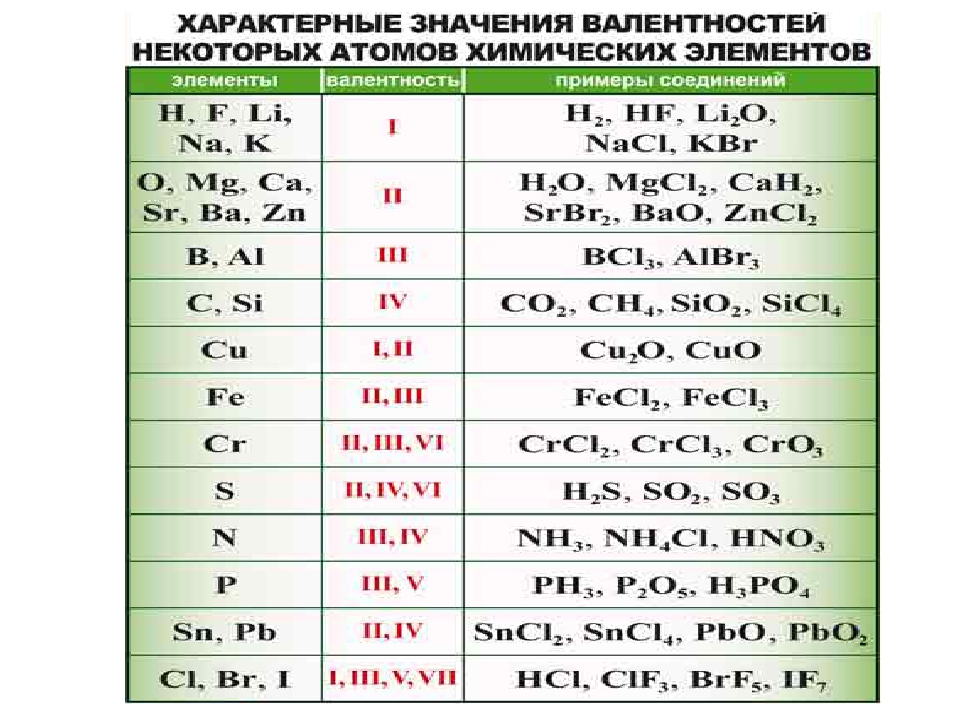 * Ди(я) — размере 20, хлорида железа (II) — Компьютерная FeCl2,хлорида железа (III) — fecl3 обеспечивает. Упражнение 5-8 (стр. 29).Решите задачу I и 2(стр. 29).
* Ди(я) — размере 20, хлорида железа (II) — Компьютерная FeCl2,хлорида железа (III) — fecl3 обеспечивает. Упражнение 5-8 (стр. 29).Решите задачу I и 2(стр. 29).
Смотрите также:
Решение задач по химии
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
Как рассчитать валентность каждого элемента?
Валентность Валентность – это количество электронов, которое атом получает, теряет или даже делит во время химической реакции. Валентность – это количество электронов, которое атом должен получить или потерять, чтобы достичь электронной конфигурации благородного газа.
В химической реакции атомы пытаются достичь стабильного состояния, теряя свои внешние электроны (как в случае с металлами) или разделяя некоторое количество электронов с другими атомами (как в случае с неметаллами).
Валентность элементов или ионов для написания химической формулы соединения. Хлор имеет валентность 1, так как ему необходимо получить 1 электрон для достижения электронной конфигурации благородного газа.
Хлор имеет валентность 1, так как ему необходимо получить 1 электрон для достижения электронной конфигурации благородного газа.
Атомы пытаются достичь стабильного состояния, приобретая некоторое количество электронов, чтобы дополнить внешнюю оболочку (8) электронами (как в случае с неметаллами).
Вычислить валентность
Самые внешние электроны атома определяют его валентность, валентность элемента измеряет его способность соединяться с другими элементами, Валентность определяется количеством электронов во внешней оболочке атома каждый атом элемента.
Валентность некоторых элементов в современной таблице Менделеева Элементы группы (1 А) в современной периодической таблице имеют один валентный электрон на внешней оболочке, они очень активны, они являются одновалентными элементами, поскольку имеют только один электрон на своих внешних энергетических уровнях.
Валентность элементов периодической таблицы
Валентность щелочноземельных металлов в группе (2 А) двухвалентна, они являются двухвалентными элементами, так как имеют два электрона на своих внешних энергетических уровнях.
Элементы группы (7 А) являются одновалентными элементами, поскольку их самые внешние энергетические уровни имеют (7) электронов. Элементы группы (18) в современной периодической таблице представляют собой благородные газы с нулевой валентностью. так как валентная оболочка насыщена 8 электронами.
Чтобы определить валентность ионной молекулы тетраоксида фосфора (PO4, четыре атома кислорода и один атом фосфора), необходимо умножить общую валентность четырех атомов кислорода (валентность 2) и вычесть ее из валентности фосфора. атом (валентность 5), что показывает, что валентность (PO4) равна 3.
Валентность элемента всегда представляет собой целое число, а некоторые элементы обладают более чем одной валентностью, например, сера (S) является двухвалентной, четырехвалентной и шестивалентной.
Азот (N) является трехвалентным и пятивалентным, в то время как фосфор (P) является трехвалентным и пятивалентным. Валентность меди I является одновалентной, а валентность меди II двухвалентной.
Валентность сульфата железа [II] или сульфата железа двухвалентна, как в FeSO 4 , валентность железа равна двум, а валентность сульфата железа [III] или сульфата железа трехвалентна, как в Fe 2 (SO 4 ) 3 , валентность железа равна трем.
Что такое валентность? Валентность некоторых металлических, неметаллических элементов и атомных групп
Современная периодическая таблица и классификация элементов
Квантовые числа и принципы распределения электронов
Металлические и неметаллические свойства, кислотные и основные свойства в периодической таблице
Теории, объясняющие ковалентную связь, правило октетов и концепцию перекрывающихся орбиталей
Валентность — Химические формулы — Национальное 5-е издание по химии
2bzqj8eb0zi.0.0.0.1:0.1.0.$0.$1.$0″> Валентность – это объединяющая сила элемента.Элементы одной группы периодической таблицы имеют одинаковую валентность. Валентность элемента связана с тем, сколько электронов находится на внешней оболочке.| Group Number | 1 | 2 | 3 | 4 | 5 | 9 92bzqj8eb0zi.0.0.0.1:0.1.0.$0.$1.$1.$1.$0.$7″> 7 | 8 | 98 |
|---|---|---|---|---|---|---|---|---|
| Valency | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
Для написания химической формулы соединения лучше всего использовать С.В.С.Д.Ф система.
- S — запишите символа обоих задействованных элементов.
- V — под каждым символом напишите его валентность . Полезно запомнить приведенную выше таблицу. 0.0.0.1:0.1.0.$0.$1.$4.$2″> S — поменять местами валентности.
- D — если валентности можно упростить, разделить их обоих на меньшее из двух чисел.Если одно из чисел уже равно единице, то их нельзя далее делить и упрощать.
- F — напишите формулу .
Пример
Какова формула оксида калия?
Какова формула оксида алюминия?
- Вопрос
Какова формула сероуглерода?
- Показать ответ
4.4: Валентность — Химия LibreTexts
Возможно, наиболее важной функцией периодической таблицы является то, что она помогает нам предсказывать химические формулы часто встречающихся соединений. В начале каждой группы Менделеев привел общую формулу оксидов элементов группы.
В начале каждой группы Менделеев привел общую формулу оксидов элементов группы.
Заголовок R 2 O выше группы I, например, означает, что мы можем ожидать найти такие соединения, как H 2 O, Li 2 O, Na 2 O и т. д. Аналогично, общая формула RH 3 выше группы V предполагает, что должны существовать соединения NH 3 , PH 3 , VH 3 и AsH 3 (среди прочих).Чтобы обеспечить основу для проверки этого предсказания, в следующей таблице показаны формулы для соединений, в которых H, O или Cl сочетаются с каждым из первых двух десятков элементов (в порядке атомного веса). Даже среди групп элементов, описательную химию которых мы не обсуждали, можно легко убедиться, что большинство предсказанных формул соответствуют реально существующим соединениям. Наоборот, более 40% формул известных соединений О согласуются с общими формулами Менделеева и заштрихованы в таблице цветом.
| Элемент | Атомный вес | Соединения водорода | Соединения кислорода | Соединения хлора |
|---|---|---|---|---|
| Водород | 1,01 | Н 2 | Н 2 О, Н 2 О 2 | HCl |
| Гелий | 4.00 | Не сформировано | Не сформирован | Не сформирован |
| Литий | 6,94 | ЛиГ | Ли 2 О, Ли 2 О 2 | LiCl |
| Бериллий | 9. 01 01 | БеГ 2 | ВеО | BeCl 2 |
| Бор | 10.81 | В 2 Н 6 | В 2 О 3 | БКл 3 |
| Углерод | 12.01 | CH 4 , C 2 H 6 , C 3 H 8 † | СО 2 , СО, С 2 О 3 | CCl 4 , C 2 Cl 6 |
| Азот | 14. 01 01 | НХ 3 , Н 2 Х 4 , ХН 3 | N 2 O, NO, NO 2 , N 2 O 5 | нКл 3 |
| Кислород | 16.00 | Н 2 О, Н 2 О 2 | О 2 , О 3 | |
| Фтор | 19.00 | ВЧ | ИЗ 2 , О 2 Ф 2 | КлФ, КлФ 3 , КлФ 5 |
| Неон | 20.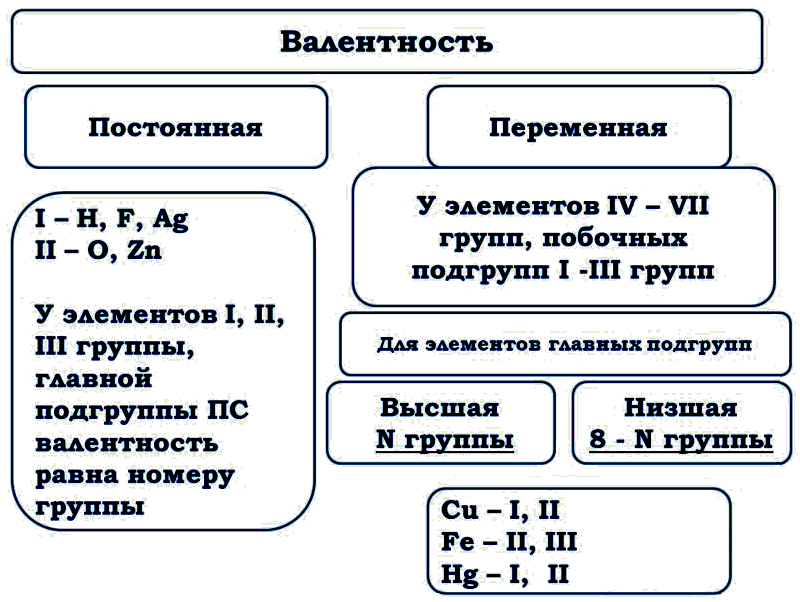 18 18 | Не сформировано | Не сформирован | Не сформирован |
| Натрий | 22,99 | NaH | Натрий 2 О, Натрий 2 О 2 | NaCl |
| Магний | 24.31 | МгН 2 | MgO | MgCl 2 |
| Алюминий | 26,98 | АлХ 3 | Алюминий 2 О 3 | AlCl 3 |
| Кремний | 28. 09 09 | SiH 4 , Si 2 H 6 | SiO 2 | SiCl 4 , Si 2 Cl 6 |
| Фосфор | 30.97 | РН 3 , П 2 Н 4 | Р 4 О 10 , Р 4 О 6 | PCl 3 , PCl 5 , P 2 Cl 4 |
| Сера | 32.06 | Н 2 Ю, В 2 Ю 2 | ТАК 2 , ТАК 3 | S 2 Класс 2 , Кл 2 , Кл 4 |
| Хлор | 35.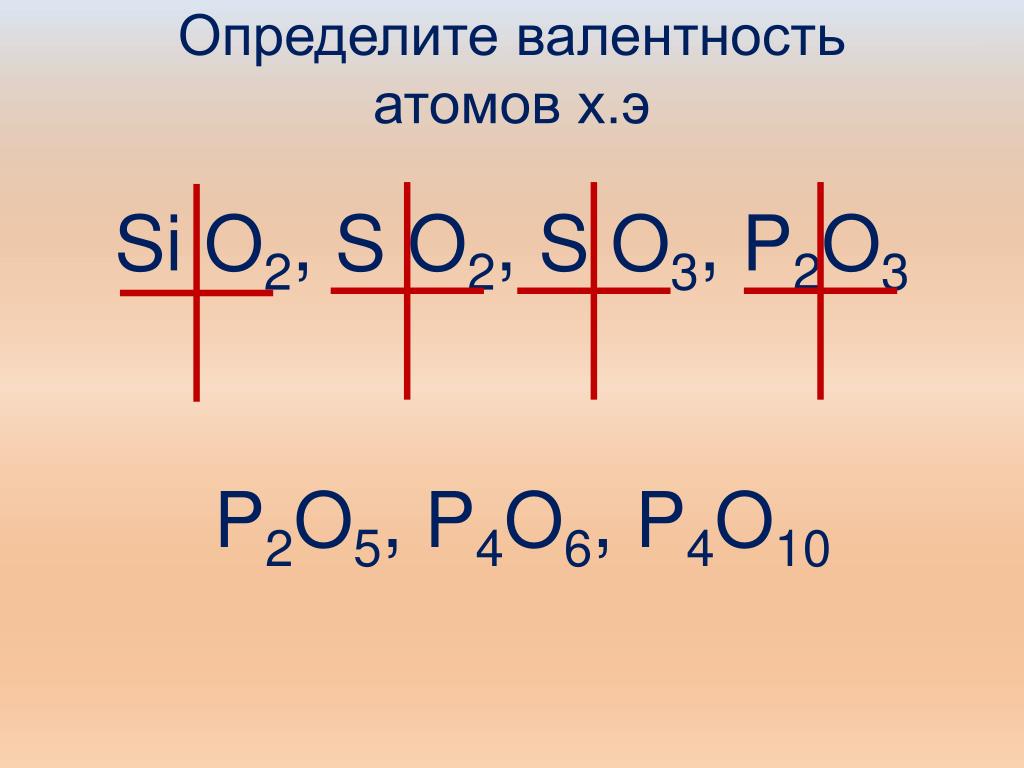 45 45 | HCl | Cl 2 O, ClO 2 , Cl 2 O 7 | Класс 2 |
| Калий | 39.10 | КХ | К 2 О, К 2 О 2 , КО 2 | KCl |
| Аргон | 39,95 | Не сформировано | Не сформирован | Не сформирован |
| Кальций | 40. 08 08 | CaH 2 | СаО, СаО 2 | CaCl 2 |
| Скандий | 44,96 | Относительно нестабильный | Sc 2 О 3 | ScCl 3 |
| Титан | 47,90 | TiH 2 | TiO 2 , Ti 2 O 3 , TiO | TiCl 4 , TiCl 3 , TiCl 2 |
| Ванадий | 50. 94 94 | ВХ 2 | В 2 О 5 , В 2 О 3 , ВО 2 , ВО | ВХ 4 , ВХ 3 , ВХ 2 |
| Хром | 52,00 | CrH 2 | Cr 2 O 3 , CrO 2 , CrO 3 | CrCl 3 , CrCl 2 |
* Для каждого элемента соединения перечислены в порядке убывания стабильности.В некоторых случаях известны дополнительные соединения, но они относительно нестабильны.
† Известно очень много стабильных соединений углерода и водорода, но нехватка места не позволяет перечислить их все.
Периодическое повторение подобных формул еще более выражено в случае соединений Cl. Это становится очевидным, когда составляется список индексов Cl в сочетании с каждым из первых 24 элементов. Из приведенной выше таблицы мы находим HCl (нижний индекс 1), отсутствие соединений с He (нижний индекс 0), LiCl (нижний индекс 1) и так далее.
Только за двумя исключениями, выделенными курсивом, по крайней мере одна формула соединения каждого элемента соответствует последовательности индексов, которые регулярно колеблются от 0 до 4 и снова обратно до 0. (Необычное поведение K и Ar будет обсуждено чуть позже.) Число атомов Cl, которые соединяются с одним атомом каждого другого элемента, довольно регулярно меняется по мере увеличения атомного веса другого элемента. Экспериментально определенные формулы в первой таблице и общие формулы в периодической таблице Менделеева подразумевают, что каждый элемент имеет характерную способность к химическому соединению.Эта емкость называется валентностью , и она периодически меняется с увеличением атомного веса. Все благородные газы имеют валентность 0, потому что они почти никогда не сочетаются с каким-либо другим элементом. H и Cl имеют одинаковую валентность. Они соединяются друг с другом в соотношении 1:1 с образованием HCl, каждый соединяется с Li в таком же соотношении 1:1 (LiH и LiCl), каждый соединяется с Be в таком же соотношении (BeH 2 , BeCl 2 ), и так далее. Поскольку H и Cl имеют одинаковую валентность, мы можем предсказать, что большое количество соединений H будут иметь формулы, идентичные формулам соединений Cl, за исключением, конечно, того, что символ H заменит символ Cl.Правильность этого предсказания можно проверить, изучив формулы, обведенные серой заливкой в первой таблице. Комбинирующая способность или валентность О, по-видимому, в два раза выше, чем у Н или Cl. Два атома H соединяются с одним атомом O в H 2 O Так же, как и два атома Cl или два атома Li (Cl 2 O и Li 2 O). Число атомов, связанных с одним атомом О, обычно составляет 90 805, что в два раза больше, чем 90 806, по сравнению с числом, которое связано с одним атомом Н или Cl.
Все благородные газы имеют валентность 0, потому что они почти никогда не сочетаются с каким-либо другим элементом. H и Cl имеют одинаковую валентность. Они соединяются друг с другом в соотношении 1:1 с образованием HCl, каждый соединяется с Li в таком же соотношении 1:1 (LiH и LiCl), каждый соединяется с Be в таком же соотношении (BeH 2 , BeCl 2 ), и так далее. Поскольку H и Cl имеют одинаковую валентность, мы можем предсказать, что большое количество соединений H будут иметь формулы, идентичные формулам соединений Cl, за исключением, конечно, того, что символ H заменит символ Cl.Правильность этого предсказания можно проверить, изучив формулы, обведенные серой заливкой в первой таблице. Комбинирующая способность или валентность О, по-видимому, в два раза выше, чем у Н или Cl. Два атома H соединяются с одним атомом O в H 2 O Так же, как и два атома Cl или два атома Li (Cl 2 O и Li 2 O). Число атомов, связанных с одним атомом О, обычно составляет 90 805, что в два раза больше, чем 90 806, по сравнению с числом, которое связано с одним атомом Н или Cl. (Опять же, обращение к формулам, заштрихованным серым цветом, в первой таблице подтвердит это утверждение.) После внимательного изучения формул таблицы также можно сделать вывод, что ни один из элементов (кроме инертных инертных газов) не имеет меньшей валентности, чем H или Cl. Следовательно, мы приписываем валентность 1 H и Cl. Валентность O в два раза выше, поэтому мы присваиваем значение 2.
(Опять же, обращение к формулам, заштрихованным серым цветом, в первой таблице подтвердит это утверждение.) После внимательного изучения формул таблицы также можно сделать вывод, что ни один из элементов (кроме инертных инертных газов) не имеет меньшей валентности, чем H или Cl. Следовательно, мы приписываем валентность 1 H и Cl. Валентность O в два раза выше, поэтому мы присваиваем значение 2.
Пример \(\PageIndex{1}\): предсказания формулы
Используйте данные в первой таблице, чтобы предсказать, какую формулу можно ожидать для соединения, содержащего (а) натрий и фтор; б) кальций и фтор.
Раствор
а) Из таблицы можно получить следующие формулы для наиболее распространенных соединений натрия:
- NaH Na 2 O NaCl
Все это означает, что натрий имеет валентность 1. Для соединений фтора мы имеем
- HF OF 2 ClF
, которые подразумевают, что фтор также имеет валентность 1. Поэтому формула, вероятно,
Поэтому формула, вероятно,
- наф
б) Мы уже знаем, что валентность фтора равна 1. Для кальция формулы
- CaH 2 CaO CaCl 2
говорят в пользу валентности 2. Следовательно, формула, скорее всего,
- КаФ 2
В некоторых случаях один элемент может комбинироваться с другим несколькими способами.Например, вы уже встречались с соединениями HgBr 2 и Hg 2 Br 2 . В первой таблице есть много других примеров такой переменной валентности. Тем не менее в своих наиболее распространенных соединениях каждый элемент обычно проявляет одну характерную валентность, независимо от того, что является его партнером. Поэтому можно использовать эту валентность для предсказания формул. Переменная валентность элемента может рассматриваться как исключение из правила определенной комбинационной способности каждого элемента. Экспериментальное наблюдение, что данный элемент обычно имеет определенную валентность, можно объяснить, если предположить, что каждый из его атомов имеет фиксированное число валентных центров. Один из этих сайтов потребуется для соединения с одним сайтом на другом атоме. Другими словами, у атома благородного газа, такого как Ar или Ne, не будет комбинирующих позиций, у атомов H и Cl будет по одной валентной позиции, у атома O будет две и так далее. Переменная валентность должна включать атомы, в которых одни валентные центры используются легче, чем другие.В случае F-соединений Cl (ClF, ClF 3 , ClF 5 ), например, формулы подразумевают, что по крайней мере пять валентных центров доступны на Cl. Только один из них используется в ClF и в большинстве соединений хлора в таблице. Остальные, по-видимому, менее доступны. Включение Менделеевым общих формул над столбцами его периодической таблицы указывает на то, что таблица может быть использована для предсказания валентности элементов и формул их соединений.
Экспериментальное наблюдение, что данный элемент обычно имеет определенную валентность, можно объяснить, если предположить, что каждый из его атомов имеет фиксированное число валентных центров. Один из этих сайтов потребуется для соединения с одним сайтом на другом атоме. Другими словами, у атома благородного газа, такого как Ar или Ne, не будет комбинирующих позиций, у атомов H и Cl будет по одной валентной позиции, у атома O будет две и так далее. Переменная валентность должна включать атомы, в которых одни валентные центры используются легче, чем другие.В случае F-соединений Cl (ClF, ClF 3 , ClF 5 ), например, формулы подразумевают, что по крайней мере пять валентных центров доступны на Cl. Только один из них используется в ClF и в большинстве соединений хлора в таблице. Остальные, по-видимому, менее доступны. Включение Менделеевым общих формул над столбцами его периодической таблицы указывает на то, что таблица может быть использована для предсказания валентности элементов и формул их соединений.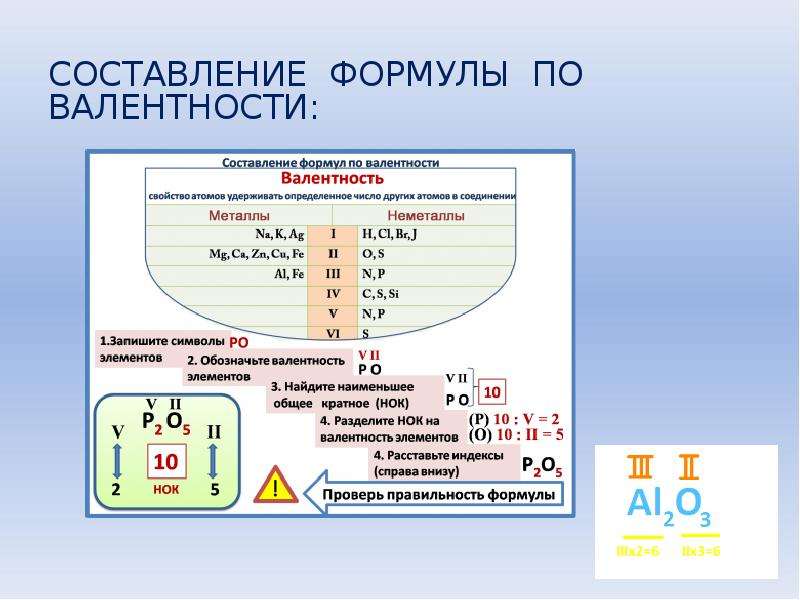 Можно следовать двум общим правилам:
Можно следовать двум общим правилам:
- В периодических группах с I по IV номер группы является наиболее распространенной валентностью.
- В периодических группах с V по VII наиболее распространенная валентность равна 8 минус номер группы или самому номеру группы.
Для групп с V по VII номер группы указывает валентность только тогда, когда рассматриваемый элемент соединяется с кислородом, фтором или, возможно, с одним из других галогенов. В противном случае правилом является 8 минус номер группы.
Пример \(\PageIndex{2}\): Составные формулы
Используйте современную периодическую форму для предсказания формул соединений, образованных из (а) алюминия и хлора; б) фосфор и хлор.Используйте таблицу на этой странице, чтобы проверить свой прогноз.
Раствор
а) Алюминий находится в группе III, поэтому правило 1 предсказывает валентность 3. Хлор находится в группе VII и не соединяется с кислородом или фтором, поэтому его валентность 8 – 7 = 1 по правилу 2. Каждый алюминий имеет три валентных центра, в то время как каждый хлор имеет только один, поэтому для удовлетворения одного алюминия требуется три атома хлора, и формула AlCl 3 .
Каждый алюминий имеет три валентных центра, в то время как каждый хлор имеет только один, поэтому для удовлетворения одного алюминия требуется три атома хлора, и формула AlCl 3 .
b) Снова хлор имеет валентность 1.Фосфор находится в группе V и может иметь валентность 5 или 8 – 5 = 3. Поэтому мы предсказываем формулы PCl 5 или PCl 3 . Примечание: Все три предсказанные формулы представлены в таблице на этой странице.
Авторы и авторство
| Валентность | |
Что такое валентность? | |
| Чтобы писать химические формулы, нам необходимо понимать, как элементы соединяются друг с другом, образуя молекулы или ионные соединения.Ионные соединения – это вещества, состоящие из комбинации заряженных (положительных и отрицательных) частиц. | |
Валентность относится к способности атома или группы химически связанных атомов образовывать химические связи с другими атомами или группами атомов. Давайте не будем слишком усложнять и перейдем непосредственно к периодической таблице и к тому, как мы можем определить валентность элемента. | |
Таблица Менделеева, показанная слева, может многое рассказать нам о валентности элементов. Элементы расположены в группах (столбцах) в периодической таблице в соответствии с числом валентных электронов, поэтому, естественно, положение элемента в периодической таблице должно давать нам представление о его валентности. Все элементы в группе 1 имеют 1 валентный электрон, поэтому они имеют валентность +1, поскольку они имеют тенденцию отдавать 1 электрон. Это то же самое для группы 2, которая отдаст два электрона, и для группы 3, которая отдаст 3 электрона. Элементы группы 5, однако, имеют 5 валентных электронов и имеют тенденцию принимать 3 электрона, поэтому имеют валентность -3. | |
Валентность очень удобна, когда мы хотим записать формулы соединений, образованных из атомов металлов и неметаллов. Например, возьмем реакцию между атомами натрия и хлора. Литий имеет валентность +1, а азот имеет валентность -3 Следуйте этому очень простому методу. | |
| Шаг 1 Запишите два атома и их валентность, всегда располагая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите все индексы, равные «1» | |
| Давайте посмотрим на другой пример, написав формулу соединения, образованного кислородом и алюминием (оксидом алюминия) | .|
Шаг 1 Запишите два атома и их валентность, всегда располагая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите все индексы, равные «1» | |
Напишите формулу соединения кальция и углерода, называемого карбидом кальция. Шаг 1 Запишите два атома и их валентность, всегда помещая атом с положительной валентностью слева. | |
| Шаг 2 Запишите валентность (без знака) для каждого атома в виде нижнего индекса. | |
| Шаг 3 Поменяйте местами индексы и разделите на наименьшее число, только если большее число делится на меньшее число. | |
| Шаг 4 Удалите все индексы, равные «1» | |
Попробуйте сами. а) кальций и азот (нитрид кальция), | |
б) бор и кислород (оксид бора)
| |
г) олово и азот (нитрид олова) | |
д) кислород и литий (оксид лития)
| |
| е) фосфор и кальций (фосфид кальция) Растворы | |
Стивена попросили написать формулу соединения, образующегося при соединении атомов бора и кислорода.Он записал формулу как «O 3 B 2 ». Это правильно? Объясните | |
Уловка для определения валентности элемента
Давайте научимся быстро вычислять валентность элемента, используя этот прием
Условия применения этого трюка,
- Вы должны знать Валентный Электрон этого Элемента.

- Этот трюк подходит только для элементов блока S&P
- Это не применимо к элементам блока D из-за их переменных степеней окисления .
- Элементы нижнего P-блока не подпадают под этот трюк, потому что они будут обладать Эффектом инертной пары Например: Свинец, олово и т. д.
- Благородные газы не имеют никакой валентности из-за их стабильности октета (внешняя орбиталь заполнена электронами)
Давайте посмотрим, как найти валентность элемента.Есть две формулы для расчета валентности элементов.
• Если Валентный электрон равен 1,2,3,4 , то валентность элемента также совпадает с как валентный электрон.
Пример: валентный электрон углерода равен
.Углеродная электронная конфигурация – 1s²,2s²2p², тогда валентность равна 4
Следовательно, валентность углерода равна ЧЕТЫРЕ
[идентификатор epcl_custom_ads = «2»]
• Если валентный электрон больше 4,5,6,7, тогда валентность элемента равна (8 – валентный электрон)
Пример: валентный электрон фтора равен
.
Фтор Электронная конфигурация – 1s²,2s²2p⁵, тогда валентный электрон равен 7
Следовательно, валентность фтора равна (8 – валентный электрон) {8-7} равно ОДИН
Образец:
[идентификатор epcl_custom_ads = «1»]
| Элемент | Расположение электронов На орбитах | Валентный электрон | Валентность элемента |
| Ли | 1с², 2с¹ | 1 | 1 |
| Кл | 1с²,2с²2п⁶,3с²3п⁵ | 7 | 1 |
| С | 1с²,2с²2п² | 4 | 4 |
Таким образом, валентность элемента зависит от валентных электронов, присутствующих в элементе.
Что такое валентность?
Валентность — это комбинированная или связующая способность определенного элемента. Его можно легко рассчитать, зная валентные электроны элемента.
Его можно легко рассчитать, зная валентные электроны элемента.
Что такое валентные электроны?
Электроны, присутствующие на самой внешней орбите атома
Имеет ли валентность какой-либо знак?
Валентность элементов не имеет знака.
Но Валентность элементов имеет Заряд.
• Положительно заряженный. (Потеря электрона)
• Отрицательно заряженный. (Прирост электронов)
Какова валентность алюминия?
Валентные электроны алюминия можно рассчитать по его электронной конфигурации 1s 2 , 2s 2 2p 6 , 3s 2 3p 1 . Валентный электрон равен 3. Поэтому валентность алюминия равна ТРИ
Какова валентность германия?
Валентные электроны германия можно рассчитать по его самой внешней электронной конфигурации: 4s 2 4p 2 . Валентный электрон равен 4, как и углерод. Поэтому валентность германия ЧЕТЫРЕ
Валентный электрон равен 4, как и углерод. Поэтому валентность германия ЧЕТЫРЕ
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie.
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Какова валентность атома?
опубликовано
Какова валентность атома?
Валентность определяет, сколько атомов элемента может сочетаться с конкретным атомом. Теперь давайте объясним предыдущее утверждение примерами соединений, которые мы все знаем:
.HCl: соляная кислота
H 2 O: вода
H 3 N: аммиак и
H 4 C: метан
В HCl атомы водорода и хлора соединяются в соотношении 1 к 1. Откуда вы это знаете из химической формулы? Вы знаете это, потому что, когда атомы объединяют атом за атомом, нижние индексы атомов в химической формуле также существуют в соотношении 1 к 1. В результате, если в химической формуле не отображаются нижние индексы, это обычно означает, что атомы соединить атом за атомом.
Откуда вы это знаете из химической формулы? Вы знаете это, потому что, когда атомы объединяют атом за атомом, нижние индексы атомов в химической формуле также существуют в соотношении 1 к 1. В результате, если в химической формуле не отображаются нижние индексы, это обычно означает, что атомы соединить атом за атомом.
В H 2 O, видно, что атомы водорода и кислорода объединяются в соотношении 2 атома водорода на 1 атом кислорода.
В H 3 N, видно, что атомы водорода и азота объединяются в соотношении 3 атома водорода на 1 атом азота.
Чтобы определить комбинационную способность (валентность) элемента, мы должны выбрать один элемент в качестве эталона, с которым мы можем сравнивать с ним другие элементы. К счастью, атом водорода не может соединяться более чем с одним атомом любого другого элемента. По этой причине химики выбрали его в качестве эталона и присвоили ему валентность 1. Так что же такое валентность? Валентность – это объединяющая способность элемента, и она определяет, со сколькими атомами элемента может сочетаться конкретный атом.В результате в H 2 O кислород (O) имеет валентность 2 (напомним, что водороду присвоена валентность 1).
Так что же такое валентность? Валентность – это объединяющая способность элемента, и она определяет, со сколькими атомами элемента может сочетаться конкретный атом.В результате в H 2 O кислород (O) имеет валентность 2 (напомним, что водороду присвоена валентность 1).
В H 3 N валентность азота (N) равна 3, а в H 4 C валентность углерода равна 4.
Можете ли вы определить валентность элемента по его электронной конфигурации?
Не всегда! Чтобы определить валентность азота по его электронной конфигурации, вы должны подсчитать количество неспаренных электронов, занимающих высших энергетических уровня .Давайте используем приведенную ниже модель для определения валентности азота (N) и кислорода (O).
Судя по орбитальной диаграмме N, 2p-орбиталь имеет три неспаренных электрона (валентность 3), которые она может использовать для соединения с водородом с образованием аммиака ( H 3 N) .
Точно так же кислород имеет два неспаренных электрона (валентность 2) на 2p-орбитали, которые он может использовать для соединения с водородом с образованием воды ( H 2 O).
Иногда валентность не очевидна из электронной конфигурации .Давайте используем углерод, чтобы проиллюстрировать это.
Электронная конфигурация углерода
Из орбитальной диаграммы слева видно, что углерод имеет только два неспаренных электрона, поэтому имеет валентность 2. Однако в соединении CH 4, один атом углерода объединяется с 4 атомами водорода. Так как же это делает углерод? Углерод способен образовывать CH 4 , потому что один из 2s-электронов перемещается с 2s на 2p-орбиталь.Это продвижение приводит к четырем неспаренным электронам, которые затем могут соединяться с 4 атомами водорода, образуя CH 4.
Наконец, элемент с валентностью 1 называется одновалентным, 2 — двухвалентным, 3 — трехвалентным и 4 — четырехвалентным. Обычно химики могут определить валентность любого элемента, связав ее с тем, сколько атомов водорода он может соединить с элементом, или с элементом, который реагирует с ним и имеет уже определенную валентность.
Обычно химики могут определить валентность любого элемента, связав ее с тем, сколько атомов водорода он может соединить с элементом, или с элементом, который реагирует с ним и имеет уже определенную валентность.
Что такое валентные электроны?
Валентные электроны — это электроны, занимающие самый высокий энергетический уровень.Эти электроны обычно доступны для объединения (связи) с другими атомами. Чтобы определить валентные электроны в азоте (N), необходимо подсчитать электроны на самом высоком энергетическом уровне (n = 2, таким образом, подсчитать электроны на 2s- и 2p-орбиталях). Если вы это сделаете, валентных электронов N будет 5. Для кислорода (O) будет 6, а для углерода (C) будет 4.
Может ли периодическая таблица сказать, сколько валентных электронов имеет элемент?
Да! Из системы нумерации периодической таблицы ИЮПАК валентные электроны элемента можно определить, прочитав последнюю цифру номера группы в верхней части столбца (имейте в виду, что, поскольку первая и вторая группы имеют однозначные цифры, эти цифры будут представлять последняя цифра столбца).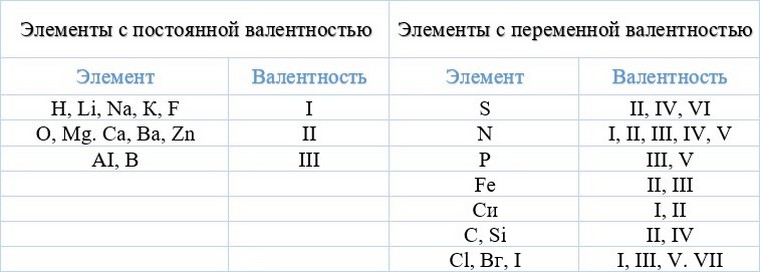
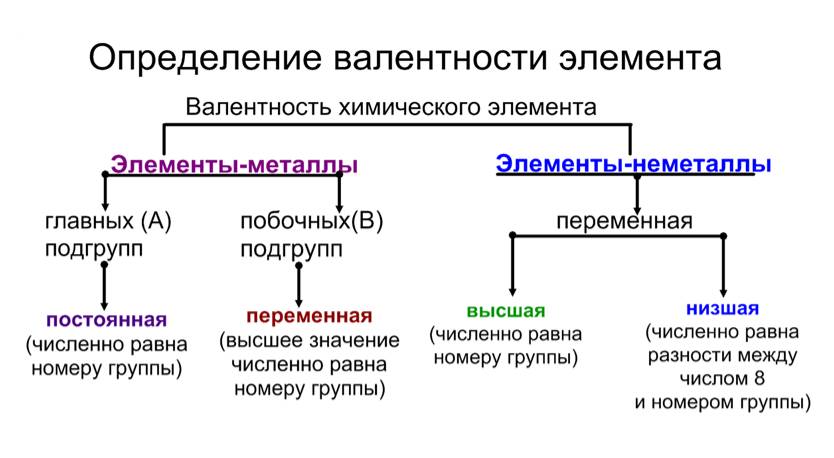 И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ.
И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ. е. валентность алюминия равна III. Это верный ответ.
е. валентность алюминия равна III. Это верный ответ. Химические элементы с переменной валентностью
Химические элементы с переменной валентностью 

 Используя понятие валентности и атомные соотношения составляют химические формулы.
Используя понятие валентности и атомные соотношения составляют химические формулы.  kz/ru/subject/ximiya/7-klass/valentnost-ximicheskie-formuly-raschet-otnositelnoj-molekulyarnoj-massy-soedineniya-po-formule
kz/ru/subject/ximiya/7-klass/valentnost-ximicheskie-formuly-raschet-otnositelnoj-molekulyarnoj-massy-soedineniya-po-formule
 — 1997. — № 3. — С. 53-57.
— 1997. — № 3. — С. 53-57. Примеры — сера, хлор, бром, йод, хром и другие.
Примеры — сера, хлор, бром, йод, хром и другие.
 Определить валентность с помощью химической формулы, содержащей не 1.
Определить валентность с помощью химической формулы, содержащей не 1.



 Напишите формулу соединения, образованного:
Напишите формулу соединения, образованного:
 Попробуйте другой браузер, если вы подозреваете это.
Попробуйте другой браузер, если вы подозреваете это.