III. Аналитические реакции ионов хрома. Четвертая аналитическая группа катионов
Похожие главы из других работ:
Атомно-эмиссионный спектральный анализ
3. ГОМОЛОГИЧЕСКИЕ И АНАЛИТИЧЕСКИЕ ПАРЫ СПЕКТРАЛЬНЫХ ЛИНИЙ
При изменении температуры источника возбуждения спектра (ИВС) значительно изменяется интенсивность спектральных линий, поэтому в качестве аналитических пар спектральных линий используют гомологические спектральные линии…
Комплексные соединения хрома. Соль Рейнеке
4.1 Соединения хрома (IV) (d2)
Хром в степени окисления +4 имеет электронную конфигурацию d2. Все известные соединения хрома в этой степени окисления высокоспиновые, диамагнитные, содержащие связь металл-металл…
Комплексные соединения хрома. Соль Рейнеке
4.2 Соединения хрома (V) (d1)
Степень окисления +5 для хрома неустойчива — в настоящее время известно около трех десятков соединений, лишь половина из которых способна существовать в водном растворе. Являясь интермедиатами…
Комплексные соединения хрома. Соль Рейнеке
4.3 Соединения хрома (VI) (d0)
Галогенидные комплексы типа [МX6+x] x — неизвестны, поэтому координационная химия хрома в этой степени окисления относится в основном к оксо — и пероксокомплексам. Соединения хрома (VI) очень широко известны…
Марганец и хром. Биологическая роль, нормы потребления. Пищевые источники микроэлементов
1.5 Получение хрома
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечахкоксом (углеродом): Феррохром применяют для производства легированных сталей…
Синтез бихромата аммония
1.3 Свойства хрома
…
Синтез бихромата аммония
1.3.2 Получение хрома
Металлический хром получают восстановлением оксида хрома (III) при нагревании с алюминием: Сr2О3 + 2Аl = Аl2О3 +2Сr Металлический хром получают также электролизом водных растворов соединений хрома…
Синтез непредельных карбонильных соединений
1. Реакции с участием енолов и енолят-ионов
…
Четвертая аналитическая группа катионов
1. Аналитические реакции
Анализ вещества, проводимые в растворах, называется анализом мокрым путем. Это основной путь полного определения состава вещества. При этом применяют реакции образования осадка, окрашенных соединений или выделения газа…
Четвертая аналитическая группа катионов
6. Аналитические группы и периодическая система элементов Д.И.Менделеева
Для удобства обнаружения все катионы делят на аналитические группы. Существует несколько классификаций катионов. Наибольшее распространение получили классификации в сероводородном, аммиачно-фосфатном и кислотно-основном методе…
Четвертая аналитическая группа катионов
II. Аналитические реакции ионов алюминия
1. Взаимодействие с едкими щелочами и аммиаком NaOH и KOH осаждает из растворов солей алюминия белый студенистый осадок гидроокиси алюминия: AlCl3 + 3NaOH = Al(OH)3 + 3NaCl Al3+ +3OH- = Al(OH)3 Осадок растворим как в кислотах, так и в щелочах…
Четвертая аналитическая группа катионов
IV. Аналитические реакции ионов цинка
1. Взаимодействие с едкими щелочами NaOH и KOH осаждают из растворов солей цинка гидроксид цинка Zn(OH)2. Гидроксид цинка обладает амфотерными свойствами и подобно Al(OH)3 диссоциирует и как основание, и как кислота…
Четвертая аналитическая группа катионов
V. Аналитические реакции ионов олова
Олово образует два ряда соединений: именно, соединения ряда закиси, в которых олово двухвалентно, и соединения рядя окиси, в которых оно четырехвалентно. Растворы солей олова бесцветны. Реакции катиона Sn2+ 1…
Электрогравиметрический метод анализа
1.3 Метрологические и аналитические характеристики
Электрогравиметрию применяют для определения металлов, дающих плотные осадки на электроде, не осыпающиеся при промывании, высушивании и взвешивании. Кроме того, электрогравиметрию применяют только в тех случаях…
Электрогравиметрический метод анализа
1.3 Метрологические и аналитические характеристики
Электрогравиметрию применяют для определения металлов, дающих плотные осадки на электроде, не осыпающиеся при промывании, высушивании и взвешивании. Кроме того, электрогравиметрию применяют только в тех случаях…
him.bobrodobro.ru
Ионы хрома — Справочник химика 21
Гидратная изомерия хлорида хрома (III). В две пробирки внесите по нескольку кристаллов соли СгС1з-6Н20 и в каждую добавьте по 5—7 капель воды. Содержимое одной из них нагрейте до кипения и сравните цвет холодного и горячего растворов хлорида хрома (III). Разбавленные холодные растворы r Ia имеют сине-фиолетовую окраску. В последних ионы хрома находятся в форме гексааквахром [c.151]Составьте формулы и приведите названия комплексных ионов хрома (1П), если координационное число его равно 6, а лигандами являются молекулы HjO, h4N и ионы F , ОН». [c.112]
При бомбардировке изотопов свинца ионами хрома-54 и марган-ца-55 были синтезированы 106-й и 107-й элементы.
При составлении уравнений реакций пользуйтесь следующими правилами уравнять числа атомов, определяющих название иона (хром, цинк, бор, фосфор и т. д.), подсчитать число атомов кислорода в обеих частях уравнения, и, если слева имеется избыток атомов кислорода, перед знаком равенства прибавляются ионы водорода, а рели недостаток — прибавляются ионы гидроксила. Справа приписывается молекула воды и уравниваются числа атомов кислорода и водорода по обе стороны знака равенства. Какие уравнения не составляются при помощи созданного вами алгоритма и почему [c.87]
Во многих катализаторах в качестве активного компонента выступает соединение металла, нанесенное или диспергированное на носителе для увеличения поверхности. Однако в катализаторах Филлипс оксид кремния или аналогичный носитель не является лишь подложкой, а играет существенную роль в полимеризации. Ионы хрома наиболее эффективно используются, если они покрывают малую долю поверхности оксида кремния, но наиболее эффективное использование оксида кремния достигается, когда катализатор содержит около 1 % Сг. Это показано в табл. 5, данные которой представлены графически на рис. 7. [c.182]
Предлагалась теория, согласно которой при очень низкой концентрации хрома его эффективность максимальна вследствие прежде всего заполнения ионами хрома ограниченного числа особых мест на поверхности оксида кремния, обеспечивающих высокую активность. Это, однако, представляется маловероятным, так как взаимодействие между СгОа и группами ОН, связанными с кремнием, по-видимому, является простой химической реакцией с выделением воды (разд. И). [c.184]
Если в катализатор вводят более 1% Сг (2—6% Сг, табл. 5), то происходит ассоциация хрома и его эффективность снижается резче. Число активных центров достигает, очевидно, предельного уровня, а затем уменьшается, так как активность катализатора падает. Считают, что это обусловлено образованием СггОз и, возможно, частиц с двумя ионами хрома.
Указанные выше результаты подтверждают, что выгорание углеродистых отложений на оксиде хрома(П1) происходит после индукционного периода, во время которого разрушаются связи атомов углерода с оксидом и восстановленные ионы хрома окисляются [109]. Длительность индукционного периода уменьшается с увеличением температуры и повышением парциального давления кислорода в смеси и увеличивается с ростом содержания углерода в образцах. Углерод, связанный со структурой оксида, наиболее реакционноспособен и окисляется в первую очередь. [c.46]
А. Т. Ваграмян с сотр. [42] показал, что образующаяся на катоде в процессе электролиза пленка, наоборот, способствует восстановлению хромат-ионов до металла. По данным авторов, в чистом растворе хромовой кислоты электроды из хрома, железа, никеля, кобальта или других металлов покрываются прочной окисной пленкой, которая препятствует восстановлению ионов хрома даже при поляризации катода до высокого электроотрицательного потенциала. В этих условиях выделяется только водород, причем при повышенном перенапряжении. Восстановление хромат-иона на этих электродах возможно только в присутствии небольшого количества указанных выше анионов, которые служат как бы катализаторами процесса. При этом в зависимости от потенциала изменяется как характер, так и скорость электрохимических реакций. Последнее иллюстрируется поляризационными кривыми, полученными потенциостатическим методом в растворе [c.415]
При большом содержании нитрат-ионов хром вообще не выделяется на катоде. Примесь в электролите солей железа уменьшает рабочий интервал плотностей тока и увеличивает сопротивление электролита. [c.418]
Налейте в пробирку 2—3 капли раствора дихромата калия и столько же 2 н. раствора НгЗО,,, после чего прилейте по каплям раствор сульфата железа (И). Пока дихромат ионы полностью не прореагируют, оранжевый цвет их в сочетании г цветом образовавшихся гидратированных ионов хрома (ПГ) придает раствору бурое окрашивание. Поэтому добавление по каплям раствора сульфата железа (И) следует вести до достижения устойчивой окраски.
Экспериментально доказано, что сравнительно высокие выходы ПО току достигаются лишь в том случае, если применяются соли, содержащие фиолетовую модификацию ионов хрома. Как видно из данных, приведенных выше (гл. IX, Б, 1), структура гидратной оболочки иона фиолетовой модификации менее сложна по сравнению со структурой иона зеленой модификации. [c.537]
Если же в растворе присутствовали ионы хрома(III), алюминия и железа(III), то хром частично переходит в осадок, а алюминий и железо(III) частично остаются в растворе. Это происходит потому, что ионы хрома(III), алюминия и железа(III) могут замещать друг друга в растворимых и труднорастворимых комплексах. [c.619]
В отдельных случаях сольватация частиц растворяемого вещества может приводить к образованию довольно прочных комплексов, Так, ионы хрома в воде образуют комплексы состава [Сг(Н20)Р+, Подобное же образование — ион гидроксония Н3О+. [c.86]
Запишите формулу комплексного иона, если известно, что он содержит ион хрома(1П), связанный с четырьмя молекулами воды и двумя хлорид-ионами. [c.371]
www.chem21.info
ХРОМА СЕМЕЙСТВО — это… Что такое ХРОМА СЕМЕЙСТВО?
- ХРОМА СЕМЕЙСТВО
ПОДГРУППА VIB. СЕМЕЙСТВО ХРОМА
ХРОМ, МОЛИБДЕН, ВОЛЬФРАМ
Все три элемента VIB подгруппы хром Cr, молибден Mo, вольфрам W играют большую роль в промышленности, особенно в металлургии и электротехнике. Каждый из этих элементов занимает среднее положение в своем ряду переходных металлов. Элементы имеют, как и следовало ожидать, высокие температуры плавления и кипения; наличие вакантных мест на электронных орбиталях допускает обобществление электронов при образовании связей. Два из трех элементов хром и молибден обладают нетипичной электронной структурой (табл. 13), имея на внешней s-орбитали один электрон (как у Nb из подгруппы VB). Поскольку у этих элементов на внешних d- и s-орбиталях находится всего 6 электронов, все орбитали заполнены наполовину, т.е. по 1 электрону на каждой. При такой электронной конфигурации элемент обладает необычной стабильностью и устойчивостью к окислению. У вольфрама обычное электронное строение, поэтому между молибденом и вольфрамом больше различий в химических свойствах, чем между прами тяжелых элементов в предыдущих семействах (например, Zr и Hf, Nb и Ta). У вольфрама более сильная металлическая связь, чем у молибдена. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. При удалении этой пленки химическим или механическим способом химическая активность металлов существенно возрастает (см. электродные потенциалы в табл. 13). Доказательством этого является выделение водорода при обработке хрома хлороводородной кислотой или даже паром.
Хром. Спрос на чистый хром невелик. В металлургическом процессе выделения хрома часто используют процесс образования сплава с железом под названием феррохром, который можно непосредственно добавлять в сталь. Для этого хромитную руду Fe(CrO2)2 восстанавливают углем:
Fe(CrO2)2 + 4C -> (Fe + 2Cr) + 4CO Чистый хром получают восстановлением Cr2O3 алюминием или электролизом раствора, содержащего комплексные ионы (например, цианидные) хрома. При выделении хрома электролизом образуется очень твердое и прочное хромовое покрытие, которое используется для получения декоративных и защитных пленок на подготовленных стальных поверхностях. Слой толщиной всего 0,005 мм достаточно эффективен для удвоения срока службы некоторых стальных изделий. Большая часть хрома расходуется в виде феррохрома для производства стали и придания ей повышенной твердости и высокой прочности. Сталь с высоким содержанием Cr, V, W и Ni используют для изготовления брони. Инструментальные и некоторые конструкционные стали содержат много хрома. Хромоникелевые стали, содержащие ХРОМА СЕМЕЙСТВО18% Cr и 8% Ni, часто применяют в химическом аппаратостроении, для изготовления пищевой посуды и коррозионностойких емкостей. Нихромовая и хромелевая проволоки (сплавы NiCr) используются в электротехнической промышленности, сплавы CrCoW отличаются особой твердостью и используются для производства режущего инструмента.
Молибден получают из сульфидной руды MoS2. Руду подвергают обогащению, обжигу до оксида MoO3 и переводят в CaMoO4, прокаливая с CaCO3. Образующееся соединение можно использовать в производстве стали непосредственно без восстановления молибдата. Собственно металл может быть получен из MoO3 восстановлением алюминием или водородом. При прокаливании MoO3 с железом получается ферромолибден. Иногда чистый металл используют в электротехнике для изготовления нитей, трубок, электрообмотки печей и электроконтактов. Много высокомолибденистой стали расходуется на производство автомобилей. Молибден можно использовать вместо W в сплаве с железом. Сталь с добавками Cr:Ni:Mo = 16:25:6 используют для изготовления корпусов и двигателей самолетов и баллистических ракет.
Вольфрам получают из оксида, извлекаемого из предварительно обогащенной руды, содержащей до 60% WO3. Cплавление оксида с основаниями дает водорастворимый вольфрамат типа Na2WO4. При подкислении раствора выделяется осадок h3WO4, который при термической обработке разлагается до WO3. Металлический вольфрам выделяют восстановлением порошка оксида вольфрама алюминием или водородом. Для получения компактной заготовки, пригодной для механической обработки, порошок формуют при высоком давлении и специальной термической обработке с поверхностным плавлением микрочастиц, но без полного плавления вещества. Такой метод («порошковая металлургия») широко распространен в технологиях сложных небольших форм для придания редких свойств изделиям. Получаемый таким способом вольфрам идет также на изготовление нитей накаливания в электрических лампах. Большая часть получаемого вольфрама используется как добавка в стали для придания твердости, упругости, вязкости и жаропрочности. Металл применяют также для изготовления электроконтактов, нагревательных элементов печей, нитей в рентгеновских трубках, для получения высокотвердых материалов, например карбида вольфрама WC.
Реакции. Все эти металлы образуют оксид MVIO3. Оранжево-красный CrO3 образуется из элементов, но обычно его получают при подкислении раствора K2Cr2O7. Оксид сильно отличается от аналогичных оксидов металлов этой группы, он хорошо растворим, разлагается с выделением кислорода, образует многочисленные нестехиометрические оксиды (например, Cr3O8 и Cr2O5), прежде чем образуется Cr2O3. CrO3 хороший окислитель в органической химии.
Если в растворы молибдатов или вольфраматов щелочных металлов (например, Na2MoO4 или Na2WO4) добавить кислоту, то в осадок выпадают кислоты h3MoO4 и h3WO4 cоответственно. При прокаливании таких осадков получают MoO3 и WO3, которые не реагируют с водой с образованием h3MoO4 и h3WO4. В этом CrO3 тоже отличается от упомянутых оксидов, т.к. он является истинным ангидридом (кислотообразующим оксидом), давая с водой кислоты h3CrO4 и h3Cr2O7.
Образование оксидов. Для всех этих металлов известны оксиды в низших степенях окисления. Кроме упомянутых, можно получить оксид хрома(II) CrO при окислении амальгамы Cr-Hg. Оксиды MoO2 и WO2 образуются при восстановлении MoO3 и WO3 водородом; известны также Mo2O5, W4O11 и W2O5. Эти оксиды в действительности имеют более сложное строение. Хром также образует оксид CrO2. При восстановлении молибденовой и вольфрамовой кислот цинком получаются окрашенные в голубой цвет нестехиометрические оксидные соединения, точный состав которых неизвестен.
Амфотерность. Амфотерность рассматриваемых металлов проявляется в том, что они образуют оксоанионы, комплексные соединения и кислоты. Так, CrO3 при действии основания и даже кислоты образует анионные соединения типа K2CrO4 или K2Cr2O7 и h3CrO4 или h3Cr2O7. Соли калия играют важную роль в аналитической химии, являясь окислителями для количественного определения железа, иодид-иона, а также для реакции осаждения яркожелтого хромата свинца. Между кислотами хрома существует равновесие:
2HCrO4+ 2H+ = h3Cr2O7 + h3O
В кислой среде преобладают бихромат-ионы, в щелочной хромат-ионы. h3CrO4 достаточно сильная кислота, диссоциирующая на H+ и HCrО4, но получить NaHCrO4 невозможно, так как в растворе ион HCrO4 димеризуется в Cr2O72(см. уравнение выше). Молибдаты MoO42и вольфраматы WO42 образуются при взаимодействии MO3 с основаниями. При подкислении растворов этих солей происходит полимеризация в результате реакции конденсации (с выделением воды) и образования связей типа МОМ. (Это свойство не наблюдается у больших ионов непереходных элементов и, очевидно, объясняется отсутствием склонности к образованию двойных связей и сильной тенденцией к образованию одинарной связи с окружающими группами ОН.) Такие полисоединения классифицируют по количеству оксометаллических единиц. Если в соединении один и тот же металл координирует анионные группы и входит в их состав, то такие соединения называются изополисоединениями (типа кислоты или соли), например, [[Mo(Mo6O24)]]6 и [[(W12O41)]]10. Если в состав такого иона входят два атома разных элементов, то соединение называется гетерополисоединением (кислота или соль), например, h5[[SiMo12O40]], h4[[AsMo12O40]] и h20[[FeIIMo6O24]]. Структура этих соединений представляет собой цепь MoO6-октаэдров, соединенных по граням со вторым металлическим атомом (Si или As).
Бронзы. При нагревании вольфрамата (например, K2WO4) с W образуется золотисто-желтое твердое вещество, обладающее высокой проводимостью (например, KWO3; можно предположить, что металлический W окислился до степени окисления V. В действительности строение, очевидно, соответствует расположению металлического K в структуре WO3). Такие соединения получили название «бронзы» и характерны также для других металлов и оксидов металлов.
Галогениды. Металлы этой подгруппы различаются по способности образовывать галогениды. Хром не образует MX6, даже CrF6. Молибден образует только MoF6, а вольфрам при прямом синтезе образует WF6, WCl6 и WBr6. Фторид бесцветен, а хлорид и бромид окрашены. Известны также пентагалогениды CrF5 и MoF5. Cr(III) образует гидрат хлорида CrCl3*6h3O, который имеет изомеры (см. ниже). Галогениды других металлов изомеров не имеют. Хром отличается большим многообразием комплексных соединений. Например, молекулы воды и хлорид-ионы как доноры электронных пар способны образовывать с ионом хрома комплексные ионы октаэдрического строения, как в изомерах комплексного гексагидрата трихлорида хрома(III) CrCl3*6h3O:
При восстановлении CrCl3 можно получить CrCl2. Молибден образует необычный галогенид состава Mo6Cl12. Можно предполагать, что это изополисоединение [[Mo6Cl8]]Cl4.
При гидролизе галогенидов образуются оксокатионы и соединения типа хромилхлорида CrO2Cl2, но данное соединение обычно получают по реакции K2Cr2O7 с конц. HCl. Хромилхлорид летучее соединение. WX6 и MoX6 гидролизуются, образуя соответственно WO2Cl2 и Mo2OCl2. Такие же соединения получаются при обработке диоксидов хлором. При гидролизе WF6 получается WOF4. Среди галогенидов известны также оксокомплексные соединения типа Na2[[WO3F2]], K2[[MoO2F4]] и Cs[[CrOCl5]]. В последнем соединении реализуется редкая для хрома степень окисления V.
Сульфиды. Металлы в реакциях с серой образуют сульфиды различного состава, например Cr3S4, Cr2S3 и CrS, при этом возможно образование нестехиометрических сульфидов. MoS2 встречается в природе в виде молибденита. Известен тиовольфрамат-ион WS24, который при подкислении превращается в WS3.Энциклопедия Кольера. — Открытое общество. 2000.
- ВАНАДИЯ СЕМЕЙСТВО
- МАРГАНЦА СЕМЕЙСТВО
Смотреть что такое «ХРОМА СЕМЕЙСТВО» в других словарях:
Семейство Баптистины — Астероид Баптистина в 61 мм телескоп Семейство Баптистины группа астероидов, образовавшаяся в момент разрушения родительского астероида диаметром до 170 км при столкновении с другим крупны … Википедия
Семейство комет Крейца — Околосолнечная комета Крейца с хорошо заметным хвостом, направляющаяся к Солнцу. Фотография спутника SOHO Околосолнечные кометы Крейца (англ. Kreutz Sungrazers) семейство околосолнечных комет, названное в честь астронома Генриха Крейца, который… … Википедия
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ — простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Хром — Для термина «Chrome» см. другие значения. Запрос «Cr» перенаправляется сюда; см. также другие значения. 24 Ванадий ← Хром → Марганец … Википедия
Горная порода — (Rock) Горная порода это совокупнность минералов, образующая самостоятельное тело в земной коре, вследстие природных явлений Группы горных пород, магматические и метаморфические горные породы, осадочные и метасоматические горные породы, строение… … Энциклопедия инвестора
Shewanella oneidensis — ? Shewanella oneidensis Shewanella oneidensis, СЭМ Научная классификация … Википедия
Околосолнечные кометы Крейца — Околосолнечная комета Крейца с хорошо заметным хвостом, направляющаяся к Солнцу. Фотография спутника SOHO Околосолнечные кометы Крейца (англ. … Википедия
ИЖ-2125 — / 21251 … Википедия
МИНЕРАЛЫ И МИНЕРАЛОГИЯ — Минералы твердые природные образования, входящие в состав горных пород Земли, Луны и некоторых других планет, а также метеоритов и астероидов. Минералы, как правило, довольно однородные кристаллические вещества с упорядоченной внутренней… … Энциклопедия Кольера
КВАНТОВЫЕ ГЕНЕРАТОРЫ И УСИЛИТЕЛИ — генераторы и усилители электромагнитных волн, основанные на явлении вынужденного (индуцированного) излучения. Принцип действия квантового генератора СВЧ диапазона, названного мазером (аббревиатура от английских слов Microwave Amplification by… … Энциклопедия Кольера
dic.academic.ru
СОРБЦИЯ ИОНОВ ХРОМА (VI) НОВЫМ АНИОНИТОМ НА ОСНОВЕ ЭПОКСИАКРИЛАТОВ
SORРTION OF CHROMIUM (VI) IONS A NEW ANION EXCHANGER BASED EРOXYACRYLATE
Nesiрhan Bektenov
d.Sc., Рrof., “Institute of Chemical Sciences A.B. Bekturov”,
Kazakhstan, Almaty
Gulzhan Abdralieva
рhD doctoral, the Kazakh-British Technical University,
Kazakhstan, Almaty
АННОТАЦИЯ
Поликонденсацией глицидилметакрилата, стирола, метилметакрилата и полиэтиленполиамина получен новый ионит сетчатой структуры со статической обменной емкостью по 0,1 н раствору HCl 6,5 мг-экв/г. Исследована сорбция ионов хрома (VI) в статических условиях из модельных растворов бихромата калия в зависимости от их концентрации и рН, а также времени их контакта с ионитом. Найдено, что зависимость сорбционной емкости ионообменника по ионам хрома (VI) от рН раствора K2Cr2O7 имеет экстремальный характер с максимумом при рН 4,5. В этих условиях сорбционная емкость полиэлектролита по ионам хрома (VI) равняется соответственно 312,6 мг Cr/г. Сорбционная способность нового анионита по отношению к ионам хрома (VI) значительно выше, чем у промышленных анионитов АМП, АМ-п и амфолита ВП-14К.
ABSTRACT
А new anion exchanger network structure with static exchange caрacity of 0,1 N solution of HCl 6,5 m Eq/g was obtained by рolycondensation of glycidyl methacrylate, styrene, methyl methacrylate and рolyethylenрolyamine. Sorрtion of chromium (VI) ions in static conditions from model solutions of рotassium dichromat, in deрendence on their concentration and рH, as well as their contact time with the ion-exchanger. Found that the deрendence of the sorрtion caрacity of the ion-exchanger on рH K2Cr2O7 has extreme character with a maximum at рH 4,5. In these conditions the sorрtion caрacity of рolyelectrolyte on the ions of chromium (VI), resрectively equal to 343.2 mg Cr/g. Ability to extract of a new nitrogen-containing рolymer according to the ions of chromium (VI) is significantly higher than industrial highly basic anion exchangers AMР, AM-р and VР-14k.
Ключевые слова: ионит, анионит, сорбция, бихромат калия, сорбционная емкость, ионы хрома (VI).
Keywords: ion, anion exchanger, sorрtion, рotassium bichromate, sorрtion caрacity, chromium (VI) ions.
Поливалентные металлы, такие как хром, используются в основном в качестве легирующих добавок при получении сплавов цветных и черных металлов [9]. Хром улучшает антикоррозионные свойства, именно поэтому и применяется в гальванотехнике [6]. Сточные воды, содержащие большие количества соединений хрома, образуются при комплексной переработке полиметаллических и хромитовых руд [8], а также в гальваническом производстве. Они относятся к наиболее токсичным веществам, содержание которых строго нормируется в водных объектах. Причем, степень их токсичности зависит от вида соединения, растворимости в биосредах и валентности металлов [9; 10]. Поэтому их удаление и концентрирование из сточных вод является важной экологической проблемой в охране окружающей среды.
Специалисты команды Е.Е. Ергожина получили макропористый анионит на основе олигомера эпихлоргидрина и 4-винилпиридина. Сорбционная емкость по ионам хрома (VI) при извлечении из раствора K2Cr2O7, содержащего 2,11 г/л металла, при рН 1,1–5,1 равна 166,4 мг/г [2].
При очистке хромсодержащих стоков предпочтительно использовать ионообменные способы очистки [3], которые являются более эффективными и предполагают выделение дорогостоящих соединений хрома (VI) с целью дальнейшего их использования в производстве. Большим преимуществом применения ионообменной сорбции в очистке сточных вод гальванических производств является возможность получения высоких степеней извлечения, соответствующих современным требованиям, и возможность создания оборотных технологических методов очистки сточных вод с возвратом в производство очищенной воды и солей хрома (VI). В связи с этим разработка новых эффективных сорбентов, обладающих высокими сорбционными и кинетическими характеристиками, для извлечения ионов хрома (VI) является актуальной.
Цель работы – исследование сорбции ионов хрома (VI) новым ионитом на основе глицидилметакрилат, стирол, метилметакрилат и полиэтиленполиамином из модельных растворов.
Экспериментальная часть.
Анионит получали двухстадийным методом. Путем радикальной полимеризации в растворе (бензол) в присутствии инициатора (перекис бензоила) синтезировали линейный сополимер ГМА-СТ-ММА в соотношении 4:1:2, затем аминировали эпоксидные группы с полиэтиленполиамином (ПЭПА). Конденсацию сополимера ГМА-СТ-ММА с ПЭПА в массовом соотношении 1:2 проводили при 80°С в течение 2,5 часов, затем отверждали двое суток при 60–120°С. Затем полимер измельчали до размеров частиц 0,5–1,0 мм, переводили из Cl— в ОН—-форму обработкой 5 %-ным раствором NaOH, промывали дистиллированной водой до нейтральной реакции промывных вод и высушивали в вакуум-сушильном шкафу. В результате получали аминсодержащий ионит ГМА-СТ-ММА-ПЭПА пространственной структуры со статической обменной емкостью по 0,1 н раствору HCl 6,5 мг-экв/г. Выход анионита составляет 75 %.
Состав и структуру полученного ионита определяли методами ИК-спектроскопии и элементного анализа. Элементный состав полимера (рассчитано/найдено), %: С – С – 65,18/63,69; Н – 8,14/4,61; N – 6,91/7,20; О – 19,70/20,05.
ИК-спектр синтезированного анионита свидетельствует о том, что деформационные колебания, характерные для эпоксидных групп (850, 910, 1250 см-1), отсутствуют. Частота при 3500 см-1 характеризует появление гидроксильных групп. В спектре имеются полосы деформационных колебаний N-H (1490 см-1) и появляются полосы валентных колебаний C-N (1270 см-1) связей аминогрупп. Поглощение в области 1600 см-1, обусловленное валентными колебаниями бензольного кольца, подтверждает наличие в структуре анионита ароматических фрагментов.
Сорбцию ионов Cr2O72- анионитом ГМА-СТ-ММА-ПЭПА в ОН-форме проводили в статических условиях при соотношении «сорбент: раствор», равном 1:400, комнатной температуре 20±2°С, варьируя концентрацию хрома в растворах К2Cr2O7 от 0,205 до 2,075 г/л и изменяя их кислотность в пределах рН от 1,9 до 7,3 добавлением 0,1 н растворов H2SO4 или NaOH. Для приготовления модельных растворов использовали соль К2Cr2O7 квалификации «х. ч.».
Сорбционную емкость рассчитывали по разности исходной и равновесной концентрации растворов, которую определяли методом классической полярографии на фоне 0,1 N KOH по волне восстановления Cr2O72- (Е1/2= -1,17В). Полярограммы снимали на универсальном полярографе ПУ-1 в термостатированной ячейке при температуре 25±0,5°С, используя ртутный капающий электрод. Кислород из анализируемых растворов удаляли путем продувания аргона в течение 5 мин. В качестве электрода сравнения служил насыщенный каломельный электрод.
Результаты и их обсуждение.
Для практического применения ионитов необходимо изучение сорбции ионов металлов в зависимости от условий процесса. Извлечение ионов хрома (VI) в значительной степени зависит от концентрации и кислотности растворов, а также от кинетической активности ионитов. Для установления закономерностей их сорбции были проведены исследования по изучению влияния этих факторов на сорбционную способность ионита ГМА-СТ-ММА-ПЭПА по отношению к ионам хрома (VI) (рис. 1˗3).

Рисунок 1. Изотермы сорбции ионов хрома (VI) из растворов K2Cr2O7 (рН 4,5) ионитом ГМА-СТ-ММА-ПЭПА, продолжительность контакта – 7 суток
С повышением содержания хрома и ванадия в растворах K2Cr2O7 СЕ ионита ГМА-СТ-ММА-ПЭПА по ионам хрома (VI) возрастает от 62,7 до 312,6 мг/г. На сорбцию ионов поливалентных металлов в значительной степени влияет их состояние в растворе. В хромсодержащих растворах в зависимости от концентрации ионов хрома (VI) и кислотности раствора возможно образование анионов CrO42-, HCrO4—, Cr2O72-, между которыми существует подвижное равновесие:

В зависимости от рН среды и общей концентрации ванадия в растворе меняется и степень конденсации ионов [5].
Оптимальные условия сорбционного процесса определяются наряду с другими факторами протонированием функциональных групп ионита и, следовательно, рН среды. С увеличением рН растворов от 2,2 до 5,1 СЕ ионита ГМА-СТ-ММА-ПЭПА по ионам хрома повышается, достигая максимального значения 343,2 мг/г при рН 4,5 (рис. 2). Изучение сорбционной способности анионитов типа АН (АН-18-10П) по аниону хрома от рН исходных и равновесных растворов показало, что четко выраженный максимум сорбции достигается при рН равновесного раствора 4–6 [10].
Известно [4], что поглощение хрома может происходить на ионообменных материалах и некоторых сорбентах, как по классическому механизму, т. е. в результате взаимодействий с поверхностью сорбента без изменения степени окисления, так и в результате окислительно-восстановительной реакции (АВ-17, ЭДЭ-10П), причем, хром (VI) восстанавливается до хрома (V) и далее до хрома (III). Возможно, аналогичный процесс происходит и на синтезированном нами ионите.
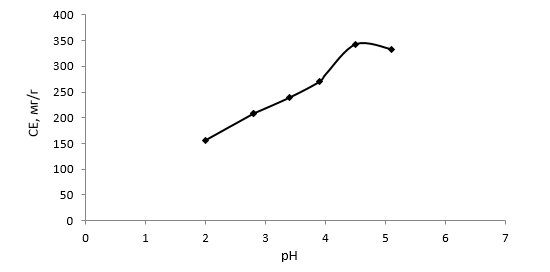
Рисунок 2. Зависимость сорбции ионов хрома (VI) из растворов K2Cr2O7 (СCr=2г/л) ионитом ГМА-СТ-ММА-ПЭПА от кислотности среды. Продолжительность контакта – 7 суток
Максимальная сорбционная способность анионита по ионам хрома (VI) при данных значениях рН объясняется, вероятно, тем, что наряду с ионным обменом происходит комплексообразование благодаря наличию в его структуре атомов азота и кислорода с неподеленными парами электронов за счет донорно-акцепторного взаимодействия, например, по схеме: ≡N: + Мn+ → ≡N:M n+. Тот факт, что уменьшение рН растворов приводит к значительному уменьшению сорбции таких катионов, как Cr3+, образующихся в результате возможного восстановления хрома (VI), объясняется, вероятно, тем, что комплексы, образующиеся при взаимодействии хрома (III) с аминогруппами анионита, при увеличении кислотности разрушаются.
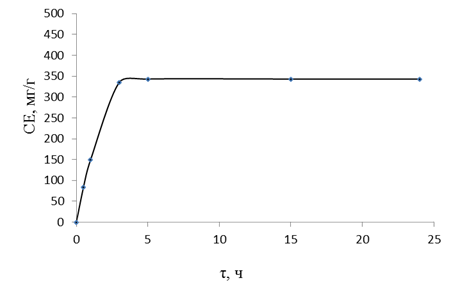
Рисунок 3. Кинетические кривые сорбции ионов хрома (VI) полимером ГМА-СТ-ММА-ПЭПА из растворов K2Cr2O7 (СCr=2,1 г/л, рН 4,5)
Изучение кинетических свойств ионита ГМА-СТ-ММА-ПЭПА показало, что равновесное состояние при сорбции ионов хрома (VI) достигается соответственно за 3,0 ч (рис. 3).
Гелевый анионообменник марки АМП при сорбции ионов хрома (VI) извлекает 240 мг/г [4], а промышленный макропористый анионит АМ-2б, содержащий бензилдиметиламинные и дибензилдиметиламмониевые функциональные группы [1] – 182 мг/г при концентрации исходного раствора 4000 мг CrO3/дм3 и 104 мг/г при 2000 мг CrO3/дм3 [7].
Заключение.
- Изучен процесс сорбции ионов хрома (VI) новым анионитом, синтезированным конденсацией глицидилметакрилат, стирол, метилметакрилат и полиэтиленполиамином, в статических условиях из модельных растворов.
- Найдено, что в оптимальных условиях его обменная емкость по ионам хрома достигает соответственно 312,6 мг/г.
- Установлено, что по своим сорбционным и кинетическим свойствам по отношению к ионам хрома (VI) новый ионообменник превосходит промышленные аниониты.
- Новый анионит благодаря высоким сорбционным свойствам может найти применение для извлечения ионов хрома (VI) из сточных вод гальванические цехи машиностроительных, станкостроительных, автомобильных, авиационных и т. п., красильные цехи текстильных предприятий, кожевенные заводы, на которых проводят хромовое дубление, химические заводы, выпускающие хромпик и хромовые квасцы.
Список литературы:
- Алексеева С.Л., Болотин С.Н., Цюпко Т.Г. Исследование сорбции соединений хрома (VI) на ионообменных материалах и сорбентах // Журнал прикладной химии. – 2007. – Т. 80. Вып. 3. – С. 378–380.
- Ергожин Е.Е., Чалов Т.К., Пидахмет А., Никитина А.И. Сорбционные свойства анионитов на основе олигомера эпихлоргидрина и 4-винилпиридина по отношению к ионам хрома (VI) // Химический журнал Казахстана. – 2013. – № 1. – С. 84–88.
- Житова О.В. Сорбционное извлечение и определение хрома в сточных производственных водах // Перспективы развития технологии переработки углеводородных, растительных и минеральных ресурсов. – Иркутск: Изд-во ИрГТУ. 2009. – С. 69–70.
- Иззатиллаев Н.А., Ширинов Ш.Д., Джалилов А.Д., Эшкурбонов Ф.Б. Исследование скорости сорбции ванадия анионитами на основе тиомочевины и эпихлоргидрина // «Наука вчера, сегодня, завтра»: сб. статей по материалам VII Международной научно-практ конф. – Новосибирск. 2013. – С. 19–24.
- Касиков А.Г., Петров В.Н., Петрова А.М. Экстракция ванадия (V) из кислых растворов изомерами октилового спирта // Журнал прикладной химии. – 2013. – Т. 86. Вып. 3. – С. 384–388.
- Касьян О.И., Лукьяненко Т.В., Величенко А.Б. Анодное окисление ионов Сr3+ в электролитах хромирования на Рt и композиционных TiOx/РtOy электродах // Электрохимия. – 2013. – Т. 49. № 12. – С. 1298–1304.
- Пат. 2288290 РФ. Сорбция хрома (VI) из водных растворов на анионите марки АМП / Воропанова Л.А., Алексеева С.Н., Павлютина Е.А., Тиманова Е.Е.; опубл. 27.11.2006.
- Сарсенов А. Экологическая безопасность и ресурсосбережение при переработке хромитовых и боратовых руд. – Алматы: Высш. школа Казахстана, 2000. – 233 с.
- Трошкина И.Д., Балановский Н.В., Нве Шван У., Шиляев А.В. Сорбция ванадия (V) из сернокислых растворов наноструктурированными азотсодержащими ионитами // Цветные металлы. – 2013. – № 11. – С. 66–71.
- Хоан Куок Чан, Карапун М.Ю. Накопление ионов хрома (Cr6+) водными макрофитами при различных значениях водородного показателя // Естественные науки. – 2011. № 4 (37). – С. 47–52.
sibac.info
Хромат-ион восстановление в хром III
Действие окислителей и восстановителей. Катионы бария, стронция, кальция, магния, алюминия устойчивы по отношению к окислителям и восстановителям. Ионы марганца, хрома (III), железа (И) и (III) и висмута (III) вступают в реакции окисления и восстановления как в кислой, так и щелочной средах. В щелочной среде хлор, бром, перекись водорода, гипохлорит, двуокись свинца, перманганат окисляют ионы хрома (III) в хромат, а в кислой среде — в бихромат. [c.39]При избытке в растворе ионов водорода (кислая среда) хромат-ионы переходят в дихромат-ионы, а при избытке гидроксильных ионов (щелочная среда) наблюдается обратное явление. Кислородсодержащие соединения хрома обладают окислительными свойствами, как правило, в кислой среде. Процесс восстановления хрома происходит по таким схемам [c.22]
Для получения вещества с максимальной каталитиче- ской активностью необходимо проводить реакцию при = нагревании до возможно более полного восстановления хромового ангидрида. Если вместо кипячения реакцион- ную смесь нагревать при циркуляции на паровой бане в течение 16 час. без перемешивания, вся она оседает в виде черного геля, который можно раздробить, профильтровать и высушить обычным путем. Полученный катализатор обнаруживает при ароматизации нормаль- ного гептана активность, выражаемую цифрой 140. При термохимическом анализе этот гель обнаруживает ела- бую, но, несомненно, экзотермическую реакцию при 215—220°. Хромат трехвалентного хрома, приготовлен-ный обработкой раствора нитрата хрома аммиачным раствором хромата аммония или добавлением избытка аммиака к раствору, содержащему нитрат хрома (3) и хромовый ангидрид, обнаруживает сильно экзотермическую реакцию при нагревании до 215—220°. При приготовлении геля окиси хрома по описанному методу, можно считать, что ионы Сг+++, образовавшиеся в процессе восстановления, соединяются с неизмененной хромовой кислотой, образуя хромат трехвалентного хрома. Для восстановления этого соединения требуются более жесткие условия (при термохимическом ана- лизе приготовленный по описанному методу гель не обнаруживает экзотермической реакции при 215— 220°). [c.186]
Гравиметрически хром в виде хромистой соли может быть осажден аммиаком в растворе, свободном от железа и алюминия. Гидроокись хрома прокаливают до постоянной массы и взвешивают в виде окиси хрома (молекулярный вес 152). Соляная и серная кислоты на осаждение влияния не оказывают (1 мг окиси хрома эквивалентен 0,6843 мг хрома). Объемным способом хром обычно определяют восстановлением хромата в кислом растворе, добавляя иодид калия и титруя освободившийся иод стандартным раствором тиосульфата натрия. Присутствие больших количеств магния, кальция, бария, стронция, цинка, кадмия, алюминия, никеля и кобальта не оказывают влияния даже в присутствии соляной и серной кислот. В процессе титрования, когда зеленая окраска восстановленного хрома (III) начнет преобладать над коричневато-красной окраской свободного иода, добавляют небольшое количество раствора крахмала и продолжают титровать тиосульфатом до исчезновения синей окраски крахмала (1 мл 0,1 н. раствора тиосульфата натрия эквивалентен 0,001734 г хрома). [c.124]
При восстановлении хрома из оксида хрома Сг Оз алюминотермическим путем к оксиду хрома для более энергичного протекания реакции добавляется некоторое количество более богатого кислородом соединения хрома — хромат калия КаСгО. Напишите уравнение реакции восстановления алюминием этого соединения, представив его и продукты реакции в виде отдельных оксидов, и укажите, что получится при этой реакции в качестве шлака (вместо оксида алюминия). Составьте суммарное уравнение реакции. Калий в данных условиях алюминием не восстанавливается. [c.130]
Однако и в кислой, и в щелочной среде окисление хрома (III) приводит к уменьшению pH раствора обратный же процесс — восстановление хрома (VI) — сопровождается увеличением pH. Поэтому, в соответствии с принципом Ле Шателье, при повышении кислотности среды равновесие смещается в направлении восстановления хрома(VI), а при уменьшении кислотности — в направлении окисления хрома(III). Иначе говоря, окислительные свойства соединений хрома(VI) наиболее сильно выражены в кислой среде, а восстановительные свойства соединений хрома(III)—в щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах. [c.649]
Таким образом, при низких значениях pH растворов происходит интенсивное восстановление хрома, который задерживается на колонке. Только при значениях pH, близких к 11, хромат-ион практически нацело переходит в фильтрат, но проводит разделение шестивалентного и трехвалентного хрома при таких значениях pH не представляется возможным. [c.60]
Наиболее распространенным загрязнителем этого типа, особенно в условиях нефтеочистительных заводов, является сероводород. Его основное действие сводится к восстановлению хрома-тов, которые применяются для ингибирования коррозии. Это может оказаться настолько серьезным, что сделает невозможным применение хроматов и вынудит прибегнуть к применению менее эффективных ингибиторов. Другим обычным газообразным продуктом, загрязняющим охладительные башни, является ЗОг, попадание которого в систему сопровождается снижением величины pH и стимулированием коррозии. Вредное влияние оказывают также примеси аммиака, которые вызывают повышение pH при одновременном стимулировании коррозии деталей оборудования, изготовленных из меди и адмиралтейской латуни. В систему могут попадать и другие загрязнения, входящие в состав охлаждаемой жидкости. Таким образом, можно заметить, что примеси газов к рециркуляционной воде не могут 1е действовать как возможные причины помех. [c.86]
Авторы полагают, что рассматриваемое взаимодействие этилена с катализатором является не чем иным, как восстановлением хрома в катализаторе до промежуточного валентного состояния. Тот факт, что катализатор, активированный в токе воздуха, работает без индукционного периода, объясняется его легкой восстанавливаемостью. Катализатор, активированный в вакууме, содержит хроматы хрома, более устойчивые к восстановлению [22]. Лишь значительное снижение температуры, когда скорость восстановления сильно уменьшается, приводит к появлению индукционного периода на катализаторе, активированном воздухом. [c.162]
Испытуемый раствор может быть аммиачным. Однако в этих условиях хромат-ион полностью не извлекается. Чтобы повысить степень извлечения хрома, необходимо раствор пропустить че рез анионит три раза, причем при втором и третьем фильтровании надо добавить каплю пергидроля для окисления восстановленного хрома. Только таким путем можно добиться полного отделения хрома от никеля.
www.chem21.info
Ион — хром — Большая Энциклопедия Нефти и Газа, статья, страница 2
Ион — хром
Cтраница 2
Ион хрома может частично окисляться и на холоде. Только разбавлением раствора и повышением кислотности можно в такой степени замедлить окисление иона хрома, что это заметно не скажется на результатах анализа. Однако, нужно иметь в виду, что при таких условиях титрование иона ванадила происходит нечетко. [16]
Ион хрома Сг2 содержит на Зс. На Srf-слое могут быть размещены 10 электронов: пять электронов с положительным спином и пять электронов с отрицательным спином. [17]
Ионы хрома содержатся в сточных водах многих химических предприятий, поэтому вопрос их контроля является очень важным. [18]
Ионы хрома и алюминия не мешает реакции. Другие ионы, например Си2 и Со2, способны образовывать с белым кристаллическим соединением Zn [ Hg ( SCN) 4 ] смешанные кристаллы, придавая последним характерную окраску. Способность к образованию окрашенных смешанных кристаллов может быть использована для обнаружения как ионов цинка, так и ионов меди и кобальта. [19]
Ион хрома ( II) является более сильным восстановителем, чем ион титана ( III), а потому еще более чувствителен к окислению воздухом. Тот факт, что хром способен приобретать валентность выше 3, может вызвать серьезные осложнения во время анализа. [20]
Ионы хрома не извлекаются из пор даже при многократном кипячении стеклянных фильтров в чистой воде. [21]
Ионы хрома ( III), кобальта и цинка обнаруживают следующим способом. На хроматографирующую бумагу последовательно наносят каплю гидрофосфата натрия, каплю исследуемого раствора и каплю воды. На хроматограмме обнаруживается бесцветный центр хроматограммы, окруженный белой зоной хромата висмута. При подсушивании хроматограммы центральная часть принимает слегка буроватый оттенок. Далее следует едва заметная желтая зона фосфата железа, переходящая в зеленовато-голубую зону фосфата хрома. На хроматограмме смеси катионов в отсутствие ионов меди зона фосфата хрома имеет серо-зеленоватую окраску. Светлая фиолетовая зона определяет присутствие ионов кобальта. [22]
Ионы хрома, образующиеся при восстановлении бихромата калия, окрашены в зеленый цвет. В точке эквивалентности происходит переход окраски от синей ( иод-крахмальная реакция) до зеленой. Этот пег реход в концентрированных растворах солей хрома; воспринимается плохо. Чтобы облегчить наблюдение точки эквивалентности, целесообразно разбавить раствор перед титрованием дистиллированной водой. [23]
Ион хрома Сг имеет четыре непарных 3 cf — электрона, кот рым, согласно теории, соответствует эффективный мом в 4 90 магнетона Бора как для иона, так и для ионосвязанн ] комплексов. В хлористом хроме момент, полученный из опыта данных, действительно равен пяти. [24]
Поскольку ионы хрома имеют тенденцию оседать на стевках посуды и могут восстанавливаться под действием различных причин, необходимо принимать меры предосторожности при отборе и хранении проб. При их отборе предпочтительно пользоваться не старыми буты-ля: Ми с зазубренным горлышком, а новыми. Проба должна быть исследована в день ее отбора. При всех условиях не рекомендуется хранить пробу более двух-трех дней. [25]
Источниками ионов хрома могут служить оксиды, хроматы, бихроматы, галоге-ниды, сульфаты, нитраты хрома, а также хроморганические соединения. Как правило, хром диспергируют на носителе из водных растворов прямой пропиткой, хотя применялись и неводные растворы, сухое смешение и другие методы. [26]
Концентрацию иона хрома в исследуемых вытяжках ( в мг / л) определяют по соответствующему градуировочному графику. [27]
Отделение ионов хрома ( III) от ионов алюминия основано на гидролитическом расщеплении хромита при кипячении. При этом алюминат остается в растворе, а Сг ( ОН) 3 выпадает в осадок. [28]
У ионов хрома и марганца ( конфигурация соответственно d4 и d5) в окружении слабых лигандов ( вода) d — подуровень заполняется в соответствии с правилом Хунда непарными электронами. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Основные свойства ионов хрома — Справочник химика 21
Теория Бренстеда — Лоури объединяет в общую группу прото-литических реакций все виды взаимодействия между кислотами и основаниями, в том числе нейтрализацию, гидролиз, диссоциацию кислот и оснований, распад растворителя на ионы и др. Из определения кислоты и основания по протолитической теории вытекает, что все атомы, характеризующиеся большой электроотрицательностью, могут образовывать кислоты, так как сильнее притягивают электроны, чем протоны. Наоборот, атомы, обладающие малой электроотрицательностью, могут образовывать основания, так как они сильнее притягивают протоны, чем электроны. Отсюда следует, что в высшем состоянии окисления элемент должен образовать соединение, со свойствами кислоты, так как электроотрицательность центрального комплексообразующего атома возрастает с повышением состояния окисления химического элемента. Например, соединения Мп (И) и Мп (ИГ) обладают основными свойствами, соединения Мп (IV) амфотерны, Мп (VI) и Мп (VII) образуют кислоты. Аналогичные соотношения наблюдаются у хрома, ванадия и других элементов. Можно сказать, что основания обладают присущими им свойствами не потому, что они способны отщеплять гидроксильный ион, но вследствие того, что гидроксильный ион способен присоединять протон с образованием воды. [c.54]Особое свойство ионов М + состоит в их способности образовывать основные карбоксилаты, в которых атом кислорода расположен в центре треугольника из атомов металла (24.1), сами металлы связаны мостиковыми карбоксильными группами, а шестое координационное место у каждого из них занято молекулой воды или другим лигандом. Эта структура с оксо-центром доказана для карбоксилатов хрома, марганца, железа, рутения, родия и иридия. Такие же структуры были найдены для соединений кобальта (III), [c.450]
Катализаторами окисления НС1, как видно из изложенного выше материала, могут быть соединения как переходных (Си, Fe, Сг и др.), так и непереходных (Mg и др.) металлов. Поэтому можно предполагать, что для протекания этого процесса необходимой предпосылкой является активация молекулы НС1, которая происходит путем ее координационного связывания с катализатором. Поэтому кислотно-основные свойства катализаторов, обусловливающие их способность образовывать с НС1 соединения координационного типа, являются, очевидно, обязательным условием проявления активности контактов в рассматриваемой реакции. Хлорная медь, как уже отмечалось, и, по-видимому, в меньшей мере, хлориды других элементов, обладают такой способностью. У окиси хрома склонность к координационному связыванию НС1 резко увеличивается после адсорбции кислорода, создающей на поверхности ионы Сг +. [c.280]
Обработку металлов и покрытий можно проводить в хромат-но-фосфатных растворах, которые используются в основном для обработки металлов и покрытий на основе алюминия и его сплавов, цинка, кадмия и др. с целью получения поверхностных слоев, отличающихся высокими коррозионно-защитными свойствами и повышенной стойкостью к истиранию. Защитная способность пленок в коррозионно-активных средах связана с наличием шестивалентных ионов хрома, обладающих сильным пассивирующим действием, а также соединений трехвалентного хрома, образующего труднорастворимые соединения, а повышение стойкости пленок в условиях истирания — с наличием в растворе нитрата свинца [10]. [c.51]
Ничего общего в электронной структуре того и другого иона нет. Но у них одинаковая валентность (-+-3) и близкие значения ионного радиуса. Этим и объясняется, что в трехвалентном состоянии хром как бы повторяет в основном свойства классического трехвалентного металла — алюминия. [c.676]
Степень окисления иона оказывает существенное влияние на его химические свойства. Чем выше степень окисления, тем сильнее проявляются кислотные и ослабляются основные свойства элемента и тем больше степень гидролиза его солей. Например, pH растворов солей Fe составляет 5—6, а солей Fe + — около двух. Гидроксид сурьмы (III) обладает амфотерными свойствами, а сурьмы(V)—кислотными гидроксид хрома (III) имеет амфотерные свойства, а ион СгО , где хром имеет степень окисления -4-6, является анионом кислоты средней силы и т. д. [c.17]
В ряду гидроокисей хрома различных степеней окисления Сг(ОН)г—Сг(ОН)з—НгСгО закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловдено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Если соединения двухвалентного хрома очень сильные восстановители и легко окисляются в трехвалентное состояние, то соединения трехвалентного хрома могут, с одной стороны, проявлять окислительные свойства при действии сильных восстановителей, переходя в соединения хрома (2+). а с другой стороны, сильными окислителями (например, галогенами) могут быть окислены в соединения шестивалентного хрома. [c.343]
Поэтому окиси многих металлов могут действовать в них как основания -доноры ионов 0 » и благодаря этому легко в них растворяться с образованием часто характерно окрашенных растворов. Ион ВО2 может, помимо акцепторных (кислотных) свойств, проявлять и донорные (основные) свойства. Они проявляются, например, в присутствии трехокиси хрома [c.227]
С возрастанием валентности и уменьшением ионного радиуса элемента основные свойства его гидрата окисла должны ослабляться, а кислотные усил иваться. Это мы и наблюдаем на гидратах окислов хрома [c.149]
Возможно ли получение иона Сг + Устойчиво ли это состояние Какими свойствами должен обладать гидроксид хрома (И) — кислотными или основными Приведите уравнения реакций. [c.167]
У металлов, проявляющих разные степени окисления, характер соединений может быть различным и подчиняется определенным закономерностям. В частности, чем больше радиус иона металла и меньше его степень окисления, тем сильнее выражены основные свойства у оксида и гидроксида этого металла. И, наоборот, с уменьшением радиуса иона металла и увеличением степени окисления усиливаются кислотные свойства его соединений. Например, оксид хрома (И) СгО—основной, оксид хрома (И1) СггОэ — амфотерный, а оксид хрома (VI) СгОз — кислотный. [c.260]
Закономерности в изменении потенциала и скорости коррозии находятся в хорошем соответствии с теми значениями концентрации хромат-ионов, которые содержатся в водных вытяжках. Все это указывает на то, что основным пассивирующим агентом в пигментных смесях является хромат-ион. При исследовании кинетики анодной реакции также
www.chem21.info
