3.Основные положения атомно-молекулярного учения
1.Химия как предмет естествознания Химия изучает ту форму движения материи, в которой происходит взаимодействие атомов с образованием новых определенных веществ.Химия-наука о оставе,строении и свойствах веществ, их превращении или явлениях, кот.эти превращения сопровождают.Современная химия включает:общую, органическую,коллоидную,аналитическую,физическую,геологическую,биохимию,химию строительных материалов.Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. соединяет физико-математические и биолого-социальные науки.
2.Класс неорганических соединений. Основные химические свойства кислот, оснований, солей. По свойствам неорганических соединений разделяеют на след. Классы
1.Все вещества состоят из молекул(корпускулы), при физических явлениях, молекулы сохраняются, при химических разрушаются.
2.Молекулы состоят из атомов(элементы), при химических реакциях атомы сохраняются.
3.Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида.
4. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
5.Химичские реакции заключаются в образовании новых веществ, из тех же самых атомов, из которых состоят первоначальные вещества.+6.молек. и атомы находятся в непрерывном движении, а теплота состоит во внутреннем движении этих частиц
. Атом — наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами
Химический элемент — вид атомов с одинаково полож. Зарядом ядра. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя. Простые вещества — это вещества, состоящие из атомов одного и того же химического элемента. 4.Основные законы химии(закон сохранения, постоянства состава,кратных отношений, закон Авагадро) Закон сохранения: Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Закон постоянства состава: (любое хим. Соединение имеет один и тот же количественный состав независимо от способа его получения)Соотношения между массами элементов, входящих в сотав данного соединения,постоянны и не зависят от способа получения этого соединения.
Закон кратных отношений: Если два элемента образут друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре при одинаковом давлении, содержится одно и то же число молекул.
5.
Закон Эквивалентов. Эквивалент
вещества—
это такое количество вещества,какое
взаимодействует с 1 молем атома водорода
или вытесняет такое же количество
атомов Н в хим. Реакций.
Vэ(Л/Моль)-
эквивалентный объем вещества, тоесть
то объем одного эквивалента вещества
в газообразном состояние.ЗАКОН.Все
вещества реагируют в химических реакциях
и образуются в эквивалентных количествах. Отношение
эквивалентных масс, объемов, реагирующих
или образующих вещества,прямо
пропорционально отнощению их
масс(объемов)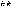 или
или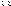
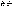 Э(простые)=А(атомная
масса)/В(валентность элемента)
Э(кислоты)=М(молярная
масса)/осн(основание кислоты) Э(Гидроксида)=М/Кисл)Кислотность
гидроксида) Э(аксиды
соли)=M/а(количество
атомов элемента образ. Оксид(соли)*в
(валентность этого элемента или металла)
Э(простые)=А(атомная
масса)/В(валентность элемента)
Э(кислоты)=М(молярная
масса)/осн(основание кислоты) Э(Гидроксида)=М/Кисл)Кислотность
гидроксида) Э(аксиды
соли)=M/а(количество
атомов элемента образ. Оксид(соли)*в
(валентность этого элемента или металла)6. Строение атомов. Ядро. Ядерные реакции. Виды излучения. Модель по резерфорду:1.практически вся масса сосредоточена в ядре 2.+ компенисруются – 3.заряд равен номеру группы. Простейшим –Н водород Современное понятие хим. Элемента-вид атомов с одинаково полож. Зарядом ядря атом состоит из положительно заряженного ядра и электронной оболочки. Электронная оболочка образована электронами. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 Число протонов, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
studfile.net
Основные положения атомно-молекулярного учения. Атом. Молекула.
Основные положения атомно-молекулярного учения. Атом. Молекула.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Первый определил химию как науку М. В. Ломоносов. Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории. Оно сводится к следующим положениям:
1. Каждое вещество состоит из мельчайших, далее физически неделимых частиц ( Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
2. Молекулы находятся в постоянном, самопроизвольном движении.
3. Молекулы состоят из атомов ( Ломоносов назвал их элементами).
4. Атомы характеризуются определенным размером и массой.
5. Молекулы могут состоять как из одинаковых, так и различных атомов.
Молекула — это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы в газах притягиваются друг к другу очень слабо, тогда как между молекулами жидких и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении. Этим явлением объясняется, например, изменение объема веществ при нагревании.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом — это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами. При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разновидности атомов одного и того же элемента с различной массой, называются изотопами. Поэтому, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия «химический элемент» и «простое вещество».
Вещество — это определенная совокупность атомных и молекулярных частиц в любом из трех агрегатных состояний.
Агрегатные состояния вещества — состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем).
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Химический элемент — это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами.
Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества — это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических — разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
examchemistry.com
Атомно — молекулярная теория
Атомно-молекулярное учение – совокупность положений, аксиом и законов, которые описывают все вещества как набор молекул, состоящих из атомов.
 Древнегреческие философы задолго до начала нашей эры в своих трудах уже выдвигали теорию существования атомов. Отвергая существование богов и потусторонних сил, они пытались объяснить все непонятные и загадочные явления природы естественными причинами – соединением и разъединением, взаимодействием и смешиванием невидимых человеческому глазу частичек – атомов. Но служители церкви на протяжении многих веков преследовали приверженцев и последователей учения об атомах, подвергали их гонениям. Но из-за отсутствия необходимых технических приспособлений философы древности не могли скрупулезно изучить природные явления, и под понятием «атом» у них скрывалось современное понятие «молекула».
Древнегреческие философы задолго до начала нашей эры в своих трудах уже выдвигали теорию существования атомов. Отвергая существование богов и потусторонних сил, они пытались объяснить все непонятные и загадочные явления природы естественными причинами – соединением и разъединением, взаимодействием и смешиванием невидимых человеческому глазу частичек – атомов. Но служители церкви на протяжении многих веков преследовали приверженцев и последователей учения об атомах, подвергали их гонениям. Но из-за отсутствия необходимых технических приспособлений философы древности не могли скрупулезно изучить природные явления, и под понятием «атом» у них скрывалось современное понятие «молекула».
Лишь в середине ХVIII века великий русский учёный М.В. Ломоносов обосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
М.В. Ломоносов четко разграничивал две ступени в строении вещества: элементы (в современном понимании – атомы) и корпускулы (молекулы). В основе его корпускулярно-кинетической теории (современного атомно-молекулярного учения) лежит принцип прерывности строения (дискретности) вещества: любое вещество состоит из отдельных частиц.
 В 1745 году М.В. Ломоносов писал: «Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел… Корпускулы есть собрание элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
В 1745 году М.В. Ломоносов писал: «Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел… Корпускулы есть собрание элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
Молекула является наименьшей частицей вещества, обладающей всеми его химическими свойствами. Вещества, имеющие молекулярную структуру, состоят из молекул (большинство неметаллов, органические вещества). Значительная часть неорганических веществ состоит из атомов (атомная решётка кристалла) или ионов (ионная структура). К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является комбинация элементарных частиц (ионы или атомы), то есть кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом – мельчайшая, далее химически неделимая составная часть молекулы.
Получается, молекулярная теория объясняет физические явления, которые происходят с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно-молекулярное учение. Сущность этого учения можно сформулировать в виде нескольких законов и положений:
- вещества состоят из атомов;
- при взаимодействии атомов образуются простые и сложные молекулы;
- при физических явлениях молекулы сохраняются, их состав не изменяется; при химических – разрушаются, их состав изменяется;
- молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются;
- атомы одного элемента сходны друг с другом, но отличаются от атомов любого другого элемента;
- химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.
Благодаря своей атомно-молекулярной теории М.В. Ломоносов по праву считается родоначальником научной химии.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
5) Возникновение и развитие атомно
Атомно-молекулярное учение зародилось в Древней Греции. Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом. Как же зародилась атомистика? Основным научным методом древнегреческих философов являлись дискуссия, спор. Для поиска “первопричин” в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет, если начать его дробить? Большинство философов считало, что этот процесс можно продолжать бесконечно. И только Левкипп (500—440 до н. э.) и его школа утверждали, что этот процесс не бесконечен: при дроблении в конце концов получится такая частица, дальнейшее деление которой будет просто невозможно. Основываясь на этой концепции, Левкипп утверждал: материальный мир дискретен, он состоит из мельчайших частиц и пустоты. Ученик Левкиппа Демокрит (460—370 до н. э.) назвал мельчайшие частицы “неделимые”, что по-гречески значит “атом”. Это название мы используем и сегодня. Демокрит, развил новое учение — “атомистику”, приписал атомам такие свойства, как размер и форму, способность к движению. Последователь Демокрита Эпикур (342—270 до н. э.) придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.
Ни одно из положений атомистики древних греков в то время не было доказано. Поэтому и по ряду других причин учение атомистов было надолго забыто. Атомисты не оставили после себя систематических трудов, а отдельные записи споров и дискуссий, которые были сделаны, лишь с трудом позволяли составить правильное представление об учении в целом.
Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. идеи древнегреческих атомистов были возрождены благодаря работам французского философа Пьера Гассенди (1592—1655 гг.). Почти 20 лет он потратил; чтобы восстановить и собрать воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах. В них воззрения древнегреческих материалистов впервые были изложены систематически, стали “учебником” для европейских ученых и философов. Возрождение древнегреческой атомистики совпадает по времени с установлением Р. Бойлем (1627—1691 гг.) фундаментальной закономерности, описывающей изменения объема газа от его давления. Качественное объяснение фактов,наблюдаемых Бойлем, может дать только атомистика: если газ имеет дискретное строение, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними.
Первая робкая попытка применения атомистики для объяснения количественно наблюдаемых явлений природы позволяет сделать два очень важных вывода:
1. Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно правильную трактовку самым разнообразным явлениям природы.
2. Для скорейшего превращения атомистики из философской гипотезы в научную концепцию доказательство существования атомов необходимо прежде всего искать при изучении газов, а не жидких и твердых веществ, которыми до этого занимались химики.
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ: водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения.
studfile.net
МИР ВОКРУГ НАС: Атомно — молекулярное учение
Мы уже знаем,что многие вещества состоят из молекул, а молекулы — из атомов. Сведения об атомах и молекулах объединяются в атомно-молекулярное учение. Вам известно, что основные положения этого учения были разработаны великим русским ученым М. В. Ломоносовым. С тех пор прошло более двухсот лет, учение об атомах и молекулах получило дальнейшее развитие. Так, например, теперь известно, что не все вещества состоят из молекул. Большинство твердых веществ, с которыми мы встретимся в неорганической химии, имеют немолекулярное строение.
Однако относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
4. Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движений.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
8. У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии.Задание
1. Выберите слайд с одним из положений Атомно-молекулярного учения. Подберите иллюстрации и примеры из жизни, доказывающие это положение.
Сроки выполнения: 25.01- 30.01.162.Оцените следующий после вашего слайд по следующим критериям:
1. Наличие иллюстрации, соответствующей данному положению. 0-1б
2. Подобранные факты доказывают данное положение. 0-1б
3. Материал изложен доступным языком. 0-1б
4. Эстетическое оформление (иллюстрация хорошего качества, текст читаем). 0-1б
5. Указаны данные участников группы. 0-1б
Оценки запишите в таблицу под презентацией.
Сроки выполнения: 01.02 — 07.02.16
Совместная презентация 8-1 класса
https://docs.google.com/presentation/d/1OF-hRpfcyt2tzedGGJyPahOjdBGFoOxGDvMCFdkIIug/edit?usp=sharinglara1972kav.blogspot.com
Атомно-молекулярное учение — Химия — СУЗ

Атомно-молекулярное учение

Положение № 1. Существуют вещества с молекулярным и немолекулярным строением
Вещества с молекулярным строением состоят из молекул, в твердом состоянии в узлах их кристаллической решетки находятся молекулы. Чаще всего это жидкости или газы, реже — твердые вещества с низкой температурой плавления и испарения (воск, парафин, вода, спирты, кислоты, эфиры, все газы).
Вещества с немолекулярным строением в основном твердые, обладают высокой температурой плавления и кипения (металлы).


Положение № 2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры
Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость.
Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше.
В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются

Положение № 3. Молекулы находятся в непрерывном движении
- Молекулы находятся в непрерывном хаотическом (тепловом) движении. Это доказывают такие явления как: Броуновское движение и Диффузия.
- Броуновское движение — это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Они движутся под влиянием беспорядочных ударов молекул.
- Диффузия — это явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
- В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров. жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между
молекулами на таких больших расстояниях
малы, и каждая молекула движется вдоль
прямой линии до очередного столкновения
с другой молекулой или со стенкой сосуда

Положение № 4. Между молекулами существуют силы взаимного притяжения и отталкивания
- Эти силы имеют электрическую природу, так как нейтрально заряженные молекулы имеют слабые электрические поля, которые действуют на заряженные частицы, входящие в состав других молекул.
- Эти силы короткодействующие и обнаруживаются только на расстояниях, сравнимых с размерами самих молекул.
- Опытно доказано, что когда мы сближаем две молекулы, вначале они притягиваются. Начиная с какого-то момента сила отталкивания становится больше и молекулы начинают отталкиваться. Это объясняется тем, что сила притяжения обратно пропорциональна расстоянию между ними в седьмой степени, а сила отталкивания – расстоянию в девятой степени

Положение № 5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении
Вещество (например, сахар) можно размолоть и все равно каждая крупинка будет состоять из огромного количества одинаковых молекул сахара и сохранит все известные нам свойства этого вещества. Даже если раздробить вещество на отдельные молекулы, как это происходит при растворении сахара в воде, то вещество продолжает существовать и проявлять свои свойства (в этом легко убедиться, попробовав раствор на вкус). Значит, самостоятельно существующая молекула сахара — это еще вещество под названием «сахар» (пусть даже очень маленькое количество этого вещества). Но если продолжить дробление дальше, то придется разрушить молекулы. А разрушив молекулы или даже отняв у них по паре атомов (из трех десятков, составляющих молекулу сахара!), мы уже разрушаем само вещество. Конечно, атомы никуда не исчезают — они начинают входить в состав каких-то других молекул. Но сахар как вещество при этом перестает существовать — он превращается в какие-то другие вещества

Положение № 6. Атомы одного вида отличаются от атомов другого вида массой и свойствами
- 1.1. Атомы одного вида отличаются от атомов другого вида массой:
* Зарядом ядра
* Числом протонов
* Числом нейтронов в ядре и числом электронов в электронной оболочке
* Числом электронов на внешнем уровне т.е. строением
- 1.2. Следовательно будут отличаться свойствами:
* Могут быть металлами и неметаллами
* Могут быть восстановителями или окислителями
* Различаются валентностью
* Различаются электроотрицательностью
Положение № 7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются
- Допустим мы поставим чайник на огонь. Через некоторое время вода начнет нагреваться, затем закипать. Мы услышим характерное шипение, из горлышка чайника будут вылетать струйки пара. Вода при определенной температуре, начинает превращаться в газ, меняет свое физическое состояние из жидкого на газообразное. Т. е. она осталась все той же водой, только теперь в виде пара.
- А в химических явлениях мы увидим, если опустим в кипяток пакетик с чайной заваркой. Вода в стакане или другом сосуде окрасится в красно-коричневый цвет. Произойдет химическая реакция: под воздействием тепла чаинки начнут запариваться, выделяя цветовые пигменты и вкусовые свойства, присущие этому растению. У нас получится новое вещество – напиток со специфическими, свойственными только ему качественными характеристиками.
- Таким образом, химические явления – это такие, при которых одни вещества превращаются в другие. Т. е. молекулы разрушаются и превращаются в другие. А в физических молекулы сохраняются

Положение № 8. У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы
У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые при нагревании разрываются.
Поэтому вещества с молекулярным строением , как правило, имеют низкие температуры плавления

Положение № 9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы
Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления
multiurok.ru
Урок химии по теме Атомно-молекулярное учение
Конспект урока по химии 8 класса
Атомно-молекулярное учение
Борисова Ольга Дмитриевна,
педагог дополнительного образования
Цели и задачи урока
Сегодня вы познакомитесь с основными положениями атомно-молекулярного учения и выясните его значение для науки химии.
Атомы и молекулы
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы – молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике. Осознать значение числа радиуса атомного ядра очень сложно. Например, радиус атома углерода равен 1,5–10 м. Возьмите карандаш (графит – это углерод), проведите отрезок прямой линии длиной 3 см.
Как вы думаете, сколько атомов углерода содержится в проведенной вами линии? Полученная линия содержит 100 мл атомов углерода в длину и около 1 мл в ширину.
Рассмотрим пример с сахаром: Какими свойствами обладает сахар? Представим, что крупинки сахара это молекулы. Раздробим молекулы до атомов. А сейчас смотрим, мы размельчили наши «молекулы», свойства сахара изменились? Какой вывод мы можем сделать? Какое определение вы дадите молекуле и атому с химической точки зрения.
Атом (от греч. atomos – неделимый) – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Атом сохраняется во всех химических превращениях и является носителем свойств химического элемента.
Вид атомов с одинаковым зарядом ядра и идентичными химическими свойствами называется химическим элементом. В настоящее время известно более 110 химических элементов, 89 из которых встречаются в природе, остальные получены искусственным путем.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей. Молекула сохраняет все свойства данного вещества.
И молекул и атомов не видно даже под микроскопом, но они реально существуют.
Однако подобные представления о строении вещества сформировались много веков назад, когда человечество пыталось ответить на вопрос: можно ли из одного вещества в процессе химических превращений получить какое угодно другое вещество или в этом имеются определенные ограничения?
Поскольку увидеть устройство вещества невозможно, то ученые стали создавать модели (помните, мы тоже пытались представить себе невидимый объект?).
Итак, модель 1 — Аристотеля (384-322 гг. до н.э.): огонь, вода, воздух и земля — неделимые элементы, которые могут превращаться друг в друга, а также соединяться, образуя новые более сложные тела. Соединение элементов с противоположными свойствами невозможно (земля и воздух, огонь и вода). Иными словами, из одного вещества можно получить любое другое, главное — подобрать соответствующие условия!
Модель 2 — Демокрита (460 — 370 гг. до н.э.): вещество нельзя делить до бесконечности пополам. Предел такого деления — атом (греч. atomos — неделимый). Благодаря особенностям своей формы и размера, они могут объединяться, образуя вещества. Иными словами, из одного вещества невозможно получить какое угодно другое вещество.
М.В.Ломоносов
Модель Аристотеля просуществовала много веков, модель Демокрита забыли довольно быстро, поскольку не могли найти доказательств существования атомов. Несколько поколений ученых посвятили свои исследования экспериментальному доказательству атомно-молекулярного строения вещества, в том числе и наш соотечественник М.В.Ломоносов (1711-1765).
В результате была сформулирована атомно-молекулярная теория, основными положениями которой пользуются до сих пор и физики, и химики:
1. Вещества состоят из молекул.
2. Между молекулами есть промежутки.
3. Молекулы находятся в постоянном движении.
4. Молекулы состоят из атомов.
5. В ходе химических реакций атомы не изменяются (не делятся).
Атомно-молекулярное учение имеет исключительное значение для развития науки. Считают, что химия действительно стала наукой в то время, когда химические реакции стали истолковывать с точки зрения атомно-молекулярного учения.
Более двухсот лет назад М.В. Ломоносов объявил изучение строения вещества главной задачей химии. За это время его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена.
Значение атомно-молекулярного учения состоит в том, что на нем базируются современные научные представления о строении материи, о свойствах веществ, о природе физических и химических явлений.
Атомно-молекулярное учение, превратившись из догадок и предположений в научную теорию, является мощным инструментом для правильной трактовки самых разнообразных явлений природы.
Выводы:
Атомно-молекулярное учение – это теоретическая основа химии.
Атомно-молекулярное учение сложилось из атомного и молекулярного учений.
Основные положения атомно-молекулярного учения сформулированы М.В. Ломоносовым.
Закрепление
1. Укажите формулу вещества, отличающуюся от других(лишнее):
N2
Cl2
Р
О2
2. Укажите формулу вещества, отличающуюся от других:
HCl
H2О
H2
HNO3
3. Какие эксперименты иллюстрируют основные положения атомно-молекулярной теории?
infourok.ru