Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Что такое расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Что такое расчеты массы (объема, количества вещества) продукта реакции? Какой алгоритм поиска массы растворенного вещества, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
формула расчета массы растворенного вещества, зная массу раствора и его концентрацию
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе.
m(р-ра) = ρ(р-ра) ∙V(р-ра)
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
n(в-ва) = m(в-ва)/M(в-ва), где М — молярная масса вещества
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
n(A)/n(B) = k(A)/k(B)
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Расчет количества продукта по данным раствора другого вещества
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
V(газа) = Vm ∙ n(газа) = n(газа) ∙ 22,4 л/моль
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(h3SO4) = w(h3SO4) ∙ m(р-ра h3SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(h3SO4) = m(h3SO4) / M(h3SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
h3SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты.
n(BaSO4)/n(h3SO4) = k(BaSO4)/k(h3SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(h3SO4) ∙ k(h3SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + h3S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(h3S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и h3S соответственно
Следовательно:
n(h3S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(h3S) = Vm ∙ n(h3S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Концентрация массовая: что это такое и как правильно рассчитать
Концентрация смеси выражает содержание в ней составляющих компонентов. Показатель дает возможность определить содержание конкретного вещества в растворе. Чаще всего используются такие виды концентрации растворов: массовая, объемная, массовые доли, молярная концентрация.
Показатель дает возможность определить содержание конкретного вещества в растворе. Чаще всего используются такие виды концентрации растворов: массовая, объемная, массовые доли, молярная концентрация.
Что такое раствор?
Большинство веществ, которые нас окружают, не являются чистыми. Как правило, это смеси, которые содержат в своем составе несколько компонентов, находящихся в одном или разных состояниях (жидкость, газ, твердое вещество). Смеси, которые имеют однородный состав, называются гомогенными, если состав неоднородный, – гетерогенными. Гомогенные смеси – это растворы, когда одно вещество (растворитель) полностью растворяет другое. Растворитель является компонентом раствора, который в получившейся смеси сохраняет свое состояние, как правило, его количество наибольшее.
Растворы могут быть газовыми, жидкими, твердыми.
Концентрация раствора бывает качественной и количественной. Качественная концентрация определяет растворы насыщенные, ненасыщенные, перенасыщенные. Количественная концентрация раствора выражается через доли вещества, которые входят в его состав.
Количественная концентрация раствора выражается через доли вещества, которые входят в его состав.
Массовая концентрация
Показатель характеризует растворенное вещество. Массовая концентрация выражается в граммах, которые содержатся в 100 грамм раствора.
Каждая смесь может содержать разное количество растворителя и растворенного вещества. Если количество второго в отношении растворителя достаточно большое, раствор будет концентрированный, если меньше – слабый.
Концентрация раствора – важная характеристика при его описании. Важно установить, процентное содержание растворенного вещества в полученном растворе. Так, если масса раствора 110 г, масса вещества 10 г, то для расчета его концентрации нужно 10/110х100%. В результате получится, что концентрация раствора составляет около 9,09 процентных единиц.
Используется концентрация растворов, чтобы описать массовую долю вещества, которое в нем растворяется (w), как отношение его массы е общей массе всего раствора. Выражается массовая доля в процентах или долях, как единица безразмерная.
Выражается массовая доля в процентах или долях, как единица безразмерная.
Если раствор имеет массу 200 г, в нем содержится 50 г растворенного вещества, то массовая доля последнего будет составлять 25% или 0,25 доли (50/200=0,25). Также можно рассчитать массовую долю растворителя. Для этого требуется выполнить такие действия: 200-50=150 г, а затем 150/200=0,75. Таким образом, массовая доля растворителя составит 75% или 0,75 долей.
Отсюда следует, что для расчета массовой доли веществ в составе раствора используется следующая формула: w(вещества) = m(вещества)/m(раствора). Зная массовую долю вещества, можно найти его массу по формуле: m(вещества) =w(вещества) х m(раствора).
Сумма массовых концентраций раствора (растворителя включительно) образует его плотность. Если химическое вещество чистое, массовая концентрация такая же, как и его плотность (масса/объем). Отсюда следует, что массовая концентрация компонента в смеси – это его плотность.
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Как найти массу растворителя если известна масса раствора – ООО ДХЗ
Опубликовано: 17. 02.2022
Время чтения: 2 минуты
1121
02.2022
Время чтения: 2 минуты
1121
Растворимость соединений, состоящих в одном гомологическом ряду значительно уменьшается в случае увеличения молекулярной массы, это связано с тем, что межмолекулярные силы взаимодействия повышаются.
К примеру, бензол способен полностью смешаться с этанолом, тогда как этанол и антрацен смешиваются только частично. Влияние молекулярной массы на общую растворимость особенно заметно в макромолекулах. Например, ацетон, спирт и концентрированная уксусная кислота способны легко растворить стирол, однако не могут растворить полистирол; винилацетат без проблем растворяется в эфирах и насыщенных углеводородах, но с поливинилацетатом такое не наблюдается. В спиртах не растворяется целлюлоза, в эфирах – полиэтиленгликоль, в винилхлориде – поливинилхлорид, в ацетонитриле – полиакрилонитрил, хотя наличие химического родства между этими полимерами и мономерами очевидно.
Из-за большой молекулярной массы структурированные полимеры не способны раствориться в растворителях даже при высокой температуре. Одна они способны набухать в присутствии растворителей в зависимости от плотности и природы поперечных связей.
В растворах общее соотношение количеств растворителя и растворенного вещества бывает разным. Если же количество растворенного вещества в отношении к растворителю довольно большое, то этот раствор называется концентрированным. В противном случает этот раствор считается слабым.
Масса раствора представляет собой сумму масс растворителя и растворенного вещества. К примеру, если 10 г сахара растворить в 100 г воды, то масса всего раствора составит 110 г. При описании любого раствора очень важной характеристикой считается его концентрация, т.е. сколько процентов занимает растворенное вещество в растворе. Например, если масса растворителя 647 равна 10 г, а масса раствора 110 г, то для нахождения концентрации 647 растворителя нужно 10 г разделить на 110 г, а результат умножить на 100%.
Концентрация растворов точно описывает массовую долю всего растворенного вещества (w) – отношение всей массы растворенного вещества к массе раствора. Следует отметить, что именно отношение к массе самого раствора, а не к общей массе растворителя. Массовая доля выражается в процентах и в долях (безмерная величина).
Если же масса раствора будет составлять 200 г, а масса растворенного вещества в данном растворе равняется 50 г, то рассчитать массовую долю очень просто – 50/200 = 25% или 0,25. Также легко можно найти массовую долю самого растворителя. Она будет равна 200-50 = 150 г, таким образом, 150/200 = 75% или 0,75.
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I)
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
Поскольку А = Vp, формула (1) будет иметь вид:
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4)
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(8)
(9)
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
К оглавлению
см. также
Способы выражения концентраций
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества.
 Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества. - Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029 = 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mh3O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Тема №8965 Решение задач на приготовление растворов приблизительной концентр
Алгоритм нахождения массы растворенного вещества и массы воды, необходимые для приготовления раствора.
Задача.
Вычислить массу соли и воды, необходимые для приготовления 40 г раствора NаСl с массовой долей 5%.
1. Запишите условие задачи с помощью общепринятых обозначений
Дано:
m р-ра = 40г
ω = 5%
m (NаСl) — ?
m (Н2О) — ?
Решение:
1. Рассчитайте массу растворенного вещества по формуле:
m в-ва= ω ∙ m р-ра/100%
m (NаСl) = 5% · 40г/100% = 2г
2. Найдите массу воды по разности между массой раствора и массой растворенного вещества:
m р-ля = m р-ра – m в-ва
m (Н2О) = 40г – 2г = 38 г.
3. Запишите ответ.
Ответ: для приготовления раствора необходимо взять 2г соли и 38г воды.
Алгоритм нахождения массовой доли растворенного вещества
при разбавлении (упаривании) раствора
Задача
К 15% раствору, масса которого 80г, добавили 30г воды. Какой стала массовая доля растворённого вещества в полученном растворе?
Какой стала массовая доля растворённого вещества в полученном растворе?
1. Запишите условие задачи с помощью общепринятых обозначений.
Дано:
ω1 = 15%
mр-ра1=80г
m(Н2О) = 30г
ω2-?
Решение:
1. В результате разбавления (упаривания) раствора масса раствора увеличилась (уменьшилась), а вещества в нём осталось столько же.
Рассчитайте массу растворённого вещества, преобразуя формулу:
ω = m в-ва /m р-ра ∙ 100%
m в-ва = ω1· mр-ра1 /100%
m в-ва = 15% · 80г = 12г
2. При разбавлении раствора общая масса его увеличивается (при упаривании — уменьшается).
Найдите массу вновь полученного раствора:
m р-ра2 = m р-ра1 + m(H2O)
m р-ра2 = 80г + 30г=110г
3. Рассчитайте массовую долю растворённого вещества в новом растворе:
ω2 = m в-ва / m р-ра2 ∙ 100%
ω2 = 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Запишите ответ
Ответ: массовая доля растворенного вещества в растворе при разбавлении равна 10,9%
Алгоритм решения задач по «правилу креста»
Для получения раствора с заданной массовой долей (%) растворенного вещества путем смешивания двух растворов с известной массовой долей растворенного вещества пользуются диагональной схемой («правило креста»).
Сущность этого метода состоит в том, что по диагонали из большей величины массовой доли растворенного вещества вычитают меньшую.
a с – в \ / с / \ в а – с | где а – большая, в – меньшая, с – искомая массовая доля (%) растворенного вещества в растворе |
Разности (с-в) и (а-с) показывают, в каких соотношениях нужно взять растворы а и в, чтобы получить раствор с.
Если для разбавления в качестве исходного раствора используют чистый растворитель, например, Н20, то концентрация его принимается за 0 и записывается с левой стороны диагональной схемы.
Задача
Для обработки рук хирурга, ран, послеоперационного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330 г йодной настойки с массовой долей йода 5%?
1. Запишите условие задачи с помощью общепринятых обозначений.
Дано:
ω1 = 30%
ω2 = 2,5%
ω3 = 5%
m3 = 330г
m1 = ?
m2 = ?
Решение:
1. Составьте «диагональную схему». Для этого запишите массовые доли исходных растворов друг под другом, по левую сторону креста, а в центре заданную массовую долю раствора.
2,5
\ /
5
/ \
30
2. Вычитают из бóльшей массовой доли меньшую (30–5=25; 5–2,5=2,5) и находят результаты.
Записывают найденные результаты с правой стороны диагональной схемы: при возможности сокращают полученные числа.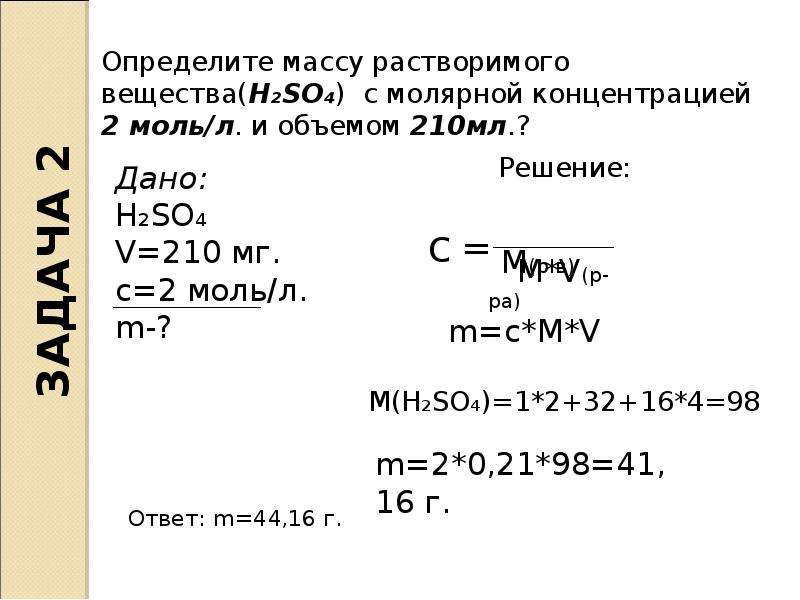 В данном случае 25 в десять раз больше, чем 2,5, то есть вместо 25 записывают 10, вместо 2,5 пишут 1.
В данном случае 25 в десять раз больше, чем 2,5, то есть вместо 25 записывают 10, вместо 2,5 пишут 1.
30 2,5 (1)
\ /
5
/ \
2,5 25 (10)
Числа (в данном случае 25 и 2,5 или 10 и 1)называют массовыми числами. Массовые числа показывают, в каком соотношении необходимо взять исходные растворы, чтобы получить раствор с массовой долей йода 5%.
3. Определите массу 30% и 2,5% раствора по формуле:
m р-ра = число частей · m3/ сумму массовых частей
m1(30%) = 1· 330г /1+10 = 30г
m2(2,5%) = 10 · 330г/ 1+10 = 300г
4. Запишите ответ.
Ответ: для приготовления 330 г раствора с массовой долей йода 5% необходимо смешать 300 г раствора с массовой долей 2,5% и 30 г с массовой долей 30%.
Алгоритм решения задач на приготовление раствора из кристаллогидрата
Задача
Определить массу кристаллогидрата Na2CO3∙ 10H2O и воды, которые необходимо взять для приготовления раствора массой 540 г. с массовой долей карбоната натрия 15%.
с массовой долей карбоната натрия 15%.
1. Запишите условие задачи с помощью общепринятых обозначений.
Дано:
m р-ра = 540г
ω (Na2CO3) = 30%
m (Na2CO3∙ 10H2O) = ?
m(Н2О) = ?
Решение:
1. Определите массу карбоната натрия Na2CO3, содержащегося в 540 г. раствора
m в-ва = ω1· m р-ра /100%
m (Na2CO3) = 15% ∙ 540 г. /100% = 81 г.
2. Сделайте пересчет рассчитанной массы на кристаллогидрат. Для этого рассчитайте молярные массы Na2CO3 и Na2CO3∙ 10H2O
М (Na2CO3) = 106 г/моль
М (Na2CO3∙ 10H2O) = 286 г/моль
Отсюда по формуле m = n∙ M найдите массы Na2CO3 и Na2CO3∙ 10H2O, приняв количество вещества n равным 1 моль
m (Na2CO3) = 106 г.
m (Na2CO3∙ 10H2O) = 286 г.
3. Вычислите массу кристаллогидрата, составив отношение:
в 286 г. Na2CO3∙ 10H2O содержится 106 г. Na2CO3,
а в х г. Na2CO3∙ 10H2O —————— 81 г. Na2CO3
х = 286∙ 81/ 106 = 219 г. – масса Na2CO3∙ 10H2O, необходимая для приготовления раствора.
4. Вычислите массу воды:
m(Н2О) = m р-ра – m в-ва
m(Н2О) = 540 – 219 = 321 г.
5. Запишите ответ:
Ответ: для приготовления раствора потребуется 219 г. Na2CO3∙ 10H2O и 321 г. воды
Задачи для самостоятельного решения
1. В 100 г. теплой воды растворили 150 г. нитрата серебра. Рассчитайте его массовую долю (процентную концентрацию) в растворе.
нитрата серебра. Рассчитайте его массовую долю (процентную концентрацию) в растворе.
а) 40%
б) 60%
в) 67%
г) 150%
2. Сколько граммов хлорида натрия надо добавить к 200 г. 10% — ного раствора, чтобы получить 20% — ный раствор?
а) 10 г.
б) 20 г.
в) 25 г.
г) 200 г.
3. Рассчитайте массу хлороводорода в 200 мл. 20% — ной соляной кислоты (плотность раствора 1,1 г/мл).
а) 36,4 г.
б) 44 г.
в) 909 г.
г) 1100 г.
4. Из 200 г. 15% — ного раствора сахарозы выпарили 50 г. воды. Определите массовую долю сахарозы в оставшемся растворе.
а) 11,25 %
б) 12 %
в) 20 %
г) 25 %
5. При охлаждении 150 г. 40% — ного раствора вещества выпало 15 г. осадка (не содержащего воды). Осадок отфильтровали. Определите концентрацию полученного раствора.
а) 33,3 %
б) 30 %
в) 36 %
г) 44,4 %
6. В 16 % — ном растворе сульфата магния содержится 0,2 моль соли. Рассчитайте массу раствора
Рассчитайте массу раствора
а) 3, 84 г.
б) 96 г.
в) 150 г.
г) 3750 г.
7. Смешали 250 г. 20% — ного раствора соляной кислоты и 100 мл. 30% — ного раствора той же кислоты (плотность 1,15 г/мл). Определите массовую долю (%) HCl после смешивания. ( Ответ: 23,1 %)
8. Какую массу воды надо прибавить к 200 мл. 30%-ного раствора гидроксида натрия (ρ=1,33г/мл.) для получения 10 % — ного раствора щелочи?
9. В 200 воды растворено 25 г. медного купороса CuSO4∙ 5H2O. Какова концентрация сульфата меди (II) в полученном растворе? (Ответ: 7,1%)
10. Приготовить 100г. 5 % — ного раствора MgSO4 из кристаллогидрата MgSO4 ∙ 7Н2О.
11. Сколько мл. 12%-ного и 6%-ного растворов серной кислоты потребуется для приготовления 600 г. 8%-ного раствора?
12. При ожоге кожи кислотой, для нейтрализации применяют 3%-ный раствор гидрокарбоната натрия. Сколько граммов раствора, содержащего
25 % этой соли и воды понадобится для приготовления 100 г. 3%-ного раствора.
3%-ного раствора.
13. Для нейтрализации щелочи, попавшей в глаза, применяют 2%-ный раствор борной кислоты. Сколько граммов раствора, содержащего 5% этой кислоты, понадобится для приготовления 500 г. 2%-ного раствора?
14.Формалин – это 40% раствор формальдегида. Сколько граммов 65%-ного раствора формальдегида и воды нужно взять для приготовления 500 г. формалина
Проверочные задачи по теме
«Решение задач на приготовление растворов приблизительной концентрации»
Вариант 1.
1. В медицинской практике применяют водные растворы перманганата калия разной концентрации. Рассчитайте массу KМnO4 и объем воды, необходимые для приготовления 100г. 3%-ного раствора перманганата калия.
2. При ожогах щелочами пораженный участок кожи в течение 10-15 минут обмывают водой, а затем нейтрализуют раствором с массовой долей уксусной кислоты 2%. Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 2%-ного раствора массой 600г.?
Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 2%-ного раствора массой 600г.?
3. Сколько граммов Na2SO4 ∙ 10H2O надо растворить в 800мл. воды, чтобы получить 10%-ный раствор Na2SO4? ( Ответ: 234,6г)
Вариант 2.
1. В медицине применяется 5%-ный спиртовой раствор йода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10г. кристаллического йода? Плотность раствора 0,950г/мл.
2. Сколько мл. 12%-ного раствора серной кислоты и воды потребуется для приготовления 600 г. 8%-ного раствора?
3. Для приготовления 5%-ного раствора MgSO4 взято 400г MgSO4∙ 7Н2О. Найти массу полученного раствора. (Ответ: 3,90кг)
Вариант 3.
1. Какие массы соли и воды необходимо взять для приготовления 500г. 0,9% -ного раствора NaCl? Такой раствор называется физиологическим и широко используется в медицинской практике.
2. Для обработки рук хирурга, ран, операционного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330г йодной настойки с массовой долей 5%?
3. Определить массовую долю CuSO4 в растворе, полученном при растворении 50г медного купороса CuSO4∙ 5Н2О в 450г воды. (Ответ: 6,4%)
Вариант 4.
1. Для смазывания десен приготовлен раствор из 5 мл. 30%-ного раствора Н2О2 и 15 мл. дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе. (Плотность раствора принять равной 1 г/мл.)
2. При некоторых аллергических заболеваниях взрослым назначают раствор с массовой долей хлорида кальция CaCl2 10%, детям – с массовой долей CaCl2 – 5%. Рассчитайте массу 10 %-ного и 2%-ного растворов CaCl2, которые необходимы для приготовления 400г. 5%-ного раствора CaCl2.
5%-ного раствора CaCl2.
3. В какой массе воды нужно растворить 25г CuSO4∙ 5Н2О, чтобы получить 8%-ный раствор CuSO4? (Ответ:175г)
Эталоны ответов к проверочной работе по теме
«Решение задач на приготовление растворов приблизительной концентрации»
Вариант 1
1. ω = m р.в./ mр-ра ∙ 100%
m р.в = ω ∙ mр-ра / 100%
m (KМnO4) = 3% ∙ 100 г./100%
m (KМnO4) = 3 г.
m (Н2О) = 100 – 3 = 97 г.
V (Н2О) = 97 мл.
Ответ: m (KМnO4) = 3 г, V (Н2О) = 97 мл.
2. 60 2
2
0 58
m 60% = 2 ∙ 600/60 = 20 г.
m (Н2О) = 58 ∙ 600/60 = 580 г.
Ответ: m 60% = 20 г. , m (Н2О) = 580 г.
, m (Н2О) = 580 г.
3. М (Na2SO4 ∙ 10H2O) = 322 г/моль
М (Na2SO4 ) = 142 г/моль
m р.в = ω ∙ mр-ра / 100%
m р.в = 10% ∙ 800 г./100%
m (Na2SO4 ) = 80 г.
322 г. Na2SO4 ∙ 10H2O — 142 г. Na2SO4
х г. — 80 г.
х = 322 ∙ 80 /142 = 181, 4 г.
Ответ: m (Na2SO4 ∙ 10H2O) = 181, 4г.
Вариант 2
1. ω = m р.в./ mр-ра ∙ 100 %
m р.ра = mр.в. ∙ 100%/ ω
m р.-ра = 10 г.∙ 100% / 5%
m р.-ра = 200 г.
V = m / ρ
V = 200 г. / 0, 950 г/мл = 210, 5 г.
Ответ: V (5%-ного спиртового раствора йода) = 210, 5 г.
2.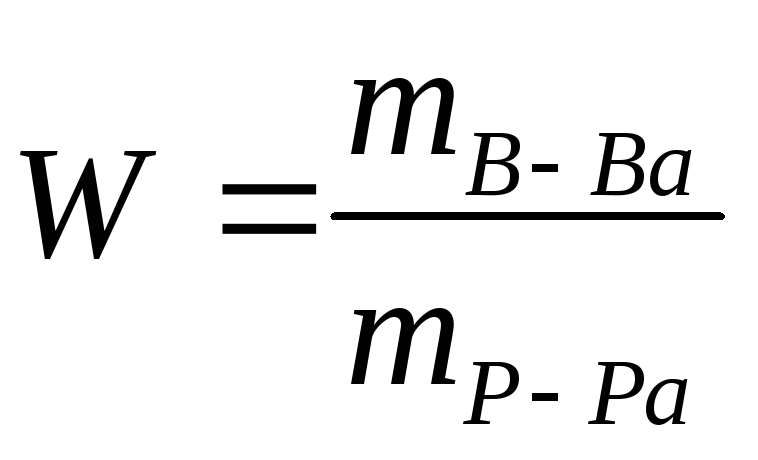 12 8
12 8
8
0 4
m 12% = 8 ∙ 600/12 = 400 г.
m (Н2О) = 4 ∙ 600/12 = 200 г.
V = m / ρ
V12% = 400 г. /1, 08 = 370 мл
V (Н2О) = 200 г. /1 г/мл = 200 мл
Ответ: V 12% = 370 мл, V (Н2О) = 200 г.
3. М (MgSO4∙ 7Н2О) = 246 г/моль
М (MgSO4) = 120 г/моль
246 г. MgSO4∙ 7Н2О — 120 г. MgSO4
400 г. — х г.
х = 400 ∙ 120 / 246 = 195 г.
m р.ра = mр. в. ∙ 100%/ ω
m р.ра = 195 г. ∙ 100%/ 5% = 3900 г.
Ответ: m (р-ра) = 3,90кг
Вариант 3
1. m р.в = ω ∙ mр-ра / 100%
m (NaCl) = 0,9 ∙ 500г. / 100% = 4,5 г.
m (Н2О) = 500 – 4,5 г. = 495,5 г.
Ответ:m (NaCl) = 4,5 г. , m (Н2О) = 495,5 г.
, m (Н2О) = 495,5 г.
2. 2,5 25
5
30 2,5
m 2,5% = 25 ∙ 330 /27,5 = 300 г.
m 30% = 2,5 ∙ 330 / 27,5 = 30 г.
Ответ: m 2,5% = 300 г., m 30% = 30 г.
3. М (CuSO4 ∙ 5Н2О) = 250 г/моль
М (CuSO4) = 160 г/моль
250 г. CuSO4∙ 5Н2О — 160 г. CuSO4
50 г. — х г.
х = 50 г.∙ 160 г. / 250 г. = 32 г.
ω = m р.в./ mр-ра ∙ 100%
ω = 32 г../ 500 г. ∙ 100% = 6, 4%
Ответ: ω = 6,4%
Вариант 4
1. m р-ра1 = 5 мл ∙ 1 г/мл = 5 г.
m р.в = 30% ∙ 5 г. / 100% = 1,5 г.
m р.в.2 = 5 г. + 15 г. = 20 г.
ω = m р.в./ mр-ра ∙ 100%
ω = 1,5 г.. / 20 г. ∙ 100% = 7, 5 г.
/ 20 г. ∙ 100% = 7, 5 г.
Ответ: ω = 7,5 %
2. 10 3
5
2 5
m 10% = 3 ∙ 400 / 8 = 150 г.
m 2% = 5 ∙ 400 / 8 = 250 г.
Ответ: m 10% = 150 г., m 2% = 250 г.
3. М (CuSO4 ∙ 5Н2О) = 250 г/моль
М (CuSO4) = 160 г/моль
250 г. CuSO4 ∙ 5Н2О — 160 г. CuSO4
25 г. — х г.
х = 25 г. ∙ 160 г. / 250 г. = 16 г.
m р.ра = mр. в. ∙ 100% / ω
m р.ра = 16 г. ∙ 100% / 8% = 200 г.
m (Н2О) = 200 г. – 25 г. = 175 г.
Ответ: m (Н2О) = 175 г.
Решение задач на приготовление растворов приблизительной концентрации
Вариант 1.
Часть А
Выберите один правильный вариант ответа
1. Массовая доля ( % ) растворенного вещества в растворе, полученном при растворении 40 г. нитрата серебра в 200 г. воды, равна
Массовая доля ( % ) растворенного вещества в растворе, полученном при растворении 40 г. нитрата серебра в 200 г. воды, равна
а) 8,35
б) 10,0
в) 16,7
г) 20,0
2. Масса соли, которую необходимо растворить в 50 мл. воды для приготовления 20%-ного раствора
а) 10 г.
б) 12,5 г.
в) 20,0 г.
г) 25,0 г.
3. Из 200 г. 15% — ного раствора сахарозы выпарили 50 г. воды. Определите массовую долю сахарозы в оставшемся растворе.
а) 11,25 %
б) 12 %
в) 20 %
г) 25%
Часть В
4. В медицинской практике применяют водные растворы перманганата калия разной концентрации. Рассчитайте массу KМnO4 и объем воды, необходимые для приготовления 100г. 3%-ного раствора перманганата калия.
5. При ожогах щелочами пораженный участок кожи в течение 10-15 минут обмывают водой, а затем нейтрализуют раствором с массовой долей уксусной кислоты 2%. Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 2%-ного раствора массой 600г.?
Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 2%-ного раствора массой 600г.?
6. Сколько граммов Na2SO4 ∙ 10H2O надо растворить в 800мл. воды, чтобы получить 10%-ный раствор Na2SO4? ( Ответ: 234,6г)
Решение задач на приготовление растворов приблизительной концентрации
Вариант 2.
Часть А
Выберите один правильный вариант ответа
1. Массовая доля ( % ) растворенного вещества в растворе, полученном при растворении 20 г. сахара в 140 мл. воды, равна
а) 6,25
б) 12,5
в) 18,75
г) 20,0
2. Масса щелочи, которую необходимо растворить в 50 г. воды для приготовления 10%-ного раствора
а) 5,6 г.
б) 6,25 г.
в) 10,0 г.
г) 12,5 г.
3. При охлаждении 150 г. 40% — ного раствора вещества выпало 15 г. осадка (не содержащего воды). Осадок отфильтровали. Определите концентрацию полученного раствора.
а) 33,3 %
б) 30 %
в) 36 %
г) 44,4 %
Часть В
4. В медицине применяется 5%-ный спиртовой раствор йода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10г. кристаллического йода? Плотность раствора 0,950г/мл.
5. Сколько мл. 12%-ного раствора серной кислоты и воды потребуется для приготовления 600 г. 8%-ного раствора?
6. Для приготовления 5%-ного раствора MgSO4 взято 400г MgSO4∙ 7Н2О. Найти массу полученного раствора. (Ответ: 3,90кг)
Решение задач на приготовление растворов приблизительной концентрации
Вариант 3.
Часть А
Выберите один правильный вариант ответа
1. Массовая доля (%) глюкозы в растворе, содержащем 280 г. воды и 40 г. глюкозы.
а) 14,3
б) 16,6
в) 12,5
г) 7,0
2. Какая масса хлорида железа (III) содержится в 200 мл. раствора с массовой долей FeCl340 %? Плотность раствора 1,13г/мл.
а) 90,4 г.
б) 80,0 г.
в) 70,8 г.
г) 5,0 г.
3. Из 400 г. 20 %-ного при охлаждении выделилось 50 г. растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
а) 22, 3 %
б) 28 %
в) 7,5 %
г) 8,6 %
Часть В
4. Какие массы соли и воды необходимо взять для приготовления 500г. 0,9% раствора NaCl? Такой раствор называется физиологическим и широко используется в медицинской практике.
5. Для обработки рук хирурга, ран, операционного поля используется йодная настойка с массовой долей 5%. В каком массовом соотношении нужно смешать растворы с массовыми долями йода 2,5% и 30%, чтобы получить 330г йодной настойки с массовой долей 5%?
6. Определить массовую долю CuSO4 в растворе, полученном при растворении 50г медного купороса CuSO4∙ 5Н2О в 450г воды. (Ответ: 6,4%)
Эталоны ответов на тестовые задания
Решение задач на приготовление растворов приблизительной концентрации
Часть А | Часть С | |
Вариант I | 1. 2. б 3. в мах – 6 балла | 4. – 2 балла mр..в.= mр-ра∙ ẃ / 100% mр..в.= 100г.∙ 3% / 100% = 3г. m (Н2О) = mр-ра— mр..в. m (Н2О) = 300-3 = 97г. V (H2O) = 97мл. Ответ: 3 г., 97 г. 5. – 5 баллов 60% 2 2% 0% 58 m(эссенции) = 2 ∙ 600 / 60 = 20 г. Ответ: 20 г. 6. – 7 баллов М(Na2SO4)=142г/моль М(Na2SO4∙ 10Н2О)= 322г/моль 0,1=х / х+800 х =89 г. 322 — 142 х=322 ∙ 89 / 142 = 201,8 г. х — 89 мах – 14 баллов |
Вариант II | 1. 2. а 3. а мах – 6 баллов | 4. – 2 балла mр-ра = mр.в. ∙ 100% / ẃ mр-ра = 10 ∙ 100 / 5 = 200 г. Vр-ра = m / ρ = 200 / 0,950 = 210,5.г. Ответ: 210,5 г. 5. – 5 баллов 12% 8 8% 0% 4 m (Н2О) = 4 ∙ 600 / 12 = 200 г. m (12%) = 8 ∙ 600 / 12 = 400 г. Vр-ра = m / ρ 6. – 7 баллов M(MgSO4) = 120 г/моль M(MgSO4 ∙ 7H2O) = 246 г/моль 400 – х х = 195,12 г. 246 – 120 mр-ра = mр.в. ∙ 100% / ẃ mр-ра = 195,12 ∙ 100 / 5 = 3902 г. (3, 90 кг) Ответ: 3,90 кг. мах – 14 баллов |
Вариант III | 1. 2. а 3. г мах – 6 баллов | 4. – 2 балла mр..в.= mр-ра∙ ẃ / 100% m(NaCl) = 500 ∙ 0,9 / 100 = 4,5г. m (Н2О) = mр-ра— mр..в. m (Н2О) = 500 – 4,5 = 495, 5г. Ответ: 4,5 г., 495,5 г. 5. — 5 баллов 2,5% 25 5% 30% 2,5 m(2,5%) = 25 ∙ 330 / 27,5 = 300 г. m(30%) = 2,5 ∙ 330 / 27,5 = 30 г. Ответ: 300 г., 30 г. 6. – 7 баллов M(CuSO4) = 160 г/моль M(CuSO4∙ 5H2O) = 250 г/моль 250 — 160 х = 50 ∙ 160 / 250 = 32 г. 50 — х ẃ = mр.в./ mр-ра ∙ 100% ẃ = 32 / 500 ∙ 100% = 6,4% Ответ: 6,4 % мах — 14 баллов |
Как рассчитать массовую концентрацию | Химия
Расчет массовой концентрации
Этап 1: Определите массу растворенного вещества.
Шаг 2: Определите объем раствора.
Шаг 3: Разделите массу растворенного вещества на объем раствора, чтобы найти массовую концентрацию раствора.
Словарь и формула расчета массовой концентрации
Решение: Когда соединения полностью смешиваются и становятся однородной смесью, такая смесь называется раствором.
Растворенное вещество: Растворенное вещество – это вещество, растворенное в растворе.
Растворитель: Растворитель – это вещество, растворяющее растворенное вещество в растворе.
Массовая концентрация: Мера растворенного вещества в граммах на 1 литр или 1 миллилитр раствора. $$\text{Концентрация (г/л)} = \frac{\text{масса растворенного вещества (г)}}{\text{объем общего раствора (л)}} $$
Давайте попрактикуемся в расчете концентрации растворенного вещества в граммах на литр на следующих двух примерах.
Расчет массовой концентрации Пример
15 г хлорида натрия растворяли в воде. Общий объем раствора хлорида натрия составил 0,75 л. Какова массовая концентрация раствора хлорида натрия в г/л?
Общий объем раствора хлорида натрия составил 0,75 л. Какова массовая концентрация раствора хлорида натрия в г/л?
Этап 1: Определите массу растворенного вещества.
Масса растворенного вещества 15 грамм.
Шаг 2: Определите объем раствора.
Общий объем раствора 0,75 л.
Шаг 3: Разделите массу растворенного вещества на объем раствора, чтобы найти массовую концентрацию раствора.$$\begin{выравнивание} \text{Концентрация (г/л)} &= \frac{\text{масса растворенного вещества (г)}}{\text{объем всего раствора (л)}} \\\\ &=\frac{15 \text{ г}}{0,75 \text{ литров}} \\\\ &= 20 \text{ г/л} \end{выравнивание} $$ Концентрация раствора NaOH 20 г/л.
Расчет массовой концентрации Пример
20,4 г хлорида лития растворяли в воде. Общий объем раствора хлорида лития составлял 100 мл. Какова массовая концентрация раствора хлорида лития в г/мл?
Этап 1: Определите массу растворенного вещества.
Масса растворенного вещества 20,4 грамма.
Шаг 2: Определите объем раствора.
Общий объем раствора 100 миллилитров.
Шаг 3: Разделите массу растворенного вещества на объем раствора, чтобы найти массовую концентрацию раствора. $$\begin{выравнивание} \text{Концентрация (г/л)} &= \frac{\text{масса растворенного вещества (г)}}{\text{объем всего раствора (л)}} \\\\ &=\frac{20,4 \text{ г}}{100 \text{ миллилитров}} \\\\ &= 0.204 \text{ г/мл} \end{выравнивание} $$ Концентрация раствора LiCl 0,204 г/мл.
Получите доступ к тысячам практических вопросов и пояснений!Определение, Формула, Примеры ~ ChemistryGod
Массовая концентрация — например, молярная концентрация, моляльность, массовая доля — является величиной для измерения концентрации растворенного вещества в растворе. Это отношение массы растворенного вещества, присутствующего в растворе, к объему раствора.Он говорит нам, сколько растворенного вещества присутствует в данном объеме раствора. Давайте попробуем разобраться на примере кофе.
Давайте попробуем разобраться на примере кофе.
Простой растворимый кофе готовится путем смешивания кофе и сахара в горячей воде. На обычную чашку (250 мл) кофе нам нужно 10 г кофе и 5 г сахара. Сумма может варьироваться в зависимости от личного выбора. Для приготовления двух чашек (500 мл) нам понадобится вдвое больше ингредиентов по массе — 20 г кофе и 10 г сахара. Точно так же нам понадобится 100 г кофе и 50 г сахара на десять чашек.
| Кубок кофе | Масса кофе | Масса сахара | Масса сахара | Масса кофе на чашку | Масса сахара на чашку |
|---|---|---|---|---|---|
| 1 (250 мл) | 10 г | 5 г | 10 г | 5 г | 5 г |
| 2 (500 мл) | 20 г | 10 г | 10 г | 5 г | |
| 3 (750 мл) | 30 г | 15 г | 10 г | 5 г | 5 г |
| 10 (2500 мл) | 100 г | 50 г | 10 г | 5 г | |
| 5 г |
из вышеуказанного стола мы можно увидеть, что масса каждого ингредиента на чашку (250 мл) остается постоянной. В химии мы называем это массовой концентрацией, массой ингредиента на единицу объема.
В химии мы называем это массовой концентрацией, массой ингредиента на единицу объема.
Содержание
Определение
Массовая концентрация растворенного вещества определяется как масса растворенного вещества на единицу объема раствора.
Формула
Формула массовой концентрации выглядит следующим образом.
Здесь ρ i — массовая концентрация i -го растворенного вещества, m i — масса i -го растворенного вещества, V -го растворенного вещества, решение.
Примечание: Массовая концентрация и плотность обозначаются как ρ . Это может сбить с толку. Обе величины можно отличить друг от друга с помощью нижнего индекса, например, ρ i для массовой концентрации и ρ для плотности.
Единицы
Единицей массовой концентрации в системе СИ является кг·м −3 . Эквивалентными единицами измерения кг м -3 являются г л -1 , г дм -3 и мг мл -1
и мкг м -3 .
Объяснение
Согласно приведенному выше определению, отношение массы растворенного вещества к объему раствора является массовой концентрацией.
В химических лабораториях химические вещества обычно измеряются в граммах, а объем раствора в мл или л. Таким образом, мы можем переопределить определение как граммы растворенного вещества на мл (или л) раствора. Это более практичное определение.
0,90 г л -1 раствора NaCl содержит 0,90 г NaCl в 1 л раствора.В 20 г л раствора -1 будет 20 г NaCl в 1 л. Таким образом, по мере увеличения концентрации растворенного вещества его масса на литр также увеличивается.
Масса растворенного вещества в данном объеме увеличивается с концентрацией.Пример 1: Гидроксид калия
Заявление: Гидроксид калия (КОН) является сильным основанием. Он растворим в воде и имеет множество промышленных применений, особенно в мыловаренной промышленности.
Гидроксид калия 121 г КОН растворяют в воде. Объем раствора 100 мл. Найдите концентрацию КОН?
Объем раствора 100 мл. Найдите концентрацию КОН?
Решение: масса КОН составляет 121 г. м КОН = 121 г. Пусть ρ КОН — концентрация КОН в растворе.
Концентрация КОН составляет 1,21 г мл -1 .
Примечание: Растворимость часто выражается в массовой концентрации. В приведенном выше примере 1,21 г мл -1 представляет собой растворимость КОН в воде при 25 °C.
Медицина
Массовая концентрация очень полезна в медицине.Состав жидких лекарственных средств обычно указывается в процентах от массы к объему (m/v), т. е. массы лекарственного средства, присутствующего в данном объеме раствора. Эти препараты в основном хранятся в пакетах для внутривенных вливаний (см. изображение ниже).
Пакеты для внутривенных вливанийНиже приведены некоторые примеры таких растворов:
- Изотонический раствор: 0,9 % NaCl. Содержит 0,9 г соли в 100 мл раствора.
- 5 % Декстроза: содержит глюкозу в качестве растворенного вещества.
 Он состоит из 5 г глюкозы в 100 мл раствора.
Он состоит из 5 г глюкозы в 100 мл раствора. - Солевой раствор декстрозы: содержит глюкозу и соли.
Примечание. В биологии символ % используется неправильно. 1 % означает, что 1 г растворенного вещества растворяется в 100 мл раствора.
Пример 3. Солевой раствор
Заявление. Пациенту вводят 0,9 % NaCl. Объем вводимого раствора составляет 250 мл. Найдите массу введенного в организм NaCl?
Решение: в биологии 0,9 % означает 0,9 г NaCl в 100 мл раствора.
Таким образом, концентрация NaCl равна 0.009 г мл -1 .
Объем раствора, введенного в организм пациента, составляет 250 мл. Пусть м в будет массой закачанного NaCl.
Свойства массовой концентрации
- Это свойство раствора.
- Это интенсивное свойство, поскольку соотношение двух экстенсивных свойств всегда дает интенсивное свойство. В результате он не будет меняться от образца к образцу.
- Это концентрация по объему.
 Следовательно, это зависит от объема раствора.
Следовательно, это зависит от объема раствора. - Поскольку на объем влияют давление и температура, массовая концентрация зависит от давления и температуры.
Связь с другими величинами
Температура
С повышением температуры увеличивается и объем раствора. Эта зависимость связана с коэффициентом теплового расширения раствора.
Здесь V – объем при T , V 0 – объем при T 0 , а α – коэффициент теплового расширения раствора.
Пусть ρ ( I , T ) и ρ ( I , T 0 ) Быть концентрацией при температуре T и T 0 . Соотношение следующее:
Плотность
Пусть ρ i — плотность раствора. Плотность раствора равна сумме массы каждого растворенного вещества, деленной на объем раствора.
Следовательно, сумма концентраций каждого растворенного вещества является плотностью раствора.
Массовая доля
Массовая доля представляет собой отношение массы растворенного вещества к общей массе и обозначается как w i . Соотношение между ними следующее:
Мольная доля
Мольная доля представляет собой отношение моля растворенного вещества к общему количеству молей. Символ x i используется для его представления. Он связан с массовой концентрацией следующим уравнением.
Здесь M i — молярная масса растворенного вещества.
Молярность
Молярность, она же молярная концентрация, похожа на массовую концентрацию. Это отношение молей растворенного вещества, а не массы растворенного вещества, к объему раствора. c i — молярность растворенного вещества i .
Моляльность
Моляльность ( b i ) – количество молей растворенного вещества на кг растворителя. Для раствора n растворенного вещества моляльность i растворенного вещества определяется приведенным ниже уравнением.
Здесь M 0 — молярная масса растворителя.
Эквивалентные соотношения
Пусть i и j — любые два компонента в растворе. Соотношение между каждой из вышеуказанных величин следующее:
Решенные задачи
Задача 1: Атмосфера Земли
Утверждение: Атмосфера Земли представляет собой смесь различных газов. Он простирается до высоты 90 км. Кислород и азот являются доминирующими газами в атмосфере.Молярный процент кислорода и азота составляет 21 % и 79 %. Найдите массовую концентрацию каждого газа, если молярная масса кислорода и азота равна 32 г моль -1 и 28 г моль -1 ?
Атмосфера ЗемлиРешение: В 100 моль воздуха количество кислорода и азота составляет 21 моль и 79 моль соответственно.
Расчет массы кислорода и азота в 100 моль воздуха,
Согласно закону идеального газа 1 моль воздуха занимает 22,4 дм −3 при СТП ( P = 101.325 кПа и 90 165 Тл 90 168 = 273,15 К). Для 100 моль воздуха объем составит 2240 дм −3 . Таким образом, В = 2240 дм −3 = 2240 л.
Для 100 моль воздуха объем составит 2240 дм −3 . Таким образом, В = 2240 дм −3 = 2240 л.
Массовые концентрации кислорода и азота рассчитываются следующим образом:
Если сложить обе концентрации, то получится плотность воздуха при НТД.
Задача 2: Глюкоза
Утверждение: Глюкоза (C 6 H 12 O 6 ) представляет собой моносахаридный сахар. Это первичный источник энергии не только для человека, но и для большинства организмов.Глюкоза вырабатывается растениями посредством фотосинтеза. Это самый распространенный моносахарид, который также содержится в нашей крови.
Кубики сахараРастворимость глюкозы при 25°C составляет 900 г л −1 . Найдите молекулы сахара, присутствующие в 100 мл насыщенного раствора глюкозы?
Решение: Концентрация глюкозы составляет 900 г л -1 .
Расчет массы глюкозы в 100 мл (= 0,100 л) раствора,
Молярная масса глюкозы составляет 180 г моль −1 . Моли глюкозы в 90,0 г следующие:
Моли глюкозы в 90,0 г следующие:
Один моль глюкозы содержит молекулы, равные числу Авогадро N A . Молекулы в 0,500 моль глюкозы составляют 0,500 × N A .
Задача 3: хлорид лития
Утверждение: хлорид лития (LiCl) представляет собой белое ионное соединение с высокой растворимостью в полярных растворителях, таких как вода. Он в основном используется для производства лития, который является ключевым компонентом электронных батарей.
Литий хлоридНайдите концентрацию ионов Li + и ионов Cl − при растворении 50 г LiCl в 100 мл воды?
Решение: Молярная масса LiCl равна 42.4 г моль -1 . Пусть количество молей LiCl в 42,4 г моль 90 193 -1 90 194 равно 90 165 n 90 168 90 166 LiCl 90 167 .
Один моль LiCl содержит один моль Li + и один моль Cl − . Соответственно, 1,18 моль LiCl будет содержать 1,18 моль Li + и 1,18 моль Cl — .
Расчет массы Li + и Cl — ,
Примечание: M LI + + M LI + = м LiCl Так как масса всегда законсервированный.
Объем раствора примерно равен объему воды, что составляет 100 мл. В = 100 мл.
Расчет концентрации Li + и Cl − ,
Практические задачи
Задача 1. Найдите концентрацию NaOH в растворе, если 10 молей NaOH растворено в 1,00 л воды? Молярная масса гидроксида натрия составляет 40 г моль −1
Задача 2. Молярная концентрация серной кислоты равна 4.00 моль л -1 . Найти массовую концентрацию H 2 SO 4 и SO −
4 ? Молярная масса H 2 SO 4 и SO —
4 составляет 98,1 г моль -1 и 96,1 г моль -1 .
Проблема 3: Гидроксид алюминия (Al(OH) 3 ) используется в качестве антацида — химического вещества, используемого для лечения кислотности. Пациент принимает две чайные ложки (по 5 мл) сиропа. Концентрация гидроксида алюминия в сиропе составляет 50 мг мл -1 .Найдите потребление гидроксида алюминия?
Пациент принимает две чайные ложки (по 5 мл) сиропа. Концентрация гидроксида алюминия в сиропе составляет 50 мг мл -1 .Найдите потребление гидроксида алюминия?
- Концентрация NaOH составляет 400 г л −1 .
- Массовая концентрация H 2 SO 4 и SO −
4 составляет 392 г л −1 и 384 г л −1 . - Потребление Al(OH) 3 составляет 500 мг.
Резюме
- Массовая концентрация – это масса растворенного вещества на единицу объема раствора.
- Обозначается ρ i .
- Его формула .
- Единицей СИ является кг·м −3 .
- Это интенсивное свойство. Но она может меняться в зависимости от давления и температуры.
Связанные статьи
Калькулятор концентрации раствора по объему
Калькулятор концентрации раствора по массе на объем
Предназначенный для использования как в учебной, так и в исследовательской лаборатории, этот калькулятор (см. например, масса по объему) или вес на объем (т.е. вес по объему) единицы концентрации, такие как мг/мл, мкг/мкл, мкг/л и т. д. Такие расчеты концентрации необходимы, если исходить из твердой формы химическое вещество и раствор должны быть приготовлены с единицей концентрации, выраженной в единице массы на единицу объема (например, мг/мл). Эти расчеты особенно полезны при работе с соединениями, не имеющими четко определенной молекулярной массы (такими как некоторые белки, углеводы и другие полимеры).
например, масса по объему) или вес на объем (т.е. вес по объему) единицы концентрации, такие как мг/мл, мкг/мкл, мкг/л и т. д. Такие расчеты концентрации необходимы, если исходить из твердой формы химическое вещество и раствор должны быть приготовлены с единицей концентрации, выраженной в единице массы на единицу объема (например, мг/мл). Эти расчеты особенно полезны при работе с соединениями, не имеющими четко определенной молекулярной массы (такими как некоторые белки, углеводы и другие полимеры).
 д.), используйте наш коэффициент разбавления. Калькулятор — масса на объем.
д.), используйте наш коэффициент разбавления. Калькулятор — масса на объем.Масса на объем (масса/объем) уравнение концентрации
- C — желаемая концентрация конечного раствора с единицей концентрации, выраженной в единицах массы на объем раствора (например, мг/мл).
- m — это масса (т. е. вес) растворенного вещества, которое необходимо растворить в объеме V раствора, чтобы получить желаемую концентрацию раствора ( C ).
- V – это объем раствора, в котором необходимо растворить указанную массу ( м ) растворенного вещества, чтобы получить желаемую концентрацию раствора ( C ). Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель.
Масса на объем (масса/объем) Калькулятор концентрации раствора
Каждая показанная ниже ячейка калькулятора соответствует термину в представленной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать. Следовательно, как минимум две ячейки должны содержать значения, и не более одной ячейки может быть пустой . Значение пустой ячейки будет рассчитано на основе других введенных значений. После выполнения вычисления вычисляемая ячейка будет выделена, а последующие вычисления будут вычислять значение выделенной ячейки (без необходимости иметь пустую ячейку). Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать. Следовательно, как минимум две ячейки должны содержать значения, и не более одной ячейки может быть пустой . Значение пустой ячейки будет рассчитано на основе других введенных значений. После выполнения вычисления вычисляемая ячейка будет выделена, а последующие вычисления будут вычислять значение выделенной ячейки (без необходимости иметь пустую ячейку). Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Для удобства этот калькулятор позволяет выбирать различные единицы массы, объема и концентрации, а также выполняются необходимые преобразования для получения значения пустой ячейки в нужной единице.
Комментарии и/или инструкции по приготовлению
Размещено: пятница, 2 августа 2013 г.
Последнее обновление: воскресенье, 21 января 2018 г.
Весовая/объемная концентрация в процентах Учебное пособие по химии
Ключевые понятия
⚛ Концентрация в процентах по массе/объему – это измерение концентрации раствора.
· Концентрация в процентах по массе/объему также известна как концентрация в процентах по массе/объему.
⚛ массовая/объемная концентрация в процентах обычно обозначается аббревиатурой w/v (%) или w/v% или (w/v)% или %(w/v) или %w/v
· Массовая/объемная концентрация в процентах обычно обозначается аббревиатурой m/v (%) или m/v% или (m/v)% или %(m/v) или %m/v
⚛ вес./об.% (масс./об.%) — полезная мера концентрации при дозировании реагентов.
⚛ Для расчета концентрации вес/объем % (массовая/объемная концентрация):
| мас./об. (%) = % (масс./об.) = | масса растворенного вещества (г) объем раствора (мл) | × 100 |
⚛ Общепринятыми единицами измерения (1) для концентрации вес./об.% являются г/100 мл (граммы растворенного вещества на 100 мл раствора)
· пример: 5% (масса/объем) = 5 г/100 мл
· пример: 12%(масс./об.) = 12 г/100 мл
⚛ Измените уравнение для концентрации w/v% (m/v%), чтобы найти:
(i) масса растворенного вещества
масса (растворенное вещество) = [объем (раствор) × (вес/объем)%]/100
(ii) объем раствора
объем (раствор) = [масса (растворенное вещество)/(вес/объем)%] × 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Расчет концентрации в процентах по массе/объему
Концентрация в процентах по массе/объему (w/v%) или концентрация в процентах по массе/объему (m/v%) является мерой концентрации раствора.
мас./об.% или масс./об.% рассчитывается путем деления массы растворенного вещества в граммах на объем раствора в миллилитрах с последующим умножением на 100, как показано ниже.
| мас./об. (%) = | масса растворенного вещества (г) объем раствора (мл) | × 100 |
Процентная концентрация говорит нам, сколько частей растворенного вещества присутствует на 100 частей раствора.В терминах веса на объем (масса на объем) это означает, что процентная концентрация говорит нам части растворенного вещества по массе на 100 частей по объему раствора.
В единицах СИ концентрация w/v% (m/v%) должна быть указана в кг/100 л, но эти единицы слишком велики, чтобы быть полезными для химиков в лаборатории, граммы и миллилитры являются более удобными единицами измерения для нас. .
.
Напомним, что 1 кг = 1 000 г
Напомним, что 1 л = 1 000 мл
т.о. кг/100 л = 1000 г/100 000 мл = г/100 мл
, так что единицы измерения % массы/объема чаще всего указываются как г/100 мл
Таким образом, единицами измерения концентрации вес/объем (масс./об.%) являются граммы растворенного вещества на 100 мл раствора (г/100 мл).
Это означает, что концентрация в процентах масса/объем (концентрация в процентах масса/объем) может быть указана разными, но эквивалентными способами. Некоторые примеры приведены в таблице ниже:
| мас./об.% (масс./об.%) | = | г/100 мл |
|---|---|---|
| 0,5 % (вес/объем) | = | 0,5 г/100 мл |
| 1,0 %(масс./об.) | = | 1.0 г/100 мл |
| 5,25 % (вес/объем) | = | 5,25 г/100 мл |
12,78 %(масс. /об.) /об.) | = | 12,78 г/100 мл |
| 22,75 % (вес/объем) | = | 22,75 г/100 мл |
Чтобы приготовить раствор определенной концентрации, вы взвесите твердое вещество, а затем растворите его в достаточном количестве растворителя, чтобы получился известный объем раствора.Следовательно, вы будете знать значение двух величин:
- масса растворенного вещества
- объем раствора
, который можно использовать для расчета процентной концентрации веса/объема (концентрация в процентах по массе/объему).
Для расчета процентной концентрации масса/объем (массовая/объемная концентрация в процентах):
- Шаг 1: Напишите уравнение: либо масса/объем % = масса/объем × 100, либо масса/объем % = масса/объем × 100
- Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
- Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
- Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
- Шаг 5: Подставьте эти значения в уравнение и решите.

- Шаг 6: Напишите ответ
Примеры обработки: масс./об.% (масс./об.%) Расчеты
Вопрос 1. Какова массовая/объемная концентрация 250 мл водного раствора хлорида натрия, содержащего 5 г NaCl?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
вес/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaCl) = 5 г
объем раствора = 250 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества (NaCl) = 5 г (преобразование единиц измерения не требуется)
объем раствора = 250 мл (пересчет единиц измерения не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = (5 г ÷ 250 мл) × 100 = 2 г/100 мл
(Примечание: допустима только 1 значащая цифра)
Шаг 6: Напишите ответ
% масс./об. = 2 г/100 мл = 2%(масс./об.) = 2%(масс./об.)
Вопрос 2. 10,00 г BaCl 2 растворяют в 90,00 г воды.Плотность раствора составляет 1,090 г/мл (1,090 г/мл -1 ).
Рассчитайте массовую/объемную процентную концентрацию раствора.
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
масса/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид бария = BaCl 2
растворитель = вода = H 2 O (l) (это водный раствор)
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
массы растворенного вещества = масса (BaCl 2 ) = 10. 00 г
00 г
масса растворителя = масса (H 2 O) = 90,00 г
плотность раствора = 1,090 г/мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г (преобразование единиц не требуется)
объем раствора неизвестен и должен быть рассчитан с использованием плотности раствора и массы растворенного вещества и растворителя:
плотность = масса(раствор) ÷ объем(раствор)
масса(раствор) = масса(раствор) + масса(растворитель)
Масса(раствор) = 10.00 г BaCl 2 + 90,00 г воды = 100,0 г
объем(раствор) = масса(раствор) ÷ плотность(раствор)
объем (раствор) = 100,0 г ÷ 1,090 г /мл = 91,74 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
m/v (%) = (масса растворенного вещества ÷ объем раствора) × 100
м/об (%) = (10,00 г ÷ 91,74 мл) × 100
м/об (%) = 10. 90 г/100 мл
90 г/100 мл
(Примечание: оправданы только 4 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 10,90 г/100 мл = 10,90 % (масс./об.) = 10,90 % (масс./об.)
↪ Наверх
Преобразование из других единиц в масс./об. % или масс./об. %
Наиболее распространенными единицами измерения концентрации w/v% (m/v%) являются г/100 мл (граммы растворенного вещества на 100 мл раствора).
Если масса растворенного вещества не указана в граммах, вам необходимо перевести единицы измерения в граммы.
Если объем раствора не указан в миллилитрах, вам необходимо перевести единицы измерения в миллилитры.
Примеры работы: w/v% (m/v%) Расчеты, требующие преобразования единиц измерения
Вопрос 1. 2,00 л водного раствора хлорида калия содержат 45,0 г KCl.Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид калия = KCl
Растворитель — вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса KCl = 45,0 г
объем раствора = 2,00 л
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса KCl = 45,0 г (масса в г, преобразование единиц измерения не требуется)
объема раствора = 2.00 л (необходимо преобразовать в мл)
V(раствор) = 2,00 л × 10 3 мл/ л = 2000 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = [45,0 г ÷ 2000 мл] × 100 = 2,25 г/100 мл
(Примечание: допустимы только 3 значащие цифры)
Шаг 6: Напишите ответ
мас./об.% = 2.25 г/100 мл = 2,25 % (масса/объем) = 2,25 % (масса/объем)
Вопрос 2. 15 мл водного раствора сахарозы содержат 750 мг сахарозы.
Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = сахароза
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (сахароза) = 750 мг
объем раствора = 15 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
Масса растворенного вещества (сахароза) = 750 мг (необходимо перевести в граммы)
масса растворенного вещества = 750 мг ÷ 1000 мг /г = 0.750 г
объем раствора = 15 мл (преобразование не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = (0,750 г ÷ 15 мл) × 100 = 5,0 г/100 мл
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ
м/об% = 5.0 г/100 мл = 5,0 % (масс./об.) = 5,0 % (масс./об.)
Вопрос 3. 186,4 л водного раствора гидроксида натрия содержит 1,15 кг NaOH.Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = гидроксид натрия = NaOH
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaOH) = 1,15 кг
объем раствора = 186,4 л
Шаг 4: Проверить единицы измерения на соответствие и при необходимости преобразовать (масса в граммах, объем в миллилитрах) (2)
масса растворенного вещества (NaOH) = 1,15 кг (перевести единицы в г)
массы растворенного вещества (NaOH) = 1. 15 кг = 1,15
15 кг = 1,15 кг × 1000 г/ кг = 1 150 г
объем раствора = 186,4 л (перевести единицы в мл)
объем раствора = 186,4 л = 186,4 л × 1000 мл/ л = 186 400 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
мас./об. (%) = (1 150 г ÷ 186 400 мл) × 100
мас./об. (%) = 0.617 г/100 мл
(Примечание: допустимы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 0,617 г/100 мл = 0,617 % (масс./об.) = 0,617 % (масс./об.)
↪ Наверх
Расчет объема и массы реагента
В предыдущих разделах мы рассчитали концентрацию растворов в процентах по весу и объему, используя известные массу растворенного вещества и объем раствора.
Когда мы начинаем использовать этот раствор в лаборатории, мы, скорее всего, будем использовать пипетку или бюретку для подачи объема раствора.
Если мы знаем объем используемого раствора, мы можем рассчитать массу присутствующего растворенного вещества.
| масса растворенного вещества (г) = | объем раствора (мл) × масса/объем (%) 100 |
Если мы знаем массу растворенного вещества, которое хотим использовать, мы можем рассчитать объем раствора, который нам потребуется.
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) | × 100 |
Студенту предоставляется 11,78 г/100 мл водного раствора хлорида натрия (11,78 % масс./об.).
Какой объем этого раствора нужно добавить в реакционный сосуд?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти объем раствора:
мас. /об.% = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
/об.% = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Умножить обе части уравнения на объем
мас./об.% × объем (мл) = (масса растворенного вещества (г) ÷ объем раствора (мл) ) × объем (мл) × 100
мас./об.% × объем (мл) = масса растворенного вещества (г) × 100
Разделите обе части уравнения на мас./об.%
[ мас./об.% × объем (мл)]/ мас./об.% = (масса растворенного вещества (г) × 100)/масс./об.%
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) | × 100 |
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г
концентрация NaCl (водн. ) при условии = масса/объем (%) = 11,78 г/100 мл
) при условии = масса/объем (%) = 11,78 г/100 мл
объема раствора = ? мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
Требуетсямассы растворенного вещества = масса (NaCl) = 1.22 г (пересчет единиц измерения не требуется)
концентрация NaCl (водн.) при условии = масса/объем (%) = 11,78 г/100 мл (пересчет единиц не требуется)
Требуетсяобъема раствора = ? мл
Шаг 5: Подставьте эти значения в уравнение и решите.
| объем раствора (мл) | = | масса растворенного вещества (г) масса/объем (%) | × 100 |
| = | 1.22 г 11,78 г/100 мл | × 100 | |
| = | 10,36 мл | ||
| = | 10,4 мл |
(Примечание: допустимы только 3 значащие цифры)
Шаг 6: Напишите ответ
объема раствора = 10. 4 мл
4 мл
Вопрос 2. Какова масса йодида калия в граммах в 14,86 мл 32,44 г/100 мл водного раствора йодида калия (32,44 % вес/объем)?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти массу растворенного вещества:
вес/объем (%) = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Разделите обе части уравнения на 100
вес/объем (%) ÷ 100 = масса растворенного вещества (г) ÷ объем раствора (мл)
Умножьте обе части уравнения на объем раствора (мл)
масса растворенного вещества (г) = (вес/объем (%) ÷ 100) × объем раствора (мл)
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = йодид калия = KCl
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (KI) = ? г
объем (KI (водн. ) ) = 14,86 мл
) ) = 14,86 мл
концентрация раствора = мас./об.% (KI (водн.) ) = 32,44 г/100 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
объем(КИ (водный) ) = 14.86 мл (пересчет единиц измерения не требуется)
мас./об.% (KI (водн.) ) = 32,44 г/100 мл (преобразование единиц не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
масса растворенного вещества (г) = (масс./об.% ÷ 100) × объем раствора (мл)
масса (KI) = (32,44 ÷ 100) × 14,86 = 4,821 г
(Примечание: оправданы 4 значащие цифры)
Шаг 6: Напишите ответ
массы растворенного вещества (KI) = 4.821 г
↪ Наверх
Пример вопроса: расчеты масс./об.% (масс./об.%)
Определите массу в граммах нитрата калия (KNO 3 ) в 22,65 мл 2,15% (масс. /об.) водного раствора нитрата калия.
/об.) водного раствора нитрата калия.
↪ Наверх
Примечания:
(1) Общепринятыми единицами измерения % масс./об. (масс./об.%) являются г/100 мл, но возможны и другие единицы, например, кг/100 л, мг/100 мкл.
Мы ограничим последующее обсуждение г/100 мл, но вы можете применить ту же логику и уравнения, используя другие подходящие единицы измерения.
Обратите внимание, что растворимость чаще всего указывается в виде весового отношения процентной концентрации.
(2) Вам действительно не нужно преобразовывать эти единицы, потому что и масса, и объем даны в единицах СИ, то есть
мас./об.% = (1,15 кг/186,4 л) × 100 = 0,617 кг/100 л = 617 г/100 000 мл = 0,617 г/100 мл
, но, вероятно, лучше попрактиковаться в преобразовании единиц измерения, по крайней мере, до тех пор, пока вы полностью не поймете, что означает концентрация w/v%.
↪ Наверх
Как рассчитать молярную концентрацию раствора | Часто задаваемые вопросы
Единица молярной концентрации [моль/л (М)] традиционно широко используется в качестве метода концентрации. Это количество молей целевого вещества (растворенного вещества), растворенного в 1 л раствора. Вот как рассчитать концентрацию.
Это количество молей целевого вещества (растворенного вещества), растворенного в 1 л раствора. Вот как рассчитать концентрацию.
(Масса 1 л раствора) x (чистота) ÷ молекулярная масса
[Удельная плотность раствора (г/мл) x 1000 (мл) x чистота (мас./мас.%) /100 ÷ молекулярная масса]
Например, рассчитаем молярную концентрацию 2-меркаптоэтанола (HSCH 2 CH 2 OH).Необходимая информация следующая.
- Удельный вес (или плотность) = 1,114 г/мл
- Чистота (или содержание) = 100 мас.% (предполагаемая)
- Молекулярная масса = 78,13
Рассчитав это значение, применив это значение к приведенному выше уравнению, вы можете узнать молярную концентрацию.
1,114 г/мл x 1000 мл x 100 мас./мас.%/100 ÷ 78,13 = 14,26 моль/л
Чтобы рассчитать концентрацию, как описано выше, необходимо знать три точки «удельный вес (или плотность)», «чистота (или содержание)» и «молекулярный вес».В таблице ниже приведена краткая справочная таблица общих концентраций кислот и оснований. В кислоте и щелочи используется «нейтрализационное титрование», часто используется «нормальность (N)».
В кислоте и щелочи используется «нейтрализационное титрование», часто используется «нормальность (N)».
【Краткая справочная таблица общих концентраций кислот и оснований】
| Соединение | Молекулярная формула | Молекулярная масса | Чистота (мас./мас.%) | Удельный вес (20℃) | Концентрация (моль/л) | Эквивалент | Нормальность (Н) |
|---|---|---|---|---|---|---|---|
| Соляная кислота | HCl | 36.46 | 20% | 1.10 | 6,0 | 1 | 6,0 |
| 35% | 1,17 | 11,2 | 11,2 | ||||
| Азотная кислота | HNO 3 | 63.01 | 60% | 1,37 | 13,0 | 1 | 13,0 |
| 65% | 1,39 | 14,3 | 14,3 | ||||
| 70% | 1. 41 41 | 15,7 | 15,7 | ||||
| Сульфат | H 2 SO 4 | 98.08 | 100% | 1,83 | 18,7 | 2 | 37,3 |
| Фосфорная кислота | H 3 Заказ на покупку 4 | 98.00 | 85% | 1,69 | 14,7 | 3 | 44,0 |
| 90% | 1,75 | 16.1 | 48,2 | ||||
| Ацетат | СН 3 СООН | 60,05 | 100% | 1,05 | 17,5 | 1 | 17,5 |
| Хлорная кислота | HClO 4 | 100,46 | 60% | 1,54 | 9,2 | 1 | 9,2 |
| 70% | 1,67 | 11,6 | 11,6 | ||||
| Вода с перекисью водорода | Н 2 О 2 | 34. 01 01 | 30% | 1.11 | 9,8 | — | |
| 35% | 1,13 | 11,6 | |||||
| Аммиачная вода | НХ 3 | 17.03 | 25% | 0,91 | 13,4 | 1 | 13,4 |
| 28% | 0,90 | 14,8 | 14,8 | ||||
【Краткий справочник по концентрации и единицам измерения】
●Как выразить концентрацию раствора
| Выражение | Комментарий |
|---|---|
| Массовая концентрация | «г числа» растворенного вещества в 100 г раствора.Во многих случаях выражается как мас./мас.%, мас.% и % для плотности. |
| Концентрация в процентах по объему | «число м» растворенного вещества в 100 м раствора. Выражается как об./об.%, когда смесь или растворенное вещество являются жидкими. |
| Вес в зависимости от объемной концентрации в процентах | «г количество растворенного вещества в 100м раствора. Выражено в мас./об.%. |
| Нормальность | г эквивалентного количества растворенного вещества в 1 л раствора. Выражается как N для анализа емкости. |
| Объемная удельная концентрация | Концентрация косвенно выражается объемной долей разбавляемого жидкого реагента. Он используется в JIS и других. Пример: Серная кислота (1 + 2) → Серная кислота показана разбавленной 2 объемами воды. |
| Массовая доля концентрации | Концентрация, косвенно выраженная весовым соотношением, при котором растворяется твердый реагент. Он используется в JIS и других. Пример: хлорид натрия (1 + 19) → Растворяют в 19 весовых частях воды по отношению к 1 NaCl. |
| Молярность | Молярное число целевого вещества (растворенного вещества) в 1 л раствора. Выражается в моль/или М. |
● Префикс, представляющий несколько
| Экспресс-величина | Экспресс малость | |||
|---|---|---|---|---|
| 100 =10 2 | ч (гекто) | 1/100 =10 -2 | с (Сенти) | %(Проценты) |
| 1000 =10 3 | к(Килограмм) | 1/1000 =10 -3 | м (Милли) | ‰(Пермили) |
| 100 дюймов =10 6 | М (Мега) | 1/100″ =10 -6 | мк(Микро) | частей на миллион |
| 1 миллиард =10 9 | Г(Гига) | 1/10 миллиардов =10 -9 | н (нано) | частей на миллиард |
| 1 триллион =10 12 | Т (Тера) | 1/1 триллиона =10 -12 | р(Пико) | п.п. |
| 1000 трлн = 10 15 | р (Петта) | 1/1000 трлн =10 -15 | ф (фемто) | мг/кг |
●ppmТаблица преобразования
| частей на миллион | частей на миллион | % | мг/г | мг/л |
|---|---|---|---|---|
| 1000 | 1 | 0. 0001 0001 | 0,001 | 1 |
| 10 000 | 10 | 0,001 | 0,01 | 10 |
| 100 000 | 100 | 0,01 | 0,1 | 100 |
| 1 000 000 | 1000 | 0,1 | 1 | 1000 |
| 10 000 000 | 10 000 | 1 | 10 | 10 000 |
Массовая концентрация – обзор
11.1 Определения, относящиеся к испытаниям на биоразложение
Активный ил (ISO 14851)
Биомасса, полученная при аэробной очистке сточных вод путем роста бактерий и других микроорганизмов в присутствии растворенного кислорода.
Активированный вермикулит (ISO 14855-1)
Вермикулит, колонизированный активными микроорганизмами во время предварительной фазы роста.
Биохимическое потребление кислорода (БПК) (ISO 14851)
Массовая концентрация растворенного кислорода, потребленного при определенных условиях аэробным биологическим окислением химического соединения или органического вещества в воде, выраженная в миллиграммах поглощения кислорода на миллиграмм или грамм тестируемого соединения.
Фаза биодеградации (ISO 14855, часть 2)
Время, измеряемое в днях, от окончания лаг-фазы испытания до достижения примерно 90% максимального уровня биодеградации.
Сброженный ил (ISO 14853)
Смесь осевших сточных вод и активного ила, инкубированная в анаэробном реакторе при температуре около 35 °C для уменьшения биомассы и запаха, а также для улучшения обезвоживаемости ила. Переваренный ил содержит ассоциацию анаэробных ферментирующих и метаногенных бактерий, продуцирующих углекислый газ и метан.
Растворенный неорганический углерод (DIC) (ISO 14852)
Та часть неорганического углерода (IC) в воде, которую нельзя удалить с помощью специального разделения фаз, например, путем центрифугирования при 40 000 мс −2 в течение 15 мин или методом мембранной фильтрации с использованием мембран с диаметром пор 0,2–0,45 мкм.
Растворенный органический углерод (DOC) (ISO 14851)
Та часть органического углерода (OC) в воде, которая не может быть удалена с помощью определенного разделения фаз, например. г., центрифугированием при 40000 мс -2 в течение 15 мин или мембранной фильтрацией с использованием мембран с диаметром пор 0,2-0,45 мкм.
г., центрифугированием при 40000 мс -2 в течение 15 мин или мембранной фильтрацией с использованием мембран с диаметром пор 0,2-0,45 мкм.
Неорганический углерод (IC) (ISO 14853)
IC, растворенный или диспергированный в водной фазе жидкости и извлекаемый из надосадочной жидкости после того, как осадку дали осесть.
Лаг-фаза (ISO 14855, часть 2)
Время, измеряемое в днях, от начала испытания до достижения адаптации и/или селекции микроорганизмов-деструкторов и степень биодеградации химического соединения или органического вещества увеличился примерно до 10% от максимального уровня биодеградации.
Максимальный уровень биоразложения (ISO 14855, часть 2)
Степень биоразложения, измеренная в процентах, химического соединения или органического вещества в испытании, выше которой дальнейшее биоразложение не происходит во время испытания.
Фаза плато (ISO 14855, часть 2)
Время, измеряемое в днях, от окончания фазы биоразложения до окончания испытания.
Первичное анаэробное биоразложение (ИСО 14853)
Структурное изменение (трансформация) химического соединения микроорганизмами, приводящее к утрате определенного свойства.
Теоретическое количество выделяемого биогаза (Thbiogas) (ISO 14853)
Максимальное теоретическое количество биогаза (CH 4 + CO 2 ), выделяющегося после полного биоразложения органического материала в анаэробных условиях, рассчитанное по молекулярному формулы и выражается в миллилитрах биогаза, выделяемого на миллиграмм исследуемого материала при стандартных условиях.
Теоретическое количество выделяющегося диоксида углерода (ThCO 2 ) (ISO 17088, ISO 14855 часть 2)
Максимальное теоретическое количество диоксида углерода, выделяющегося после полного окисления химического соединения, рассчитанное по молекулярной формуле и выраженное в миллиграммах углекислого газа, выделяемого на миллиграмм или грамм тестируемого соединения.
Теоретическое количество выделившегося метана (ThCH 4 ) (ISO 14853)
Максимальное теоретическое количество метана, выделившегося после полного восстановления органического материала, рассчитанное по молекулярной формуле и выраженное в миллиграммах метана, выделившегося на миллиграмм тестовый материал.
Теоретическая потребность в кислороде (ThOD) (ISO 14851)
Теоретическое максимальное количество кислорода, необходимое для полного окисления химического соединения, рассчитанное по молекулярной формуле, выраженное в миллиграммах поглощения кислорода на миллиграмм или грамм испытуемого соединения.
Общее количество сухих веществ (ISO 17088; ISO 14855, часть 2)
Количество сухих веществ, полученное путем взятия известного объема испытуемого материала или компоста и сушки при температуре около 105 °C до постоянной массы.
Общий органический углерод (TOC) (ISO 14851)
Весь углерод, присутствующий в органическом веществе, который растворен или взвешен в воде.
Полное аэробное биоразложение (ISO 14853)
Разложение органического соединения микроорганизмами в отсутствие кислорода до двуокиси углерода, метана, воды и минеральных солей любых других присутствующих элементов (минерализация) плюс новая биомасса.
Полное аэробное биоразложение (ISO 17088; ISO 14855, часть 2)
Разложение органического соединения микроорганизмами в присутствии кислорода на двуокись углерода, воду и минеральные соли любых других присутствующих элементов (минерализация) плюс новая биомасса .
Летучие твердые вещества (ISO 17088)
Количество твердых веществ, полученное путем вычитания остатка известного объема испытуемого материала или компоста после сжигания при температуре около 550 °C из общего количества сухих веществ того же образца.
Калькулятор молярности | Технологические сети
Что такое молярность? Молярность – это концентрация раствора в пересчете на число молей растворенного вещества в 1 дм 3 (1 л) раствора.
Единицы молярности: M или моль/л. Раствор 1 M называется «одномолярным».
Что такое моль?Моль — это количество всего, что имеет такое же количество частиц, как 12 г углерода-12.Это примерно равно 6,02×10 23 , также называемому числом Авогадро. Так, 1 моль газообразного водорода (H 2 ) содержит 6,02×10 23 молекул, а 1 моль глюкозы (C 6 H 12 O 6 ) также содержит 6,02×10 43 молекул, но поскольку молекула H 2 намного проще, 1 моль H 2 будет иметь гораздо меньшую массу (молярную массу), чем 1 моль C 6 H 12 O 6 .
Что такое молярная масса?Молярная масса – это масса в граммах 1 моля конкретной молекулы.
Как найти молярную массу Один моль натрия (Na) составляет 22,99 г, а 1 моль хлора — 35,45 г. Для хлорида натрия (NaCl) они находятся в соотношении 1:1, поэтому молярная масса NaCl составляет 22,99 + 35,45 = 58,44 г/моль.
Для хлорида натрия (NaCl) они находятся в соотношении 1:1, поэтому молярная масса NaCl составляет 22,99 + 35,45 = 58,44 г/моль.
Для такого соединения, как вода (H 2 O), 1 моль водорода (H) равен 1,008 г/моль, а 1 моль кислорода (O) равен 15,9994 г/моль. Итак, молярная масса H 2 O равна (2 х 1,008) + 15.9994 = 18,0154 г/моль.
Два раствора с одинаковой молярностью будут иметь одинаковое количество молекул химического вещества на литр, но, вероятно, будут содержать разные массы этого химического вещества на литр для достижения этой цели. Принимая во внимание, что два раствора с одинаковой концентрацией будут иметь одинаковую массу химического вещества на литр раствора, но, следовательно, вероятно, будут иметь разное количество молекул этого химического вещества на литр.Если известна дополнительная информация, одно значение можно вывести из другого, используя приведенные ниже уравнения.
Для расчета молярности или для расчета связанных значений (включая объем, массу, молярную массу и концентрацию) по молярности используются следующие уравнения.
Количество молей (моль) = масса (г) / молярная масса (г/моль)Концентрация (г/л) = Масса (г) / Объем (л)
Молярность ( M или моль/л) = количество молей (моль) / объем (л) Пример расчета молярности и концентрации
Сценарий, в котором большинство ученых-лаборантов столкнутся с этим типом вычислений, — это при составлении решений в соответствии со стандартной рабочей процедурой (СОП) или научной статьей.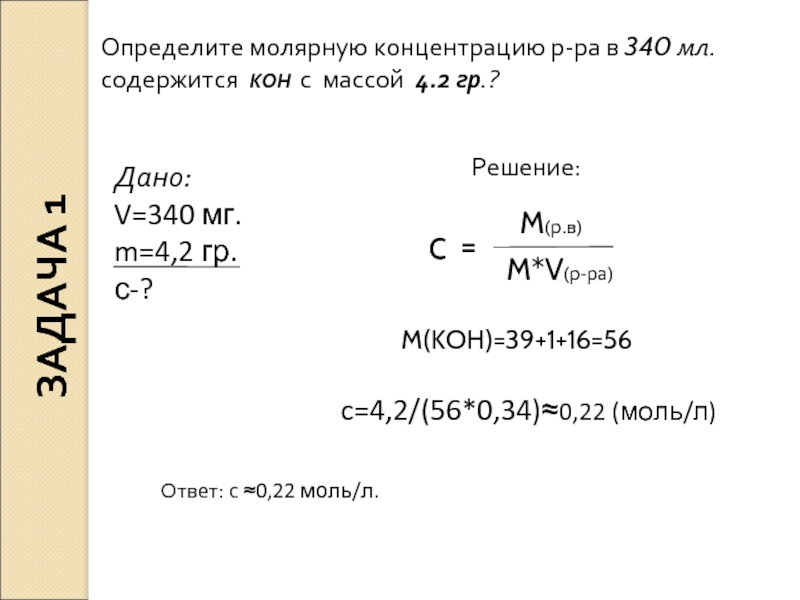 Здесь используемый раствор обычно определяется его молярной концентрацией ( M ). Например;
Здесь используемый раствор обычно определяется его молярной концентрацией ( M ). Например;
Вам нужно приготовить 0,5 М раствор NaCl, решив, что вам нужно 2 литра, сколько NaCl нужно добавить?
- Сначала вы должны рассчитать количество молей в этом растворе, переставив уравнение
. Количество Моль (моль) = Молярность ( M ) x Объем (л)
= 0.5 х 2
= 1 моль - Для NaCl молярная масса 58,44 г/моль
Теперь мы можем использовать переставленное уравнение
. Масса (г) = количество молей (моль) x молярная масса (г/моль)
= 1 х 58,44
= 58,44 г
Таким образом, чтобы получить 2 литра 0,5 М раствора NaCl, нужно добавить 58.44 г NaCl.
Перестраивать уравнение нет необходимости, так как калькулятор сделает это за вас.

Поскольку вы добавляете 58,44 г NaCl к 2 л воды, вы также можете выразить это значение через его концентрацию
Концентрация (г/л) = Масса (г) / Объем (л)
= 58,44 / 2
= 29,22 г/л
Атомная масса ( m a ) – масса одного атома этого элемента, которая обычно отражает массу ядра (протоны плюс нейтроны).Например, водород равен 1. Раньше это измерялось в атомных единицах массы (AMU), но теперь обычно выражается в дальтонах (Да).
Молекулярная масса (также называемая молекулярной массой)
— сумма атомных весов всех атомов, входящих в данную молекулярную формулу. Например, глюкоза имеет молекулярную формулу C 6 H 12 O 6 , молекулярная масса С составляет 12 Да, Н составляет 1 Да и О составляет 16 Да. Следовательно, молекулярная масса глюкозы равна
= (6 х 12) + (12 х 1) + (6 х 16)
= 72 + 12 + 96
= 180 Да
Численно это то же самое, что и молярная масса, отличающаяся только единицами, в которых они выражены.
Относительная атомная масса и относительная молекулярная масса ( M R ) – значения атомной и, следовательно, молекулярной массы обычно получают относительно массы изотопа 12 C (углерод-12), однако «относительная» обычно не упоминается в заголовке. При правильном написании относительные величины не имеют единиц измерения.
Масса формулы (также называемая массой формулы) — сумма атомных масс всех атомов, входящих в данную эмпирическую формулу. Эмпирическая формула указывает соотношение атомов каждого элемента в молекуле, а не фактическое количество.Например, глюкоза (молекулярная формула C 6 H 12 O 6 ) поэтому будет иметь эмпирическую формулу CH 2 O, молекулярная масса C составляет 12 г, H составляет 1 г, а O составляет 16 г. . Следовательно, формула массы глюкозы равна
.
= (1 х 12) + (2 х 1) + (1 х 16)
= 12 + 2 +16
= 30 г
Для таких молекул, как H 2 O, где формула уже находится в простейшей форме, масса формулы и молекулярная масса совпадают.
Нормальность – аналогична молярности, однако при расчете нормальности используется количество молярных эквивалентов, а не количество молей. Единицы: N или экв/л.
Нормальность обычно используется только тогда, когда вещество имеет более одного подвида, которые могут участвовать в определенной реакции, например, протон для кислотно-основных реакций, электрон для реакций окисления/восстановления или в реакциях осаждения.
Например, серная кислота (H 2 SO 4 ) имеет два ионизируемых протона (H + ), которые могут участвовать в нейтрализации основания, такого как гидроксид натрия (NaOH)
. H 2 SO 4 (водн.) + 2 NaOH → 2 Na + (водн.) + 2 H 2 O + SO 4 2+ (водн.)
Если раствор серной кислоты 1 М , то это 2 Н , выраженное как нормальность.Раствор 2 N называется «два нормальных».
Моляльность – аналогична молярности, однако при расчете моляльности используется масса, а не объем используемого растворителя, что делает ее независимой от температуры, в отличие от молярности.
 Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества. в
в б
б в
в Он состоит из 5 г глюкозы в 100 мл раствора.
Он состоит из 5 г глюкозы в 100 мл раствора. Следовательно, это зависит от объема раствора.
Следовательно, это зависит от объема раствора.