Жидкий кислород — Википедия
 Заправка жидкого кислорода в самолёт C-130H Hercules.
Заправка жидкого кислорода в самолёт C-130H Hercules. 
Жи́дкий кислоро́д (ЖК, жO2, LOX[1]) — жидкость бледно-синего цвета, которая относится к сильным парамагнетикам. Является одним из четырёх агрегатных состояний кислорода. Жидкий кислород обладает плотностью 1,141 г/см³(1141 кг/м³) и имеет умеренно криогенные свойства с точкой замерзания 50,5 K (−222,65 °C) и точкой кипения 90,188 K (−182,96 °C).
Жидкий кислород активно используется в космической и газовой отраслях, при эксплуатации подводных лодок, широко используется в медицине. Обычно промышленное получение основывается на фракционной перегонке воздуха. Коэффициент расширения кислорода при смене жидкого агрегатного состояния на газообразное составляет 860:1 при 20 °C, что иногда используется в системах снабжения кислородом для дыхания в коммерческих и военных самолётах.
Основным и практически неисчерпаемым источником получения жидкого кислорода является атмосферный воздух: производится сжижение воздуха и последующее разделение его на кислород и азот.
Из-за своей криогенной природы жидкий кислород может вызвать хрупкость материалов, которые находятся с ним в соприкосновении.
Парамагнетические свойства[править | править код]
Для объяснения отклонения парамагнетических свойств жидкого кислорода от закона Кюри американским физикохимиком Г. Льюисом в 1924 году была предложена молекула тетракислорода (O4).[2] На сегодняшний день теория Льюиса считается лишь частично верной: компьютерное моделирование показывает, что хотя в жидком кислороде не образуется устойчивых молекул O4[3], молекулы O2 на самом деле имеют тенденцию ассоциировать в пары с противоположными спинами, которые формируют временные объединения O 2-O2[3].
Химические свойства[править | править код]
Жидкий кислород также является очень мощным окислительным агентом: органическое вещество быстро сгорает в его среде с большим выделением тепла. Более того, некоторые из этих веществ, будучи пропитанными жидким кислородом имеют свойство непредсказуемо взрываться. Часто так ведут себя нефтепродукты, включая асфальт.
Компонент ракетного топлива[править | править код]
Жидкий кислород является широко распространённым окислительным компонентом ракетных топлив обычно в комбинации с жидким водородом или керосином. Его использование обусловлено высоким удельным импульсом, который получается при применении этого окислителя в ракетных двигателях. Кислород — самый дешевый из применяемых компонентов ракетных топлив. Первое использование имело место в германской БР Фау-2, позднее в американских БР «Редстоун» и РН «Атлас», а также в советской МБР Р-7. Жидкий кислород активно использовался в ранних МБР, но более поздние версии этих ракет его не используют из-за криогенной природы и необходимости регулярной дозаправки для компенсации выкипания окислителя, что затрудняет быстрый запуск. Многие современные ЖРД используют ЖК в качестве окислителя, например РД-180, RS-25.
Изготовление взрывчатки[править | править код]
Жидкий кислород также активно использовался при изготовлении взрывчатки «Оксиликвит», но сейчас она редко используется из-за большого количества происшествий и несчастных случаев.
В качестве уплотнительных прокладочных материалов в системах с жидким кислородом применяются материалы, не теряющие эластичности при низких температурах: паронит, фторопласты, отожженные медь и алюминий.
Хранение и транспортировка больших количеств жидкого кислорода осуществляется в ёмкостях объёмом от нескольких десятков до 1500 м³ из нержавеющей стали, снабженных теплоизоляцией, а также в сосудах Дьюара. Наружный, защитный кожух теплоизоляции может выполняться и из углеродистой стали. Резервуары транспортных ёмкостей изготавливаются также из сплава АМц. Применение вакуумно-порошковой или экранно-вакуумной теплоизоляции позволяет снизить суточные потери кипящего продукта до уровня 0,1—0,5 % (в зависимости от размеров ёмкости) и скорость повышения температуры переохлажденного — до 0,4—0,5 К в сутки.
Транспортировка кипящего кислорода производится с открытым вентилем газосброса, а переохлажденного — при закрытом вентиле, с контролем давления не реже 2 раз в сутки; при повышении давления больше, чем на 0,02 МПа (изб.) вентиль открывается.
Хранение с жидким азотом[править | править код]
Жидкий азот имеет более низкую точку кипения 77 K (−196 °C) и устройства, которые содержат жидкий азот, могут конденсировать кислород из воздуха: когда большая часть азота испаряется из такого устройства возникает риск того, что остаток жидкого кислорода может сильно прореагировать с органическими материалами. С другой стороны, жидкий азот или жидкий воздух может оказаться насыщенным жидким кислородом, если оставить ёмкость на открытом воздухе — атмосферный кислород будет в ней растворяться, в то время как азот будет испаряться быстрее.
Меры безопасности при работе с жидким кислородом[править | править код]
- Кислород — не токсичный продукт, но при работе с ним должны использоваться защитные средства, предохраняющие от возможного обморожения: летом — хлопчатобумажный комбинезон, рукавицы, кожаные сапоги, очки; зимой — валенки, подшитые кожей, тёплые рукавицы, очки.
- Кислород — весьма пожароопасный и даже взрывоопасный продукт в контакте с органическими веществами при наличии даже небольшого теплового импульса. Едва тлеющий на воздухе тепловой очаг разгорается ярким пламенем в атмосфере кислорода. Известны трагические последствия курения на месте недавнего пролива жидкого кислорода на почву. Для воспламенения таких материалов, как паронит, резина, хлопчатобумажная ткань, полиэтилен и др. в атмосфере кислорода достаточно нагрева их всего до 200—300°С. Даже резкое сжатие органического материала, пропитанного кислородом (например, при падении тяжелого предмета на асфальт, облитый жидким кислородом), может вызвать возгорание и взрыв. При контакте с маслами кислород может образовывать с некоторыми их компонентами активные эндотермичные перекисные соединения, накопление которых может приводить к взрыву, поэтому контакт кислорода с такими веществами в любых вариантах, работа в промасленной одежде, замасленными руками или инструментом недопустима. По окончании работ в контакте с жидким или газообразным кислородом запрещается ранее, чем через 20—30 минут подходить к открытому огню, закуривать и тому подобное, так как кислород длительное время удерживается в складках одежды, волосах, что при наличии огня создает пожарную опасность.
- Сварочные и ремонтные работы в ёмкостях и помещениях, где хранится жидкий кислород, должны производиться только после двух-трёхчасового проветривания их тёплым воздухом (70—80°С). Перед заливкой кислорода в новую ёмкость последняя обезжиривается.
- При перекачке жидкого кислорода производится предварительное «захолаживание» системы малым расходом продукта. Без этого в «горячей» системе образуется интенсивный поток газифицированного кислорода, который при наличии резких поворотов и перепадов давления на элементах системы (вентили и тому подобное) может вызвать возгорание металла.
Свойства кислорода — урок. Химия, 8–9 класс.
Простое вещество кислород состоит из двухатомных молекул. Атомы в молекуле связаны ковалентной неполярной связью. Связь двойная, так как у каждого атома имеются два неспаренных электрона на внешнем энергетическом уровне. Структурная и электронная формулы кислорода:
O=O, :O:..:O:..
Физические свойства
При комнатной температуре кислород — газ без цвета, запаха и вкуса. Он примерно в \(1,1\) раза тяжелее воздуха.
При температуре \(–183\) °С кислород сжижается и превращается в голубую жидкость, а при \(–218\) \( \)°С становится твёрдым.
Кислород плохо растворяется в воде. При \(20\) °С в \(1\) объёме воды растворяется примерно \(3,1\) объёма кислорода. Растворимость кислорода, так же как и других газов, зависит от температуры. С повышением температуры растворимость уменьшается.
Химические свойства
Связь в молекуле кислорода прочная. При обычных условиях это малоактивный газ, который вступает в реакции только с наиболее активными веществами: щелочными и щелочноземельными металлами. При повышении температуры активность кислорода резко возрастает. Он энергично реагирует с большинством простых и многими сложными веществами, проявляя при этом окислительные свойства.
Почти все реакции с кислородом экзотермичны, поэтому нагревание требуется лишь для начала процесса. Большинство реакций с участием кислорода сопровождается выделением тепла и света. Такие реакции называют реакциями горения.
- Взаимодействие с простыми веществами-неметаллами.
При нагревании неметаллы (кроме инертных газов и галогенов) сгорают в кислороде с образованием оксидов. Если серу зажечь и опустить в сосуд с кислородом, то она сгорает ярким синим пламенем. При этом образуется сернистый газ:
Зажжённый фосфор горит в кислороде белым пламенем. Сосуд заполняется дымом, состоящим из мелких частиц оксида фосфора(\(V\)):
4P+5O2=t2P2O5+Q.
Подобным образом протекают реакции с углеродом, кремнием, водородом:
C+O2=tCO2+Q,
Si+O2=tSiO2+Q,
2h3+O2=t2h3O+Q.
Реакция азота с кислородом идёт с поглощением тепла. Для её протекания требуется высокая температура:
N2+O2⇄3000°C2NO−Q.
- Взаимодействие с простыми веществами-металлами.
Активные металлы реагируют с кислородом при комнатной температуре:
4Li+O2=2Li2O,
2Ca+O2=2CaO+Q.
При нагревании реагируют менее активные металлы:
2Cu+O2=t2CuO.
Многие металлы сгорают в кислороде. Так, раскалённое железо в чистом кислороде начинает ярко светиться и разбрасывать яркие искры:
3Fe+2O2=tFe3O4+Q.
В реакции с железом образуется смешанный оксид: Fe3O4 (FeO⋅Fe2O3).
Неактивные металлы (золото, платина, серебро) с кислородом не реагируют.
- Взаимодействие со сложными веществами.
В кислороде горят многие сложные органические и неорганические вещества. При этом, как правило, образуются оксиды элементов, входящих в состав этих веществ:
Ch5+2O2=tCO2+2h3O+Q,
2h3S+3O2=t2SO2+2h3O+Q,
2CO+O2=t2CO2+Q.
Что такое жидкий кислород: общая информация :: SYL.ru
Кислород – самый распространенный элемент на планете. Он присутствует в воде, земной коре, воздухе и в организмах живых существ, активно участвуя во многих обменных процессах. В природе он обычно существует в виде газа, а в промышленности часто используется в качестве жидкости. Как ведет себя жидкий кислород? Какими свойствами он обладает и где используется?
Газ кислород
Кислород – один из важнейших элементов на планете. Он участвует в процессе дыхания, в метаболизме живых организмов, а также в круговороте веществ в биосфере. Кроме того, он способствует гниению и разложению органических остатков.
В нормальных условиях он является бесцветным газом, который не имеет вкуса и запаха. Он тяжелее воздуха и с трудом растворяется в воде. В химическом плане он очень активен и способен образовывать соединения практически со всеми элементами.
В свободном состоянии в виде молекул О2, состоящих из двух атомов оксигена, он находится в атмосфере. Благодаря такому строению элемент также называется «дикислородом», но он может существовать и в других вариациях. При определенных условиях его атомы могут образовывать «трикислород» с молекулой О3, которая представляет собой голубой газ озон со специфическим запахом.
В атмосфере содержание кислорода составляет примерно 21 % по массе, в земной коре его доля значительно выше и составляет около 47 % по массе. Элемент входит в состав более полутора тысяч разнообразных пород и минералов, большая часть из которых являются силикатами. Там он присутствует в виде соединений. В воде его содержание доходит до 85 %, и это не удивительно, ведь атомы оксигена и образуют воду вместе с элементом гидрогеном.

Жидкий кислород
Как и другие вещества, кислород может пребывать в различных агрегатных состояниях. Чтобы превратить газ в твердое тело или жидкость, его нужно сильно охладить. При давлении в 51 атмосферу он становится жидким уже при -119 °C. При нормальном давлении превращение происходит только при -183 °C. Охлаждаясь до температуры -220 °C, он затвердевает, образуя светло-голубые снегоподобные кристаллы.
В жидком состоянии кислород окрашивается в голубой оттенок и усиливает некоторые свойства газообразного вещества. Так, он ведет себя более агрессивно в химических реакциях, а также становится сильным парамагнетиком и может притягиваться магнитом.

Он закипает только при -183 °C, а плавится при +219 °C. Благодаря устойчивости к столь низким температурам жидкий кислород обладает криогенными свойствами и может использоваться в качестве хладагента. В нормальных условиях он быстро испаряется, превращаясь в газ. При этом он усиленно поглощает тепло и охлаждает окружающий воздух, отчего рядом с ним появляется ореол тумана. Во время испарения объем кислорода увеличивает в несколько сотен раз. Так, 1 см3 жидкости образует почти 800 см3 газа.
Химические свойства
Газообразный кислород является окислителем. Сам по себе он негорюч, но хорошо поддерживает процесс горения, а при значительной концентрации и высоких температурах является взрывоопасным.
С активными веществами (например, щелочными металлами) он может вступать в реакции даже при комнатной температуре и при обыкновенной концентрации в воздухе, образуя с ними соединения оксиды. Результат хорошо виден на многих металлах, на которых он проявляется в виде коррозии.
Жидкий кислород также обладает сильными окислительными свойствами. Многие пропитанные им вещества легко воспламеняются и горят с выделением энергии и тепла. Хлопок, бумага, дерево, уголь и некоторые другие материалы могут взрываться.

Получение
Самым распространенным и легким в получении источником кислорода является воздух. К тому же он неиссякаем и присутствует в нашей жизни повсеместно. Чтобы получить из него необходимые вещества, его сжижают, а затем разделяют на жидкий азот и кислород.
Еще один способ получения жидкости – конденсация ее из газа. Для этого достаточно опустить медный змеевик в контейнер с жидким азотом, а затем пропустить через змеевик газообразный кислород. Температура азота ниже, чем у кислорода, поэтому, проходя по медной трубке, газ будет конденсироваться и превратится в жидкость. При этом на поверхности змеевика образуется небольшой слой снега.
Применение
Способность жидкого кислорода окислять другие вещества и усиливать горение ценятся во многих сферах производства. В конце XIX – середине XX века из него изготавливали взрывчатку «Оксиликвит», которую использовали в горной промышленности для подрыва породы, а также в качестве оружия во Второй мировой войне.

Сегодня его чаще применяют в медицине, фармацевтике, в металлургии, стекольной, химической, бумажной и других видах промышленности. С его помощью получают различные полезные соединения, например окись титана, которая участвует в производстве лакокрасочных изделий, бумаги и пластмасс. При изготовлении стекла он нужен для поддержания жара в печах, а также для уменьшения количества окиси азота, попадающей в атмосферу. В космической авиации жидкий кислород является одним из компонентов ракетного топлива, где он используется в качестве окислителя, а в роли самого топлива выступает водород или керосин.
В медицине и фармацевтике без него тоже не обходится. Жидкий кислород входит в состав биореакторов, а также используется в качестве добавки к ферментам. В медицине он необходим для анестезии, приготовления кислородных ванн и коктейлей, лечения или облегчения состояния при интоксикации, астме и других недугах. Здесь он чаще всего не используется напрямую в виде жидкости, а является источником газообразного кислорода.
Хранение и меры предосторожности
Жидкий кислород не возгорается и не взрывается сам по себе, он не токсичен для человека и не вреден для окружающей среды. Однако активная реакция в химических процессах, а также криогенный эффект делают его не совсем безопасным веществом.

При работе с ним нужно держать подальше смазочные, горючие и легковоспламеняющиеся материалы, а также всегда использовать перчатки и спецодежду. Кислород очень низкой температуры легко повреждает кожу и может привести к обморожению, травмам и отмиранию живых клеток. Если жидкость покрывает значительную часть тела, все может закончиться даже летальным исходом.
Технический и медицинский жидкий кислород хранят сосудах Дьюара, которые делают преимущественно из стали или алюминия. Это цилиндрические контейнеры с двойными стенками, между стенками которых располагается вакуумная полость, а также теплоизоляционные материалы. Они работают по принципу термосов, хорошо сохраняя жидкости внутри.
Кислород: физические и химические свойства

Содержание:
Пожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ – вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.
Эта статья доступна на английском языке – Oxygen.
Формула кислорода. Периодическая таблица Менделеева
Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: H2RO3, H2RO4.
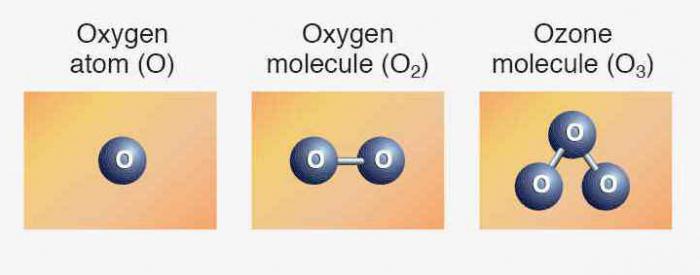
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента — озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
Строение атома кислорода
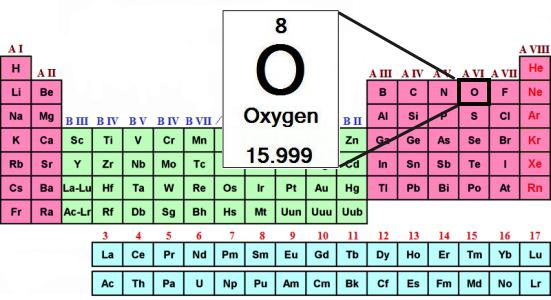
Периодическая таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
- Общее число электронов — 8.
- Электронная формула кислорода — 1s22s22p4.
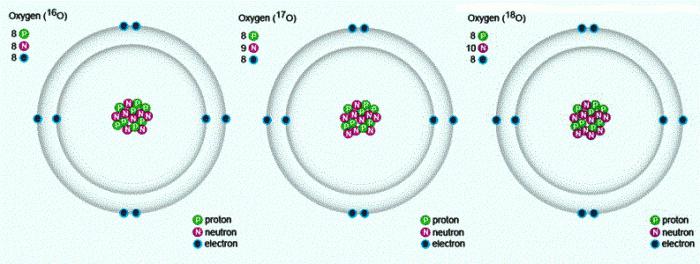
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
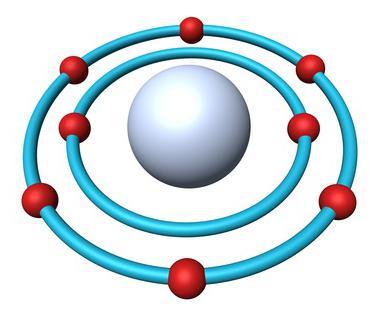
Кислород — простое вещество
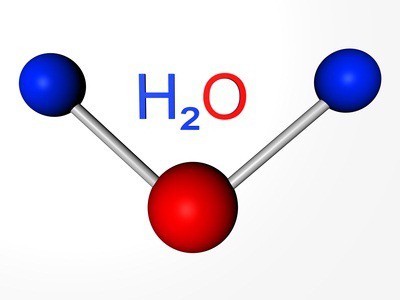
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода — разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
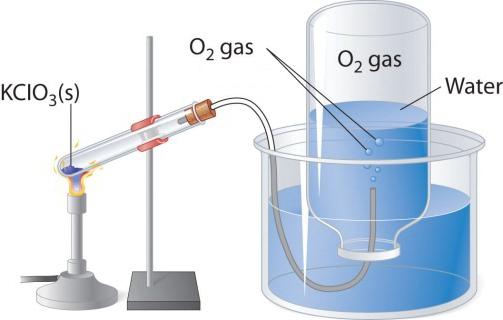
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
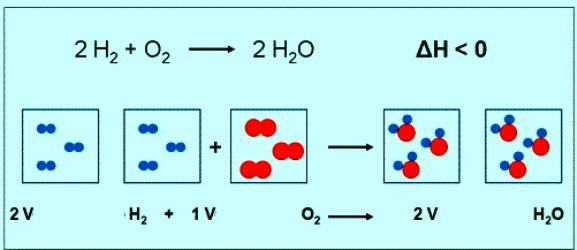
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
Кислород история — Знаешь как
То что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в.—швед Карл Виль гельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликовав позже, чем сообщение об открытии Пристли.
И все-таки тловпля фигура в истории открытия кислорода — не Шееле и не Пристли. Они открыли новый газ — и только. Открыли кислород — и до конца дней своих остались ревноствыми защитниками теории флогистона! Теории — некогда полезной, но к концу XVIII в. ставшей уже «кандалами на ногах науки».
Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно… Собственно открывшим кислород поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли. Спустя два месяца после открытия «дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый «воздух» выделяется.До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек «ртутной окалины» и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 г «ртутной окалины» и получил 2,5 г ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймов воздуха, а остаток его стал «а-зотом» — не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его «жизненным газом». Лавуазье выяснил сущность горения. И надобность в флогистоне — «огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе № 8 современной науке известно абсолютно все. Рассказывать в популярной статье о свойствах кислорода — дело в высшей степени неблагодарное. С одной стороны, этот элемент сам по себе слишком популярен п, рассказывая о нем, рискуешь повторять многочисленные учебники. Одна из характерных особенностей кислорода состоит в том, что, наверное, во всех странах этот элемент «проходят» в школе…
Но с другой стороны, для объяснения свойств кислорода иногда приходится забираться в такие научные дебри, лексикон которых крайне трудно «переводится» на общепринятый язык.
Возьмем, к примеру, такое свойство кислорода, как па-рамагнитность. Именно магнитными свойствами элемент № 8 отличается от всех прочих газообразных (при обычных условиях) элементов. Кислород — активный окислитель, но есть и другие элементы-окислители, например фтор. Кислород превращается в жидкость при очень низких температурах — но у водорода, гелия, азота точки I кипения лежат еще ниже. А вот другого парамагнетика среди газообразных элементов нет.Видимое проявление парамагнетизма — способность вещества втягиваться в магнитное поле — объясняется тем, что у молекул парамагнитных веществ есть собственный магнитный момент. Есть он и у молекул кислорода, но откуда он берется?Внешняя электронная оболочка кислородного атома состоит из шести электронов. Четыре из них—спаренные—объединены в две пары, а два — «холостые». Спаренные электроны отличаются друг от друга лишь спином. Спин — это внутренний момент количества движения частицы, имеющий квантовую природу. Именно этими «моментами» определяются все магнитные свойства вещества (диамагнетизм, ферромагнетизм, парамагнетизм и т. д.). Физический носитель магнитных свойств — не просто электрон, а именно неспаренный электрон, потому что спаренные электроны образуют устойчивую систему, не имеющую собственного магнитного момента.
Идя путем спортивных аналогий, можно сказать, что спаренный электрон подобен футболисту, который получил на игру установку «не упустить» одного из соперников. А тот ведет себя в соответствии с установкой своего тренера: следи за опекающим тебя защитником, подключившись в атаку, он, дескать, очень опасен. Оба увлечены «взаимоудержанием» и в каком-то смысле выпадают из игры — футбольной или магнитной. Зато неспаренный электрон — это «блуждающий форвард», от которого можно ждать чего угодно (правда, как и в спорте, в рамках определенных правил).
Итак, способность молекул кислорода втягиваться в магнитное поле показывает, что они обладают неспарен-ными электронами. На первый взгляд в этом нет ничего удивительного: давно установлено, что каждый атом кислорода имеет на внешней оболочке два неспаренных электрона. Но могут ли они остаться неспаренными при объединении двух атомов кислорода в молекулу?
Очевидно, каждая молекула 02 должна образовываться при помощи двух ковалентных связей 0=0. Но в этом случае на построение молекулы были бы израсходованы все четыре неспаренных электрона. И тогда у молекулы кислорода не могло бы быть парамагнитных свойств. Но парамагнетизм элемента № 8 — факт, многократно подтвержденный в эксперименте.
Высказывалось предположение, что на образование двухатомной молекулы каждый атом кислорода затрачивает лишь один неспаренный электрон, а другой так и остается «холостым», и эти электроны делают молекулу парамагнитной. Однако такое объяснение противоречит экспериментальным данным. Для разрыва одинарных связей в грамм-молекуле кислорода потребовалось бы около 50 ккал; в действительности же приходится тратить в два с лишним раза больше энергии.
Выходит, что в молекуле кислорода не может быть ни двойной, ни одинарной связи. Тогда какая же она, эта связь?
Единого мнения на этот счет у ученых до сих пор нет, и многие детали строения молекулы кислорода еще не полностью выяснены. Вполне удовлетворительно, правда, объяснение свойств кислородной молекулы с помощью выдвинутого квантовой химией метода молекулярных орбит. Однако это объяснение слишком сложно, чтобы говорить о нем вскользь в популярной статье.
Теперь о других —более понятных и легче объяснимых свойствах элемента № 8.
Как и положено элементу, занимающему место в правом верхнем углу таблицы Менделеева, кислород обладает ярко выраженными окислительными свойствами. Наружная электродная оболочка атома кислорода состоит из шести электронов, и к предельно заполненной оболочке (условие максимальной химической устойчивости) атом кислорода может прийти двумя путями: или захватив два «посторонних» электрона, или отдав шесть. Первый путь, естественно, проще, он требует меньших затрат энергии. Поэтому в реакциях с подавляющим большинством атомов кислород выступает в роли окислителя. Если можно так выразиться, окислительнее кислорода только один элемент — фтор. Лишь в реакциях с фтором окислителем оказывается не элемент № 8, а его партнер.
Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание — чтобы преодолеть потенциальный барьер, препятствующий химическому процессу. Энергетическая «добавка» (энергия активации) в разных реакциях нужна разная. С фосфором кислород активно реагирует при нагревании последнего до 60, с серой — до 250, с водородом — больше 300, с углеродом (в виде графита) — при 700—800° С. Правда, есть вещества, например окись азота, соединения одновалентной меди и, к счастью, гемоглобин крови, способные реагировать с кислородом и при комнатной температуре. С помощью катализаторов, снижающих энергию активации, могут идти без подогрева и другие процессы, в частности соединение кислорода с водородом.
Обычно же эта реакция идет при повышенных температурах и протекает очень бурно — может даже перейти во взрыв. Такой процесс происходит по схеме разветвленной цепной реакции. (Теория цепных реакций создана в результате работы многих ученых и в первую очередь — лауреата Нобелевской премии академика Н. И. Семенова.) Цепные реакции начинаются с образования нестабильных активных частиц — свободных радикалов, «носителей» неспаренных электронов (на схеме они обозначены звездочками). Они-то и ведут реакцию «по цепочке»: Высокая окислительная способность кислорода лежит в основе горения всех видов топлива, включая пороха, для горения которых не нужен кислород воздуха: в процессе горения таких веществ кислород выделяется из них самих.
Кислород — один из сильных окислителей. Об этом можно судить хотя бы потому, что баки с жидким кислородом — необходимая принадлежность большинства жидкостных ракетных двигателей.
Впрочем, далеко не всегда окислительные реакции с участием кислорода выглядят как стихия пламени или взрыва.
Процессы медленного окисления различных веществ при обычной температуре имеют для жизни не меньшее значение, чем горение — для энергетики.
Медленное окисление веществ пищи в нашем организме — «энергетическая база» жизни. (Заметим попутно, что наш организм не слишком экономно использует вдыхаемый кислород: в выдыхаемом воздухе кислорода примерно 16%.) Тепло преющего сена — результат медленного окисления органических веществ растительного происхождения. Медленное окисление навоза и перегноя согревает парники…
Но не всегда медленное окисление органических веществ безвредно и безопасно. Если тепло, выделяющееся в этом процессе, не отводится, может произойти самовоспламенение. Это известно издавна. В учебнике химии, выпущенном в России в 1812 г., рассказывалось о пожарах в Петербурге, вызванных этим явлением. «В 1770 г. сделался великий пожар в пеньковом магазине на острове Малыя Невы, где совсем не держали огня». Правда, в том же учебнике рассказывалось о случае самовоспламенения «одной старухи из Северной Америки» с примечанием, что «сие происходит преимущественно с людьми, невоздержанными в употреблении спиртных напитков»…
Памятуя о необходимости борьбы с пьянством силами печати и науки, не стоило бы опровергать подобные заявления. Но, увы, факты —вещь упрямая: человеческий организм рассеивает тепло в пространстве, и даже самые прожженные пьяницы физически не могут самовоспламениться. Хорошо, что с научной точки зрения противоположный тезис — пьяного бог бережет — столь же несостоятелен.
Заканчивая главу о свойствах и особенностях кислорода, напомним — совсем коротко — о круговороте этого элемента в природе.
Если бы растения в процессе фотосинтеза не превращали воду и углекислый газ в органические соединения и этот процесс не сопровождался высвобождением связанного кислорода, то, исчерпав довольно быстро запасы атмосферного кислорода, весь животный мир, включая человечество, вскоре задохнулся бы. Но и растениям после этого пришлось бы несладко.Дело в том, что растения, подобно животным, потребляют атмосферный кислород, правда, они делают это исключительно в темное время суток. На ночь, когда прекращаются процессы фотосинтеза, растения из производителей кислорода превращаются в его потребителей. Это явление наблюдал еще Шееле. А другой первооткрыватель кислорода Дж. Пристли еще до того, как кислород был открыт, выяснил, что зеленая ветка мяты, помещенная под стеклянный колпак с воздухом, в котором уже погасла свеча, возвращает этому воздуху способность поддерживать дыхание и горение.
Статья на тему Кислород история
Кислород химический элемент
По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности же все эти три эпитета вполне можно отнести к химическому элементу с атомным номером 8 — кислороду. Кислород — вездесущ: из него в значительной степени состоят не только воздух, вода и земля, но и мы с вами, наши еда, питье, одежда; в подавляющем большинстве окружающих нас веществ есть кислород.
Могущество кислорода проявляется уже в том, что мы им дышим, а ведь дыхание это синоним жизни. «Dum spiro — spero»: пока дышу, — надеюсь… Это Овидий. И еще кислород можно считать всемогущим потому, что могучая стихия огня, как правило, сильно зависит от нашего кандидата в вездесущие и всемогущие.
Что касается третьего эпитета — «невидимый», то здесь, вероятно, нет нужды в доказательствах. При обычных условиях элементный кислород не только бесцветен и потому невидим, но и не воспринимаем, не ощутим никакими органами чувств. Правда, недостаток, а тем более отсутствие кислорода мы ощутили бы моментально.
Опасаясь быть заподозренным в ереси и поповщине одновременно, автор вынужден признаться: идею сравнить кислород с господом богом он придумал не сам, а заимствовал ее у одного из персонажей поэмы Алексея Константиновича Толстого «Поток-богатырь». Там есть строки о некоем аптекаре, который «пред толпою ученье проводит, что мол нету души, а одна только плоть, и что если и впрямь существует господь, то он только есть вид кислорода».
Итак, кислород — элемент с атомным номером 8, «газ дыхания и горения», самый распространенный на Земле элемент.
Троекратное открытие кислорода
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие. Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
Кислород открыли почти одновременно два выдающихся химика второй половины XVIII в. — швед Карл Вильгельм Шееле и англичанин Джозеф Пристли. Шееле получил кислород раньше, но его трактат «О воздухе и огне», содержавший информацию о кислороде, был опубликован позже, чем сообщение об открытии Пристли.
И все-таки главная фигура в истории открытия кислорода — не Шееле и не Пристли. Они открыли новый газ — и только. Открыли кислород — и до конца дней своих остались ревностными защитниками теории флогистона! Теории — некогда полезной, но к концу XVIII в. ставшей уже «кандалами на ногах науки».
Позже Фридрих Энгельс напишет об этом: «Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суждено было революционизировать химию, пропадал в их руках бесследно… Собственно открывшим кислород поэтому остается Лавуазье, а не те двое, которые только описали кислород, даже не догадываясь, что они описывают».
Великий французский химик Антуан Лоран Лавуазье (тогда еще очень молодой) узнал о кислороде от самого Пристли, Спустя два месяца после открытия «дефлогистонированного воздуха» Пристли приехал в Париж и подробно рассказал о том, как было сделано это открытие и из каких веществ (ртутная и свинцовая окалины) новый «воздух» выделяется.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Лавуазье наблюдал образование красных чешуек «ртутной окалины» и уменьшение объема воздуха при нагревании ртути в запаянной реторте. В другой реторте, применив высокотемпературный нагрев, он разложил полученные в предыдущем опыте 2,7 г «ртутной окалины» и получил 2,5 г ртути и 8 кубических дюймов того самого газа, о котором рассказывал Пристли. В первом опыте, в котором часть ртути была превращена в окалину, было «потеряно» как раз 8 кубических дюймов воздуха, а остаток его стал «а-зотом» — не жизненным, не поддерживающим ни дыхания, ни горения. Газ, выделенный при разложении окалины, проявлял противоположные свойства, и потому Лавуазье вначале назвал его «жизненным газом». Лавуазье выяснил сущность горения. И надобность в флогистоне — «огненной материи», якобы выделяющейся при сгорании любых горючих, отпала.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе № 8 современной науке известно абсолютно все.
Об известном и не слишком известном кислороде
Рассказывать в популярной статье о свойствах кислорода — дело в высшей степени неблагодарное. С одной стороны, этот элемент сам по себе слишком популярен и, рассказывая о нем, рискуешь повторять многочисленные учебники. Одна из характерных особенностей кислорода состоит в том, что, наверное, во всех странах этот элемент «проходят» в школе…
Но с другой стороны, для объяснения свойств кислорода иногда приходится забираться в такие научные дебри, лексикон которых крайне трудно «переводится» на общепринятый язык.
Возьмем, к примеру, такое свойство кислорода, как парамагнитность. Именно магнитными свойствами элемент № 8 отличается от всех прочих газообразных (при обычных условиях) элементов. Кислород — активный окислитель, но есть и другие элементы-окислители, например фтор. Кислород превращается в жидкость при очень низких температурах — но у водорода, гелия, азота точки кипения лежат еще ниже. А вот другого парамагнетика среди газообразных элементов нет.
Видимое проявление парамагнетизма — способность вещества втягиваться в магнитное поле — объясняется тем, что у молекул парамагнитных веществ есть собственный магнитный момент. Есть он и у молекул кислорода, но откуда он берется?
Внешняя электронная оболочка кислородного атома состоит из шести электронов. Четыре из них — спаренные — объединены в две пары, а два — «холостые». Спаренные электроны отличаются друг от друга лишь спином. Спин — это внутренний момент количества движения частицы, имеющий квантовую природу. Именно этими «моментами» определяются все магнитные свойства вещества (диамагнетизм, ферромагнетизм, парамагнетизм и т. д.). Физический носитель магнитных свойств — не просто электрон, а именно неспаренный электрон, потому что спаренные электроны образуют устойчивую систему, не имеющую собственного магнитного момента.
Идя путем спортивных аналогий, можно сказать, что спаренный электрон подобен футболисту, который получил на игру установку «не упустить» одного из соперников. А тот ведет себя в соответствии с установкой своего тренера: следи за опекающим тебя защитником, подключившись в атаку, он, дескать, очень опасен. Оба увлечены «взаимоудержанием» и в каком-то смысле выпадают из игры — футбольной или магнитной. Зато неспаренный электрон — это «блуждающий форвард», от которого можно ждать чего угодно (правда, как и в спорте, в рамках определенных правил).
Итак, способность молекул кислорода втягиваться в магнитное поле показывает, что они обладают неспаренными электронами. На первый взгляд в этом нет ничего удивительного: давно установлено, что каждый атом кислорода имеет на внешней оболочке два неспаренных электрона. Но могут ли они остаться неспаренными при объединении двух, атомов кислорода в молекулу?
Очевидно, каждая молекула O2 должна образовываться при помощи двух ковалентных связей O=O. Но в этом случае на построение молекулы были бы израсходованы все четыре неспаренных электрона. И тогда у молекулы кислорода не могло бы быть парамагнитных свойств. Но парамагнетизм элемента № 8 — факт, многократно подтвержденный в эксперименте.
Высказывалось предположение, что на образование двухатомной молекулы каждый атом кислорода затрачивает лишь один неспаренный электрон, а другой так и остается «холостым», и эти электроны делают молекулу парамагнитной. Однако такое объяснение противоречит экспериментальным данным. Для разрыва одинарных связей в грамм-молекуле кислорода потребовалось бы около 50 ккал; в действительности же приходится тратить в два с лишним раза больше энергии.
Выходит, что в молекуле кислорода не может быть ни двойной, ни одинарной связи. Тогда какая же она, эта связь?
Единого мнения на этот счет у ученых до сих пор нет, и многие детали строения молекулы кислорода еще не полностью выяснены. Вполне удовлетворительно, правда, объяснение свойств кислородной молекулы с помощью выдвинутого квантовой химией метода молекулярных орбит. Однако это объяснение слишком сложно, чтобы говорить о нем вскользь в популярной статье.
Теперь о других — более понятных и легче объяснимых свойствах элемента № 8.
Как и положено элементу, занимающему место в правом верхнем углу таблицы Менделеева, кислород обладает ярко выраженными окислительными свойствами. Наружная электронная оболочка атома кислорода состоит из шести электронов, и к предельно заполненной оболочке (условие максимальной химической устойчивости) атом кислорода может прийти двумя путями: или захватив два «посторонних» электрона, или отдав шесть. Первый путь, естественно, проще, он требует меньших затрат энергии. Поэтому в реакциях с подавляющим большинством атомов кислород выступает в роли окислителя. Если можно так выразиться, окислительнее кислорода только один элемент — фтор. Лишь в реакциях с фтором окислителем оказывается не элемент № 8, а его партнер.
Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание — чтобы преодолеть потенциальный барьер, препятствующий химическому процессу. Энергетическая «добавка» (энергия активации) в разных реакциях нужна разная. С фосфором кислород активно реагирует при нагревании последнего до 60, с серой — до 250, с водородом — больше 300, с углеродом (в виде графита) — при 700 — 800°С. Правда, есть вещества, например окись азота, соединения одновалентной меди и, к счастью, гемоглобин крови, способные реагировать с кислородом и при комнатной температуре. С помощью катализаторов, снижающих энергию активации, могут идти без подогрева и другие процессы, в частности соединение кислорода с водородом.
Обычно же эта реакция идет при повышенных температурах и протекает очень бурно — может даже перейти во взрыв. Такой процесс происходит но схеме разветвленной цепной реакции. (Теория ценных, реакций создана в результате работы многих ученых и в первую очередь — лауреата Нобелевской премии академика Н.Н. Семенова.) Ценные реакции начинаются с образования нестабильных активных частиц — свободных радикалов, «носителей» неспаренных электронов
Кислород — один из сильных окислителей. Об этом можно судить хотя бы потому, что баки с жидким кислородом — необходимая принадлежность большинства жидкостных ракетных двигателей. Впрочем, далеко не всегда окислительные реакции с участием кислорода выглядят как стихия пламени или взрыва.
Процессы медленного окисления различных, веществ при обычной температуре имеют для жизни не меньшее значение, чем горение — для энергетики.
Медленное окисление, веществ пищи в пашем организме — «энергетическая база» жизни. (Заметим попутно, что наш организм не слишком экономно использует вдыхаемый кислород: в выдыхаемом воздухе кислорода примерно 16%.) Тепло преющего сена — результат медленного окисления органических веществ растительного происхождения. Медленное окисление навоза и перегноя согревает парники…
Но не всегда медленное окисление органических веществ безвредно и безопасно. Если тепло, выделяющееся в этом процессе, не отводится, может произойти самовоспламенение. Это известно издавна. В учебнике химии, выпущенном в России в 1812 г., рассказывалось о пожарах в Петербурге, вызванных этим явлением. «В 1770 г. сделался великий пожар в пеньковом магазине на острове Малыя Невы, где совсем не держали огня». Правда, в том же учебнике рассказывалось о случае самовоспламенения «одной • старухи из Северной Америки» с примечанием, что «сие происходит преимущественно с людьми, невоздержанными в употреблении спиртных напитков»…
Памятуя о необходимости борьбы с пьянством силачи печати и науки, не стоило бы опровергать подобные заявления. Но, увы, факты — вещь упрямая: человеческий организм рассеивает тепло в пространстве, и даже самые прожженные пьяницы физически не могут самовоспламениться. Хорошо, что с научной точки зрения противоположный тезис — пьяного бог бережет — столь же несостоятелен.
Заканчивая главу о свойствах и особенностях кислорода, напомним — совсем коротко — о круговороте этого элемента в природе.
Если бы растения в процессе фотосинтеза не превращали воду и углекислый газ в органические соединения и этот процесс не сопровождался высвобождением связанного кислорода, то, исчерпав довольно быстро запасы атмосферного кислорода, весь животный мир, включая человечество, вскоре задохнулся бы. Но и растениям после этого пришлось бы несладко.
Дело в том, что растения, подобно животным, потребляют атмосферный кислород, правда, они делают это исключительно в темное время суток. На ночь, когда прекращаются процессы фотосинтеза, растения из производителей кислорода превращаются в его потребителей. Это явление наблюдал еще Шееле. А другой первооткрыватель кислорода Дж. Пристли еще до того, как кислород был открыт, выяснил, что зеленая ветка мяты, помещенная под стеклянный колпак с воздухом, в котором уже погасла свеча, возвращает этому воздуху способность поддерживать дыхание и горение.