Каков характер оксидов
Поговорим о том, как определить характер оксида. Начнем с того, что все вещества принято подразделять на две группы: простые и сложные. Простые вещества подразделяют на металлы и неметаллы. Сложные соединения делят на четыре класса: основания, оксиды, соли, кислоты.

Определение
Так как характер оксидов зависит от их состава, для начала дадим определение данному классу неорганических веществ. Оксиды представляют собой сложные вещества, которые состоят из двух элементов. Особенность их в том, что кислород всегда располагается в формуле вторым (последним) элементом.
Самым распространенным вариантом считают взаимодействие с кислородом простых веществ (металлов, неметаллов). Например, при взаимодействии магния с кислородом образуется оксид магния, проявляющий основные свойства.

Номенклатура
Характер оксидов зависит от их состава. Существуют определенные правила, по которым называют такие вещества.
Если оксид образован металлами главных подгрупп, валентность не указывается. Например, оксид кальция СаО. Если же в соединении первым располагается металл подобной подгруппы, который обладает переменной валентностью, то она обязательно указывается римской цифрой. Ставится после названия соединения в круглых скобках. Например, существуют оксиды железа (2) и (3). Составляя формулы оксидов, нужно помнить о том, что сумма степеней окисления в нем должна быть равна нулю.

Классификация
Рассмотрим, как характер оксидов зависит от степени окисления. Металлы, имеющие степень окисления +1 и +2, образуют с кислородом основные оксиды. Специфичной особенностью таких соединений является основный характер оксидов. Такие соединения вступают в химическое взаимодействие с солеобразующими оксидами неметаллов, образуя с ними соли. Кроме того, основные оксиды реагируют с кислотами. Продукт взаимодействия зависит от того, в каком количестве были взяты исходные вещества.
Неметаллы, а также металлы со степенями окисления от +4 до +7, образуют с кислородом кислотные оксиды. Характер оксидов предполагает взаимодействие с основаниями (щелочами). Результат взаимодействия зависит от того, в каком количестве была взята исходная щелочь. При ее недостатке в качестве продукта взаимодействия образуется кислая соль. Например, в реакции оксида углерода (4) с гидроксидом натрия образуется гидрокарбонат натрия (кислая соль).
В случае взаимодействия кислотного оксида с избыточным количеством щелочи продуктом реакции будет средняя соль (карбонат натрия). Характер кислотных оксидов зависит от степени окисления.
Они подразделяются на солеобразующие оксиды (в которых степень окисления элемента равна номеру группы), а также на безразличные оксиды, не способные образовывать соли.
Амфотерные оксиды
Есть и амфотерный характер свойств оксидов. Суть его заключается во взаимодействии этих соединений и с кислотами, и со щелочами. Какие оксиды проявляют двойственные (амфотерные) свойства? К ним относят бинарные соединения металлов со степенью окисления +3, а также оксиды бериллия, цинка.
Способы получения
Существуют различные способы получения оксидов. Самым распространенным вариантом считают взаимодействие с кислородом простым веществ (металлов, неметаллов). Например, при взаимодействии магния с кислородом образуется оксид магния, проявляющий основные свойства.
Кроме того, получить оксиды можно и при взаимодействии сложных веществ с молекулярных кислородом. Например, при горении пирита (сульфида железа 2) можно получить сразу два оксида: серы и железа.
Еще одним вариантом получения оксидов считается реакция разложения солей кислородсодержащих кислот. Например, при разложении карбоната кальция можно получить углекислый газ и оксид кальция (негашеную известь).
Основные и амфотерные оксиды образуются и при разложении нерастворимых оснований. Например, при прокаливании гидроксида железа (3) образуется оксид железа (3), а также водяной пар.
Заключение
Оксиды являются классом неорганических веществ, имеющем широкое промышленное применение. Они используются в строительной сфере, фармацевтической промышленности, медицине.
Кроме того, амфотерные оксиды часто используют в органическом синтезе в качестве катализаторов (ускорителей химических процессов).
Характер оксидов и гидроксидов I-VII групп
Номер группы | I | II | III | IV | V | VI | VII |
Оксиды, их характер | R2O Осн. | RO Осн., амф. | R2O3 Осн., амф., кисл. | RO Кисл. | R2O5 Кисл. | RO3 Кисл. | R2O7 Кисл. |
Гидроксиды, их характер | ROH Осн. | R(OH)2 Осн., амф.гидр. | R(OH)3 H3RO3 Осн., амф.гидр., кислота | H2RO3 Кислота | HRO3 H3RO4 Кислота | H2 RO4Кислота | HRO4 Кислота |
Химическая связь
Вид химической связи зависит от электроотрицательности образующих её элементов.
Ионная связь
Образуется при взаимодействии атомов элементов, резко отличающихся друг от друга значениями электроотрицательности (Ме + НеМе).

Свойства: ненаправленность, ненасыщаемость.
Соединения: твердые, малолетучие, тугоплавкие вещества (галогениды типичных металлов, щелочи, гидриды металлов).
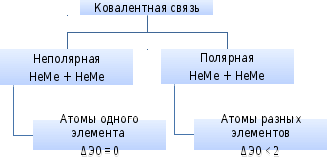
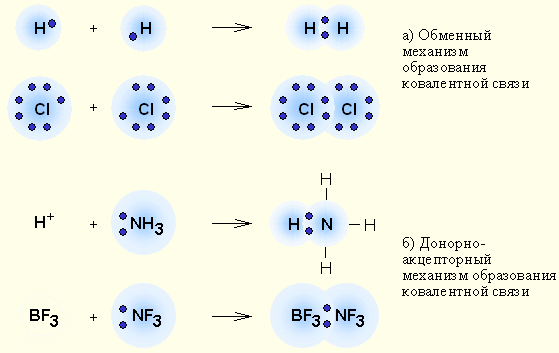
Ковалентная связь
Возникает в результате образования общих электронных пар (НеМе + НеМе).
A· + ·В → А : В
Соединения (неполярная ковалентная связь): газообразные, твердые, реже – жидкие вещества (O2, Cl2, Br2, I2, алмаз, графит, сера).
Соединения (полярная ковалентная связь): жидкие и газообразные вещества (HCl, H2O, NH3, кислотные оксиды, кислоты).
Металлическая связь
Образуется в результате взаимодействия относительно свободных электронов с ионами металлов.
Свойства: ненаправленность.
Соединения: твердые вещества (все Ме, кроме ртути).
Водородная связь
Образуется между атомом водорода, связанным с атомом электроотрицательного элемента одной молекулы и атомом сильно электроотрицательного элемента другой молекулы.
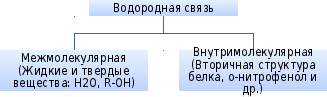
Механизмы образования ковалентной связи
Обменный
Донорно-акцепторный
Способы перекрывания электронных облаков
(«а,б,в» — σ-тип, «г» — π-тип)
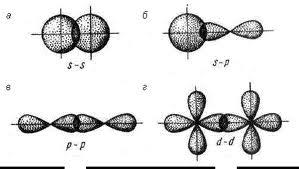
σ-связь – это ковалентная связь, образованная при перекрывании атомных орбиталей по линии, соединяющей центры атомов (прочная связь).
π-связь – это ковалентная связь, образованная при перекрывании атомных орбиталей вне линии, соединяющей ядра атомов (непрочная связь).
Свойства ковалентной связи
Длина связи (l) – это расстояние между ядрами атомов, образующих связь.
Энергия связи (Есв) – это энергия, необходимая для разрыва связи, измеряется в кДж/моль.
Чем больше перекрывание атомных орбиталей, тем больше энергия связи, тем прочнее химическая связь.
Порядок (кратность) связи – это число электронных пар, участвующих в образовании связи.
N=N Тройная связь (σ+π+π) | О=С=О Двойная связь (σ+π) | Cl-Cl Одинарная связь (σ) |
Чем больше кратность связи, тем больше прочность (энергия) связи, тем меньше ее длина.
Насыщаемость – это способность атомов образовывать определенное число ковалентных связей.
Направленность связи обуславливает пространственную структуру молекул, т.е. их геометрию.
Полярность связи характеризует степень смещения общей электронной пары к более электроотрицательному атому.
Поляризуемость ковалентной связи – это способность молекул изменять свою полярность под действием внешнего электрического поля.
Гибридизация электронных орбиталей – это процесс взаимодействия атомных орбиталей разной формы, обладающих различной энергией, приводящий к образованию гибридных орбиталей, одинаковых по форме и энергии.
Число гибридных орбиталей равно числу исходных орбиталей!Тип гибридизации электронных орбиталей определяет пространственную конфигурацию молекулы.
Как определить тип оксида (кислотный, основный,амфотерный)?
Кислотные оксиды — это оксиды образованные неметаллом, Основные оксиды — это оксиды образованные металлом валентность которого в соединение меньше 3, к амфотерным относятся оксиды металлов валентность которых 3 и более. Можно определить по таблице Менделеева они окрашены (имеется в виду металлы и неметаллы) в разные цвета. А по диагонали расположены металлы которые проявляют амфотерные свойства, они окрашены в цвета металлов и неметаллов.
Кислотный-образован от кислоты, реагирует с основаниями и т. д (CO2),Оновный-образован от оснований, реагирует с кислотами и т. д. (CаO).Амфотерные, оксиды, обладающие и теми и другими свойствами (Al2O3)
только методом исключения видимо: основные знаешь — вычеркивай, кислотные знаешь — вычеркивай, все что осталось амфотерное. как то так надеюсь кому нить помог ))амфотерный оксид-это оксид со степенью окисления +3 +4,лучший ответ мне
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! 2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов 3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный.а ничего что у нас таблица менделеева на кафедре бесцветная??? мне как тогда из головы цвета придумовать????
как, пользуясь периодической системой элементов, определить характер оксида, гидроксида?
Периодичность в свойствах элементов, связанная с изменением строения электронных оболочек при возрастании заряда ядра их атомов, наблюдается и для однотипных соединений. В периоде слева направо основные свойства оксидов и гидроксидов групп IA, IIA постепенно сменяются амфотерными и для соединений элементов групп VA-VIIA становятся кислотными. В группах А, кроме VIII, сверху вниз усиливается основной характер оксидов и гидроксидов, а их кислотные свойства ослабевают, например: CsOH — более сильное основание, чем LiOH, а кислота НРО3 значительно слабее, чем HNO3. В то же время для водных растворов бинарных соединений неметаллов с водородом типа HF, HCl, HBr, HI или h3O, h3S, h3Se, h3Te кислотные свойства возрастают от HF к HI, а также от h3O к h3Te . Для оксидов и гидроксидов элементов, величины относительных электроотрицательностей которых находятся в интервале 1,5-2,2 обычно характерны амфотерные свойства, при этом, чем меньше значение относительной электроотрицальности, тем больше проявляются основные свойства их оксидов и гидроксидов. По мере увеличения относительной электроотрицательности элементов возрастает кислотность их оксидов и гидроксидов. Для галлия 31Ga (ОЭО=1,82) кислотные и основные свойства его оксида Ga2O3 и гидроксида Ga(OH)3 выражены в одинаковой степени.
Вниз по группе металличность ВОЗРАСТАЕТ. Далее по Закону