атом, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль.
Молекула — мельчайшая частица вещества, сохраняющая св-ва данного вещества.
Моль — кол-во вещества в граммах, численно равное атомной или молекулярной массе.
Простое вещество – это вещество, состоящее из атомо одного вида
Сложное вещество – из 2 и более атомов разного вида.
АТОМ (от греч. atomos — неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (~10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома — его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные — возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов
Эквивалент – реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Фактор эквивалентности
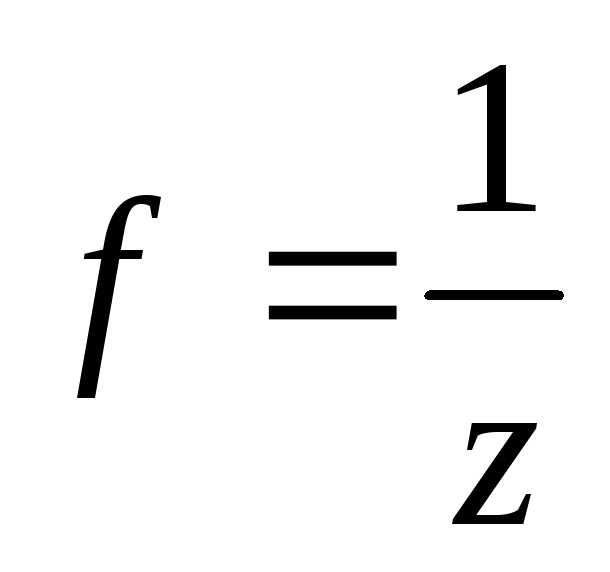 ,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества.
,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества. 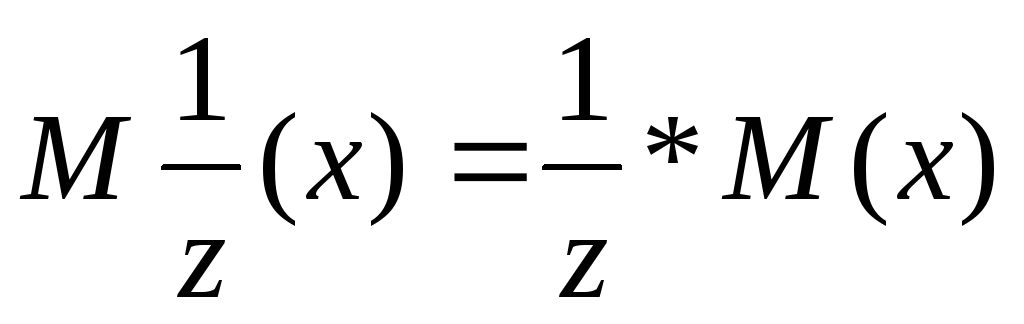 ,
где
,
где 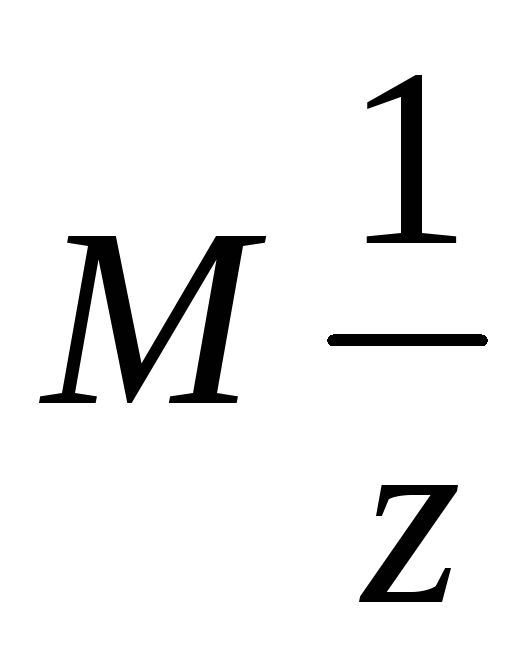 молярная
масса эквивалента,
молярная
масса эквивалента,  фактор
эквивалентности, М – молярная масса
атома элемента
фактор
эквивалентности, М – молярная масса
атома элемента2. Основные законы химии.
studfile.net
Основные законы и понятия химии
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na– натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента — кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Сложное вещество, или соединение, — это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления
может иметь положительное, отрицательное
и нулевое значения, которые обычно
ставятся над символом элемента сверху.
Например, 

 .
Степень окисления элементов в простых
веществах равна нулю
.
Степень окисления элементов в простых
веществах равна нулю  Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро
Степень окисления некоторых элементов
в их соединениях имеет постоянное
значение. К таким элементам относятся
щелочные металлы (степень окисления
+1), металлыIIА подгруппы
Периодической системы (+2), а также серебро ,
цинк
,
цинк , кадмий
, кадмий ,
алюминий
,
алюминий
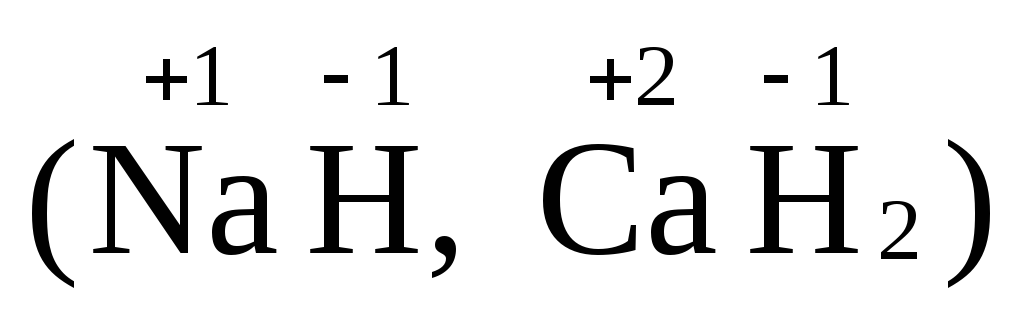 .
Степень окисления кислорода практически
постоянна и составляет –2.
.
Степень окисления кислорода практически
постоянна и составляет –2.Большинство элементов
имеет переменную степень окисления,
например, 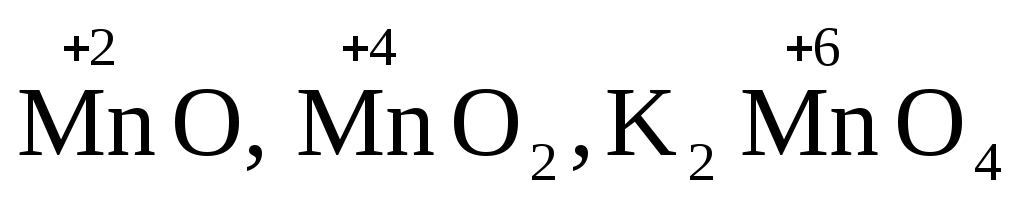 .
.
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023структурных единиц. Число 6,02×1023называется числом Авогадро. ¥
Применяя понятие
«моль», необходимо в каждом конкретном
случае указывать, какие именно структурные
единицы имеются в виду. Например, следует
различать моль атомов Н, моль молекул
Н2, моль ионов Н+. В моле
атомов, молекул, ионов водорода содержится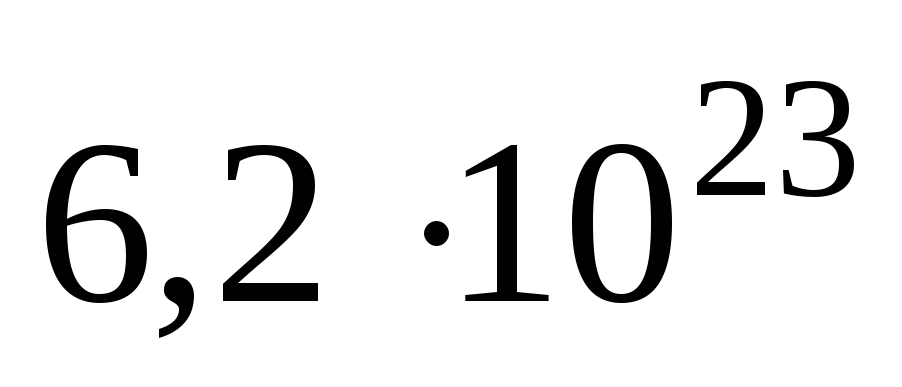 атомов, молекул, ионов водорода
соответственно.
атомов, молекул, ионов водорода
соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой

после подбора коэффициентов будет выглядеть следующим образом:
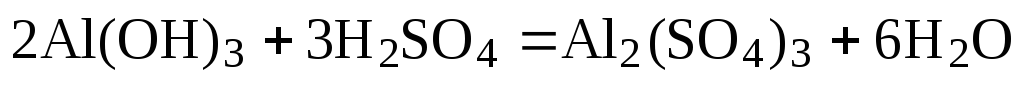 (1)
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:

Примем nравным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а)  (2)
(2)
б) 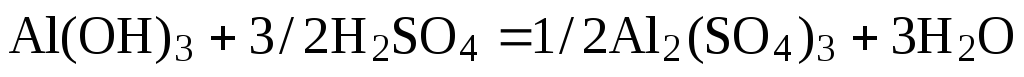 (3)
(3)
Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:
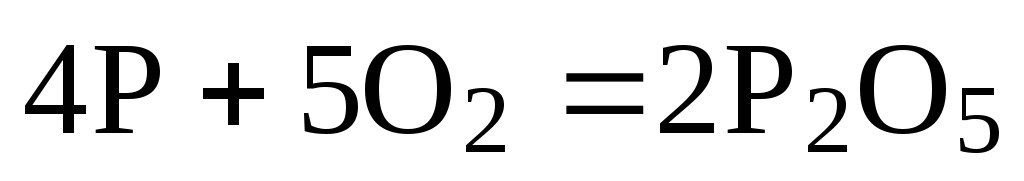 а)
а)
 б)
б)
Чтобы исключить
промежуточное вещество 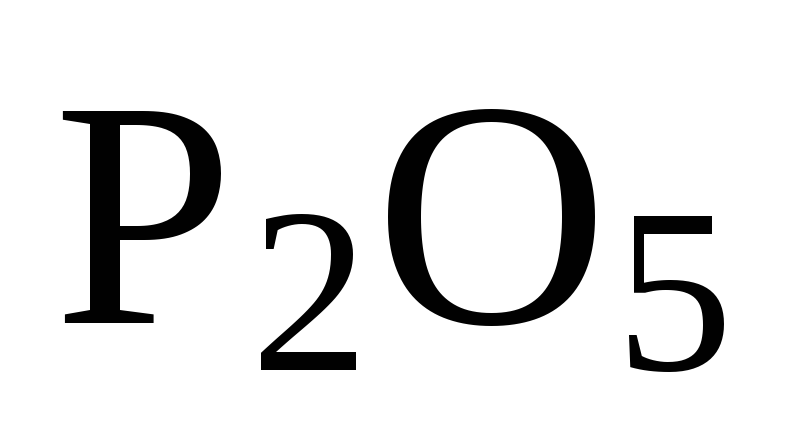 ,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения

+
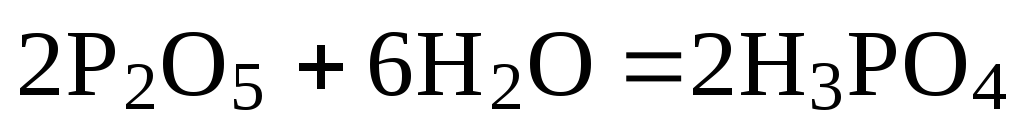
______________________


Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры.
Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро.
В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул.
В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро):
При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Поскольку
объем данной массы газа зависит от
давления и температуры, то при расчетах
по химическим реакциям с участием
газообразных веществ необходимо
указывать условия, при которых находится
газ. Наиболее употребительными являются
так называемые «нормальные» условия
(н.у.). К нормальным условиям относятся:
температура 00С (273К) и давление,
равное
Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л.
Этот объем называется молярным или мольным объемом газа при нормальных условиях.
Вещества, способные распадаться в растворе или в расплаве на заряженные частицы (ионы), называются электролитами.
Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Катионами являются ионы водорода, Н+, ион аммония,NН+4, ионы металлов, например,Na+,Ca2+,Al3+. К анионам относятся гидроксид-ион, ОН—, ионы кислотных остатков, например,Cl—,NO3—,SO42-.
Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Так, натрий и калий разлагают воду с выделением водорода, а ионы Na+иK+такими свойствами не обладают.
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
Электролитическая диссоциация является обратимым процессом, т.е. в растворе или расплаве одновременно протекают две реакции: распад молекул на катионы и анионы (КАК++ А—) и ассоциация (соединение) ионов в молекулы (К++ А—КА). Поэтому уравнение реакции электролитической диссоциации записывается следующим образом: КАК++А—; знакуказывает на обратимость процесса.
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов одновременно присутствуют не только ионы, но и молекулы, не распавшиеся на ионы. Способность молекул данного электролита диссоциировать в растворе или расплаве характеризуется степенью диссоциации .
Степенью диссоциации называется отношение числа молекул (молей) электролита, распавшихся на ионы, к общему числу его молекул (молей). Степень диссоциации выражается либо в долях единицы, либо в процентах.
Все электролиты подразделяются на сильные и слабые. Сильные электролиты диссоциируют практически нацело, степень их диссоциации близка к единице (100%). В растворах сильных электролитов содержатся преимущественно ионы, недиссоциированных молекул практически нет.
Слабые электролиты характеризуются малой степенью диссоциации, поэтому в растворе присутствует значительное количество непродиссоциированных молекул.
К электролитам относятся кислоты, основания и соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком.
Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+и анионNO3—(нитрат-ион)
HNO3 Н++ NO3—.
Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные.
Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл.
Кислоты бывают разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы.
Слабые кислоты диссоциируют ступенчато. Например, угольная кислота диссоциирует в две ступени:
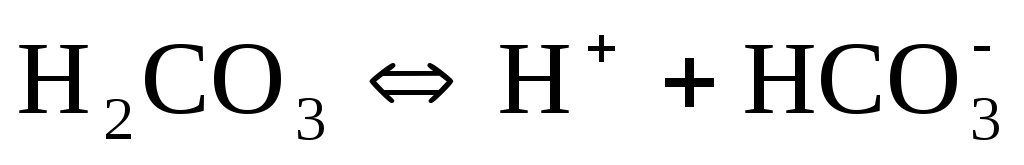

Названия кислотных остатков, полученных при ступенчатой диссоциации кислот, образуются прибавлением приставки гидро- или дигидро- (по числу оставшихся в анионе ионов водорода) к названию кислотного остатка, полученного при полной диссоциации кислоты. Например, ион СО32-называется карбонат-ионом, а ион НСО3—— гидрокарбонат-ионом, ион РО43-называется фосфат-ионом (или ортофосфат-ионом), ионHPO42-– гидрофосфат-ионом, а ион Н2РО4—— дигидрофосфат-ионом).
В таблице приведены формулы и названия некоторых кислот и их кислотных остатков.
Таблица
Формулы и названия кислот и кислотных остатков
Формула кислоты | Название кислоты | Кислотный остаток (анион) | Название аниона |
HCl | Сильные кислоты Соляная (хлористо-водородная) | Cl— | Хлорид |
HBr | Бромисто-водородная | Br— | Бромид |
HJ | Йодисто-водородная | J— | Иодид |
HNO3 | Азотная | NO3— | Нитрат |
H2SO4 | Серная | SO42 HSO4— | Сульфат Гидросульфат |
HF | Слабые кислоты Фтористо-водородная | F— | Фторид |
HNO2 | Азотистая | NO2— | Нитрит |
Формулы и названия кислот и кислотных остатков
H2S | Сероводородная | S2- HS— | Сульфид Гидросульфид |
H2SO3 | Сернистая | SO32- HSO3— | Сульфит Гидросульфит |
H2CO3 | Угольная | CO32- HCO3— | Карбонат Гидрокарбонат |
H2SiO3 | Кремниевая | SiO32- HSiO3— | Силикат Гидросиликат |
H3PO4 | Ортофосфорная(фосфорная) | PO43- HPO42- H2PO4— | Фосфат Гидрофосфат Дигидрофосфат |
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН—).
Основания имеют формулу Me(OH)n, где Ме — ион металла; ОН—— гидроксильная группа; n — количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2.
Запишем уравнение диссоциации основания на примере КОН
КОНК++ОН—
Названия гидроксидов образуются из слова гидроксид и названия металла: NaOH — гидроксид натрия, Ba(OH)2 — гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 — гидроксид железа (П), Fe(OH)3 — гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия — едкое кали, гидроксид натрия — едкий натр, гидроксид кальция — гашеная известь.
Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH — однокислотное основание, Cu(OH)2 — двухкислотное.
Названия катионов, содержащих, кроме металла, гидроксильные ионы. образуются из названия металла с прибавлением приставки гидроксо-, причем, если в состав катиона входят две гидроксогруппы, то название будет включать приставку дигидроксо-. Так, катион, образующийся на первой стадии диссоциации гидроксида алюминия, Al(OH)2+, называется ионом дигидроксоалюминия, а катион, образующийся на второй стадии, Al(OH)2+ — ионом гидроксоалюминия.
Основания подразделяются на растворимые и нерастворимые, а также сильные и слабые. Так, все гидроксиды 1А группы Периодической системы элементов Д.И. Менделеева, например, NaOH, KOH, а также гидроксиды щелочно-земельных металлов, Ca(OH)2, Sr(OH)2, Ba(OH)2 — хорошо растворимые соединения и сильные электролиты. Они называются щелочами. Большинство гидроксидов других металлов плохо растворяются в воде и являются слабыми электролитами. Гидроксид аммония, NH4OH, диссоциирующий по уравнению NH4OH NH4++OH—, является слабым электролитом, но хорошо растворим в воде.
Существуют гидроксиды, способные проявлять как свойства кислот, так и свойства оснований. Такие гидроксиды называются амфотерными. К ним относятся, например, Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 и др.
Солями называются электролиты, полученные при замещении ионов водорода в кислоте на ионы металла или гидроксид-ионов основания на анионы кислотного остатка.
При полном замещении образуются средние соли, например, K2SO4,Al(NO3)3,CuCO3. Средние соли состоят из ионов металла и ионов кислотного остатка, полученного при полном отщеплении всех ионов водорода в процессе диссоциации кислоты.
Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную валентность, то она указывается римской цифрой. Например, K2SO4– сульфат калия,Al(NO3)3– нитрат алюминия,CuCO3– карбонат меди (II).
При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4– гидрофосфат калия,KH2PO4– дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты.
Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, — то дигидроксо-, например CuOHCl– хлорид гидроксомеди (II),Al(OH)2NO3– нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания.
Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются.
Кислоты, основания и соли — это электролиты. К неорганическим соединениям относится еще один класс соединений, которые не являются электролитами, — оксиды.
Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород.
Примеры оксидов: NO, NO2, Mn2O7, ZnO, K2O.
Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO — оксид азота (П), NO2— оксид азота (IV), Mn2O7-оксид марганца (VII). В названиях последних трех оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3— оксид алюминия, ZnO оксид цинка, K2O — оксид калия.
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями. К ним относятся NO, N2O, CO.
Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные.
Основные оксиды — это оксиды, которым соответствуют основания.
Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO — основание Ca(OH)2.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Оксиду углерода (IV) — СО2 — соответствует угольная кислота Н2СО3, оксиду фосфора (V) — Р2О5— фосфорная кислота,H3PO4.
Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5– фосфорный ангидрид, СО2– угольный ангидрид.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления углерода в СО2и Н2СО3равна +4, а степень окисления фосфора в Р2О5и Н3РО4равна +5.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислоты, так и основания.
Так, оксид цинка ZnO — амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) — Cr(OH)3— тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений.
studfile.net
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
состоит из ядра и электронов. Ядро атома содержит положительно заряженные протоны и незаряженные нейтроны. Число отрицательно заряженных электронов в атоме совпадает с числом протонов. Химический элемент − совокупность атомов с одинаковым зарядом ядра. Каждый химический элемент имеет свое название и символ, которые приведены в Периодической системе элементов
Дмитрия Ивановича Менделеева. Порядковый номер элемента в таблице совпадает с зарядом ядра и, соответственно, с числом протонов в нем.
Так как число протонов в ядре совпадает с числом электронов, заряды которых равны по величине и противоположны по знаку (±е), то атом в целом оказывается электрически нейтральным. Если из него удалить или добавить электрон, возникает заряженная частица – положительно или отрицательно заряженный ион:
А− ē → А+ А + ē → А-.
Вкачестве единицы измерения заряда частиц (ядро, электрон, ион…) используют элементарный заряд е = 1,602·10-19 Кл.
Определенный атом обозначается символом, например углерод
−С. Иногда дополнительно цифрами слева у символа указывают подстрочным индексом заряд ядра (порядковый номер) и над-
строчным – массу атома (массовое число), например: 126 C; 2760Co;
9038Sr; 13755Cs .
Для иона у символа атома надстрочным индексом справа указывается его заряд. Например: H+; Na+; Cu2+; Cl-; S2-.
Поскольку массы атомов чрезвычайно малы, то в качестве единицы их измерения принята атомная единица массы (а.е.м.), равная 1/12 массы атома углерода 12С (1 а.е.м. = 1,6605·10-27 кг). В Периодической системе элементов указаны их относительные атомные массы (Ar) − безразмерные величины, показывающие, во
сколько раз масса данного атома больше 1/12 массы атома углерода 12С.
Редко встречаются вещества, у которых минимальной частицей, обладающей его химическими свойствами, является атом, для многих это молекула − частица, состоящая из двух и более одинаковых или разных атомов. Состав и порядок соединения атомов в молекуле при помощи символов передает химическая формула. В химической формуле справа у символа атома подстрочным ин-
studfile.net
Основные понятия в химии
Химия — это наука о веществах, их свойствах и превращениях, происходящих в результате химических реакций, а также о фундаментальных законах, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается в основном изучением взаимодействий между атомами и молекулами, полученными в результате таких взаимодействий.
Химический элемент — определённый вид атома имеющий название, порядковый номер, и положение в таблице Менделеева называют химическим элементом. В настоящее время известно 118 химических элементов, заканчивая Uuo (Ununoctium — Унуноктий). Каждый элемент обозначен символом, который представляет одну или две буквы из его латинского названия (водород обозначен буквой H — первой буквой его латинского названия Hydrogenium).
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т.д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Аллотропия — это способность некоторых химических элементов существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Например: алмаз и уголь состоят из одного и того же элемента — углерода.
Относительная атомная масса. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Обозначают относительную атомную массу элемента символом Аr, где r — начальная буква английского слова relative (относительный).
Относительная молекулярная масса. Относительной молекулярной массой Мr называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С.
Обратите внимание на то, что относительные массы по определению являются безразмерными величинами.
Таким образом, мерой относительных атомных и молекулярных масс избрана 1/12 часть массы атома изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.):
Моль. В химии чрезвычайное значение имеет особая величина — количество вещества.
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или других частиц) этого вещества, оно обозначается обычно n и выражается в молях (моль).
Моль — это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 12 г углерода, состоящего только из изотопа 12С.
Число Авогадро. Определение моля базируется на числе структурных единиц, содержащихся в 12 г углерода. Установлено, что данная масса углерода содержит 6,02× 1023 атомов углерода. Следовательно, любое вещество количеством 1 моль содержит 6,02× 1023 структурных единиц (атомов, молекул, ионов).
Число частиц 6,02 × 1023 называется числом Авогадро или постоянной Авогадро и обозначается NA:
NA = 6,02 × 1023 моль-1
Молярная масса. Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится понятие молярной массы вещества.
Молярная масса M вещества представляет собой отношение его массы к количеству вещества:
где г — масса в граммах, n — количество вещества в молях, М — молярная масса в г/моль — постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Валентность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов или количество связей, которые может образовывать вещество.
Степень окисления
(окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в формульной единице, например:
Na+Cl—, Mg2+Cl2—, N-3H3—, C+2O-2, C+4O2-2, Cl+F—, H+N+5O-23, C-4H4+, K+1Mn+7O-24.
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда иона, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
H+N+3O-22 — степень окисления, H+N3+O2-2 — заряды.
Степень окисления атома в простом веществе равна нулю, например:
O03, Br02, C0.
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
H+2S+6O-24, (+1 • 2) + (+6 • 1) + (-2 • 4) = +2 +6 -8 = 0
Химическая связь , взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют химические связи. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Основные характеристики химической связи — прочность, длина, полярность.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав.(плотность, агрегатное состояние, температуры плавления и кипения и т.п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменятся под действием определённых условий.Результатом является превращения одного вещества или веществ в другие вещества.
Физические явления — новые вещество не образуется.Химические явления — новые вещество образуется.examchemistry.com
I. Основные понятия и законы химии
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Руководство к изучению курса «Общая и неорганическая химия» предназначено для студентов биологического факультета Белгосуниверситета и подготовлено в соответствии с действующей программой этого курса.
Цель руководства – конкретизировать подлежащий изучению материал, определить его объем, основные понятия и определения и указать студентам доступные источники необходимой информации.
После каждого раздела (выделены жирным шрифтом) программированного плана курса приводятся цифровые ссылки на основную и дополнительную литературу, которая указана в конце руководства. В связи с тем, что учебники во многом взаимозаменяемы, студенту не обязательно прорабатывать все пособия из основного списка. Дополнительная литература дается для более глубокого изучения вопросов, в частности, связанных с биологией.
Вопросы в плане составлены таким образом, что студент получает возможность выяснить, какими сведениями он обязан располагать по тому или иному вопросу независимо от того, что он узнал на лекции.
Материал каждого из разделов программированного плана подразделяется на отдельные пункты, каждый из которых охватывает небольшой круг взаимосвязанных вопросов.
Первая подчеркнутая цифра означает номер учебного пособия по списку литературы, затем указываются страницы учебного пособия, на которых приводятся сведения по этому разделу.
1. Основные понятия химии. Атомная частица. Атом и атомный ион. Атомная единица массы. Химический элемент. Нуклид. Изотопы. Относительная атомная масса нуклида и относительная атомная масса элемента. Молекула и относительная молекулярная масса. Вещество. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения. Кристаллические решётки веществ. Химические формулы. Формульная единица вещества. Химическое количество вещества. Моль как единица количества вещества. Молярная масса и молярный объём вещества. Химический эквивалент. Молярная масса и молярный объём эквивалента.
1. с. 5–31; 2. с. 11–35; 4. с. 10–12; 5. с. 3–16; 6. с. 8–20; 8. с. 10–14; 11. с.4–16, с.23–40
Атомная частица – мельчайшая, химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Следует различать электронейтральные атомные частицы – атомы и заряженные атомные частицы – атомные ионы.
Атом
– мельчайшая,
электронейтральная, химически неделимая
частица, состоящая из положительно
заряженного ядра и отрицательно
заряженных электронов.
Примеры атомов: 
Атомный
ион – мельчайшая,
заряженная, химически неделимая частица,
состоящая из положительно заряженного
ядра и отрицательно заряженных электронов.
Примеры атомных ионов: 
Общий признак атомных частиц – наличие в них одного ядра. Важнейшими количественными характеристиками любой атомной частицы являются «протонное число» Z (число протонов в ядре, его положительный заряд) и «массовое число» A (общее число протонов и нейтронов (N) в ядре):
A = Z + N.
Химический элемент – вид атомных частиц с одинаковым зарядом ядер (с одинаковым протонным числом). Каждый химический элемент имеет своё название и символ. В настоящее время известны 117 химических элементов.
Постоянная
атомной массы (mu, u)
– физическая
величина, численно равная одной
двенадцатой массы атома нуклида  :
:
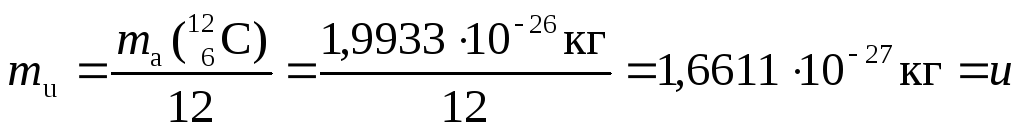 .
.
Раньше эту величину называли «атомная единица массы» (а. е. м) или «углеродная единица» (у. е.). В биологической литературе встречается ещё одно устаревшее название этой величины – «Дальтон» (Dа).
Относительная атомная масса элемента Ar(Э) – величина, равная отношению средней массы атомных частиц данного элемента к mu:
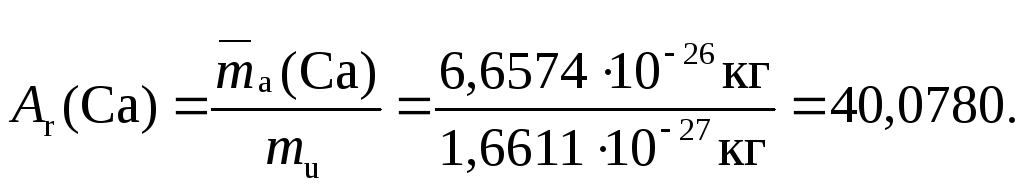
Молекула – мельчайшая, способная к самостоятельному существованию частица, обладающая всеми химическими свойствами и химическим составом данного вещества. В большинстве случаев молекулы состоят из нескольких химически связанных атомов, например, Н2О; C3H8; P4O10; C60. Однако известны и одноатомные молекулы, к которым относятся атомы «благородных газов» – He, Ne, Ar, Kr, Xe, Rn, и атомы ртути Hg, содержащиеся в её парáх. В состав молекул могут входить атомы одного или нескольких химических элементов.
Относительная молекулярная масса (Mr) – величина, равная отношению средней массы молекул данного вещества к mu.
Например, относительная молекулярная масса воды равна:
Mr(H2O)
= 
Значение относительной молекулярной массы можно найти, исходя из значений относительных атомных масс, например:
Mr(H2O) = 2 ∙ Ar(H) + Ar(O) = 2 ∙ 1,0079 + 15,9994 = 18,0152
Вещество – устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определёнными химическими и физическими свойствами.
В настоящее время известно около 47 миллионов индивидуальных веществ. Подавляющее большинство из них (~98 %) относятся к органическим веществам, остальные – к неорганическим.
В зависимости от числа химических элементов, образующих вещества, последние делятся на простые и сложные. Простое вещество образовано атомами одного элемента, сложное – атомами разных элементов. Известно около 550 простых веществ, что намного больше числа известных элементов. Причина этого в том, что некоторым элементам соответствуют по несколько простых веществ. Такое явление называется аллотрóпией, а сами простые вещества, образованные атомами одного элемента, – его аллотропными модификациями.
При определенных условиях вещества могут находиться в трёх агрегатных состояниях – газообразном, жидком и твёрдом (аморфном или кристаллическом).
Для описания пространственного строения любого твёрдого кристаллического вещества используется понятие «кристаллическая решётка».
Кристаллическая решётка вещества – пространственная модель его кристалла, представляющая собой условный каркас, в узлах которого находятся молекулы, атомы или ионы, образующие данное вещество.
В зависимости от природы частиц, образующих вещества, различают 4 основных типа кристаллических решёток – молекулярные, атомные, ионные и металлические решётки. Вещества с молекулярным типом кристаллической решётки относятся к веществам молекулярного, а вещества с тремя другими типами решёток – к веществам немолекулярного строения.
Вещества молекулярного строения обладают низкими температурами плавления (обычно до 300 оС). Они летучи и часто обладают запахом. К ним относятся все газообразные или жидкие при комнатной температуре вещества, а также некоторые легкоплавкие твёрдые вещества (парафин, фенол, сахароза и др.).
Вещества немолекулярного строения характеризуются высокими температурами плавления (обычно выше 300 оС). При комнатной температуре они находятся только в твёрдом агрегатном состоянии, практически нелетучи и поэтому не обладают запахом. Атомное строение присуще кристаллам некоторых простых веществ-неметаллов – бора, углерода, кремния, фосфора и других. Ионное строение характерно почти для всех соединений щёлочных и щёлочноземельных металлов, магния, а также для всех солей аммония.
Важнейшей характеристикой любого сложного вещества является его качественный и количественный состав, выражающийся с помощью химических формул.
Химическая формула – графическое изображение состава и (или) строения вещества с помощью символов химических элементов и математических знаков (цифр, скобок, штрихов, точек).
Различают несколько типов химических формул.
Стехиометрические формулы (формулы состава) отражают качественный и количественный состав веществ с помощью символов химических элементов, цифр, скобок и точек, например: C6H12O6, (NH4)2CO3, CuSO4∙5H2O. Различают простейшие (эмпирические) и молекулярные стехиометрические формулы, например, СH2O и С6Н12О6.
Структурные формулы (формулы строения) отображают порядок (последовательность) соединения атомов в молекулах или в атомных кристаллах с помощью символов элементов, штрихов и цифр. Различают сокращённые и развёрнутые структурные (графические) формулы (рис.1 а, б).
Формульная единица вещества (ФЕ) – реальная или условная частица вещества, состав которой определяет его химическую формулу.
К
Рис. 1. Сокращённая (а) и развёрнутая (б) структурные формулы молекулы пропана
реальным формульным единицам относятся молекулы (в случае веществ молекулярного строения) и атомы (в случае простых веществ атомного строения). Например, формульной единицей воды является её молекула – H2O, формульной единицей кремния – его атом – Si.К условным формульным единицам относят группы атомов или ионов, входящих в состав сложных веществ немолекулярного строения. Например, формульной единицей сульфата калия K2SO4 является условная частица, состоящая из двух катионов калия и одного сульфат-аниона, т. е. группа ионов состава «K2SO4». Формульной единицей оксида кремния(IV) SiO2 является условная частица, состоящая из одного атома кремния и двух атомов кислорода, т. е. группа атомов состава «SiO2».
Химическое количество вещества n(X) – величина, равная отношению числа ФЕ данного вещества Х к постоянной Авогадро:
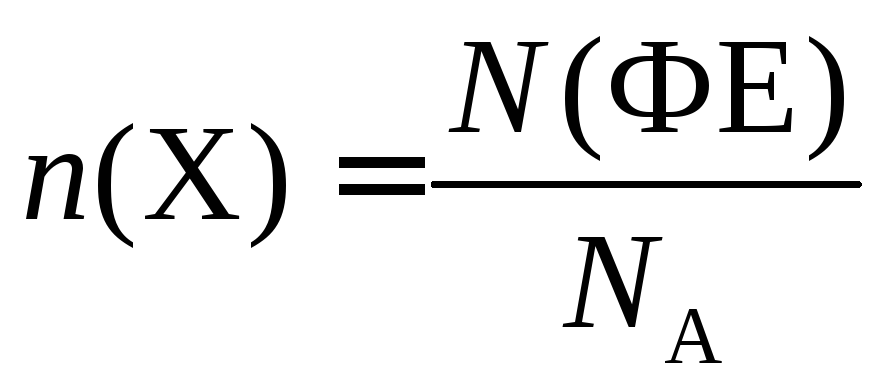 .
.
Единица химического количества вещества – моль. Установлено, что любое вещество химическим количеством 1 моль всегда содержит 6,02∙1023 его ФЕ. Число 6,02∙1023 называется числом Авогадро. Это число, отнесённое к количеству вещества, равному 1 моль, называется постоянной Авогадро и обозначается символом NA:

Физический смысл химического количества вещества: числовое значение n показывает, во сколько раз число ФЕ вещества в данной его порции больше числа Авогадро.
Обратите внимание на различие понятий «моль» и «1 моль». Моль – единица химического количества вещества, но 1 моль – порция вещества, содержащая 6,02∙1023 его формульных единиц.
Важнейшей количественной характеристикой любого сложного вещества является его количественный состав, который отображает массовое либо молярное соотношение атомов элементов, входящих в его состав.
Массовое соотношение элементов в веществе выражается через их массовые доли. Массовая доля элемента в веществе (w) – величина, показывающая, какую часть от общей массы всего вещества составляет масса атомов данного элемента.
Мольное соотношение атомов определяет простейшую химическую формулу данного вещества. Это соотношение получают исходя из значений массовых долей атомов разных элементов, образующих вещество. Например, массовые доли водорода, серы и кислорода в серной кислоте равны, соответственно, 2,0554 %, 32,6939 % и 65,2507 %. В порции кислоты массой 100 г массы указанных элементов будут составлять 2,0555 г, 32,6901 г и 65,2554 г. Соответствующие химические количества атомов равны:
n(H) =  n(S)
=
n(S)
= 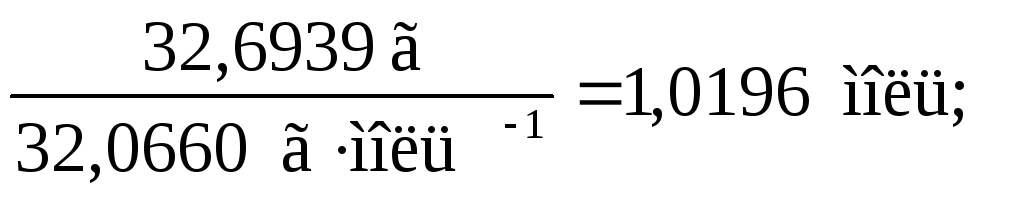
n(O)
= 
Соотношение химических количеств атомов водорода, серы и кислорода равно: n(H) : n(S) : n(O) = 2,0392 моль : 1,0196 моль : 4,0783 моль =
= 2 моль : 1 моль : 4 моль. Эти количества указываются в формуле вещества в виде индексов. Таким образом, химическая формула серной кислоты – H2SO4.
Молярная масса вещества (М) – физическая величина, равная отношению массы данного вещества Х к его химическому количеству:

Единицы молярной массы – г/моль.
Физический смысл молярной массы: она численно равна массе вещества, взятого в количестве 1 моль.
Числовые значения молярных масс простых и сложных веществ молекулярного строения совпадают с соответствующими значениями их относительных молекулярных масс, например: Мr(Р4) = 123,896 и М(Р4) = 123,896 г/моль; Мr(Н2О) = 18,015 и М(Н2О) = 18,015 г/моль.
Значения молярных масс простых и сложных веществ немолекулярного строения численно равны соответствующим значениям относительных атомных или относительных формульных масс, например: Ar(Si) = 28,085 и М(Si) = 28,085 г/моль; Mf,r(CuSO4∙5H2O) = 249,681 и M(CuSO4∙5H2O) = 249,681 г/моль.
Молярный
объём вещества Vm – физическая
величина, численно равная отношению
объёма данного вещества Х к его химическому количеству: 
Единицы молярного объёма – см3/моль; дм3/моль; м3/моль. Например, Vm (CO2)(н.у.) = 22,392 дм3/моль; Vm(Fe) = 7,086 см3/моль.
Химический
эквивалент вещества  —реальная
или условная частица вещества, которая
в кислотно-основной реакции химически
эквивалентна (соответствует) одному катиону водорода, а в
окислительно-восстановительной реакции
– одному электрону.
—реальная
или условная частица вещества, которая
в кислотно-основной реакции химически
эквивалентна (соответствует) одному катиону водорода, а в
окислительно-восстановительной реакции
– одному электрону.
Число  – число
эквивалентности,
равное числу ионов водорода (в
кислотно-основной реакции) или числу
электронов (в окислительно-восстановительной
реакции), которое соответствует одной
формульной единице данного вещества.
– число
эквивалентности,
равное числу ионов водорода (в
кислотно-основной реакции) или числу
электронов (в окислительно-восстановительной
реакции), которое соответствует одной
формульной единице данного вещества.
Число 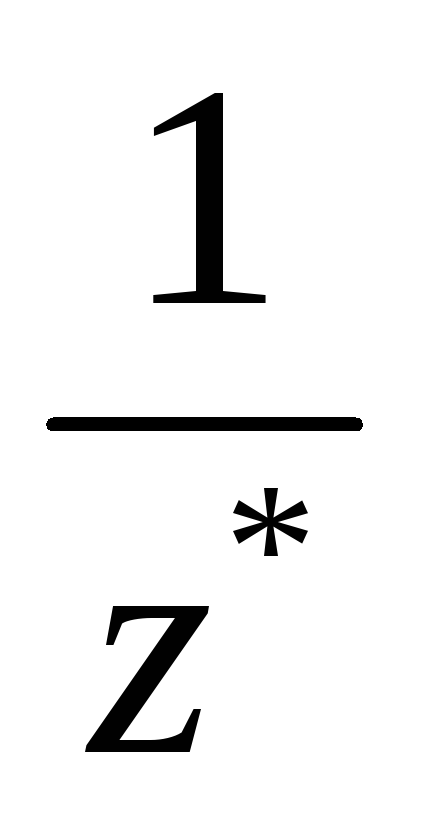 – фактор
эквивалентности.
Оно показывает, какая часть формульной
единицы вещества (половина, треть,
четверть и т. д.) соответствует одному
катиону Н+ в кислотно-основной реакции или одному
электрону в окислительно-восстановительной
реакции.
– фактор
эквивалентности.
Оно показывает, какая часть формульной
единицы вещества (половина, треть,
четверть и т. д.) соответствует одному
катиону Н+ в кислотно-основной реакции или одному
электрону в окислительно-восстановительной
реакции.
Необходимо помнить, что химический эквивалент одного и того же вещества может быть различным в зависимости от характера реакций. Например, при образовании средней соли:
H2SO4 + 2KOH = K2SO4 + 2H2O
в
каждой молекуле серной кислоты на металл
замещаются 2 иона Н+ ( =
2), поэтому в данном случае эквивалентом
серной кислоты является половина её
молекулы, т. е.
=
2), поэтому в данном случае эквивалентом
серной кислоты является половина её
молекулы, т. е.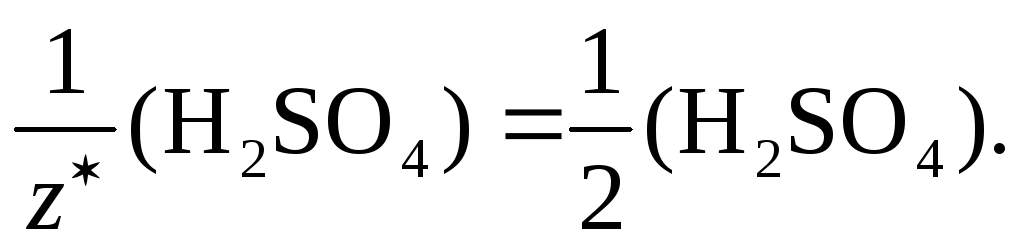 В
то же время при образовании кислой соли:
H2SO4 + KOH = KHSO4 + H2O
В
то же время при образовании кислой соли:
H2SO4 + KOH = KHSO4 + H2O
в
каждой молекуле кислоты замещается
только один ион водорода ( =
1), и поэтому её эквивалентом является
целая молекула H2SO4:
=
1), и поэтому её эквивалентом является
целая молекула H2SO4:

В окислительно-восстановительных реакциях, в которых Н2SO4 играет роль только окислителя, эквивалент кислоты определяется числом электронов, принятых одной её молекулой. Например, при взаимодействии концентрированной серной кислоты с иодоводородом:
8HI + H2S+6O4 = H2S-2 + 4I2 + 4H2O
каждая её молекула принимает по 8 электронов, поэтому в данной реакции эквивалентом кислоты является одна восьмая часть молекулы, т. е.

Химическое
количество эквивалентов вещества 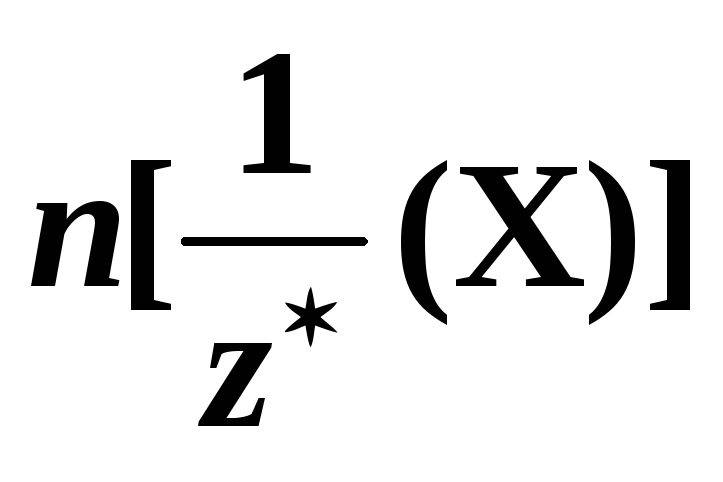 – величина,
равная отношению числа эквивалентов
данного вещества Х к постоянной Авогадро:
– величина,
равная отношению числа эквивалентов
данного вещества Х к постоянной Авогадро:  .
.
Единица химического количества эквивалентов – моль.
Химическое количество вещества X и соответствующее ему химическое количество эквивалентов вещества Х связаны соотношением:

Физический смысл химического количества эквивалентов: оно показывает, во сколько раз число эквивалентов вещества в данной его порции больше числа Авогадро.
Молярная
масса эквивалентов вещества – величина,
численно равная отношению массы данного
вещества Х к соответствующему химическому количеству
его эквивалентов:
– величина,
численно равная отношению массы данного
вещества Х к соответствующему химическому количеству
его эквивалентов:
 .
.
Единицы молярной массы эквивалентов – г/моль, кг/моль.
Молярная масса эквивалентов и молярная масса вещества Х связаны соотношением:
 .
.
Физический смысл молярной массы эквивалентов: она численно равна массе вещества, которой соответствует химическое количество эквивалентов, равное 1 моль.
Молярный
объём эквивалентов газа при н. у.  –величина, численно
равная отношению объёма данного газа
при н. у. к соответствующему химическому
количеству его эквивалентов:
–величина, численно
равная отношению объёма данного газа
при н. у. к соответствующему химическому
количеству его эквивалентов:
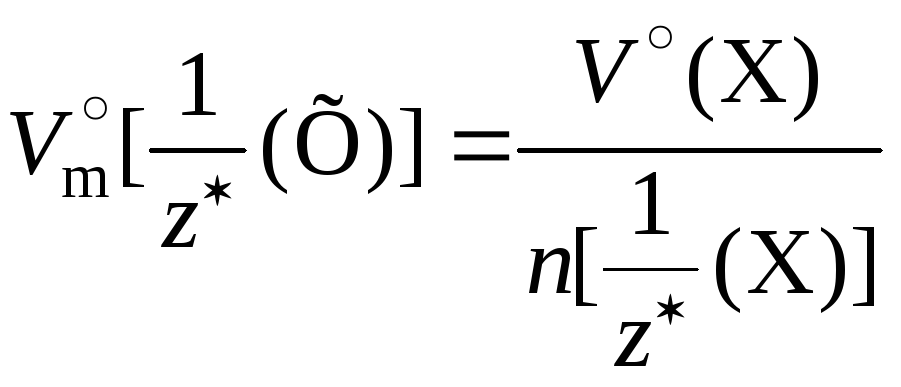 .
.
Единицы молярного объёма эквивалентов газов – дм3/моль, м3/моль.
При н. у. молярный объём эквивалентов газа Х и его молярный объём связаны соотношением:
 .
.
Физический смысл молярного объёма эквивалентов газа Х при н. у.: он численно равен объёму газа Х при н. у., если химическое количество его эквивалентов равно 1 моль.
2.Основные законы химии. Закон сохранения массы веществ. Закон постоянства состава веществ. Закон кратных отношений. Закон эквивалентов. Газовые законы. Закон объёмных отношений Гей-Люссака. Закон Авогадро.
1. с. 9–14; 2. с. 20–24; 5. с. 17–22; 6. с. 12–15; 8. с. 11–14;11. с. 34–42.
Закон сохранения массы веществ: «Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ с учётом изменения массы, соответствующего тепловому эффекту данной реакции».
В общем виде математическое выражение этого закона для химической реакции
aA
+ bB
→ cC
+ dD 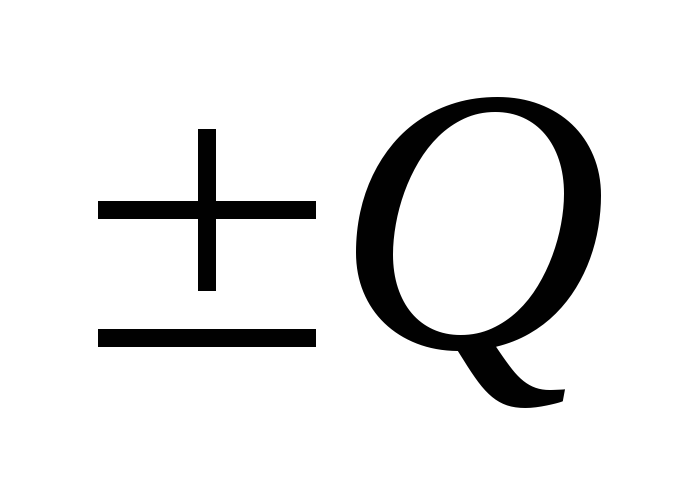
имеет вид:
[m(A) + m(B)] = [m(C) + m(D)] 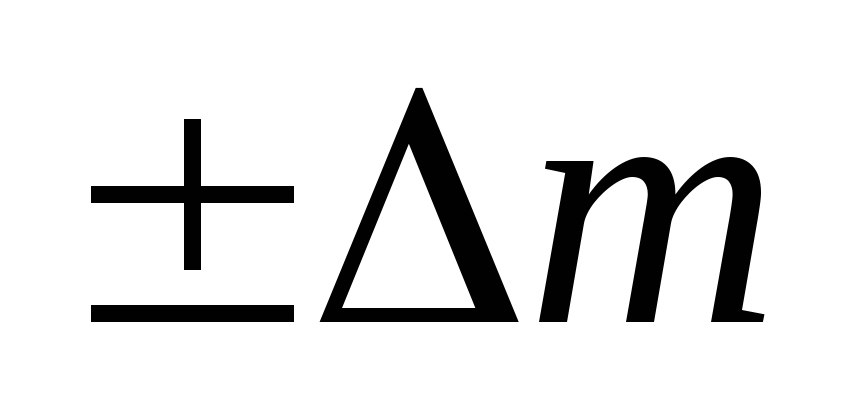 ,
,
где  m
– изменение
массы за счёт выделения или поглощения
теплоты (энергии), происходящее в
соответствии с уравнением А. Эйнштейна:
m
– изменение
массы за счёт выделения или поглощения
теплоты (энергии), происходящее в
соответствии с уравнением А. Эйнштейна: 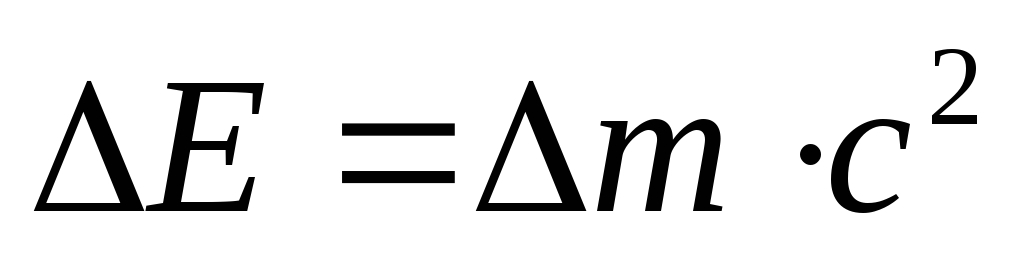 ,
где
,
где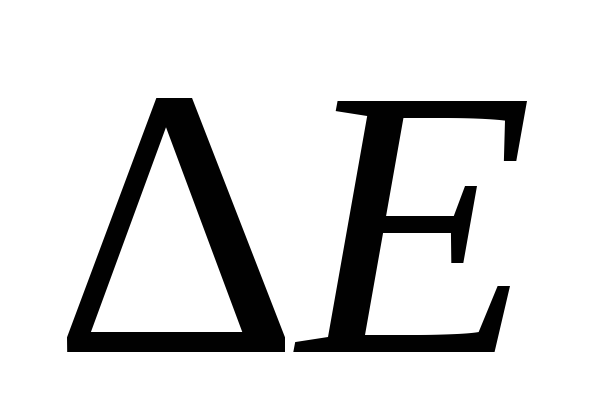 – изменение энергии (в данном случае –
тепловой эффект реакции),
– изменение энергии (в данном случае –
тепловой эффект реакции),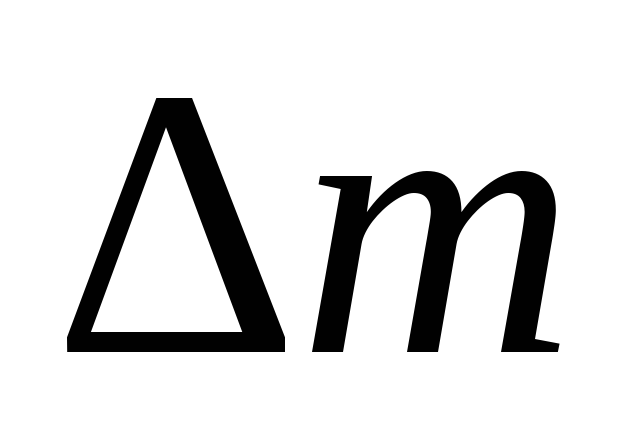 – изменение массы,с – скорость света в вакууме, равная 3∙108 м ∙ с-1.
Поскольку тепловые эффекты химических
реакций (
– изменение массы,с – скорость света в вакууме, равная 3∙108 м ∙ с-1.
Поскольку тепловые эффекты химических
реакций (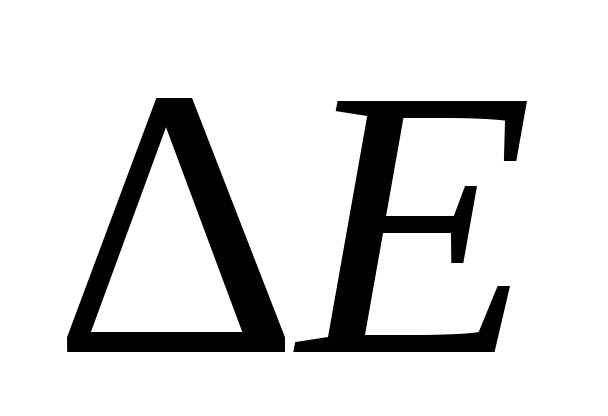 )
чрезвычайно малы по сравнению с величинойс2,
то соответствующими значениями
)
чрезвычайно малы по сравнению с величинойс2,
то соответствующими значениями 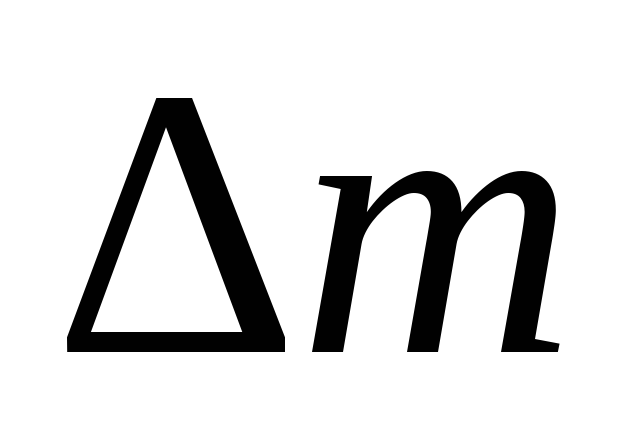 (10–9–10–11 г) можно пренебрегать из-за невозможности
их практического определения.
(10–9–10–11 г) можно пренебрегать из-за невозможности
их практического определения.
Закон постоянства состава веществ: «Количественный и качественный состав любого сложного вещества молекулярного строения не зависит от способов его получения».
Обратите внимание: данный закон применим для веществ только молекулярного строения. Например, количественный состав воды, независимо от способов её получения, всегда один и тот же: w(H) = 11,1899 %, w(O) = 88,8101 %. Поэтому молекулярная формула воды, выведенная исходя из указанных значений массовых долей элементов всегда одна и та же – Н2,000О1,000, или просто H2O.
Экспериментально доказано, что количественный состав веществ немолекулярного строения зависит от способов их получения. Так, например, в образцах оксида меди(II), полученных разными способами, значения массовой доли меди могут изменяться от 74,6 % до 80,7 %. Поэтому количественный состав оксида меди(II) выражается формулами от Cu0,739O до СuO1,053. Однако часто формулу этого вещества записывают упрощённо в виде CuO, округляя соответствующие индексы до целых чисел.
Закон эквивалентов: «Химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой».
Для реакции аА + вВ = сС + dD справедливо соотношение:

При решении задач с использованием данного закона приравнивают количества эквивалентов двух соответствующих веществ. Если в условии задачи речь идёт о веществах А и В, то математическое выражение закона эквивалентов в этом случае имеет вид:
 .
.
Соответствующие
химические количества эквивалентов
веществ  и
и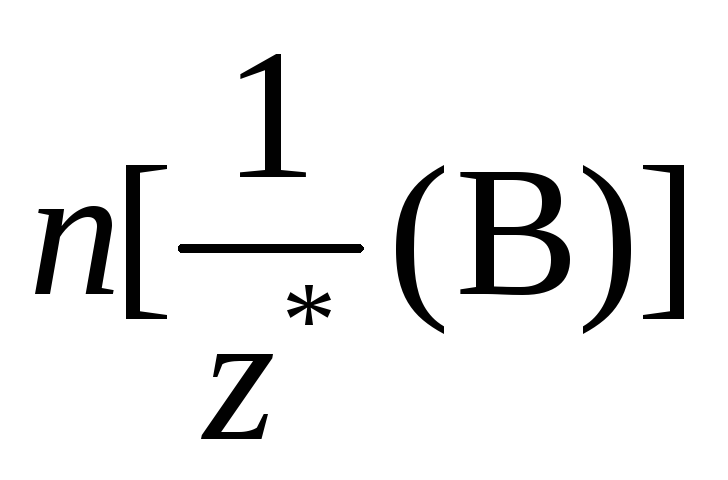 выражаются через величины, указанные
в условии задачи (масса или объём).
Например, если в условии задачи приводятся
значения массы вещества А и объёма (н.
у.) газа В, то выражение закона эквивалентов
в этом случае будет иметь вид:
выражаются через величины, указанные
в условии задачи (масса или объём).
Например, если в условии задачи приводятся
значения массы вещества А и объёма (н.
у.) газа В, то выражение закона эквивалентов
в этом случае будет иметь вид:

Если же в условии задачи указаны массы веществ А и В, то математическое выражение закона эквивалентов запишется так:
 =
=
Последнее равенство, переписанное в виде:
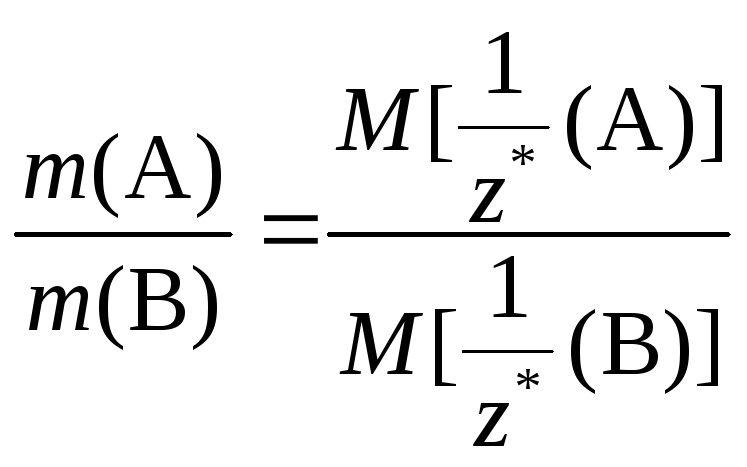
представляет собой математическое выражение другой формулировки закона эквивалентов: «Массы реагирующих веществ относятся друг к другу как молярные массы их эквивалентов».
Закон объёмных отношений Гей-Люссака: «Объёмы газов, вступающих в химическую реакцию и образующихся в результате реакции, относятся между собой как небольшие целые числа».
Закон Авогадро: «В равных объёмах различных газов при одинаковых внешних условиях (давление и температура) содержатся одинаковые числа молекул».
Этот закон применим для веществ, находящихся только в газообразном состоянии.
Из молекулярно-кинетической теории газов следует, что при одинаковых внешних условиях расстояния между частицами в сотни раз больше размеров самих частиц. Поэтому объем порции любого газа определяется не размером его молекул, а расстоянием между ними. Именно по этой причине в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
studfile.net
атом, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль.
Молекула — мельчайшая частица вещества, сохраняющая св-ва данного вещества.
Моль — кол-во вещества в граммах, численно равное атомной или молекулярной массе.
Простое вещество – это вещество, состоящее из атомо одного вида
Сложное вещество – из 2 и более атомов разного вида.
АТОМ (от греч. atomos — неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (~10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома — его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные — возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов
Эквивалент – реальная или условная частица, которая
может присоединять, высвобождать или
быть каким-либо другим образом эквивалентна
одному иону водорода в кислотно-основных
реакциях или одному электрону в
окислительно-восстановительных реакциях. Фактор
эквивалентности 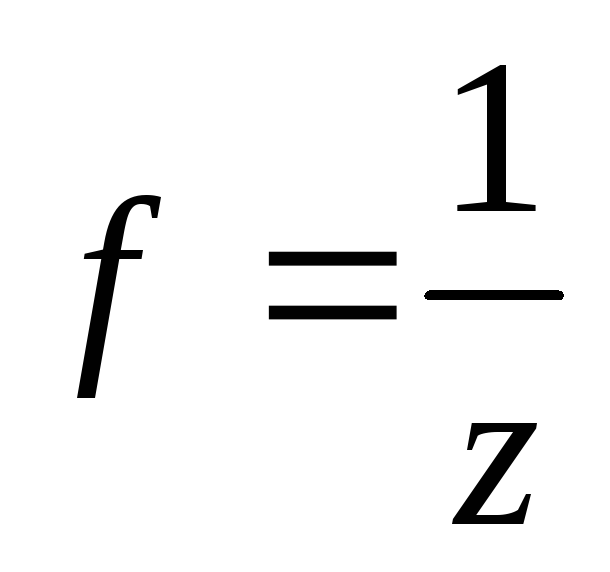 ,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества.
,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества. 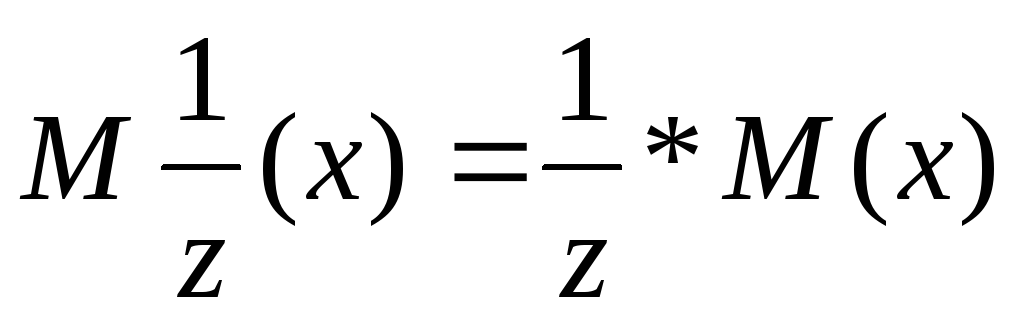 ,
где
,
где  молярная
масса эквивалента,
молярная
масса эквивалента,  фактор
эквивалентности, М – молярная масса
атома элемента
фактор
эквивалентности, М – молярная масса
атома элемента
2. Основные законы химии.
З-н Авогадро: Равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул. Парциальное давление -давление, которое оказывает каждый компонент газовой смеси. PV=n*m/M*RT. З-н парциальных давлений: Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь. Понятие эквивалентной массы -Все элементы соединяются между собой в количествах прямопропорциональных их количественной массе(m1/m2=Э1/Э2). З-н эквивалентов: Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. З-н сохранения энергии: Энергия системы, включающей вещества, вступившие в реакцию, равна энергии системы, включающей вещества, образовавшиеся в результате реакции. З-н сохранения массы: Масса вещ-в, вступивших в реакцию равна массе вещ-в после реакции. Молярный объем газа -это отношение объема вещ-ва к количеству этого вещ-ва. Vmгаза(н.у.)=22,4 л/моль. 1а.е.м=по углеродной шкале 1/12 часть массы атома углерода изотопа (12).
studfile.net
химический элемент, атом, молекула, ион, вещество.
Хим элемент – это вид атома с опр-ным зарядом ядра. Атом – мельчайшая хим-ки неделимая электронейтральная частица вещества. Молекула – мельчайшая электронейтральная частица вещества, кот обуславливает хим и физ свойства этого вещ-ва.
Ион – мельчайшая заряженная частица вещества (электролита), которая обуславливает хим и физ свойства этого вещ-ва. Вещество — вид материи, обладающее массой покоя и состоящий главным образом из элементарных частиц (электронов, протонов, нейтронов). Любое в-во состоит из структурных единиц – атомов, молекул, ионов.
2.Сколько химических элементов известно в настоящее время? в чём заключаются различия между химическим элементом и простым веществом?
В наст время известно 110 видов атомов. Об атомах одного вида говорят, что они являются атомами одного хим элемента. Т.е. хим эл-т – то же самое, что вид атома.
Если молекулы состоят из атомов только одного вида, то вещество называют простым.
3.Чем отличаются вещества молекулярного строения от веществ немолекулярного строения? Какие физические свойства присущи тем и другим веществам?
Среди органических веществ преобладают молекулярные вещества, среди неорганических — немолекулярные. Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях. Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение — слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников — кремния, германия и пр.) Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д.
4.Чем определяется химическое количество вещества? Сформулируйте определение понятия моль. Каков физический смысл постоянной Авогадро и чему равно ее значение?
Количество вещества п — физическая величина, определяемая числом элементарных объектов (структурных единиц), из которых это вещество состоит. Под элементарными объектами понимают атомы, молекулы, ионы, электроны, любые условные части или фрагменты молекулы. За единицу количества вещества принят моль, определяемый как количество вещества системы, содержащей столько же структурных единиц, сколько атомов содержится в 0,012 кг углерода 12С. Эта величина является фундаментальной физической константой, называется постоянной Авогадро и обозначается NA:= 6,02*1023 моль-1
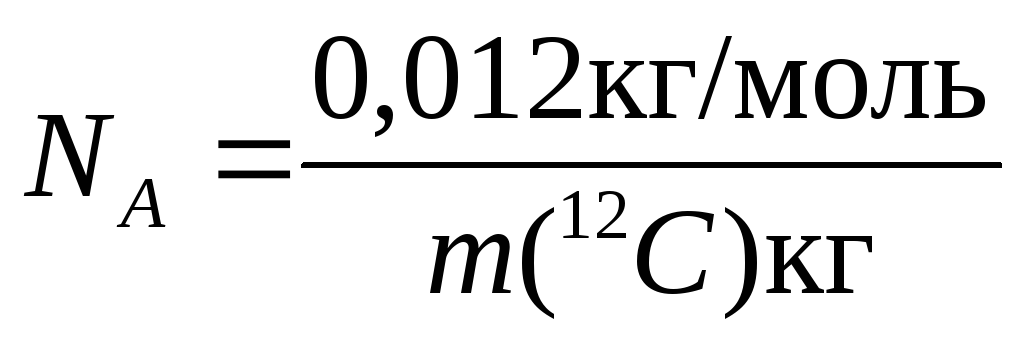
studfile.net