Способы увеличения скорости химических реакций. Гомогенные процессы.
Для достижения химического равновесия при протекании обратимых реакций требуется определенный период времени, зависящей от природы веществ, составляющих реакционную систему. Для характеристики используется величина — скорость химической реакции.
Скорость реакции — это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
Зависимость скорости реакции от температуры определяется правилом Вант — Гоффа :
 |
Правило Вант — Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние, оказываемое катализаторами на химические реакции, называется катализом. По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
3.Влияние концентрации реагирующих веществ.При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
 |
Из кинетического уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
Гомогенные процессы, т.е. процессы, протекающие в однородной среде (жидкие или газообразные смеси, не имеющие поверхностей раздела, отделяющих части системы друг от друга), сравнительно редко встречаются в промышленности. Чисто гомогенную систему получить трудно, так как любое вещество содержит примеси. Для многих промышленных процессов воздух считается гомогенной средой, а для процесса окисления аммиака тот же воздух из-за наличия в нем пыли, влаги считается гетерогенной средой. Исходное сырье всегда имеет примеси. Поэтому лишь условно можно принять за гомогенные те производственные процессы, которые протекают в газовой или жидкой фазе. В гомогенных системах реакции проходят быстрее, чем в гетерогенных. Осуществление и управление гомогенными процессами, протекающими в гомогенной среде, значительно облегчается. Аппаратура тоже проще. Поэтому многие промышленные гетерогенные процессы включают в качестве этапа гомогенный химический процесс в газовой или жидкой фазе. Для гомогенизации системы при проведении химической реакции в однородной среде в промышленности используют разные способы:
1) Поглощение газов, конденсация паров, растворение или плавление твердых материалов приводящей к получению жидкой среды, в которой быстрее протекают реакции.
2) Испарение жидкостей или выделение из них в газовую фазу нужных компонентов и проведение реакции в газовой фазе.
Гомогенные процессы в газовой фазе широко применяются в технологии органических веществ. Для осуществления этих процессов органическое вещество испаряется, и затем его пары обрабатываются тем или иным газообразным компонентом: хлором, окислами азота, сернистым ангидридом и т.п. Значительное применение получил парофазный пиролиз, в котором химические реакции разложения осуществляются в паровой фазе, хотя процесс в целом относится к гетерогенным, поскольку химическим реакциям в паровой фазе предшествует испарение углеводородов. Из большого числа процессов, идущих в жидкой фазе, можно отнести к гомогенным процессы нейтрализации щелочи в технологии минеральных солей без образования твердой соли.
Гомогенные процессы, как правило, идут в кинетической области, т.е. общая скорость процесса определяется скоростью химической реакции, поэтому закономерности, установленные для реакций, применимы и к процессам, идущим в газовой и жидкой среде. С точки зрения кинетики, химические реакции можно классифицировать по молекулярности, т. е по числу молекул, принимающих одновременное участие в элементарном акте химического превращения, и по порядку реакции. Порядок реакции равен сумме показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Чаще всего порядок реакции не совпадает с ее молекулярностью. По молекулярности реакции подразделяются на моно -, би и тримолекулярные и по порядку — первого, второго и дробного порядка.
1. Одномолекулярные (мономолекулярные) реакции. К ним относятся:
– реакции внутримолекулярных перегруппировок А→Д, например, изомеризация, инверсия;
– реакции разложения А →Д +Д′.
В виде примера можно указать крекинг этана
С2Н6 → С2Н4 +Н2
2. Двумолекулярные
– реакции присоединения А +А →АА, А +В → АВ и разложения 2А→Д +Д′
– реакции замещения или обмена А +ВВ′ → АВ + В′
– реакции двойного обмена АА′ +ВВ′ → АВ + А′В′
К бимолекулярным реакциям присоединения относятся присоединение атома или радикала к молекуле непредельного соединения и ассоциация насыщенных молекул. Например,
С2Н4 +Н2 →С2Н6,
Н2 +І2 →2НІ
К реакциям замещения или обмена принадлежит большое количество реакций атомов и радикалов с различными молекулами. Типичная реакция двойного обмена в растворе
КСl +NаNО3 →ΝаСl + КNО3
3.Трехмолекулярные, где встречаются и вступают в химическое взаимодействие три молекулы, могут быть реакции присоединения, обменного типа и реакции рекомбинации.
3А →Д, 2А +В →Д +Д′… А +А′ +В → Д +Д′….
Так протекает взаимодействие хлорного железа и хлористого олова в водном растворе
2FеСl3 +SnСl2 ↔2FеСl2 + SnСl4
Каждому из перечисленных типов реакций соответствует свое кинетическое уравнение, связывающее концентрации реагентов со временем. Влияние концентраций реагирующих веществ определяется законом действия масс, который является основным законом химической кинетики. Зависимость скорости химической реакции от температуры сильно изменяется при возрастании порядка реакции. С ростом концентрации исходных веществ скорость реакции до достижения равновесного выхода увеличивается тем сильнее, чем выше порядок реакции. Скорость реакции наиболее сильно зависит от концентраций тех реагирующих веществ, которые входят в наибольшем количестве в уравнения химических реакций. При этом скорость многомолекулярных реакций с повышением концентраций будет возрастать быстрее, чем скорость реакций более низших порядков. Для повышения концентраций реагентов в гомогенных системах применяются следующие методы:
– для газов: выделение из газовой смеси в более концентрированном виде, сжатие или сжижение, растворение газов для проведения реакции в растворе;
– для жидкостей: выпаривание, вымораживание, что позволяет получить раствор более насыщенный реагентами, или же дополнительный ввод реагента в раствор.
Давление влияет на увеличение скорости как прямой, так и обратной реакции пропорционально числу реагирующих молекул. Таким образом, давление влияет в основном через увеличение концентраций реагентов, что практически относится к реакциям, идущим в газовой среде, особенно с уменьшением объема. Давление на скорость реакций в растворах влияет очень мало. Перемешивание ускоряет процессы, протекающие в диффузионной области вследствие замены медленной молекулярной диффузии быстрым конвективным переносом реагентов в зону реакции.
Похожие статьи:
poznayka.org
Как концентрация влияет на скорость реакции? — Наука и Техника — Каталог статей
Увеличение концентрации реагентов обычно увеличивает скорость реакции, поскольку для образования продуктов реакции присутствует большее количество реагирующих молекул или ионов. Это особенно верно, когда концентрации низкие и мало молекул или ионов реагируют. Когда концентрации уже высоки, часто достигается предел, когда увеличение концентрации мало влияет на скорость реакции. Когда задействованы несколько реагентов, увеличение концентрации одного из них может не повлиять на скорость реакции, если недостаточно других реагентов. В целом, концентрация — это только один фактор, влияющий на скорость реакции, и взаимосвязь обычно не является простой или линейной.
В типичной химической реакции несколько веществ реагируют с образованием новых продуктов. Вещества могут быть объединены в виде газов, жидкостей или в растворе, и то, сколько присутствует каждого реагента, влияет на скорость реакции. Зачастую одного реагента более чем достаточно, и скорость реакции зависит от других присутствующих реагентов. Иногда скорость реакции может зависеть от концентрации всех реагентов, а иногда присутствуют катализаторы и помогают определить скорость реакции. В зависимости от конкретной ситуации изменение концентрации одного реагента может не иметь никакого эффекта.
Например, в реакции между магнием и соляной кислотой магний вводится в виде твердого вещества, в то время как соляная кислота находится в растворе. Как правило, кислота реагирует с атомами магния из металла, и когда металл разъедается, реакция продолжается. Когда в растворе содержится больше соляной кислоты, а концентрация выше, у металла расходуется больше ионов соляной кислоты, и реакция ускоряется.
Аналогичным образом, когда карбонат кальция реагирует с соляной кислотой, увеличение концентрации кислоты ускоряет скорость реакции, пока присутствует достаточное количество карбоната кальция. Карбонат кальция представляет собой белый порошок, который смешивается с водой, но не растворяется. Поскольку он реагирует с соляной кислотой, он образует растворимый хлорид кальция и выделяется углекислый газ. Увеличение концентрации карбоната кальция, когда в растворе уже содержится много, не влияет на скорость реакции.
Иногда реакция зависит от катализаторов. В этом случае изменение концентрации катализатора может ускорить или замедлить реакцию. Например, ферменты ускоряют биологические реакции, а их концентрация влияет на скорость реакции. С другой стороны, если фермент уже полностью использован, изменение концентрации других веществ не будет иметь никакого эффекта.
Как определить скорость реакции
Химическая реакция истощает реагенты и создает продукты реакции. В результате скорость реакции может быть определена путем измерения того, как быстро расходуются реагенты или сколько образуется продукта реакции. В зависимости от реакции обычно легче всего измерить одно из наиболее доступных и легко наблюдаемых веществ.
Например, в приведенной выше реакции магния и соляной кислоты в результате реакции образуется водород, который можно собирать и измерять. Для реакции карбоната кальция и соляной кислоты с образованием диоксида углерода и хлорида кальция также можно собирать диоксид углерода. Более простым способом может быть взвешивание реакционного контейнера, чтобы определить, сколько углекислого газа было выделено. Измерение скорости химической реакции таким способом может определить, изменило ли изменение концентрации одного из реагентов скорость реакции для конкретного процесса.
www.winstein.org
Химические реакции. Скорость химических реакций
Химические реакции. Скорость химической реакции
Что же такое химическая реакция? Представьте, химическая реакция (от лат. реакция – противодействие, отпор) – это какое-то ответное действие веществ на воздействие других веществ и физических факторов: температуры, давления, излучения и т.д. При химических реакциях обязательно разрушаются одни химические связи и возникают новые, поэтому из одних веществ образуются новые.
Химические реакции протекают как внутри нас, так и в окружающем мире.

Давайте вспомним, какие же мы знаем признаки классификации химических реакций.
По числу и составу исходных веществ и продуктов, реакции делятся на:
· реакции соединения
· разложения
· замещения
· обмена
К реакциям соединения относятся реакции, в результате которых из двух или нескольких простых или сложных веществ образуется одно сложное.
Например, в реакции магния с кислородом образуется оксид магния. Эта реакция сопровождаются выделением света и тепла. Поэтому её ещё называют реакцией горения.

2Mg + O2 = 2MgO
В реакцию соединения могут вступать и два сложных вещества с образованием одного сложного. Например, в реакции двух сложных веществ оксида кальция с водой образуется новое сложное вещество – гидроксид кальция.

СаО + Н2О = Са(ОН)2
К реакциям разложения относятся реакции, в результате которых из одного сложного вещества образуется два или более новых веществ.
Например, реакция разложения оксида ртути (II). В результате этой реакции образуется ртуть и кислород. Или, например, при разложении воды в электролизёре образуется кислород и водород.

2HgO = 2Hg + O2


2Н2О = 2Н2 + О2
К реакциям замещения относятся реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе, при этом образуется новое простое и новое сложное вещество.
К реакциям замещения относятся реакции взаимодействия металлов с кислотами и металлов с солями. Так, в реакции цинка с серной кислотой образуется новое сложное вещество – сульфат цинка и выделяется газ водород (новое простое вещество).

Zn + H2SO4 = ZnSO4 + H2↑
Или, как в реакции меди с раствором нитрата серебра (I) атомы меди замещают атомы серебра в сложном веществе, и образуется новое сложное вещество – нитрат меди (II) и новое простое – серебро.

Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
В реакциях обмена обязательно участвуют два сложных вещества, которые обмениваются своими составными частями.
Так, в реакции сульфата натрия с хлоридом бария образуется две новые соли – хлорид натрия и сульфат бария.

Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
По признаку выделения теплоты реакции делятся на:
· экзотермические
· эндотермические
Если реакции протекают с выделением теплоты, то такие реакции называются экзотермическими
Если реакции протекает с поглощением теплоты, то их называют эндотермическими.
К экзотермическим реакциям относится реакция горения магния, а реакция разложения ртути является эндотермической.
2Mg + O2 = 2MgO + Q
2HgO = 2Hg + O2 – Q
По признаку обратимости реакции делятся на:
· обратимые
· необратимые
Обратимые реакции всегда протекают одновременно в двух противоположных направлениях, как реакция получения аммиака их двух простых веществ – азота и водорода. В этих реакциях вместо знака равенства ставится знак обратимости.
N2 + 3H2 ↔ 2NH3
Необратимые реакции идут до конца, т.е. в результате этих реакций образуется газ, осадок или слабый электролит. Например, в реакции соляной кислоты и карбоната калия образуется углекислый газ и вода, т.е. реакция прошла до конца.
2HCl + K2CO3 = 2KCl + CO2↑ + H2O
По признаку участия катализатора реакции делятся на:
· каталитические
· некаталитические
Каталитические реакции – это реакции, протекающие с участием катализатора. Например, реакция получения оксида серы (VI) из оксида серы (IV) является каталитической, т.к. необходимым условием её протекания является наличие катализатора оксида ванадия (V).

По признаку изменения степени окисления реакции делятся на:
· реакции, протекающие без изменения степени окисления
· реакции, протекающие с изменением степени окисления, или окислительно-восстановительные
Так, реакция разложения гидроксида меди (II) на оксид меди (II) и воду протекает без изменения степени окисления. Ни один элемент, в этой реакции, не изменил свою степень окисления.
А реакция взаимодействия цинка с серной кислотой является окислительно-восстановительной, т.к. цинк изменяет степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Цинк является восстановителем, а водород окислителем.

По агрегатному состоянию реагирующих веществ, реакции делятся на:
· гомогенные
· гетерогенные
Гомо, означает одинаковый, поэтому в гомогенных реакциях вещества находятся в одинаковом агрегатном состоянии, т.е. только в жидком или газообразном.
Так, в реакции соляной кислоты и гидроксида натрия оба вещества находятся в жидком состоянии, поэтому эта гомогенная реакция.
HCl(р-р) + NaOH(р-р) = NaCl(р-р) + H2O
Гетеро, означает разный, поэтому в этих реакциях вещества находятся в разных агрегатных состояниях.
Так, например, реакция горения серы является гетерегенной, т.к. вступающая в реакцию сера является твёрдым веществом, а кислород – газообразным.
S(тв.) + O2(г.) = SO2(г)
Попробуем провести эксперимент. Поместим железный гвоздь в раствор сульфата меди (II). И что же наблюдаем? Через некоторое время на той части гвоздя, которая была помещена в раствор осела медь, раствор тоже поменял свою окраску с голубой на, жёлтую.

CuSO4(р-р) + Fe(тв.) = FeSO4(р-р) + Cu↓
Охарактеризуем эту реакцию по всем признакам.
1. реакция замещения, потому что из исходного сложного вещества (сульфата меди (II)) и исходного простого (железа) образуется новое сложное (сульфат железа (II)) и новое простое вещество (медь).
2. реакция необратимая. Она протекает только в одном направлении (между левой и правой частью уравнения стоит знак равенства).
3. реакция экзотермическая, т.к. протекает с выделением незначительного количества теплоты, ведь в опыте не требуется нагревание.
4. реакция окислительно-восстановительная, потому что медь и железо изменили свои степени окисления: медь с +2 до 0, железо с 0 до +2, медь является окислителем, а железо восстановителем.

5. реакция гетерогенная. Она протекает между твёрдым веществом и раствором.

6. Реакция является некаталитической, т.к. катализатор не участвует в этой реакции.
Однако для того чтобы прошла химическая реакция, реагирующие частицы должны столкнуться друг с другом. Но не всегда это столкновение приводит к их взаимодействию. Для этого, частицы должны быть достаточно активными, т.е. обладать таким запасом энергии, который приводит к ослаблению химических связей, а потом и к разрыву их.
Например, у нас вступают в реакцию вещество А и вещество Б. На оси ординат отложена энергия. Для того чтобы у нас образовалось вещество В, исходные вещества А и Б должны преодолеть энергетический барьер. На вершине этой кривой – переходное состояние, т.е. здесь нет уже веществ А и Б, но и ещё не образовалось вещество В. Это состояние существует очень короткое время, после чего образуется вещество В и выделяется энергия.

Теперь мы плавно можем перейти к изучению и скорости химической реакции. Если энергия активации мала, то скорость реакции будет высокой, но если энергия активации велика, то реакции будут протекать медленно.

Известно, что некоторые химические реакции протекают очень быстро. Например, если добавить раствор нитрата серебра к раствору хлорида натрия, то практически мгновенно выпадает белый творожистый осадок, или если к раствору карбоната калия добавить соляной кислоты, то сразу же вы увидим выделение пузырьков газа, с огромной скоростью протекают реакции, сопровождающиеся взрывом.

Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой пленкой. Такие реакции, как рост сталактитов и сталагмитов в пещерах, разрушение статуй под действием кислотных дождей, протекают очень медленно.

Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой – миллионы лет. Почему так? Термодинамика ответить на этот вопрос бессильна: в этой теории не учитывается время скорости химических реакций, которую изучает химическая кинетика. Более того, химическая кинетика дает ключ к управлению реакций.
Что же такое скорость?
Например, Бальзак прочитывал 200 страниц за полчаса

Наполеон читал со скоростью две тысячи слов в минуту, т.е. 12.000 знаков.

Археолог Р. Шлиман путём тренировок добился того, что очередной иностранный язык выучивал за 6-8 недель.

Ураган движется со скоростью 125 миль в час.

Как определить скорость, а в частности скорость химической реакции? Количественной характеристикой быстроты протекания химической реакции является скорость химической реакции, которую обозначают латинской буквой υ.
Скорость химической реакции определяется изменением концентрации исходных веществ или продуктов реакции в единицу времени.

От чего же зависит сама скорость химической реакции?
· она зависит от природы реагирующих веществ. Сейчас мы это докажем. Нальём в две пробирки 1-2 мл соляной кислоты, в одну поместим гранулу цинка, а во вторую кусочек железа такого же размера. Понаблюдаем, что же происходит? В первой пробирке реакция протекает быстрее, чем во второй, это видно по интенсивности выделения водорода. Почему? Да потому, что цинк более активный металл, чем железо и реакция буде протекать быстрее с цинком, чем с железом. То есть природа металла оказывает влияние на скорость этой реакции.
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
А теперь поместим в две пробирки по грануле цинка и прильём в первую пробирку соляной кислоты, во вторую – уксусной кислоты, но эти кислоты будут одинаковой концентрации. Проследим за изменениями. В первой пробирке скорость реакции гораздо выше, чем во второй. Значит, природа кислоты тоже оказывает влияние на скорость реакции. Т.к. интенсивность выделения водорода в первой реакции больше, значит, и кислота там более сильная, чем во второй пробирке.
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2CH3COOH = (CH3COO)2Zn + H2↑
· скорость реакции зависит и от концентрации реагирующих веществ. Нальём в три пробирки разное количество соляной кислоты: в первую – 3мл, во втору – 2 мл, а в третью – 1 мл. Затем во вторую пробирку добавим 1 мл воды, а в третью – 2 мл. Получается, что объём жидкости в трёх пробирках у нас одинаковый. А концентрация кислоты? Подумайте? Затем добавим в каждую пробирку по грануле цинка и посмотрим, что будет происходить. Интенсивнее всего водород выделяется в первой пробирке, во второй – менее интенсивно, а в третьей – меньше всего наблюдается выделение водорода. Получается, что концентрация кислоты в первой пробирке была больше всего, а меньше всего в третьей. Следовательно, чем выше концентрация веществ, тем и больше скорость взаимодействия между ними.

· Третьим фактором, влияющим на скорость реакции, является площадь соприкосновения реагирующих веществ. Нальём в две пробирке равное количество соляной кислоты, в первую пробирку поместим кусочек мрамора, а во вторую – мраморную крошку. И что же наблюдаем? Во второй пробирке реакция прошла гораздо быстрее, чем в первой. Ведь площадь соприкосновения во второй пробирке гораздо больше, чем в первой. Поэтому, чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции.

Из повседневного опыта вы знаете, что быстрее сгорит 1 кг стружек, чем 1 кг цельной древесины. Когда вы разжигаете костёр, то наверняка, подкладываете под дрова мелкие щепки, а под них скомканную бумагу. При тушении пожаров, наоборот, уменьшают площадь соприкосновения горящих предметов с воздухом.

А на производстве используют так называемый кипящий слой, т.е. измельчают твёрдое вещество до состояния пыли, затем через него снизу пропускают второе вещество, чаще газообразное, когда оно проходит через мелкораздробленный слой, то создает эффект кипения. Этот метод используют при производстве серной кислоты и нефтепродуктов.


Можно самим смоделировать «кипящий слой». Для этого на кольцо лабораторного штатива закрепим кусочек сетчатой ткани. Насыплем на неё 1-2 столовые ложки манной крупы. А снизу будем продувать воздух с помощью резиновой груши. У нас вами тоже получается эффект кипения.
· Четвёртым фактором, который влияет на скорость химической реакции, является температура. В химическое взаимодействие вступают только активные частиц, а при повышении температуры количество этих активных частиц значительно увеличивается, т.к. нагревание сообщает частицам необходимую энергию активации. Поэтому, естественно, что чем выше температура, тем больше скорость реакции.

Я.Х. Вант-Гофф сформулировал правило: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в 2-4 раза. Эта величина называется температурным коэффициентом (γ).

Поэтому на производстве используются высокотемпературные химические процессы: при выплавке чугуна и стали, варке стекла и мыла, производстве бумаги и нефтепродуктов и др.




Попробуем это доказать с помощью лабораторного опыта. Если, насыпать в две пробирки одинаковое количество чёрного порошка оксида меди (II), и прилить в каждую 3-4 мл раствора серной кислоты. Затем первую пробирку поставить в стакан с горячей водой, а вторую нагреть на пламени спиртовки, то очевидно, что реакция во второй пробирке пойдёт гораздо быстрее, чем в первой, ведь температура выше во втором случае. Таким образом, мы доказали с вами, что, чем выше температура, тем больше скорость реакции.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O

· Пятым фактором, от которого зависит скорость реакции, являются катализаторы, но о них вы узнаете чуть позже.

· Кроме этого, такой фактор, как изменение давления влияет на скорость только тех реакций, в которых участвуют газообразные вещества. При увеличении давления уменьшается объём газов, что ведёт к увеличению концентрации газов, а следовательно и увеличению скорости реакции.

videouroki.net
Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Химическая кинетика – это раздел химии, изучающий скорость и механизмы химических реакций.
Химические реакции протекают с различными скоростями. Столетиями разрушаются лаки и краски на полотнах мастеров. Процесс ржавления также идёт достаточно медленно. Взрыв – мгновенная реакция, а процесс нейтрализации идёт на глазах.

Чтобы прошла химическая реакция, нужно, чтобы взаимодействующие частицы были активными. Они должны обладать повышенной энергией, чтобы преодолеть энергетический барьер, называемый энергией активации. Если энергия активации мала, то и скорость реакции будет высокой.

В химии рассматривается вещество или совокупность веществ, это так называемая система. В этой системе можно выделить часть, которая отделена от других частей − это фаза.
Если система состоит из одной фазы, то её называют гомогенной, или однородной. Гомогенными системами являются газовые смеси, растворы. Гетэрогенными, или неоднородными считаются системы, которые состоят из нескольких фаз. Например, это смеси из твёрдых веществ, смесь, состоящая из газа и твёрдого вещества, а также смесь, которая состоит из жидкости и твёрдого вещества.

Следовательно, реакции, которые протекают в гомогенных системах, называются гомогенными, а реакции, которые идут в гетэрогенных системах, называются гетэрогенным. Сами гомогенные реакции протекают во всём объёме смеси, а гетэрогенные – на поверхности раздела фаз.
Скорость гомогенной реакции – это количество вещества, которое вступило в реакцию или образовалось в результате её за единицу времени в единице объёма системы.

В данной формуле эн – это число молей реагирующего вещества в данный момент времени; тэ – это время; а вэ – это объём системы.
Если учесть, что отношение числа молей к объёму реакционной смеси это молярная концентрация, то для определения скорости гомогенной реакции можно использовать формулу, где в числителе использована молярная концентрация. В этой формуле цэ – молярная концентрация реагирующего вещества в данный момент времени.
Следовательно, скорость гомогенной реакции равна изменению концентрации какого-либо из реагирующих веществ в единицу времени и выражается в моль на литр в секунду.

Так как скорость химической реакции может быть только положительной, то знак «плюс» ставится тогда, когда молярная концентрация – это концентрация продукта реакции, а знак «минус», если молярная концентрация – это концентрация исходного вещества.
Скорость же гетэрогенной реакции – это отношение числа количества вещества, которое вступает в химическую реакцию или которое образуется в результате реакции за единицу времени на единице поверхности раздела фаз. В этой формуле эс – это поверхность раздела фаз.
Скорость любой химической реакции зависит от ряда факторов.
Во-первых, скорость реакции зависит от природы реагирующих веществ. То есть при одинаковых условиях различные вещества взаимодействуют друг с другом иначе. Если взять уксусную и серную кислоту одинаковой концентрации и поместить туда гранулы цинка, то интенсивность выделения водорода в пробирке с серной кислотой будет больше.

Скорость химической реакции зависит от концентрации реагирующих веществ. Как правило, при увеличении концентрации реагирующих веществ скорость реакции увеличивается, так как увеличивается число столкновений между частицами реагирующих веществ.

Зависимость скорости реакции от концентрации веществ количественно выражается законом действующих масс, который сформулировали Гульберг и Вааге в 1867 году.

К. Гульдберг
(1836–1902)
Согласно этому закону скорость химической реакции пропорциональная произведению концентраций реагирующих веществ. Концентрации веществ при этом берутся в степенях, которые равны коэффициэнтам перед формулами веществ.
Например, для реакции двух веществ А и Б скорость реакции равна произведению концентрации вещества А на концентрацию вещества Б с учётом стереохимических коэффициэнтов.
A и Б – это концентрации исходных веществ, а ка – это константа скорости, которая равна скорости реакции, если концентрация вещества А и Б равны по одному моль на литр.

Константа скорости зависит от природы реагирующих веществ, температуры, но не зависит от концентрации веществ.
Чтобы образовался хлорид аммония должны столкнуться молекулы аммиака и соляной кислоты. Скорость этой реакции прямопропорциональна концентрации реагирующих веществ.

Если в элементарном акте превращения участвует 2 молекулы, то такая реакция называется двухмолекулярной. Такой реакцией является реакция взаимодействия водорода с йодом.
Разложение азометана в газовой фазе обусловлено разложением одной молекулы. Такая реакция называется одномолекулярной. Все одномолекулярные реакции являются реакциями первого порядка.
Двухмолекулярные реакции являются реакциями второго порядка.

Зависимость скорости реакции от концентрации можно показать с помощью эксперимента. Если в пробирки налить растворы серной кислоты разной концентрации и поместить туда гранулы цинка, то интенсивность выделения водорода будет больше в той пробирке, где концентрация кислоты была больше.

Скорость химической зависит также от температуры. Так, при увеличении температуры скорость большинства химических реакций увеличивается.

Эта зависимость подчиняется правилу Вант-Гоффа: при повышении температуры на 10 градусов по Цэльсию скорость большинства химических реакций увеличивается в два-четыре раза.

Я. Вант-Гофф
(1852–1911)
Это можно изобразить в виде формулы, где гамма – это температурный коэффициэнт, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов по Цэльсию; вэ-один – скорость реакции при температуре тэ-один; вэ-два – скорость реакции при температуре тэ-два.

Вант-Гофф первый лауреат Нобелевской премии по химии в 1901году, он изучил зависимость скорости реакции от температуры. Своё правило он сформулировал в 1884 году. Кроме того, он создал теорию пространственного расположения атомов в молекуле, вывел основные уравнения химической тэрмодинамики. Заложил основы теории разбавленных растворов.
Зависимость скорости реакции от температуры можно показать с помощью эксперимента.

Если положить в пробирку гранулу цинка и прилить раствор соляной кислоты, то можно заметить, что водород выделяется интенсивно. Если содержимое пробирки нагреть, то интенсивность выделения водорода увеличивается.

Молекулы сталкиваются друг с другом миллионы раз в секунду. Если бы все столкновения были эффективными, то все бы реакции заканчивались мгновенно.
Причины увеличения скорости реакции при увеличении температуры объясняется теорией активных молекул или теорией активации. Согласно теории, в реакции могут участвовать только те молекулы, энергия которых больше средней энергии молекул на какую-то определённую величину. Эта избыточная энергия, или энергия активации, необходима для разрыва или ослабления исходных связей в молекулах.

Соответственно, чем больше активных молекул, тем больше скорость реакции, а при повышении температуры количество этих активных молекул увеличивается.
Для газообразных веществ скорость реакции зависит от давления. Соответственно, при увеличении давления увеличивается концентрация вещества, а значит, увеличивается и скорость реакции.

Эта закономерность отражена в уравнении Менделеева-Клайперона.

На скорость химических реакций влияет также наличие катализаторов, которые изменяют скорость химической реакции, но сами не расходуются. Реакции, которые идут в присутствии катализаторов, называются каталитическими.
Катализ может быть гомогенным и гетэрогенным. Если катализатор и реагирующие вещества находятся в одном агрегатном состоянии или являются компонентами одного раствора, то такой катализ называется гомогенным.
Если же реагирующие вещества и катализатор находятся в разных агрегатных состояниях, то тогда данный катализ считается гетэрогенным.
Так, реакция получения аммиака из азота и водорода в присутствии катализатора железа является гетэрогенным катализом, а реакция получения оксида шесть из оксида серы четыре и кислорода в присутствии катализатора оксида азота два является гомогенным катализом.

Если реакция идёт в присутствии катализатора, то катализатор взаимодействует с одним из исходных веществ и образуется промежуточное соединение. Затем это соединение реагирует с другим исходным веществом и образуется конечный продукт, а катализатор выделяется в свободном состоянии.

Таким образом, ускоряющее действие катализатора заключается в понижении энергии активации основной реакции. Каждая из промежуточных реакций с участием катализатора протекает с меньшей энергией активации, чем катализируемая реакция.
При нагревании муравьиная кислота разлагается на углекислый газ и воду. Энергия активации данной реакции велика, поэтому эта реакция идёт медленно.

Чтобы увеличить скорость реакции можно не только увеличить число активных молекул, но и уменьшить энергетический барьер. Для этого нужно нагреть муравьиную кислоту с сильными кислотами. В данном случае ион водорода будет катализатором, он уменьшить энэргетический барьер, препятствующий разложению муравьиной кислоты. Скорость реакции при этом увеличится.
Как правило, катализаторы увеличивают скорость реакции. Но есть вещества – ингибиторы, которые замедляют химические реакции.
Если в пробирку с серной кислотой и цинком прилить формалин, то интенсивность выделения водорода уменьшиться, потому что формалин, в данном случае – ингибитор.
Биологические катализаторы – это ферменты, или энзимы. По своей природе ферменты являются белками. Они осуществляют все биохимические процессы.

На скорость химической реакции влияет также площадь поверхности соприкосновения реагирующих веществ. Чем больше площадь соприкосновения, тем быстрее протекает реакция.

Если в две пробирки налить соляной кислоты одинаковой концентрации, но в одну поместить измельчённый мел, а в другую кусочек мела, то выделение углекислого газа более бурно происходит в пробирке с измельчённым мелом, то есть, где площадь соприкосновения с кислотой большая.

videouroki.net
Задания 20. Скорость реакции и ее зависимость от различных факторов.
Задание №1
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к уменьшению скорости реакции этилена с водородом.
1) понижение температуры
2) увеличение концентрации этилена
3) использование катализатора
4) уменьшение концентрации водорода
5) повышение давления в системе
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеОтвет: 14
Пояснение:
1) понижение температуры
Понижение температуры снижает скорость любой реакции, как экзотермической, так и эндотермической.
2) увеличение концентрации этилена
Увеличение концентрации реагентов всегда увеличивает скорость реакции
3) использование катализатора
Все реакции гидрирования органических соединений являются каталитическими, т.е. существенно ускоряются в присутствии катализаторов.
4) уменьшение концентрации водорода
Уменьшение концентрации исходных реагентов всегда снижает скорость реакции
5) повышение давления в системе
Повышение давления, когда хотя бы один из реагентов является газом, увеличивает скорость реакции, т.к. фактически это то же самое, что увеличение концентрации этого реагента.
Задание №2
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции метанола с пропионовой кислотой.
1) повышение температуры
2) понижение давления
3) понижение температуры
4) использование сильной неорганической кислоты в качестве катализатора
5) облучение ультрафиолетовым светом
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеОтвет: 14
Пояснение:
1) повышение температуры
При повышении температуры скорость любой реакции увеличивается (как экзотермической, так и эндотермической)
2) понижение давления
Никак не влияет на скорость реакции, т.к. исходные реагенты — метанол и пропионовая кислота, являются жидкостями, а давление влияет на скорость только тех реакций, в которых хотя бы один реагент является газом
3) понижение температуры
Понижение температуры снижает скорость любой реакции (как экзотермической, так и эндотермической).
4) использование сильной неорганической кислоты в качестве катализатора
Взаимодействие спиртов с карбоновыми кислотами (реакция этерификации) ускоряется в присутствии сильных минеральных (неорганических) кислот
5) облучение ультрафиолетовым светом
Реакция этерификации протекает по ионному механизму, а ультрафиолетовый свет влияет лишь на некоторые реакции, протекающие по свободнорадикальному механизму, например, хлорирование метана.
Задание №3
Скорость прямой реакции
N2 + 3H2 ↔ 2NH3 + Q
возрастает при:
1) увеличении концентрации азота
2) уменьшении концентрации азота
3) увеличении концентрации аммиака
4) уменьшении концентрации аммиака
5) повышении температуры
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №4
Из предложенного перечня внешних воздействий выберите два воздействия, от которых не зависит скорость реакции
2C(тв) + CO2(г) → 2CO(г)
1) степень измельчения угля
2) температура
3) количество угля
4) концентрация CO
5) концентрация CO2
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №5
Из предложенного перечня внешних воздействий выберите два воздействия, при которых скорость реакции
2CaO(тв) + 3С(тв) → 2CaC2(тв) + CO2(г)↑
возрастает.
1) повышение концентрации CO2
2) понижение температуры
3) повышение давления
4) повышение температуры
5) степень измельчения CaO
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №6
Из предложенного перечня внешних воздействий выберите два воздействия, которые не оказывают влияния на скорость реакции
HCOOCH3(ж) + H2O(ж) → HCOOH(ж) + CH3OH(ж).
1) изменение концентрации HCOOCH3
2) использование катализатора
3) повышение давления
4) повышение температуры
5) изменение концентрации HCOOH
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №7
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
S(тв) + O2(г) → SO2(г).
1) увеличение концентрации сернистого газа
2) повышение температуры
3) уменьшение концентрации кислорода
4) понижение температуры
5) увеличение концентрации кислорода
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №8
Из предложенного перечня внешних воздействий выберите два воздействия, которые не влияют на скорость реакции
Na2SO3(р-р) + 3HCl(р-р) → 2NaCl(р-р) + SO2↑ + H2O.
1) изменение концентрации соляной кислоты
2) изменение давления
3) изменение температуры
4) изменение концентрации сульфита натрия
5) изменение концентрации хлорида натрия
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №9
Из предложенного перечня веществ выберите по две пары, реакция между которыми протекает с наибольшей скоростью при комнатной температуре.
1) цинк и сера
2) растворы карбоната натрия и хлорида калия
3) калий и разбавленная серная кислота
4) магний и соляная кислота
5) медь и кислород
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №10
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
CH4(г) + 2O2(г) → CO2(г) + H2O(г).
1) увеличение концентрации кислорода
2) понижение температуры
3) увеличение концентрации углекислого газа
4) увеличение концентрации метана
5) понижение давления
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №11
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
2AgNO3(тв) → 2Ag(тв) + O2(г) + 2NO2(г).
1) понижение давления в системе
2) повышение давления в системе
3) повышение температуры
4) степень измельчения серебра
5) степень измельчения нитрата серебра
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №12
Из предложенного перечня веществ выберите по две пары, реакция между которыми протекает с наименьшей скоростью при комнатной температуре.
1) сульфат меди (р-р) и гидроксид натрия (р-р)
2) натрий и вода
3) магний и вода
4) кислород и цинк
5) серная кислота (р-р) и карбонат калия (р-р)
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №13
Из предложенного перечня веществ выберите по две пары, скорость реакции между которыми повышается при увеличении давления.
- 1. Cu и O2
- 2. Fe и H2SO4(р-р)
- 3. NH3 и O2
- 4. Zn и HCl(р-р)
- 5. BaCl2(р-р) и H2SO4(р-р)
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №14
Из предложенного перечня реакции выберите две реакции, скорость которых увеличивается при увеличении концентрации азота.
- 1. 6Li + N2 = 2Li3N
- 2. 2NH3 = N2 + 3H2
- 3. 2NO = N2 + O2
- 4. 2NO + 2H2 = N2 + H2O
- 5. N2 + 3H2 = 2NH3
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №15
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции
Fe(тв) + 2H+ → Fe2+ + H2(г)↑.
1) увеличение концентрации ионов железа
2) измельчение металлического железа
3) добавление нескольких кусочков железа
4) увеличение концентрации кислоты
5) уменьшение температуры
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №16
Из предложенного перечня веществ выберите по две пары, скорость реакции между которыми не зависит от увеличения площади поверхности соприкосновения реагентов.
1) сера и железо
2) кремний и кислород
3) водород и кислород
4) диоксид серы и кислород
5) цинк и соляная кислота
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №17
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции азота с водородом.
1) увеличение температуры
2) использование ингибитора
3) использование катализатора
4) уменьшение концентрации аммиака
5) уменьшение концентрации водорода
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №18
Из предложенного перечня внешних воздействий выберите два воздействия, которые не приводят к изменению скорости реакции
CH3COOC2H5 + OH— → CH3COO— + C2H5OH.
1) изменение температуры
2) изменение концентрации спирта
3) изменение концентрации щелочи
4) изменение концентрации соли
5) изменение концентрации эфира
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №19
Из предложенного перечня внешних воздействий выберите два воздействия, при которых скорость реакции гидролиза сложного эфира значительно увеличится.
1) увеличение температуры
2) добавление щелочи
3) уменьшение концентрации спирта
4) уменьшение концентрации эфира
5) увеличение давления
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №20
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к изменению скорости реакции между медью и азотной кислотой.
1) увеличение массы меди
2) увеличение концентрации кислоты
3) уменьшение температуры
4) уменьшение объема кислоты
5) увеличение объема колбы
Запишите в Поле «ОТВЕТ» номера выбранных типов реакций.
РешениеЗадание №21
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции железа с серой.
1) понижение давления в системе
2) понижение температуры
3) добавление сульфида железа(II)
4) увеличение степени измельчения железа
5) повышение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
РешениеЗадание №22
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции между растворами медного купороса и гидроксида натрия.
1) понижение давления в системе
2) увеличение концентрации щёлочи
3) повышение давления в системе
4) увеличение концентрации купороса
5) понижение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
РешениеЗадание №23
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции между растворами медного купороса и сульфида натрия.
1) использование ингибитора
2) повышение давления в системе
3) увеличение концентрации сульфида натрия
4) увеличение концентрации сульфата меди(II)
5) понижение температуры
Запишите в поле ответа номера выбранных внешних воздействий.
РешениеЗадание №24
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции пропена с водородом.
1) понижение температуры
2) увеличение концентрации водорода
3) использование ингибитора
4) уменьшение концентрации водорода
5) повышение давления в системе
Запишите в поле ответа номера выбранных внешних воздействий.
РешениеЗадание №25
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции азота с водородом.
1) понижение температуры
2) увеличение концентрации азота
3) использование ингибитора
4) уменьшение концентрации водорода
5) повышение давления в системе
Запишите в поле ответа номера выбранных внешних воздействий.
РешениеЗадание №26
Из предложенного перечня выберите две реакции, для которых увеличение давления приводит к увеличению скорости реакции.
- 1. 2KOH + H2SO4 = K2SO4 + 2H2O
- 2. 2P + 5Cl2(г) = 2PCl5
- 3. Fe2O3 + H2 = 2FeO + H2O
- 4. Ca + 2H2O(ж) = Ca(OH)2+ H2
- 5. Fe + CuSO4 = FeSO4 + Cu
Запишите в поле ответа номера выбранных реакций.
РешениеЗадание №27
Из предложенного перечня выберите две реакции, для которых уменьшение концентрации кислоты приводит к уменьшению скорости реакции.
- 1. SO2 + H2O = H2SO3
- 2. PCl5 + 4H2O = 5HCl + H3PO4
- 3. Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
- 4. Mg + 2H+ = Mg2+ + H2
- 5. Cl2 + H2O = HCl + HClO
Запишите в поле ответа номера выбранных реакций.
Решениеscienceforyou.ru
1. Химические реакции. Интернет-урок 4.2. Скорость химических реакций
ПРЕДМЕТ | Химия |
КЛАСС | 11 |
НАЗВАНИЕ ЗАНЯТИЯ | 4. Химические реакции |
НАЗВАНИЕ ИНТЕРНЕТ-УРОКА | Интернет-урок 4.2. Скорость химических реакций |
АВТОР-РАЗРАБОТЧИК | Тележинская Е.Л. |
Интернет-урок 1. Классификация химических реакций
Интернет-урок 2. Скорость реакции, её зависимость от различных факторов
Интернет-урок 3. Обратимость реакций. Химическое равновесие
Ключевой вопрос Интернет-урока
Подводка:
Представьте, что вы сотрудник медицинской корпорации, в которой выпускают лекарство от тяжелой болезни, позволяющее вылечить недуг многих людей. Стратегия вашего предприятия – скорость разработки и скорость воздействия лекарства на организм. Управлять скоростями очень важно. Многие промышленные химические реакции (например, синтез аммиака или синтез лекарственных препаратов) хотелось бы ускорить. Другие реакции (например, коррозию металлов) хотелось бы замедлить. Возникает вопрос, от чего зависит скорость реакции? Что произойдёт с продуктами реакций одного и того же вещества, если: а) изменить температуру, б) уменьшать концентрацию вещества, в) изменить площадь контакта веществ друг с другом?
п/пСодержание
Связанные элементы правого поля
1.
Вспоминаем
Подводка
Кинетика – наука о скоростях химических реакций. Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Истинная скорость реакции определяется по формуле:
ММО интерактивный рисунок истинная скорость химической реакции
Художнику
Нарисовать истинную формулу скорости реакции, как рукописный вариант:
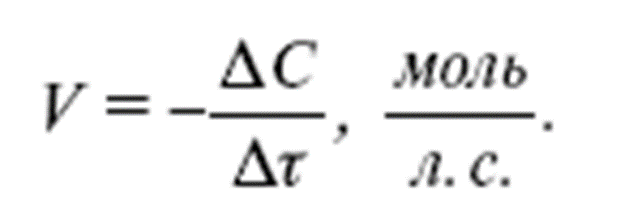
Конец объекта
1.1. Это интересно. Скорость и производство.
1.2. Это интересно. Скорость в быту.
1.3. Это интересно. ИКТ компетентность.
1.4. Это интересно. Химическая кинетика.
2.
Тип объекта: Заметки в рабочую тетрадь
Подводка
Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Приведите примеры реакций и веществ.
Запишите свой ответ здесь
Тип объекта: ЗТФ — Растаскивание по колонкам
Название: Скорость реакции
Содержание объекта:
Вы уже знакомы с факторами, влияющими на скорость протекания химических реакций. Разнеси химические реакции по соответствующим колонкам.
Самые медленные реакцииБыстрые реакции
Самые быстрые реакции
Элементы для перетаскивания: Zn и О2, CuS и HCl (р-р), Zn и HCl (1% р-р), Mg и HCl (р-р), AgCl и Mg(NO3)2, MgCO3 и HNO3(р-р), KOH(р-р) и HNO3(р-р), ZnCl2(р-р) и NaOH(р-р).
Правильный ответ:
Самые медленные реакцииБыстрые реакции
Самые быстрые реакции
Zn и О2
CuS и HCl (р-р)
Zn и HCl (1% р-р)
Mg и HCl (р—р)
AgCl и Mg(NO3)2
MgCO3 и HNO3(р-р)
KOH(р-р) и HNO3(р-р)
ZnCl2(р-р) и NaOH(р-р)
Конец объекта
2.1. Экология и скорость реакции.
2.2. Практическая работа. Техника безопасности
2.3 Опыт 1
2.4. Опыт 2
2.5. Опыт 3
2.6. Опыт 4
2.7. Опыт 5
1.1.Это интересно. Скорость и производство.
Гиперссылка:
Скорость реакции может быть как положительным, так и отрицательным фактором на промышленном предприятии.
Положительное значение на производстве. Например, ускорение реакции (при повышении температуры) спиртового брожения, на заводе по производству спирта, даст больше спирта за тот же промежуток времени. Соответствующая реакция:
C6H12O6 = 2C2H5OH + 2CO2.
Художнику: Вставить рисунок или данную фотографию

Ссылка на рисунок: http://freeppt4u.com/u/storage/ppt_1855/16ce4-1382195691-15.jpg
Отрицательное значение на производстве: Например, на молочном производстве увеличение скорости реакции спиртового брожения, даст уже отрицательный эффект.
Художнику: Вставить рисунок или данную фотографию
Вставить фотография: http://www.mmrusskih.ru/uploads/images/pictures/p_57.jpg
Тип объекта: Задание с открытым ответом/ЗОО
Название: Спиртовое и молочнокислое брожение
Содержание объекта:
Крупнейшим российским поставщиком этилового спирта из пищевого сырья является ОАО «РОССПИРТПРОМ», рейтинг «Топ-50 компаний-производителей сырого молока» возглавляет ООО «ЭкоНиваАгро». Запишите соответствующую реакцию брожения на предприятии ООО «ЭкоНиваАгро»
Приступить к выполнению
Конец объекта
1.2. Это интересно. Скорость в быту.
Гиперссылка:
Положительное значение в быту. Чистящие вещества, содержащие кислоты, позволяют быстро растворить известковый налет, но они так же отрицательно влияют, например, на хромовое покрытие смесителей для воды и т. д., поэтому в чистящие вещества добавляют специальные ингибиторы для уменьшения скорости реакций кислот с металлами.
Отрицательное значение в быту. Ускорение процессов гниения (разложение азотсодержащих органических соединений, в результате их ферментативного гидролиза).
Конец гиперссылки.
1.3. Это интересно. ИКТ компетентность.
Тип объекта: Задание с открытым ответом/ЗОО
Название: Приводим примеры и рассуждаем
Содержание объекта: Выберите положительное или отрицательное значение скорости химических реакций в быту и подготовьте устное сообщение, которое необходимо записать на диктофон или смартфон, загрузить данный файл в облако, скопировать ссылку на свой аудиофайл, вставить данную ссылку в «Запишите свой ответ». Если вы пока не умеете выполнять данные действия, то обратитесь за помощью к учителю информатики, и он объяснит вам, как работают облачные сервисы. Ваш рассказ должен длиться ровно 1 минуту.
Приступить к выполнению
Конец объекта
Гиперссылка:
1.4. Это интересно. Химическая кинетика.
Гиперссылка:
Объект 1С: http://online.obr.1c.ru/library.html#searchMode=0&searchState=2&id=4423&type=1&title=%25D0%25A5%25D0%25B8%25D0%25BC%25D0%25B8%25D1%2587%25D0%25B5%25D1%2581%25D0%25BA%25D0%25B0%25D1%258F+%25D0%25BA%25D0%25B8%25D0%25BD%25D0%25B5%25D1%2582%25D0%25B8%25D0%25BA%25D0%25B0+%25D0%25B8+%25D1%2580%25D0%25B0%25D0%25B2%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B5%25D1%2581%25D0%25B8%25D0%25B5&resource-type=dlr&simpleSearchQuery=%25D0%259E%25D0%25B1%25D1%2580%25D0%25B0%25D1%2582%25D0%25B8%25D0%25BC%25D0%25BE%25D1%2581%25D1%2582%25D1%258C+%25D1%2580%25D0%25B5%25D0%25B0%25D0%25BA%25D1%2586%25D0%25B8%25D0%25B9.+%25D0%25A5%25D0%25B8%25D0%25BC%25D0%25B8%25D1%2587%25D0%25B5%25D1%2581%25D0%25BA%25D0%25BE%25D0%25B5+%25D1%2580%25D0%25B0%25D0%25B2%25D0%25BD%25D0%25BE%25D0%25B2%25D0%25B5%25D1%2581%25D0%25B8%25D0%25B5&view=search
2.1. Экология и скорость реакции.
Гиперссылка:
Последнее время в мире все чаще говорят про вред, который наносят окружающей среде полиэтиленовая упаковка, так как средний период полураспада полиэтилена составляет около 100 лет. Именно поэтому, достаточно актуальной темой является применение только экологически чистых материалов, которые будут полностью безопасны для окружающей среды.
Уже с весны этого года, многие компании начали переходить на новую, экологически чистую полиэтиленовую упаковку — биопакеты, тем самым участвуя в программе защиты окружающей среды.
Биопакеты не загрязняют окружающую среду. Специальная добавка d2W при изготовлении служит катализатором, который ускоряет процесс разложения. Полное время распада происходит за 3 года. Период распада зависит от факторов окружающей среды. В итоге полиэтиленовые пакеты полностью распадаются на безопасные для природы частицы — вода, гумус, углекислый газ.
Гиперссылка: добавка d2W
Биоразлагаемая добавка d2w: что это?
— Представляет собой мастербатч.
— Вводится в полимер в соотношении 1% добавки к 99% основного материала.
— Применяется в производстве изделий из полиэтилена, полипропилена, полистирола.
— Разлагает полимеры через заданный период времени (от нескольких месяцев до нескольких лет).
— Безопасна для контакта с пищевыми продуктами — подтверждено сертификатами испытаний ведущих лабораторий мира, в частности сертификатом лаборатории RAPRA.
— Производитель — Symphony Environmental Technologies plc, Великобритания
Добавка d2w: где используется?
— Пакеты для различных нужд.
— Изделия для медицины (перчатки, бахилы, фартуки).
— Полимерные пленки для упаковки продуктов питания, сигарет, одежды, журналов и т. д.
— Укрывные, пузырчатые пленки.
— Жесткая упаковка (одноразовая пластиковая тара и посуда, бутыли).
Биоразлагаемая добавка d2w: как работает?
Является катализатором реакции разрушения и окисления углеродных связей в молекулах полимера через “запрограммированный” рецептурой период времени. В обычных условиях это занимает столетия! Оптимальна для биоразлагаемой упаковки с коротким сроком службы (в первую очередь — фасовочных пакетов). Добавка успешно используется в 60 странах мира. Крупнейшие клиенты — розничные сети, сети отелей, ресторанов (Walmart, Tesco, KFC, Pizza Hut и многие другие).

Изображение: http://www.simplexnn.ru/?id=7024
2.2. Практическая работа. Техника безопасности
Гиперссылка:
Практическая работа
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, держатель, штатив для пробирок, цинк, магний, железо: гранулы и порошок, растворы серной (1:5, 1:10) и соляной кислоты, пероксид водорода, оксид марганца (IV), оксид меди (II).
Ход работы:
Вспомните правила техники безопасности при выполнении химического эксперимента.
Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
Без разрешения учителя, ничего на столах не трогать.
Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
После работы приведи порядок на рабочем месте.
Конец гиперссылки
2.3 Опыт 1
Влияние природы реагирующих веществ.
Налейте в три пробирки по 2 мл раствора соляной кислоты. Положите в первый стакан кусочек магния, во второй стакан — гранулу цинка, в третий – кусочек железа. Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему?
Запишите свой ответ в виде таблицы
Гиперссылка: таблицы
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Проверяем себя
Гиперссылка: проверяем себя
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Влияние природы реагирующих веществ
Налили в три пробирки по 2 мл раствора соляной кислоты. Положили в первый стакан кусочек магния, во второй стакан — гранулу цинка, в третий – кусочек железа. Наблюдаем за скоростью трех реакций.
Выделение газа наиболее бурно происходит в пробирке с магнием.
Мg + 2HCl → MgCl2 +H2↑
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
Скорость химической реакции зависит от природы реагирующих веществ. Магний обладает наиболее сильными восстановительными свойствами.
2.4. Опыт 2
Влияние концентрации реагирующих веществ.
В две пробирки, наклонив их, опустите по грануле цинка, осторожно прилейте растворы серной кислоты: в первую пробирку раствор кислоты 1:5, во вторую – 1:10. В какой из них реакция идет быстрее?
Запишите свой ответ в виде таблицы
Гиперссылка: таблицы
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Проверяем себя
Гиперссылка: проверяем себя
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Влияние концентрации реагирующих веществ
В две пробирки, наклонив их, опустили по грануле цинка, осторожно прилили растворы серной кислоты: в первую пробирку раствор кислоты 1:5, во вторую – 1:10.
В первой пробирке газ выделяется более интенсивно.
Zn + h3SO4 → ZnSO4 + h3↑
Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции.
2.5. Опыт 3
Влияние площади соприкосновения реагирующих веществ.
В одну пробирку насыпьте немного порошка железа, в другую – положите железную скрепку и в обе пробирки прилить по 2 мл разбавленной соляной кислоты (1:2). В какой из пробирок реакция идет быстрее? Почему?
Запишите свой ответ в виде таблицы
Гиперссылка: таблицы
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Проверяем себя
Гиперссылка: проверяем себя
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Влияние площади соприкосновения реагирующих веществ
В одну пробирку насыпали немного порошка железа, в другую – положили железную скрепку и в обе пробирки прилили по 2 мл разбавленной соляной кислоты (1:2).
Выделение газа идет быстрее в пробирке с порошком железа.
Fe + 2HCl → FeCl2 + H2↑
Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость химической реакции
2.6. Опыт 4
Влияние температуры.
В де пробирки поместите немного черного порошка оксида меди (II), прилейте в обе пробирки раствор серной кислоты. Одну из пробирок нагрейте. В какой из пробирок реакция идет быстрее? Почему?
Запишите свой ответ в виде таблицы
Гиперссылка: таблицы
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Проверяем себя
Гиперссылка: проверяем себя
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Влияние температуры
В две пробирки поместили немного черного порошка оксида меди (II), прилили в обе пробирки раствор серной кислоты. Одну из пробирок нагрели.
Растворение оксида меди (II) и образование раствора голубого цвета идет быстрее при нагревании.
СuO + H2SO4 CuSO4 + H2O
При повышении температуры возрастает скорость движения частиц и скорость химической реакции.
2.7. Опыт 5
Влияние катализатора.
В две пробирки налейте по 2 мл пероксида водорода Н2О2, в одну из пробирок добавьте несколько кристалликов оксида марганца (IV) MnO2. В какой из пробирок реакция идет быстрее? Почему?
Запишите свой ответ в виде таблицы
Гиперссылка: таблицы
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Проверяем себя
Гиперссылка: проверяем себя
Описание экспериментаНаблюдения, позволяющие судить о скорости реакции. Уравнения реакций
Вывод
Влияние катализатора
В две пробирки налейте по 2 мл пероксида водорода Н2О2, в одну из пробирок добавьте несколько кристалликов оксида марганца (IV) MnO2.
В присутствии оксида марганца (IV) происходит бурное выделение пузырьков газа.
2Н2О2 2Н2О + О2↑
Оксид марганца (IV) – катализатор, ускоряет реакцию разложения пероксида водорода.
infourok.ru
Скорость реакции, ее зависимость от различных факторов » HimEge.ru
Лимит времени: 0
0 из 15 заданий окончено
Вопросы:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
Информация
Скорость реакции, ее зависимость от различных факторов. Теория здесь.
Вы уже проходили тест ранее. Вы не можете запустить его снова.
Тест загружается…
Вы должны войти или зарегистрироваться для того, чтобы начать тест.
Вы должны закончить следующие тесты, чтобы начать этот:
| Место | Имя | Записано | Баллы | Результат |
|---|---|---|---|---|
| Таблица загружается | ||||
| Нет данных | ||||
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- С ответом
- С отметкой о просмотре
Задание 1 из 15
Для увеличения скорости химической реакции
Н2 + I2 —> 2HI
необходимо
НеправильноОдним из факторов влияющих на скорость реакции является температура. С увеличением температуры увеличивается скорость реакции, т.к возрастает число «активных» столкновений, приводящих к разрыву старых связей и образованию новых.
Задание 2 из 15
Скорость реакции азота с водородом понизится при
НеправильноОдним из факторов влияющих на скорость реакции является температура. С уменьшением температуры уменьшается и скорость реакции, т.к уменьшается число «активных» столкновений, приводящих к разрыву старых связей и образованию новых.
Задание 3 из 15
Скорость реакции окисления оксида серы(IV) уменьшается при
НеправильноОдним из факторов влияющих на скорость реакции является температура. С уменьшением температуры уменьшается и скорость реакции, т.к уменьшается число «активных» столкновений, приводящих к разрыву старых связей и образованию новых.
Задание 4 из 15
Скорость реакции мрамора с соляной кислотой уменьшается при
НеправильноПо закону действующих масс при уменьшении концентрации реагирующих веществ, скорость реакции уменьшается. Скорость реакции мрамора с соляной кислотой уменьшается при разбавлении раствора кислоты.
Задание 5 из 15
На скорость протекающей в растворе химической реакции
FeCl3 + 3KCNS —> Fe(CNS)3 +3KCl
не влияет
НеправильноДавление оказывает влияние на скорость химической реакции только в том случае, если реагирующие вещества (хотя бы одно) находятся в газовой фазе. Данная реакция относится к реакциям ионного обмена и проводится в растворе.
Задание 6 из 15
С наибольшей скоростью при комнатной температуре протекает реакция между водородом и
НеправильноПрирода реагентов влияет на скорость химической реакции — чем активнее вещество, тем выше скорость. Из приведенных неметаллов самым активным окислителем является фтор.
Задание 7 из 15
С наибольшей скоростью при комнатной температуре протекает реакция между
НеправильноРеакции ионного обмена протекают практически мгновенно, т.к энергия активации таких реакции очень мала.
Задание 8 из 15
Скорость реакции угарного газа с кислородом определяется как
НеправильноПо определению скорость реакции – это изменение концентрации реагента или продукта реакции в единице времени.
Задание 9 из 15
С наибольшей скоростью при комнатной температуре взаимодействуют
НеправильноДля гетерогенных реакций скорость зависит от площади поверхности соприкосновения реагирующих веществ, т.к именно на поверхности раздела происходит реакция. Чем больше площадь поверхности, тем выше скорость реакции. К увеличению поверхности приводит измельчение твердых веществ. Поэтому цинк в виде порошка будет быстрее реагировать, чем цинк в гранулах. Третий вариант исключаем, т.к при комнатной температуре цинк с кислородом практически не реагирует. А с соляной кислотой реакция протекает достаточно интенсивно и при комнатной температуре.
Задание 10 из 15
Для увеличения скорости реакции
ЗН2 + N2 = 2NH3 + Q
необходимо
НеправильноПо закону действующих масс при увеличении концентрации реагирующих веществ, скорость реакции возрастает. При охлаждении системы и снижении давления скорость реакции уменьшается, а удаление аммиака никак не повлияет на скорость (только на смещение равновесия).
Задание 11 из 15
Скорость реакции углерода с кислородом не зависит от
НеправильноПо закону действующих масс скорость реакции зависит от концентрации реагирующих веществ, и не зависит от количества продукта реакции.
Задание 12 из 15
С наибольшей скоростью соляная кислота взаимодействует с
НеправильноС наибольшей скоростью соляная кислота взаимодействует с раствором гидроксида натрия, т.к реакции между ионами в растворе протекают практически мгновенно.
Задание 13 из 15
Скорость реакции между магнием и раствором медного купороса не зависит от
НеправильноСкорость реакции между магнием и раствором медного купороса не зависит от объёма реакционного сосуда, т.к среди реагирующих веществ нет газообразных.
Задание 14 из 15
Для увеличения скорости реакции гидролиза 1-бромпропана необходимо
Задание 15 из 15
От увеличения площади поверхности соприкосновения реагентов не зависит скорость реакции между
НеправильноОт увеличения площади поверхности соприкосновения реагентов зависит скорость гетерогенных реакций. А реакция между водородом и кислородом при нормальных условиях — гомогенная, поэтому нет никакой поверхность соприкосновения.
himege.ru